1 材料与方法
1.1 接种污泥
实验接种污泥取自北京清河污水处理厂。对接种污泥进行连续曝气,待污泥为黄褐色絮体状并具有良好的沉降性能和清新的泥土气味时,标志着污泥驯化完成。
1.2 实验装置及运行参数
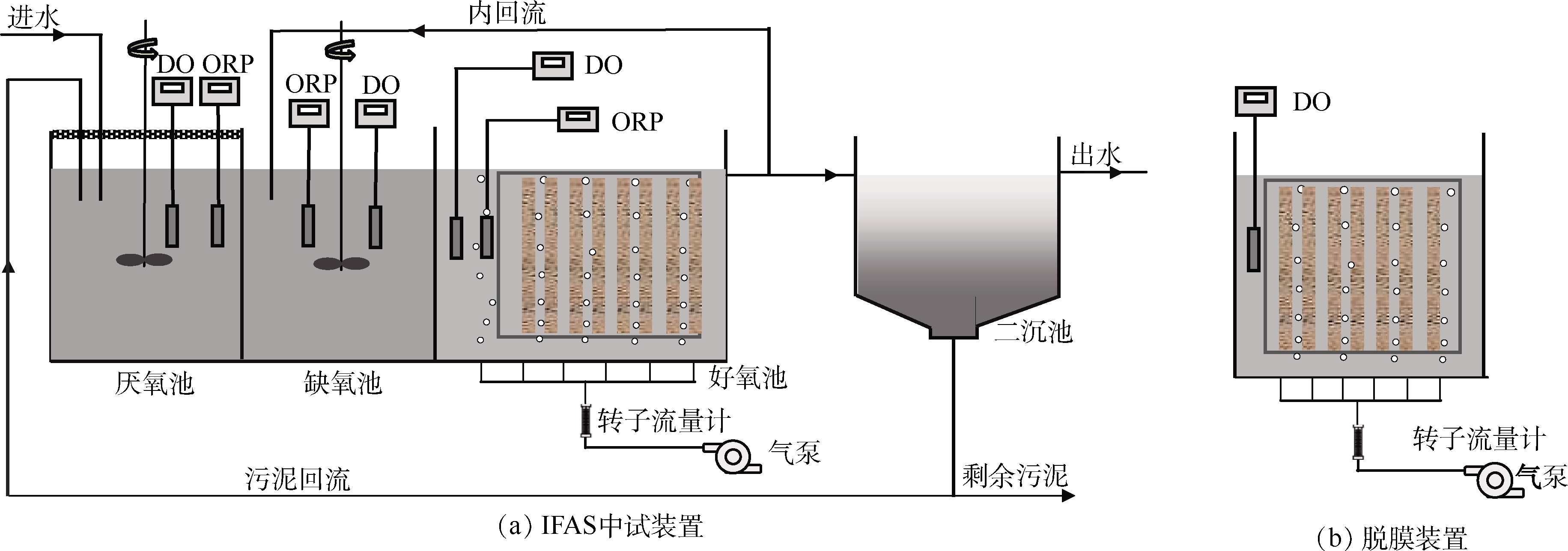
本研究中,IFAS中试装置主要用于考察3种固定式填料的污染物去除效果、生物菌群分布特征。装置如图1(a)所示,其进水为中国人民大学生活污水,处理水量为1.02 t·
d-1 ;装置体积为480 L,且V厌氧池∶V缺氧池∶V好氧池=1∶1.5∶3;水力停留时间 (HRT) 为11 h;污泥泥龄(SRT)为15 d;内回流比为250%;外回流比为100%;好氧池内填料填充比为60%。另外,研究3种填料脱膜性能的小试装置为长方体形自制有机玻璃反应器。装置如图1(b)所示,有效体积为50 L,反应器内填料填充比为60%,脱膜装置通过微孔曝气头曝气,维持溶解氧在2~3 mg·L-1 运行,采用人工配水(pH为7.8左右,COD为350~450 mg·L-1 ,氨氮为45~75 mg·L-1 )。1.3 实验所用填料
选取3种固定式填料为生物膜载体,分别为市场购买的YDT型弹性立体填料、组合填料以及自制纤维填料(下称自制填料)。本研究自制的填料以动物毛皮为原型,有效避免结点,以防止产生纤维填料常见的结团现象。
1.4 样品采集
中试级别IFAS装置每2 d对进出水进行取样,每14 d对生物膜进行取样,每次采集3组平行样,编号T、X、Z分别表示弹性填料、自制纤维填料和组合填料生物膜。第1次采样编号为1,第2次采样编号为2,依此类推。例如,第3次取样弹性填料生物膜,则编号为T3。脱膜实验过程中,每3 d进行1次取样。从反应器中取1 L均匀混合液(取样前停止曝气,静止30 min),取样后补充等量人工配水,测得单位混合液中含有的悬浮固体质量为生物膜脱落
量[9] 。1.5 主要测试方法
1) 水质及挂膜量分析:COD、氨氮、TN和TP均采用国家标准方
法[10] 检测分析;生物膜量采用超声预处理重量法[11] 测定。2) 填料理化指标分析:比表面积采用北京金埃普科技公司的型号为V-Sorb2800P全自动高性能比表面积及孔径测试仪检测纤维的比表面积;真密度检测采用金埃普公司(北京)的G-DenPyc 2900全自动真密度测定仪,在25 ℃下,通过气体置换法对填料样品进行检测;接触角分析使用Dataphysics仪器股份有限公司的DCAT21表面/界面张力仪进行测试,测试3次取平均值;扫描电镜分析使用日本Hitachi公司型号为CA-1115A的扫描电镜仪进行检测,采用真空喷镀法对样品表面进行金属喷镀处理,喷镀金属为金-钯合金。
3) 细菌群落结构分析:微生物菌群结构采用高通量测序技术(诺禾致源,北京)。
2 结果与讨论
2.1 3种填料理化指标分析
3种填料实物图及理化测试结果如表1所示。自制填料的密度为1.04 g·m
L-1 ,密度与水更相近,挂膜后如图2(a)所示,纤维在气体鼓动下,持续紊动,单根纤维丝上生物膜不断接触摩擦,从而有利于生物膜挂、脱膜平衡,且在设计时有效避免结点的产生,解决了纤维填料结团问题,纤维挂膜后呈现松茸状漂浮在水中。组合填料纤维密度为1.27 g·mL-1 ,密度略大于水,在水中也能呈现较好的紊动状态,但由于组合填料的醛化维纶纤维压在环的环圈上,纤维分布不够均匀,挂膜后一段时间,会出现轻微的生物膜粘连和增厚现象,如图2(b)所示。弹性填料的纤维真密度最小,但由于其材质为聚乙烯,有很强的硬度,能够在水中保持枝丫状结构,如图2(c)所示。表1 反应器中填料的物理参数
Table 1 Physical parameters of the fillers in the reactors
载体 主要材料 密度/(g·m L-1 )比表面积/( m2 ·m-3 )接触角/(°) YDT型弹性立体填料 聚乙烯 0.89 431 137 组合填料 聚乙烯+维纶丝 1.27 2 217 38 自制填料 变性腈纶 1.04 2 756 73 实验结果显示,弹性填料、组合填料和自制填料3种纤维填料的比表面积分别为431、2 217、2 756
m2 ·m-3 。另从接触角可判断亲水性由强到弱依次为组合填料(38°)>自制填料(73°)>弹性填料(137°)。从扫描电镜结果来看,自制纤维(图3(a))表面比较粗糙,能清楚的看到表面有纵向沟槽,边缘凹凸不平,内部存在微小空穴;在同样的放大倍数下,组合填料(图3(b))的纤维丝更细,存在少量微小沟壑;弹性填料(图3(c))单根纤维直径较粗,表面相对光滑,这也是其亲水性较小的原因之一。
2.2 3种填料应用于IFAS工艺中的污染物去除情况
3种填料系统进出水情况见图4。
2.2.1 COD去除情况
3种填料分别放入中试装置后,其系统出水COD均可达到一级A排放标准,从图4(a)中可看出,当进水COD平均值在350 mg·
L-1 左右时,3种填料的出水COD平均值相差不大,均在30~37 mg·L-1 之间,满足一级A排放标准[12] 。2.2.2 氨氮去除情况
3种填料放入中试装置后,进出水氨氮浓度以及去除率如图4(b)所示,氨氮去除率均有所提高,出水逐渐满足一级A排放标
准[12] 。其中,弹性填料的出水氨氮在第29天后基本稳定在5 mg·L-1 之下,平均浓度为3.8 mg·L-1 ,平均去除率为92%,出水效果和去除率略低于另外2种填料的IFAS系统。这是由于自制纤维填料和组合填料亲水性高,挂膜较快,为生长较慢的硝化细菌在生物膜上生长繁殖创造了有利条件,使更多的硝化细菌附着在填料上而不随剩余污泥的排放所流失,增加了系统内硝化细菌的数量,强化了系统的硝化性能。组合填料在放入装置第13 天后出水氨氮基本稳定在3.0 mg·L-1 之下,平均去除率为96%,平均浓度为1.7 mg·L-1 ,但在第59天后出水氨氮浓度略有提升,均值为2.0 mg·L-1 ,平均去除率降至95.6%。这可能是由于去除氨氮的微生物需要有较长的停留时间,而此类微生物多数生长在膜的内层,所以氨氮的去除率不仅与微生物的量有关,更与膜间传质密切相关。然而,组合填料的维纶纤维接触角可达38°,亲水性最强,膜表面与微生物间作用力最强,导致形成的生物膜厚度较大且结构致密,因而传质阻力较大[13] ,造成组合填料氨氮去除率在后期有所下降。另外,组合填料结构是将纤维丝压在双圈大塑料环的环圈上,有多个结点分布在中心硬件的四周,反而增加了结团点,从而把软性填料的中心结团转变成类似汽车轮胎状的四周结团,经过几个月的挂膜后,就会完全形成生物膜结团[14] ;而自制纤维填料避免了纤维结点,并使用亲水性较为适中的变性腈纶加以粗糙化处理制得,在放入装置第15 天后出水氨氮稳定在2.5 mg·L-1 之内,平均浓度为1.7 mg·L-1 ,平均去除率为96.8%。2.2.3 TN去除情况
3种填料放入中试装置后,其进出水TN浓度以及去除率如图4(c)所示。在1~15 d间,三者去除率较为相近,在50%~70%之间波动。由于自制纤维填料和组合填料挂膜较快,在放入填料后第2天就吸附上大量的污泥。随着生物膜的生长,生物膜量不断增加,生物膜内层逐渐形成缺氧区,硝化细菌在生物膜表层将氨氮氧化成硝酸盐,随后运送到生物膜的缺氧层进行脱氮,从而实现同步硝化反硝化。在第17天之后,自制纤维填料和组合填料的总氮去除率逐渐高于弹性填料。组合填料的出水TN在第23天左右逐渐达到一级A排放标
准[12] 。但随着组合填料上生物膜的增长,在第53天左右,其总氮的去除率出现下降,出水TN无法达到一级A排放标准[12] ,可能是由于其致密的生物膜逐渐增厚,又加上结点处出现结团现象导致氧传质效率及营养物质传质效率低。而自制纤维填料在第27天之后,TN出水稳定达到一级A排放标准[12] 。2.2.4 TP去除情况
如图4(d)所示,弹性填料、组合填料和自制填料系统平均出水总磷为1.2、1.1、1.1 mg·
L-1 ,均未达到一级A排放标准[12] 。这可能是由于回流至厌氧池的硝酸盐氮较多,影响生物除磷效果。虽然在高通量结果中发现,生物膜中有一定丰度的反硝化除磷菌,但反硝化聚磷菌除磷的最终机理是通过排泥实现的,因此,生物膜上过长的泥龄不利于系统除磷[15] 。2.3 脱膜实验分析
脱膜是生物膜代谢的重要过程之一,若脱膜不及时不仅会造成生物膜老化,使得生物膜活性降低,而且可能会造成后期生物膜大块脱落现象等,最终影响出水效果。因此,保持生物膜生长和脱落的动态平衡对维持生物膜功能至关重要。本研究针对3种固定式填料的脱膜性能,进行生物膜脱膜实验的对比研究。
在IFAS中试级别系统中运行近70 d后,通过显微镜观察到生物膜上有大量活跃的原生动物(如钟虫)和较多的后生动物(如线虫)时,表明生物膜整体较为健康。在相同的填充比下,弹性填料、自制填料和组合填料脱膜装置中生物膜量分别达到894、2 535、2 697 mg·
L-1 。对成熟的生物膜进行脱膜实验,3种填料上生物膜脱落量及脱落率随运行时间动态变化如图5所示。因为弹性立体填料主要成分为聚乙烯材料,其亲水性差,形成的生物膜量较小且生物膜厚度较薄又疏松,加上曝气对生物膜的冲击,其生物膜脱落量在1~21 d内不断增长,脱落率(生物膜脱落量/初始生物膜量)达95%,接近初始生物膜量,且在第24 天时脱落量有所下降。这主要是因为在21~24 d之间,生物膜已基本完成更新。组合填料的生物膜脱膜量在1~18 d不断增多,但因组合填料结构易引起生物膜粘连,从而导致结团现象的产生,使得生物膜内部厌氧区得不到足够的营养而容易失去活性,在脱膜12~18 d内出现少量块状脱落生物膜,且脱膜率在第18 天达到63%后,脱膜率未明显增加。自制填料生物膜脱落量在1~24 d稳步上升,其生物膜脱落率增长趋势先快后慢,整体不断上升,最终趋于平缓,于24 d时达到近80%的脱落率。这可能是由于绝大多数生长速率较快的异养菌分布在营养物质浓度高的生物膜外层,加上外部受到机械力的原因生物膜脱落率高,而世代周期长的自养型细菌如硝化菌等则生长在生物膜的内部不易脱落[16] ,但纤维载体挂膜后呈松茸状且无结团现象,营养物质传质效果较好,所以更新较为稳定。2.4 不同填料运用于IFAS中试系统的高通量分析
2.4.1 原始数据质量评估
本研究采用高通量测序方法。样品的稀释曲线如图6所示,可知测序数据量在40 000条以上时,曲线趋于平坦,说明本研究测序数据量合理,足以覆盖样本中绝大多数细菌。
2.4.2 菌群多样性分析
Alpha多样性是指一个特定区域或生态系统内的物种多样性。如表2所示,样本覆盖率均在0.993以上, 说明本次实验取样合理, 测序的工作完成较好。
表2 生物膜样品测序信息及细菌的多样性指数
Table 2 Sequencing information of biofilm samples and bacterial diversity index
样品 OTU数 Shannon指数 chao1指数 样品覆盖率 T1 1 243 7.616 1 338.610 0.995 T2 1 281 7.845 1 394.824 0.995 T3 1 304 7.693 1 519.530 0.994 T4 1 374 7.715 1 492.845 0.994 T5 1 339 7.731 1 437.809 0.995 X1 1 166 7.732 1 193.878 0.997 X2 1 270 7.624 1 416.229 0.994 X3 1 233 7.515 1 332.382 0.995 X4 1 282 7.748 1 564.075 0.993 X5 1 418 8.178 1 660.851 0.993 Z1 1 291 7.886 1 518.635 0.994 Z2 1 248 7.797 1 368.128 0.996 Z3 1 209 7.85 1 295.232 0.996 Z4 1 342 7.847 1 444.782 0.995 Z5 1 353 7.885 1 474.701 0.995 chao1指数表示一个群落或生境中物种数目的复杂度,值越高说明群落内物种的数目越多。由于chao1指数,组合填料生物膜>弹性填料生物膜>自制填料生物膜, 表明组合填料生物膜上的物种总数更大。
Shannon指数体现样品中物种的生物多样性。比较发现,随时间的推移,3种填料上多样性均在逐渐增多,说明整个系统逐步趋于稳定。初期Shannon指数,组合填料多样性>自制填料多样性>弹性填料多样性,而后期,自制填料多样性>组合填料多样性>弹性填料多样性,说明自制填料的物种多样性随时间的推移会逐渐高于组合填料、弹性填料。这可能是由于组合填料亲水性高,初期微生物极容易附着而形成生物膜,但后期同样由于亲水性高,使得形成的生物膜致密,造成传质效率差,从而致使其物种多样性降
低[17] 。2.4.3 菌群分类和群落结构分析
1) 门水平下3种填料生物膜上不同时期的关键微生物分析。在图7中,由分类学分析结果显示,组合填料、弹性填料和自制填料生物反应器中,生物膜菌群分别由330、314、329个属组成,其中弹性立体填料富集的微生物菌群大部分为变形菌门(Proteobacteria, 41.47%)和拟杆菌门(Bacteroidetes, 26.20%),其次是厚壁菌门(Firmicutes, 13.93%)、放线菌门(Actinobacteria, 4.91%)和硝化螺旋菌门(Nitrospirae, 4.28%)等;自制填料富集的微生物菌群大部分为变形菌门(Proteobacteria, 44.06%)和拟杆菌门(Bacteroidetes, 26.84%),其次是放线菌门(Actinobacteria, 7.70%)、硝化螺旋菌门(Nitrospirae, 5.75%)和厚壁菌门(Firmicutes, 5.17%)等;组合填料富集的微生物菌群大部分为变形菌门(Proteobacteria, 38.73%)和拟杆菌门(Bacteroidetes, 30.92%),其次是放线菌门(Actinobacteria, 6.74%)和硝化螺旋菌门(Nitrospirae, 5.73%)等。
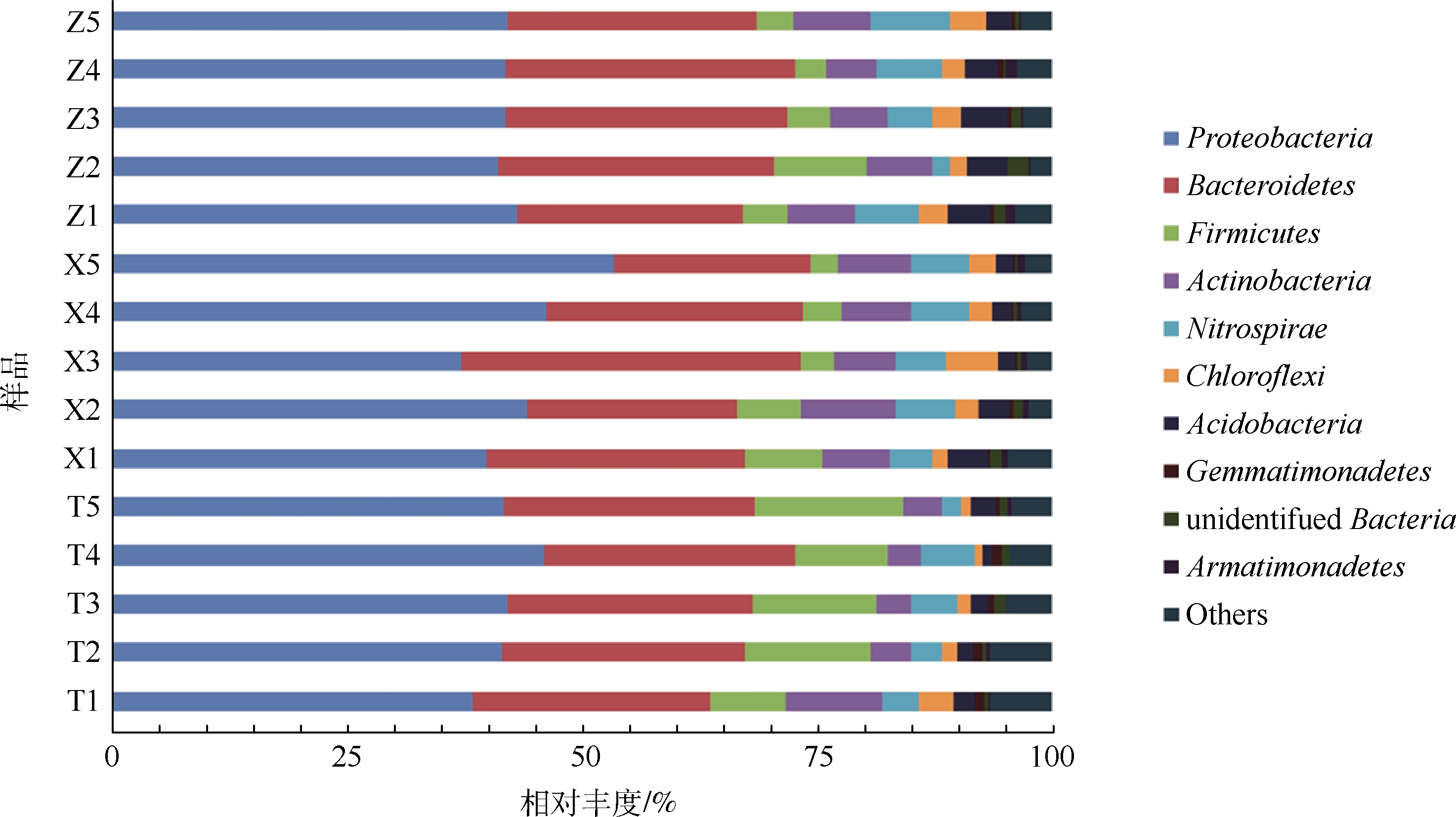
图7 门水平下3种填料不同时期的微生物群落对比
Fig. 7 Comparison of microbial communities of three filters at phylum level during different periods
在门单元下,不同填料附着相上的细菌门类差别不显著,硝化螺旋菌门丰度有些差别,随着时间的推移,3种填料生物膜上硝化螺旋菌门丰度虽有小幅度波动,但整体是在不断的增多;最终,自制填料(5.75%)>组合填料(5.73%)>弹性填料(4.28%),说明自制填料和组合填料对富集该优势物种的效果好于弹性填料。
2) 属水平下3种填料生物膜上不同时期的关键微生物分析。AOB(氨氧化菌)和NOB(亚硝酸盐氧化菌)是污水处理生物脱氮过程中关键的功能性细菌,协同发挥硝化作用。其中,AOB主要归属于变形菌纲(Proteobacteria)中的β-Proteobacteria和γ-Proteobacteria[18,19],包括亚硝化单胞菌属(Nitrosomonas)、亚硝化螺杆菌属(Nitrosospira)、亚硝化叶菌属(Nitrosolobus)、亚硝化球菌属(Nitrosococcus)和亚硝化弧菌属(Nitrosovibrio)
等[20] 。如图8所示,本实验中3种生物膜检测到的AOB有亚硝化单胞菌属(Nitrosomonas)和unidentified Nitrosomonadaceae,弹性填料、自制填料、组合填料生物膜上AOB随反应器运行的时间推移,波动较为明显,且组合填料上AOB(0.41%)>自制填料(0.16%)>弹性填料(0.11%)。这可能是由于AOB 相较于NOB易流失[21] ,而相比于弹性填料,自制填料和组合填料表面的亲水基团更多,尤其是组合填料,亲水性最高,世代时间较长、生长缓慢的AOB更易吸附固定在其表面,使得AOB的数量及氨氧化效率有所提高,系统抗冲击负荷能力随之增强[22] ;这也与水质指标相对应,3种填料的反应器氨氮去除率均在90%以上,但自制填料与组合填料对氨氮的去除率高于弹性填料。
图8 属水平下3种填料不同时期的微生物群落对比
Fig. 8 Comparison of microbial communities of three filters at genus level during different periods
而已知的NOB分别为硝酸杆菌属(Nitrobacter)、硝酸球菌属(Nitrococcus)、硝化螺旋菌属(Nitrospira)和硝酸刺菌属(Nitrospina)。本研究检测出的NOB主要为硝化螺旋菌,硝化螺旋菌属于变形菌纲下的一类革兰氏阴性细菌,是存在于污水处理系统中的主要亚硝酸氧化
菌[23] ,可将亚硝酸盐氧化成硝酸盐。弹性填料、自制填料、组合填料硝化螺旋菌属占比分别为4.68%、3.20%、2.90%。弹性填料上硝化螺旋菌占比最高,可能是由于其疏水性高,形成的生物膜较为疏松,有利于氧传质。已有研究表明,绿弯菌门(Chloroflexi)在团聚体的形成中起着非常重要的作用,为各种厌/缺氧细菌的生长提供了良好的条件,如一些自养反硝化菌的生
长[24,25] 。本研究高通量结果显示,在3种填料的生物膜上发现多种反硝化菌,说明在DO较高的好氧池中,由于填料的投加,当生物膜达到一定的厚度时,其内部会形成缺氧或厌氧微环境,为反硝化细菌提供生存条件,这与大多数研究相符
合[26,27,28,29,30] 。在本研究中,变形菌门(Proteobacteria)为绝对的优势菌种,而以往的研究结果表明,绝大多数已确认的反硝化菌集中分布于变形菌门(Proteobacteria),α-Proteobacteria纲、β-Proteobacteria纲和γ-Proteobacteria纲均包含反硝化菌[31,32] 。在本实验中,3种生物膜检测出的反硝化菌属包括热单胞杆菌属(Thermomonas)、红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)、陶厄氏菌属(Thauera)、Defluviimonas、脱氯单胞菌属(Dechloromonas)、简易螺旋菌属(Simplicispira)、副球菌属(Paracoccus)、动胶菌属(Zoogloea)、黄杆菌属(Flavobacterium)、生丝微菌属(Hyphomicrobium)、芽孢杆菌属(Bacillus)、硫杆菌属(Thiobacillus)、食酸菌属(Acidovorax)等。由于组合填料更有利于形成厌、缺氧微环境,因为组合填料对微生物的亲和性更好,形成的生物膜厚且致密,在生物膜内部更有利于形成缺氧微环境,所以在组合填料中附着的生物膜中,反硝化菌群比例较高(4.61%
)[18] 。弹性填料挂膜难,形成的生物膜厚度薄且疏松,加上曝气的搅动、湍流加剧,将会使生物膜更新速率加快,相比形成的缺氧微环境区较小或不稳定,其反硝化细菌占比最低(3.08%)。而由于自制填料特殊的结构,在贴近填料骨架部分添加短纤维,以增加根部纤维密度,使其在骨架表面形成良好的缺/厌氧环境,给反硝化细菌提供很好的生存环境(占比5.19%)。水质分析结果表明,TN出水浓度与反硝化菌占比呈负相关,自制填料与组合填料系统的脱氮效果均好于弹性填料。高通量检测中发现反硝化细菌多数为异养型,少数为自养型。假单胞菌属(Pseudomonas)是已知反硝化菌中最大的分类群之一,该属中的多个种已被作为研究反硝化过程的模式菌
株[33] ;热单胞杆菌(Thermomonas)曾在厌氧反硝化反应器内被分离出来,且在50 ℃下表现较好的反硝化特性[34] ;硫杆菌属为化能自养型反硝化细菌,具有极性鞭毛,最佳pH生长范围为6~7.5[35] ;陶厄氏菌(Thauera)是β-Proteobacteria纲下的一类革兰氏阴性细菌,大多为杆状,是一类广泛存在于各种类型的废水处理装置中并具有多种芳香族污染物降解能力的重要功能类群,同时具有反硝化能力[36,37,38,39] ;Defluviimonas作为优势菌属,在生物滤池膜表面分离得到,并被验证了其反硝化特性[40] 。另外,在本研究检测结果中还发现一部分反硝化除磷菌(DPB)主要包括:脱氯单胞菌属(Dechloromonas)、链球菌(Streptococcus)和节杆菌(Arthrobacter)。脱氯单胞菌属曾被发现与Dechloromonas sp.R-28400相似度高达99%,是一种具有反硝化除磷功能的可培养
菌[41] 。链球菌(Streptococcus)是一种兼性厌氧型反硝化除磷菌,而节杆菌(Arthrobacter)是一种化能异养型菌,具有反硝化除磷功能[42] 。而生丝微菌属(Hyphomicrobium)是反硝化细菌的典型代表,在以甲醇为碳源时可实现脱氮除磷[43] 。反硝化聚磷微生物在缺氧环境下以硝酸盐作为电子受体,以PHB作为碳源(电子供体),通过“一碳两用”途径来实现同步反硝化和过量吸磷[44,45,46] 。自制填料生物膜上反硝化除磷菌占比为1.65%,而弹性填料和组合填料生物膜上均为0.19%。这说明自制填料形成的生物膜厌、缺、好微环境更加稳定,对反硝化除磷菌有一定的富集作用。综上所述,由高通量测序结果可知,与弹性填料和组合填料相比,自制填料生物膜上生物多样性最高,系统运行稳定,且自制填料上功能菌占比突出,具有丰度较高的好氧反硝化菌和反硝化除磷菌,这可能在污水处理的脱氮除磷过程中发挥着协同作用。
3 结论
1) 3种填料的亲水性检测结果表明,组合填料纤维的亲水性最高,但脱膜效果最差,最高脱膜率为63%;弹性填料亲水性最差,脱膜效果最好,21 d可基本完成生物膜的更新;自制填料的亲水性介于上述2种填料之间,24 d时脱膜率可高达80%。
2) 3种填料生物膜系统对COD、氨氮的去除率均高于90%,出水达到一级A排放标准。自制纤维填料系统稳定运行期间,TN出水满足一级A排放标准。
3) 3种填料生物膜上硝化螺旋菌门丰度随运行时间的推移,整体呈增长的趋势。结果表明自制纤维填料、组合填料和弹性填料上的硝化螺旋菌门相对丰度最高。
4) 高通量结果显示,在3种填料上均检测到一定丰度的反硝化除磷菌,表明自制填料对反硝化除磷菌具有一定的富集优势;同时,在含有3种填料的污水处理系统中反硝化除磷菌可能协同发挥着脱氮除磷作用。
参 考 文 献
- 1
念兴宇. 基于分子生物学技术的IFAS系统不同季节下菌群结构及关键硝化细菌变化研究[D]. 上海: 华东师范大学, 2015.
- 2
PEHRSON R L, MCDOWELL C. Integrated fixed-film activated sludge (IFAS) technology for WWTP upgrades[J]. Proceedings of the Water Environment Federation, 2002, 12: 387-398.
- 3
刘晋旭, 刘振鸿. 复合式生物处理系统的研究与应用[J]. 工业水处理, 2003, 23(1): 8-11.
- 4
ZIELIŃSKI M, ZIELIŃSKA M, DĘBOWSKI M. Application of microwave radiation to biofilm heating during wastewater treatment in trickling filters[J]. Bioresource Technology, 2013, 127(1): 223-230.
- 5
ODEGAARD H, RUSTEN B, WESTRUM T. A new moving bed biofilm reactor-applications and results[J]. Water Science & Technology, 1994, 29(10): 157-165.
- 6
曹相生. 生物膜反应器设计与运行手册[M]. 北京: 中国建筑工业出版社, 2013.
- 7
MCQUARRIE J, RUTT K, SEDA J, et al. Observations from the first year of full-scale operation: The IFAS/BNR process at the broomfield wastewater reclamation facility, broomfield, CO[J]. Proceedings of the Water Environment Federation, 2004, 2004, 7: 274-285.
- 8
PSALTAKIS E P, LIUBICICH J, PITT P, et al. Demonstration of integrated fixed film activated sludge process for BNR at the mamaroneck WWTP[J]. Proceedings of the Water Environment Federation, 2003, 6: 120-141.
- 9
胡小兵, 朱荣芳, 唐素兰, 等. 不同负荷下生物膜脱落与载体生物膜生物特性的相互影响[J]. 环境科学学报, 2017, 37(8): 2925-2935.
- 10
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
- 11
马兆昆. 炭纤维的微生物固着机制及在污水处理中的应用研究[D]. 北京: 北京化工大学, 2003.
- 12
国家环境保护总局. 城镇污水处理厂污染物排放标准: GB 18918-2002[S]. 北京: 中国环境出版社, 2002.
- 13
杨东方, 齐崴, 苏荣欣, 等. 填料表面亲水改性对MBBR处理船舶生活污水的影响[J]. 环境工程学报, 2014, 8(5): 1895-1898.
- 14
陈耀章. 接触氧化填料问题的探讨[J]. 石油化工环境保护, 1992(3): 5-9.
- 15
刘洪波, 孙力平, 夏四清. 生物膜中反硝化除磷作用的研究[J]. 工业用水与废水, 2006, 37(1): 40-43.
- 16
殷峻, NICOLAS D, ETIENNE P. 限制基质条件下生物膜特性的研究[J]. 中国给水排水, 2012, 28(1): 24-27.
- 17
顾佳艳, 何国富, 林楠. 固定膜-活性污泥系统细菌多样性及脱氮关键菌研究[J]. 环境工程, 2016, 34(8): 36-39.
- 18
CÉBRON A, COCI M, GARNIER J, et al. Denaturing gradient gel electrophoretic analysis of ammonia-oxidizing bacterial community structure in the lower Seine River: Impact of Paris wastewater effluents[J]. Applied and Environmental Microbiology, 2004, 70(11): 6726-6737.
- 19
VIANCELLI A, KUNZ A, ESTEVES P A, et al. Bacterial biodiversity from an anaerobic up flow bioreactor with ANAMMOX activity inoculated with swine sludge[J]. Brazilian Archives of Biology & Technology, 2011, 54(5): 1035-1041.
- 20
MERBT S N, AUGUET J C, BLESA A, et al. Wastewater treatment plant effluents change abundance and composition of ammonia-oxidizing microorganisms in mediterranean urban stream biofilms[J]. Microbial Ecology, 2015, 69(1): 66-74.
- 21
KINH C T, AHN J, SUENAGA T, et al. Free nitrous acid and pH determine the predominant ammonia-oxidizing bacteria and amount of N2O in a partial nitrifying reactor[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1673-1683.
- 22
李青, 成小英. 不同填料生物反应器中脱氮微生物群落比较分析[J]. 安全与环境学报, 2017, 17(6): 2360-2365.
- 23
黄菲, 梅晓洁, 王志伟, 等. 冬季低温下MBR与CAS工艺运行及微生物群落特征[J]. 环境科学, 2014, 35(3): 1002-1008.
- 24
CHU Z R, WANG K, LI X K, et al. Microbial characterization of aggregates within a one-stage nitritation-anammox system using high-throughput amplicon sequencing[J]. Chemical Engineering Journal, 2015, 262: 41-48.
- 25
XU X L, LIU G H, WANG Y Y, et al. Analysis of key microbial community during the start-up of anaerobic ammonium oxidation process with paddy soil as inoculated sludge[J]. Journal of Environmental Sciences, 2018, 64(2): 317-327.
- 26
HUANG S, RONG H, LIN M. Effect of pH value on distribution of dissolved oxygen (DO) during simultaneous nitrification and denitrification( SND) in biofilm[J]. Chinese Journal of Environmental Engineering, 2015, 9(9): 4233-4238.
- 27
WON S G, JEON D Y, KWAG J H, et al. Nitrogen removal from milking center wastewater via simultaneous nitrification and denitrification using a biofilm filtration reactor[J]. Asian Australasian Journal of Animal Sciences, 2015, 28(6): 896-902.
- 28
WANG B, YANG Q, LIU R, et al. A study of simultaneous organics and nitrogen removal by extended aeration submerged biofilm process[J]. Water Science & Technology, 2011, 24(5): 197-213.
- 29
SHE Z L, ZHANG X L, GAO M, et al. Effect of salinity on nitrogen removal by simultaneous nitrification and denitrification in a sequencing batch biofilm reactor[J]. Desalination & Water Treatment, 2016, 57(16): 7378-7386.
- 30
冯翠杰, 王淑梅, 陈少华. 复合生物膜-活性污泥反应器同步脱氮除磷[J]. 环境工程学报, 2012, 6(9): 3106-3114.
- 31
王春香, 刘常敬, 郑林雪, 等. 厌氧氨氧化耦合脱氮系统中反硝化细菌研究[J]. 中国环境科学, 2014, 34(7): 1878-1883.
- 32
郑林雪, 李军, 胡家玮, 等. 同步硝化反硝化系统中反硝化细菌多样性研究[J]. 中国环境科学, 2015, 35(1): 116-121.
- 33
MERGAERT J, CNOCKAERT M C, SWINGS J. Thermomonas fusca sp. nov. and Thermomonas brevis sp. nov. two mesophilic species isolated from a denitrification reactor with poly(epsilon-caprolactone) plastic granules as fixed bed, and emended description of the genus Thermomonas[J]. International Journal of Systematic & Evolutionary Microbiology, 2003, 53(6): 1961-1966.
- 34
WOOD A P, KELLY D P. Physiological characteristics of a new thermophilic obligately chemolithotrophic thiobacillus species, thiobacillus tepidarius[J]. International Journal of Systematic Bacteriology, 1985, 35(4): 434-437.
- 35
MAO Y, ZHANG X, XI X, et al. Versatile aromatic compound-degrading capacity and microdiversity of Thauera, strains isolated from a coking wastewater treatment bioreactor[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(9): 927-934.
- 36
MECHICHI T, STACKEBRANDT E, GAD'On N, et al. Phylogenetic and metabolic diversity of bacteria degrading aromatic compounds under denitrifying conditions, and description of Thauera phenylacetica sp. nov., Thauera aminoaromatica sp. nov. and Azoarcus buckelii sp. nov. [J]. Archives of Microbiology, 2002, 178(1): 26-35.
- 37
THOMSEN T R, KONG Y, NIELSEN P H. Ecophysiology of abundant denitrifying bacteria in activated sludge[J]. FEMS Microbiology Ecology, 2007, 60(3): 370-382.
- 38
VALLE A, BAILEY M J, WHITELEY A S, et al. N-acyl-l-homoserine lactones (AHLs) affect microbial community composition and function in activated sludge[J]. Environmental Microbiology, 2004, 6(4): 424-433.
- 39
FOESEL B U, DRAKE H L, SCHRAMM A. Defluviimonas denitrificans gen. nov. sp. nov. and Pararhodobacter aggregans gen. nov. sp. nov. non-phototrophic Rhodobacteraceae from the biofilter of a marine aquaculture[J]. Systematic & Applied Microbiology, 2011, 34(7): 498-502.
- 40
郭丽芸, 时飞, 杨柳燕. 反硝化菌功能基因及其分子生态学研究进展[J]. 微生物学通报, 2011, 38(1): 583-590.
- 41
HEYLEN K, VANPARYS B, WITTEBOLLE L, et al. Cultivation of denitrifying bacteria: Optimization of isolation conditions and diversity study[J]. Applied and Environmental Microbiology, 2006, 72(4): 2637-2643.
- 42
库辉. 反硝化除磷菌的生物特性及除磷功能基因的表达研究[D]. 武汉: 武汉理工大学, 2014.
- 43
RODRÍGUEZ-MARTÍNEZ S, DEKEL A, AIZENBERG-GERSHTEIN Y, et al. Characterization of biofilm bacterial communities in a vertical unsaturated-flow bioreactor treating domestic greywater[J]. Environmental Processes, 2016, 3(2): 1-16.
- 44
刘洪波, 孙力平, 夏四清. 生物膜中反硝化除磷作用的研究[J]. 工业用水与废水, 2006, 37(1): 40-43.
- 45
王亚宜, 王淑莹, 彭永臻. MLSS、pH及NO-2-N对反硝化除磷的影响[J]. 中国给水排水, 2005, 21(7): 47-51.
- 46
SEVIOUR R J, MINO T, ONUKI M. The microbiology of biological phosphorus removal in activated sludge systems[J]. FEMS Microbiology Reviews, 2003, 27(1): 99-127.
- 1
全文HTML
摘要
为考察固定式填料在生物膜-活性污泥工艺(IFAS)中的性能和菌群结构,选取弹性立体填料、组合填料以及自制填料3种固定式填料投入中试级别的IFAS反应器好氧池中进行对比,另于小试系统中进行3种填料的脱膜实验。结果表明:组合填料的亲水性最高(接触角为38°),生物膜厚且致密,加上结点的存在,易结团,脱膜率最高为63%;弹性填料21 d基本可以完成生物膜的更新;而自制填料脱膜速率先快后慢,第24 天时脱膜率高达80%。在系统运行期间,3种填料对COD、氨氮去除率均在90%以上,出水均达到一级A排放标准。自制填料和组合填料系统的总氮去除率高于弹性填料。当自制填料系统运行27 d以后,TN出水可稳定达到一级A排放标准。与组合填料和弹性填料相比,由于自制填料结构的特殊性,其负载的生物量最多,生物多样性最高,同时,对硝化细菌、反硝化菌和反硝化除磷菌均表现出富集优势。
Abstract
In order to investigate the performance and microbial community structure of fixed fillers in integrated fixed film-activated sludge (IFAS) process, three kinds of fixed fillers (elastic filler, combined filler and self-made filler) were used in the pilot-scale aerobic tank of IFAS reactor for comparison. In addition, biofilm detachment experiments of three fillers were carried out in a small test device. The results showed that the combined filler had the highest hydrophilicity (contact angle was 38°), which resulted in the formation of thick and dense biofilm, and even easy agglomeration due to the existence of nodes, the highest biofilm detachment rate was 63%. The biofilm on the elastic filler could basically renew within 21 days. The biofilm detachment rate of the self-made filler changed from fast to slow, and on the 24th day the biofilm detachment rate reached 80%. During the operation of the system, the removal rates of COD and ammonia for these three fillers were above 90%, and the effluents meet the first-class A discharge standard. The TN removal rates of the two systems filled with self-made fillers and combined filler were higher than that of elastic filler. After 27 days of the self-made filled system running, TN in the effluent could meet the first-class A discharge standard. Compared with the combined filler and elastic filler, the self-made filler had the most biomass and the highest biodiversity due to its special structure. Meanwhile, it had enrichment advantages in nitrifying bacteria, denitrifying bacteria and denitrifying phosphorus removal bacteria. This research contributes to the engineering application of IFAS process.
生物膜-活性污泥系统(integrated fixed-film activated sludge, IFAS),是将生物膜和活性污泥相结合的一种复合型系统。此工艺有效解决了传统活性污泥法在脱氮除磷上的污泥龄问题。近年来,IFAS工艺在污水处理厂提标改造中倍受青睐。目前,对IFAS工艺的研究主要集中在工艺模型建立和微生物菌群,工艺运行参数确定以及系统运行效果
随着材料领域的不断发展,IFAS工艺系统中填料的类型和应用方式也更加多样
本研究将3种固定式填料:弹性立体填料、组合填料以及本研究自制的固定式纤维填料应用于IFAS中试平台和小试脱膜装置,通过污染物去除效果、微生物菌群特征以及脱膜情况,结合各自的理化性质进行了对比分析,以期为IFAS工艺的工程应用,提高工艺的脱氮除磷性能提供更多的理论支撑与数据支持。










 百度学术
百度学术


 下载:
下载:
