-
我国现有近5 000座市政污水处理厂,年处理污水总量超6×1010 m3。市政污水经活性污泥法处理后,其中约1/3的有机污染物可被完全氧化成二氧化碳(CO2)。而其余大部分污水有机物则经由活性污泥代谢后被转化为微生物生物质(按污水处理量及COD折算约合污染物近1×107 t),成为市政污水处理厂产量最大的副产物——剩余污泥的主要干物质成分。剩余污泥中的有机物是生产能源、燃料和高附加值化学品的潜在原料,可被资源化利用[1-2],故不宜简单地归类于亟需处理或处置的“有害废物”。
厌氧消化(anaerobic digestion, AD)被认为是实现剩余污泥资源化的主流技术之一[2]。然而,受限于停留时间长、沼气产率低、资源化产品单一等因素,该技术的资源回收效率与资源化产品经济价值等有待进一步提升[3]。近年来,羧酸平台引起了国内外研究者的广泛关注,其“构筑模块”为短链脂肪酸(short-chain fatty acids, SCFAs, C1~C5)。SCFAs可进一步转化为多种高附加值化学品,包括酯类、生物塑料(聚羟基脂肪酸酯)、单细胞蛋白以及中链脂肪酸(medium-chain fatty acids, MCFAs)[2]。SCFAs是污泥厌氧消化的中间产物。经过水解和发酵过程,污泥中的有机物(蛋白质、多糖、脂类)被代谢转化生成SCFAs,转化率可达约70%[2, 4]。相较于传统AD产甲烷过程,污泥的厌氧发酵产SCFAs过程的停留时间、稳定性及发酵产品产率等条件均更具优势。
MCFAs是指碳原子个数为6~12的饱和脂肪酸,包括己酸(C6)、庚酸(C7)、辛酸(C8)等,在精细化工中被广泛用于制作香料、医药、化妆品及增塑剂、橡胶等化工产品。MCFAs的水溶性较弱,如己酸和辛酸在常温常压条件下的水溶解度仅为10.82 g∙L−1和0.68 g∙L−1,易于从发酵液中分离回收。碳链延长(chain elongation, CE)是微生物合成MCFAs的重要代谢途径。该过程以SCFAs为电子受体、乙醇或乳酸为电子供体进行逆向β-氧化(reverse β-oxidation,RBO)[5]。近年来,利用SCFAs产MCFAs的研究已由早期的纯培养(pure culture)体系(以人工培养基为底物接种科氏梭菌Clostridium kluyveri)向开放式培养(open culture)体系(以未经灭菌的实际有机废水或有机废弃物为底物培养混合微生物菌种)稳步推进。AGLER等[6]将发酵液pH稳定控制在5.5,利用玉米生物乙醇发酵液(富含乙醇、葡萄糖、酵母菌细胞及少量残留玉米粒生物质)产SCFAs同时进行碳链延长,并在发酵反应器下游设置在线液液萃取体系同步连续回收发酵液中的己酸,产率达到2 g∙(L∙d)−1。以此为基础,GE等[7]在550 d的连续培养过程中将己酸产率继续提高至3.4 g∙(L∙d)−1。KUCEK等[8]利用葡萄酒粗酒泥(乙醇质量分数为40%)产MCFAs,在优化条件下(pH为5.2,以COD计的有机负荷率5.8 g∙(L∙d)−1),己酸和辛酸的总产率为3.9 g∙(L∙d)−1。除了酿酒工业产生的有机废物,合成气发酵液、餐厨垃圾、乳清废水等也被报道用作产MCFAs的原料[9-13]。综上所述,目前微生物CE技术产MCFAs的主要原料均为具有高COD且易生物降解的有机废水或废弃物,而利用市政污水处理厂剩余污泥产MCFAs的系统研究仍需深入开展。
相较于酿酒废水或餐厨垃圾,污泥的惰性组分含量较高,且经由AD过程产MCFAs的产率极低。影响污泥产MCFAs的因素包括:1)污泥水解(限速步骤)进程缓慢;2)污泥厌氧发酵累积SCFAs过程中自发产甲烷导致碳转化效率降低;3)CE微生物组驯化期较为漫长。
本研究以酿酒废水厌氧塔颗粒污泥为接种物,采用混合SCFAs为电子受体、乙醇为电子供体,通过优化水力停留时间(HRT)与醇酸比进行微生物驯化以获得在代谢功能上占主导优势的CE微生物组。同时,采用碱性热水解预处理技术促进污泥破解,进而加速水解效率、提高SCFAs产率,完成从人工配制培养基溶液到真实污泥发酵液的底物转变,以“两相发酵”工艺实现污泥产MCFAs,并基于微生物多样性和宏基因组分析进一步揭示了过程中的微生态机制,以期为污泥有机质转化高附加值化学品的策略构建提供参考。
-
微生物合成MCFAs厌氧发酵的接种污泥取自河南省三门峡市渑池县白酒厂废水厌氧处理塔,污泥初始pH为7.2,挥发性悬浮物质量分数(VSS)为0.9%。在驯化期(实验设置条件见1.2节)所使用的人工培养基组分包括:乙酸钠(醇酸比为2∶1与3∶1条件下其质量浓度分别为8.20 g∙L−1与6.15 g∙L−1)、乙醇(醇酸比为2∶1与3∶1条件下其质量浓度分别为15.3 mL∙L−1与17.3 mL∙L−1)、磷酸二氢铵3.60 g∙L−1、六水氯化镁0.15 g∙L−1、七水硫酸镁0.20 g∙L−1、氯化钾0.15 g∙L−1、二水氯化钙0.20 g∙L−1、微量元素溶液1 mL∙L−1。微量元素溶液的配方为(每升溶液):四水氯化亚铁1.50 g、氯化锌70 mg、四水氯化锰100 mg、硼酸6 mg、六水氯化钴190 mg、二水氯化铜2 mg、六水氯化镍24 mg、二水钼酸钠36 mg,以及25%稀盐酸10 mL。
用于产SCFAs的剩余污泥取自上海市闵行区水质净化厂二沉池,经过离心浓缩后(在转速为4 000 r·min−1条件下离心旋转5 min),再利用泥水分离后的上清液将污泥总固体含量调至约3%。调整后的污泥基本理化性质如表1所示。
-
CE反应器为5 L连续搅拌反应器(continuous stirred-tank reactor,CSTR)。实验中的反应体系的体积为3 L,接种比例为20% (体积分数),温度、搅拌速率和pH分别为30 °C、200 r·min−1和6.2。反应器运行采用连续模式发酵,连续运行135 d,共分为5个运行周期(见表2)。其中,Phase Ⅰ~Ⅳ为驯化期,底物为人工配制培养基;Phase Ⅴ为实验期,底物为污泥厌氧发酵上清液。反应器运行期间,每24 h取5 mL样品测定发酵液中的底物(乙醇、乙酸)及产物(丁酸、己酸和辛酸)浓度。
污泥厌氧发酵液的制备过程分为预处理和厌氧发酵2个阶段。
1)预处理阶段:将污泥的pH用NaOH溶液(OH−物质的量为2 mol·L−1)调至11.0,水浴加热至90 ℃后持续进行热碱处理2 h,待冷却降温至37 ℃后,用HCl溶液(H+物质的量为2 mol·L−1)将pH调至7.0。
2)厌氧发酵阶段:采用全自动厌氧消化测试仪器(MultiTalent203,碧普华瑞)进行发酵,反应器为2 L培养瓶,单个反应器工作体积为1.8 L,每组可同时运行6台反应器;厌氧接种比为5:1(以TS计),接种物取自本实验室稳定连续运行超过1 a的污泥中温厌氧消化反应罐;在发酵实验开始前通入高纯氩气5 min以吹脱溶氧,并添加50 mmol·L−1的2-溴乙烷磺酸钠(BES)用于抑制产甲烷古菌的代谢活性;发酵控制条件为温度(37 ± 1)℃、搅拌速率120 r·min−1、发酵时间5 d;最后将发酵液进行泥水分离(4 000 r·min−1高速离心5 min),保留上清液进行高温灭菌(121℃,15 min)后,置于4 ℃下冷藏保存待用;使用前添加适量乙醇将醇酸比调至3∶1,保存时间不超过2 d。
-
剩余污泥pH使用FE28标准pH计(Mettler-Toledo,瑞士)测定;其余理化指标(包括TS、VS、COD、TKN、TAN),采用国标法测定。污泥厌氧发酵液经离心15 min (转速离心力为12 000g)后,取上清液过膜(滤膜孔径0.45 μm),分析其SCOD、多糖、蛋白质和SCFAs浓度等。多糖和蛋白质分别采用蒽酮-硫酸比色法(以葡萄糖为标准物质)和考马斯亮蓝法(以牛血清蛋白为标准物质)[14-15]测定。SCFAs(乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸)的组分和浓度采用气相色谱法测定,即在对其酸化预处理后(添加适量3%磷酸溶液将样品pH降至4.0以下),使用装配有火焰离子化检测仪(FID)和DB-FFAP型毛细管柱的GC-7890B气相色谱(安捷伦,美国)进行定量分析。微生物连续发酵产MCFAs实验中的底物(乙醇、SCFAs)与产物(丁酸、己酸、辛酸)浓度的定量分析方法与SCFAs相同。
-
在运行周期Phase II~V(分别为反应进行50、90、120和133 d)各取发酵液2 mL,在14 000 r·min−1转速下离心旋转5 min,撇除上清液后获得微生物混菌样品置于−80 °C下冷冻保存,直至进行微生物种群多样性分析。分析内容:1)使用E.Z.N.A. Soil DNA试剂盒(Omega Bio-Tek,美国)抽提DNA,DNA浓度、纯度和完整性分别使用TBS-380、NanoDrop2000和1%琼脂凝胶电泳进行检测;2)采用338F/806R和524F/958R引物对分别进行细菌区V3~V4片段和古菌区V4~V5片段的16S rRNA扩增;3)桥式PCR扩增步骤见参考文献[16];4)高通量测序采用Illumina MiSeq PE300平台,优化原始数列后,按97%相似度进行OTU聚类,并采用RDP Classifier贝叶斯算法(Silva数据库,70%置信度)进行OTU聚类分析。
-
宏基因组分析可探究污泥厌氧发酵液作为底物合成MCFAs对微生物CE代谢过程的影响。分别提取实验周期Phase IV和Phase V的发酵液,进行DNA抽提和质量分析,方法与微生物种群多样性分析相同。DNA片段化使用Covaris M220超声破碎仪,数据质控后cleaned reads使用MegaHit(http://github.com/voutcn/megahit)进行组装拼接(contig),仅保留片段长度大于300 bp的拼接序列进入后续拼接。在基因预测阶段,使用MetaGene软件(http://metagene.cb.k.u-tokoyo.ac.jp)进行开放式阅读框(ORFs)预测,长度大于100 bp的ORF被翻译为氨基酸序列。使用CD-HIT软件(http://www.bioinformatics.org/cd-hit)对预测出的基因组进行聚类分析(95%序列一致性,90%覆盖度),选出每个聚类中最长序列作为代表性序列建立非冗余基因集,使用SOAPaligner(http://soap.genomics.org.cn)计算样品的基因丰度。最后,使用BLASTP (v 2.2.28+, http://blast.ncbi.nlm.nih.gov/Blast.cgi),参考NCBI_NR数据库和KEGG数据库对比该非冗余基因集序列,分别进行分类注释和功能注释。
-
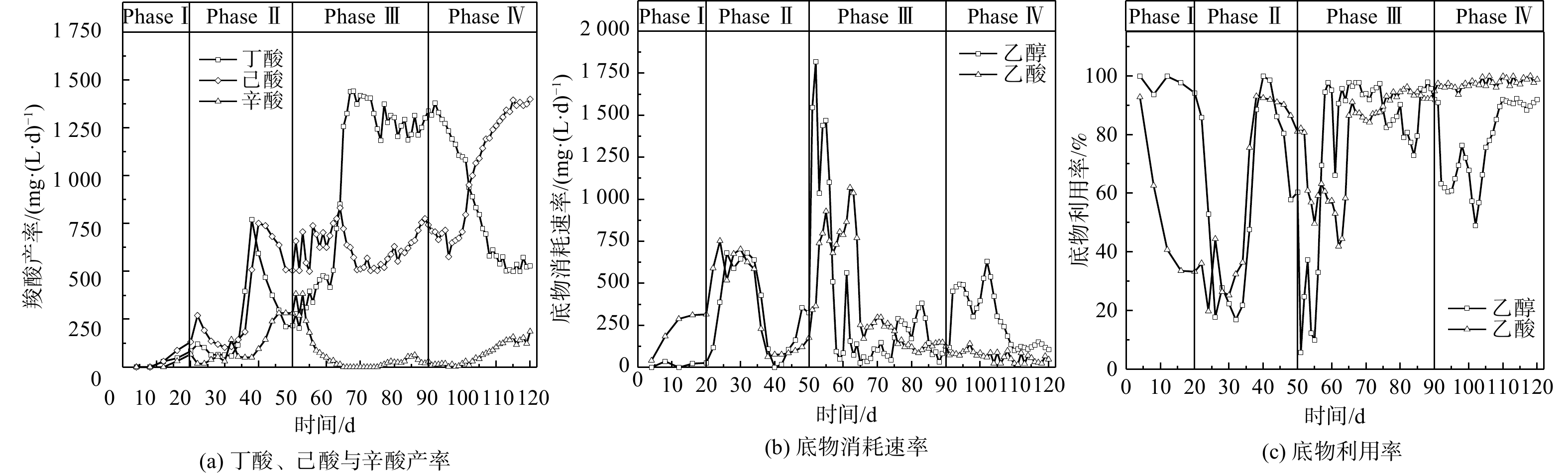
调控反应器的HRT是最常见的驯化微生物菌群以产MCFAs策略之一。如图1所示,在整个驯化期间(0~90 d),丁酸、己酸和辛酸是主要的微生物CE合成产物。在实验启动期(Phase I),3种羧酸的产率均很低,至10~20 d后呈现缓慢增长趋势。在启动期结束时(20 d),丁酸、己酸和辛酸的产率已分别达到65、133和82 mg∙(L∙d)−1。进入Phase II(HRT=10 d),即反应进行至21~35 d,丁酸和辛酸的产率基本维持不变,而己酸的产率出现小幅下降;在35~40 d,丁酸和己酸的产率均迅速增长,其最高产率分别为766和756 mg∙(L∙d)−1,而辛酸产率相较于Phase I发生明显增长。在40~50 d,己酸产率保持在500~750 mg∙(L∙d)−1,但丁酸产率逐步降低至200 mg∙(L∙d)−1,而辛酸产率则上升至265 mg∙(L∙d)−1。CE代谢过程中碳链逐级延长的现象表明“丁酸+乙醇”合成己酸与“己酸+乙醇”合成辛酸的动力学变化决定了己酸产率的动态变化。当HRT由10 d缩短至5 d后,在51~60 d,丁酸和己酸的产率继续保持稳定,辛酸产率则持续下降,表明CE微生物代谢效率并未随着体系OLR增加而上升。而在60~70 d,丁酸产率由468 mg∙(L∙d)−1急剧上升至1 413 mg∙(L∙d)−1,增幅达202%;另一方面,己酸产率则维持在500 mg∙(L∙d)−1左右,辛酸的产率则出现显著下降,最终降至25 mg∙(L∙d)−1。直至Phase III结束,丁酸、己酸与辛酸的相对占比基本维持在这一水平。
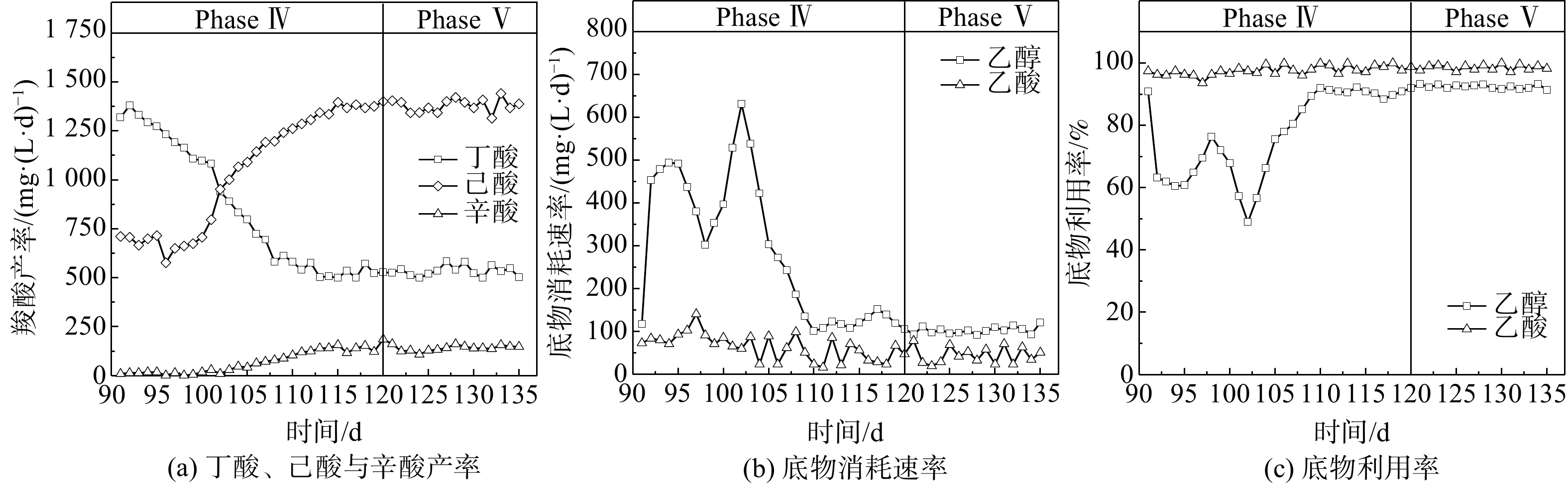
底物利用率反映了微生物进行CE代谢过程的碳转化效率。在Phase I,乙醇利用率达到90%以上,但乙酸利用率却急剧下降,最终仅保持在30%左右,其原因可能是由于乙醇在发酵细菌与产甲烷古菌的协同作用下被代谢转化为乙酸、CH4与CO2。当HRT缩短至10 d(Phase II),因其自身增殖速率过低,产甲烷古菌被逐渐洗脱,而由于存在能量壁垒,导致失去了“互养搭档(syntrophic partner)”的厌氧发酵细菌无法单独进行“乙醇→乙酸”的代谢过程(CH3CH2OH + H2O → CH3COO− + H+ +2H2,ΔG0 = 9.7 kJ∙mol−1)。这表明该周期乙醇与乙酸的利用率完全取决于CE微生物菌群的相对丰度与代谢活性,在Phase II的后半期(35~50 d)上升至近100%;而在Phase III阶段,其变化趋势也基本与同时期丁酸与MCFAs的产率一致,在CE微生物菌群逐渐稳定之后,乙醇和乙酸的利用率基本稳定在90%~100%。因此,导致这一时期(65~90 d)MCFAs产率明显低于丁酸的原因可能是醇酸比过低,乙醇被更多地用于进行乙酸CE反应生成丁酸,进而限制了己酸和辛酸的合成[17-18]。
当醇酸比调至3∶1后(Phase IV),初期(90~100 d)己酸与辛酸的产率相较于Phase III时无明显变化,而丁酸产率则开始逐渐降低;乙酸利用率仍接近100%,而乙醇利用率则下降至60%左右。上述结果表明,微生物未能立即利用富余乙醇作为电子供体进行CE反应,其原因可能是发酵液乙醇浓度骤升所引起的轻微胁迫效应[17]。在100~120 d,丁酸产率由1 074 mg∙(L∙d)−1降至528 mg∙(L∙d)−1,降幅为50.8%,而己酸产率则由701 mg∙(L∙d)−1增至1 402 mg∙(L∙d)−1,辛酸产率也由18.2 mg∙(L∙d)−1增至200 mg∙(L∙d)−1。在此期间,乙醇利用率稳步上升,并保持在88.1%~92.3%,表明乙醇经由逆向β-氧化代谢路径用于微生物CE过程生成MCFAs。有文献报道,当醇酸比为2∶1时,以科氏梭菌Clostridium kluyveri为优势菌的微生物菌群进行CE反应的主要产物为丁酸,将醇酸比提高至3∶1或4∶1,可促使丁酸进一步转化为己酸[7, 17, 19]。在逆向β-氧化过程中,乙醇既是电子供体提供还原当量NADH,也在被氧化时为代谢提供ATP,每5 mol参与CE反应的乙醇对应1 mol被氧化为乙酸的乙醇(5CxH2x-1O2− + 6CH3CH2OH → 5Cx+2H2x+3O2− + CH3COO− + H+ + 4H2O + 2H2),因此,较高的醇酸比使得乙醇更多参与丁酸的CE反应而非厌氧氧化,从而提高了己酸产率[7]。在本研究中,考虑到醇酸比为3∶1的条件下乙醇利用率始终未达到100%,故未进一步提高培养基中的醇酸比,以避免发酵液中乙醇浓度过高而产生底物胁迫效应[18]。WU等[20]发现,当醇酸比从3∶1增至5∶1时,尽管己酸产率在短期内有所提高,但发酵液中的残留乙醇会明显抑制CE微生物的代谢活性。
总烷基量(total alkyl groups, TAL)、平均碳链长度(average chain length, ACL)与CE过程碳效率(carbon conversion efficiency, CCE)是评价微生物产MCFAs的重要指标,其计算公式如式(1)~(3)所示。
式中:C丁酸为丁酸的浓度,mmol∙L−1;C己酸为己酸的浓度,mmol∙L−1;C辛酸为辛酸的浓度,mmol∙L−1;C乙醇为乙醇的浓度,mmol∙L−1;C乙酸为乙酸的浓度,mmol∙L−1。
因为MCFA的水溶性随着碳链长度增加而降低,所以TAL与ACL与发酵液中MCFAs的可分离性能呈线性相关。如表3所示,除启动期Phase Ⅰ之外,其余运行周期内MCFAs的可分离性较好,仅在Phase Ⅲ有所降低,其主要原因在于丁酸的大量生成,而己酸、辛酸的产量不足。CCE反映了乙醇与乙酸参与CE过程被转化为C4~C8羧酸的效率。由于在Phase Ⅰ阶段产甲烷古菌代谢活性较高,CCE仅为33.4%,但在Phase Ⅱ至Ⅳ期间骤增至62.1%~72.9%,表明CE代谢过程的碳利用效率较高。己酸选择性变化趋势与己酸产率保持一致,证明了提高醇酸比有利于CE微生物合成己酸。
-
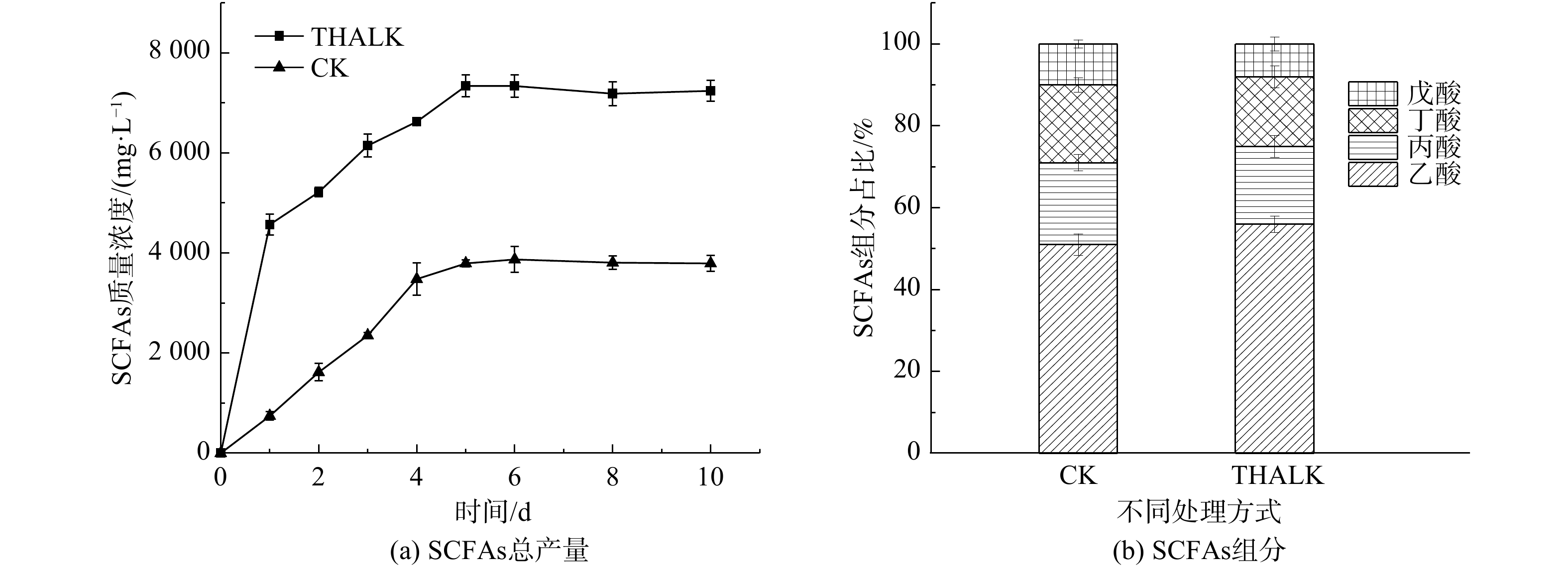
如图2(a)所示,空白组(CK)与热碱预处理组(THALK)的剩余污泥厌氧发酵过程均在5 d后达到稳定。发酵液SCFAs的最终质量浓度(以COD计)分别为(4 240±157) mg∙L−1与(7 000±240) mg∙L−1。这表明热碱预处理对污泥絮体的破壁溶胞作用释放SCOD可明显提升SCFAs产率。对上清液成分进行分析后可知,CK组与THALK组污泥发酵液的SCFAs成分结构类似,主要为乙酸,分别占总SCFAs的51.0%与56.2%,其余为丙酸、正丁酸和正戊酸(图2(b))。其中,碳原子个数为偶数的SCFAs(乙酸、丁酸)占比达到73.3%,表明污泥厌氧发酵液可作为底物合成MCFAs,特别是己酸和辛酸。
如图3所示,Phase Ⅴ阶段的运行条件(HRT=5 d,醇酸比为 3∶1)与Phase Ⅳ阶段保持一致,当底物由人工配制培养基溶液替换为污泥发酵液后,丁酸、己酸和辛酸的合成情况并未出现明显变化,其平均产率分别为534、1 380和141 mg∙(L∙d)−1。另外,乙醇与乙酸的转化利用情况也与Phase Ⅳ阶段时基本相同,利用率保持在92.4%~98.2%。Phase Ⅴ阶段的TAL、ACL和CCE和己酸选择性分别达到519.4 mmol∙L−1、6.47和63.3%,与Phase IV阶段基本持平。因此,尽管污泥发酵液中存在蛋白质(以COD计,质量浓度946.6 mg∙L−1)、多糖(以COD计,质量浓度1 566.6 mg∙L−1)及其他包括腐殖质在内的DOM(以COD计,质量浓度3 122.1 mg∙L−1)。然而,这些DOM并未影响CE微生物合成MCFAs的过程。由此可见,当反应器内微生物保持稳定的菌群多样性结构和代谢活性时,利用污泥发酵液产MCFAs是可行的。值得注意的是,尽管污泥厌氧发酵液中含有丙酸(C3)和正戊酸(C5),但奇数碳链MCFAs(如C5戊酸、C7庚酸等)产率极低,这与HAN等[21]的研究结果一致。产生以上现象的主要原因为如下2个机制。1) CE微生物的底物选择性:在长达90 d的驯化期间, CE微生物始终以乙酸(C2)作为电子受体,并且Phase V期污泥发酵液的SCFAs也是以偶数碳链羧酸为主要组分(乙酸56.2%,正丁酸17.1%),使得CE微生物更倾向于利用乙酸和丁酸为电子受体与乙醇生成偶数碳链的MCFAs。2)逆向β-氧化过程的能量代谢机制:在电子受体为奇数碳链羧酸(如C3丙酸)CE过程中,每5 mol乙酰辅酶A生成戊酸(C5)的同时,有1 mol乙酰辅酶A会被氧化成1 mol乙酸以用于合成ATP提供细胞代谢能量,从而使得乙酸会在下一轮CE过程中,与丙酸竞争电子供体(乙醇)以生成相应的碳链延长羧酸,故理论上奇数碳链MCFAs产物选择率仅为83.33%。已有研究表明,即使仅丙酸为电子供体,奇数碳链MCFAs(C5戊酸、C7庚酸)的产物选择率也仅为35%~66%[22-24]。
综上所述,在优化条件(醇酸比为3∶1、HRT=5 d)下,总含固率为3%的剩余污泥己酸和辛酸产率分别为1.38、0.14 kg∙(L∙d)−1,以我国市政污泥年产量5×107 t(含水率80%)进行估算,以污泥定向发酵产己酸和辛酸的年产量可分别达到46×104 t与4.7×104 t。
-
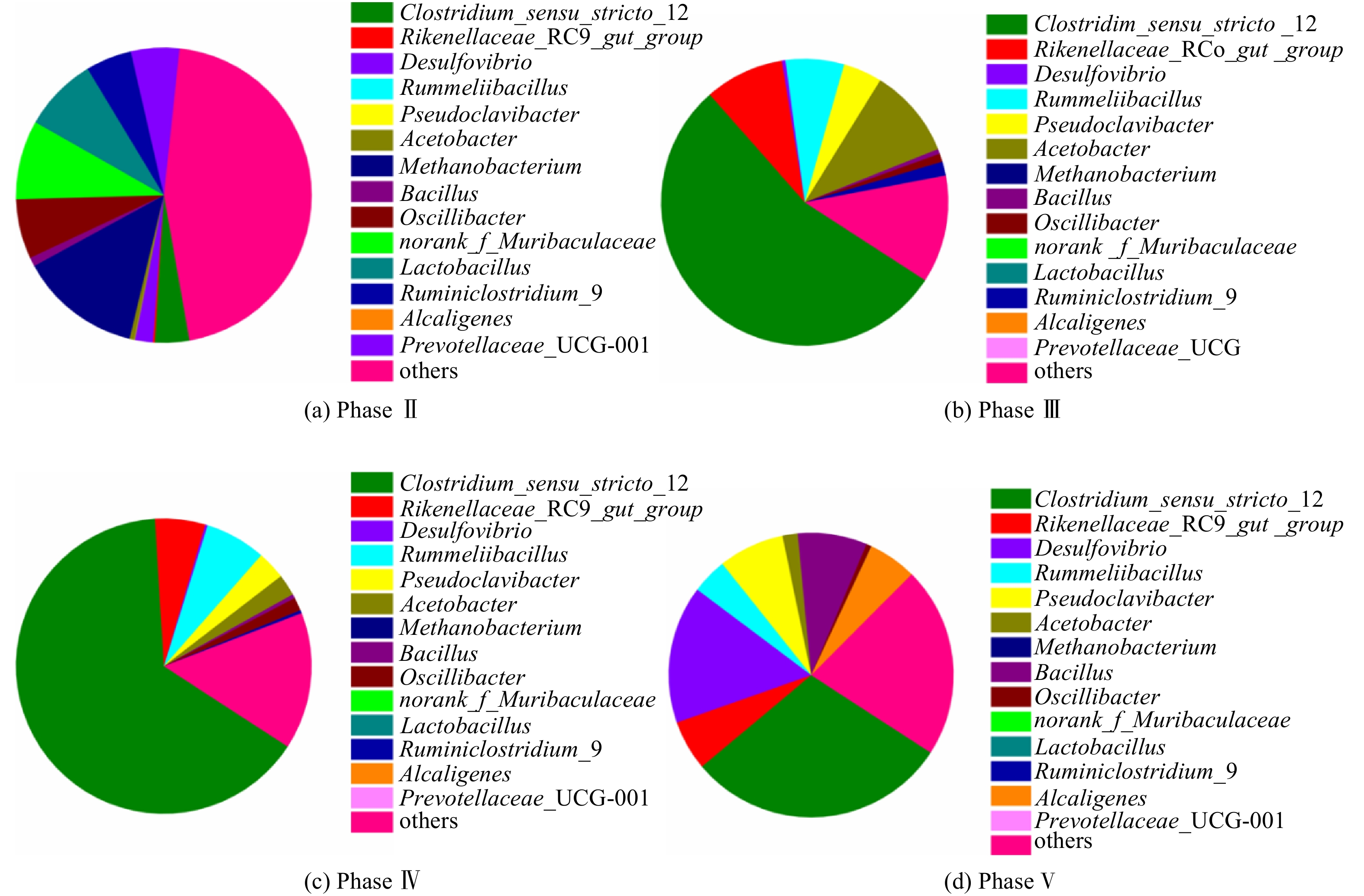
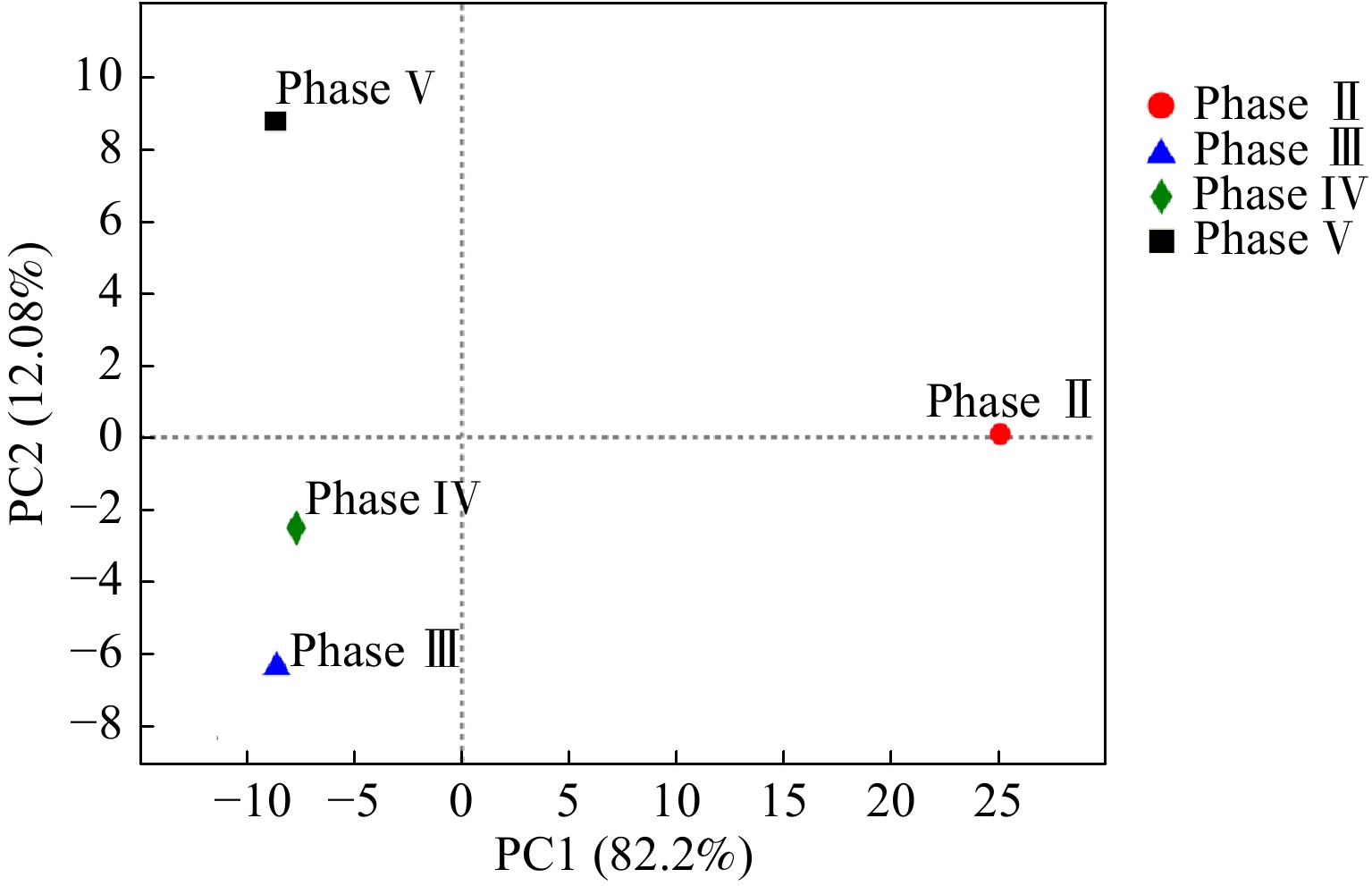
图4展示了反应器不同运行周期的微生物在属水平的菌群多样性结构。Phase II阶段的优势微生物包括甲烷杆菌Methanobacterium、木里菌Muribaculaceae及乳酸杆菌Lactobacillus,其相对丰度分别为13.3%、8.7%和8.2%。其中,Methanobacterium是氢营养型产甲烷古菌,与厌氧发酵细菌共生以克服热力学能量壁垒,将乙醇和VFAs降解代谢为甲烷。有文献报道,Methanobacterium与CE微生物菌群形成的底物竞争关系是导致反应器启动期间MCFAs产率较低的微生物机制[7, 25]。Phase Ⅲ阶段的微生物群落结构较Phase Ⅱ阶段改变明显,狭义梭菌Clostridium sensu stricto_12成为优势菌(相对丰度55.0%),其他优势菌属包括醋杆菌Acetobacter(9.9%)、理研菌科属Rikenellaceae RC9(8.9%)、鲁梅尔芽胞杆菌Rummeliibacillus(6.2%),而Methanobacterium几乎未被检测到(相对丰度<0.1%),故缩短HRT是消除产甲烷古菌底物竞争的有效策略。值得注意的是,根据美国国家生物技术信息中心NCBI数据库的BLAST比对结果分析,Clostridium sensu stricto_12的OTU序列与CE模式微生物Clostridium kluyveri的OTU序列相似度大于99%[5, 26-27],故优势菌Clostridium sensu stricto_12是发酵液中合成MCFAs的核心功能细菌。Phase IV阶段的微生物群落结构与Phase III阶段的相似,Clostridium sensu stricto_12的相对丰度进一步上升至64.9%,但Acetobacter的相对丰度降至2.5%,表明提高醇酸比有利于富集CE微生物Clostridium。由于Phase V阶段的底物为污泥发酵上清液,微生物菌群结构发生了明显变化,尽管此时Clostridium sensu stricto_12仍为优势菌之一,但其相对丰度已降至29.7%。其他相对丰度较高的微生物包括脱硫弧菌Desulfovibrio(15.6%)、伪假苍黄菌Pseudoclavibacter(7.5%)、芽孢杆菌Bacillus(7.8%)。这些微生物未被证明是CE微生物,但广泛存在于市政污水处理厂的活性污泥中,因此,引入污泥发酵液会不可避免地提高这些微生物DNA水平上的相对丰度。DE VRIEZE等[28]发现,相较于DNA水平上的总微生物群落(包括活性与非活性),RNA水平上的微生物群落结构(即活性微生物)能更准确反映厌氧生态体系的状况。微生物属水平的主成分分析(PCA)结果如图5所示,成分因子1(PC1)与成分因子2(PC2)对数据点差异性贡献率之和达到94.28%。从象限分布来看,Phase Ⅲ阶段和Phase Ⅳ阶段的微生物群落结构较为相似,与Phase Ⅱ及Phase Ⅴ阶段的群落结构差异明显。
-
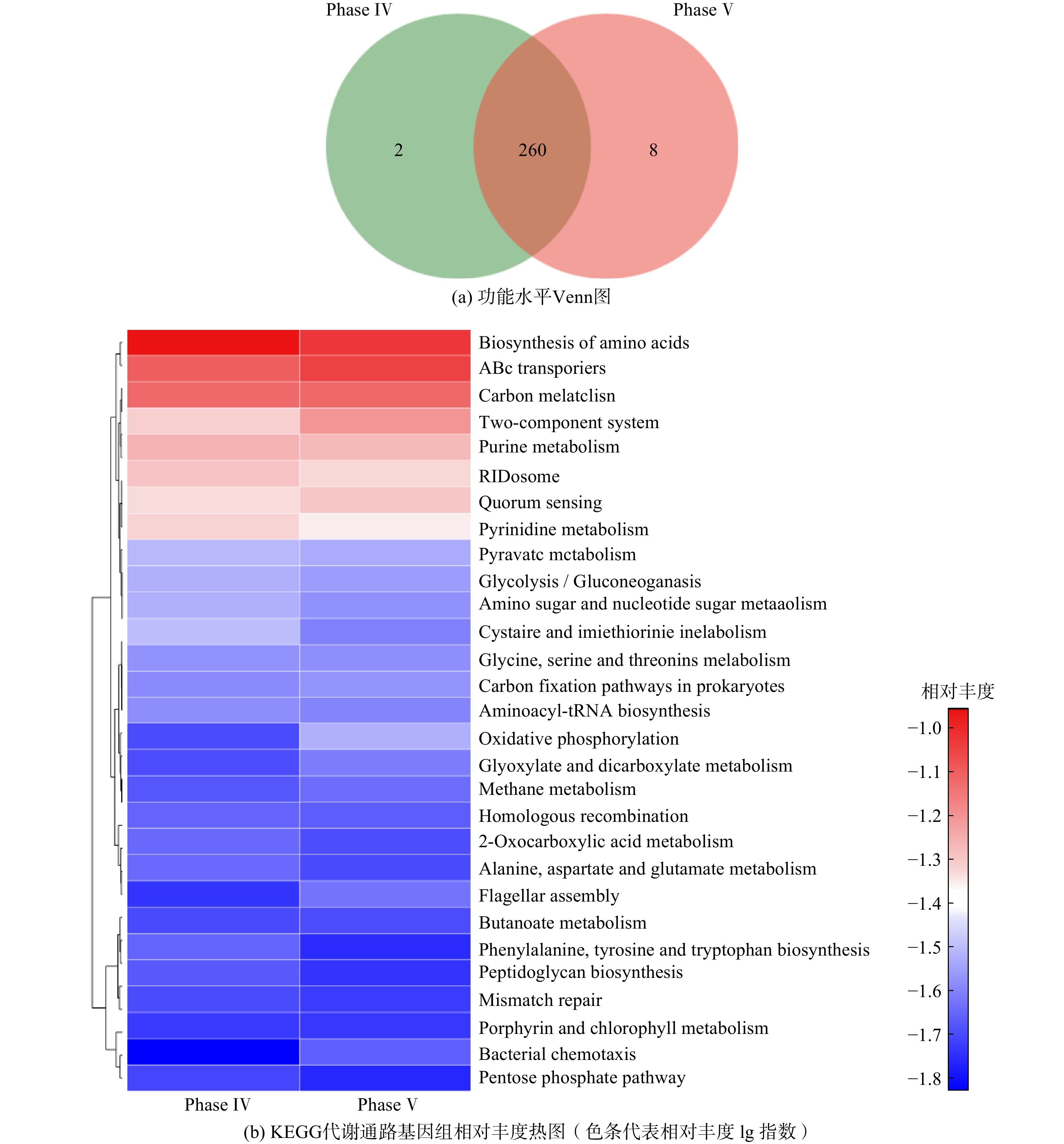
宏基因组分析过程中,Phase Ⅳ和Phase Ⅴ阶段的发酵液样品原始reads数分别为67 758 922 和69 750 096。经数据质控和拼接组装后,ORF的总长度为345 493 103 bp。2组样品在KEGG功能水平上共享代谢通路260个,共享率为97%(见图6(a))。这说明底物由人工培养基替换为污泥厌氧发酵液并未使得微生物种类和功能层面产生明显差异。Phase Ⅳ和Phase Ⅴ阶段的微生物组主要参与氨基酸合成、ABC转运、碳代谢和双组分系统等代谢过程(见图6(b)),但这些代谢过程的基因丰度在这2个周期无明显差异,与Phase Ⅳ和Phase Ⅴ阶段的稳态阶段具有几乎一致的底物利用率和MCFAs产率相吻合。尽管Phase Ⅳ和Phase Ⅴ阶段的微生物结构有一定变化,但体系内相应的功能基因活性却保持稳定,这是前期驯化的结果。另外,丰富的氨基酸合成、ABC转运、碳代谢等代谢过程是微生物复杂新陈代谢的保证,这也从微观角度证实了驯化后的微生物在利用污泥发酵液为底物时仍能保持相当的活性。值得注意的是,双组分系统对微生物适应快速变化的外部环境有积极作用,能实现其调控蛋白和DNA、RNA的结合,最终实现对细胞基因表达的调控[29]。
表4展示了Phase IV和PhaseV阶段微生物组在CE过程代谢通路中关键酶的丰度,包括EC 1.1.1.100(3-氧酰基-[酰载体蛋白]还原酶)、EC 2.3.1.179(β-酮脂酰-[酰载体蛋白]合成酶Ⅱ)、EC 2.3.1.180(β-酮脂酰-[酰载体蛋白]合成酶Ⅲ)、EC 6.3.4.14(生物素羧化酶)及EC 6.4.1.2(乙酰辅酶A羧化酶)。关键酶丰度的变化证实了转化底物后微生物新陈代谢的变化,但从宏观角度而言,进入Phase V阶段后,MCFAs产率并没有随微生物代谢和转录出现波动。事实上,CE过程中发酵体系内多种微生物可能共同具备关键酶,很难将某种特定酶与特定微生物相对应。因此,只要具备转录翻译功能的微生物拥有足够活性,就能够促进合成MCFAs。
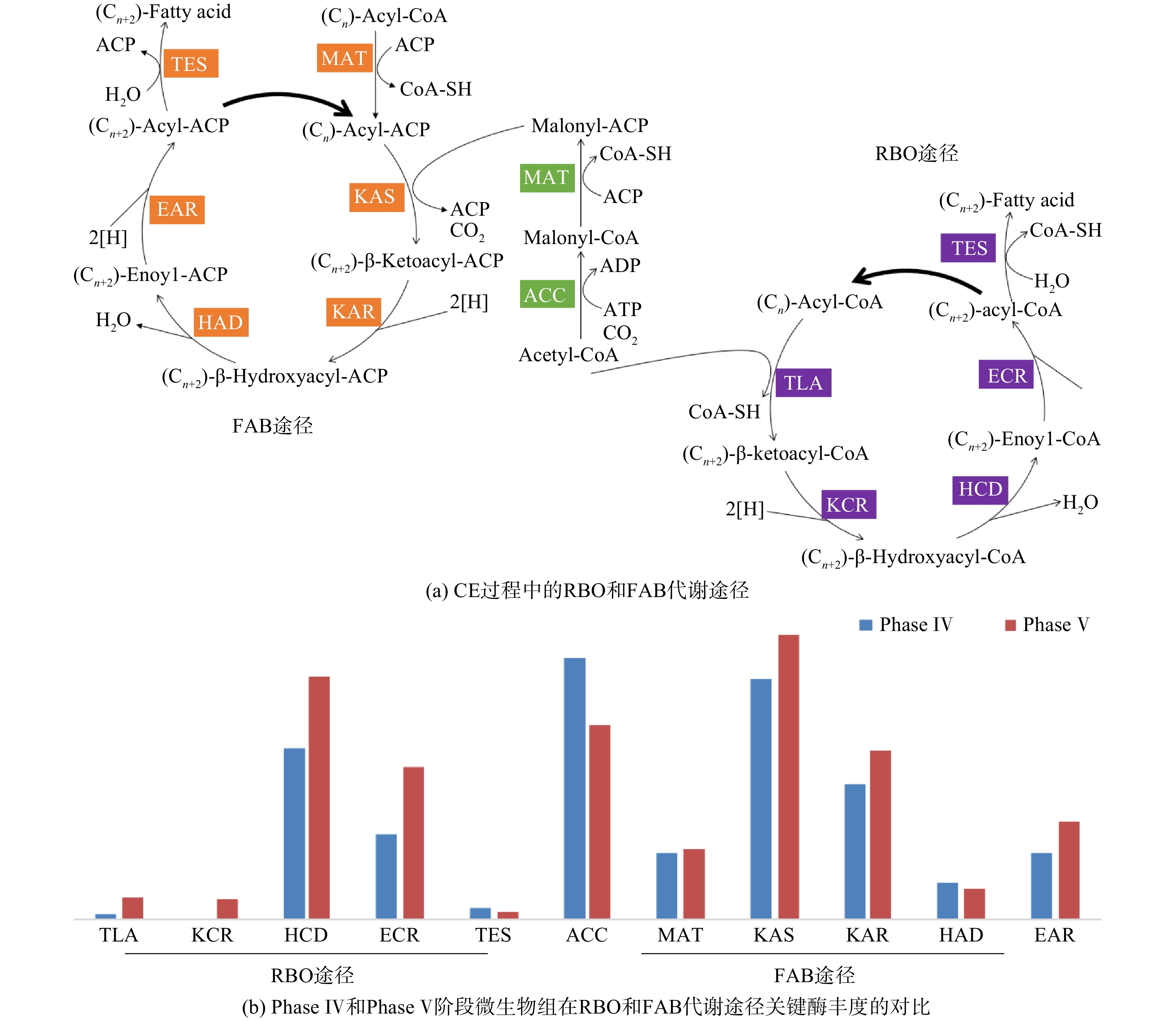
逆向β-氧化过程(reverse β-oxidation,RBO)和脂肪酸合成(fatty acid biosynthesis,FAB)是微生物混菌体系经CE过程合成MCFAs的主要代谢途径(见图7(a))[5, 21]。相较于FAB途径,RBO途径的步骤更少,且ATP净消耗量更小,故可认为RBO更加高效。本研究中RBO和FAB途径所涉及的关键酶均被检出。RBO途径关键酶的总丰度为65 980(Phase Ⅳ)和10 630(Phase Ⅴ),而FAB途径关键酶的总丰度则达到192 904(Phase IV)和202 588(Phase V)。FAB的总丰度高于RBO表明MCFAs可能更多地经由FAB途径合成,这与HAN等[21]的研究结果一致。相较于Phase Ⅳ,Phase Ⅴ的微生物组RBO途径中的TLA、KCR、HCD、ECR酶丰度分别增加了285.0%、814.6%、40.9%、78.9%,仅有TES酶丰度降低28.2%;FAB途径中的MAT、KAS、KAR和EAR酶丰度分别增加了7.6%、18.5%、23.8%和45.6%,而ACC的酶丰度则降低25.3%。上述结果表明,中间产物乙酰辅酶A的后续代谢可能有部分从FAB转入RBO途径(见图7(b))。综上所述,在其他发酵条件(HRT、醇酸比)相同的情况下,以乙醇为电子供体,使用富SCFAs污泥发酵液为电子受体比单独使用乙酸更有利于合成MCFAs。
-
1) 当HRT由20 d优化至5 d,醇酸比保持在2∶1时,发酵体系中Methanobacterium的丰度明显降低,而关键产MCFAs菌Clostridium sensu stricto_12丰度为优势菌种,最大丰度为64.89%。然而,此时体系内堆积大量丁酸,证明通过HRT调整可洗脱污泥内竞争性产甲烷菌,对体系内微生物起到良好的驯化作用,但醇酸比偏低会导致电子供体不足,不能使丁酸进一步延长为己酸。
2) 当HRT为5 d时,将醇酸比由2∶1提升至3∶1后,乙醇作为电子供体促使丁酸进一步转化为己酸,此时己酸产率达到1 400 mg·(L·d)−1。同时,体系内微生物群落结构变化并不明显,说明乙醇含量并未对微生物造成抑制。
3) 将底物由人工配制特定培养基转为热碱预处理污泥发酵液后,丁酸、己酸和辛酸的产率并未发生明显变化。尽管此时Clostridium sensu stricto_12丰度下降,但宏基因组学分析发现,体系内关键代谢通路RBO、FBA关键酶依旧保持较高丰度,说明体系具备一定的抗冲击能力,可连续高效生产MCFAs。
利用富乙酸剩余污泥厌氧发酵液产中链脂肪酸
Conversion of acetate-rich waste activated sludge anaerobic fermentation liquor into medium-chain fatty acids
-
摘要: 为实现剩余污泥的资源化利用,探索了混菌体系中以剩余污泥为底物连续产中链脂肪酸(MCFAs)的可行性。本研究基于乙醇/乙酸人工配制废水,采用热碱水解污泥-短期厌氧发酵-微生物碳链延长(CE)反应的“两相发酵”技术合成MCFAs,并逐步优化水力停留时间(HRT)与底物醇酸比以驯化厌氧污泥微生物。结果表明:在为期135 d的连续模式CE过程中,在醇酸比为2∶1的条件下,驯化期(Phase Ⅰ~Ⅲ)的HRT由20 d逐步缩减至5 d后,典型CE微生物Clostridium sensu stricto_12成为优势菌种,其相对丰度升至65.21%,但己酸产率仅为775 mg∙(L∙d)−1;当醇酸比提高至3∶1 (Phase Ⅳ),己酸产率升至1 402 mg∙(L∙d)−1,MCFAs产物选择性明显提高。将实验期(Phase Ⅴ)系统中的底物置换为污泥厌氧发酵液,己酸产率依然稳定保持在1 400 mg∙(L∙d)−1,表明功能微生物组的结构稳定。宏基因组分析结果显示,逆向β-氧化(RBO)和脂肪酸生物合成(FAB)代谢通路均参与了CE过程的MCFAs合成;另外,相较于乙醇/乙酸人工配制废水,污泥发酵液可提高这2种代谢通路的关键酶丰度。本研究证实了污泥连续发酵产MCFAs的可行性,并阐明了过程中微生物的生态功能机制,可为污泥资源化利用提供参考。Abstract: To determine the feasibility of producing medium-chain fatty acids (MCFAs) from waste activated sludge in mixed culture, this study firstly optimized bioreactor parameters, i.e. hydraulic retention time (HRT) and ethanol : acid ratio, to assimilate anaerobes and later adopted the “two-stage fermentation” strategy, in which alkaline pretreated sludge was subjected to short-term acidogenesis and microbial chain elongation The results showed that during the 135-day chain elongation (CE) over the long term, with ethanol∶acid ratio=2∶1, when HRT was shortened from 20 d to 5 d (Phase Ⅰ~Ⅲ), the CE functional microbe, Clostridium sensu stricto_12, evolved as the dominant genus (relative abundance 65.21%). However, the maximal productivity of n-caproate was merely 775 mg∙(L∙d)−1. Subsequently, with ethanol∶acid ratio increased to 3∶1 (Phase Ⅳ), the productivity of n-caproate boosted to 1 402 mg∙(L∙d)−1, demonstrating an increased product selectivity towards MCFAs. In PhaseⅤ (test phase), during which the substrate swamped from synthetic ethanol/acetate wastewater to sludge fermentation liquor (SFL), the n-caproate productivity maintained at 1 400 mg∙(L∙d)−1. Based on the metagenomics analysis, both reverse β-oxidation (RBO) and fatty acid biosynthesis (FAB) pathways were involved in microbial chain elongation for MCFAs production. Moreover, as compared to synthetic ethanol/acetate wastewater, SFL increased the relative abundance of some key functional enzymes for the RBO and FAB pathways. The present study provided the practical evidence for continuous production of MCFAs from waste activated sludge, and more importantly, it elucidated the microbial and ecological mechanisms. Taken together, it shed a light on the sludge-derived value-added chemicals for its valorization.
-

-
表 1 市政污水处理厂剩余污泥的基本理化性质
Table 1. Characteristics of waste activated sludge from a municipal wastewater treatment plant
pH TS/(g∙L−1) VS/(g∙L−1) COD/(mg∙L−1) SCOD/(mg∙L−1) TKN/(mg∙L−1) TAN/(mg ∙L−1) 6.72±0.05 29.66±0.60 18.63±0.38 21 100±420 346±46 2 560±94 12.4±1.5 表 2 不同运行周期的反应器运行条件
Table 2. Operational conditions of different phases of bioreactor for chain elongation
运行周期 HRT/d 醇酸比 运行时间/d Phase Ⅰ 20 2∶1 0~20 Phase Ⅱ 10 2∶1 21~50 Phase Ⅲ 5 2∶1 51~90 Phase Ⅳ 5 3∶1 91~120 Phase Ⅴ 5 3∶1 121~135 表 3 驯化期不同运行条件下的总烷基量、平均碳链长度与碳效率
Table 3. Total alkyl groups, average chain length and carbon conversion efficiency of microbial chain elongation process under different operational conditions during the acclimation period
运行周期 总烷基量/(mmol·L−1) 平均碳链长度 碳效率/% Phase Ⅰ 291.8 6.82 33.4 Phase Ⅱ 543.4 6.83 62.1 Phase Ⅲ 507 5.63 72.9 Phase Ⅳ 535.6 6.51 64.8 表 4 碳链延长(CE)过程涉及到的关键酶及其在Phase Ⅳ和Phase Ⅴ阶段微生物组中的丰度
Table 4. Key enzymes involved in chain elongation pathways and their abundance in Phase Ⅳ and Ⅴ
关键酶的名称 缩写 EC# 功能描述 不同周期酶丰度 Phase Ⅳ Phase Ⅴ Thiolase TLA 2.3.1.16 Acetyl-CoA C-acyltransferase 1 356 5 220 Ketoacycl-CoA reductase KCR 1.1.1.36 Acetyl-CoA reductase 536 4 902 Hydroxyacyl-CoA dehydratase HCD 1.1.1.157 3-hydroxybutyryl-CoA dehydrogenase 19 452 16 412 1.1.1.35 3-hydroxyacyl-CoA dehydrogenase 5 686 15 354 2.3.1.16 Acetyl-CoA C-acyltransferase 1 356 5 220 4.2.1.17 Enoyl-CoA hydratase 13 918 15 978 Enoyl-CoA reductase ECR 5.1.2.3 3-hydroxybutyryl-CoA epimerase 666 4 922 Thioesterase TES 3.1.2.23 4-hydroxybenzoyl-CoA thioesterase 2 740 1 968 Acetyl-CoA carboxylase ACC 6.3.4.14 Biotin carboxylase 21 802 12 782 6.4.1.2 Acetyl-CoA carboxylase 40 616 33 858 Malonyltransferase MAT 2.3.1.39 [acyl-carrier-protein]S-
malonyltransferase15 826 17 026 Ketoacyl-ACP synthase KAS 2.3.1.41 β-ketoacyl-[acyl-carrier-protein] synthase Ⅰ 5 360 11 046 2.3.1.179 β-ketoacyl-[acyl-carrier-protein] synthase Ⅱ 20 000 26 892 2.3.1.180 β-ketoacyl-[acyl-carrier-protein] synthase Ⅲ 32 110 30 154 Ketoacyl-ACP reductase KAR 1.1.1.100 3-oxoacyl-[acyl-carrier-protein] reductase 32 462 40 198 Hydroxyacyl-ACP dehydratase HAD 4.2.1.59 3-hydroxyacyl-[acyl-carrier-protein] dehydratase 8 812 7 466 Enoyl-ACP reductase EAR 1.3.1.9 enoyl-[acyl-carrier-protein] reductase (NADH) 14 468 16 656 1.3.1.10 enoyl-[acyl-carrier-protein] reductase (NADPH, Si-specified) 1 448 6 510 -
[1] MEERBURG F A, BOON N, VAN WINCKEL T, et al. Optimizing retention times in high-rate contact stabilization for maximal recovery of organics from wastewater[J]. Environmental Science & Technology, 2016, 50(17): 9781-9790. [2] ALLOUL A, GANIGUE R, SPILLER M, et al. A three-step approach for the valorization of sewage organics as commodities[J]. Environmental Science & Technology, 2018, 52(12): 6729-6742. [3] ANGENENT L T, USACK J G, XU J, et al. Integrating electrochemical, biological, physical, and thermochemical process units to expand the applicability of anaerobic digestion[J]. Bioresource Technology, 2018, 247(9): 1085-1094. [4] CAGNETTA C, COMA M, VLAEMINCK S E, et al. Production of carboxylates from high rate activated sludge through fermentation[J]. Bioresource Technology, 2016, 217(3): 165-172. [5] ANGENENT L T, RICHTER H, BUCKEL W, et al. Chain elongation with reactor microbiomes: open-culture biotechnology to produce biochemicals[J]. Environmental Science & Technology, 2016, 50(6): 2796-2810. [6] AGLER M T, SPIRITO C M, USACK J G, et al. Chain elongation with reactor microbiomes: Upgrading dilute ethanol to medium-chain carboxylates[J]. Energy & Environmental Science, 2012, 5(8): 8189-8192. [7] GE S J, USACK J G, SPIRITO C M, et al. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction[J]. Environmental Science & Technology, 2015, 49(13): 8012-8021. [8] KUCEK L A, XU J J, NGUYEN M, et al. Waste conversion into n-caprylate and n-caproate: Resource recovery from wine lees using anaerobic reactor microbiomes and in-line extraction[J]. Frontiers In Microbiology, 2016, 7: 1892. [9] VASUDEVAN D, RICHTER H, ANGENENT L T. Upgrading dilute ethanol from syngas fermentation to n-caproate with reactor microbiomes[J]. Bioresource Technology, 2014, 151(9): 378-382. [10] RICHTER H, MOLITOR B, DIENDER M, et al. A narrow pH range supports butanol, hexanol, and octanol production from syngas in a continuous co-culture of Clostridium ljungdahlii and Clostridium kluyveri with in-line product extraction[J]. Frontiers in Microbiology, 2016, 7: 1773. [11] LIU C, LUO G, LIU H P, et al. CO as electron donor for efficient medium chain carboxylate production by chain elongation: Microbial and thermodynamic insights[J]. Chemical Engineering Journal, 2020, 390: 124577. doi: 10.1016/j.cej.2020.124577 [12] LI X, CHEN Y G, ZHAO S, et al. Efficient production of optically pure L-lactic acid from food waste at ambient temperature by regulating key enzyme activity[J]. Water Research, 2015, 70(11): 148-157. [13] XU J J, HAO J X, GUZMAN J J L, et al. Temperature-phased conversion of acid whey waste into medium-chain carboxylic acids via lactic acid: No external e-donor[J]. Joule, 2018, 2(2): 280-295. doi: 10.1016/j.joule.2017.11.008 [14] LE C C, STUCKEY D C. Colorimetric measurement of carbohydrates in biological wastewater treatment systems: A critical evaluation[J]. Water Research, 2016, 94: 280-287. doi: 10.1016/j.watres.2016.03.008 [15] LE C C, KUNACHEVA C, STUCKEY D C. "Protein" measurement in biological wastewater treatment systems: A critical evaluation[J]. Environmental Science & Technology, 2016, 50(6): 3074-3081. [16] LÜ C X, SHEN Y W, LI C, et al. Redox-active biochar and conductive graphite stimulate methanogenic metabolism in anaerobic digestion of waste-activated sludge: Beyond direct interspecies electron transfer[J]. Sustainable Chemistry & Engineering, 2020, 8(33): 12626-12636. [17] LIU Y H, LÜ F, SHAO L M. Alcohol-to-acid ratio and substrate concentration affect product structure in chain elongation reactions initiated by unacclimatized inoculum[J]. Bioresource Technology, 2016, 218: 1140-1150. doi: 10.1016/j.biortech.2016.07.067 [18] LONKAR S, FU Z H, HOLTZAPPLE M. Optimum alcohol concentration for chain elongation in mixed-culture fermentation of cellulosic substrate[J]. Biotechnology and Bioengineering, 2016, 113(12): 2597-2604. doi: 10.1002/bit.26024 [19] STEINBUSCH K J J, HAMELERS H V M, PLUGGE C M, et al. Biological formation of caproate and caprylate from acetate: Fuel and chemical production from low grade biomass[J]. Energy & Environmental Science, 2011, 4(1): 216-224. [20] WU S L, WEI W, SUN J, et al. Medium-chain fatty acids and long-chain alcohols production from waste activated sludge via two-stage anaerobic fermentation[J]. Water Research, 2020, 186: 116381. doi: 10.1016/j.watres.2020.116381 [21] HAN W H, HE P J, SHAO L M, et al. Metabolic interactions of a chain elongation microbiome[J]. Applied and Environmental Microbiology, 2018, 84(22): 01614-01618. [22] GROOTSCHOLTEN T I, STEINBUSCH K J, HAMELERS H V, et al. High rate heptanoate production from propionate and ethanol using chain elongation[J]. Bioresource Technology, 2013, 136: 715-718. doi: 10.1016/j.biortech.2013.02.085 [23] GANIGUE R, NAERT P, CANDRY P, et al. Fruity flavors from waste: A novel process to upgrade crude glycerol to ethyl valerate[J]. Bioresource Technology, 2019, 289: 121574. doi: 10.1016/j.biortech.2019.121574 [24] CANDRY P, ULCAR B, PETROGNANI C, et al. Ethanol: Propionate ratio drives product selectivity in odd-chain elongation with Clostridium kluyveri and mixed communities[J]. Bioresource Technology, 2020, 313: 123651. doi: 10.1016/j.biortech.2020.123651 [25] AGLER M T, SPIRITO C M, USACK J G, et al. Development of a highly specific and productive process for n-caproic acid production: Applying lessons from methanogenic microbiomes[J]. Water Science and Technology, 2014, 69(1): 62-68. doi: 10.2166/wst.2013.549 [26] SEEDORF H, FRICKE W F, VEITH B, et al. The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(6): 2128-2133. doi: 10.1073/pnas.0711093105 [27] WU S L, SUN J, CHEN X M, et al. Unveiling the mechanisms of medium-chain fatty acid production from waste activated sludge alkaline fermentation liquor through physiological, thermodynamic and metagenomic investigations[J]. Water Research, 2020, 169: 115218. doi: 10.1016/j.watres.2019.115218 [28] DE VRIEZE J, REGUEIRO L, PROPS R, et al. Presence does not imply activity: DNA and RNA patterns differ in response to salt perturbation in anaerobic digestion[J]. Biotechnology for Biofuels, 2016, 9: 244. doi: 10.1186/s13068-016-0652-5 [29] 李雷, 卫科科, 姜卫红, 等. 细菌双组分系统应答调控蛋白调控策略的多样性[J]. 中国科学:生命科学, 2017, 47(5): 462-469. -



 下载:
下载: