-
溴酸盐(
${\rm{BrO}}_3^ - $ )是含溴离子(Br−)水体在臭氧或氯气消毒过程中生成的一种消毒副产物 [1]。在经臭氧消毒的饮用水中检测到BrO3−的质量浓度可达到120 μg·L−1[2]。${\rm{BrO}}_3^ - $ 具有较强的DNA损伤能力,可引起肾肿瘤和腹膜间皮瘤等疾病[3]。因此,世界卫生组织(WHO)规定饮用水中${\rm{BrO}}_3^ - $ 质量浓度应低于10 μg·L−1。目前,很多技术被应用于水体中${\rm{BrO}}_3^ - $ 的去除,包括生物修复[4-5]、化学/催化还原[6-7]、光催化还原[8]、物理分离[9]等。然而这些技术存在二次污染、运行和维护成本高以及操作复杂等缺点。近年来,电化学还原技术因其反应速度快、无污染、操作便捷等优点,在控制水体中BrO3−污染方面已有较多应用[10]。在电化学还原
${\rm{BrO}}_3^ - $ 体系中,阴极材料处于“心脏”地位,是实现高效率和低能耗去除BrO3−的关键。常用的电极材料有贵金属基(Pd、Ir、Pt等)[11-13]和非贵金属基(Fe、Cu等)[6,14]两大类。MAO等采用氧化还原石墨烯修饰碳纸负载钯纳米颗粒阴极(Pd-rGO/C),并耦合活性炭负载钯(Pd/GAC)颗粒电极,在恒定电流条件下可将${\rm{BrO}}_3^ - $ 还原成为Br−离子[12]。然而贵金属价格昂贵,目前对其研究仅仅停留在实验室阶段。因此,开发具有高活性且廉价的非贵金属基电极材料已受到更广泛的关注。${\rm{BrO}}_3^ - $ 的电化学还原包括2种作用,即电子的直接还原和活性氢(H*)介导的间接还原[13]。泡沫钴(cobalt foam, CF)由于成本低廉、比表面积大、稳定性高等优点,被认为是优良的电极材料[15]。但CF电子传递速率差和催化产生H*的活性较低,导致其电化学还原${\rm{BrO}}_3^ - $ 的性能较差。因此,能否在保留CF自身优点的基础上提升其催化产生H*的性能和电子传递速率是一个值得研究的课题。磷化钴(CoP)具有独特的电子结构,不仅可以作为电子媒介促进电子传递,还能作为催化剂电催化产生H*[16-18]。LIU等在以CoP作为阴极开展氟苯尼考电化学脱卤的研究中发现CoP确实能促进电子传递和H*的形成[16]。受上述结果启发,将CoP与CF结合有望得到一种活性高和稳定性佳的复合电极。通常,研究者会利用聚偏氟乙二烯、聚四氟乙烯等高分子化合物粘结剂将催化剂负载于电极表面,但粘结剂的使用会严重影响活性物质的催化性能和电极的稳定性[19-20]。为此,无粘结剂的催化剂和电极耦合技术是制备复合电极的热门方法[21-23]。本研究以CF作为基底,通过原位生长制备CoP与CF耦合自支撑电极(CoP/CF),该电极不使用粘结剂,增加了电子传递速率和电催化产H*性能,具备较好的电还原
${\rm{BrO}}_3^ - $ 性能。本研究通过优化电极制备条件,调控其还原${\rm{BrO}}_3^ - $ 性能,并探讨其机制,以期为电催化还原${\rm{BrO}}_3^ - $ 提供参考。 -
溴酸钠(NaBrO3)、硫酸钠(Na2SO4)、丙酮(CH3COCH3)、无水乙醇、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、磷酸二氢钠(NaH2PO4)等药剂均从国药集团化学试剂有限公司购买,药品均为分析纯且在使用前未经任何前处理。泡沫钴(CF)从北京鹏达科技有限公司采购,其面密度为600 g·m2,孔径为450 μm,厚度约0.5 mm。
-
CoP/CF自支撑电极以CF作为钴源和载体,以NaH2PO4作为磷源,通过高温原位一步磷化法制备。具体方法:取一小片有效面积为5 cm2 (5 cm ×1 cm)的CF,用乙醇、盐酸(1 mol·L−1)、丙酮以及超纯水依次清洗数次去除其表面的杂质,在鼓风干燥箱中60 ℃烘干12 h。将 0.5 g NaH2PO4、CF、0.5 g NaH2PO4依次按照5 cm的间距排列后,N2氛围保护下在管式炉(OTF-1200X, HF-Kejing, China)中进行高温磷化(300~450 ℃),并将在300、350、400和450 ℃下制备的复合电极分别记作CoP/CF-300、CoP/CF-350、CoP/CF-400和CoP/CF-450。
-
电化学还原BrO3−实验均在直流电源(ATTEN, PPS3005T-3S, China)提供的恒定电流下开展(电流密度2.5~10 mA·cm−2),槽压为~18.0 V,50 mM Na2SO4为电解质,
${\rm{BrO}}_3^ - $ 为目标污染物,反应温度为室温(20±5) ℃。电化学反应器是采用质子交换膜(Nafion 117, Dupont, USA)隔开的双室电解池,阴极和阳极室的有效容积均为100 mL。其中,阴极采用CoP/CF自支撑电极,阳极为同等面积的Ir-Ru/Ti电极。电化学反应过程中使用磁力搅拌器将溶液混匀(600 r·min−1),每间隔12 min从阴极室取样2 mL用于检测溶液中${\rm{BrO}}_3^ - $ 和Br−的浓度。 -
溶液中
${\rm{BrO}}_3^ - $ 和Br−采用离子色谱仪(ICS-900, Dionex, USA)进行检测。检测使用的分析柱为IonPac® AS 23 4 mm×250 mm,检测器为电导型检测器(ASRS 300 4 mm),保护柱为IonPac® AG 23 4 mm×50 mm、抑制器型号DZS1106397,进样体积为500 μL。淋洗液为碳酸盐混合溶液(9.4 mmol·L−1 Na2CO3和1.8 mmol·L−1 NaHCO3),流动速度为1 mL·min−1,抑制器施加的电流为40 mA,${\rm{BrO}}_3^ - $ 的最低检测限为1 μg·L−1。电极中的Co和P的价态采用X-射线光电子能谱仪(XPS, Escalab 250Xi, Thermol scientific, USA)对Co 2p和P 2p进行分析;电极的表面形貌和形态利用扫描电子显微镜(SEM, FEI QuANTA 200 CZ, Netherlands)进行观察;晶体结构采用X射线衍射(XRD, Ultima IV, Rigaku, Japan)进行分析,以JCPDS (Joint Committee on Powder diffraction Standards) 数据库为参考,采用MDI (MDI) Jade 5.0对衍射峰和晶相进行分析。
电化学阻抗谱(EIS)奈奎斯特图中弧半径大小可以表示电解过程中电极表面电子传输速率的快慢[24]。本研究采用特定大小的CoP/CF(1 cm2)为工作电极在电化学工作站(辰华CHI7760E,中国上海)上利用三电极体系进行EIS图谱和循环伏安曲线(CV)分析,其中EIS的扫描频率为105~10−2 Hz,对电极为Pt片,参比电极是Ag/AgCl。CV的扫描范围为−1.2~0 V(以Ag/AgCl为参比电极)。
${\rm{BrO}}_3^ - $ 的去除率根据式(1)进行计算;电化学还原${\rm{BrO}}_3^ - $ 的过程利用准一级动力学模型进行分析,动力学方程如式(2)所示;去除每毫克${\rm{BrO}}_3^ - $ 需要消耗的电能根据式(3)进行计算。式中:R为
${\rm{BrO}}_3^ - $ 的去除率,%;Ct和C0是指不同反应时间下电解液中${\rm{BrO}}_3^ - $ 质量浓度,μg·L−1;k为电化学去除${\rm{BrO}}_3^ - $ 的速率常数,min−1;U为系统运行的平均电压,V;I为电流,mA;m为${\rm{BrO}}_3^ - $ 的去除量,μg;t为运行时间,min。 -
本研究以NaH2PO4为磷源,在高温下将CF直接磷化合成CoP/CF自支撑电极。在此过程中CF不仅作为CoP的Co源,还作为CoP的载体或支撑体。显然,这种原位生长方式在不使用粘合剂的条件下可实现CoP和CF的紧密接触,提高了电化学氧化还原反应中的电子转移速率,从而改善了电极的电化学性能[15]。如图1(a)和图1(b)所示,原始CF具有多孔骨架结构且表面光滑。高温磷化后的CF保持了其原有的宏观结构,但在其表面生长出了均匀的纳米颗粒(图1(c)和图1(d))。该变化可能是由于高温下CF表面发生结构塌陷和再固结形成CoP所致[25]。
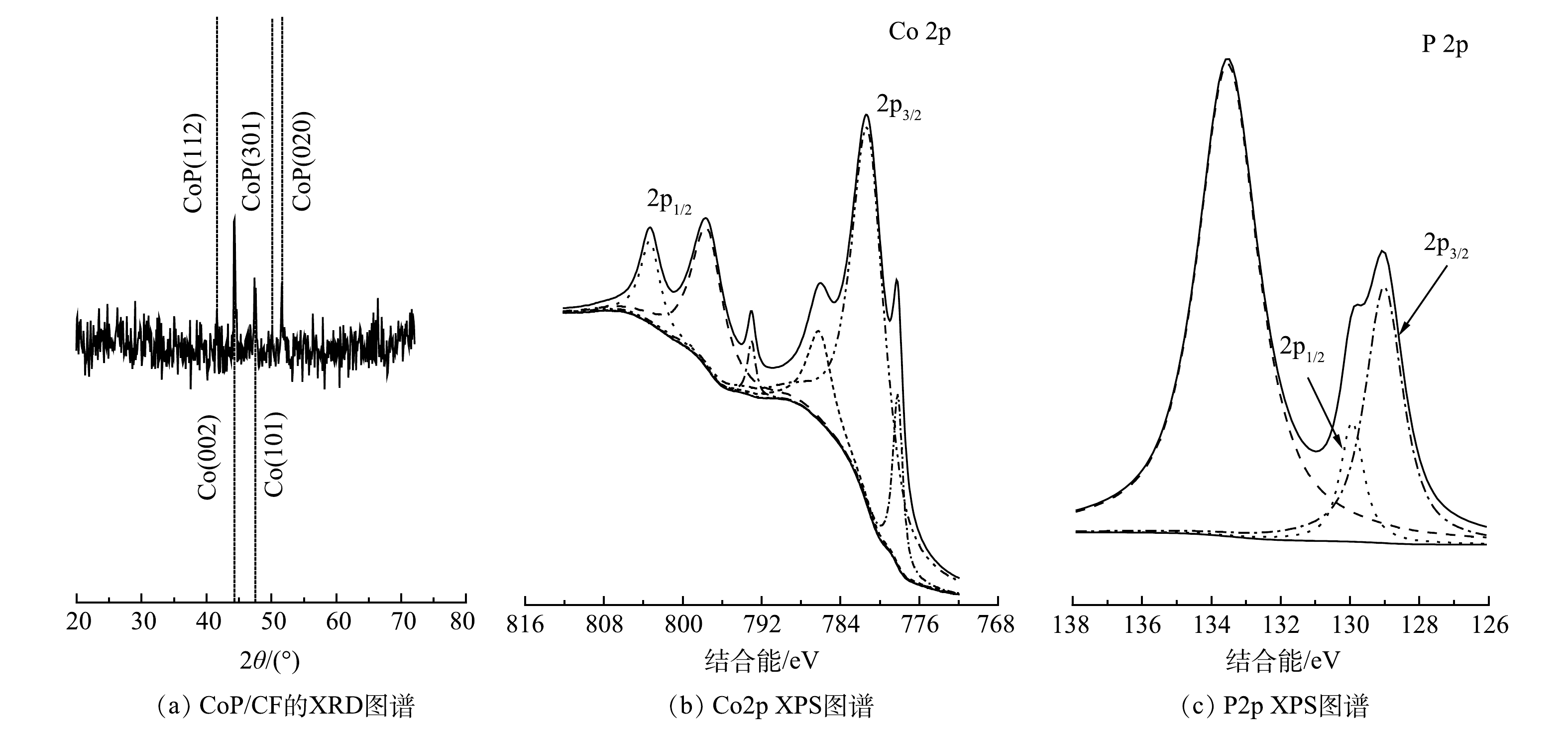
为了证明CoP成功地原位生长在CF表面,利用X射线衍射(XRD)对CoP/CF自支撑电极表面的晶相和主要物质成分进行分析(图2(a))。在CoP/CF的XRD图谱中,在衍射角为44.51°和47.37°处有2个明显的衍射峰,这2个峰与金属钴的标准特征峰的位置一致,分别对应钴的(002)和(101)晶面(JCPDS 89-7373)。此外,在衍射角为40.81°、50.27°和51.4°处观察到3个峰,分别对应CoP的(112)、(301)和(020)晶面(JCPDS 65-2380)。上述结果证明,经过高温磷化后CoP纳米颗粒成功地原位生长在CF表面,CoP/CF自支撑电极制备成功。
为了进一步分析电极的表面元素组成及相应的价态,采用X射线光电子能谱(XPS)对CoP/CF进行了表征,结果如图2(b)和图2(c)所示。Co2p图谱中结合能为793.0 eV和778.1 eV处对应金属钴的特征峰。此外,结合能为781.2 eV和797.5 eV以及位于786.1 eV和803.3 eV的2个肩峰分别对应钴的氧化物[15]。从P2p的图谱中可以看出,结合能在129.5 eV和130.3 eV处的峰对应磷化物[26-27]。而位于134.1 eV的峰对应的是磷的氧化物。钴和磷的氧化物的出现主要是材料在制备过程中被空气氧化所致。上述结果进一步证明:高温磷化的方法能够直接将CoP原位生长在CF的表面,从而获得CoP/CF自支撑电极。虽然在电极表面不可避免的存在少量磷和钴的氧化物,但不影响自支撑电极的结构和组成。
-
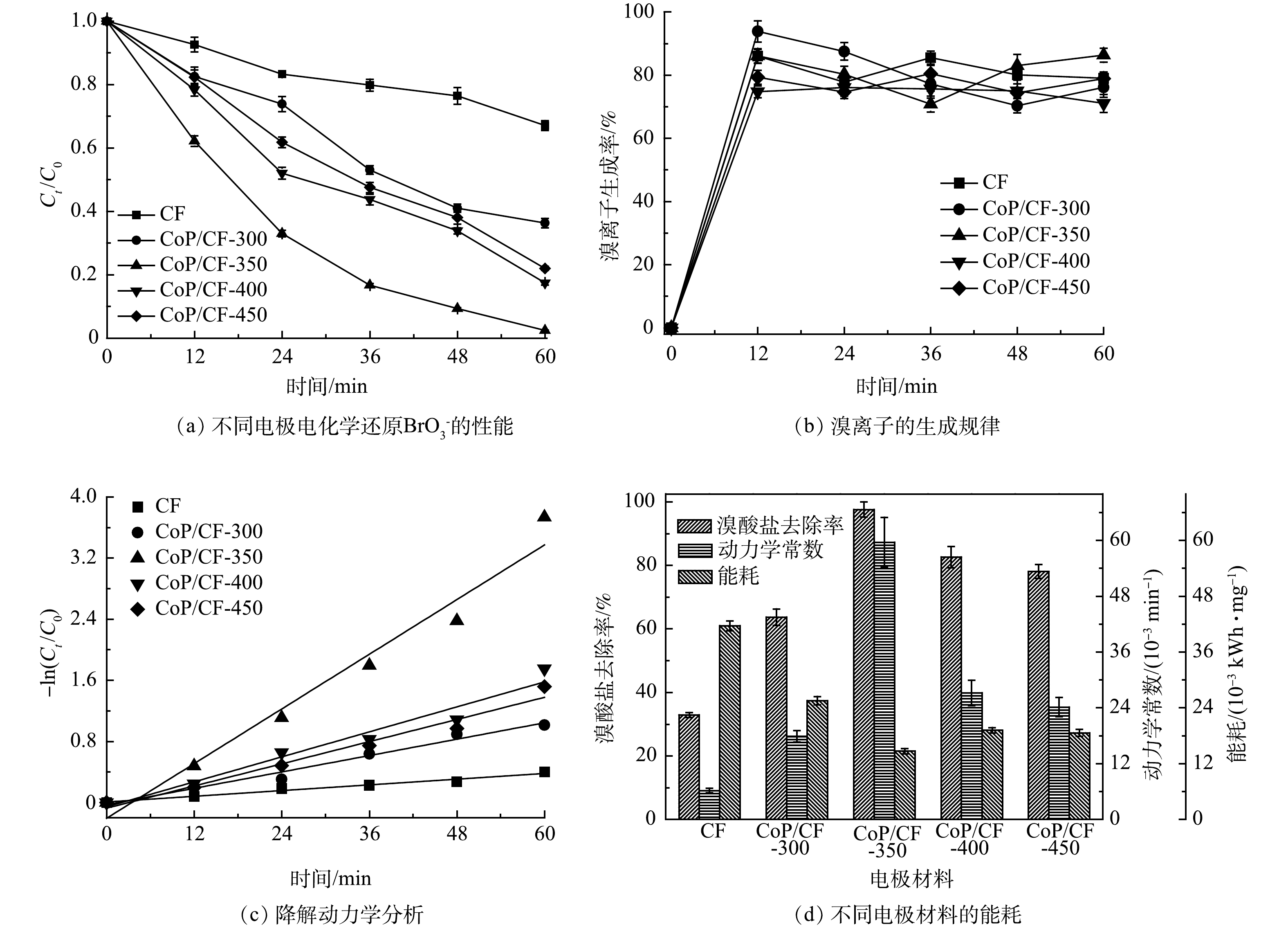
在本研究中,CoP/CF自支撑电极的理化和电化学特性主要受制备的磷化温度所影响。为优化制备条件,本研究使用在不同温度下(300~450 ℃)得到的CoP/CF自支撑电极作为阴极开展电化学还原
${\rm{BrO}}_3^ - $ 的实验,结果如图3所示。不同磷化温度下制备的自支撑电极均表现出较好的电化学还原${\rm{BrO}}_3^ - $ 的活性。其中CoP/CF-350电催化性能最佳,${\rm{BrO}}_3^ - $ 去除率(R)和降解动力学常数(k)分别达到97.6%和0.059 min−1;相比之下,CF电极电化学还原${\rm{BrO}}_3^ - $ 的性能最差,相应的R和k分别仅有32.9%和0.006 min−1。有研究[16]表明,CoP在电化学反应过程中不仅可以作为电子传递媒介或桥梁促进电子传递,还能作为催化剂电催化还原H+产生H*。H*作为一种强还原物质可以将
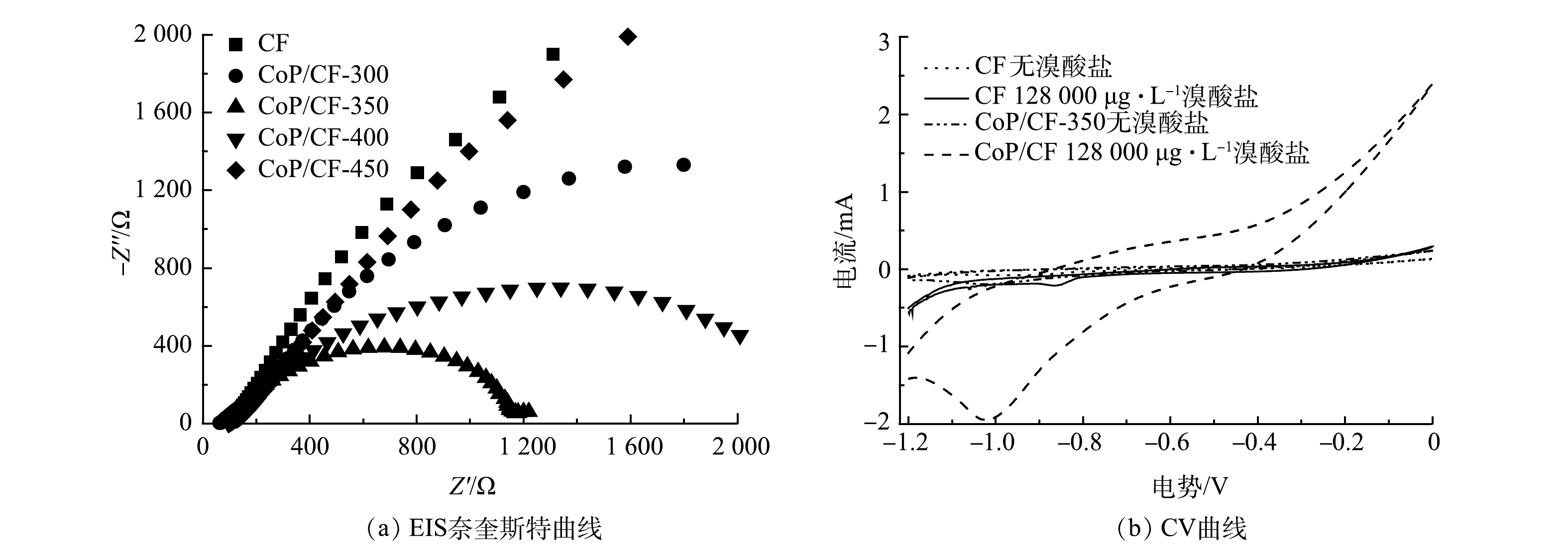
${\rm{BrO}}_3^ - $ 通过加氢还原为Br−[12]。电化学阻抗谱(EIS)奈奎斯特图中弧半径大小可以表示电解过程中电极表面电子传输速率的快慢[24]。由图4(a)可以看出,CF磷化之后具有了较快的电子传递速率和还原${\rm{BrO}}_3^ - $ 的活性。因此,在CF表面原位生长CoP有利于${\rm{BrO}}_3^ - $ 的电化学还原。此外,当温度为300 ℃时,CF表面只有小部分的钴被磷化成CoP,${\rm{BrO}}_3^ - $ 去除率和k分别只有63.7%和0.017 min−1;当磷化温度达到450 ℃时,尽管CF电极表面CoP含量有所增加,但其电子传递速率却相对于CoP/CF-300、CoP/CF-350和CoP/CF-400降低,${\rm{BrO}}_3^ - $ 去除率和k分别仅为78.0%和0.024 min−1。因此,在适中的磷化温度(350 ℃)下得到的CoP/CF-350电极具有较高电化学还原活性。 -
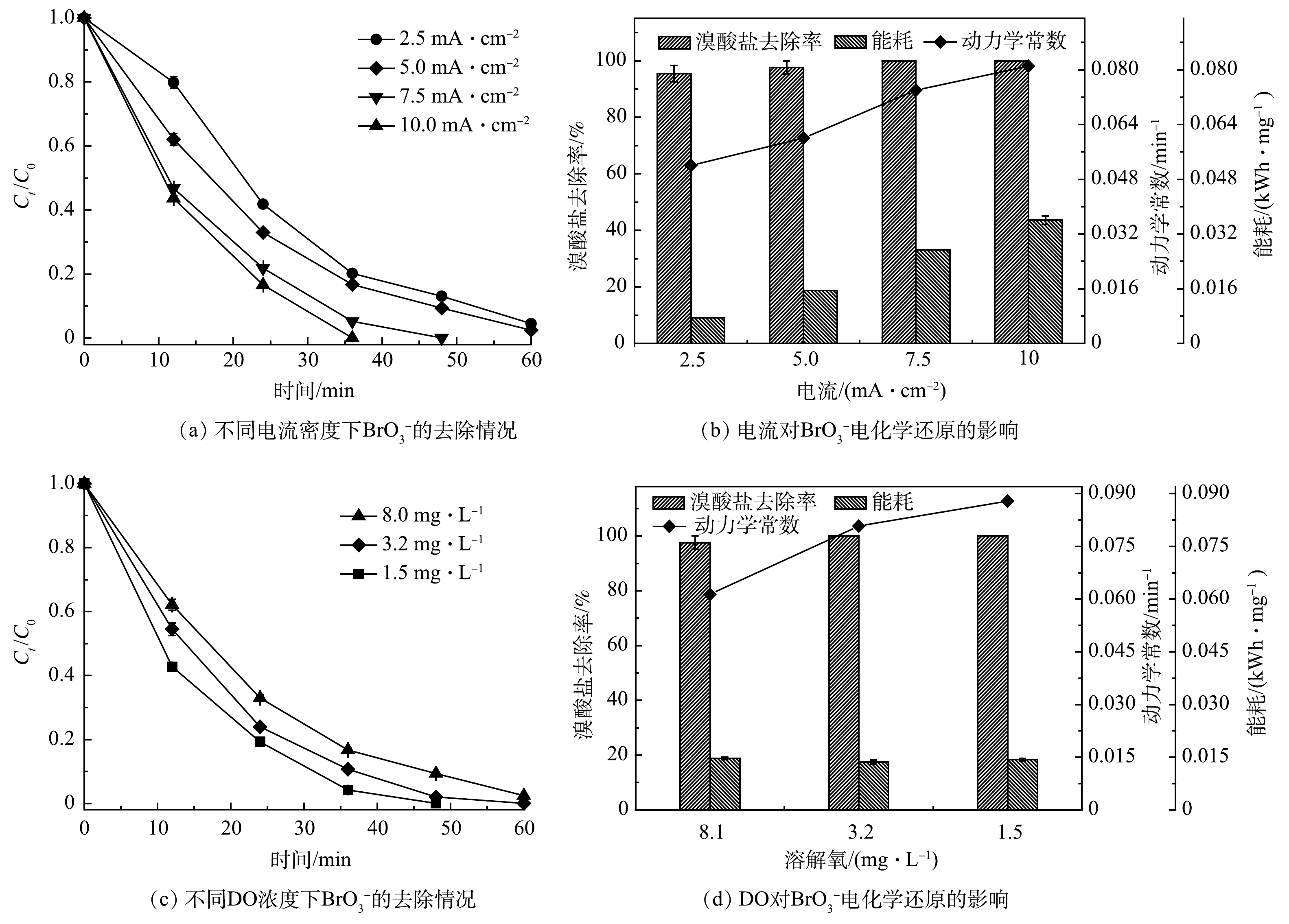
本研究中,电化学还原
${\rm{BrO}}_3^ - $ 是在恒定电流下开展的,故电流密度对于电化学系统的影响至关重要。不同电流密度(2.5、5.0、7.5和10.0 mA·cm−2)下CoP/CF-350电化学还原${\rm{BrO}}_3^ - $ 的效果如图5(a)和图5(b)所示。当CoP/CF-350电极表面的电流密度由2.5 mA·cm−2增加到10.0 mA·cm−2时,系统中${\rm{BrO}}_3^ - $ 去除率由95.2%增加到100%,相应的降解动力学常数k也由0.052 min−1增加到0.081 min−1。电流密度越高,产生的电子越多,进而导致更高的去除效率和更快的降解速率。然而,相应的去除${\rm{BrO}}_3^ - $ 的所需电能却从0.007 kWh·mg−1上升到0.036 kWh·mg−1。这是由于在高的电流密度下水被电解,从而浪费的电能也相应地增加。值得注意的是,虽然在电流密度为2.5 mA·cm−2和5.0 mA·cm−2时,系统对于${\rm{BrO}}_3^ - $ 去除率差别不大,但当电流密度为2.5 mA·cm−2时,系统出水中BrO3−质量浓度约为12 μg·L−1,该值大于WHO规定的10 μg·L−1限值。因此,综合考虑系统对${\rm{BrO}}_3^ - $ 的去除率和能耗,5.0 mA·cm−2是CoP/CF-350电极电化学还原${\rm{BrO}}_3^ - $ 的最佳值。 -
在电化学反应过程中,溶液中溶解氧(DO)会与
${\rm{BrO}}_3^ - $ 竞争电子,从而影响${\rm{BrO}}_3^ - $ 的去除效率[10]。不同初始DO浓度对CoP/CF-350电极电化学还原${\rm{BrO}}_3^ - $ 的影响如图5(c)和图5(d)所示。当初始DO质量浓度由1.5 mg·L−1增加到8.0 mg·L−1时,${\rm{BrO}}_3^ - $ 的去除率由100%略微下降到97.6%。此外,去除${\rm{BrO}}_3^ - $ 需要的电能没有明显变化(0.013~0.014 kWh·mg−1)。值得注意的是,${\rm{BrO}}_3^ - $ 的去除速率由0.086 min−1降至0.059 min−1,下降了31.3%。这是由于DO在反应过程中与${\rm{BrO}}_3^ - $ 争夺电子,从而导致${\rm{BrO}}_3^ - $ 的去除速率下降。综上所述,CoP/CF自支撑电极可以在较广的DO范围内开展电催化还原${\rm{BrO}}_3^ - $ ,但较低的DO更有利于${\rm{BrO}}_3^ - $ 的去除。 -
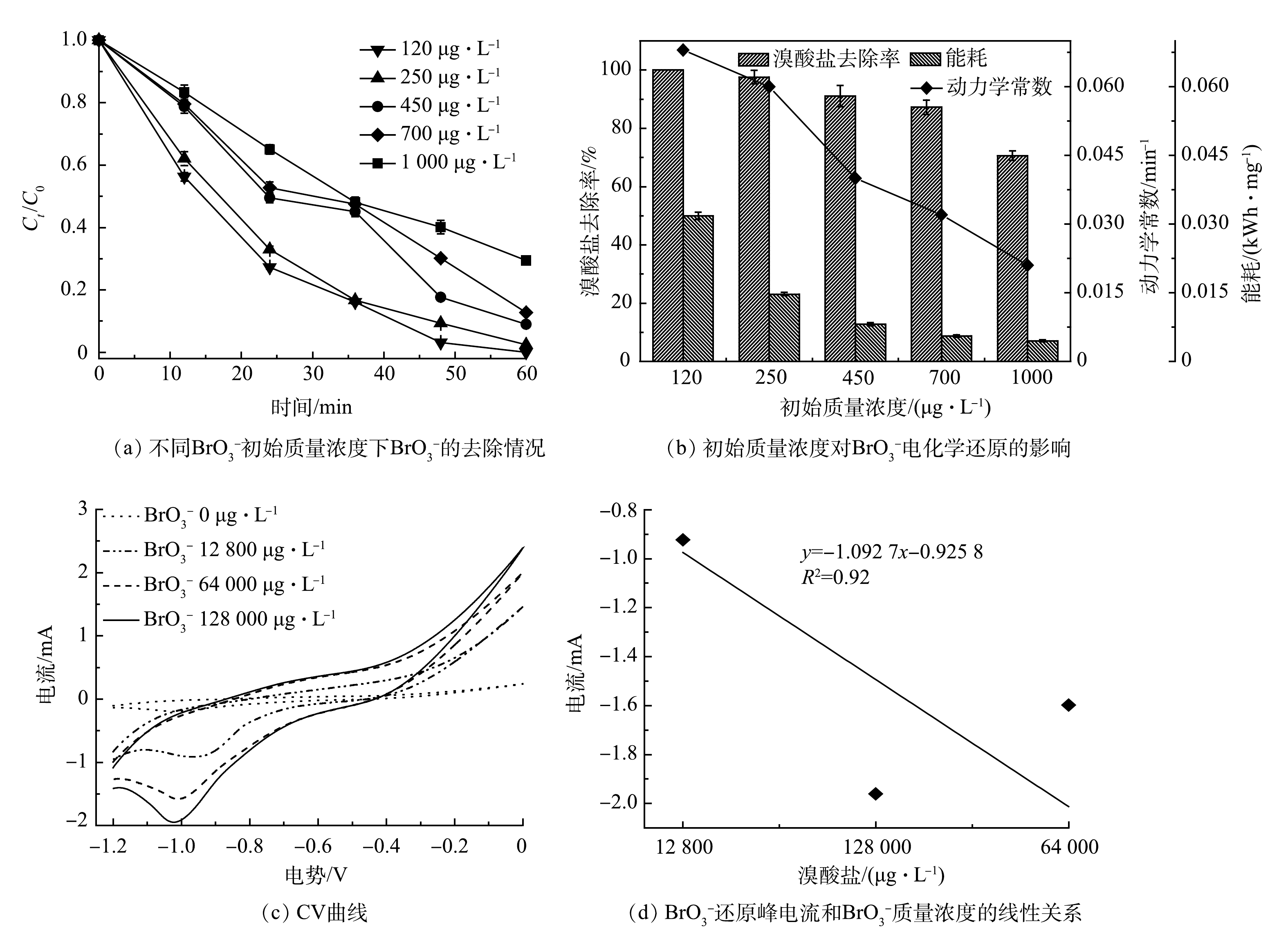
在实际水体中,
${\rm{BrO}}_3^ - $ 质量浓度存在较大差异。本研究在120~1 000 μg·L−1内开展了${\rm{BrO}}_3^ - $ 初始质量浓度对CoP/CF-350电化学还原${\rm{BrO}}_3^ - $ 的影响实验,结果如图6(a)和图6(b)所示。${\rm{BrO}}_3^ - $ 初始质量浓度对CoP/CF-350电化学去除${\rm{BrO}}_3^ - $ 系统的影响较明显。低质量浓度(120 μg·L−1)条件下,系统的反应速率常数(k)为0.068 min−1;然而在高质量浓度1 000 μg·L−1下k仅仅只有0.021 min−1。但是,值得注意的是,在高质量浓度下${\rm{BrO}}_3^ - $ 的绝对去除量较高。当${\rm{BrO}}_3^ - $ 初始质量浓度为120 μg·L−1时,CoP/CF-350电化学反应60 min后去除的${\rm{BrO}}_3^ - $ 总量为11.69 μg。然而,当BrO3−初始质量浓度提高到1 000 μg·L−1时,去除的${\rm{BrO}}_3^ - $ 总量高达74.12 μg,相应的能耗分别为0.032 kWh·mg−1和0.004 kWh·mg−1。以上结果表明:在高浓度下在体系中更多的${\rm{BrO}}_3^ - $ 被去除,并且电能的利用效率更高。如图6(c)所示,
${\rm{BrO}}_3^ - $ 的还原峰电流随着${\rm{BrO}}_3^ - $ 浓度的升高而增加,并且峰电流与${\rm{BrO}}_3^ - $ 浓度呈线性关系(图6(d))。这表明电化学还原${\rm{BrO}}_3^ - $ 是一个由扩散控制的过程[28-29]。通常情况下,溶液中污染物浓度越高,扩散或吸附到电极表面的污染物也就越多[30]。因此,在高的${\rm{BrO}}_3^ - $ 初始质量浓度条件下更多的${\rm{BrO}}_3^ - $ 被吸附到CoP/CF表面,从而使得${\rm{BrO}}_3^ - $ 绝对去除量和电能利用效率增大。此外,虽然在${\rm{BrO}}_3^ - $ 初始质量浓度为1 000 μg·L−1时电化学反应60 min后其去除率只有70.6%,但当反应继续延长到180 min后,${\rm{BrO}}_3^ - $ 的去除率高达98%。上述结果证明,CoP/CF在较宽的${\rm{BrO}}_3^ - $ 浓度范围内均展现出较高的电化学活性以及处理含有不同浓度${\rm{BrO}}_3^ - $ 水体的能力。 -
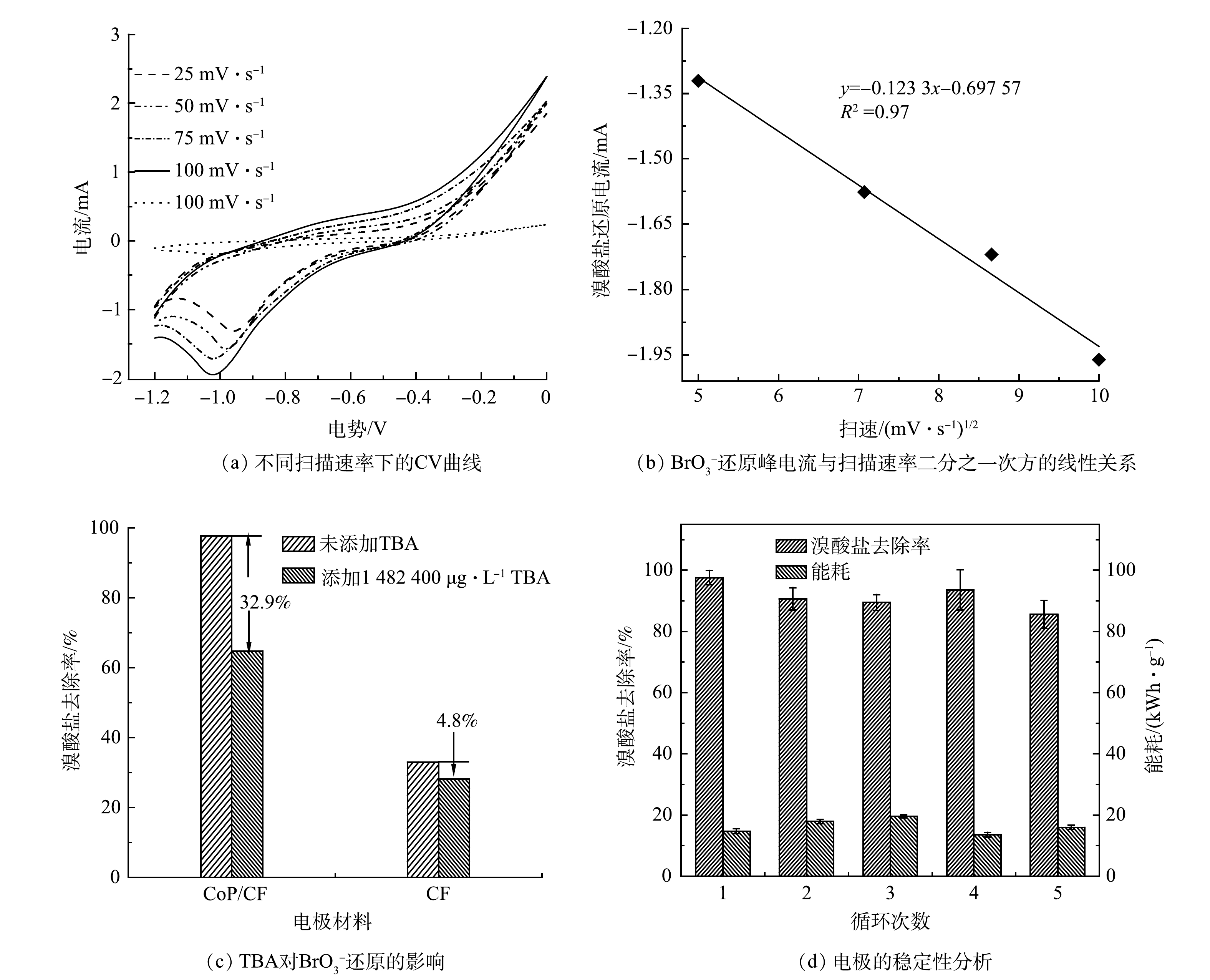
电化学还原
${\rm{BrO}}_3^ - $ 是一个复杂的过程,其中溴的价态从+5价变为−1价[31]。如图3(b)所示,在不同的电极构建的电化学还原${\rm{BrO}}_3^ - $ 体系中Br−的生成率高达90%。这表明被去除的${\rm{BrO}}_3^ - $ 几乎全部转化成为Br−。此外,有研究[13]表明,${\rm{BrO}}_3^ - $ 不仅能够被电极表面的电子直接还原,还可以被电化学反应中产生的H*通过加氢还原转化成为Br−。在本研究中,由图6(c)可见,${\rm{BrO}}_3^ - $ 能够从CoP/CF自支撑电极表面直接获得电子被还原成为Br−。如图7(a)和图7(b)所示,${\rm{BrO}}_3^ - $ 的还原峰电流随着扫描速率的增加升高,并且其与扫描速率的0.5次方呈线性关系。这表明CoP/CF电化学还原${\rm{BrO}}_3^ - $ 的电子传递过程存在质子扩散控制的过程[28]。CoP在电化学反应过程中不仅能够促进电子传递,还可以电催化还原H+产生H*。因此,本研究以CoP/CF-350和CF电极分别作为阴极,在添加一定浓度叔丁醇(TBA)下开展电化学还原
$ {\rm{BrO}}_3^ -$ 的实验(淬灭实验)。TBA能够有效地淬灭电化学反应过程中产生的H*[32],并将其转化成为惰性的2-甲基-2-丙醇自由基[33]。如图7(c)所示,当溶液中的TBA浓度为20 mmol·L−1时,CF电极构建的电化学系统中${\rm{BrO}}_3^ - $ 的去除率并没有发生显著变化。这表明CF电化学还原${\rm{BrO}}_3^ - $ 主要是通过电子传递而不是H*介导的加氢还原实现。然而,CoP/CF电极对${\rm{BrO}}_3^ - $ 的去除率因为TBA的加入降低了32.9%。因此,可以推测,在CoP/CF构建的电化学系统中${\rm{BrO}}_3^ - $ 的去除是通过电子直接还原和H*介导的间接还原的协同作用。综上所述,CoP/CF自支撑电极电化学还原
${\rm{BrO}}_3^ - $ 的机理如图8所示。在CoP/CF电极为阴极构建的电化学系统中,${\rm{BrO}}_3^ - $ 首先通过浓差扩散吸附到电极表面(式(4),${\rm{BrO}}_{3{\rm{ads}}}^ - $ ),${\rm{BrO}}_{3{\rm{ads}}}^ - $ 通过电子传递直接被还原为Br−(式(5))。在此过程中CoP作为电子传递媒介或桥梁促进反应的进行。此外,CoP还可以电催化产生H*(式(6)~(8))。由于金属磷化物中有磷的存在会改变H*在电极表面的吸附能,使其不倾向于Heyrovsky或Tafel过程生成H2[34-35],而是作为强还原剂参与加氢还原反应。因此,${\rm{BrO}}_3^ - $ 可以通过加氢还原转化为Br−(式(9))。 -
电极的稳定性是电化学反应的一个重要指标,其不仅包括电极的性能稳定,也包括电极在反应过程是否会有溶出或渗出从而导致水体的二次污染。为了有效地评估电极的可持续利用性能,本研究在最优条件下(350 ℃磷化CoP/CF电极,电流密度5.0 mA·cm−2,溴酸盐初始质量浓度250 μg·L−1),在反应60 min内开展了CoP/CF-350电极电化学还原
${\rm{BrO}}_3^ - $ 的循环实验,结果如图7(d)所示。相对于第1次反应,第2次循环反应后${\rm{BrO}}_3^ - $ 去除率由97.6%降低到90.5%,但在后续的3次循环反应中${\rm{BrO}}_3^ - $ 去除率基本保持在90%左右。溶液中溶出的Co离子基本保持在0.1 mg·L−1左右。此外,5次循环后的SEM和XRD表征结果表明(图(9)),电极的表面结构和磷化钴的晶体结构并未发生明显的变化。这表明CoP/CF-350在多次循环后仍能保持较好的稳定性。与其他的电极比较(表1),CoP/CF-350在电极制备、稳定性和对溴酸盐去除等方面具有较大优势。 -
1)当磷化温度为350 ℃时,CoP/CF自支撑电极对
$ {\rm{BrO}}_3^ - $ 展现出最佳的还原性能,对初始质量浓度为250 μg·L−1的$ {\rm{BrO}}_3^ - $ ,去除率最高可达97.6%。2) CoP/CF自支撑电极电化学还原
$ {\rm{BrO}}_3^ - $ 时,$ {\rm{BrO}}_3^ - $ 初始浓度越高,去除的绝对量越大,同时还原1 mg$ {\rm{BrO}}_3^ - $ 需要的电能越低;电流密度越大,$ {\rm{BrO}}_3^ - $ 去除率越高,但相应的能耗也越高;DO对CoP/CF自支撑电极影响不大。3) CoP/CF自支撑电极电化学还原
$ {\rm{BrO}}_3^ - $ 的产物为Br−,并没有其他副产物的积累;在以CoP/CF为阴极构建的电化学系统中,$ {\rm{BrO}}_3^ - $ 的去除包括直接电子还原和H*介导的间接还原;CV分析表明$ {\rm{BrO}}_3^ - $ 的还原是一个受扩散传质控制的过程;在还原过程中CoP不仅作为电子传递媒介或桥梁促进电子传递,还可以作为电催化剂催化产生H*并用于$ {\rm{BrO}}_3^ - $ 的加氢还原。4) CoP/CF自支撑电极在循环5次后仍然保持较高的电化学活性。
磷化钴-泡沫钴自支撑电极电化学还原溴酸盐
Efficient electrochemical bromate reduction using cobalt phosphide self-supported cobalt foam electrode
-
摘要: 开发活性高和价格低廉的电极材料是溴酸盐(
${\rm{BrO}}_3^ - $ )电化学还原技术的关键。贵金属电极因其高活性受到广泛关注,但贵金属储量低且价格昂贵导致其推广应用受限。为此,本研究在不使用粘结剂的情况下,通过直接在高温条件下将磷化泡沫钴原位生长转化为磷化钴,从而制备出磷化钴-泡沫钴自支撑电极(CoP/CF),并将其用于电化学还原${\rm{BrO}}_3^ - $ 。结果表明:350 ℃下磷化制备的电极CoP/CF-350性能最优;当${\rm{BrO}}_3^ - $ 初始质量浓度为250 μg·L−1、电流密度为5.0 mA·cm−2时,该电极对${\rm{BrO}}_3^ - $ 去除率为97.6%,相应的能耗为0.014 kWh·mg−1。循环伏安测试(CV)和淬灭实验结果表明,${\rm{BrO}}_3^ - $ 的去除归因于直接电子传递和活性氢(H*)间接还原的协同作用。原位生长的CoP作为双功能催化剂,起到了电子传递媒介和桥梁的作用,强化了${\rm{BrO}}_3^ - $ 的还原。经过5次循环实验后,CoP/CF-350电极仍保持良好电催化活性,说明其具有良好的稳定性。Abstract: Exploring highly active and inexpensive electrode are the keys in electrochemical reduction of bromate (${\rm{BrO}}_3^ - $ ). Although the noble metal-based electrode has attracted intensive attention for its high activity, low abundance and high price of noble metal seriously impede its practical application. In this study, a binder-free composite electrode (CoP/CF) was prepared by direct growth of cobalt phosphide(CoP) on cobalt foam(CF) and then was used to perform electrochemical reduction of${\rm{BrO}}_3^ - $ . The results showed that CoP/CF-350 electrode prepared at 350 ℃ had a better electrochemical performance on high${\rm{BrO}}_3^ - $ reduction(97.6%) and lower energy consumption (0.014 kWh·mg−1) at the initial${\rm{BrO}}_3^ - $ concentration of 250 μg·L−1 and current density of 5.0 mA·cm−2. The cyclic voltammetry(CV) and quenching experiments demonstrated that${\rm{BrO}}_3^ - $ removal should be ascribed to the synergistic effect of direct electron transfer and active hydrogen (H*) indirect reduction. The in-situ grown CoP served as the bifunctional catalyst and played the dual roles of electron mediator and bridge, further enhanced the${\rm{BrO}}_3^ - $ reduction. Even after five cyclic experiments, the CoP/CF-350 electrode still remained a good electrocatalytic activity, this indicated that this electrode had a good stability.-
Key words:
- CoP /
- self-supported electrode /
- electrochemical reduction /
- ${\rm{BrO}}_3^ - $ /
- reaction mechanism
-

-
-
[1] 武琳, 杨宏伟, 杨少霞, 等. 催化臭氧氧化过程中溴酸盐的生成机制研究[J]. 环境科学, 2011, 32(8): 2281-2283. [2] LI Y K, SHEN W H, FU S J, et al. Inhibition of bromate formation during drinking water treatment by adapting ozonation to electro- peroxone process[J]. Chemical Engineering Journal, 2017, 264: 322-328. [3] 王执伟, 刘冬梅, 张文娟, 等. 溴酸盐对水生生物的急性毒性效应[J]. 环境科学, 2016, 37(2): 756-764. [4] 钟宇, 杨麒, 李小明, 等. RBER生物降解溴酸盐及微生物群落结构分析[J]. 中国环境科学, 2017, 37(5): 1945-1953. doi: 10.3969/j.issn.1000-6923.2017.05.043 [5] ZHONG Y, LI X M, YANG Q, et al. Complete bromate and nitrate reduction using hydrogen as the sole electron donor in a rotating biofilm-electrode reactor[J]. Journal of Hazardous Materials, 2016, 307: 82-90. doi: 10.1016/j.jhazmat.2015.12.053 [6] WU X Q, YANG Q, XU D C, et al. Simultaneous adsorption/reduction of bromate by nanoscale zerovalent iron supported on modified activated carbon[J]. Industrial & Engineering Chemistry Research, 2013, 52: 12574-12581. [7] YURANOVA T, KIWI-MINSKER L, FRANCH C, et al. Nanostructured catalysts for the continuous reduction of nitrates and bromates in Water[J]. Industrial & Engineering Chemistry Research, 2013, 52: 13930-13937. [8] CHEN F, YANG Q, ZHONG Y, et al. Photo-reduction of bromate in drinking water by metallic Ag and reduced graphene oxide (RGO) jointly modified BiVO4 under visible light irradiation[J]. Water Research, 2016, 101: 555-563. doi: 10.1016/j.watres.2016.06.006 [9] 安东, 宋佳秀, 乐林生, 等. 溴离子和溴酸盐活性炭竞争吸附及溴酸盐生成影响[J]. 环境科学, 2008, 29(4): 948-953. doi: 10.3321/j.issn:0250-3301.2008.04.018 [10] 李昂臻, 冒冉, 赵旭. 泡沫铜电极电还原去除溴酸盐研究[J]. 中国科学, 2014, 44(10): 1675-1681. [11] MAO R, ZHAO X, QU J H, et al. Electrochemical reduction of bromate by a Pd modified carbon fiber electrode: Kinetics and mechanism[J]. Electrochemical Acta, 2014, 132: 151-157. doi: 10.1016/j.electacta.2014.03.170 [12] MAO R, ZHAO X, LAN H C, et al. Graphene-modified Pd/C cathode and Pd/GAC particles for enhanced electrocatalytic removal of bromate in a continuous three-dimensional electrochemical reactor[J]. Water Research, 2015, 77: 1-12. doi: 10.1016/j.watres.2015.03.002 [13] LAN H C, MAO R, TONG Y T, et al. Enhanced electroreductive removal of bromate by a supported Pd-In bimetallic catalyst: Kinetics and mechanism investigation[J]. Environmental Science & Technology, 2016, 50: 11872-11878. [14] SHEN W J, LIN F J, JIANG X, et al. Efficient removal of bromate with core-shell Fe@Fe2O3 nanowires[J]. Chemical Engineering Journal, 2017, 308: 880-888. doi: 10.1016/j.cej.2016.09.070 [15] YUAN C Z, ZHONG S L, JIANG Y F, et al. Direct growth of cobalt-rich cobalt phosphide catalysts on cobalt foil: an efficient and self-supported bifunctional electrode for overall water splitting in alkaline media[J]. Journal of Materials Chemistry A, 2017, 5: 10561-10566. doi: 10.1039/C7TA01776F [16] LIU H L, HAN J L, YUAN J L, et al. Deep dehalogenation of florfenicol using crystalline CoP nanosheet arrays on a Ti plate via direct cathodic reduction and atomic H[J]. Environmental Science & Technology, 2019, 53: 11932-11940. [17] MISUDOME T, SHENG M, NAKATA A, et al. A cobalt phosphide catalyst for the hydrogenation of nitriles[J]. Chemical Science, 2020, 11: 6682-6689. doi: 10.1039/D0SC00247J [18] LIU D N, CHEN T, ZHU W X, et al. Cobalt phosphide nanowires: An efficient electrocatalyst for enzymeless hydrogen peroxide detection[J]. Nanotechnology, 2016, 27: 33LT01. doi: 10.1088/0957-4484/27/33/33LT01 [19] LIU Z W, DONG S S, ZOU D, et al. Electrochemically mediated nitrate reduction on nanoconfined zerovalent iron: Properties and mechanism[J]. Water Research, 2020, 173: 115595. [20] SU L, HAN D D, ZHU G J, et al. Tailoring the assembly of iron nanoparticles in carbon microspheres toward high-performance electrocatalytic denitrification[J]. Nano Letters, 2019, 19: 5423-5430. doi: 10.1021/acs.nanolett.9b01925 [21] CHEN X T, ZHANG T, KAN M, et al. Binderless and oxygen vacancies rich FeNi/graphitized mesoporous carbon/Ni foam for electrocatalytic reduction of nitrate[J]. Environmental Science & Technology, 2020, 54: 13344-13353. [22] YAO Q F, ZHOU X F, XIAO S Z, et al. Amorphous nickel phosphide as a noble metal-free cathode for electrochemical dechlorination[J]. Water Research, 2019, 165: 114930. doi: 10.1016/j.watres.2019.114930 [23] YAO F B, YANG Q, YAN M, et al. Synergistic adsorption and electrocatalytic reduction of bromate by Pd/N-doped loofah sponge-derived biochar electrode[J]. Journal of Hazardous Materials, 2020, 386: 121651. doi: 10.1016/j.jhazmat.2019.121651 [24] ZHANG X, WANG Y T, LIU C B, et al. Recent advances in non-noble metal electrocatalysts for nitrate reduction[J]. Chemical Engineering Journal, 2021, 403: 126269. doi: 10.1016/j.cej.2020.126269 [25] PFEIFFER H, TANCRET F, BICHAT M P, et al. Air stable copper phosphide (Cu3P): A possible negative electrode material for lithium batteries[J]. Electrochemistry Communications, 2004, 6: 263-267. doi: 10.1016/j.elecom.2003.12.012 [26] ZHUANG M H, OU X W, DOU Y B, et al. Polymer-embedded fabrication of Co2P nanoparticles encapsulated in N, P-doped graphene for hydrogen generation[J]. Nano Letters, 2016, 16: 4691-4698. doi: 10.1021/acs.nanolett.6b02203 [27] JIANG N, YOU B, SHENG M L, et al. Electrodeposited cobalt-phosphorous-derived films as competent bifunctional catalysts for overall water splitting[J]. Angewandte Chemie-International Edition, 2015, 54: 6251-6254. doi: 10.1002/anie.201501616 [28] SHIH Y J, WU Z L, HUANG Y H, et al. Electrochemical nitrate reduction as affected by the crystal morphology and facet of copper nanoparticles supported on nickel foam electrodes (Cu/Ni)[J]. Chemical Engineering Journal, 2020, 383: 123157. doi: 10.1016/j.cej.2019.123157 [29] YAO F B, JIA M C, YANG Q, et al. Highly selective electrochemical nitrate reduction using copper phosphide self-supported copper foam electrode: Performance, mechanism, and application[J]. Water Research, 2021, 193: 116881. doi: 10.1016/j.watres.2021.116881 [30] KISHIMOTO N, MATSUDA N. Bromate ion removal by electrochemical reduction using an activated carbon felt electrode[J]. Environmental Science & Technology, 2009, 43: 2054-2059. [31] MAO R, ZHAO X, LAN H C, et al. Efficient electrochemical reduction of bromate by a Pd/rGO/CFP electrode with low applied potentials[J]. Applied Catalysis B:Environmental, 2014, 160: 179-187. [32] GAO J N, JIANG B, NI C C, et al. Enhanced reduction of nitrate by noble metal-free electrocatalysis on P doped three- dimensional Co3O4 cathode: Mechanism exploration from both experimental and DFT studies[J]. Chemical Engineering Journal, 2020, 382: 123034. doi: 10.1016/j.cej.2019.123034 [33] GAO J N, JIANG B, NI C C, et al. Co3O4-TiO2/Ti cathode based electrocatalytic nitrate reduction: Preparation, performance and mechanism[J]. Applied Catalysis B: Environmental, 2019, 254: 391-402. [34] LIU C, ZHANG A Y, PEI D N, et al. Efficient electrochemical reduction of nitrobenzene by defect engineered TiO2-x single crystals[J]. Environmental Science & Technology, 2016, 50: 5234-5242. [35] LI Y H, LIU P F, PAN L F, et al. Local atomic structure modulations activate metal oxide as electrocatalyst for hydrogen evolution in acidic water[J]. Nature Communications, 2015, 6: 8064 [36] YAO F B, YANG Q, JIAN S, et al. Electrochemical reduction of bromate using noble metal-free nanoscale zero-valent iron immobilized activated carbon fiber electrode[J]. Chemical Engineering Journal, 2020, 389: 123588 -
















 下载:
下载: