-
天然有机物(natural organic matter, NOM)是由腐殖酸、黄腐酸、低分子质量有机酸、碳水化合物、蛋白质等组成的复杂非均相混合物[1]。地表水中的NOM主要来源于周边流域的自然生态系统和人为活动[2],并受气候和季节变化的影响[3]。NOM中可通过0.45 μm过滤器的部分可以定义为DOM(dissolved organic matter, DOM)[4]。在水处理过程中,DOM作为前体物会与消毒剂(如氯、氯胺和臭氧等)发生一系列氧化、取代和水解反应,生成消毒副产物(disinfection by-products, DBPs)[5]。DBPs因具有较高的细胞毒性、致突变性和致癌性,会导致呼吸系统、生殖发育、肝脏、肾脏、神经及免疫系统等方面的健康问题[6-7]。尽管DBPs生成不可避免,我们仍可通过改变DOM的数量和性质来控制DBPs的形成[8]。有研究表明,相较于改变消毒条件或引入其他先进技术去除已形成的DBPs,在消毒前去除DBPs前体物更具经济性[9-10]。因此,了解水源水中DOM的特征及其与DBPs生成的关系,对于保障水处理厂达到预期出水水质具有重要意义[11-12]。
DOM的化学组成显著受季节变化影响。例如,深圳市水源水在雨季主要富含类腐殖质荧光组分,而旱季则以类蛋白质荧光组分为主[13];珠江口的DOM在雨季的相对分子质量高于旱季[14]。这些变化不仅影响着水处理过程,也与DBPs生成密切相关。具体来说,类腐殖质组分与三卤甲烷(trihalomethanes, THMs)和卤乙酸(haloacetic acids, HAAs)等DBPs的生成显著相关;低分子质量DOM在水处理过程中难得到有效去除,而其生成DBPs的能力高于高分子质量DOM[15–17]。此外,水体类型也会影响DOM变化规律,水库由于其庞大的存水量和混合流入水的能力,其水质稳定性高,所以其DOM受季节变化影响程度远低于河流水。
当前,对人工修建的大型自流式长距离调水工程中DOM变化规律的研究较少。该工程采用明渠输水,且水深相对较浅,易引发藻类过度生长。藻华和腐殖化是引起DOM构成变化的2个主要因素[18]。因此,本研究在冬季和夏季于长距离调水工程主干渠采集水样,采用EEMs和HPSEC-OCD对水样中的DOM进行了表征,并对加入过量氯消毒后水样中消毒副产物生成势(disinfection by-products formation potential, DBPsFP) 进行了测定,为揭示样品中DOM沿线变化特征及季节变化对其的影响,探究了DOM组分与THMs、HAAs、卤代酮(halogenated ketones, HKs)和卤乙醛(haloacetaldehydes, HALs)等含碳消毒副产物(carbon containing disinfection by-products, C-DBPs)以及卤乙腈(haloacetonitrile, HANs)、卤乙酰胺(haloacetamides, HAMs)等含氮消毒副产物(nitrogen containing disinfection by-products, N-DBPs)生成势的关系。
-
本研究涉及的长距离调水工程是世界上最长的跨流域调水工程,其水质特性独特且复杂,其他河流、大型水库和湖泊水质的研究并不适用于该工程水体[19]。该工程的水体基础水质良好,除总氮(TN)外,其他诸如溶解氧、高锰酸盐指数、总磷、氨氮、氟化物、汞等16项水质参数均达到或优于Ⅰ或Ⅱ类地表水标准[20]。随着工程运行时间的推移,多种水质参数呈下降趋势,水质状况持续改善[21]。为进一步了解其中DOM组成,本研究在长达1 000 km的输水主干渠设置了9个采样点,其中,点位N1~N6位于N省,B7~B9位于B省。样本于2023年2月和7月采集,分别代表冬季和夏季条件。样本于水面下0~0.5 m处采集,每个点位取2个重复样本,分别装入清洁塑料瓶中并立即运回实验室。所有样本到达实验室后,立即使用0.45 μm 的膜进行过滤,并在4 ℃条件下储存备用。
-
次氯酸钠为分析级,购自国药集团化学试剂有限公司。氯化铵为分析纯,购自国药集团化学试剂有限公司。浓硫酸为分析纯,购自国药集团化学试剂有限公司。无水硫酸钠为分析纯,购自国药集团化学试剂有限公司。所有标准品为色谱纯,购自阿尔塔第一标准科学有限公司。甲基叔丁基醚(Methyl tert-Butyl Ether, MtBE)为液相级,购自费希尔化学公司。N,O-双(三甲基硅基)三氟乙酰胺为液相级,购自J&K Science Ltd。
-
水样经0.45 μm滤膜过滤后,装入1 cm四面通光的石英比色皿,使用Cary Eclipse型荧光分光光度计测定荧光光谱。使用的仪器设置如下:光电倍增电压设置为700 V,所有测量的激发和发射狭缝均保持在5 nm,扫描速度设置为1 200 nm·min−1。激发波长设置为200~420 nm(间隔5 nm),发射波长设置为280~550 nm(间隔5 nm)。通过减去超纯水的三维荧光光谱去除拉曼散射效应,后续采用MATLAB R2018b软件处理数据。
荧光区域积分法(fluorescence regional integration, FRI)将三维荧光光谱(excitation emission matrices, EEMs)分为5个区域,区域Ⅰ(Ex/Em=200~250 nm/280~330 nm)和区域Ⅱ(Ex/Em=200~250 nm/330~380 nm)统称为类芳香蛋白(aromatic proteins-like, AP-like)组分,其中区域Ⅰ为类酪氨酸成分,区域Ⅱ为类色氨酸成分;区域Ⅲ(Ex/Em=200~250 nm/380~550 nm)为类富里酸(fulvic acid-like, FA-like)组分;区域Ⅳ(Ex/Em=250~400/280~380 nm)为类可溶性微生物产物(soluble microbial by products-like, SMP-like)组分;区域Ⅴ(Ex/Em=250~400 nm/380~550 nm)为类腐殖酸(humic acid-like, HA-like)组分,然后用不同范围内荧光强度积分来量化分析DOM组成和含量变化[22]。
BIX 是激发波长为310 nm时,380 nm发射波长处荧光强度和430 nm发射波长处荧光强度的比值,BIX越大,自生源特性越强。当BIX<0.8时,DOM受陆源输入或受人类活动影响较大;当0.8<BIX<1.0 时,DOM具有较强的自生源特征;当BIX>1时,DOM主要由生物活细菌等产生[23]。
-
高效尺寸排阻色谱耦合有机碳检测器(high-performance size exclusion chromatography-organic carbon detector, HPSEC-OCD)主要包括高效液相色谱和在线有机碳检测两大系统。采用磷酸盐缓冲溶液(2.500 g·L−1 KH2PO4+3.018 g·L−1 Na2HPO4·2H2O)为流动相,流速设置为1 mL·min−1,进样体积为500 μL。该检测器基于色谱柱洗脱时间的差异性将有机物分为4个组分,即生物大分子聚合体(biopolymers, BP)、腐殖质物质(humic substances, HS),腐殖质类物质构建块(building blocks of humic substances, BB)以及小分子物质(low molecular weight, LMW)[24]。
-
水样经过0.45 μm滤膜过滤后,转移至100 mL顶空自动进样瓶中进行消毒实验,消毒剂为次氯酸钠,加氯量通过式(1)确定。样品加氯后在室温(25 ℃)下避光反应72 h,反应完成后使用哈希试剂包在DR6000分光光度计测定余氯量。然后加入氯化铵进行淬灭,氯化铵与余氯的摩尔比为1.5∶1。
式中:a为加氯量,mg·L−1;b为样品溶解有机碳质量浓度,mg·L−1。
将100 mL消毒后的水样转移至蓝盖瓶中,使用浓硫酸将pH调至1以下,加入15 g无水硫酸钠以提高有机相纯度。然后使用液液萃取提取DBPs,加入8 mL MtBE萃取液,使用腕式振荡器在500 r·min−1下振荡10 min后静置10 min,水层与有机相明显分层时将有机相转移至玻璃管中,该步骤重复2次。将得到的约16 mL有机相通过无水硫酸钠柱以除水。然后将提取物氮吹至200 μL,转移至气相色谱进样小瓶中。加入10 μL内标物(1,2-二溴丙烷,25 mg·L−1),充分混合后,取出100 μL进行衍生化(加入10 μL N,O -双(三甲基硅基)三氟乙酰胺,在50 ℃下衍生30 min)用于非挥发性HAAs测定,剩下的一份用于测定挥发性DBPs(包括THMs、I-THMs,HALs、HKs、HANs和HAMs)。
通过安捷伦气相色谱-质谱仪(7890A-5975C)检测DBPs的浓度。仪器条件设置如下:进样器温度250 ℃,进样量为2 μL,测定非挥发性HAAs时载气流速为0.8 mL·min−1,测定其他挥发性DBPs时载气流速为1.2 mL·min−1。升温程序:35 ℃保持2 min,以4 ℃·min−1的速度上升至100 ℃并保持2 min,再以9 ℃·min−1 的速度上升至130 ℃并保持1 min,最后以12 ℃·min−1的速度上升至220 ℃并保持1 min。方法详情见文献[25],22种目标DBPs的名称及缩写见表1。
-
本研究利用EEMs对采集水样中的DOM进行表征分析,FRI结果如图1所示。DOM主要由类芳香蛋白组分和类富里酸组分构成,且所有样品4种荧光组分的相对丰度基本一致,说明水体拥有强大的自净能力。夏季水样中,类富里酸组分的体积占比在32.89%~42.33%,平均为冬季水样的1.14倍。类富里酸组分是腐殖质物质,与陆源输入密切相关[26]。由于夏季降雨量增多、地表径流增强,陆源输入的DOM量有所上升,从而导致类富里酸组分占比增大。在冬季采集的样品中,类芳香蛋白组分的荧光积分体积占比在39.39%~57.73%,平均为夏季样品的1.19倍。类芳香蛋白组分占比大暗示水体在一定程度上受到了人为活动的影响[27]。在冬季,由于水体内部的生物活动和陆源DOM影响减小,人为活动对水质的影响力增加。此外,类可溶性微生物产物组分反映了水体中生物的代谢状态[23],因夏季水体内微生物、藻类等生物更活跃,夏季水样中该组分占比(4.73%~12.6%)明显高于冬季水样(4.40%~5.09%)。
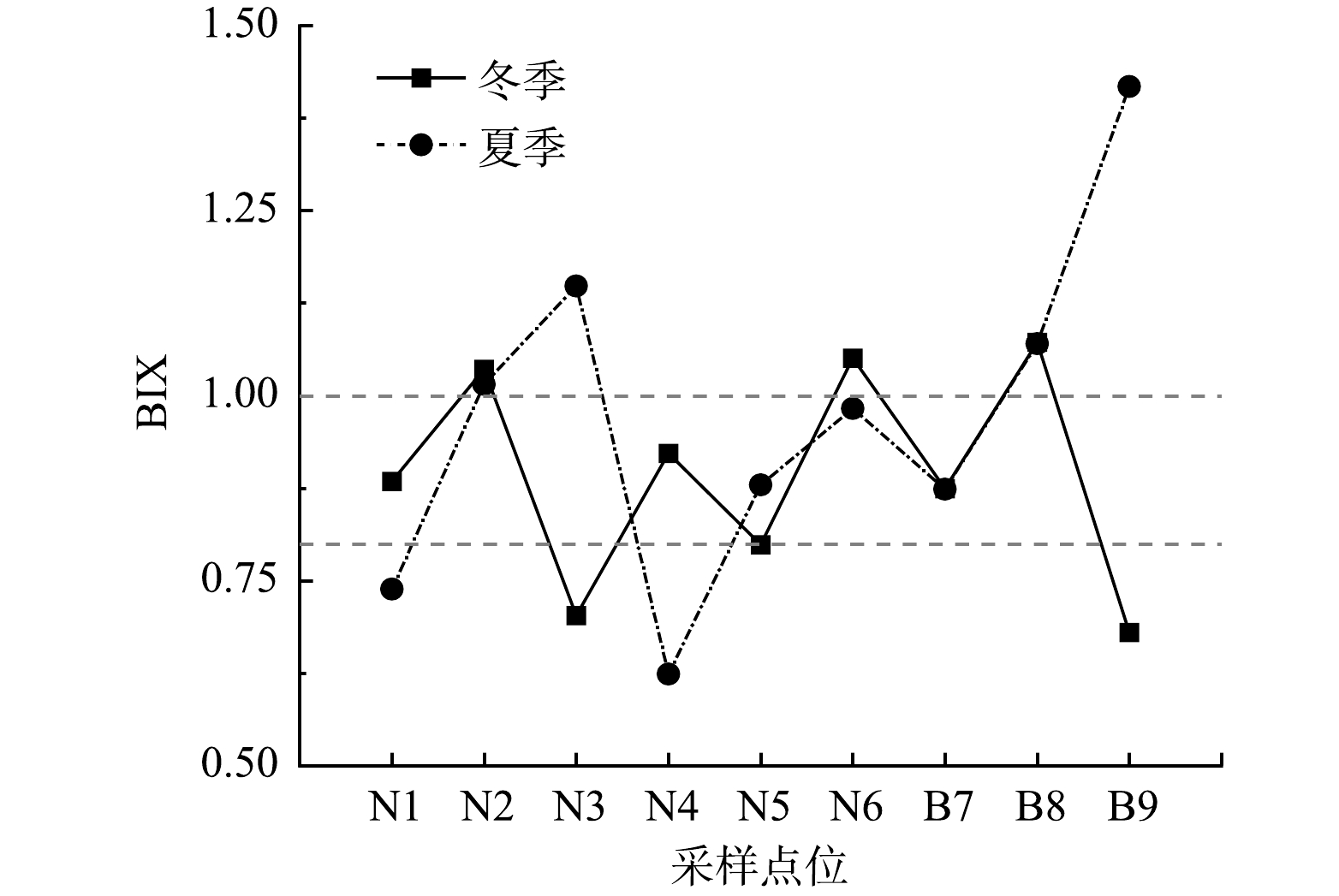
如图2所示,荧光特征参数BIX的分析结果表明大部分水样中的DOM均具有自生源特性。在冬季水样中,BIX平均值为0.89,而在夏季水样中,该值为0.97。这说明夏季水样中的DOM具有更强的自生源特性。值得注意的是,相比于冬季,夏季水样的BIX具有更大的波动性。这可能是因为夏季水体内部的生物活动和外部的陆源输入都增强,DOM受到内外双方面的强烈影响。
-
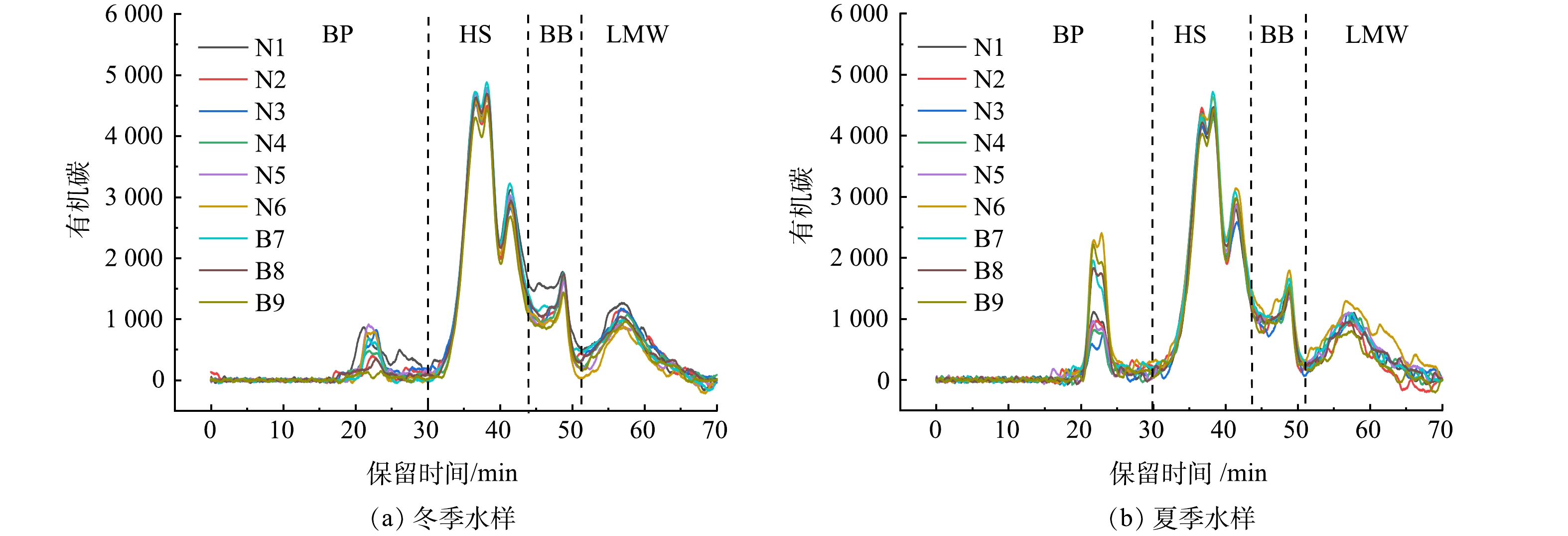
如图3所示,通过HPSEC-OCD表征,研究将水样中的DOM划分为4大组分,即分子质量大于20 kDa的BP组分,分子质量为1.5~7 kDa的HS组分,分子质量为0.5~1.5 kDa的BB组分和低分子质量组分LMW[24]。冬季和夏季采集的样品的色谱图分别展现了较好的一致性,表明DOM的分子质量分布在同一季节内基本保持不变。无论是冬季与夏季水质的差异,还是夏季各采样点水质的些许波动,都主要反映在BP组分。这个组分通常是由水体生物活动产生,如藻类的代谢和衰亡过程[28]。夏季水温升高,为生物提供了适宜的环境条件,导致更多BP组分产生。夏季下游点位(N6、B7、B8和B9)的BP组分含量明显高于上游点位,也进一步证实了该工程藻细胞密度从上游向下游呈增加的趋势[19]。鉴于BP组分与色谱柱缺乏疏水相互作用,推测此组分更倾向于亲水性组分,较高的亲水性会导致传统的混凝沉淀工艺效率下降[29]。
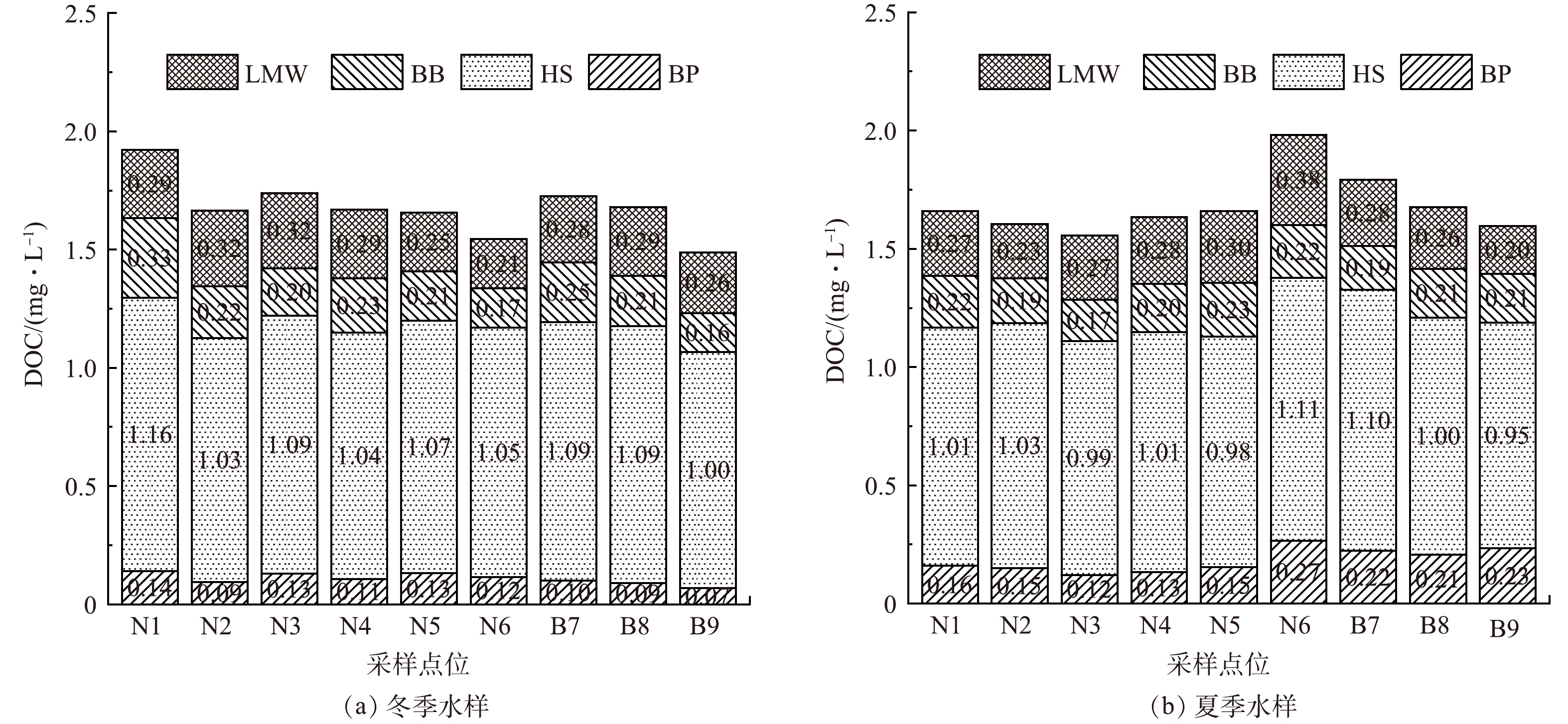
图4进一步展示了不同的分子质量组分含量,发现水样中的主要成分为HS组分,其在所有水样中的总有机碳占比均超过60%。HS主要源于陆源有机物和水中植物有机物的微生物、化学和光降解过程[30]。HS不易被微生物降解,还能与许多金属离子和有机污染物形成可溶性络合物,易导致供水系统中形成生物膜。在水处理过程中,通常在混凝工艺中大量去除HS[31],同时可以增设如臭氧氧化等预氧化工艺来进一步提高其生物降解性[30]。对于主要差异所在的BP组分,其在夏季水样中的占比(7.77%~14.65%)明显高于冬季(4.69~7.97%)。BP组分对不可逆的膜污染具有重要影响[32],因此,当夏季BP组分含量增大时,采用膜处理工艺的水处理厂应格外注意防范和解决膜污染问题。
-
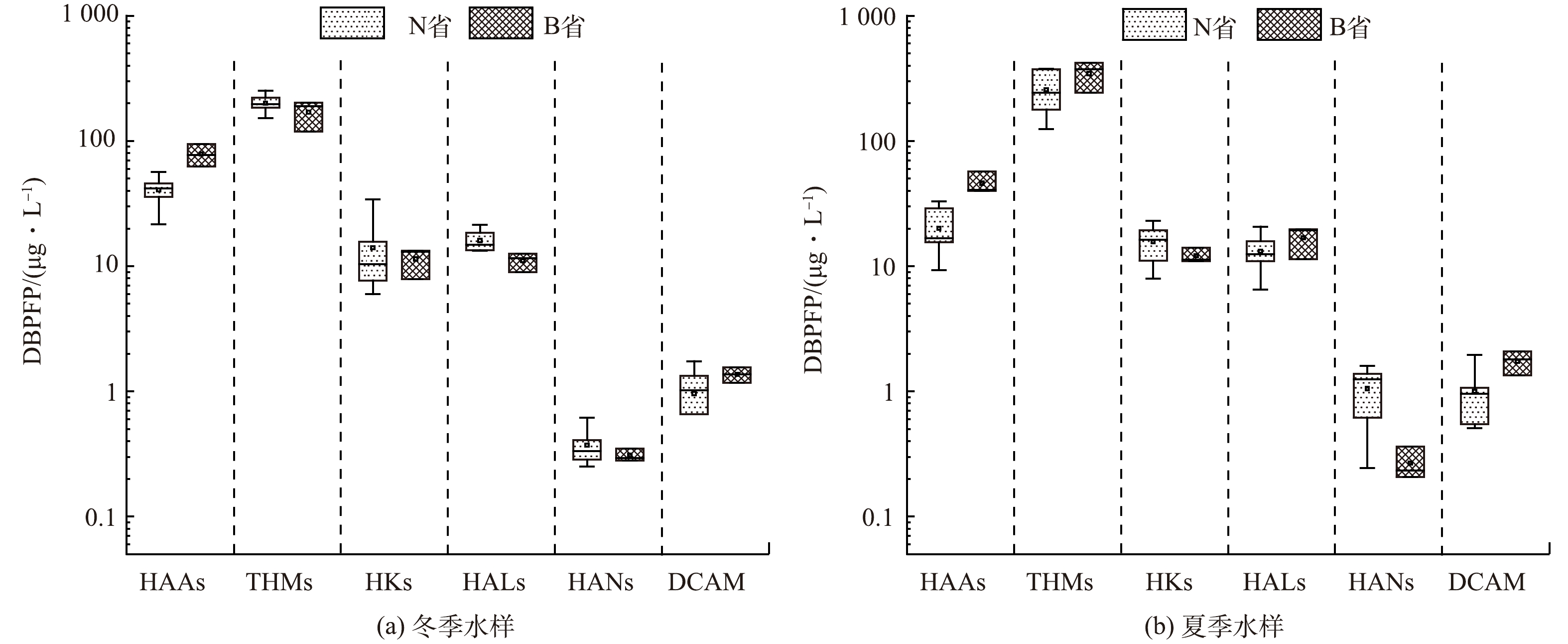
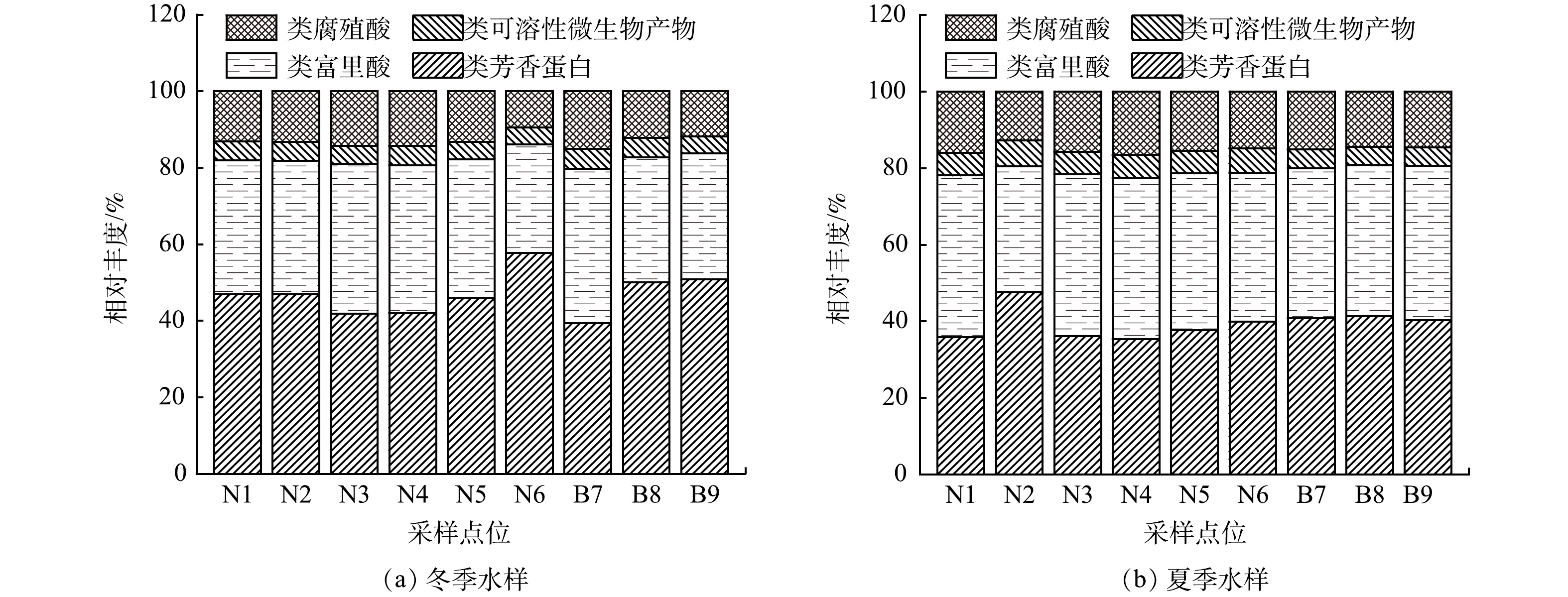
本研究对采集的水样进行了DBPsFP测定,DBPsFP可理解为原水经过量氯消毒后放大DBPs生成规律的结果,与最终的水处理厂出水质量无直接关系,具体测定结果见图5。冬季水样的目标DBPsFP总质量浓度为210.74~338.05 μg·L−1,而夏季的总质量浓度提升至239.55~489.34 μg·L−1。尽管冬季与夏季DOC水平未显现出明显差异(图4),但夏季样本的DBPs的生成水平总体上高于冬季,这反映出季节对溶解有机碳物质氯反应活性的影响,夏季反应性高于冬季[33]。但无论是冬季还是夏季,THMs和HAAs均为两类主要的DBPs[2,34]。进一步分析发现,在冬季THMs生成质量浓度平均值为190.58 μg·L−1,占总DBPs的69.74%;而在夏季,THMs生成质量浓度平均值升至286.17 μg·L−1,占比也增至82.30%,说明夏季THMs的生成势和占比都高于冬季。THMs类中的TCM、BDCM和DBCM都有检出,但以TCM为主,其生成量占THMs总量的96%以上。对于HAAs,冬季生成量为21.51~94.72 μg·L−1,占比为总DBPsFP的9.15%~35.17%,而夏季则降至9.28~57.07 μg·L−1,占比为2.94%~13.04%,足见夏季HAAs的生成量和占比都低于冬季。HAAs与THMs的不同生成趋势说明形成两者的前体物可能有所区别。其他C-DBPs(HKs和HALs),2个季节的生成量并无显著差异。另外,被检出的N-DBPs(包括DCAN、TCAN和DCAM)的生成质量浓度很低,均小于2 μg·L−1,夏季占比(0.36%~0.88%)稍高于冬季(0.12%~0.75%)。
-
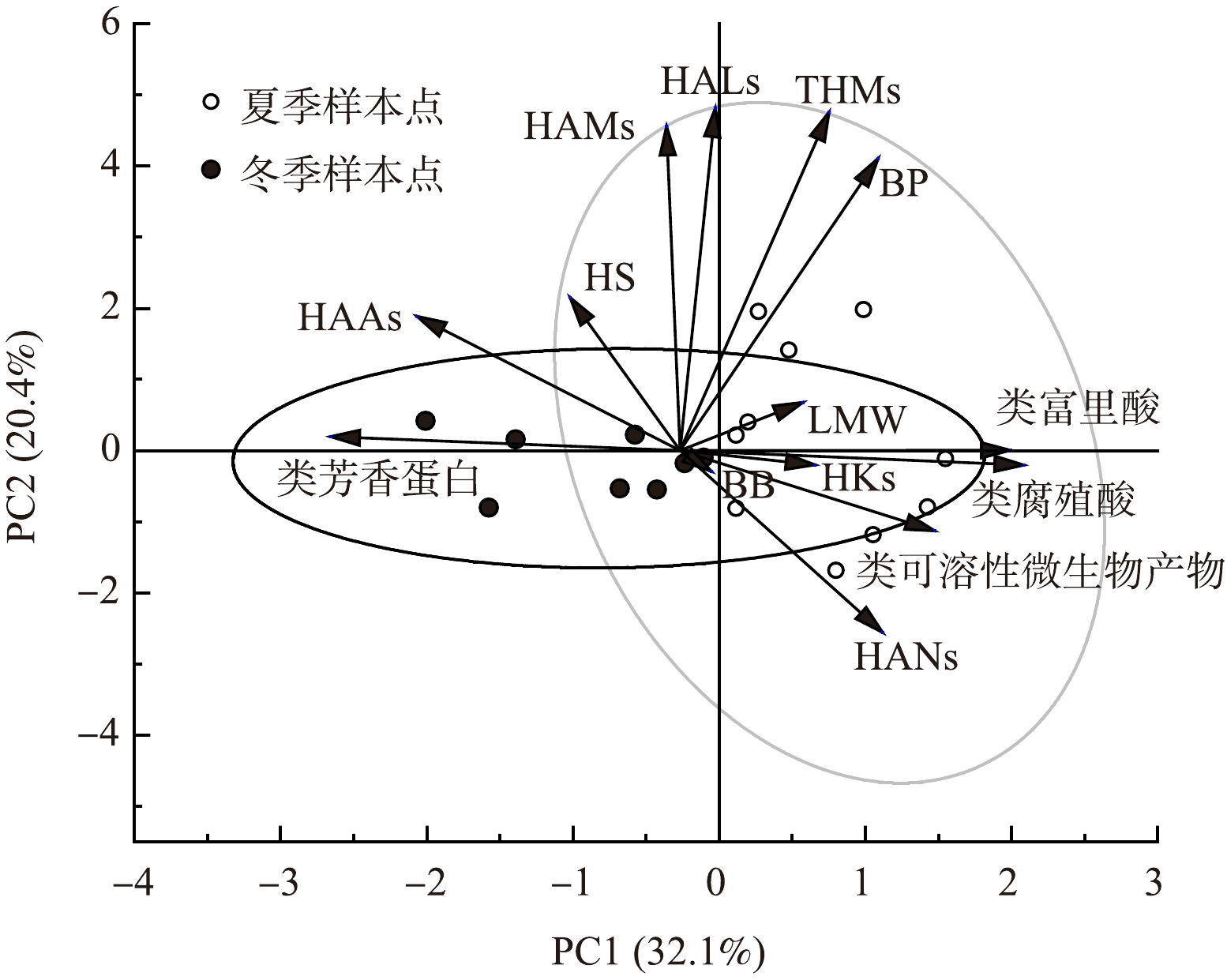
主成分分析是一种强大的统计方法,能够清晰且全面地揭示水样DOM特征的变化及其与DBPsFP的关系。在本研究中,PC1和PC2分别解释了整个数据集的32.1%和20.4%的方差。PC1的正负荷主要与EEMs中表征的类腐殖酸、类富里酸和类可溶性微生物产物组分关联,而其负负荷则主要与类芳香蛋白和HAAs相关。PC2的正负荷主要来自HALs、THMs、DCAM和BP组分,而负负荷主要与HANs相关。通过样本点在图6中的投射位置发现,冬季样本点PC1得分在−2.01~0.20,PC2得分在−0.81~0.42。相比之下,夏季样本点PC1得分在0.11~1.55,PC2得分在−1.69~1.99。HAAs成为冬季的特征DBPs,而N-DBPs、THMs和HKs在夏季更具有特异性。
在考察各变量间相关性时,发现主要生成的THMs和HAAs均与HS成正相关,说明HS是DBPs形成的主要前体物[35]。HS组分主要包括腐殖酸和黄腐酸,呈疏水性,含有丰富的芳香碳、酚类结构和共轭双键[36]。与THMs相比,HAAs前体疏水性更强且芳香碳含量更高[36-37],所以HAAs生成量与HS组分相关性更高。此外,THMs与BP组分也呈现高度正相关性。BP组分包含脂肪族蛋白和氨基酸等物质[30,38],脂肪族BP是THMs的主要前体[39],氨基酸易与氯反应先生成不稳定中间体DCAN后转化为稳定的THMs[40]。然而,三维荧光表征的组分并未显示出良好的规律性特征,可能因样品中有机物结构的影响,或是三维荧光光谱仅能表征具有荧光特性的有机物,有一定的局限性。这也再次证明在有机物预测方面,基于HPSEC-OCD组分的精度比基于EEMs组分的更高,适应性更广[41]。
-
1)本研究所考察水样中的DOM具有较强的内源性,主要包含类富里酸和类芳香蛋白成分,夏季由于生物代谢活动的增强,类可溶性微生物产物组分的荧光体积占比明显高于冬季。
2)长距离调水工程可在总体上保证水质稳定及良好性,为沿线受水区提供优质水源,有效保障了沿线受水区供水安全。HS组分占总有机碳60%以上,水处理厂可以主要通过混凝工艺进行去除,还可以增设臭氧氧化等预氧化工艺来提升其生物降解性,防止它在供水系统中形成生物膜。夏季因微生物活动增强,大分子BP组分导致水质轻微波动。受水区水厂需特别注意膜处理工艺中BP组分增加可能引发的膜堵塞等问题。
3)季节因素对水样中DBPs的生成有显著影响,夏季DBPsFP总质量浓度显著高于冬季。其中,THMs的生成量和占比在夏季更高,而HAAs则呈相反的趋势,生成量和占比都在夏季更低。
4) PCA分析反映出冬季和夏季水样有机物特征存在差异性,HAAsFP与HS组分呈正相关,THMsFP与BP组分的关联性更高。相比EEMs表征,HPSEC-OCD所表征的组分与DBPsFP相关性更好,这可能与样品中有机物的结构复杂性和荧光光谱技术的局限性有关。
长距离调水水源中溶解性有机物特征及消毒副产物生成势的变化解析
Characteristics of dissolved organic matter in the long-distance water diversion source and analysis of changes in disinfection by-products formation potential
-
摘要: 水体中溶解性有机物(dissolved organic matter, DOM)是消毒副产物的重要前体物,本研究考察了季节变化对长距离输水干渠中DOM特征及消毒副产物生成势(disinfection by-products formation potential, DBPsFP)的影响。发现类芳香蛋白和类富里酸是主要荧光类物质,而夏季类可溶性微生物产物组分的比例显著上升,且自生源指标表明夏季样本具有更强的内源特性。体积排阻色谱耦合有机碳检测器(high-performance size exclusion chromatography coupled with an organic carbon detector, HPSEC-OCD)分析显示输水过程中水质稳定,腐殖质(humic substances, HS)组分在总有机碳中所占比例超过60%,而分子质量大于20 kDa的生物大分子聚合体(biopolymers, BP)在夏季有所增加。不同季节DOM的氯反应活性也不同,夏季反应性更强,导致更高的DBPsFP。夏季温度升高,间接促进浮游生物繁殖和微生物活动,进而改变了DOM的组成结构和反应性。此外,由于HPSEC-OCD几乎可以表征所有类型的有机碳,因此它所表征的组分与DBPsFP的相关性更好,其中三卤甲烷生成势与BP组分呈高度正相关,卤乙酸生成势则与HS组分关联更紧密。了解DOM的时空变化特征及其与DBPsFP的相互关系,将有助于更好地优化水处理方法以获得更稳定的水质。Abstract: Dissolved organic matter (DOM) in water bodies serves as a crucial precursor for the formation of disinfection by-products (DBPs). This study investigates the impact of seasonal changes on the characteristics of dissolved organic matter (DOM) and the formation potential of disinfection by-products (DBPsFP) in the trunk canal of the long-distance water transfer. It was found that aromatic protein-like and fulvic acid-like substances are the predominant fluorescent materials, with a significant increase in the proportion of soluble microbial product-like components in the summer, and the biogenic index indicates stronger endogenous characteristics in the summer samples. Analysis using High-Performance Size Exclusion Chromatography coupled with an Organic Carbon Detector (HPSEC-OCD) shows that water quality is stable during the transfer process, with humic substances (HS) accounting for over 60% of the total organic carbon, and an increase in biopolymers (BP) with molecular weights greater than 20 kDa during the summer. The chlorination reactivity of DOM varies with the season, being higher in the summer, which leads to the increased total DBPsFP. The rise in temperature during summer indirectly promotes the proliferation of plankton and microbial activity, thereby altering the composition and reactivity of DOM. Moreover, since HPSEC-OCD can characterize nearly all types of organic carbon, the components it represents correlate better with DBPsFP. Specifically, the formation potential of trihalomethanes shows a high positive correlation with BP components, while the formation potential haloacetic acids is more closely related to HS components. Understanding the spatiotemporal characteristics of DOM and its relationship with DBPsFP will aid in optimizing water treatment methods to achieve more stable water quality.
-

-
表 1 22种目标DBPs的相关信息
Table 1. Information about 22 target DBPs
消毒副产物 中文名称 英文名称 缩写 卤乙酸
(HAAs)氯乙酸 chloroacetic acid CAA 二氯乙酸 dichloroacetic acid DCAA 三氯乙酸 trichloroacetic acid TCAA 溴乙酸 bromoacetic acid BAA 二溴乙酸 dibromoacetic acid DBAA 溴氯乙酸 bromochloroacetic acid BCAA 三卤甲烷
(THMs)三氯甲烷 trichloromethane TCM 三溴甲烷 tribromomethane TBM 二溴一氯甲烷 dibromochloromethane DBCM 一溴二氯甲烷 bromodichloromethane BDCM 碘代三卤甲烷
(I-THM)三碘甲烷 triiodomethane TIM 卤代酮(HKs) 氯丙酮 chloropropanone CP 1,1,1-三氯丙酮 1,1,1-trichloropropanone 1,1,1-TCP 1,1,3-三氯丙酮 1,1,3-trichloropropanone 1,1,3-TCP 卤代醛
(HALs)二氯乙醛 dichloroacetaldehyde DCAL 三氯乙醛 trichloroacetaldehyde TCAL 卤乙腈
(HANs)三氯乙腈 trichloroacetonitrile TCAN 二氯乙腈 dichloroacetonitrile DCAN 溴乙腈 bromoacetonitrile BAN 二溴乙腈 dibromoacetonitrile DBAN 碘乙腈 iodoacetonitrile IAN 卤乙酰胺(HAM) 二氯乙酰胺 dichloroacetamide DCAM -
[1] HER N, AMY G, MCKNIGHT D, et al. Characterization of DOM as a function of MW by fluorescence EEM and HPLC-SEC using UVA, DOC, and fluorescence detection[J]. Water Research, 2003, 37(17): 4295-4303. doi: 10.1016/S0043-1354(03)00317-8 [2] AVŞAR E, TORÖZ İ. Seasonal determination and investigation of disinfection by product formation potentials (DBPFPs) of surface waters, İstanbul Ömerli and Büyükçekmece case study[J]. Anadolu Ü niversitesi Bilim Ve Teknoloji Dergisi - B Teorik Bilimler, 2018, 6(1): 22-35. [3] AWAD J, VAN LEEUWEN J, CHOW C W K, et al. Seasonal variation in the nature of DOM in a river and drinking water reservoir of a closed catchment[J]. Environmental Pollution, 2017, 220: 788-796. doi: 10.1016/j.envpol.2016.10.054 [4] AVSAR E, TOROZ I, HANEDAR A. Physical characterisation of natural organic matter and determination of disinfection by-product formation potentials in Istanbul surface waters[J]. Fresenius Environmental Bulletin, 2015, 24(9). [5] ZHOU H, TIAN L, NI M, et al. Effect of dissolved organic matter and its fractions on disinfection by-products formation upon karst surface water[J]. Chemosphere, 2022, 308: 136324. doi: 10.1016/j.chemosphere.2022.136324 [6] VILLANUEVA C M, CORDIER S, FONT-RIBERA L, et al. Overview of disinfection by-products and associated health effects[J]. Current Environmental Health Reports, 2015, 2(1): 107-115. doi: 10.1007/s40572-014-0032-x [7] LI X F, MITCH W A. Drinking water disinfection byproducts (DBPs) and human health effects: Multidisciplinary challenges and opportunities[J]. Environmental Science & Technology, 2018, 52(4): 1681-1689. [8] XUE C, YU Y, HUANG X. Comparison of organic matter properties and disinfection by-product formation between the typical groundwater and surface water[J]. Water, 2022, 14(9): 1418. doi: 10.3390/w14091418 [9] BOND T, GOSLAN E H, PARSONS S A, et al. Treatment of disinfection by-product precursors[J]. Environmental Technology, 2011, 32(1): 1-25. doi: 10.1080/09593330.2010.495138 [10] HU C Y, ZHU H Z, LIN Y L, et al. Dissolved organic matter fractions and disinfection by-product formation potential from major raw waters in the water-receiving areas of south-to-north water diversion project, China[J]. Desalination and Water Treatment, 2015, 56(6): 1689-1697. doi: 10.1080/19443994.2014.953211 [11] WANG X, TONG Y, CHANG Q, et al. Source identification and characteristics of dissolved organic matter and disinfection by-product formation potential using EEM-PARAFAC in the Manas River, China[J]. RSC Advances, 2021, 11(46): 28476-28487. doi: 10.1039/D1RA03498G [12] ZHANG J, YU J, AN W, et al. Characterization of disinfection byproduct formation potential in 13 source waters in China[J]. Journal of Environmental Sciences, 2011, 23(2): 183-188. doi: 10.1016/S1001-0742(10)60440-8 [13] MAQBOOL T, LI C, QIN Y, et al. A year-long cyclic pattern of dissolved organic matter in the tap water of a metropolitan city revealed by fluorescence spectroscopy[J]. Science of the Total Environment, 2021, 771: 144850. doi: 10.1016/j.scitotenv.2020.144850 [14] LIU Y, YE Q, HUANG W L, et al. Spectroscopic and molecular-level characteristics of dissolved organic matter in the Pearl River Estuary, South China[J]. Science of the Total Environment, 2020, 710: 136307. doi: 10.1016/j.scitotenv.2019.136307 [15] ZHANG Y, ZHANG N, ZHAO P, et al. Characteristics of molecular weight distribution of dissolved organic matter in bromide-containing water and disinfection by-product formation properties during treatment processes[J]. Journal of Environmental Sciences, 2018, 65: 179-189. doi: 10.1016/j.jes.2017.03.013 [16] RIBAU TEIXEIRA M, ROSA S M, SOUSA V. Natural organic matter and disinfection by-products formation potential in water treatment[J]. Water Resources Management, 2011, 25(12): 3005-3015. doi: 10.1007/s11269-011-9795-0 [17] FERNÁNDEZ-PASCUAL E, DROZ B, O’DWYER J, et al. Fluorescent dissolved organic matter components as surrogates for disinfection byproduct formation in drinking water: A Critical Review[J]. ACS ES& T Water, 2023, 3(8): 1997-2008. [18] MAQBOOL T, QIN Y, LY Q V, et al. Exploring the relative changes in dissolved organic matter for assessing the water quality of full-scale drinking water treatment plants using a fluorescence ratio approach[J]. Water Research, 2020, 183: 116125. doi: 10.1016/j.watres.2020.116125 [19] NONG X, SHAO D, SHANG Y, et al. Analysis of spatio-temporal variation in phytoplankton and its relationship with water quality parameters in the South-to-North Water Diversion Project of China[J]. Environmental Monitoring and Assessment, 2021, 193(9): 593. doi: 10.1007/s10661-021-09391-6 [20] NONG X, SHAO D, ZHONG H, et al. Evaluation of water quality in the South-to-North Water Diversion Project of China using the water quality index (WQI) method[J]. Water Research, 2020, 178: 115781. doi: 10.1016/j.watres.2020.115781 [21] XU Y, LIN J, LEI X, et al. Assessment of the spatiotemporal water quality variations in the Middle Route of China’s South-to-North Water Diversion Project by multivariate analysis[J]. Environmental Science and Pollution Research, 2023, 30(15): 44206-44222. doi: 10.1007/s11356-022-25115-w [22] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation−emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [23] 韩港胜, 侯嫔, 储文斌, 等. 水源水Fe(Ⅵ)与Mn(Ⅶ)预氧化对天然有机物的组成特征及消毒副产物生成势的影响[J]. 环境化学, 2023. DOI: 10.7524/j.issn.0254-6108.2022092904. [24] ZUO Y T, CHENG S, JIANG H H, et al. Release and removal of algal organic matter during prechlorination and coagulation treatment of cyanobacteria-laden water: Are we on track?[J]. Science of the Total Environment, 2022, 824: 153793. doi: 10.1016/j.scitotenv.2022.153793 [25] WU S, DONG H, ZHANG L, et al. Formation characteristics and risk assessment of disinfection by-products in drinking water in two of China’s largest basins: Yangtze River basin versus Yellow River basin[J]. ACS ES&T Water, 2023[2023-12-21].https://doi.org/10.1021/acsestwater.3c00355. [26] XU L, HU Q, JIAN M, et al. Exploring the optical properties and molecular characteristics of dissolved organic matter in a large river-connected lake (Poyang Lake, China) using optical spectroscopy and FT-ICR MS analysis[J]. Science of the Total Environment, 2023, 879: 162999. doi: 10.1016/j.scitotenv.2023.162999 [27] 申钊颖, 弓晓峰, 江良, 等. 利用荧光区域积分法解析鄱阳湖DOM组成及来源[J]. 环境科学与技术, 2019, 42(5): 196-203. [28] WANG Z, WU Z. Distribution and transformation of molecular weight of organic matters in membrane bioreactor and conventional activated sludge process[J]. Chemical Engineering Journal, 2009, 150(2-3): 396-402. doi: 10.1016/j.cej.2009.01.018 [29] HUBER S A, BALZ A, ABERT M, et al. Characterisation of aquatic humic and non-humic matter with size-exclusion chromatography – organic carbon detection – organic nitrogen detection (LC-OCD-OND)[J]. Water Research, 2011, 45(2): 879-885. doi: 10.1016/j.watres.2010.09.023 [30] TRAN N H, NGO H H, URASE T, et al. A critical review on characterization strategies of organic matter for wastewater and water treatment processes[J]. Bioresource Technology, 2015, 193: 523-533. doi: 10.1016/j.biortech.2015.06.091 [31] QUANG V L, CHOI I, HUR J. Tracking the behavior of different size fractions of dissolved organic matter in a full-scale advanced drinking water treatment plant[J]. Environmental Science and Pollution Research, 2015, 22(22): 18176-18184. doi: 10.1007/s11356-015-5040-3 [32] KIMURA K, TANAKA K, WATANABE Y. Microfiltration of different surface waters with/without coagulation: Clear correlations between membrane fouling and hydrophilic biopolymers[J]. Water Research, 2014, 49: 434-443. doi: 10.1016/j.watres.2013.10.030 [33] UYAK V, OZDEMIR K, TOROZ I. Seasonal variations of disinfection by-product precursors profile and their removal through surface water treatment plants[J]. Science of the Total Environment, 2008, 390(2/3): 417-424. [34] LI A, ZHAO X, MAO R, et al. Characterization of dissolved organic matter from surface waters with low to high dissolved organic carbon and the related disinfection byproduct formation potential[J]. Journal of Hazardous Materials, 2014, 271: 228-235. doi: 10.1016/j.jhazmat.2014.02.009 [35] NGUYEN H V M, TAK S, HUR J, et al. Fluorescence spectroscopy in the detection and management of disinfection by-product precursors in drinking water treatment processes: A review[J]. Chemosphere, 2023, 343: 140269. doi: 10.1016/j.chemosphere.2023.140269 [36] HUA G, RECKHOW D A. Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size[J]. Environmental Science & Technology, 2007, 41(9): 3309-3315. [37] LIANG L, SINGER P C. Factors influencing the formation and relative distribution of haloacetic acids and trihalomethanes in drinking Water[J]. Environmental Science & Technology, 2003, 37(13): 2920-2928. [38] HUA L C, LIN J L, CHEN P C, et al. Chemical structures of extra- and intra-cellular algogenic organic matters as precursors to the formation of carbonaceous disinfection byproducts[J]. Chemical Engineering Journal, 2017, 328: 1022-1030. doi: 10.1016/j.cej.2017.07.123 [39] HIDAYAH E N, CHOU Y C, YEH H H. Using HPSEC to identify NOM fraction removal and the correlation with disinfection by-product precursors[J]. Water Supply, 2016, 16(2): 305-313. doi: 10.2166/ws.2015.139 [40] WESTERHOFF P, MASH H. Dissolved organic nitrogen in drinking water supplies: a review[J]. Journal of Water Supply:Research and Technology-Aqua, 2002, 51(8): 415-448. doi: 10.2166/aqua.2002.0038 [41] HIDAYAH E N, CHOU Y C, YEH H H. Comparison between HPSEC-OCD and F-EEMs for assessing DBPs formation in water[J]. Journal of Environmental Science and Health, Part A, 2017, 52(4): 391-402. doi: 10.1080/10934529.2016.1262607 -



 下载:
下载: