-
地下水具有优良的水源储备,是重要的淡水来源[1],目前全世界有超过50%的地下水被用于满足日常生产和生活所需[2]。随着全球经济以及工农业的迅速发展,地下水污染已经成为全球共性的地下水环境问题[3],引起了世界范围的广泛关注,地下水污染修复成为当今环境领域研究的一个热点问题。原位化学氧化(in-situ chemical oxidation, ISCO)因其处理成本低、对污染物去除效率高以及修复速率快而成为地下水污染修复的主流方式之一[4-5],过硫酸盐具有强氧化性、水溶性、稳定性、pH适用范围广、产生的自由基寿命长且成本低的特点[6-8],因此是降解地下水污染物的优选氧化剂。传统原位氧化技术直接注入氧化剂,对污染物缺乏有效选择性,无法长时间持续输送氧化剂,从而导致修复稳定性差,药剂反扩散,污染物修复出现浓度拖尾、反弹等问题,甚至造成二次污染[9]。采用缓释技术制备缓释氧化剂,可以控制氧化剂的释放速度,长时间维持氧化环境,减少氧化剂的非靶向性消耗,从而提高化学氧化修复的效率。KAMBHU等[10]制备石蜡-过硫酸钠缓释材料,以Fe2+为过硫酸盐活化剂处理苯甲酸和BTEX化合物,7 d内污染物的降解率达到90%。EVANS等[11]制备了石蜡-过硫酸钠缓释材料,在无催化剂添加的条件下,修复208 d后污染场地中二恶烷和氯化溶剂的去除率达到99%。TANG等[12]以壳聚糖和尿素为骨架材料,制备了过硫酸盐缓释材料,在Fe2+催化作用下,24 h内芘的去除率达到90.53%。以上研究结果证明,过硫酸盐缓释氧化剂在降解一些难降解有机污染物方面表现出良好的效果,并具有长效持续修复效果。
国内外研究者对可持续释放过硫酸盐的系统进行了研究,目前常用的主要有两种形式一种是用薄膜涂覆试剂[12-14],而另一种则是将试剂直接混合到惰性基质中,通过基质的孔隙使药剂不断扩散释放到地下水中[15-18]。然而,通过基质孔隙扩散的方式由于其自身结构特性,增加了释放前后材料形变的可能,且在整个缓释过程中缓释速率不稳定,导致材料使用寿命缩短,或在一定环境条件下出现过硫酸盐渗漏的情况,降低了过硫酸盐的利用效率。若能在原本的缓释材料外层再覆一层拥有不同渗透性的包覆材料,就可在保持缓释材料原本形态的同时,又维持过硫酸盐在整个释放周期的稳定释放,延长了缓释材料的使用寿命,提高药剂利用率。过硫酸盐降解污染物通常需要进行活化,碳材料是常用的活化材料之一。生物炭因具有丰富的官能团、稳定性强、比表面积大、阴阳离子交换能力强又符合低成本和环保要求等优点[19],被认为是碳材料活化过硫酸盐有前途的替代品。然而原始生物炭比表面积有限,需要改进生物炭的物理化学性质,提高生物炭的比表面积和官能团数量。在铁改性生物炭中掺杂氮元素,可以在生物炭表面引入了含氮基团、产生局部不成对电子,弥补铁改性生物炭在使用中,因产生铁氧化物阻塞孔隙结构或者占据活性位点,导致活化效率降低的可能[20]。因此,铁氮共掺杂生物炭具有引入更大表面积、更多官能团和磁性组分的优点,是改性生物炭良好的选择。
抗生素作为一种新污染物,已在地下水中被广泛检出。抗生素进入环境会对微生物生态产生影响,产生抗性基因,乃至威胁人类健康,而地下水作为重要的饮用水源,其抗生素污染问题不容忽视[21]。调查显示,地下水中检出频率较高的抗生素为诺氟沙星、氧氟沙星、磺胺甲恶唑、恩诺沙星、磺胺嘧啶、红霉素等[22-23]。因此,本研究选取磺胺甲恶唑(sulfamethoxazole, SMZ)为目标污染物,采用融化注模成型法制备了以聚己内酯(polycaprolactone, PCL)为基质、二氧化硅为制孔剂的双包覆型过硫酸盐缓释氧化材料;通过静态释放实验,研究了内外层材料的组分配比及外层材料的厚度对于过硫酸盐缓释材料缓释行为的影响;通过批降解实验,评估了双包覆型过硫酸盐缓释材料对SMZ的降解效果。
-
过硫酸钠(Na2S2O8,分析纯)、碘化钾(KI,分析纯)、碳酸氢钠(NaHCO3,分析纯,)、二氧化硅(SiO2,分析纯)、聚己内酯(PCL)、甲醇(CH3OH,分析纯)、磺胺甲恶唑(C10H11N3O3S,98%)、冰醋酸(CH3COOH,分析纯)、乙腈(CH3CN,色谱纯)、七水合硫酸亚铁(FeSO4·7H2O,分析纯)、尿素(CH4N2O,分析纯)、抗坏血酸(C6H8O6,分析纯)、叔丁醇(C4H10O,分析纯)、乙醇(C2H5OH,分析纯)、糠醇(C5H6O2,分析纯)。
-
超高效液相色谱(Waters:ACQUITY-UPLC);紫外可见分光光度计(722型,上海光谱仪器有限公司);数显恒温磁力搅拌器(79-1A,天津鑫博得仪器有限公司);扫描电镜(SEM,Hitachi SU3500);pH计(Phs-3c,上海雷磁有限公司);超声波清洗器(KQ-300DE型,昆山市超声仪器有限公司)。
-
1)缓释材料的制备。称取一定量的PCL于烧杯中,使用恒温磁力搅拌器加热至70 ℃,待PCL完全融化后加入预先称量的硅砂用玻璃棒搅拌均匀,再加入一定质量Na2S2O8粉末,搅拌均匀,趁热倒入模具中,室温冷却成型后脱模取出,即获得双包覆型过硫酸钠缓释材料的内层部分。制备了边长为1 cm和1.3 cm两种规格不同的正方体缓释材料的内层部分。外层是由PCL、硅砂按照不同比例配制的包覆层,外层材料的厚度可通过使用不同边长的正方体模具来控制,将硅砂、PCL混合后在恒温磁力搅拌条件下加热至70 ℃,得混合材料,用其将所得内层材料包裹,在模具中凝固定型,即得双包覆型过硫酸盐缓释材料,如图1所示。双包覆型过硫酸盐缓释材料的比例及外层厚度如表1所示。
2)铁氮共掺杂生物炭(Fe@N-BC)的制备。将七水硫酸亚铁、尿素和抗坏血酸溶解在去离子水中,然后加入荷叶粉混合并反应完全,离心,真空冷冻干燥,再置于管式炉在900 ℃温度下烧制2 h,得铁氮共掺杂生物炭(Fe@N-BC),合成材料中荷叶粉、七水硫酸亚铁、尿素、抗坏血酸的质量分别为3、5.56、3、2.5 g。
-
1)静态释放实验。将制备的过硫酸盐缓释材料分别投入到装有200 mL超纯水的锥形瓶中,密封置于室温(25±1) ℃下缓释21 d,在不同的时间点取0.1 mL浸出样于10 mL比色管中,采用碘化钾比色法[24](在样品溶液中加入0.05 g NaHCO3和1 g KI定容至10 mL刻度线后反应约15 min),用可见分光光度计在352 nm波长条件下测定吸光度,绘制标准曲线,测定取样点吸光度并计算出相应的过硫酸盐浓度。每组设计3个平行实验,每个锥形瓶投加1颗缓释剂。
2)降解实验。配制一系列质量浓度为1 mg·L−1的SMZ溶液,用0.1 mol·L−1的H2SO4和NaOH调节溶液pH分别为3、5、7、9,并配置初始质量浓度为5 mg·L−1和10 mg·L−1 pH=3的SMZ溶液,在反应体系中各加入0.03 g Fe@N-BC,投入1颗双包覆型缓释材料,静置反应48 h,间隔一定时间取样,在样品溶液中加入甲醇淬灭。使用超高效液相色谱分析样品中SMZ浓度,UPLC的测试条件为:色谱柱BEH C18(1.7 µm 2.1×100 mm Column),流动相为1%乙酸∶乙腈=70∶30,流速0.1 mL·min−1,检测波长270 nm。
-
为了进一步分析过硫酸盐缓释材料的释放机制,使用扫描电镜在放大40倍和500倍下,观察双包覆型缓释材料表面浸出前后的表面形貌和孔隙结构。
-
选择叔丁醇、乙醇、糠醇分别作为·OH、SO4−–和·OH、1O2的淬灭剂。取100 mL初始质量浓度为1 mg·L−1的SMZ溶液于250 mL的锥形瓶中,Fe@N-BC添加量为0.03 g,pH=3,淬灭剂添加量为100 mmol·L−1,分别在体系中加入1颗双包覆型过硫酸盐缓释材料,反应12 h研究在不同淬灭剂的存在下Fe@N-BC对SMZ的修复效果的影响。
-
1)不同内层材料配比过硫酸盐释放实验。制备了A1~A5 5组不同组分配比的边长为1.3 cm的正方体缓释材料,研究在没有外层包覆情况下的单层过硫酸盐缓释材料的缓释性能及特征。A1、A2、A3为过硫酸盐质量相同,但硅砂/PCL不同的缓释材料;A1、A4、A2、A5分别为硅砂/PCL相同但过硫酸盐质量比不同的缓释材料。图2为不同配比的单层材料中过硫酸盐的累计释放率。在缓释21 d后,A1、A2和A3组过硫酸盐累计释放率分别为55.41%、66.76%和83.13%,当过硫酸盐质量相同时,缓释材料的累计释放率随着硅砂/PCL的增大而增大;A1、A4和A2、A5组在第21天的过硫酸盐累计释放率分别为55.41%、72.19%和66.76%、82.21%,说明在固定硅砂/PCL的情况下,过硫酸盐累计释放率随着过硫酸盐质量的增加而增大。因此,可以通过调节硅砂/PCL的比例和过硫酸盐的添加量控制缓释材料的释放效率。由图2可见,单层过硫酸盐缓释材料随缓释时间增加过硫酸盐缓释率逐渐增加,整体呈现出初期释放速率快,后期释放较慢的特点,释放速率不均,这是单一型均匀缓释材料在研究过程中常见的弊端[25-26]。因此,后续开发了双层包覆型过硫酸盐缓释材料来弥补单层缓释材料的不足。
2)不同外层材料配比的双包覆型缓释材料的释放特征。由图2可知,后续实验内层材料配比为过硫酸盐:硅砂:PCL质量比为1∶3∶1.5。制备了B1~B6六组内层边长为1 cm、不同外层配比的双包覆型缓释材料,材料整体为边长1.5 cm的正方体结构(外层厚度为0.25 cm),考察了外层材料配比对双包覆型缓释材料的缓释效果及释放特征的影响。图3为在不同外层配比下双包覆型缓释材料的过硫酸盐累计释放率。缓释21 d后B1、B2、B3、B4组过硫酸盐累计释放率分别为0.98%、7.48%、35.52%、47.27%,B5、B6组在缓释11 d后过硫酸盐累计释放率为48.09%和54.88%。由图3可见,在外层厚度为0.25 cm时,外层硅砂/PCL≥5时双包覆型缓释材料虽与单层缓释材料相比过硫酸盐释放速率得到了一定的控制,但存在前期释放速率过快的问题;而当硅砂﹕PCL≤2时,由于外层渗透性能下降,导致双包覆型过硫酸盐缓释材料缓释性能变差;当2<硅砂﹕PCL<5时,外层材料在保持良好渗透性能的同时又能在调节过硫酸盐缓释速率方面起到较好的控制作用。因为,外层材料的存在阻隔了缓释材料表层过硫酸盐与溶液的直接接触,且外层材料渗透系数越大,内层材料中的过硫酸盐越容易与液体接触,内部溶解的过硫酸盐与缓释材料外部形成浓度差,从而扩散进入水溶液中[27-28]。因此,外层材料不同配比对内层过硫酸盐缓释材料释放速率的有着不同的调控效果。
3)不同外层厚度的双包覆型缓释材料释放特征。C1、B4、C3和C2、B3、C4为不同外层厚度的双包覆型缓释材料,图4为不同外层厚度的双包覆型缓释材料21 d后的过硫酸盐释放率,C1~C4组的过硫酸盐累计释放率分别为40.55%、58.93%、2.36%、23.47%。由此可见,在外层材料渗透性能相同的条件下,过硫酸盐溶解-扩散范围随着外层厚度的增加而增大,导致释放速率变慢。因此,外层材料可以通过改变配比及厚度改变缓释材料的渗透系数和扩散路径,起到调控内层过硫酸盐缓释速率的目的。
-
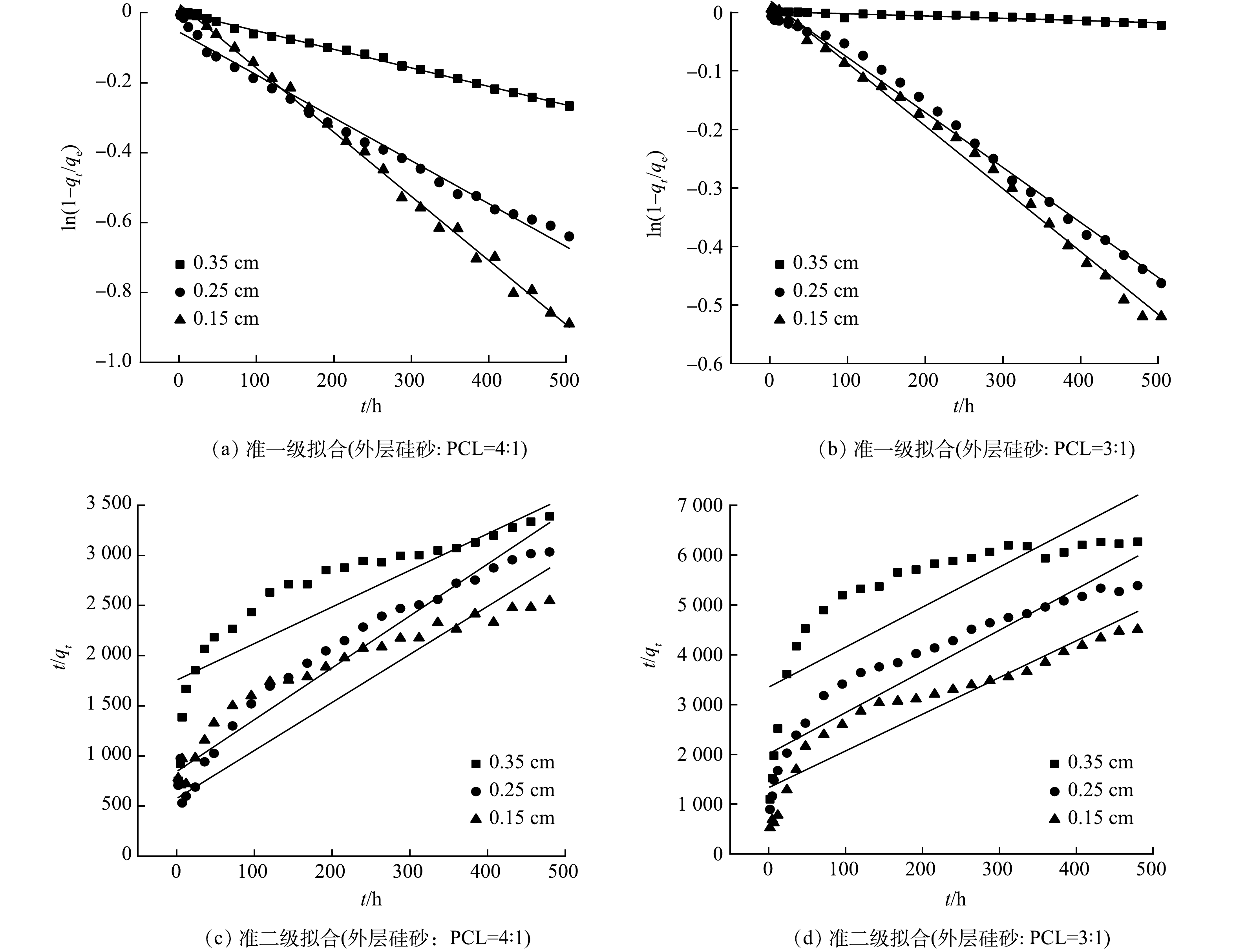
不同外层厚度和配比的双包覆型缓释材料中过硫酸盐的释放过程用零级(式(1))、准一级(式(2))、准二级(式(3))释放动力学方程进行拟合[29-30]。
式中:qe和qt分别为平衡时和t时刻的过硫酸盐释放量,g;k0为零级动力学方程的反应速率常数,min−1;k1为一级动力学方程的反应速率常数,g·(mg·min)−1;k2为二级动力学方程的反应速率常数,mg·(g·min1/2)−1; t为反应时间,min。
表2为外层不同厚度及不同配比的缓释材料在静态释放条件下的拟合参数。图5、图6分别为不同配比的双包覆型缓释材料释放曲线的零级动力学、准一级动力学和准二级动力学方程拟合曲线。由表2可见,无外层包覆的单层过硫酸盐缓释材料的释放动力学释放过程更符合准二级释放动力学的释放特征(R2=0.982 6);当有外层材料包覆的作用下,缓释材料释放特征向零级释放动力学靠近,过硫酸盐缓释速率几乎不随时间而变化,零级释放动力学速率常数k0随着外层厚度的增大和外层硅砂与PCL比例的减少而减小,说明外层厚度是影响双包覆型缓释材料释放速率的关键,同时双包覆型缓释材料的使用寿命也随之增大。
-
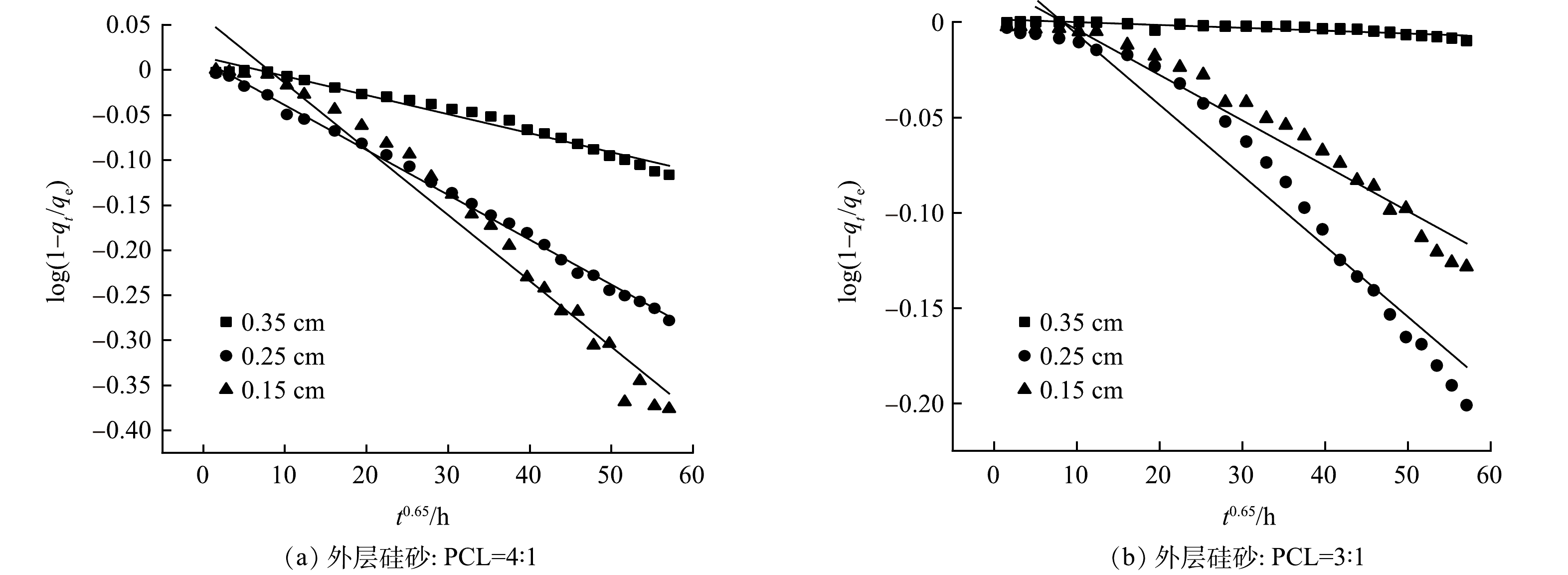
采用Bhasker模型(式(4))和Ritger-Peppas模型(式(5))分析双包覆型缓释材料不同外层配比及不同外层厚度的静态释放过程[28]。Bhasker模型可用于验证过硫酸盐在缓释材料内部的扩散是否是释放速率的控制步骤,当log(1−qt/qe)~t0.65线性相关性越高,则表明过硫酸盐在缓释材料的内部扩散是速率控制步骤。Ritger-Peppas模型可用来判别缓释型载体药物传输系统的释放机制,当扩散指数n<0.45时表示缓释材料释放机理为药物扩散行为,当n>0.89则表明缓释材料释放机理为基质的溶蚀行为,而当0.45<n<0.89时缓释材料的释放行为为药物扩散与基质溶蚀共同作用。
式中:qe和qt分别为平衡时和t时刻的过硫酸盐释放量,g;kB和kR分别为Bhasker及Rigter-Peppas模型释放动力学方程的释放速率常数;n为释放级数。
表3为外层不同厚度及不同配比的缓释材料在静态释放条件下Bhasker模型及Rigter-Peppas模型的拟合参数。图7和图8分别为外层硅砂∶PCL=4和硅砂∶PCL=3的双包覆型缓释材料的Bhasker和Rigter-Peppas模型拟合结果。由图7拟合结果可以看出log(1-qt/qe)~t0.65线性相关较好,说明过硫酸盐在双包覆型缓释材料内部扩散是扩散速率的控制步骤。Rigter-Peppas模型拟合n值随着外层厚度的增加而增大,表明随着外层厚度的增加过硫酸盐释放机理逐渐由过硫酸盐扩散与基质材料溶蚀共同作用转为以基质材料溶蚀为主。
-
为了进一步分析双包覆型过硫酸盐缓释材料的释放机制,采用扫描电子显微镜(Hitachi SU3500)对B4(内层材料配比为过硫酸钠∶硅砂∶PCL=1∶3∶1.5;外层为硅砂∶PCL=4∶1,厚度0.25 cm)缓释前和缓释10 d材料表面进行分析。
图9(a)和图9(b)分别为缓释前放大倍数40倍和500倍的SEM图,图9(c) 和图9(d)分别为缓释10 d后放大40倍和500倍的SEM图。可以看出,双包覆型过硫酸盐缓释材料在释放前表面较平整,孔隙较少;缓释之后材料表面出现较大孔隙结构,表面变粗糙。结合Ritger-Peppas方程拟合结果,进一步证实了双包覆型过硫酸盐缓释材料的释放过程是一个基质溶解-过硫酸盐扩散过程。
-
根据2.1中的研究结果,SMZ降解实验使用的缓释材料为B4(内层材料配比为过硫酸钠∶硅砂∶PCL=1∶3∶1.5;外层为硅砂∶PCL=4∶1,厚度0.25 cm)。
1)反应体系初始pH的影响。调节初始pH为3~9,考察在不同初始pH下过硫酸盐缓释材料降解SMZ的效果。由图10可见,随着pH的增大,在相同时间内SMZ的降解率降低,在pH=3和5时SMZ分别在12 h和36 h内降解率可达100%;而当pH=7和9时,反应48 h的降解率分别为96.47%和84.14%,降解完全所需时间随着pH的增大而增长。这一现象与S2O82-在不同酸碱条件下的氧化性有关,在酸性条件下S2O82-可与H+反应生成SO4−.,而新生成的SO4−.会继续与H2O反应生成·OH(式(6)~式(8)),从而促进过硫酸盐的活化[31];在碱性条件下SO4−.更易与OH−反应生成·OH(式(9)),·OH氧化电位低于SO4−.,除此之外碱性条件产生的Fe(OH)3沉淀会阻碍催化剂表面活性位点与过硫酸盐接触,从而降低了SMZ的降解速率[32-33]。
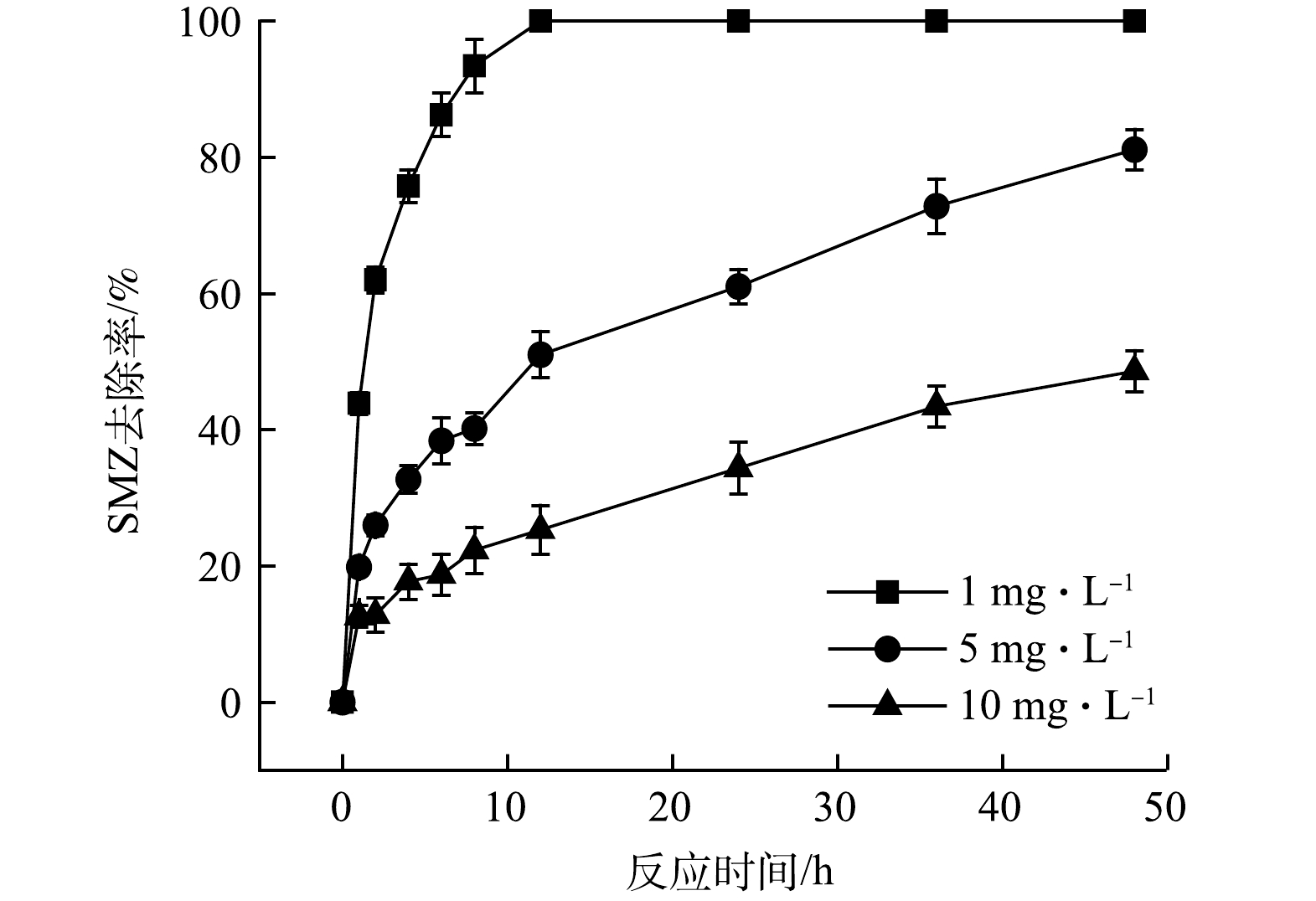
2)SMZ初始浓度的影响。图11为不同初始浓度SMZ对降解效果的影响情况。可见,在反应48 h后,初始质量浓度为5 mg·L−1和10 mg·L−1的SMZ的降解率分别为81.17%和48.59%。随着SMZ初始浓度的升高,在相同降解时间内SMZ的降解率有所降低,这是由于当SMZ的浓度较低时,双包覆型过硫酸盐缓释材料释放的S2O82-活化后产生的自由基足够用于去除体系中的SMZ,而随着SMZ浓度的进一步升高,缓释材料在相同时间内释放的S2O82-不足以将SMZ完全氧化降解,导致SMZ的降解率下降。为了避免过硫酸盐浪费或不足,在实际场地应用时可以根据场地污染物浓度,选择双包覆型缓释材料的配比或投加量。
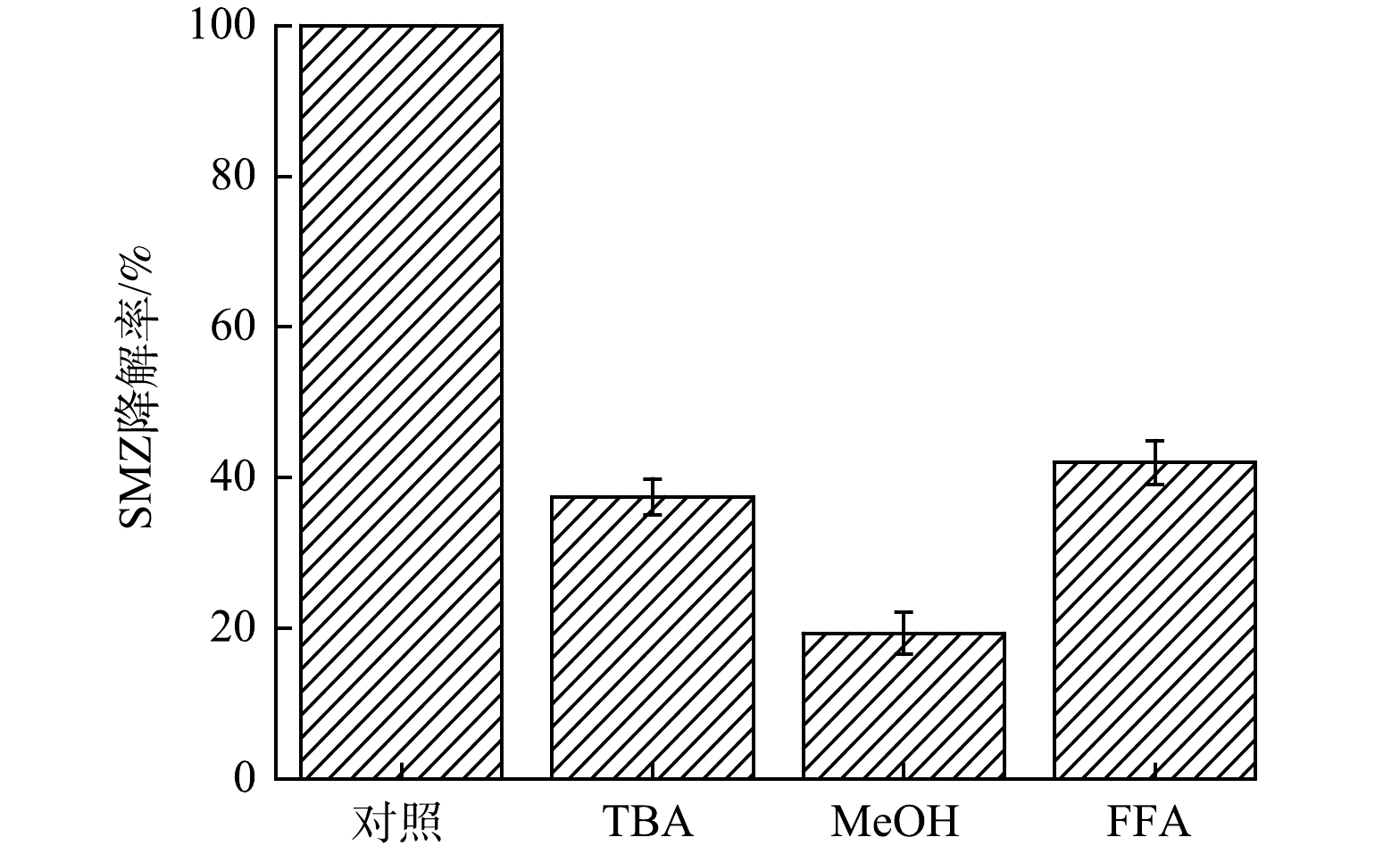
3)活性成分的测定。如图12所示,在添加100 mmol·L−1的TBA体系中,反应12 h后SMZ的降解率为37.46%,而在添加MeOH体系中SMZ的降解率为19.32%。这说明,在反应体系中同时存在–OH和SO4−–,二者均参与降解过程,通过对比可知,•OH在SMZ降解中占据主导地位。在加入FFA的体系中SMZ的降解率为42.02%,与未加淬灭剂的体系相比降解率显著降低,说明1O2在降解过程中同样起着重要作用。
-
1)内层缓释材料为过硫酸钠∶硅砂∶PCL=1∶3∶1.5用于双包覆型缓释材料的制备。双包覆型缓释材料与单层材料相比,在释放周期内可以维持较长时间的稳定释放,过硫酸盐累计释放率随时间几乎呈直线增长的趋势。在外层厚度相同的条件下,随着外层硅砂/PCL的增大渗透性能增加,释放前期释放速率随之增加,当外层硅砂/PCL=3~4时双包覆型缓释材料稳定释放效果较好。在外层配比相同的条件下,随着外层厚度的增大,缓释速率越慢,材料使用寿命也随之增加。
2)双包覆型过硫酸盐缓释材料与单层材料相比释放过程更符合零级动力学释放规律,在释放周期内稳定释放。通过不同放大倍数的扫描电镜分析以及缓释动力学方程拟合结果判断,双包覆型缓释材料在水中的释放原理主要是溶解扩散释放,并通过自身致密结构达到缓释目的。
3)使用Fe@N-BC活化释放的过硫酸盐降解SMZ时,反应体系的pH越大、SMZ初始浓度越高,反应降解速率越慢,反应达到降解平衡需要的时间越长,主要原因是由于体系pH影响生成的自由基类型以及体系中过硫酸根浓度。
双包覆型过硫酸盐缓释材料的制备及其对地下水中磺胺甲恶唑的去除
Preparation of a double-coated persulfate slow-release material for sulfamethoxazole removal from groundwater
-
摘要: 针对单层过硫酸盐缓释材料前期释放过快导致的缓释材料使用寿命缩短的问题,采用聚已内酯-硅砂为外层材料,对聚已内酯-硅砂-过硫酸钠组成的内层缓释材料进行包覆,制备了双包覆型过硫酸盐缓释材料。通过静态释放实验评估过硫酸盐缓释材料在有无外层材料包覆条件下的释放行为与机制;通过铁氮共掺杂生物炭(Fe@N-BC)活化释放的过硫酸盐考察其对地下水中的磺胺甲恶唑(SMZ)的降解效果。结果表明:双包覆型缓释材料与单层材料相比在释放周期内释放速率较稳定,且与单层缓释材料相比更符合零级释放动力学特征;在外层厚度为0.25 cm条件下,2<硅砂/聚已内酯(PCL)<5时,双包覆型缓释材料释放速率较稳定且释放性能较好,在缓释21 d之后,硅砂/PCL=3和4的双包覆型缓释材料缓释率分别为35.52%和47.27%;在外层硅砂/PCL相同条件下,双包覆型缓释材料的释放速率随着外层厚度的减小而增大,且最少可以保持21 d的稳定释放;降解实验结果显示,在pH=3的条件下SMZ去除速率最快,12 h内1 mg·L−1的SMZ去除率可达到100%,随着SMZ初始浓度的提高,降解完全所需时间增长。以上研究结果可为实现过硫酸盐持续稳定释放及去除实际地下水中SMZ提供参考依据。Abstract: To address the issue of shortened lifespan in single-layer persulfate slow-release materials due to rapid initial release, polycaprolactone-silica sand was taken as the outer-layer material, which covered on the inner-layer with a combination of sodium persulfate and polycaprolactone-silica sand, to synthesize a double-coated persulfate slow-release material. The static release experiments were used to evaluate the release behavior and mechanism of persulfate slow-release materials with or without the outer-layer material. Its performance on sulfamethoxazole (SMZ) degradation in groundwater was investigated through iron-nitrogen co-doped biochar (Fe@N-BC) activating persulfate released from the double-coated persulfate slow-release material. The results showed that the release rate of the double-coated persulfate slow-release material was more stable than that of the single-layer slow-release one over the release period, and the release kinetics of the former material were more fitted by zero-order release kinetics than the latter one. At an outer layer thickness of 0.25 cm and a silica sand/PCL ratios between 2 and 5, the release rate of the double-coated slow-release material was stable with an effective performance. After 21 days of slow release, the slow-release rates of the double-coated slow-release materials with sand /PCL ratios of 3 and 4 were 35.52% and 47.27%, respectively. At the same ratio of silica sand/PCL, the release rate of the double-coated slow-release material increased as the thickness of the outer layer decreased, and the stable release could maintain at least 21 days. At pH3, the highest SMZ degradation rate occurred, and the removal rate for 1 mg/L SMZ could reach 100% within 12 hours. As the initial concentration of SMZ increased, the time required for complete degradation also increased. The above study result could provide a reference for realizing the sustained and stable release of persulfate and removing SMZ in in groundwater.
-
Key words:
- persulfate /
- double-layer slow-release material /
- ground water /
- sulfamethoxazole
-

-
表 1 不同材料配比和外层厚度的缓释材料的质量配比
Table 1. Mass ratio of slow-release materials with different material ratio and outer-layer thickness
编号 内层材料配比 外层材料配比 外层厚度/cm 过硫酸钠∶硅砂∶PCL 硅砂∶PCL A1 1∶3∶3 — 0 A2 1∶3∶1.5 — 0 A3 1∶3∶1 — 0 A4 2∶3∶3 — 0 A5 2∶3∶1.5 — 0 B1 1∶3∶1.5 1∶1 0.25 B2 1∶3∶1.5 2∶1 0.25 B3 1∶3∶1.5 3∶1 0.25 B4 1∶3∶1.5 4∶1 0.25 B5 1∶3∶1.5 5∶1 0.25 B6 1∶3∶1.5 6∶1 0.25 C1 1∶3∶1.5 4∶1 0.35 C2 1∶3∶1.5 3∶1 0.35 C3 1∶3∶1.5 4∶1 0.15 C4 1∶3∶1.5 3∶1 0.15 表 2 缓释材料释放动力学拟合结果
Table 2. Fitting results of the release kinetics of slow-release materials
编号 零级动力学方程 准一级动力学方程 准二级动力学方程 k0/h−1 R2 k1/h−1 R2 K2/g−1·h−1 R2 A2 0.001 9 0.906 4 0.002 9 0.947 8 0.024 16 0.982 6 B3 0.000 8 0.998 4 0.001 0.998 3 0.032 8 0.882 2 B4 0.001 2 0.962 6 0.001 5 0.981 1 0.034 27 0.951 5 C1 0.000 5 0.997 0.000 6 0.994 6 0.007 8 0.768 9 C2 0.001 3 0.995 5 0.001 8 0.998 0.019 27 0.637 5 C3 0.000 03 0.943 3 0.000 03 0.942 5 0.040 89 0.904 1 C4 0.000 5 0.998 88 0.000 5 0.989 5 0.039 8 0.877 6 表 3 缓释材料Bhasker模型及Rigter-Peppas模型拟合结果
Table 3. The fitting results of Bhasker and Rigter-Peppas models for slow-release materials
编号 Bhasker模型 Ritger-Peppas模型 kB/(h−0.65) R2 kR/(g−1h−1) R2 n A2 0.009 1 0.979 5 0.125 9 0.978 5 0.488 9 B3 0.003 71 0.947 6 0.002 8 0.973 6 0.770 4 B4 0.004 98 0.996 7 0.008 78 0.965 1 0.664 3 C1 0.002 11 0.972 5 0.000 14 0.987 8 1.225 5 C2 0.000 15 0.827 7 0.000 564 0.982 1 1.151 3 C3 0.007 32 0.967 5 0.000 223 0.773 7 0.648 5 C4 0.002 38 0.950 6 0.000 558 0.854 0.965 -
[1] 牛娟婷. KMnO4缓释剂去除地下水中间氨基苯磺酸钠实验研究[D]. 北京: 中国地质大学, 2019. [2] DERMATAS D. Waste management and research and the sustainable development goals: focus on soil and groundwater pollution[J]. Waste Management & Research, 2017, 35(5): 453-455. [3] 赵崇凯. 生物炭活化过硫酸盐高级氧化体系修复苯酚污染地下水的研究[D]. 长春: 吉林大学, 2020. [4] LIU H Z, BRUTON T A, DOYLE F M, et al. In situ chemical oxidation of contaminated groundwater by persulfate: decomposition by Fe(III)-and Mn(IV)-containing oxides and aquifer materials[J]. Environmental Science & Technology, 2014, 48(17): 10330-10336. [5] MA Y, FENG Y, FENG Y L, et al. Characteristics and mechanisms of controlled-release KMnO4 for groundwater remediation: Experimental and modeling investigations[J]. Water Research, 2020, 171: 115385.1-115385.9. [6] 李坡, 蒲思淇, 李劲松, 等. 过硫酸钠缓释胶囊反应带修复苯胺污染地下水[J]. 中国环境科学, 2021, 41(12): 5718-5727. [7] 杨苑, 张倩, 彭昌盛, 等. 过硫酸钠缓释材料的释放性能及其对2, 4-二硝基甲苯的降解效果[J]. 环境科学研究, 2020, 33(3): 8. [8] 陈方义, 杨昱, 常明, 等. 过硫酸盐缓释材料释放性能及机理[J]. 环境科学研究, 2013, 26(9): 6. [9] O'CONNOR D, HOU D Y, OK Y S, et al. Sustainable in situ remediation of recalcitrant organic pollutants in groundwater with controlled release materials: A review[J]. Journal of Controlled Release, 2018, 283: 200-213. doi: 10.1016/j.jconrel.2018.06.007 [10] KAMBHU A, COMFORT S, CHOKEJAROENRAT C, et al. Developing slow-release persulfate candles to treat BTEX contaminated groundwater[J]. Chemosphere, 2012, 89(6): 656-664. doi: 10.1016/j.chemosphere.2012.06.004 [11] EVANS P J, DUGAN P, NGUYEN D, et al. Slow-release permanganate versus unactivated persulfate for long-term in situ chemical oxidation of 1, 4-dioxane and chlorinated solvents[J]. Chemosphere, 2019, 221: 802-811. doi: 10.1016/j.chemosphere.2019.01.075 [12] TANG X, YU C, LEI Y, et al. A novel chitosan-urea encapsulated material for persulfate slow-release to degrade organic pollutants[J]. Journal of Hazardous Materials, 2022, 426: 128083. doi: 10.1016/j.jhazmat.2021.128083 [13] WANG L L, LIU X. Sustained release technology and its application in environmental remediation: A review[J]. International Journal of Environmental Research and Public Health, 2019, 16: 2153. doi: 10.3390/ijerph16122153 [14] 王贞, 唐雪娇, 王翠苹, 等. 新型包膜型强化缓释氧化材料的制备及其缓释性能研究[J]. 南开大学学报(自然科学版), 2021, 54(3): 84. [15] LIANG C, CHEN C Y. Characterization of a sodium persulfate sustained release rod for in situ chemical oxidation groundwater remediation[J]. Industrial & Engineering Chemistry Research, 2017, 56(18): 5271-5276. [16] LIANG S H, KAO C M, KUO Y C, et al. In situ oxidation of petroleum-hydrocarbon contaminated groundwater using passive ISCO system[J]. water research, 2011, 45(8): 2496-2506. doi: 10.1016/j.watres.2011.02.005 [17] 王文丽. 以石蜡为载体缓释过硫酸盐在水溶液和砂孔介质的研究[D]. 长沙: 湖南大学, 2019. [18] PHAM P H, FEDERICO-PERZ R A, FINE K L, et al. Sustained release of persulfate from inert inorganic materials for groundwater remediation[J]. Chemosphere, 2020, 259: 127508. doi: 10.1016/j.chemosphere.2020.127508 [19] WANG J, WANG S. Preparation, modification and environmental application of biochar: A review[J]. Journal of Cleaner Production, 2019, 227: 1002-1022. doi: 10.1016/j.jclepro.2019.04.282 [20] MEI Y , XU J , ZHANG Y , et al. Effect of Fe7: 1002-1022. tal application of biochbiochars and their adsorption behavior on tetracycline removal from aqueous solution[J]. Bioresource Technology, 2021, 325(35): 124732. [21] JI Y F, FERRONATO C, SALVADOR A, et al. Degradation of ciprofloxacin and sulfamethoxazole by ferrous-activated persulfate: implications for remediation of groundwater contaminated by antibiotics[J]. Science of the Total Environment, 2014, 472(feb.15): 800-808. [22] ZHANG K J, LUO Z, ZHANG T Q, et al. Degradation effect of sulfa antibiotics by potassium ferrate combined with ultrasound (Fe(Vi)-Us)[J]. Biomed Research International, 2015, 169215. [23] 席慕凡. 铁氮共掺杂生物炭活化过硫酸盐降解诺氟沙星的研究[D]. 合肥: 合肥工业大学, 2021. [24] LIANG C, HUANG C F, MOHANTY N, et al. A rapid spectrophotometric determination of persulfate anion in ISCO[J]. Chemosphere, 2008, 73(9): 1540-1543. doi: 10.1016/j.chemosphere.2008.08.043 [25] 曾秋生, 苑宝玲, 李飞, 等. 复合型高锰酸钾缓释体的制备及其缓释性能研究[J]. 环境科学学报, 2013, 33(5): 1249-1255. [26] 李宝城, 艾慧颖, 陈晨, 等. 高锰酸钾凝胶缓释剂的制备及其缓释去氯乙烯[J]. 环境科学学报, 2022(8): 42. [27] 王金. 高锰酸钾缓释型氧化剂的制备与释放性能研究[D]. 长春: 吉林大学, 2012. [28] 杨昱, 徐祥健, 韩旭, 等. 双层包覆型缓释材料中过硫酸盐释放性能研究[J]. 环境科学研究, 2020, 33(3): 652-658. [29] 耿丽娜, 张茹, 李文新, 等. 纳米柠檬酸铁脂质体的体外降解及释放研究[J]. 河北师范大学学报(自然科学版), 2020, 44(3): 243-250. [30] 朱雪强, 花港, 周来, 等. 强蜡烛”型过硫酸盐缓释材料释放行为与机制[J]. 中国环境科学, 2023, 43(2): 601-609. [31] LIANG C J, WANG Z S, BRUELL C J. Influence of ph on persulfate oxidation of tce at ambient temperatures[J]. Chemosphere, 2007, 66(1): 106-113. doi: 10.1016/j.chemosphere.2006.05.026 [32] HE J, XIAO Y, TANG J C, et al. Sun. Persulfate activation with sawdust biochar in aqueous solution by enhanced electron donor-transfer effect[J]. Science of the Total Environment, 2019, 690: 768-777. doi: 10.1016/j.scitotenv.2019.07.043 [33] 汪虹西, 廖兵, 卢涛, 等. 零价铁-生物炭复合材料对地下水中硝酸盐的去除[J]. 环境工程学报, 2020, 14(12): 3317-3328. -




 下载:
下载: