-
葡萄酒产业是宁夏回族自治区“六特”产业之一,贺兰山东麓地区酿酒葡萄基地规模将达到6.67×108 m2,位居全国酒庄酒产量第一[1]。然而,葡萄酒生产过程会伴随大量有机废水的生成,每生产1 L葡萄酒可产生2~6 L废水[2]。据调查,该地区约93.1%的酒庄规模小于1 500 t·a−1,其中55.7%的酒庄采用厌氧消化法处理葡萄酒生产废水[3]。而葡萄酒生产废水由于其低pH、高有机浓度和季节性生产(主要集中在9—11月)的特点导致在单一消化时易出现快速酸化、不稳定和运行管理不便等问题,其限速步骤主要为产甲烷阶段。同时,宁夏回族自治区城镇污水处理厂的剩余污泥产量在2019年已达到6.8×104 t,其中含有大量难降解的有机物、重金属和病原体等有毒有害物质[4],可通过厌氧消化实现剩余污泥的无害化和资源化。但是剩余污泥厌氧消化存在水解效率低、甲烷产量不足等问题,水解阶段是限速步骤,其厌氧消化池的设计负荷相对于系统产甲烷能力偏低。为此,西班牙学者RIPOLL等[5]提出剩余污泥厌氧消化系统可以接纳一定量的葡萄酒生产废水进行共消化,有效平衡两种基质厌氧消化的限速步骤,提高甲烷产量。剩余污泥厌氧消化系统对葡萄酒生产废水的接纳能力主要取决于二者共消化的强化效果。
现有研究表明,在厌氧消化过程中引入导电材料能有效提高甲烷产量和系统稳定性。颗粒活性炭(granular activated carbon, GAC)作为一种经济性导电材料,可通过pH缓冲、氧化还原介质、底物和微生物富集等多种机制促进甲烷的生成,并可作为直接种间电子转移(direct interspecies electron transfer, DIET)的电子通道[6]。JOHNRAVINDAR等[7]和ZIGANSHINA[8]等分别在啤酒废活性污泥-餐厨垃圾共消化和甜菜浆-酒糟共消化过程中添加GAC,结果表明,添加GAC显著增强了共消化系统水解和产氢活性,有效提高甲烷生成的电子传递效率。ZHAO等[9]发现添加GAC可提高丙酸降解率,加快产气速率(104%~371%),并增加互营微生物种群丰度。然而,过量添加GAC可能导致底物被大量吸附,从而减少产甲烷菌可利用的底物量[10]。目前,针对GAC在葡萄酒生产废水和剩余污泥厌氧共消化中的最佳添加量以及其对二者共消化半连续运行的影响尚有待进一步研究。
为此,研究拟通过批次实验确定在葡萄酒生产废水与剩余污泥厌氧共消化中最佳GAC添加量,分析半连续运行进料下GAC对共消化系统运行性能的影响,并从微生物活性和群落结构的变化探讨GAC增强甲烷生成的潜在机制,以期为GAC投入共消化系统的稳定性和运行性能提供操作条件理论依据。
-
接种污泥取自于实验室中稳定运行的中温剩余污泥厌氧消化反应器。经浓缩后接种污泥TS为(45.9±0.1) g·L−1,VS为(23.8±0.5) g·L−1。
葡萄酒生产废水取自于银川市某葡萄酒酿造厂中的调节池。剩余污泥取自某城市污水处理厂缺氧池,经2 mm筛网过滤并沉淀浓缩后置于4 ℃冰箱中备用。葡萄酒生产废水和剩余污泥具体理化性质见表1。混合后的TS和VS质量浓度分别为(20.1±0.3) g·L−1和(10.3±0.2) g·L−1。
实验所用GAC(粒状)是定制分析纯活性炭,购买自于天津市科密欧化学试剂有限公司。具有高选择性吸附能力,每克总表面积可达500~1 000 m2,且不溶于水和任何溶剂。外观为黑色不定形颗粒,碘值≥400 mg·g−1。
-
1)批次实验。批次实验的厌氧消化反应器主要由总容积250 mL(有效容积200 mL)的有机透明玻璃罐和双孔密封橡胶塞组装而成,顶端设置有取样口和出气口,出气口连接气体收集袋。在每个反应器中加入99 mL的葡萄酒生产废水和66 mL的剩余污泥(混合比为3:2),然后加入35 mL的接种污泥,最后分别加入0、5、10、15、和20 g·L−1的GAC,分别命名为GAC-0,GAC-5、GAC-10、GAC-15、GAC-15和GAC-20,每组设置3个平行实验,共15个,在(35±1) ℃下运行35 d。
2)半连续运行实验。半连续运行实验的厌氧消化反应器由总容积为1 L(有效容积800 mL)厌氧发酵瓶组成,每个厌氧发酵瓶顶部有2个接口,其中一端用于进出料,一端用于收集消化过程中产生的沼气。设置HRT为20 d,半连续运行期间每隔24 h使用50 mL注射器进行进出料,采用先出料后进料的方式,出料时打开出料阀,使用注射器吸出40 mL的混合物,再将40 mL的新鲜底物注射进入发酵瓶中。分别设定剩余污泥单消化(A1)、葡萄酒生产废水与剩余污泥共消化(A2)、以及加入GAC的葡萄酒生产废水与剩余污泥共消化(A3)和葡萄酒生产废水单消化(A4) 4组实验,在(35±1) ℃连续运行80 d。A1~A4反应器的处理负荷分别是0.4、0.42、0.45、0.3 g·(L∙d)−1(以TCOD计)。
-
1)基本指标。TS、VS、TCOD、SCOD等常用指标采用标准方法测定[11];pH采用雷磁 PHS-3C测定;总碱度(total alkalinity, TA)使用联合滴定法[12]测定;气体组分采用TCD-气相色谱仪(SP-3420A)测定;VFAs采用FID-气相色谱仪(SP-3420A)测定。
辅酶F420浓度参照文献[13]测定;电子传递活性(iodonitrotetrazoliumchloride-electron transport system, INT-ETS)参照文献[14]测定;采用热提法提取胞外聚合物(extracellular polymeric substances, EPS)的蛋白质(protein, PN)和多糖(polysaccharide, PS),分别用福林酚法和苯酚硫酸法测定[15]。
2) 比产甲烷活性的计算。比产甲烷活性(specific methanogenic activity, SMA)根据式(1)[16]计算。
式中:Umax为最大SMA;Rmax为最大产甲烷速率,mL·(g·d)−1;X为微生物质量浓度,g·L−1;V为血清瓶中接种污泥的体积,mL;350是在标准条件下(0 ℃,
101325 Pa)1g COD的理论甲烷产量,mL。3)高通量测序。取半连续运行实验A1、A2、A3反应器第80天和A4反应器中第38天的污泥样品,运用高通量测序技术对微生物群落结构进行分析。使用通用引物341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)扩增细菌16S基因的V3-V4片段;使用通用引物Arch519F(5’-CAGCCGCCGCGGTAA-3’)和Arch915R(5’-GTGCTCCCCCGCCAATTCCT-3’)扩增古菌16S基因的V4~V5片段。随后在Illumina公司的 Miseq PE250 平台进行测序。使用IBMSPSS25.0软件对数据进行显著性分析,采用t检验,显著性水平为P<0.05差异显著。
-
各组累积产甲烷量呈现先增长后逐渐平缓的趋势(图1(a))。GAC-0、GAC-5、GAC-10、GAC-15和GAC-20的累积甲烷产量分别为201.0、244.5、283.9、255.8和216.0 mL·g−1(以VS计),相比GAC-0,GAC的加入有效提高了累积产甲烷量,且GAC-10的累积产甲烷量最高,为GAC-0的1.4倍,与JOHNRAVINDAR等[7]的研究结果类似,在共消化系统中添加GAC为15 g·L−1时,产甲烷量相应提高了45%;但随着GAC投加量的增加,GAC-15和GAC-20产甲烷量反而呈下降趋势,分别为GAC-0的1.3倍和1.1倍。这可能是因为过多的GAC吸附了过量的有机底物,减少了可利用的底物量,导致产甲烷量下降[17]。
5组实验均在第10天形成日产甲烷量高峰(图1(b))。其中GAC-5、GAC-10、GAC-15和GAC-20分别达到了36.0、40.0、34.4和32.7 mL·(g∙d)−1,均高于GAC-0(27.2 mL·(g∙d)−1)。GAC-10的日产甲烷量峰值最高,为GAC-0的1.5倍。这可能由于GAC的加入改变了微生物群落的代谢途径,加速了消化过程中有机物的降解速率[18]。与累积产甲烷量类似,随着GAC投加量从15 g·L−1增加至20 g·L−1时,日产甲烷量呈现出下降的趋势,仅为GAC-0的1.3倍和1.2倍;第25天左右,各组日产甲烷量开始趋于平缓,厌氧消化过程结束。
实验结束后各组样品中紧密结合型EPS (tightly bound EPS, TB-EPS)和松散结合型EPS (loosely bound EPS, LB-EPS) 的PN/PS比值如图1(c)所示。可见,添加GAC后的PN/PS比值均有所提高,且GAC-10的PN/PS最高,相比GAC-0提高了33.5%。PN/PS的比例会影响污泥表面疏水性和污泥凝聚能力[19],各组样品中TB-EPS和LB-EPS的PN/PS的比例均与累积产甲烷量呈显著正相关关系(P<0.05, r分别为0.981和0.882),这说明在GAC-10中的污泥凝聚性能最佳,进而提高了共消化系统的产甲烷能力。
图1(d)为厌氧共消化结束后固体有机物(VS和TCOD)的浓度。GAC-10效果最佳,VS和TCOD去除率相比GAC-0分别提高了1.3倍和1.5倍。然而,当GAC继续增加到15~20 g·L−1时,VS和TCOD去除率却下降,仅为GAC-0的1.2倍和1.0倍,这表明GAC投加量的增加并不能继续提高VS和TCOD的去除率,且其他研究者也指出了过量GAC可能会引起抑制效应,从而削减微生物对有机物的降解能力[17]。VS和TCOD的去除率与累积产甲烷量呈显著正相关关系(P<0.05, r分别为0.926和0.979),这强调了在GAC-10中有效提高了系统甲烷的产量。
-
图2(a)为4组反应器在半连续运行期间的产甲烷速率(反应器进料中每克TCOD每天所产生的甲烷体积)的变化。初期阶段Ⅰ,随着微生物对消化底物的适应,有机物降解速率逐渐增加,产甲烷速率随之持续上升。由于葡萄酒生产废水良好的可生化性,因此,底物中葡萄酒生产废水比例越高,产甲烷速率上升越快,即A4>A3>A2>A1。
在阶段Ⅱ中,进水中含葡萄酒生产废水的A2~A4组可观察到产甲烷速率再次增加,A4在第10天趋于稳定,产甲烷速率可达337.0 mL∙(g∙d)−1,与理论值接近,说明葡萄酒生产废水中的有机物质几乎全被有效转化为甲烷;而A2、A3的二次增幅相对较小,在第28天后分别稳定在(252.4±1.9) mL∙(g∙d)−1和(293.9±3.3) mL∙(g∙d)−1,且在A1、A2、A4中第2次产甲烷速率的增幅与葡萄酒生产废水的添加比例的相关性呈显著(P<0.05),推测葡萄酒废水中乙醇的存在促使系统中建立DIET产甲烷途径,从而促进甲烷生成[3]。此外,实验结果表明,GAC添加使共消化(A3)产甲烷速率的二次增幅(28.4 mL·(g∙d)−1)高于A2(13.9 mL·(g∙d)−1),这可能是因为GAC自身的导电性可进一步强化DIET途径。
在阶段Ⅲ中,微生物适应环境后,A1、A2和A3中产甲烷速率稳定,波动较小,但在第30天,A4的产甲烷速率开始下降,并在第38天完全停止产甲烷。这主要是由于葡萄酒生产废水在发酵过程中易导致VFAs积累,引起pH下降,从而破坏了产甲烷菌的生长环境,导致系统不稳定[20]。
图2(b)为4组反应器在半连续运行期间的甲烷含量的变化。在运行初期的第5天,由于系统内微生物尚未完全适应底物,各组甲烷含量仅维持在52.5%~59.0%;随着微生物对底物的逐渐适应,运行到第15天以后,各组甲烷含量均呈现出增加的趋势,A1~A4组最终稳定在66.1%、72.2%、72.7%和71.0%。共消化系统(A2、A3)的甲烷含量均显著高于单消化系统(A1、A4),且添加GAC的共消化系统(A3)甲烷含量一直略高于A2。此外,A4组在38 d后停止产甲烷(图2(a)),未检测到甲烷含量。
-
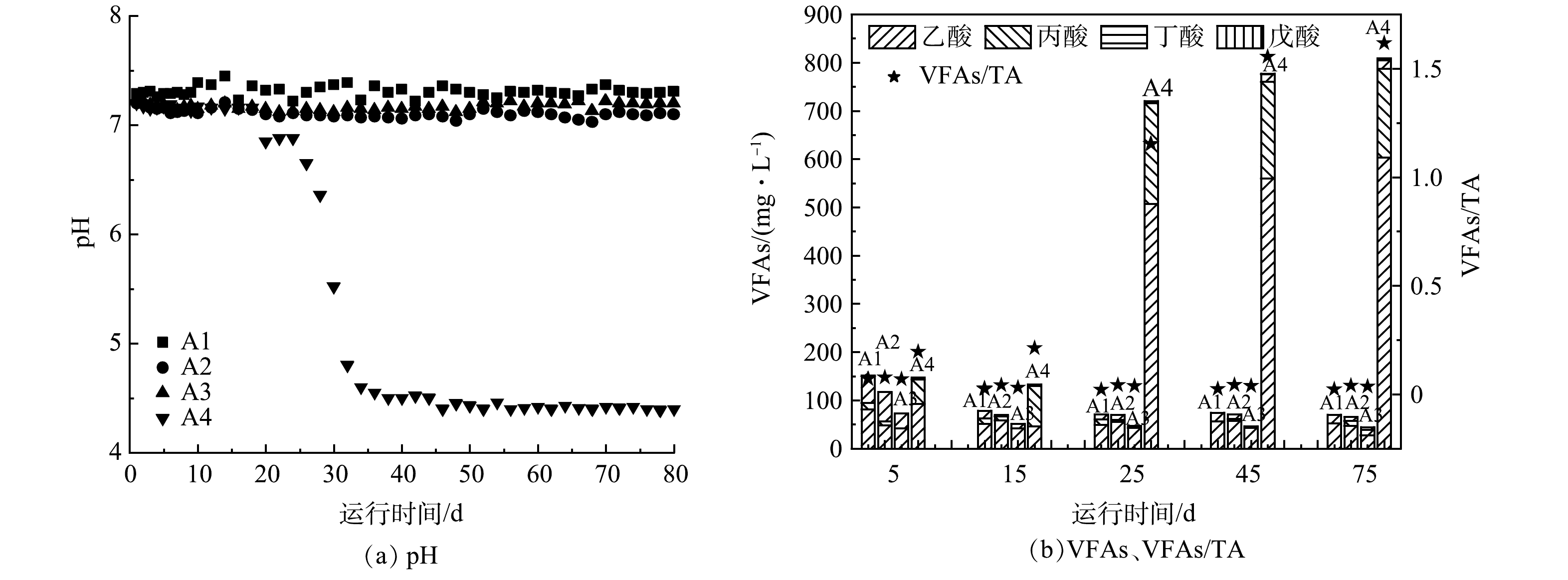
图3(a)为半连续运行期间各组反应器中pH随时间的变化情况。A1、A2和A3反应器的pH在整个运行期间相对稳定,分别为7.4±0.03、7.1±0.03和7.2±0.02,均维持在厌氧消化适宜的pH范围内[21]。A4在1~18 d的pH稳定在7.2±0.02,但第20天,pH由7.2突然下降至6.9,之后持续下降,在第32天低至4.8,系统酸化。VFAs/TA值是消化系统稳定性的指标之一。各组反应器的VFAs/TA值和VFAs的浓度如图3(b)所示。整个运行期间A1、A2和A3中的VFAs/TA值均低于0.4,反应器具有良好的缓冲能力和稳定性能。然而A4中出水VFAs浓度在第21天开始显著增加(133.1 mg·L−1),VFAs/TA值逐渐升高,在第25天VFAs/TA值超过1,系统酸化[22]。
由图3(b)可以看出,A1、A2和A3运行稳定后的出水VFAs浓度小于100 mg·L−1,且A3<A2<A1,说明共消化可以强化VFAs的同步甲烷化,而GAC可以进一步强化产甲烷过程。对比这3组实验的VFAs组分可以发现,加入GAC的A3反应器的丙酸和丁酸积累量始终低于A1和A2,说明GAC的添加可有效促进丙酸和丁酸的降解。
-
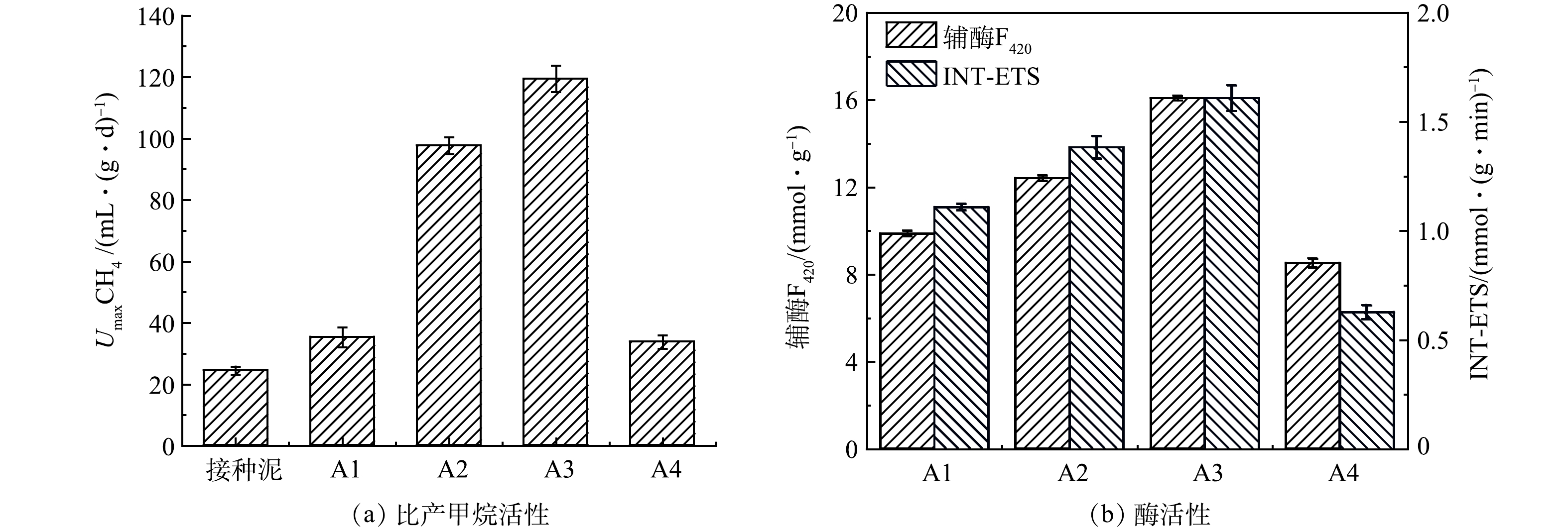
SMA活性是评估厌氧消化系统COD降解和甲烷产率的指标,由最大比产甲烷速率(UmaxCH4)表示,指单位质量的厌氧污泥在单位时间内的最大产甲烷量。SMA测定结果见图4(a),A1、A2、A3和A4的Umax分别为35.3、97.7、119.4和33.8 mL·(g∙d)−1。A2相比A1和A4分别提高了176.7%和189.3%,说明葡萄酒生产废水和剩余污泥进行共消化能够显著增强微生物活性。在A3中,添加GAC使Umax比A2进一步提高22.2%,这可能是因为GAC可改善了反应器中的微生物群落结构,促进不同种类微生物的协同效应,从而提高产甲烷活性和产量。而A4中SMA活性因VFAs积累受到抑制。
图4(b)为第80天各组反应器中辅酶F420含量和INT-ETS活性,二者通常被用来表征厌氧消化系统中产甲烷菌的活性[23]。A2中辅酶F420含量和INT-ETS活性分别比A1和A4提高25.3%、45.9%和24.3%、119.0%,与SMA活性和产甲烷速率的相关性显著(P<0.05)。而添加GAC可使辅酶F420含量和INT-ETS活性分别比A2进一步提高29.5%和16.7%,这可能由于GAC促进氢营养型产甲烷途径,提高了甲烷生成的电子传递效率,使得酶活性进一步增强[9],与TONG等[24]研究结果类似。而A4中辅酶F420含量和INT-ETS活性最低,这是因为在消化系统内发生VFAs积累,使产甲烷菌活性受到了抑制。
-
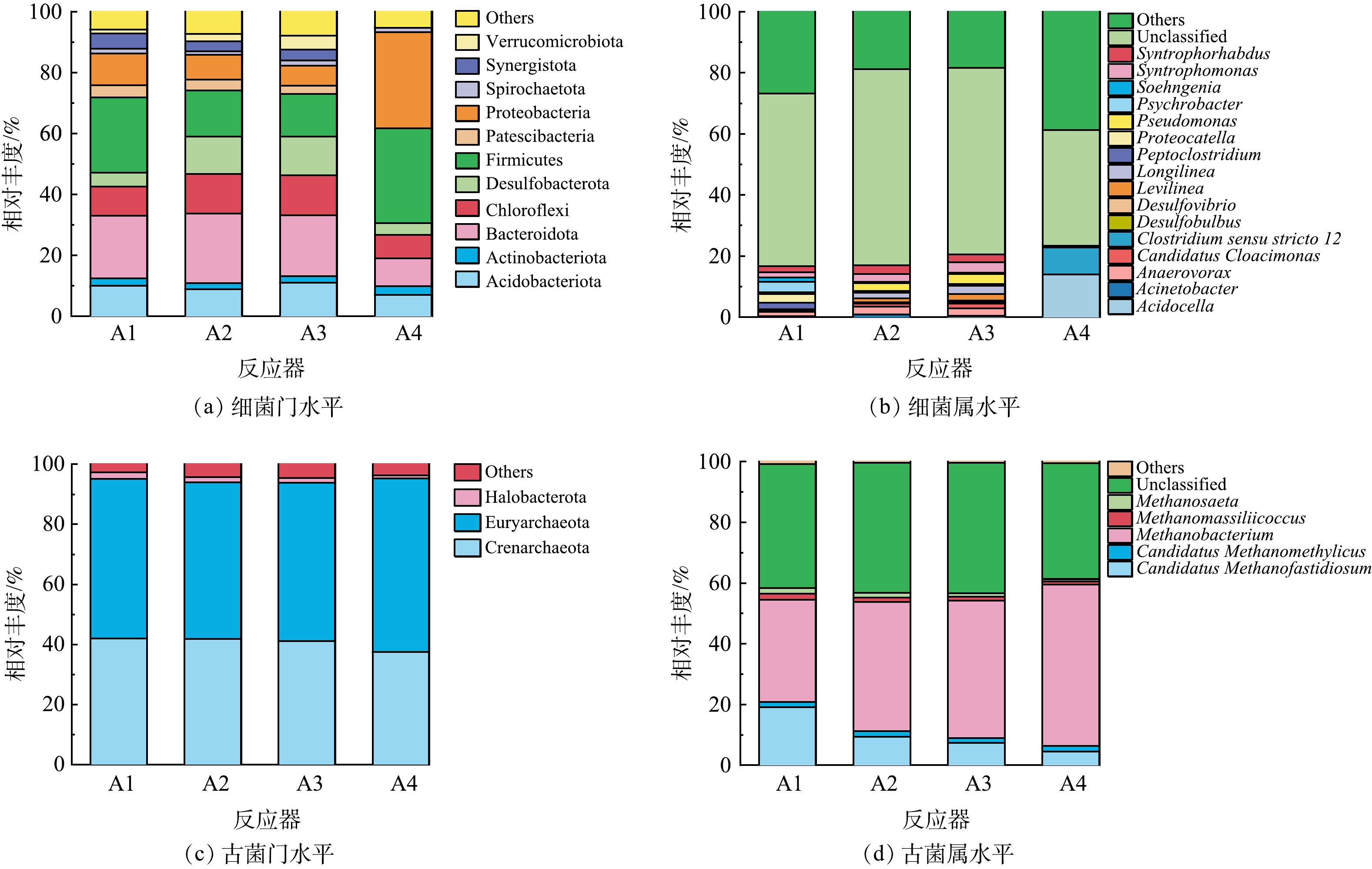
4组反应器的厌氧污泥微生物群落结构组成如图5所示,其中A1、A2、A3为第80天,A4为第38天。图5(a)和图5(b)可以看出,底物类型对反应器中细菌群落结构有显著影响。由图5(a)可见,A1的优势细菌主要为Firmicutes(24.7%)和Bacteroidetes(20.5%);A2和A3中优势细菌为Bacteroidetes(20.1%~23.0%)、Chloroflexi(12.7%~13.0%)和Desulfobacterota(12.4%~12.7%);A4的优势细菌为Firmicutes(31.3%)。共消化体系中,Chloroflexi和Desulfobacterota的丰度明显升高。
从细菌群落的属水平分布(图5(b))可以看出,A1的主要优势菌为Psychrobacter、Proteocatella和Peptoclostridium;A2和A3的优势菌为Pseudomonas和Syntrophomonas;A4中的优势菌为Acidocella和Clostridium sensu stricto 12。共消化体系中,Syntrophomonas、Longilinea、Pseudomonas和Desulfovibrio的丰度明显升高。Syntrophomonas具有促进VFAs降解为乙酸的能力,参与VFAs互营氧化过程[25]。Pseudomonas属于电活性细菌,可以转化VFAs并加速电子转移[26]。Desulfovibrio属于乙醇氧化菌,能够代谢包括乙醇在内的多种碳水化合物,Pseudomonas和Desulfovibrio均属于具有胞外电子传递能力的Fe(Ⅲ)还原菌,可参与DIET产甲烷途径[22],丰度增加的原因是由于葡萄酒生产废水中的乙醇在氧化过程中释放出的能量传递给了微生物生长,刺激微生物的活性。添加GAC(A3)进一步提高这些菌群的丰度,ZHANG等[27]进一步通过扫描电镜发现,GAC表面观察到有大量类似纤毛结构附着,从而改变了微生物群落。这一结果与在剩余污泥厌氧消化中投加GAC的研究结果类似[28]。
图5(c)~(d)是古菌在门和属水平上的群落结构。门水平上,4组反应器的古菌群落结构类似,Euryarchaeota和Crenarchaeota是占绝对优势,相对丰度为94%~96%。
在属水平上,4个反应器中的优势古菌属为Methanobacterium和Candidatus Methanofastidiosum。随底物中葡萄酒生产废水比例的增加,甲基型产甲烷古菌Candidatus Methanofastidiosum的丰度显著降低(P<0.05),氢营养型产甲烷古菌Methanobacterium丰度显著增加(P<0.05),这说明底物类型对系统产甲烷途径有重要影响。此外,由图5(d)可以看出添加GAC进一步增加Methanobacterium丰度,这可能是因为GAC可通过电活性细菌(Pseudomonas和Desulfovibrio)和氢营养型产甲烷古菌Methanobacteria之间产生电子连接。
-
1) GAC在葡萄酒生产废水和剩余污泥共消化系统中对甲烷产生起到促进作用。当GAC添加量为10 g∙L−1时,累积产甲烷量和日产甲烷量峰值达到最高值,分别为283.9 mL∙g−1(以VS计)和40.0 mL∙(g∙d)−1,相比未添加GAC提高了1.4倍和1.5倍。
2)在共消化系统内加入GAC,可调节pH水平、加速丙酸和丁酸降解、促进微生物间电子传递效率和提高关键辅酶F420含量,在此条件下SMA活性达到最大(119.4 mL∙(g∙d)−1)。
3)微生物群落分析结果表明,GAC提升了互营VFAs氧化细菌Syntrophomonas以及与DIET相关的微生物(Pseudomonas、Desulfovibrio和Methanobacterium)的丰度,因此,推测GAC添加可改善细菌和产甲烷菌的种间电子传递,形成DIET产甲烷途径,进而强化厌氧共消化系统性能。
颗粒活性炭强化葡萄酒生产废水与剩余污泥厌氧共消化的影响
Effect of granular activated carbon on enhanced anaerobic co-digestion of winery wastewater and sewage sludge
-
摘要: 葡萄酒生产废水和剩余污泥厌氧共消化具有均衡底物营养、缓减毒物抑制和增加菌群多样性等优点。为进一步提高产甲烷效率,研究考察颗粒活性炭(5~20 g·L−1)对中温(35±1) ℃厌氧共消化系统产甲烷性能、微生物活性和微生物群落结构的影响。批次实验结果表明,最佳颗粒活性炭投加量为10 g·L−1,相应累计产甲烷量可达283.9 mL·g−1(以VS计),比空白组高41.3%,GAC主要通过刺激污泥胞外聚合物分泌和有机物降解提高累积产甲烷量。在GAC投加量为10 g·L−1下,运行80 d的半连续运行实验中发现,稳定期间共消化产甲烷速率为(293.9±3.3) mL·(g·d)−1 (以TCOD计),最大比产甲烷活性为119.4 mL·(g·d)−1 (以VSS计),辅酶F420含量和电子传递活性相比未添加GAC分别提高了29.5%和16.7%,并且GAC可通过加速丙酸和丁酸降解和调节pH等途径提高系统稳定性能。此外,GAC促进了互营VFAs氧化细菌Syntrophomonas和具有胞外电子传递功能细菌Pseudomonas和Desulfovibrio的丰度,以及可作为电子受体参与直接种间电子转移的产甲烷菌Methanobacterium的丰度,从而强化了细菌和产甲烷菌的种间电子传递,提高有机物代谢速率。以上结果表明,添加GAC可有效提高葡萄酒生产废水和剩余污泥的共消化性能,提高整个消化系统的处理效率。Abstract: The anaerobic co-digestion of winery wastewater and sewage sludge has the advantages of balancing substrate nutrition, alleviating toxin inhibition and increasing microbial diversity. In order to further improve the methane production efficiency, the effects of granular activated carbon (5~20 g·L−1) on methane production performance, microbial activity and microbial community structure in mesophilic (35±1) °C anaerobic co-digestion system were investigated. The results of batch experiments showed that the optimal GAC dosage was 10 g·L−1, and the corresponding cumulative methane production could reach 283.9 mL·g−1(based on VS), which was 41.3% higher than that of the blank group. GAC addition mainly increased the cumulative methane production by stimulating the secretion of extracellular polymeric substance and degradation of organic matter. In the semi-continuous operation experiment at GAC dosage of 10 g·L−1 for 80 d, the co-digestion methanogenesis rate was (293.9±3.3) mL·(g·d)−1 (based on TCOD) during the stable period, and the maximum specific methanogenic activity was 119.4 mL·(g·d)−1 (based on VSS). The content of coenzyme F420 and electron transport activity increased by 29.5% and 16.7%, respectively, compared with the group without GAC addition, and GAC addition could improve the stability of the system by accelerating the degradation of propionic acid and butyric acid and adjusting pH. In addition, GAC addition promoted the abundance of Syntrophomonas, Pseudomonas and Desulfovibrio, which are syntrophic VFAs oxidizing bacteria and extracellular electron transfer bacteria, and Methanobacterium, which can be used as an electron acceptor to participate in direct interspecies electron transfer, thereby enhancing the interspecies electron transfer between bacteria and methanogens, and improving the metabolic rate of organic matter. In summary, the addition of GAC can effectively improve the co-digestion performance of winery wastewater and sewage sludge, and improve the treatment efficiency of the entire digestive system.
-

-
表 1 葡萄酒生产废水和剩余污泥的理化性质
Table 1. Physicochemical properties of winery wastewater and sewage sludge
样品 TS/
(g·L−1)VS/
(g·L−1)TCOD/
(g·L−1)SCOD/
(g·L−1)总蛋白/
(mg·L−1)总多糖/
(mg·L−1)总氮/
(mg·L−1)pH 葡萄酒生产废水 0.38 / 12.3±0.1 11.2±0.2 806.4±7.1 1 597.1±33.3 74.0 3.9±0.01 剩余污泥 39.0±0.5 20.0±0.3 27.7±0.3 8.9±0.1 9 244.0±32.8 10 064.8±83.2 1 490.9±20.2 7.1±0.02 -
[1] 闫玥, 王晓静, 牛艳, 等. 宁夏贺兰山东麓酿酒葡萄与葡萄酒产业发展现状及对策[J]. 安徽农业科学, 2024, 52(1): 254-259. [2] MIKLAS V, TOUS M, MIKLASOVA M, et al. Winery wastewater treatment technologies: Current trends and future perspective[J]. Chemical Engineering Transactions, 2022, 94: 847-852. [3] 王泽, 于莉芳, 马芷萱, 等. 持续负荷冲击下AnSBBR运行性能及群落结构响应[J]. 中国环境科学, 2024, 44(1): 140-149. [4] 马晶伟, 杨扬, 徐鹏, 等. 椰壳颗粒活性炭活化过硫酸钠预处理促进高固污泥水解产酸性能[J]. 环境工程学报, 2022, 16(6): 1892-1899. doi: 10.12030/j.cjee.202201034 [5] RIPOLL V, AGABO-GARCIA C, SOLERA R , et al. Modelling of the anaerobic semi-continuous co-digestion of sewage sludge and wine distillery wastewater[J]. Environmental Science: Water Research & Technology, 2020, 6(7): 1880-1889. [6] XIAO L L, LIU J, KUMAR P S, et al. Enhanced methane production by granular activated carbon: A review[J]. Fuel, 2022, 320: 123903. doi: 10.1016/j.fuel.2022.123903 [7] JOHNRAVINDAR D, LIANG B B, FU R Z, et al. Supplementing granular activated carbon for enhanced methane production in anaerobic co-digestion of post-consumer substrates[J]. Biomass & Bioenergy, 2020, 136: 105543. [8] ZIGANSHINA E E, BELOSTOTSKIY D E, BULYNINA ulynina S S, et al. Influence of granular activated carbon on anaerobic co-digestion of sugar beet pulp and distillers grains with solubles[J]. Processes, 2020, 8(10): 1226. doi: 10.3390/pr8101226 [9] ZHAO J, LI Y , EUVERINK G J W. Effect of bioaugmentation combined with activated charcoal on the mitigation of volatile fatty acids inhibition during anaerobic digestion[J]. Chemical Engineering Journal, 2022, 428: 131015. [10] GRESES S, TOMAS-PEJO E, GONZALEZ-FERNANDEZ C. Short-chain fatty acids and hydrogen production in one single anaerobic fermentation stage using carbohydrate-rich food waste[J]. Journal of Cleaner Production, 2021, 284: 124727. doi: 10.1016/j.jclepro.2020.124727 [11] 国家环境保护总局. 水和废水监测分析方法 第4版[M]. 北京: 中国环境科学出版社, 2002. [12] LI D, CHEN L, LIU X, et al. Instability mechanisms and early warning indicators for mesophilic anaerobic digestion of vegetable waste[J]. Bioresource Technology, 2017, 245: 90-97. doi: 10.1016/j.biortech.2017.07.098 [13] WANG C, WANG C Q, LIU J Y, et al. Role of magnetite in methanogenic degradation of different substances[J]. Bioresource Technology, 2020, 314: 123720. doi: 10.1016/j.biortech.2020.123720 [14] LI Y, TANG Y, XIONG P, et al. High-efficiency methanogenesis via kitchen wastes served as ethanol source to establish direct interspecies electron transfer during anaerobic Co-digestion with waste activated sludge[J]. Water Research, 2020, 176: 115763. doi: 10.1016/j.watres.2020.115763 [15] LI X Y , YANG S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 2007, 41(5): 1022-1030. [16] LI Q, LIU Y Q, YANG X H, et al. Kinetic and thermodynamic effects of temperature on methanogenic degradation of acetate, propionate, butyrate and valerate[J]. Chemical Engineering Journal, 2020, 396: 125366. doi: 10.1016/j.cej.2020.125366 [17] FLORENTINO A P, XU R, ZHANG L, et al. Anaerobic digestion of blackwater assisted by granular activated carbon: From digestion inhibition to methanogenesis enhancement[J]. Chemosphere, 2019, 233: 462-471. doi: 10.1016/j.chemosphere.2019.05.255 [18] MU H, DING X F, ZHU X Y, et al. Effects of different types of granular activated carbon on methanogenesis of carbohydrate-rich food waste: Performance, microbial communities and optimization[J]. Science of the Total Environment, 2023, 895: 165173. doi: 10.1016/j.scitotenv.2023.165173 [19] ZHANG W L, ZHANG L, LI A M. Enhanced anaerobic digestion of food waste by trace metal elements supplementation and reduced metals dosage by green chelating agent S, S -EDDS via improving metals bioavailability[J]. Water Research, 2015, 84: 266-277. doi: 10.1016/j.watres.2015.07.010 [20] FERREIRA J D, VOLSCHAN I, CAMMAROTA M C. Co-digestion of sewage sludge with crude or pretreated glycerol to increase biogas production[J]. Environmental Science and Pollution Research, 2018, 25(22): 21811-21821. doi: 10.1007/s11356-018-2260-3 [21] 王辉辉, 王雪梅, 李子富, 等. 高固体条件下黑水添加对厨余垃圾厌氧发酵的影响[J]. 环境工程学报, 2024, 18(1): 237-244. doi: 10.12030/j.cjee.202309080 [22] 郑兰香, 王泽, 马芷萱, 等. 厌氧序批式生物膜反应器处理葡萄酒生产废水性能及菌群演替分析[J]. 环境工程学报, 2023, 17(4): 1387-1396. doi: 10.12030/j.cjee.202212124 [23] YIN Q D, YANG S, WANG Z Z, et al. Clarifying electron transfer and metagenomic analysis of microbial community in the methane production process with the addition of ferroferric oxide[J]. Chemical Engineering Journal, 2018, 333: 216-225. doi: 10.1016/j.cej.2017.09.160 [24] TONG S Q, CHEN D, MAO P, et al. Synthesis of magnetic hydrochar from Fenton sludge and sewage sludge for enhanced anaerobic decolorization of azo dye AO7[J]. Journal of Hazardous Materials, 2022, 424: 127622. doi: 10.1016/j.jhazmat.2021.127622 [25] 马佳莹, 王盼亮, 汪冰寒, 等. 活性炭对城市有机固废厌氧消化过程抗生素抗性基因行为特征的影响[J]. 环境科学, 2021, 42(5): 2413-2421. [26] 王彦朝, 吴, 刘一苇, 等. 碳基导电材料促进有机固废厌氧消化产甲烷的研究进展[J]. 环境工程, 2023, 41(9): 146-155. [27] ZHANG Q Y, LI R, GUO B, et al. Thermophilic co-digestion of blackwater and organic kitchen waste: Impacts of granular activated carbon and different mixing ratios[J]. Waste Management, 2021, 131: 453-461. doi: 10.1016/j.wasman.2021.06.024 [28] 杨波, 贾丽娟, 徐辉, 等. 投加颗粒活性炭和二氧化锰对剩余污泥厌氧消化的影响[J]. 环境科学, 2020, 41(4): 1816-1824. -




 下载:
下载: