-
近年来,越来越多的终端净水器(简称净水器)被用来去除饮用水污染物,成为保障饮用水质量的最后技术屏障。净水器在工艺流程上大致相似,主要由粗滤、吸附过滤、精滤组成,其中又以吸附过滤和精滤最为重要[1],包括以活性炭为介质的吸附过滤和以微滤、超滤、纳滤、反渗透为主的膜过滤。膜技术在控制水污染和生产清洁水方面发挥了重要作用[2]。目前,净水器一般包括聚丙烯棉(polypropylene cotton,pp棉)、活性炭、膜等多种滤芯,其中膜过滤是核心部件。各级滤芯串联后用于去除粗颗粒和悬浮物,吸附异色、异味,去除有机物、余氯、重金属离子、细菌以及调节pH和口感的作用[3]。有研究表明,净水器中纳滤膜通过物理过滤将水中常见细菌(大肠杆菌)及病毒(MS2噬菌体)有效去除,并将其拦截在膜上[4],且纳滤可以最大程度地去除原水中的有毒有害物质[5]。此外,净水器膜过滤之后还设有其他后置工艺。例如,目前净水器制水量没有达到即时使用,所以膜过滤后需要设置储水设备。为了有效吸附有机物质和残留消毒剂,改善水质和口感[6],将活性炭放置在膜过滤后,又称后置活性炭。据报道净水器中若仅设置活性炭而没有抑菌或滤菌装置, 膜出水会出现微生物超标[7]。SU等[8]报道由微滤膜和活性炭组成的净水器内部形成生物膜,导致出水细菌升高。STRING等[9]发现储水容器有生物膜附着,存在微生物污染风险。鉴于净水器膜过滤的储水桶、后置活性炭均有微生物增殖风险,本研究以城市管网水为净水器进水,处理150 d后通过16S rRNA 扩增子测序技术,对净水器进水、净水器3组出水(单独纳滤出水、纳滤结合压力桶出水、纳滤结合活性炭出水)的微生物群落进行了研究,评估了净水器纳滤膜过滤及后置工艺对出水微生物丰度和群落多样性的影响,目前对于净水器出水的风险微生物检测研究过少,本研究对净水器各组出水的病原体和潜在病原体进行研究,以期为净水器二次污染削减和净水器工艺选择提供参考。
-
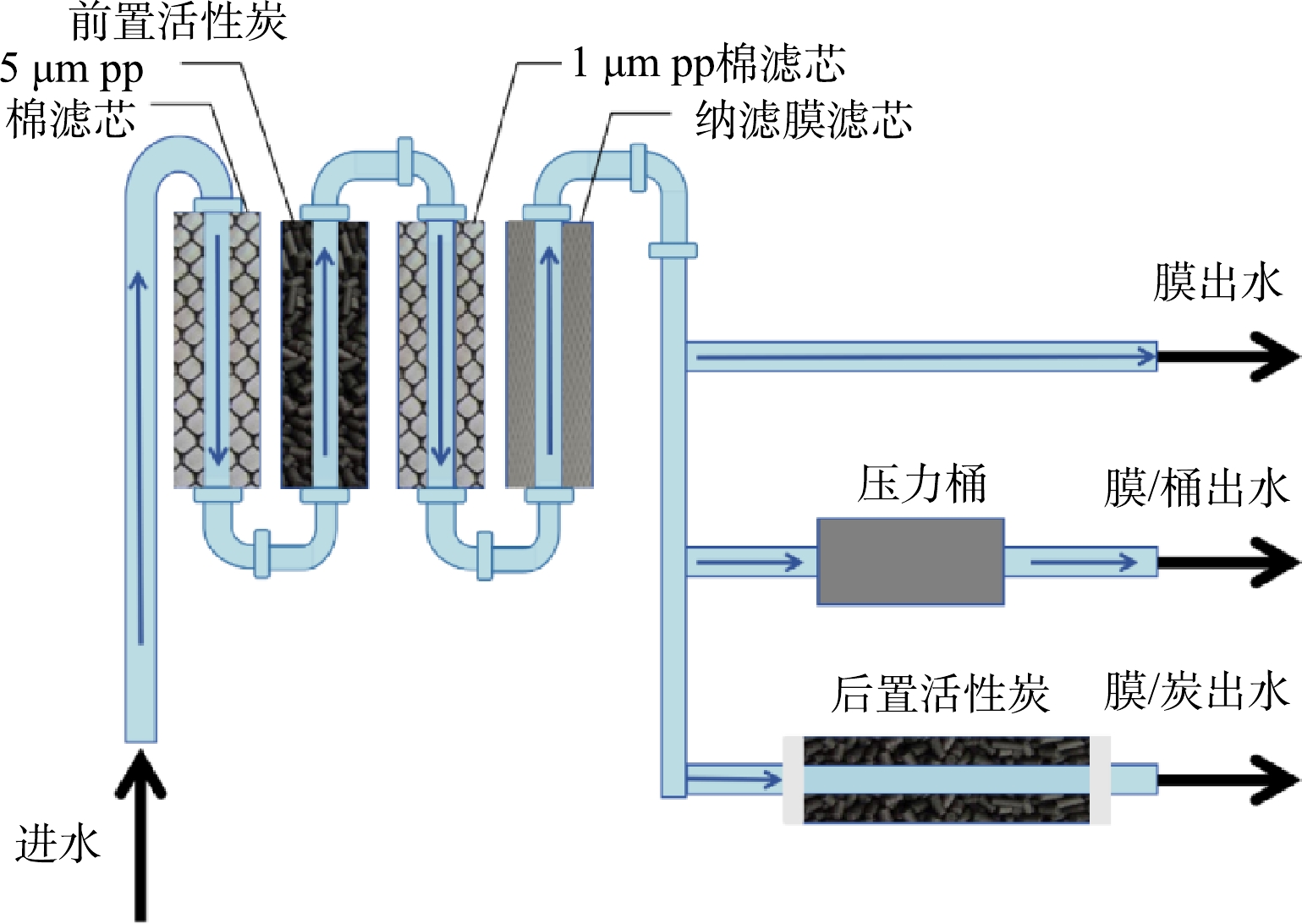
如图1所示,以城市管网水为净水器进水,并联连接6台相同净水器。净水器为全自动自吸式净水器,内部采用的滤芯分别为:5 μm 聚丙烯棉滤芯、前置活性炭、1 μm 聚丙烯棉滤芯、纳滤膜滤芯。压力桶为圆柱体玻璃容器,顶盖由聚氯乙烯材质制成,流速控制在1~1.5 L·min−1内。采集6台净水器纳滤膜出水,简记为膜出水1~6。6台净水器的纳滤膜出水分为2组平行,1组(3台)直接进入压力储水桶,出水记为纳滤-压力桶出水1~3,简记为膜-桶出水1~3;1组(3台)接后置活性炭滤芯,出水记为纳滤-后置活性炭出水1~3,简记为膜-炭出水1~3。净水器每日进水量20 L,运行150 d,从运行60 d开始,每隔30 d每台净水器通过抽滤泵对净水器进水、净水器3组出水(膜出水、膜-桶出水、膜-炭出水)进行富集,将微生物过滤至孔径0.22 µm、直径90 mm滤膜上,提取20 L水样过滤滤膜上的DNA进行16S rRNA 扩增子测序[10]。
-
在净水器运行30~150 d,净水器进水和3组出水水质如下。浊度:净水器进水 (0.13~0.58 NTU)、膜出水(0.06~0.32 NTU)、膜-桶出水(0.06~0.44 NTU)、膜-炭出水(0.06~0.38 NTU)。TDS反映水中溶解物杂质含量:净水器进水 (117.33‰~221.00‰)、膜出水(14.50‰~24.11‰)、膜-桶出水(23.78‰~43.22‰)、膜-炭出水(5. 11‰~16.00‰)。菌落总数:净水器进水(16.33~221.00 CFU·mL−1)、膜出水(339.56~1 347.78 CFU·mL−1)、膜-桶出水(163.11~1 153.33 CFU·mL−1)、膜-炭出水(411.11~1 425.00 CFU·mL−1)。
运行过程前期,单独纳滤、纳滤-压力桶、纳滤-活性炭3种处理方式的浊度和TDS远小于进水,后期与进水相差不多;同时期的菌落总数均高于净水器进水。
-
使用FastDNA®土壤自旋试剂盒(MP Biomedical, Santa Ana, CA, USA)提取样品DNA。将对 16S rDNA V3~V4 区进行扩增,4组样品:净水器进水、膜出水、膜-桶出水、膜-炭出水每组取3个重复,共 12 个。水样所提取的DNA 原液作为聚合酶链式反应(polymerase chain reaction,PCR)模板,利用细菌 16S rRNA V3~V6区采用引物341F(5-CCTACGGGAGGCAGCAG-3')和1073R(5'-ACGAGCTGACGACARCCATG-3')进行扩增[11]。PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,共40个循环,Ct检测限为40个循环。将扩增并且纯化后产物加入到 Illumina MiSeq 测序平台进行高通量并行测序。使用USEARCH根据序列相似度将序列聚类为操作分类单元(OTU),相似度阈值为 97%。通过分析物种分类、Alpha多样性等评估不同样本间微生物群落间的整体概况。
-
使用Microsoft Excel 2010进行数据分析,使用SPSS软件(PASW Statistics 20.0)进行统计分析。使用vsearch软件对原始下机数据进行质控和过滤,以97%的相似性对序列进行聚类,相似度大于97%的序列将聚为同一个OTUs,同时使用denovo模式去除嵌合体序列,最终产生的OTUs代表序列将用于后续物种注释。使用mothur计算各样本的丰富度和多样性指数,Chao、ACE指数常用来估计物种总数;通过主成分分析绘制二维 主坐标分析(principal coordinate analysis, PCoA) 图,以观察样品的分布特征及相关性。根据 KEGG数据库中微生物代谢功能的分类, 对各水样微生物群落进行功能基因预测。
-
净水器进水、膜出水、膜/桶出水和膜/炭出水的微生物群落Alpha多样性指数如表1所示,反应测序深度的覆盖度均在98%以上,表明测序结果可靠,能够较为真实、准确地描述样本微生物群落信息[12]。Shannon值越大,群落多样性越高,Simpson值则与之相反[13-14]。由表1可知,净水器进水的Shannon值较大,Simpson值较小,说明净水器进水的微生物群落多样性较高,膜出水的Shannon值最小且Simpson值最大,说明单独纳滤出水的微生物多样性最低。ACE、Chao指数通常用于估计样本中微生物群落丰富度,两者值越大代表物种越多[15],可知净水器进水的微生物群落组成最丰富,膜出水的微生物丰富度最小,与上述Shannon值和Simpson值分析结果一致。通过Alpha多样性指数分析发现,膜出水、膜-桶出水和膜-炭出水的微生物多样性均低于净水器进水,说明净水器降低进水的微生物多样性。此外,膜出水、膜-桶出水和膜-炭出水的微生物丰富度均低于净水器进水,说明单独纳滤、纳滤-压力桶、纳滤-活性炭3种处理方式均可降低进水的微生物丰富度。此外,膜-桶出水、膜-炭出水的微生物多样性与群落丰富度略高于膜出水,说明纳滤膜的后置工艺如压力桶、活性炭对水中微生物有一定富集作用。从净水器运行时间来看,90 d时膜出水、膜-桶出水和膜-炭出水的微生物群落多样性和丰富度最高,表明净水器在运行90 d时微生物污染风险最高。
-
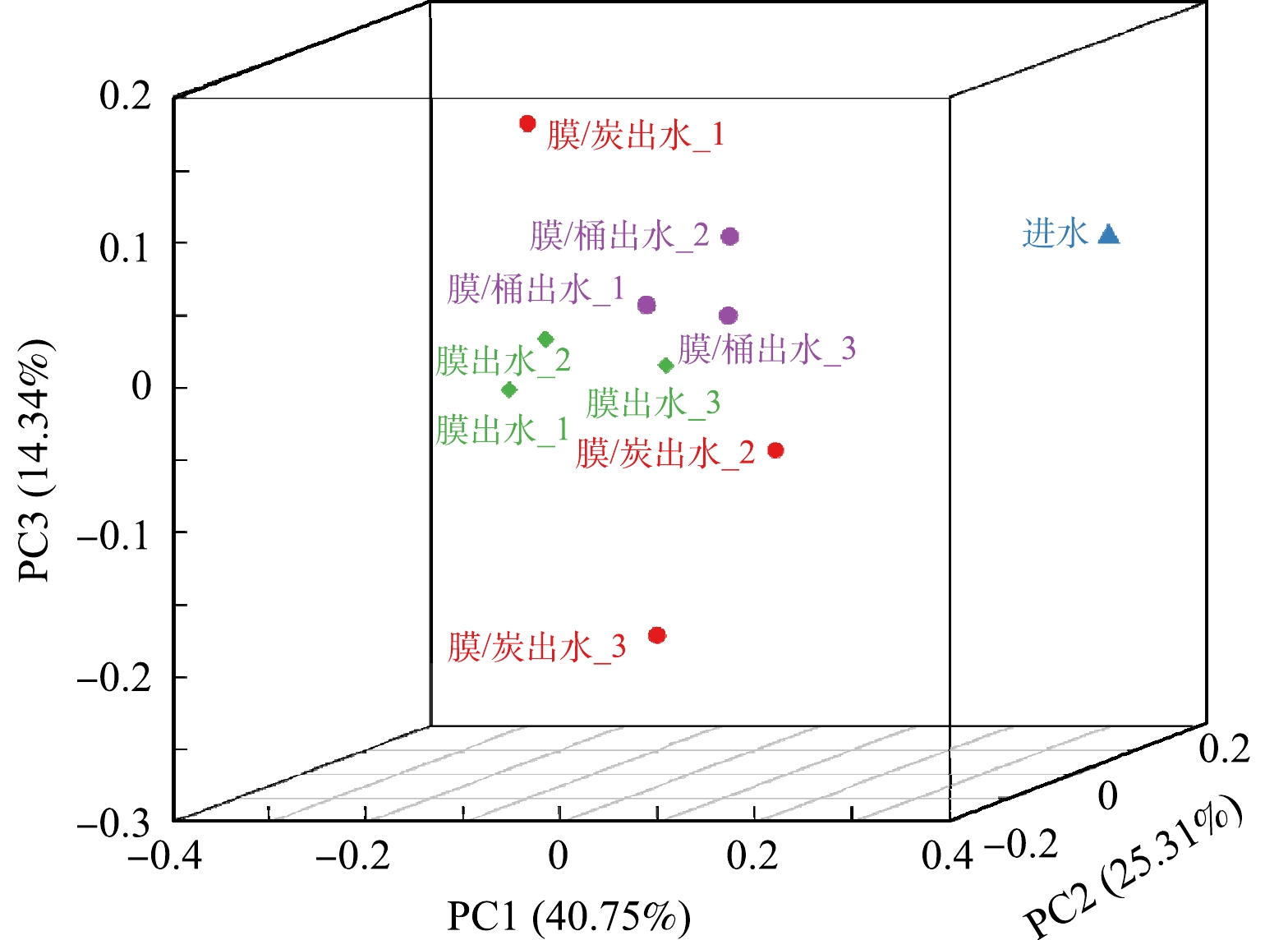
选取净水器运行150 d的净水器进水、膜出水、膜/桶出水和膜/炭出水各3组(共10组,净水器进水取3组均值),进行微生物群落主坐标分析。如图2所示,PCoA微生物群落结构结果表明,净水器进水与膜出水、膜-桶出水和膜-炭出水微生物群落结构差异明显。从出水组可以看出,膜出水的微生物群落结构与膜-桶出水较为相似,而与膜-炭出水相差较多,说明单独纳滤处理与纳滤-压力桶2种处理方式对微生物的富集作用和其内部的微生物群落结构较为相似;而纳滤-压力桶和纳滤-活性炭的2种处理方式对不同微生物的影响差别较大。这是因为在压力桶储存过程中,在桶表面发生微生物污染;活性炭处理过程可显著改变微生物结构,有研究[16]认为活性炭在水处理过程中可以显著改变细菌群落,可看出群落结构更复杂。
-
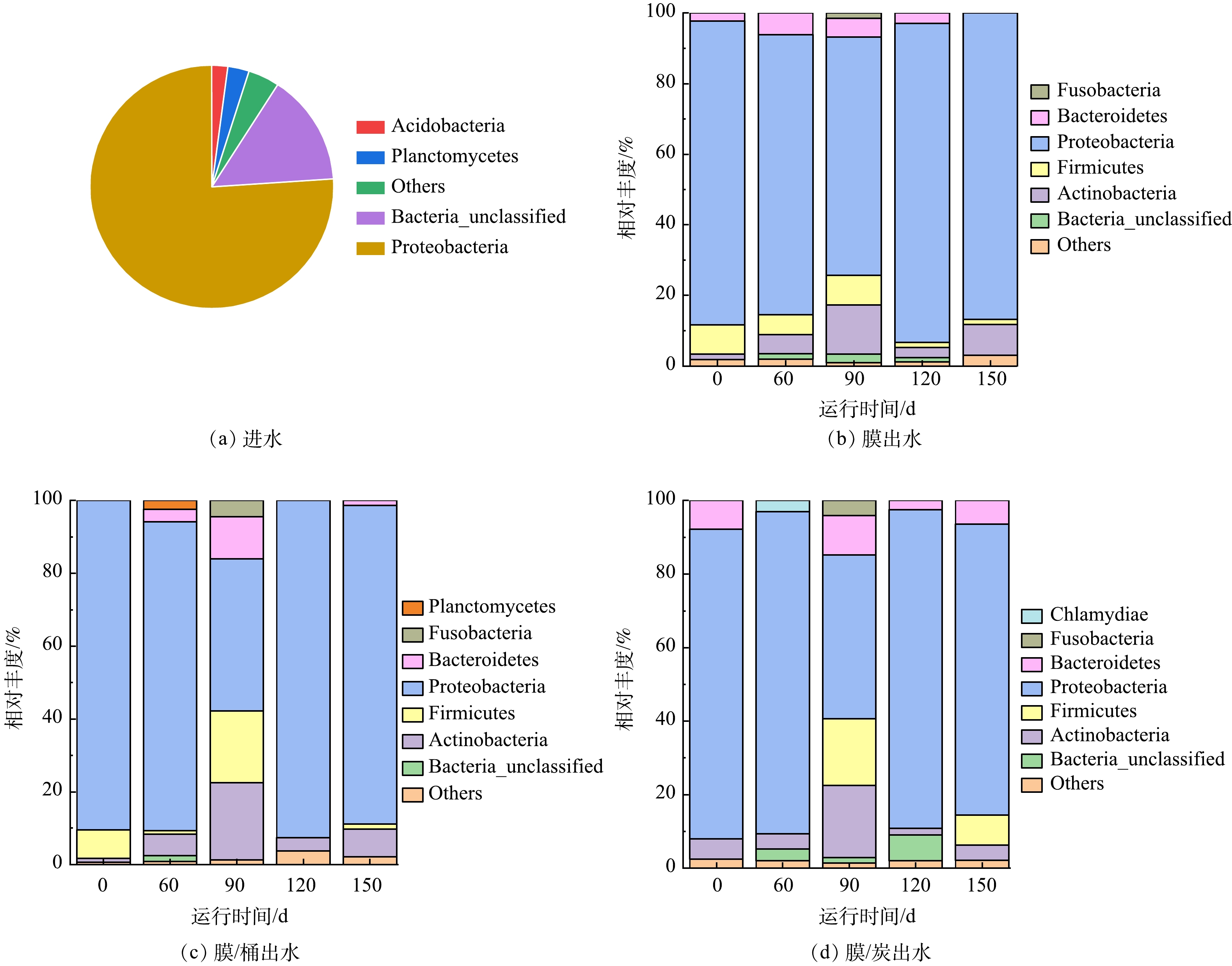
利用 Miseq 高通量测序分析技术在门水平上对测序结果进行归类,分析所取样品的菌群组成及相对丰度差异,结果如图3(a)所示。在属水平上,在所取的12个样品中,共检测出363个菌属,各水样中相对丰度均大于1%的菌属共有13个,水样菌群组成如图3(b)所示。净水器进水和膜出水、膜-桶出水、膜-炭出水在门水平上微生物群落结构大部分相似,但也存在差异。由图3(a)可见,在门水平上,膜出水、膜-桶出水、膜-炭出水共统计到22个菌门。其中变形菌门(Proteobacteria)是净水器进水和膜出水、膜-桶出水、膜-炭出水在0~150 d运行过程中的优势菌门,相对丰度为 65.46%~92.08%,这与大多数研究[17]结果相似。净水器进水的优势菌门为浮霉菌门(Planctomycetes)和酸杆菌门(Acidobacteria),而这2个菌门在膜出水、膜-桶出水和膜-炭出水均未检测出,说明单独纳滤、纳滤-压力桶和纳滤-活性炭3种处理方式对该2种菌门有拦截过滤作用。在膜出水中,在0~90 d运行过程中,厚壁菌门(Firmicutes)是仅次于变形菌门(Proteobacteria)的优势菌门;在90~150 d运行过程中,放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)相对丰度占比多。在膜/桶出水中,运行0 d时厚壁菌门(Firmicutes)仅次于变形菌门(Proteobacteria),而在60~90 d,放线菌门(Actinobacteria)相对丰度比较高。在膜-炭出水中,运行0 d的第2优势菌门为拟杆菌门(Bacteroidetes)。从0~150 d运行过程来看,90 d时膜出水、膜-桶出水和膜-炭出水的拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)相对丰度达到峰值,相对来说,变形菌门(Proteobacteria)达到最低值;单独纳滤、纳滤-压力桶和纳滤-活性炭3种处理方式对放线菌门(Actinobacteria) 均不能完全去除和拦截,导致在膜出水、膜-桶出水和膜-炭出水的每个运行时间点均有被检出。PARK等[18]报道纳滤膜形成的生物膜污染,导致变形菌门(Proteobacteria)占比升高,促进输配水系统的细菌粘附和细胞增殖。此外,有研究[19]表明,城市水厂出水的变形菌门(Proteobacteria)作为优势菌门,占比高,且随时间延长的变化较小。放线菌门(Actinobacteria)为膜出水、膜-桶出水和膜-炭出水中占比高的菌门,表明纳滤膜过滤水样的微生物群落结构中放线菌门(Actinobacteria)为优势菌种。葛英亮等[20-21]研究表明,在门水平上,生物活性炭滤后水的细菌最为分散且分类数最高,说明活性炭可能在水处理过程中放大了微生物泄漏风险。随着时间推移,引起微生物群落结构特征变化的原因很多,如滤芯孔径因杂质的堆积而变小造成对尺寸较大菌种的拦截能力增强,进而减小其相对丰度;研究认为厚壁菌门与碱度呈负相关,与有机质呈正相关,随着净水器运行时间的增加[22],其出水酸碱度和有机质都有可能发生变化,即造成了微生物结构特征变化。
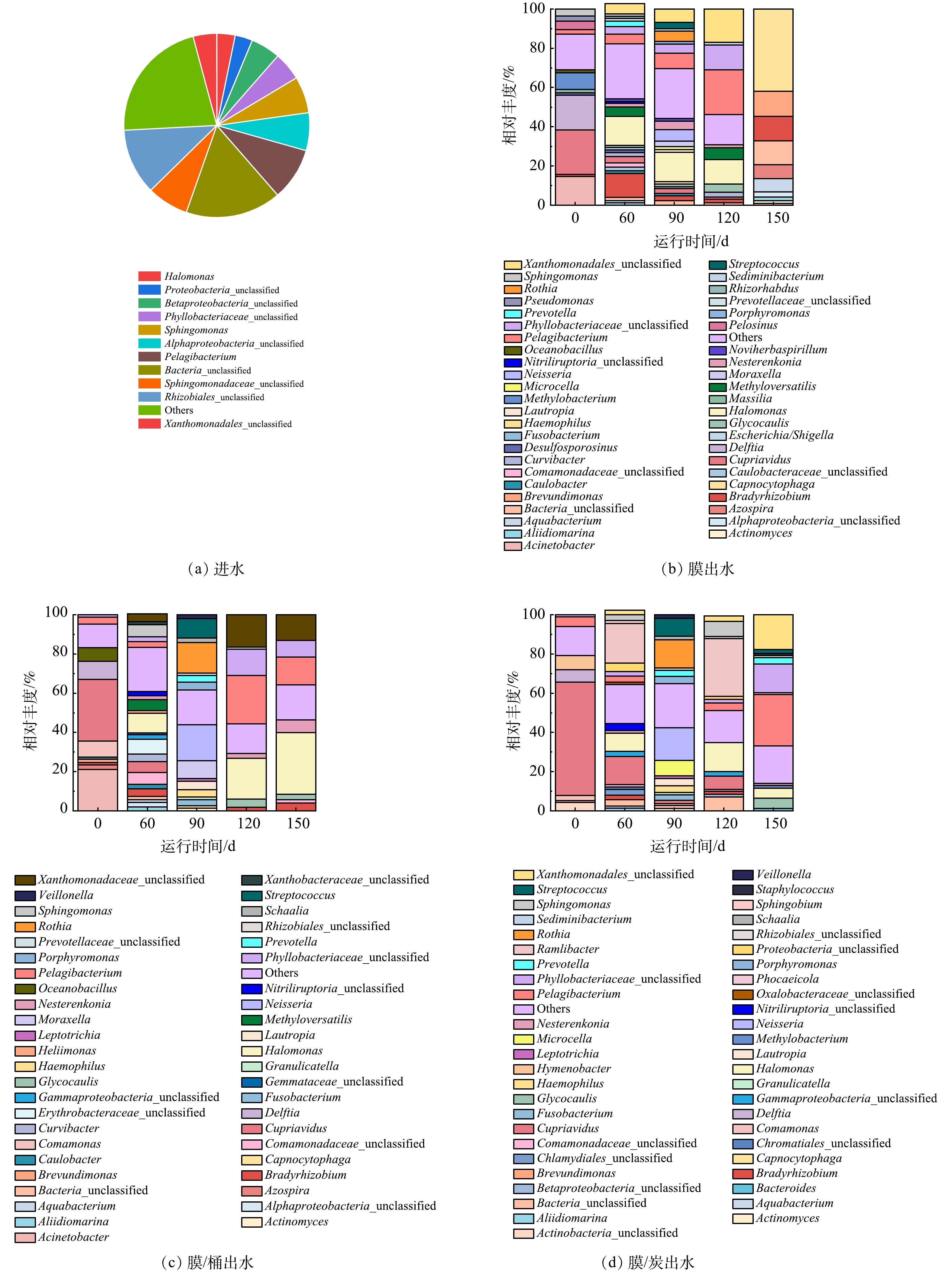
如图4可见,从群落结构看,膜过滤及后置工艺对出水菌属的构成造成较大的影响。在属水平上,净水器进水优势菌属为Rhizobiales_unclassified和Sphingomonadaceae_unclassified,相对丰度分别为19.30%和19.09%。膜出水、膜-桶出水和膜-炭出水在0~150 d运行过程的菌属组成略有差异。以膜出水为例,运行0 d的优势菌属为Delftia、Methylobacterium、Cupriavidus和Acinetobacter,运行60 d时优势菌属为Bradyrhizobium和Halomonas,在运行60 d时Bradyrhizobium的相对丰度高达12.09%,其他运行阶段微生物群落结构相似,Phyllobacteriaceae_unclassified、Pelagibacterium、Xanthomonadales_unclassified、Halomonas4种优势菌属的总相对丰度在28.71%~73.47%。在膜-桶出水中,运行初始时Cupriavidus和Acinetobacter的相对丰度占比52.66%,运行60 d和90 d时各菌属分布占比较平均,运行120~150 d期间Phyllobacteriaceae_unclassified、Pelagibacterium、Xanthomonadaceae_unclassified、Halomonas的相对丰度较高,分别为75.37%和67.30%。在膜-炭出水中,运行过程0 d时,Cupriavidus占比57.92%,是最大的优势菌属;在运行60、90、120和150 d时优势菌属分别为Ramlibacter、Neisseria、Ramlibacter和Pelagibacterium。针对膜出水、膜-桶出水、膜-炭出水来说,运行0 d时Cupriavidus相对丰度最高,净水器运行后其相对丰度均降低,说明净水器对该菌属有去除作用。杜尔登等[23]报道饮用水处理系统不同来源活性炭的微生物群落优势种群是β-Proteobacteria和α-Proteobacteria。据报道,经净水器过滤的饮用水细菌密度在前置活性炭和纳滤后分别增加1倍和1.7倍,经储水设备再次增加1倍,这是由于净水器的水停滞以及输水管和组件内形成生物膜所致[24]。一般来说,纳滤膜能够拦截多种微生物及病原体。但是PARK报道纳滤膜过滤自来水后,α-proteobacteria、β-proteobacteria和γ-proteobacteria在纳滤膜的生物膜中占比高,表明纳滤膜促进饮用水细菌的粘附和细胞增殖[18],这与本研究结果相似。VRIES等[25]调查被污染反渗透膜和纳滤膜的细菌群落,发现Rhizobiales、Sphingomonadaceae和Xanthomonadales是优势菌属,这与本研究中净水器的膜出水、膜-桶出水和膜-炭出水优势菌种一致。
-
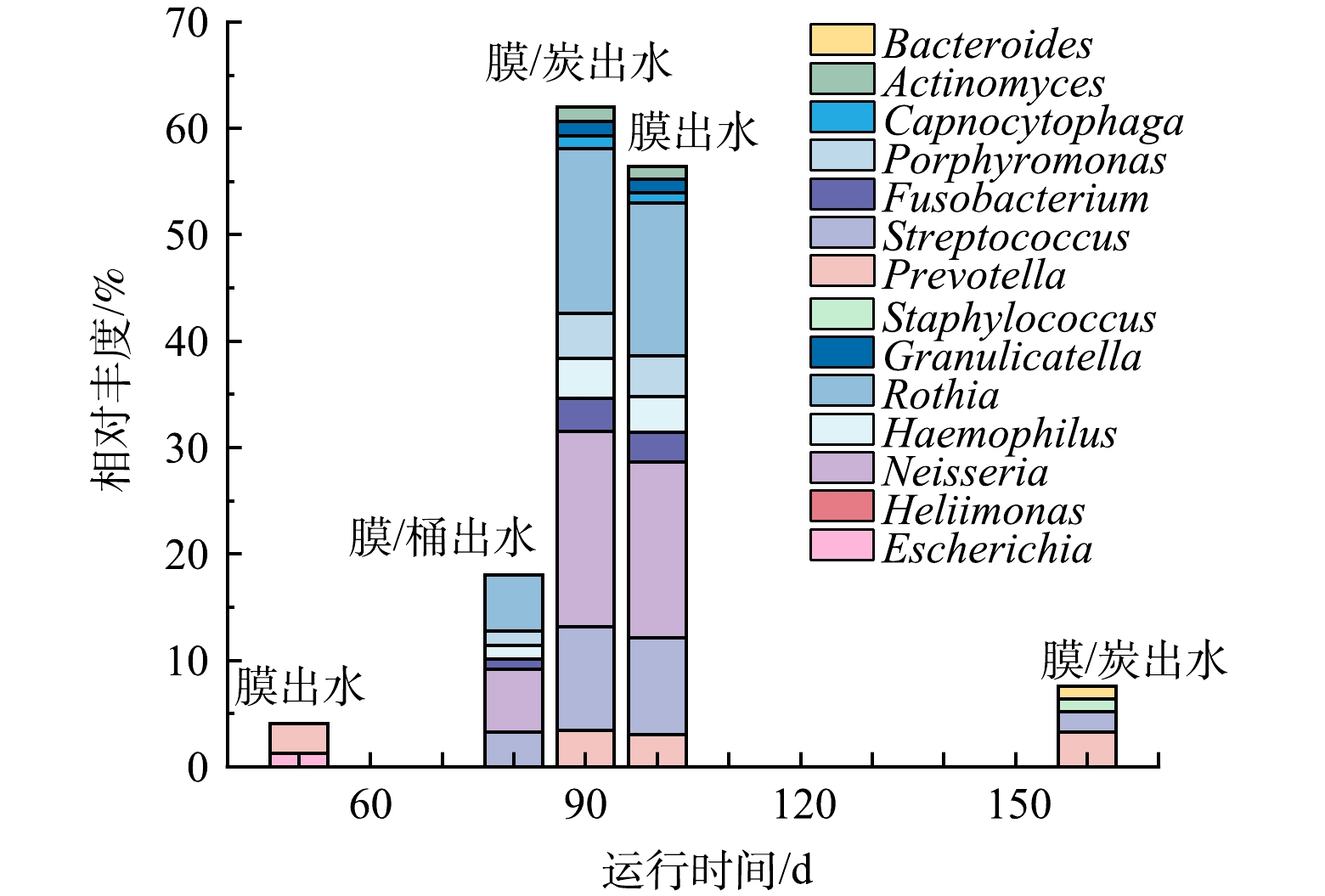
为了控制微生物风险,通常在进入饮用水分配系统之前对水进行消毒以杀死病原体。然而,一些顽固细菌会留在水中,甚至在管道中增殖和生长,传统的处理技术不能有效地去除所有的化学和微生物污染物[6]。净水器运行60~150 d,膜出水、膜-桶出水和膜-炭出水中有致病风险或条件致病风险的菌属归类为风险微生物,共检出14个风险菌属,分别属于变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)4种菌门。如图5所示,从数量方面分析,净水器进水未检出潜在病原菌,膜出水、膜-桶出水和膜-炭出水的潜在病原菌数量分别为8、10和12种。其中Streptococcus、Neisseria、Prevotella、Haemophilus、Porphyromonas、Rothia未在进水中发现,而在膜出水、膜-桶出水和膜-炭出水中均有检出,说明这几种病原菌的产生可能与纳滤膜有关,也说明净水器运行过程膜出水、膜-桶出水、膜-炭出水的潜在病原微生物污染风险提高。从相对丰度方面分析,膜出水、膜-桶出水和膜-炭出水中占比最高的潜在病原菌属为Neisseria,且均在90 d时检出,相对丰度为5.90%、18.36%和16.56%。其中N. gonorrhoeae (淋球菌)感染可引起泌尿生殖系统的化脓性感染,是常见的性传播疾病之一。同时,N. gonorrhoeae (淋球菌)可诱发淋球菌血症,导致腱鞘炎、化脓性关节炎,甚至心内膜炎和脑膜炎[26]。其次为Rothia,在90 d时检出最多,在膜出水、膜-桶出水和膜-炭出水中相对丰度分别为5.31%、15.55%和14.32%,仅次于Neisseria。Rothia在免疫功能低下的宿主中可引起严重感染,Rothia mucilaginosa(粘液罗氏菌)菌血症的危险因素包括长期和深度中性粒细胞减少、恶性肿瘤和留置血管异物[27]。
从净水器运行时间分析,风险微生物的检出集中在90 d。在运行60 d时膜出水有2种风险微生物检出,膜-桶出水和膜-炭出水则未检出风险微生物;在运行120 d时净水器3组出水均无风险微生物检出;在150 d时膜-炭出水有4种风险微生物检出,膜出水和膜/桶出水均未检出风险微生物。这主要因为净水器在运行过程中出现膜污染,在第90天时膜污染最严重,引发风险微生物的集中检出。
-
选取净水器运行150 d的净水器进水、膜出水、膜/桶出水和膜/炭出水样品进行功能基因通路分析。通过KEGG对水样基因序列进行微生物代谢功能分析,通过差异表达功能基因进行KEGG富集分析,KEGG富集程度以基因丰度来衡量。如图6所示,对于KO Level1层次上,净水器进水、膜出水、膜-桶出水、膜-炭出水4组样品,在新陈代谢功能模块中,编码相应功能的基因都呈现出在功能的多样性和丰度的显著优势。其次是遗传信息加工、环境信息加工和细胞过程模块编码相应功能的基因丰度较高,生物体系统、人类疾病和未分类模块编码相应功能的基因丰度较低,这个结果与已报道的研究[28]结果吻合。在KO Level2层次上,碳水化合物代谢、氨基酸代谢是基因组中最大的类群,第2和第3大类群是膜运转、辅助因子和维生素代谢、能量代谢、外来物质的降解与代谢、信号传导、脂类代谢,此外,复制和修复、核苷酸代谢、萜类和酮类化合物代谢、其他氨基酸代谢以及细胞运动也具有一定的丰度,这与之前的报道结果相似[29]。在同一功能基因下,膜-桶出水和膜-炭出水的功能基因数量高于膜出水和净水器进水,这可能是由于经过150 d运行,压力桶表面和活性炭形成生物膜有利于微生物生长,因此,具有相对特定生态功能的微生物数量高于后者,新陈代谢等相关活动更活跃。在环境信息加工模块中,参与膜运转的功能有明显优势,其次是参与信号传导的功能。在细胞过程模块中,占优势的为与细胞运动相关的功能,其次是与细胞生长和死亡、运输和代谢相关的功能。
-
1)膜出水、膜-桶出水、膜-炭出水的微生物多样性和丰富度都小于净水器进水,膜-桶出水和膜-炭出水的微生物多样性和丰富度高于膜出水,说明单独纳滤、纳滤-压力桶和纳滤-活性炭3种处理工艺能对微生物进行去除,且纳滤-压力桶和纳滤-活性炭更容易发生微生物富集。
2)相较于膜出水,膜-桶出水和膜-炭出水在运行90 d检出更高水平的厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),这是因为纳滤-压力桶和纳滤-活性炭更利于微生物富集。净水器运行过程中,膜出水、膜-桶出水和膜-炭出水共检出14个风险菌属,3种处理工艺优势的风险菌属均为Neisseria和Rothia,但是各自风险菌属组成略有差异。
3) KEGG通路分析表明,膜出水、膜-桶出水和膜-炭出水中各种功能表达基因的丰度均高于净水器进水,其中纳滤-活性炭出水功能表达基因的丰度最高,证明净水器运行150 d后净化效果变差,提示净水器活性炭更容易产生微生物污染,使用过程中要注意及时更换滤芯。
终端净水器膜过滤及后置工艺对水中微生物群落结构特征的影响
The influence of membrane filtration and post installation process of terminal water purifiers on the structural characteristics of microbial communities in water
-
摘要: 为探究终端净水器(简称净水器)的微生物污染情况以及群落结构的差异,采用净水器对城市管网水进行150d处理,将纳滤出水分别连接压力储水设备或者后置活性炭滤芯进行处理,并利用16S rRNA扩增子技术检测净水器进水、净水器3组出水(单独纳滤出水、纳滤结合压力桶出水、纳滤结合活性炭出水)的微生物群落。结果表明,单独纳滤、纳滤结合压力桶、纳滤结合活性炭3种处理工艺导致净水器出水在水质指标、Alpha多样性和微生物群落结构上有差异。净水器3组出水优势菌门以变形菌门(Proteobacteria),放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)为主,但纳滤结合压力桶出水和纳滤结合活性炭出水在运行90 d时,相较于单独纳滤出水,检出更高水平的厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes) ,说明纳滤结合压力桶和纳滤结合活性炭能进行显著地微生物富集。净水器3组出水共检出14个风险菌属,相对丰度最高的为Neisseria和Rothia。净水器出水中各种功能表达基因的数量均高于净水器进水,其中纳滤/活性炭出水功能表达基因的数量最高。
-
关键词:
- 终端净水器 /
- 纳滤 /
- 纳滤结合压力桶 /
- 纳滤结合活性炭 /
- 16S rRNA 扩增子
Abstract: To investigate the microbial contamination of terminal water purifiers which is referred to as water purifiers and the differences in community structure, this study utilized water purifiers to treat water sourced from the urban pipeline network over a period of 150 days. The nanofiltration effluent was connected to either a pressure storage device or a post activated carbon filter for treatment. The influent to the water purifiers, along with three groups of effluent—nanofiltration effluent alone, nanofiltration combined with a pressure bucket, and nanofiltration combined with activated carbon—was analyzed using 16S rRNA amplicon technology. The results showed that three treatment processes, namely nanofiltration, nanofiltration/pressure bucket, and nanofiltration/activated carbon, resulted in differences in water quality indicators, alpha diversity, and microbial community structure in the effluent of the water purifier. The dominant bacterial phyla in the effluent of the three groups of water purifiers are Proteobacteria, Actinobacteria, and Bacteroides. However, after 90 days of operation, higher levels of Firmicutes and Bacteroides were detected in the effluent of nanofiltration/pressure bucket and nanofiltration/activated carbon compared to the effluent of nanofiltration alone, indicating that nanofiltration/pressure bucket and nanofiltration/activated carbon can significantly enrich microorganisms. A total of 14 risk bacterial genera were detected in the effluent of the three groups of water purifiers, with Neisseria and Rothia having the highest relative abundance. The number of functional expression genes in the effluent of the water purifier is higher than that in the influent, with the highest number of functional expression genes in the effluent of nanofiltration/activated carbon. -

-
表 1 Alpha多样性指数统计表
Table 1. Alpha Diversity Index Statistics Table
样品 Chao Ace Shannon Simpson 覆盖度/% 进水 1 032.26 1027.35 4.43 0.06 99.3 膜出水0 300.58 292.31 2.10 0.31 99.4 膜出水60 d 282.14 294.90 3.38 0.10 99.5 膜出水90 d 390.36 432.36 3.42 0.08 99.2 膜出水120 d 341.92 349.15 2.77 0.16 99.3 膜出水150 d 262.60 266.85 2.30 0.25 99.5 膜-桶出水0 171.11 173.42 1.95 0.32 99.8 膜-桶出水60 d 286.33 291.84 3.66 0.06 99.7 膜-桶出水90 d 888.96 1071.21 4.00 0.05 98.6 膜-桶出水120 d 341.51 336.89 2.56 0.19 99.5 膜-桶出水150 d 363.41 365.84 2.65 0.19 99.5 膜-炭出水 0 201.79 210.35 1.65 0.52 99.8 膜-炭出水 60 d 345.54 314.65 3.04 0.15 99.7 膜-炭出水 90 d 775.86 756.69 4.15 0.04 99.3 膜-炭出水 120 d 427.16 385.00 2.71 0.19 99.6 膜-炭出水 150 d 473.56 466.39 3.04 0.13 99.6 -
[1] 滕恺, 武道吉, 任会学, 等. 家用净水器净水材料标准与卫生安全性探讨[J]. 净水技术, 2019, 38(9): 68-74+99. [2] KIMURA K, AMY G, DREWES J E, et al. Rejection of organic micropollutants (disinfection by-products, endocrine disrupting compounds, and pharmaceutically active compounds) by NF/RO membranes[J]. Journal of Membrane Science, 2003, 227(1): 113-121. [3] 杨方威, 冯叙桥, 曹雪慧, 等. 膜分离技术在食品工业中的应用及研究进展[J]. 食品科学, 2014, 35(11): 330-338. [4] HABIMANA O, HEFFERNAN R, CASEY E. Nanofiltration-induced cell death: An integral perspective of early stage biofouling under permeate flux conditions[J]. Journal of Membrane Science, 2017, 541: 93-100. doi: 10.1016/j.memsci.2017.07.004 [5] 张健, 赵长伟, 宋娜, 等. 纳滤去除饮用水中的PFOS[J]. 环境工程学报, 2013, 7(11): 4236-4240. [6] LIN W, YE C, GUO L, et al. Analysis of microbial contamination of household water purifiers[J]. Applied Microbiology and Biotechnology, 2020, 104(10): 4533-4545. doi: 10.1007/s00253-020-10510-5 [7] 周昭彦, 胡必杰, 鲍容, 等. 净水器微生物污染状况调查及影响因素分析[J]. 中华医院感染学杂志, 2012, 22(12): 2580-2582. [8] SU F, LUO M, ZHANG F, et al. Performance of microbiological control by a point-of-use filter system for drinking water purification[J]. Journal of Environmental Sciences, 2009, 21(9): 1237-1246. doi: 10.1016/S1001-0742(08)62410-9 [9] STRING G, DOMINI M, MIRINDI P, et al. Efficacy of locally-available cleaning methods in removing biofilms from taps and surfaces of household water storage containers[J]. NPJ Clean Water, 2020, 3(1): 13. doi: 10.1038/s41545-020-0061-y [10] 徐梦瑶. 管网多相界面抗性基因在终端净水工艺中的扩散和控制[D]. 北京: 北京工商大学, 2020. [11] 尹朗, 赵丹, 张素佳, 等. 饮用水管网生物膜细菌群落特征及其对腐蚀的影响[J]. 环境工程学报, 2016, 10(10): 5453-5458. [12] 刘亚妮, 朱宏伟, 黄荣新, 等. 曝气生态滤池中微生物群落组成及物种多样性[J]. 中国环境科学, 2020, 40(3): 1075-1080. [13] 王智, 张志勇, 张君倩, 等. 水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征[J]. 中国环境科学, 2012, 32(1): 142-149. [14] 杨浩, 张国珍, 杨晓妮, 等. 水窖沉积物中微生物群落及其与环境因子的相关性[J]. 兰州交通大学学报, 2018, 37(3): 110-115. [15] SHU D, HE Y, YUE H, et al. Metagenomic insights into the effects of volatile fatty acids on microbial community structures and functional genes in organotrophic anammox process[J]. Bioresource Technology, 2015, 196: 621-633. doi: 10.1016/j.biortech.2015.07.107 [16] ZHOU Z, XU L, ZHU L, et al. Metagenomic analysis of microbiota and antibiotic resistome in household activated carbon drinking water purifiers[J]. Environmental International, 2021, 148: 106394. doi: 10.1016/j.envint.2021.106394 [17] WOLF-BACA M, SIEDLECKA A. Seasonal and spatial variations of antibiotic resistance genes and bacterial biodiversity in biofilms covering the equipment at successive stages of drinking water purification[J]. Journal of Hazardous Materials, 2023, 456: 131660. doi: 10.1016/j.jhazmat.2023.131660 [18] PARK S K, CHOI J H, HU J Y. Assessing bacterial growth potential in a model distribution system receiving nanofiltration membrane treated water[J]. Desalination, 2012, 296: 7-15. doi: 10.1016/j.desal.2012.03.022 [19] EL-CHAKHTOURA J, PREST E, SAIKALY P, et al. Dynamics of bacterial communities before and after distribution in a full-scale drinking water network[J]. Water Research, 2015, 74: 180-190. doi: 10.1016/j.watres.2015.02.015 [20] 葛英亮, 于水利, 时文歆, 等. 应用Illumina MiSeq高通量测序技术解析O_3-BAC饮用水处理过程细菌多样性变化[J]. 食品科学, 2016, 37(16): 223-228. [21] LIAO X, CHEN C, WANG Z, et al. Changes of biomass and bacterial communities in biological activated carbon filters for drinking water treatment[J]. Process Biochemistry, 2013, 48(2): 312-316. doi: 10.1016/j.procbio.2012.12.016 [22] WU H, ZHANG J, MI Z, et al. Biofilm bacterial communities in urban drinking water distribution systems transporting waters with different purification strategies[J]. Applied Microbiology and Biotechnology, 2015, 99(4): 1947-1955. doi: 10.1007/s00253-014-6095-7 [23] 杜尔登, 郑璐, 冯欣欣, 等. 饮用水处理中不同来源生物活性炭微生物群落多样性和结构研究[J]. 环境科学, 2014, 35(11): 4163-4170. [24] PARK J W, PARK K Y, NA Y, et al. Evaluation of organic migration and biomass formation on polymeric components in a point-of-use water dispenser[J]. Water Research, 2019, 165: 115025. doi: 10.1016/j.watres.2019.115025 [25] DE VRIES H J, STAMS A J M, PLUGGE C M. Biodiversity and ecology of microorganisms in high pressure membrane filtration systems[J]. Water Research, 2020, 172: 115511. doi: 10.1016/j.watres.2020.115511 [26] TAPSALL J W. Antibiotic resistance in neisseria gonorrhoeae[J]. Clinical Infectious Diseases, 2005, 41(Supplement_4): S263-S268. [27] RAMANAN P, BARRETO JN, OSMON DR, et al. Rothia bacteremia: a 10-year experience at Mayo Clinic, Rochester, Minnesota[J]. Journal of Clinical Microbiology, 2014, 52(9): 3184-9. doi: 10.1128/JCM.01270-14 [28] 崔若琪, 白淼, 张玲悦, 等. 不同类型饮用水污染情况及微生物群落结构特征分析[J]. 食品研究与开发, 2023, 44(19): 152-158. doi: 10.12161/j.issn.1005-6521.2023.19.022 [29] ZHOU Q, HUANG J, GUO K, et al. Spatiotemporal distribution of opportunistic pathogens and microbial community in centralized rural drinking water: One year survey in China[J]. Environmental Research, 2023, 218: 115045. doi: 10.1016/j.envres.2022.115045 -



 下载:
下载: