-
有机磷、氨基甲酸酯类农药具有广谱杀虫性、降解快、生物积累量低等特点,因此在粮食生产、果蔬栽培等领域得到了广泛应用[1]。近年来,由于农药被过度使用,导致其在粮食、果蔬和环境水体中残留程度不一,对环境和人体健康造成了潜在危害[2]。因此,建立一种快速、简便的定量方法来提纯富集环境水样中农药的含量尤为重要[3]。
在进行农药富集过程时,样品前处理技术显得尤为重要[4]。常用方法有固相萃取(SPE)[5]、磁性固相萃取(MSPE)[6]、液相微萃取(LPME)[7]和分散液相微萃取(DLLME)[8-11]。但这些方式仍存在缺点,如DLLME的萃取过程会降低分析物与萃取剂的分配系数,导致萃取效率下降[12-14]。为克服这一问题,磁力搅拌[15]、超声波[16]和涡旋[17]等技术的运用可有效改善分析物与萃取剂的分配系数。因此,开发一种合理的样品前处理技术显得尤为重要。
离子液体的应用是分析化学领域的一个研究热点,主要是因为离子液体(ILs)是非分子溶剂,在低于100 ℃的温度下保持液态,具有许多独特的性质,如可变粘度、高导电性和高热稳定性等[18]。例如,研究人员提出的基于离子液体-分散液液微萃取(IL-DLLME)方法来替代传统的分散液液微萃取(DLLME)方法[19-20],该方法不仅扩大了萃取溶剂的范围,还降低了有毒挥发性溶剂对操作人员的潜在危害。YOU et al[21]结合AALLME和IL-DLLME的优点,提出空气辅助液-液微萃取-离子液体(IL-AALLME)技术,该技术仅使用了少量的离子液体作为萃取溶剂,便得到了良好的实验结果。而空气辅助液-液微萃取-离子液体联用高效液相色谱-紫外法(HPLC-UV)还没有应用于水样中农药的分析。
因此,本文利用液-液微萃取技术和离子液体作为样品前处理,对水样中7种农药进行提取,再利用高效液相色谱测定目标物含量。此外,该实验还将对检测波长、流动相比、离子液体类型和体积、萃取时间、盐效应、pH等实验变量进行评估和优化。
-
所有化学品均为试剂级。甲砜霉素、氟苯尼考、水胺硫磷、甲基-对硫磷、三唑磷、甲基-毒死蜱和毒死蜱购自Sigma(美国)。[BMIM]PF6、[HMIM]PF6和[OMIM]PF6均购自Energy Chemical。NaCl是从Merck (Darmstadt, Germany)购买的。实际水样:自来水(重庆,西南大学实验室)和崇德湖(绵阳,中国),二者分别经滤纸过滤后储存于冰箱内。
称取一定量的各对照品于10 mL容量瓶中,甲醇稀释至刻度得到标准溶液(甲砜霉素、氟苯尼考、水胺硫磷、甲基-对硫磷、三唑磷、甲基-毒死蜱和毒死蜱)。最后将得到的标准品溶液作为储备液,置于4 ℃冰箱避光保存备用。
-
日本岛津LC-20A高效液相色谱仪(包括SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵),KH-3200B型超声波清洗器购买于昆山禾创超声仪器有限公司,SZ-2自动双重纯化水蒸馏装置购买于上海泸西分析仪器厂,XY型电热恒温干燥箱购买于上海精宏实验设备有限公司,FA2004A型分析天平购买于上海精天电子仪器有限公司,微量注射器(100 µL)。
色谱条件:RP-InertSustain C18 (150 mm×4.6 mm, 5 μm)。流动相A:甲醇,流动相B:0.1%乙酸溶液(pH 3.0),进行线性梯度洗脱;流速:0.8 mL/min;进样量:20 μL;检测波长:225 nm;柱温:35 ℃。
-
将一定量的水样和0.4 g NaCl同时放入15 mL含螺旋盖玻璃试管中,再取40 μL离子液体 ([BMIM] PF6)注入试管混匀;在此过程中,用针管将混合物不断地反复抽动,促使离子液体以细小的液滴形式分散在水样中;再对试管进行超声和离心,保留下层液体相并将其溶解于50 μL甲醇中。最后,微量注射器取20 μL注入高效液相色谱系统进行分析。
-
为得到最佳的萃取条件,本实验进行了检测波长、流动相比、离子液体类型和体积、萃取时间和盐效应等一系列条件评估及优化,所有实验均为3次(n=3)。
-
本实验分析了7种目标分析物的最佳波长,并决定研究波长为210、215、220、225和230 nm。结果表明,在225 nm处,7种目标物的峰面积最大,峰形最佳。因此,后续实验研究选择225 nm作为检测波长。
-
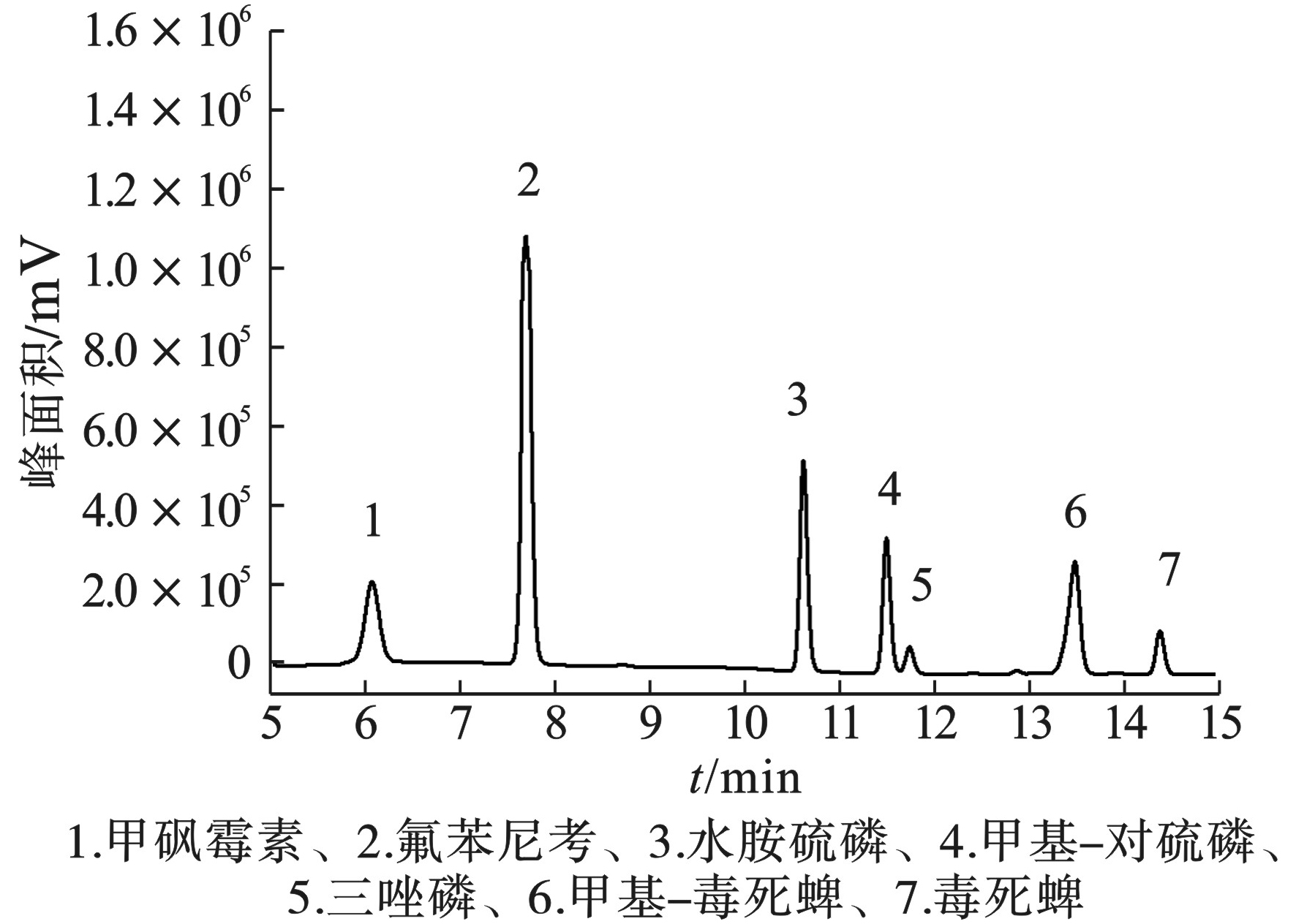
高效液相色谱中流动相的选择是影响分辨率的关键因素。本实验研究了甲醇水溶液的不同体积比(甲醇-0.3%乙酸、甲醇-0.2%乙酸、甲醇-0.1%乙酸)。结果显示,当选择甲醇-0.1%乙酸为流动相时,7种目标物的分离效果最好。因此,选择甲醇-0.1%乙酸作为流动相进行实验。在最佳色谱条件下,得到最佳色谱图,见图1。
-
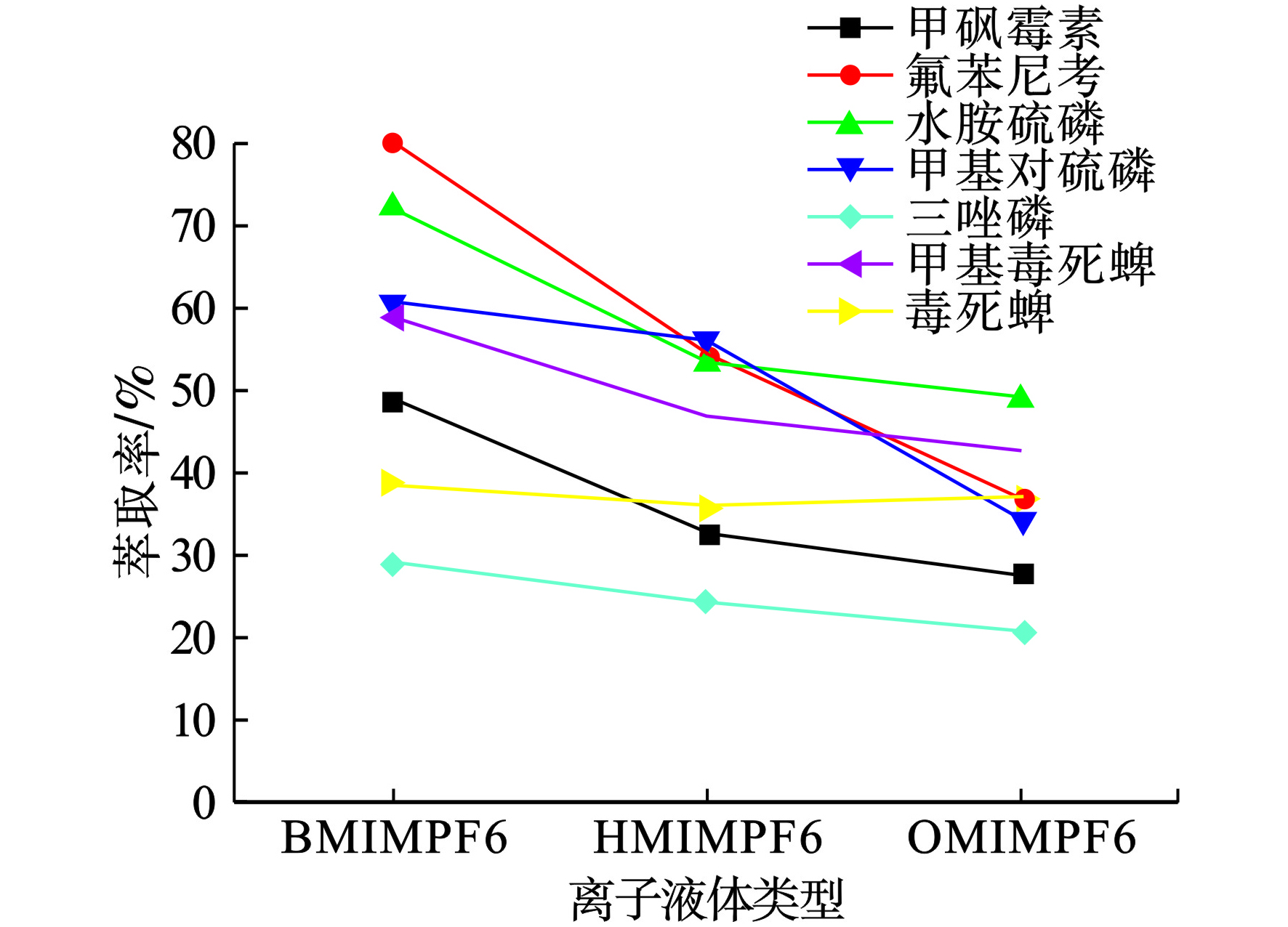
萃取溶剂在萃取过程中起着重要的作用,萃取溶剂必须具备低毒性、密度比水低、分析物萃取效率高、室温下熔点低且与HPLC色谱分离相容等特征[15, 22]。为了选择合适的萃取溶剂,本文研究了离子液体([BMIM]PF6、[OMIM]PF6和[HMIM]PF6)的影响,见图2。
图2可见,[BMIM]PF6的萃取效率优于其他两种,这可能是因为它对目标分析物有更好的溶解能力。因此,后续试验选择[BMIM]PF6作为萃取溶剂。
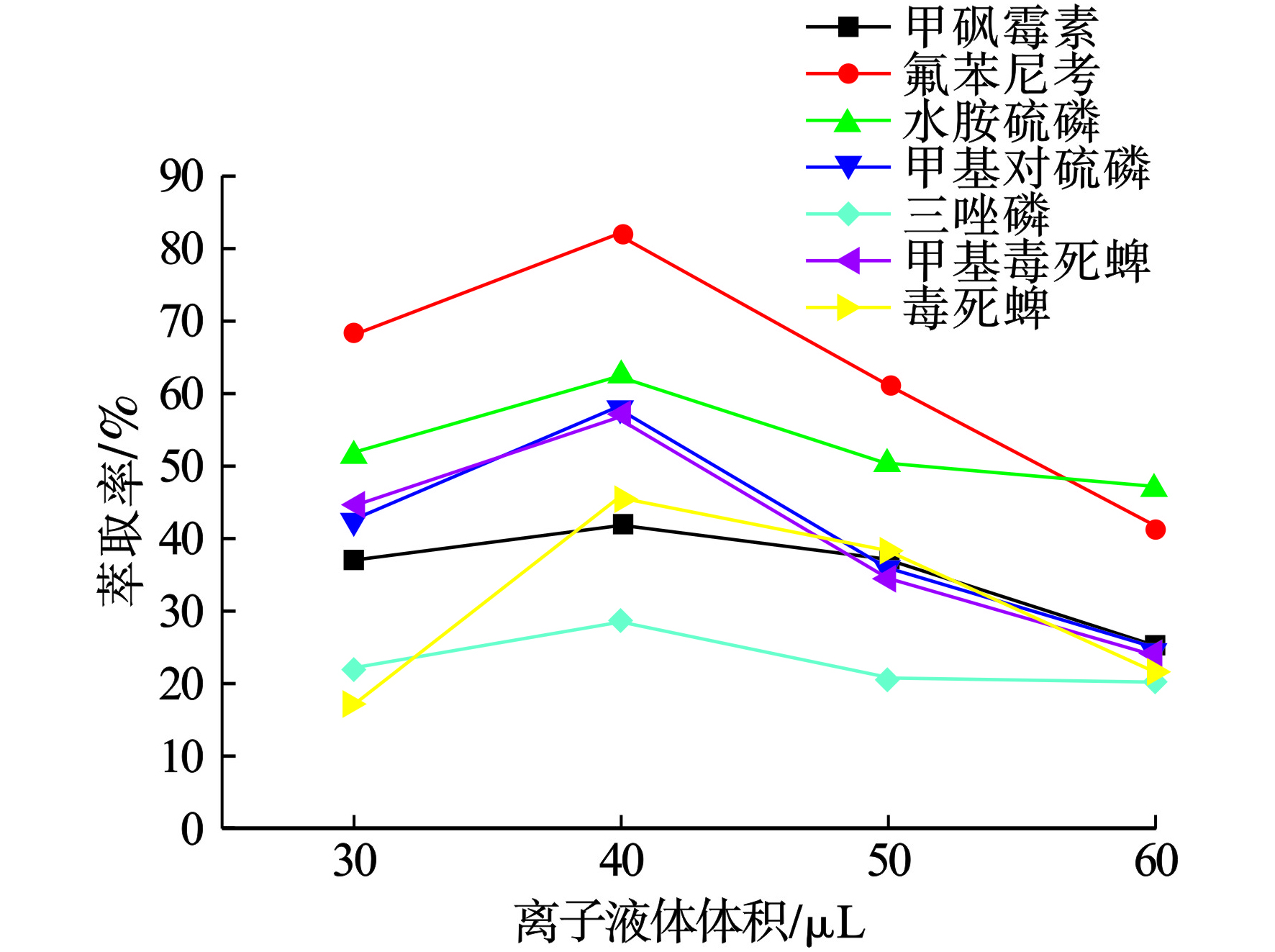
为了获得最优萃取体积,考察了不同体积[BMIM] PF6(30~60 μL)的影响。当体积从30增加到40 μL时,目标分析物的萃取率逐渐上升,当再增加离子液体体积时,目标分析物的萃取率逐渐降低。因此,后续实验研究选择[BMIM] PF6体积为40 μL,见图3。
-
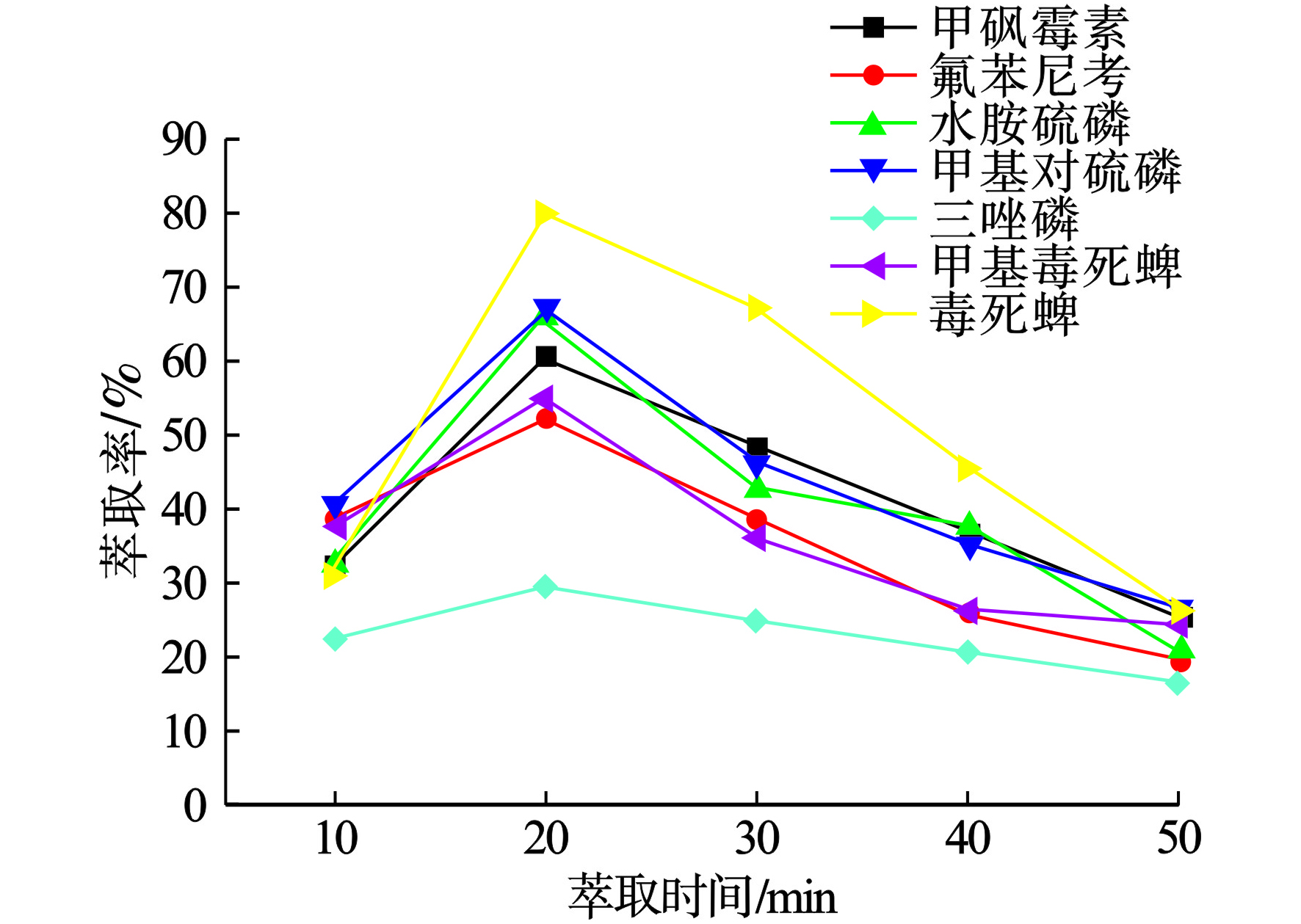
实验探讨了萃取时间(10~50 min)对实验结果的影响。当提取时间从10增加到20 min时,各种农药均有较好的峰面积及萃取率。然而,当时间被延长后,目标分析物不能得到良好的峰面积且部分目标物萃取率逐渐降低,因此,在后续研究中选取萃取时间为20 min见图4。
-
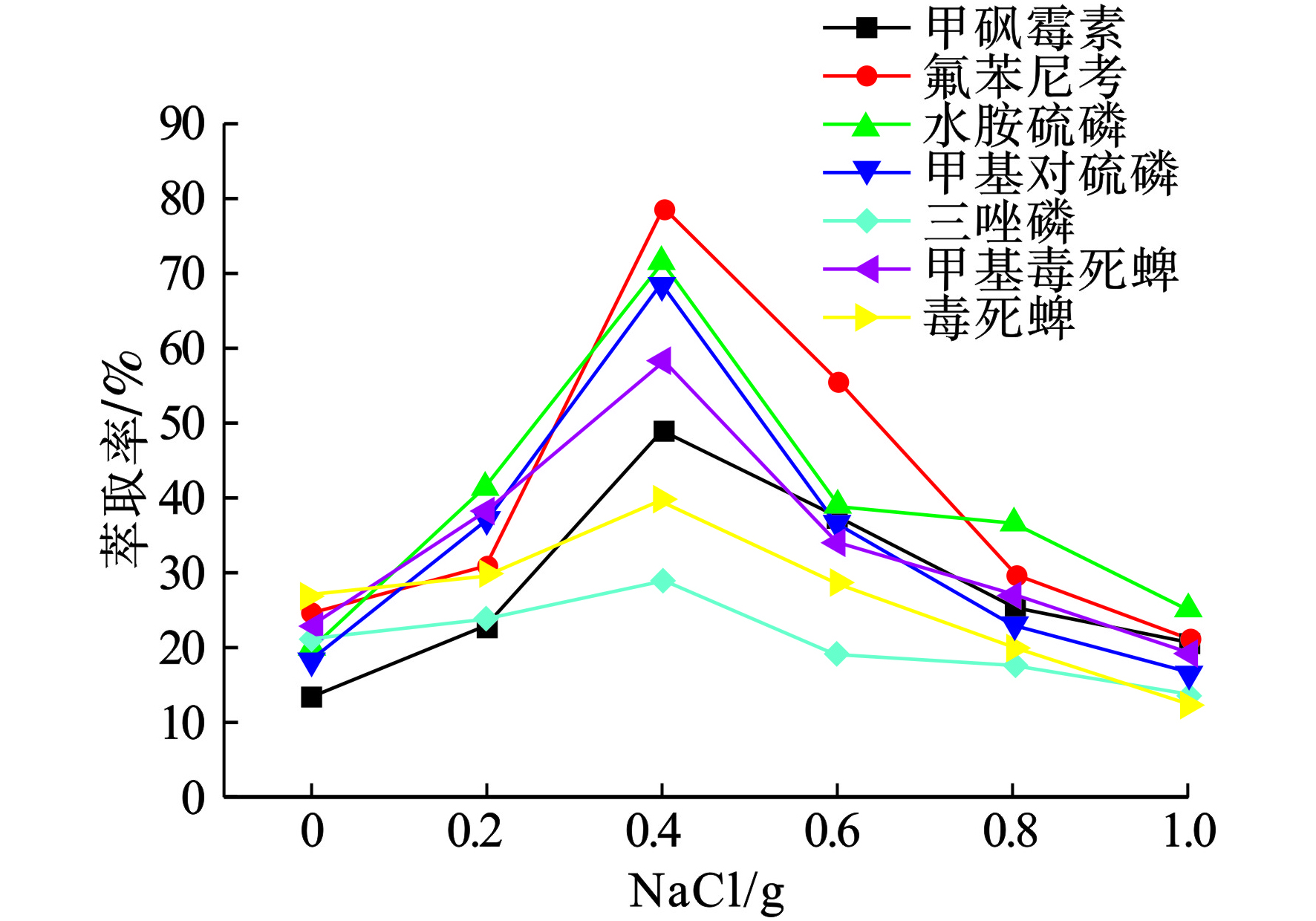
无机盐的加入会对提取结果产生不同的影响[22-23]。一方面,盐效应可能会降低分析物在水溶液中的溶解度,进而改变在有机相中的分配[24-26]。另一方面,随着离子强度增加,水溶液的粘度和密度也增强,从而降低传质效率过程[27]。此外,离子交换过程可以增强ILs在水相中的溶解度并降低提取效率[28]。因此,本文研究了氯化钠的量(0~1.0 g)对实验的影响,见图5。
图5可见,当盐的用量从0增加到0.4 g时,有利于提高水相中萃取溶剂的萃取效率,而随着盐的增加(0.4~1.0 g),许多目标分析物在高离子强度下受到抑制,并呈现出降低趋势。因此,后续实验使用0.4 g NaCl进行。
-
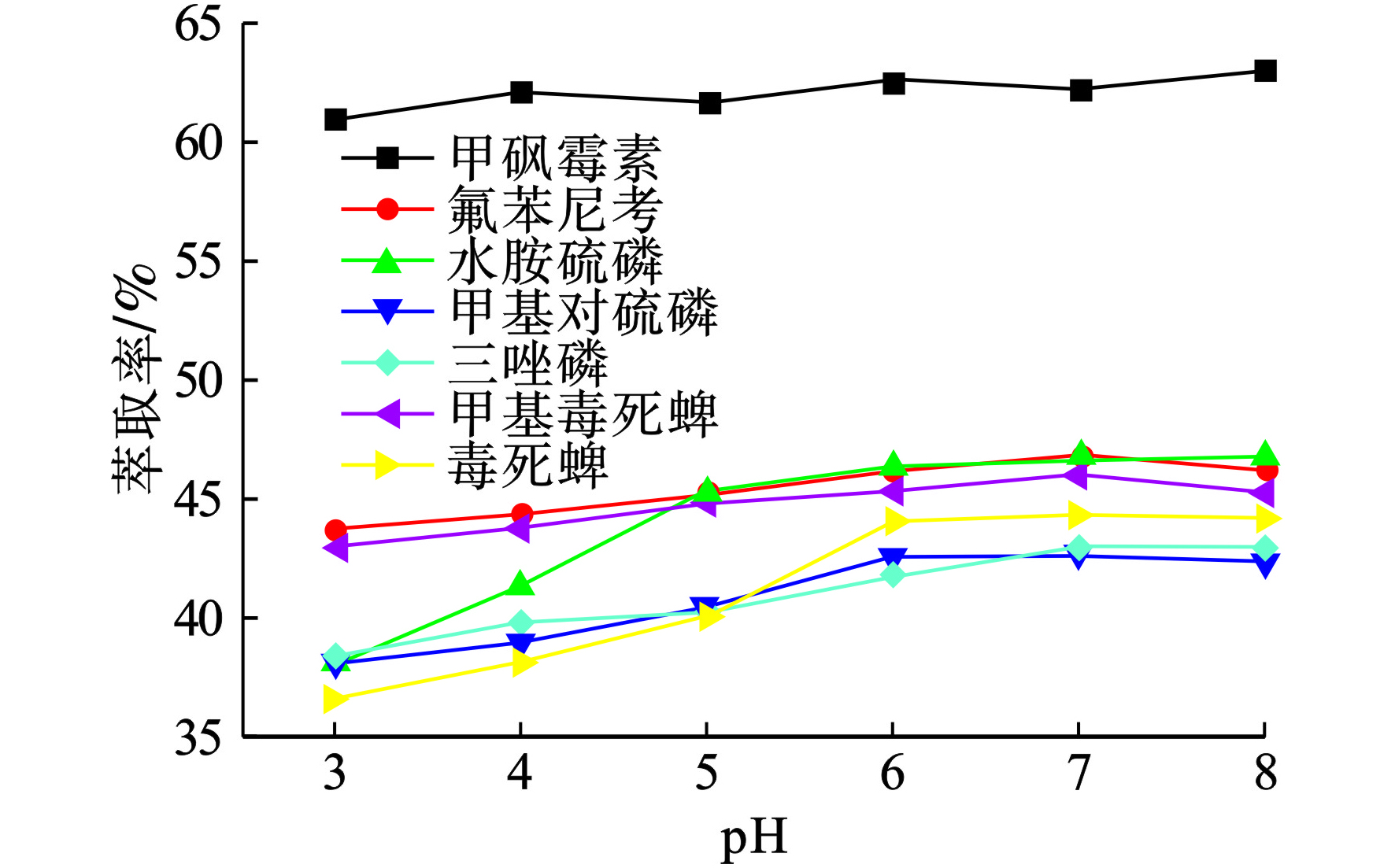
pH影响目标分析物的存在形式,因此探究了pH对IL-AALLME萃取效率的影响。该过程用CH3COOH和NaOH调节pH。当pH在3~7之间时,目标分析物的萃取率呈上升趋势;而随着pH从7增加到8时萃取率略有下降,见图6。
图6可见,pH值选择6~7进行后续研究且不需要对样品进行pH调整。
-
为了对该方法进行评估,在优化的提取条件下进行了一系列线性和重复性实验,研究了该方法的可行性。最后,通过绘制平均峰面积与样品质量浓度的关系,得到了标准曲线。各目标分析物的线性方程及线性范围,见表1。7种农药在各自的线性范围内线性关系良好,相关系数(γ
)均不小于0.999 3。 -
为了在实际样品分析中对所提出的方法进行评价,本实验对绵阳市崇德湖和实验室自来水进行了水样分析。该过程向选择的两种样品溶液中分别加入标准分析物量10、20和30 μL并计算其回收率,结果见表2。
表2可知,两种水样中7种分析物的平均回收率分别为95.52%~97.12%和96.90%~104.06%。与此同时,崇德湖和自来水的RSD分别为1.88%~4.24%和2.57%~4.86%。结果表明,该方法用于环境水样中农药的分析是可靠的。
-
移取混合标准品溶液在相同色谱条件下重复进样6次,测定各个标准品的峰面积,结果表明甲砜霉素、氟苯尼考、水胺硫磷、甲基-对硫磷、三唑磷、甲基-毒死蜱和毒死蜱对照品的峰面积相对标准偏差均在123%~1.39%之间,试验结果表明仪器精密度良好。
-
用同一供试品溶液在两天内每间隔6 h连续进样测定,结果表明7种有效成分峰面积的相对标准偏差均在0.98%~2.12%之间,试验结果表明供试品溶液稳定性良好。
-
取同一时间点,同一地方水样6份,制备供试品溶液,进样分析,计算得到7种有效成分峰面积的相对标准偏差(n=6)在1.32%~1.72%之间,试验结果表明高效液相色谱仪仪器重复性良好。
-
本研究结合AALLME与IL-DLLME的优点成功检测出水样中7种农药成分含量。其中离子液体作为主要萃取溶剂,再结合液-液微萃取技术作为样品前处理,富集提纯目标物,HPLC技术进行分离分析。该过程与传统的前处理方法相比,不仅有助于解决预处理过程中耗时、劳动强度大的问题,还具有简便、快速和高效等特点,满足水样中农药的有效提取和准确测定,是一种环境友好型的分析方法。因此,该法有望成为水样中农药检测的新方法。
液-液微萃取技术测定环境水样中7种农药
Liquid–liquid Microextraction for the Determination of Seven Pesticides in Environmental Water Samples
-
摘要: 该研究建立了一种新型高效液相色谱-紫外分光光度法(HPLC-UV) 测定环境水样中7种农药含量。在优化后的条件下,使用离子液体作为萃取溶剂,与水样混合均匀促使其形成乳液,再利用液-液微萃取技术提取出目标物,该过程对环境友好无害。在最佳条件下,7种农药分离良好、标准曲线线性良好、相关系数(γ)均不小于0.999 3。结果还表明,自来水和崇德湖的相对标准偏差(RSD)分别为1.88%~4.24%和2.57%~4.86%。自来水和崇德湖的加标回收率分别为95.52%~97.12%和96.90%~104.06%。Abstract: An improved effective high performance liquid chromatography coupled to a ultraviolet detection (HPLC-UV) was developed for the determination of seven pesticides in environmental water samples in the study. The ionic liquid was used as the extraction solvent and mixed with the aqueous sample solution, thus forming the emulsion under the improved conditions. The target objects of the mixed solution were extracted by liquid-liquid microextraction technology. The process was harmless to the environment. Under the optimized conditions, the seven pesticides were well separated. The standard curves were in a good linear curve with the correlation coefficient r≥0.999 3. The results shown that the relative standard deviations (RSD) for tap water and Chongde Lake were 1.88%~4.24% and 2.57%~4.86%, respectively. And the recovery rates of spiked samples was in the range from 95.52% to 97.12% and from 96.90% to 104.06%, respectively.
-
Key words:
- Liquid–liquid Microextraction /
- Ionic Liquid /
- HPLC-UV /
- Pesticides
-

-
表 1 7种被测成分的线性方程、线性范围和相关系数
μg·mL−1 化合物 线性方程 γ 线性范围 LOQ−1 LOD−1 甲砜霉素 Y=110 406.89+75 281.78X 0.999 6 0.32~32 0.230 0.069 氟苯尼考 Y=93 897.99+1 416 141.06X 0.999 8 0.46~46 0.110 0.033 水胺硫磷 Y=−5 412.01+480 569.50X 0.999 8 0.60~6 0.017 0.050 甲基−对硫磷 Y=−1 816.01+431 160.53X 0.999 8 0.60~6 0.061 0.018 三唑磷 Y=−1 293.29+22 111.26X 0.999 8 0.25~25 0.038 0.011 甲基−毒死蜱 Y=−5 075.90+154 460.57X 0.999 7 0.35~35 0.053 0.016 毒死蜱 Y=−8 826.02+42 658.68X 0.999 3 0.36~36 0.055 0.016 注:相关系数,γ;LOQ,定量限; LOD,检测限。 表 2 样品含量测定及加标回收率
化合物 加入量/μL 自来水 崇德湖 测得量/μg·mL−1 回收率/% RSD/% 测得量/μg·mL−1 回收率/% RSD/% 甲砜霉素 0 ND NA NA ND NA NA 10 13.26 93.38 — 14.29 100.63 — 20 13.45 94.72 2.25 14.63 103.03 3.88 30 13.98 98.45 — 15.41 108.52 — 氟苯尼考 0 ND NA NA ND NA NA 10 20.47 91.79 — 20.45 91.70 — 20 21.80 97.76 3.62 21.89 98.16 3.96 30 21.83 97.89 — 22.49 100.85 — 水胺硫磷 0 ND NA NA ND NA NA 10 13.98 91.97 — 14.94 98.29 — 20 14.79 97.30 2.20 15.68 103.16 3.20 30 15.00 98.68 — 15.88 104.47 — 甲基−对硫磷 0 ND NA NA ND NA NA 10 20.23 95.42 — 19.98 94.24 — 20 20.56 96.98 1.88 20.79 98.07 4.86 30 21.00 99.06 — 22.00 103.77 — 三唑磷 0 ND NA NA ND NA NA 10 21.46 95.38 — 20.66 91.82 — 20 21.79 96.84 1.96 21.79 96.84 3.48 30 22.49 99.96 — 22.49 99.95 — 甲基−毒死蜱 0 ND NA NA ND NA NA 10 13.23 90.62 — 14.98 102.60 — 20 13.97 95.68 4.24 15.38 105.34 2.57 30 14.68 100.55 — 15.77 108.01 — 毒死蜱 0 ND NA NA ND NA NA 10 23.21 93.59 — 23.42 94.44 — 20 24.70 99.60 3.97 24.67 99.48 4.01 30 25.02 100.89 — 25.36 102.26 — 注:ND,未检测到; NA,无法使用。 -
[1] WANG X, QIAO X, MA Y, et al. Simultaneous determination of nine trace organophosphorous pesticide residues in fruit samples using molecularly imprinted matrix solid-phase dispersion followed by gas Chromatography[J]. Journal of Agricultural & Food Chemistry, 2013, 61(16): 3821 − 3827. [2] FARAJZADEH,MA, BAMOROWAT, M, MOGADDAM, MRA. Development of a dispersive liquid-liquid microextraction method based on solidification of a floating ionic liquid for extraction of carbamate pesticides from fruit juice and vegetable samples[J]. RSC Advances, 2016, 6(114): 112939 − 112948. doi: 10.1039/C6RA20103B [3] 张蓓蓓, 章勇, 赵永刚, 等. 水中14种氨基甲酸酯类农药残留测定[J]. 广州化工, 2013, 41(23): 98 − 100. doi: 10.3969/j.issn.1001-9677.2013.23.037 [4] 孙鹏, 高玉玲, 王金梅, 等. 漂浮固化分散液-液微萃取-气相色谱法测定液态奶中5种拟除虫菊酯类农药残留[J]. 农药学学报, 2016, 18(4): 497 − 502. [5] 吴丽, 李刚, 李媛. SPE固相萃取-高效液相色谱联用测定生活废水中烷基酚[J]. 新疆环境保护, 2018, 40(4): 17 − 23. doi: 10.3969/j.issn.1008-2301.2018.01.004 [6] 李兴红, 江静, 杨莉纳, 等. 钴铁氧体磁性固相萃取结合高效液相色谱法测定果蔬汁中4种人工合成色素[J]. 河北大学学报(自然科学版), 2019, 39(1): 41 − 48. [7] FARAHANI H, SHOKOUHI M, RAHIMI-NASRABADI M, et al. Green chemistry approach to analysis of formic acid and acetic acid in aquatic environment by headspace water-based liquid-phase microextraction and high-performance liquid chromatography[J]. Toxicological & Environmental Chemistry, 2016, 98(7): 714 − 726. [8] 于佳佳, 曹娅, 王强, 等. 分散液相微萃取-气相色谱联用测定苹果汁中6种有机磷农药残留[J]. 中国园艺文摘, 2015(8): 40 − 42. doi: 10.3969/j.issn.1672-0873.2015.08.017 [9] REZAEE M, ASSADI Y, MILANIHOSSEINI M R M, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006, 1116(1/2): 1 − 9. [10] WU C, LIU H, LIU W, et al. Determination of organophosphorus pesticides in environmental water samples by dispersive liquid-liquid microextraction with solidification of floating organic droplet followed by high-performance liquid chromatography[J]. Analytical & Bioanalytical Chemistry, 2010, 397(6): 2543 − 2549. [11] PENG G, HE Q, MMEREKI D, et al. Dispersive solid-phase extraction followedby vortex-assisted dispersive liquid-liquidmicroextraction based onthesolidificationof a floating organic droplet for thedetermination of benzoylureainsecticidesin soil and sewage sludge[J]. Journal of Separation Science, 2016, 39(7): 1213 − 1398. [12] SARAJI M, BOROUJENI M K, BIDGOLI A A H. Comparison of dispersive liquid-liquid microextraction and hollow fiber liquid-liquid-liquid microextraction for the determination of fentanyl, alfentanil, and sufentanil in water and biological fluids by high-performance liquid chromatography[J]. Analytical and Bioanalytical Chemistry, 2011, 400(7): 2149 − 2158. doi: 10.1007/s00216-011-4874-x [13] LEONG M I, HUANG S D. Dispersive liquid-liquid microextraction method based on solidification of floating organic drop combined with gas chromatography with electron-capture or mass spectrometry detection[J]. Journal of Chromatography A, 2008, 1211(1/2): 8 − 12. [14] AHMADI-JOUIBARI T, FATTAHI N, SHAMSIPUR M, et al. Dispersive liquid-liquid microextraction followed by high-performance liquid chromatography-ultraviolet detection to determination of opium alkaloids in human plasma[J]. Journal of Pharmaceutical & Biomedical Analysis, 2013, 85(11): 14 − 20. [15] CHATZIMITAKOS T, BINELLAS C, MAIDATSI K, et al. Magnetic ionic liquid in stirring-assisted drop-breakup microextraction: Proof-of-concept extraction of phenolic endocrine disrupters and acidic pharmaceuticals[J]. Analytica Chimica Acta, 2016, 910(12): 53 − 59. [16] SALEH A, YAMINI Y, FARAJI M, et al. Ultrasound-assisted emulsification microextraction method based on applying low density organic solvents followed by gas chromatography analysis for the determination of polycyclic aromatic hydrocarbons in water samples[J]. Journal of Chromatography A, 2009, 1216(39): 6673 − 6679. doi: 10.1016/j.chroma.2009.08.001 [17] SEEBUNRUENGK, SANTALADCHAIYAKIT Y, SRIJARANAI S. Vortex-assisted low density solvent liquid-liquid microextraction and salt-induced demulsification coupled to high performance liquid chromatography for the determination of five organophosphorus pesticide residues in fruits[J]. Talanta, 2015, 132(42): 769 − 774. [18] FARAJZADEH M A, MOGADDAM M R. Air-assisted liquid-liquid microextraction method as a novel microextraction technique; application in extraction and preconcentration of phthalate esters in aqueous sample followed by gas chromatography-flame ionization detection[J]. Analytica Chimica Acta, 2012, 728(6): 31 − 38. [19] YAN W, KWOK Y C, HE Y, et al. Application of dynamic liquid-Phase microextraction to the analysis of chlorobenzenes in water by using a conventional microsyringe[J]. Analytical Chemistry, 1998, 70(21): 4610 − 4614. doi: 10.1021/ac9804339 [20] FARAJZADEH M A, KHOSHMARAM L. Air-assisted liquid-liquid microextraction-gas chromatography-flame ionisation detection: a fast and simple method for the assessment of triazole pesticides residues in surface water, cucumber, tomato and grape juices samples[J]. Food Chemistry, 2013, 141(3): 1881 − 1887. doi: 10.1016/j.foodchem.2013.05.088 [21] YOU X, CHEN X, LIU F, et al. Ionic liquid-based air-assisted liquid-liquid microextraction followed by high performance liquid chromatography for the determination of five fungicides in juice samples[J]. Food Chemistry, 2018, 239(24): 354 − 359. [22] 廖且根, 张大文, 罗林广. 超声辅助悬浮固化分散液液微萃取-液相色谱-串联质谱法测定环境水样中氯硝柳胺[J]. 分析科学学报, 2018, 34(6): 834 − 836. [23] HUANG Z, CHUA P E, LEE H K. Carbonized polydopamine as coating for solid-phase microextraction of organochlorine pesticides[J]. Journal of Chromatography A, 2015, 1399(23): 8 − 17. [24] ZHANG Y, LEE H K. Low-density solvent-based vortex-assisted surfactant-enhanced-emulsification liquid-liquid microextraction combined with gas chromatography-mass spectrometry for the fast determination of phthalate esters in bottled water[J]. Journal of Chromatography A, 2013, 1274(32): 28 − 35. [25] CHENGJ, XIA Y, ZHOU Y, et al. Application of an ultrasound-assisted surfactant-enhanced emulsification microextraction method for the analysis of diethofencarb and pyrimethanil fungicides in water and fruit juice samples[J]. Analytica Chimica Acta, 2011, 701(1): 86 − 91. doi: 10.1016/j.aca.2011.04.058 [26] ZHOU Q, GAO Y, BAI H, et al. Preconcentration sensitive determination of pyrethroid insecticides in environmental water samples with solid phase extraction with SiO2 microspheres cartridge prior to high performance liquid chromatography[J]. Journal of Chromatography A, 2010, 1217(31): 5021 − 5025. doi: 10.1016/j.chroma.2010.05.060 [27] CHEN L, CHEN W, MA C, et al. Electropolymerizedmultiwalled carbon nanotubes/polypyrrole fiber for solid-phase microextraction and its applications in the determination of pyrethroids[J]. Talanta, 2011, 84(1): 104 − 108. doi: 10.1016/j.talanta.2010.12.027 [28] ZHOU Q, GAO Y, XIE G. Determination of bisphenol A, 4--nonylphenol, and 4--octylphenol by temperature-controlled ionic liquid dispersive liquid-phase microextraction combined with high performance liquid chromatography-fluorescence detector[J]. Talanta, 2011, 85(3): 1598 − 1602. doi: 10.1016/j.talanta.2011.06.050 -



 下载:
下载: