-
人工湿地是一种集生态和景观性于一体的高效低耗的废水生态处理技术。随着人工湿地越来越广泛的应用于处理垃圾渗滤液、畜禽养殖废水厌氧消化液和食品废水等高氮低碳废水,有机碳源的匮乏已成为制约人工湿地高效脱氮的瓶颈,特别是针对总氮(TN)的高效去除[1-2]。长期以来,反硝化作用被人们一直认为是将活性氮转化为氮气(N2)的唯一途径,然而在实际运行的湿地中,针对高氮低碳废水的传统硝化和反硝化脱氮能力被限制在一定水平,且由于传统厌氧反硝化过程需要大量碳源,往往需要外加碳源以补充其不足,从而导致其处理废水成本较高[1, 3]。
近年来日益成熟的厌氧氨氧化处理工艺为解决此问题提供了新的途径。厌氧氨氧化(anaerobic ammonia oxidation, anammox)过程是指在厌氧条件下分别以氨盐(NH4+)和亚硝酸盐(NO2−)为电子供体和电子受体的高效生物脱氮过程,该过程无需碳源,且伴随硝酸盐(NO3−)的生成[4-5]。随着分子生物学技术的发展,荧光定量PCR和高通量测序已被用于人工湿地中厌氧氨氧化菌的研究[5-7]。厌氧氨氧化过程已经被证明可以成为人工湿地中主要的脱氮过程,发挥高效的脱氮作用[1, 6, 8]。同时有研究表明,在人工湿地中厌氧氨氧化菌呈现出种群多样性[6, 8];C/N比、植物等环境因子和反硝化作用等脱氮过程对厌氧氨氧化菌的群落、丰度有着重要的影响[5, 9-10]。
目前虽然有学者对不同C/N条件下厌氧氨氧化菌在人工湿地的存在特征有少量研究,但在不同C/N和湿地植物多重耦合作用下针对处理高氮低碳废水的人工湿地中厌氧氨氧化菌的存在特征却尚乏报道。基于此,本文通过不同C/N比和植物配置,构建4组垂直流人工湿地处理高氮低碳废水,考察各湿地中氮污染物的去除差异;利用荧光定量PCR和高通量测序技术,对比研究各湿地的微生物群落、主要功能微生物及厌氧氨氧化菌的存在特征,进一步探讨C/N和湿地植物多重耦合作用下对湿地中厌氧氨氧化菌的影响特征。
-
4组垂直流人工湿地反应器均采用3 mm厚的有机玻璃进行构建,反应器尺寸均为20 cm × 17.0 cm × 40 cm。湿地填料(砾石)取自处理高氮低碳废水的、运行3年后闲置1年的潜流人工湿地中试系统,每个人工湿地的填料层高度为30 cm,砾石粒径分布为5—22 mm,孔隙率为0.38,湿地床高为35 cm。反应器进水方式均为自下而上,进水口位于反应器底部。
-
根据进水C/N比和湿地植物配置将4个人工湿地分别命名为T1、T2、T3、T4,具体为(1)T1:无碳源(C/N = 0),无湿地植物;(2)T2:无碳源(C/N = 0),湿地植物为鸢尾;(3)T3:有碳源(C/N = 0.5),无湿地植物;(4)T4:有碳源(C/N = 0.5),湿地植物为鸢尾。4个湿地反应器均采用间歇进水,周期为3 h,包括进水阶段0.5 h和反应阶段2.5 h,水力负荷均为2 cm·d−1。根据猪场养殖污水厌氧消化液的高氮低碳特性,本试验用水为人工模拟配制,其实际进水的NH4+-N(NH4Cl)、NO2−-N(NaNO2)、NO3−-N(KNO3)和TN的质量浓度分别为(282.58±16.58)、(395.98±24.31)、(88.03±19.26)、(779.33±53.38) mg·L−1;葡萄糖为有机碳源,COD浓度按需配制。各湿地的水力停留时间均为4.1 d。通过高纯氮气(纯度>99.9%)对湿地配水吹脱0.5 h控制湿地进水溶解氧DO<1 mg·L−1。进水pH值控制在7.5—8.5。各湿地的运行环境温度为(25±2) ℃。各湿地开始运行之前,试运行40 d以恢复湿地微生物的活性,之后开始正式运行,运行时间为90 d。
-
正式运行期间,各湿地进出水样品采集周期均为每2 天采集1次。各湿地运行结束(第90 天)后,进行填料样品采集,从每个湿地中的不同层(0—10、10—20、20—30 cm)采集填料样品,混合均匀后将其保存于–20 ℃待DNA的提取和后续分子生物学的分析。
-
水质指标NH4+-N、NO2−-N、NO3−-N和TN的测定参照《水和废水监测分析方法》(第四版)[11]。溶解氧和pH测定采用Muti 3620 IDS水质分析仪。
-
将采集到的湿地填料经摇床重复振荡洗脱3次至生理盐水中,收集洗脱液并经0.2 μm的水系滤膜抽滤,洗脱的微生物即存在于滤膜上,遂将滤膜剪碎,以用于DNA的提取。湿地填料中DNA提取采用FastDNATM Spin Kit for Soil DNA提取试剂盒(MP Biomedicals, USA),并用Nano Drop 2000UV-Vis Spectrophotometer(Thermo Fisher Scientific, USA)测定DNA浓度。采用引物Amx368f/Amx820r扩增厌氧氨氧化菌16S rRNA基因片段。采用1%凝胶电泳检测扩增产物质量和特异性。PCR扩增产物外送用于厌氧氨氧化菌16S rRNA质粒标准品的制备(美吉生物,上海),载体为pMD 18-T。目标基因定量引物序列及退火温度如表1所示。
-
荧光定量PCR:厌氧氨氧化菌16S rRNA基因定量采用TransStart® Top Green qPCR SuperMix(SuperMix)试剂盒(全式金,北京)进行荧光定量PCR(qPCR)反应(LightCycler480Ⅱ, Roche, Germany)。用引物Amx368f/Amx820r定量厌氧氨氧化菌16S rRNA的拷贝数,20 µL反应体系为:DNA模板2 µL,引物各0.4 µL,SuperMix 10 µL,ddH2O 7.2 µL,反应程序为:94 ℃ 30 s,94 ℃ 5 s,56 ℃ 15 s,72 ℃ 10 s,40个循环。每个样品做3次平行,最终结果扩增效率在90%—110%之间,可决系数R2 > 0.99,溶解曲线为单一峰。
高通量测序:提取的填料样品DNA送生工生物工程(上海)公司开展Miseq高通量测序。细菌16sRNA的V3-V4区域的PCR扩增引物为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)。
-
利用和Origin 8.0和SPSS软件,进行数据分析和绘图。并采用单因素方差(One-way ANOVA)分析多组数据间的差异性,其显著水平设为P<0.05。图中相关数据为平均值±标准差。
-
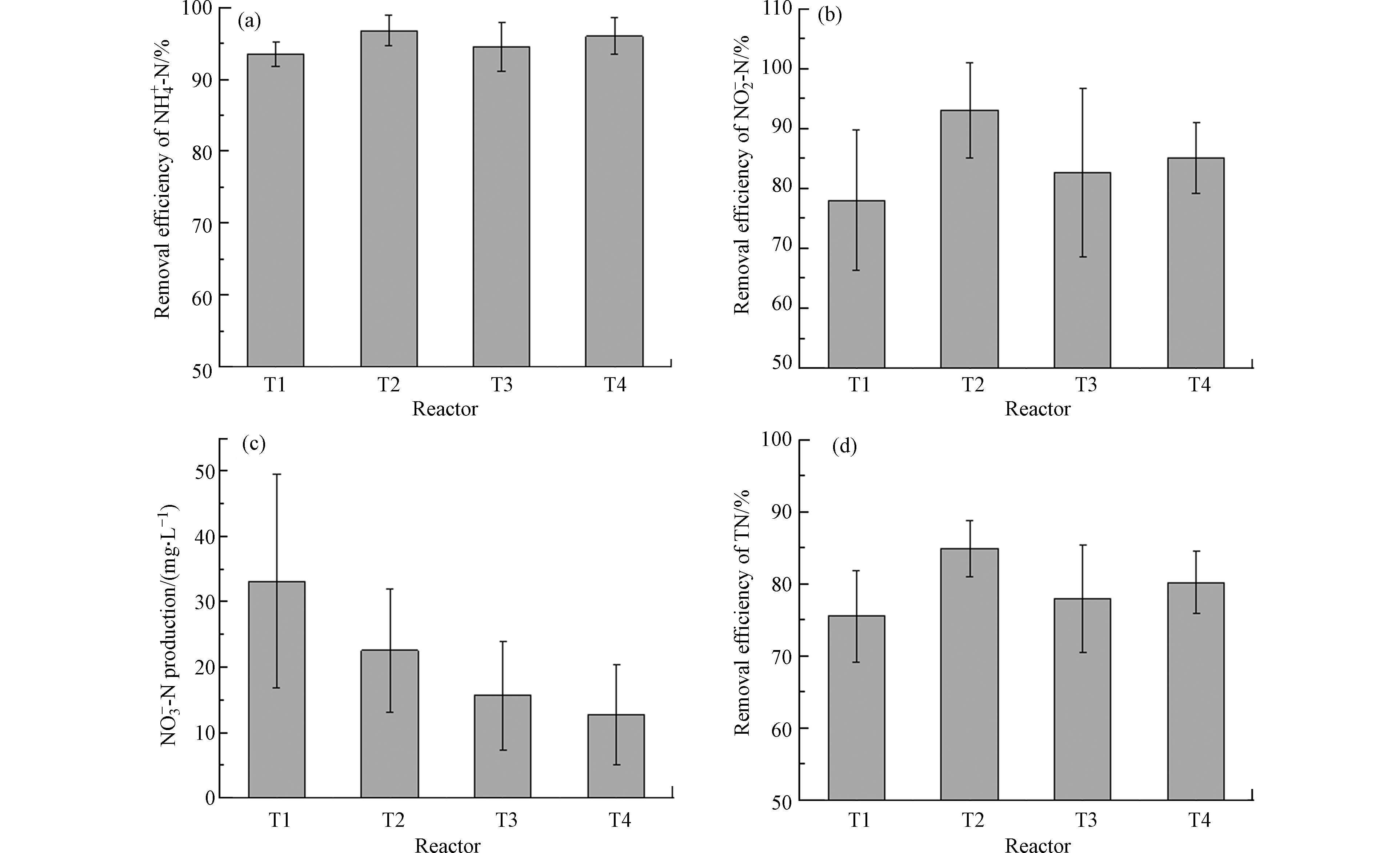
经90 d的运行,4个人工湿地对NH4+-N、NO2−-N、NO3−-N和TN的去除效果如图1所示。T1、T2、T3和T4对NH4+-N的去除率分别为(93.52±1.72)%、(96.74±2.16)%、(94.50±3.35)%和(95.97±2.52)%,去除效果均较好,无显著性差异(P>0.05),其中T2的去除效果最优。此外T2对NO2−-N的去除率亦最高,为(93.06±7.91)%,T1湿地去除率最低,仅为(77.96±11.72)%,T1和T2对NO2−-N的去除存在显著性差异(P<0.05)。T1、T2、T3和T4中NO3−-N均有不同程度的生成,呈现T4<T3<T2<T1,这表明有植物的湿地NO3−-N生成量均低于无植物湿地,有碳源湿地均低于无碳源湿地,这与Lin等[13]研究一致。TN作为考察人工湿地脱氮性能的重要指标,T1、T2、T3和T4的TN去除率分别为(75.48±6.41)%、(84.90±3.96)%、(77.94±7.43)%和(80.16±4.32)%,且T2与T1、T3、T4对TN的去除均存在显著性差异(P<0.05)。T1和T2中C/N为0,T3和T4中C/N(=0.5)亦较低,但各湿地仍发挥出较高的TN去除效果且伴随NO3−-N生成,而反硝化脱氮过程需要足够的碳源(C/N=2—5)作为电子供体将硝酸盐转化为氮气[14],厌氧氨氧化过程是将NH4+-N和NO2−-N转化为氮气,同时生成NO3−-N,此过程无需碳源,因此猜测厌氧氨氧化过程是各湿地中氮污染物去除的主要途径。
T1、T2、T3和T4的TN去除效果呈现出T1<T3<T4<T2,表明有植物无碳源湿地的脱氮效果最佳;有碳源湿地的脱氮效果优于无碳源无植物湿地;且有植物湿地的脱氮效果优于无植物湿地。Lin等[13]发现添加碳源后,种植植物湿地去除NO3−-N的能力明显高于无植物湿地。夏艳阳等[10]发现,有碳源有植物系统对NH4+-N和TN的去除效果优于有碳源无植物系统的去除效果,与本研究一致。此外,添加的碳源有助于反硝化过程,去除一部分由厌氧氨氧化过程产生的NO3−-N,提高TN的去除效果[10]。
-
采集到的湿地填料样品提取DNA后,针对厌氧氨氧化菌16S rRNA基因进行PCR扩增并经1%凝胶电泳特异性检测,初步检出各湿地中存在厌氧氨氧化菌,之后通过qPCR定量填料样品中的厌氧氨氧化菌16S rRNA基因拷贝数。Anammox bacterial 16S rRNA是参与厌氧氨氧化过程中NH4+-N和NO2−-N转化的关键基因,厌氧氨氧化菌的基因丰度分布特征如图2所示。T1、T2、T3和T4湿地的厌氧氨氧化菌基因丰度分别为2.20 × 108、2.88 × 108、2.34 × 108、2.42 × 108 copies·g−1。相较于T1、T3和T4中的厌氧氨氧化菌基因丰度略微提高,但增长不显著,而T2的厌氧氨氧化菌基因丰度增长幅度最大,这表明有植物无碳源的湿地系统可能更有利于厌氧氨氧化菌的生长富集,可能是因为植物根际提供的好氧-缺氧-厌氧微环境促进了厌氧氨氧化菌的生长,且植物根际会分泌一部分碳源,在反硝化菌的作用下利用碳源将硝酸盐还原为亚硝酸盐为厌氧氨氧化菌提供底物[10]。
-
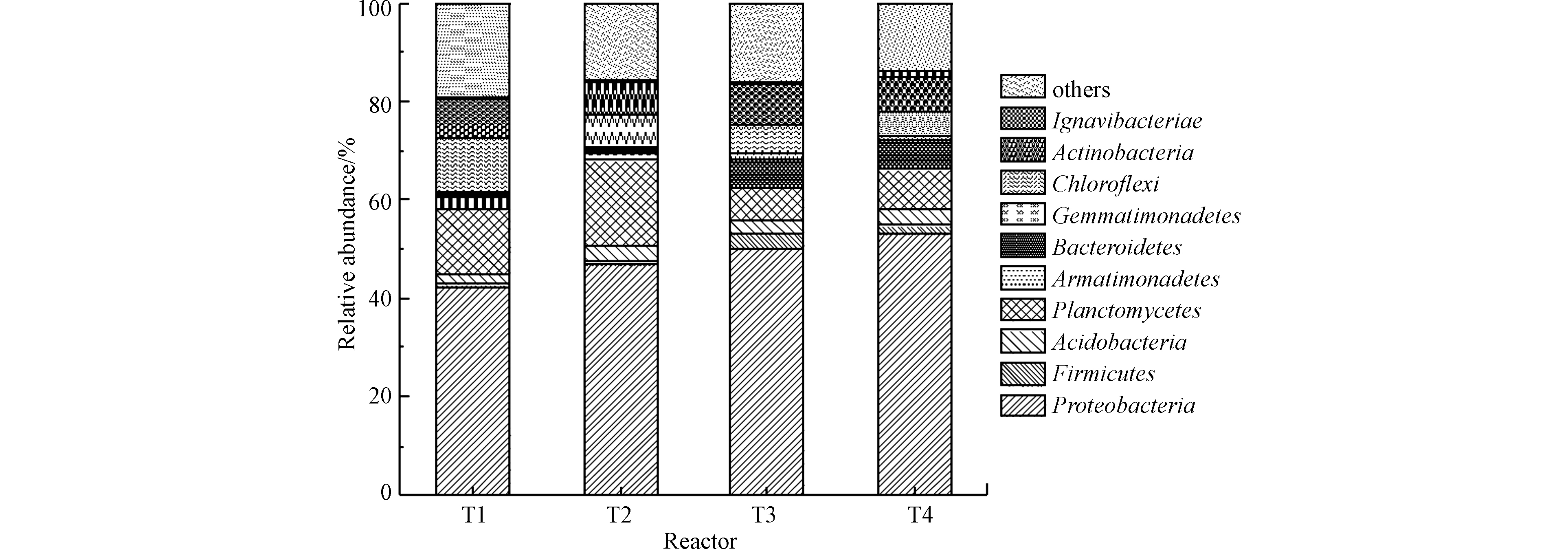
基于反应器90 d的运行,利用高通量测序技术对4组人工湿地的微生物群落结构进行分析,如图3所示,门相对丰度大于1%。由图3可知,变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)和拟杆菌门(Bacterodidetes)等在各人工湿地中相对丰度较高,且是人工湿地和厌氧氨氧化反应器的优势菌种[4-6, 9]。
变形菌门中包含许多参与硝化-反硝化脱氮过程和有机物生物降解转化的菌属[15],相较于其他菌门其在各湿地中的相对丰度均最高(>40%)。厌氧氨氧化菌属于浮霉菌门,因此其占比可反映出各湿地的厌氧氨氧化性能。T1、T2、T3和T4湿地的浮霉菌门的相对丰度存在显著差异,分别为13.38%、17.48%、6.54%、8.14%,表明植物对浮霉菌门的富集发挥促进作用,而有机物表现出抑制作用,猜测原因可能是有机物对厌氧氨氧化菌生长的抑制[4]。绿弯菌门是厌氧氨氧化系统常见的细菌,可产生生物膜结构,在缺氧条件下清除厌氧氨氧化菌可产生的代谢物且有助于厌氧氨氧化菌形成颗粒态[16]。绿弯菌门相对丰度呈现出T1>T2>T3>T4。装甲菌门(Armatimonadetes)也是厌氧氨氧化系统中常见的细菌,其可能会导致氨氮的过度消耗,导致厌氧氨氧化细菌可利用底物不足[17]。T3(2.95%)和T4(1.71%)中的厚壁菌门(Firmicutes)相对丰度高于T1(0.69%)和T2(0.66%),这是因为厚壁菌门具有反硝化作用,而T3和T4中外加的碳源为其提供了足够的底物[4]。放线菌门属于革兰氏阳性细菌,大部分是异养细菌,对有机物有一定的降解能力,其相对丰度呈现T3>T1>T4>T2,表明适当的有机物和植物对其生长富集有强化作用。植物和碳源显著影响湿地系统内部微生物群落结构与多样性,因此湿地植物、碳源与微生物之间存在相互影响、相互作用关系[18-20]。从整体来看,4组垂直流湿地中的微生物群落均较为丰富,但微生物群落结构存在显著性差异。
基于4组垂直流人工湿地中的微生物群落结构发生了显著性变化,对各湿地中参与脱氮过程的主要功能微生物进行分析,探究各湿地内部主要功能微生物的存在特征及差异。
-
硝化-反硝化过程被认为是人工湿地中重要的微生物脱氮途径,其主要参与者为硝化细菌(氨氧化细菌、亚硝化细菌)和异养反硝化细菌,基于高通量测序结果对各湿地中硝化细菌和反硝化细菌进行筛选分析,共检测出8种反硝化菌属和6种硝化菌属,见表2。
Flavobacterium属是具有代表性的反硝化菌属[6, 21],其在T1、T2、T3和T4中相对丰度均最高,且显著高于其他反硝化菌属,是各湿地反硝化菌中的优势菌属。除Flavobacterium属外,Thermomonas属是常见的兼性异养反硝化细菌,Pseudomonas属是需氧自养菌[6]。Thermomonas属在T2、T3和T4中相对丰度显著高于其他反硝化菌属,而T1中Pseudomonas属占比最高。T1、T2、T3和T4中的反硝化菌相对丰度分别为2.48%、5.83%、8.63%、10.17%,呈现出T4>T3>T2>T1,表明有机物是反硝化菌生长富集的重要限制因子,且植物对反硝化菌的富集有积极作用[10]。Ye等[22]研究发现植物根系分泌物可以加速反硝化细菌的生长,同时能一定程度上提高微生物丰富度和生物多样性。此外,植物的根际可为反硝化菌提供一部分碳源,强化其生长富集。硝化菌属包含氨氧化菌属和亚硝酸盐氧化菌属。如表2所示,其中Nitrosomonas和Nitrosovibrio是将NH4+-N转化为NO2−-N的氨氧化菌[6, 23],Nitrospira、Nitrosococcus、Nitrolancea和Nitrobacter是将NO2−-N转化为NO3−-N的亚硝酸盐氧化菌[24-25]。相较于反硝化菌属,各湿地中的硝化菌属相对丰度明显较低。T4中的硝化菌属相对丰度最高(0.89%),而T1、T2、T3中硝化菌属占比无明显差别(0.44%、0.56%、0.42%),表明有植物有碳源的湿地系统更有利于硝化细菌的富集生长。Nitrosomonas和Nitrobacter均是T1和T2中的硝化菌中的优势菌属,而Nitrosomonas是T3和T4中的优势菌属,且湿地中的Nitrosomonas和Nitrobacter属相对丰度具有较大差异,这表明碳源的添加可显著改变湿地系统的硝化菌属结构。从整体来看,植物和碳源对4组人工湿地中硝化菌属和反硝化菌属的群落结构及占比具有显著影响,可见植物和碳源是硝化反硝化菌群落演替的重要因子。
-
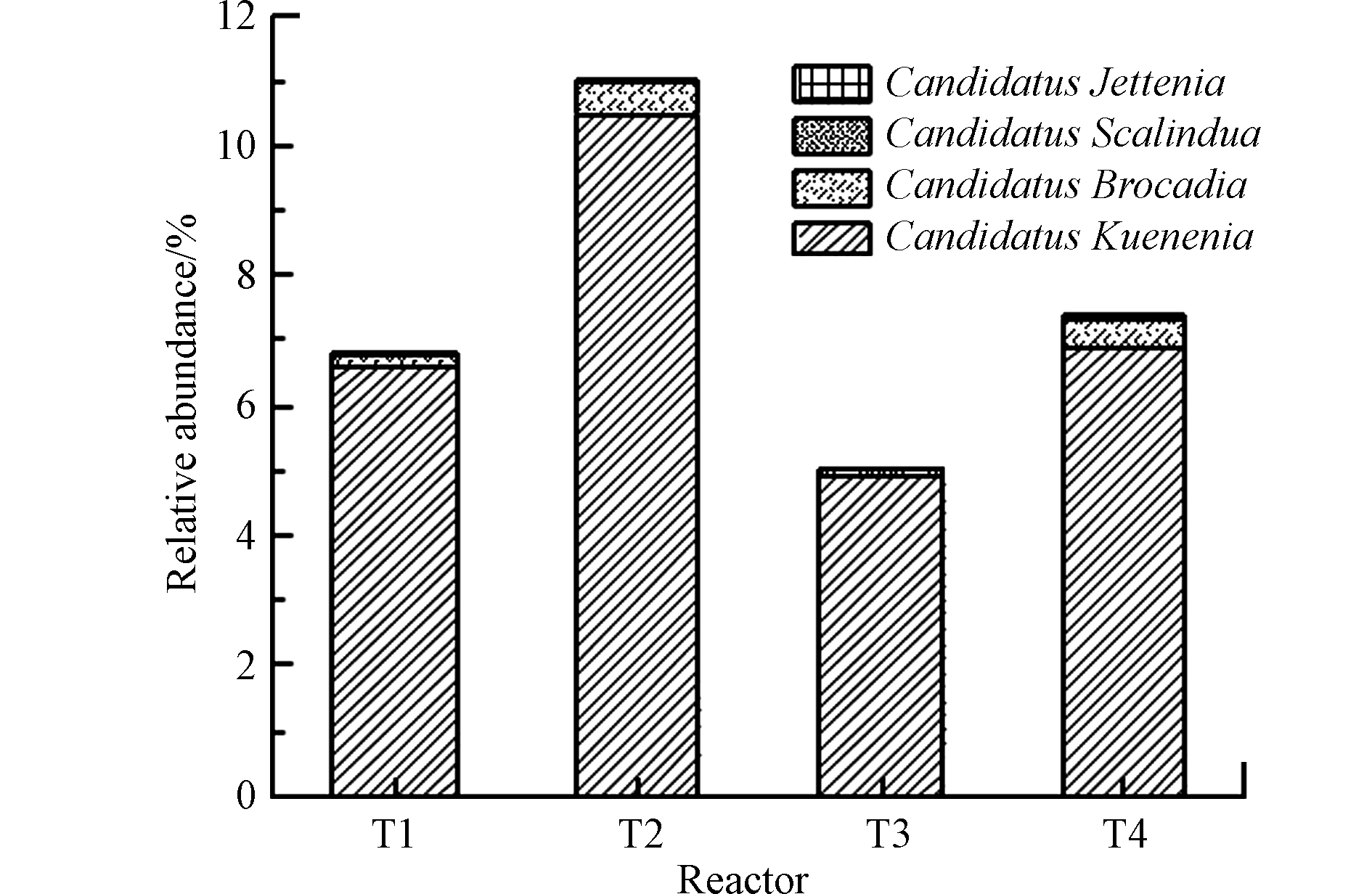
厌氧氨氧化过程作为一种新型微生物脱氮过程,其主要参与者是厌氧氨氧化菌[5],为考察在有无植物和碳源情况下厌氧氨氧化菌群落的存在特征,通过高通量测序共检出4种厌氧氨氧化菌属,如图4所示。在4组湿地系统中均检出Candidatus Kuenenia、Candidatus Brocadia、Candidatus Scalindua和Candidatus Jettenia属。Candidatus Kuenenia属在各湿地中相对丰度最高,分别为6.61%、10.47%、4.91%和6.92%,且均占厌氧氨氧化菌属的比例很高(>90%),说明其是4组湿地系统中厌氧氨氧化菌属的重要组成,发挥积极的脱氮作用。此外,T2(0.51%)和T4(0.43%)中的Candidatus Scalindua属相对丰度显著高于T1(0.19%)和T3(0.13%)。而Candidatus Brocadia和Candidatus Jettenia属相对丰度在各湿地之间无明显差异。Candidatus Kuenenia属更适宜在低氮负荷下生长,而Candidatus Brocadia属更适宜在高氮负荷下富集[7],这与本研究的结果相反。这可能是因为本研究中湿地进水中的亚硝酸盐底物相对充足,而Candidatus Kuenenia属相较Candidatus Brocadia属对亚硝酸盐底物有更高的亲和力[26]。van der Star等[7]研究表明厌氧氨氧化菌属群落的组成受氮负荷、C/N比、溶解氧浓度等因素的影响较大。T1、T2、T3和T4中的厌氧氨氧化菌属相对丰度分别为6.83%、11.03%、5.06%和7.38%,表明厌氧氨氧化菌属是各湿地系统中的优势脱氮菌,呈现出T2>T4>T1>T3。厌氧氨氧化菌属相对丰度在各湿地之间存在显著性差异(P<0.05)。Wang等[9]研究表明,相较于反硝化过程,C/N比低于2时更有利于厌氧氨氧化过程的进行。在高C/N比下,NO2可能主要用于反硝化过程,而非厌氧氨氧化过程[14]。本研究中,较低的C/N比和较高的氮污染物浓度可为厌氧氨氧化菌的生长提供适宜的生境,但碳源的添加和植物的配置仍会对厌氧氨氧化菌的富集生长产生一定的影响。以上结果表明,有植物无碳源的湿地系统更加有利于厌氧氨氧化菌的生长繁殖,而碳源的添加一定程度上会对起抑制作用,但植物在一定程度上可缓解碳源对厌氧氨氧化菌生长的抑制。
-
(1)各人工湿地系统对NH4+-N、NO2−-N和TN均有较好且稳定的去除效果。其中有植物无碳源湿地系统的脱氮效果最佳,TN平均去除率可达84.90%;有碳源湿地系统的脱氮效果优于无碳源无植物湿地系统;且有植物湿地的脱氮效果优于无植物湿地。各人工湿地系统的主要脱氮途径为厌氧氨氧化过程,且在不同程度上存在厌氧氨氧化与反硝化的协同耦合脱氮。
(2)各湿地中的微生物群落均较为丰富,其中优势菌门为变形菌门、浮霉菌门、绿弯菌门、放线菌门和拟杆菌门。但由于C/N和植物配置差异,微生物群落结构存在显著性差异。
(3)各湿地系统中均检出4种厌氧氨氧化菌属,其中Candidatus Kuenenia属在各湿地中占比最高(>90%),且其在无碳源有植物湿地中显著高于其他3组湿地。受C/N和植物配置差异影响,各湿地中的厌氧氨氧化菌属结构之间存在一定差异。相较于其他三组湿地,有植物无碳源湿地更有利于厌氧氨氧化菌的生长富集。
处理高氮低碳废水的垂直流人工湿地中厌氧氨氧化菌分布特征
Distribution characteristics of anammox bacteria in vertical flow constructed wetlands for treating high-nitrogen wastewater with low carbon
-
摘要: 为探明C/N和湿地植物对湿地中厌氧氨氧化菌的影响特征,基于不同C/N比和植物配置,构建4组垂直流人工湿地处理高氮低碳废水,研究其对氮污染物的去除特征差异,并利用荧光定量PCR技术和高通量测序技术对湿地中的主要功能微生物及厌氧氨氧化菌的分布特征进行分析。结果表明,在进水TN浓度为779.33 mg·L−1时,各湿地的TN平均去除率分别为75.48%、84.90%、77.94%和80.16%。整体来看,无碳源有植物湿地的脱氮效果最佳;有碳源湿地的脱氮效果优于无碳源无植物湿地;且有植物湿地的脱氮效果优于无植物湿地。各湿地中微生物群落结构在门上平上存在显著差异,且厌氧氨氧化菌属结构存在显著差异。 各湿地中均检出4种厌氧氨氧化菌属,其中Candidatus Kuenenia属在各湿地中占比最高(> 90%)。无碳源有植物湿地中厌氧氨氧化菌属相对丰度最高,且有植物湿地均高于无植物湿地,表明有植物无碳源的湿地系统更加有利于厌氧氨氧化的生长繁殖,而碳源的添加会对其起抑制作用,但植物在一定程度上可缓解碳源对厌氧氨氧化菌生长的抑制。各人工湿地系统的主要脱氮途径为厌氧氨氧化过程,且在不同程度上存在厌氧氨氧化与反硝化的协同耦合脱氮。Abstract: Based on different C/N ratio and plant configurations, four sets of vertical flow constructed wetlands (CWs) were constructed to treat high-nitrogen wastewater with low-carbon. The differences in characteristics of nitrogen pollutants treatment were studied, and the distribution characteristics of the main functional microorganisms and anaerobic ammonia oxidation (anammox) bacteria were analyzed. The results showed that when the influent TN concentration was 779.33 mg·L−1, the average removal efficiencies of TN in each CWs were 75.48%, 84.90%, 77.94% and 80.16%, respectively. By comparison, the CW treatment with plants and no carbon source showed the best nitrogen removal performance, and the CW treatment with carbon sources attained better nitrogen treatment performance than CW treatment with no carbon sources and no plants. Meantime, the CWs treatment with plants nitrogen treatment performance was better in than CWs without plants. At phylum level, there were significant differences in the microbial community structure in each CWs. Besides, there were significant differences in the structure of anammox bacteria among CWs. Four anammox bacteria genera were detected in each CWs, in which Candidatus Kuenenia accounted for the highest proportion (> 90%). The relative abundance of anammox bacteria genera in CW with plants and no carbon sources was the highest, and CWs with plants are higher than CWS without plants, indicating that CW system with plants and no carbon sources are more conducive to the growth and reproduction of anammox bacteria. The addition of carbon source inhibited the growth and reproduction of anammox bacteria, but plants could alleviate the inhibition of carbon source on the growth of anammox bacteria to a certain extent. The main nitrogen removal pathway of each CWs system was anammox process. And to varying degrees, there was synergistic coupling of anammox process and denitrification process for nitrogen removal.
-

-
表 1 目标基因定量引物序列及退火温度
Table 1. Primer sequences and annealing temperature for target genes of q-PCR
目标基因
Target gene引物
Primers引物序列 (5′-3′)
Primer sequences退火温度/℃
Annealing temperature引物长度/bp
Primer length参考文献
ReferenceAnammox 16S rRNA Amx368f TTCGCAATGCCCGAAAGG 56 470 [12] Amx820r AAAACCCCTCTACTAGTGCCC 表 2 硝化-反硝化相关菌属存在特征
Table 2. Characteristics of nitrification-denitrification bacteria related genus
菌属
Bacterial genera相对丰度/%
Relative abundanceT1 T2 T3 T4 反硝化相关菌属 Flavobacterium 2.01 4.06 7.01 8.06 Thermomonas 0.10 1.47 1.17 1.79 Enterobacter 0.00 0.00 0.00 0.00 Pseudomonas 0.16 0.17 0.17 0.20 Hydrogenophaga 0.07 0.02 0.07 0.02 Aeromonas 0.00 0.01 0.00 0.01 Janthinobacterium 0.02 0.01 0.01 0.02 Acidovorax 0.12 0.09 0.19 0.06 总计 2.48 5.83 8.63 10.17 硝化相关菌属 Nitrosomonas 0.12 0.13 0.23 0.70 Nitrosovibrio 0.00 0.01 0.01 0.01 Nitrospira 0.04 0.03 0.05 0.05 Nitrosococcus 0.03 0.03 0.01 0.01 Nitrolancea 0.08 0.08 0.04 0.03 Nitrobacter 0.17 0.28 0.07 0.08 总计 0.44 0.56 0.42 0.89 -
[1] WANG Z, HUANG M L, QI R, et al. Enhancing nitrogen removal via the complete autotrophic nitrogen removal over nitrite process in a modified single-stage tidal flow constructed wetland [J]. Ecological Engineering, 2017, 103: 170-179. doi: 10.1016/j.ecoleng.2017.04.005 [2] WU S B, KUSCHK P, BRIX H, et al. Development of constructed wetlands in performance intensifications for wastewater treatment: A nitrogen and organic matter targeted review [J]. Water Research, 2014, 57: 40-55. doi: 10.1016/j.watres.2014.03.020 [3] DĄBROWSKI W, KAROLINCZAK B, MALINOWSKI P. Application of SS-VF bed for the treatment of high concentrated reject water from autothermal termophilic aerobic sewage sludge digestion [J]. Journal of Ecological Engineering, 2018, 19(4): 103-110. doi: 10.12911/22998993/89663 [4] 秦榕, 宋佳宇, 齐碧薇, 等. 厌氧氨氧化反应器菌群动态演替分析[J]. 环境科学与技术, 2020, 43(增刊1): 23-28. QIN R, SONG J Y, QI B W, et al. Dynamic succession analysis of bacteria in anaerobic ammonia oxidation reactor for refining wastewater treatment[J]. Environmental Science & Technology, 2020, 43(Sup 1): 23-28(in Chinese).
[5] 吕露遥, 杨永哲, 张雷, 等. 多级垂直潮汐流人工湿地厌氧氨氧化脱氮研究 [J]. 水处理技术, 2019, 45(10): 114-120. LV L Y, YANG Y Z, ZHANG L, et al. Study on nitrogen removal by anaerobic ammonium oxidation in multi-stage vertical tidal flow constructed wetlands [J]. Technology of Water Treatment, 2019, 45(10): 114-120(in Chinese).
[6] CHEN D Y, GU X S, ZHU W Y, et al. Denitrification- and anammox-dominant simultaneous nitrification, anammox and denitrification (SNAD) process in subsurface flow constructed wetlands [J]. Bioresource Technology, 2019, 271: 298-305. doi: 10.1016/j.biortech.2018.09.123 [7] VAN DER STAR W R, MICLEA A I, VAN DONGEN U G, et al. The membrane bioreactor: A novel tool to grow anammox bacteria as free cells [J]. Biotechnology and Bioengineering, 2008, 101(2): 286-294. doi: 10.1002/bit.21891 [8] YUAN C B, ZHAO F C, ZHAO X H, et al. Woodchips as sustained-release carbon source to enhance the nitrogen transformation of low C/N wastewater in a baffle subsurface flow constructed wetland [J]. Chemical Engineering Journal, 2020, 392: 124840. doi: 10.1016/j.cej.2020.124840 [9] WANG X J, YANG R L, GUO Y, et al. Investigation of COD and COD/N ratio for the dominance of anammox pathway for nitrogen removal via isotope labelling technique and the relevant bacteria [J]. Journal of Hazardous Materials, 2019, 366: 606-614. doi: 10.1016/j.jhazmat.2018.12.036 [10] 夏艳阳, 崔理华, 黄小龙. 污水碳源对复合垂直流-水平流人工湿地脱氮效果的影响 [J]. 环境工程学报, 2017, 11(1): 638-644. doi: 10.12030/j.cjee.201509223 XIA Y Y, CUI L H, HUANG X L. Effect of internal carbon source supplement on nitrogen removal in integrated vertical-flow and horizontal-flow constructed wetland [J]. Chinese Journal of Environmental Engineering, 2017, 11(1): 638-644(in Chinese). doi: 10.12030/j.cjee.201509223
[11] 国家环境保护总局. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境出版社, 2002: 258-282. China Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 258-282 (in Chinese) .
[12] SCHMID M C, MAAS B, DAPENA A, et al. Biomarkers for in situ detection of anaerobic ammonium-oxidizing (anammox) bacteria [J]. Applied and Environmental Microbiology, 2005, 71(4): 1677-1684. doi: 10.1128/AEM.71.4.1677-1684.2005 [13] LIN Y F, JING S R, WANG T W, et al. Effects of macrophytes and external carbon sources on nitrate removal from groundwater in constructed wetlands [J]. Environmental Pollution, 2002, 119(3): 413-420. doi: 10.1016/S0269-7491(01)00299-8 [14] COBAN O, KUSCHK P, KAPPELMEYER U, et al. Nitrogen transforming community in a horizontal subsurface-flow constructed wetland [J]. Water Research, 2015, 74: 203-212. doi: 10.1016/j.watres.2015.02.018 [15] 吕纯剑, 高红杰, 宋永会, 等. 潮汐流-潜流组合人工湿地微生物群落多样性研究 [J]. 环境科学学报, 2018, 38(6): 2140-2149. LÜ C J, GAO H J, SONG Y H, et al. Microbial community diversity in the combined tide flow-subsurface flow constructed wetland [J]. Acta Scientiae Circumstantiae, 2018, 38(6): 2140-2149(in Chinese).
[16] LI X R, DU B, FU H X, et al. The bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community [J]. Systematic and Applied Microbiology, 2009, 32(4): 278-289. doi: 10.1016/j.syapm.2009.03.002 [17] ZHANG Z, LIU S. Insight into the overconsumption of ammonium by anammox consortia under anaerobic conditions [J]. Journal of Applied Microbiology, 2014, 117(6): 1830-1838. doi: 10.1111/jam.12649 [18] 张燕, 刘雪兰, 王月明, 等. 中国规模化畜禽养殖污水处理中人工湿地的研究进展 [J]. 环境科学与技术, 2016, 39(1): 87-92. ZHANG Y, LIU X L, WANG Y M, et al. Research progress of constructed wetland treating intensive livestock and poultry wastewater in China [J]. Environmental Science & Technology, 2016, 39(1): 87-92(in Chinese).
[19] 廖新俤, 骆世明. 人工湿地对猪场废水有机物处理效果的研究 [J]. 应用生态学报, 2002, 13(1): 113-117. doi: 10.3321/j.issn:1001-9332.2002.01.025 LIAO X D, LUO S M. Treatment effect of constructed wetlands on organic matter in wastewater from pig farm [J]. Chinese Journal of Applied Ecology, 2002, 13(1): 113-117(in Chinese). doi: 10.3321/j.issn:1001-9332.2002.01.025
[20] 陈永华, 吴晓芙, 陈明利, 等. 人工湿地污水处理系统中植物套种模式根际微生物多样性研究 [J]. 环境科学, 2011, 32(8): 2397-2402. CHEN Y H, WU X F, CHEN M L, et al. Analysis of microorganism species diversity in plant intercropping models in a wetland system constructed for treatment of municipal sewage [J]. Environmental Science, 2011, 32(8): 2397-2402(in Chinese).
[21] PICHINOTY F, BIGLIARDI-ROUVIER J, MANDEL M, et al. The isolation and properties of a denitrifying bacterium of the genus Flavobacterium [J]. Antonie Van Leeuwenhoek, 1976, 42(3): 349-354. doi: 10.1007/BF00394134 [22] YE J, ZHANG P Y, SONG Y H, et al. Influence of operational mode, temperature, and planting on the performances of tidal flow constructed wetland [J]. Desalination and Water Treatment, 2016, 57(17): 8007-8014. doi: 10.1080/19443994.2015.1055310 [23] ZHANG P F, PENG Y K, LU J L, et al. Microbial communities and functional genes of nitrogen cycling in an electrolysis augmented constructed wetland treating wastewater treatment plant effluent [J]. Chemosphere, 2018, 211: 25-33. doi: 10.1016/j.chemosphere.2018.07.067 [24] SHEN J P, ZHANG L M, DI H J, et al. A review of ammonia-oxidizing bacteria and archaea in Chinese soils [J]. Frontiers in Microbiology, 2012, 3: 296. [25] ZENG L P, TAO R, TAM N F Y, et al. Differences in bacterial N, P, and COD removal in pilot-scale constructed wetlands with varying flow types [J]. Bioresource Technology, 2020, 318: 124061. doi: 10.1016/j.biortech.2020.124061 [26] ZHU G B, WANG S Y, FENG X J, et al. Anammox bacterial abundance, biodiversity and activity in a constructed wetland [J]. Environmental Science & Technology, 2011, 45(23): 9951-9958. -



 下载:
下载: