-
分子印迹技术(MIT)是一种模拟了酶—底物或者抗原—抗体识别体系,使用特定的化学方法在载体的空间结构和结合位点上构建具有特异性结合特定分子聚合物的方法. 自1993年瑞典Lund大学的Mosbach等[1] 在Nature上研究报道以后,便成为国内外的研究热点. 分子印迹材料(MIPs)具有识别性强、物化性质稳定、制备简便、溶剂消耗量小、可重复使用等优点,在物质分离纯化、仿生传感、药物分析、环境治理等多个领域均具有广阔的应用前景. 分子印迹技术在小分子领域已经趋于成熟,而生物大分子(如蛋白质、多糖和核酸等)具有大分子量和复杂的表面结构等原因,导致其印迹具有很大的挑战性. 传统的MIPs由于具有固液分离复杂、难回收等问题,在发展和应用上受到了一定的限制,而磁性材料具有易回收分离、超顺磁性等特点,将磁性材料引入到MIPs的制备中不仅可以保留其对目标分子的高选择性与高识别性的特性,还可以赋予其超顺磁性,为材料的分离、回收和新性能的应用与拓展提供了可能,因此,磁性分子印迹材料(MMIPs)受到了广泛关注.
本文综述了生物大分子磁性分子印迹材料(BMMIPs)的制备原理及其方法、生物大分子分离领域取得的成就,并对其在生物大分子领域的发展现状及问题进行了阐述,最后讨论了该领域未来发展趋势和存在的挑战.
-
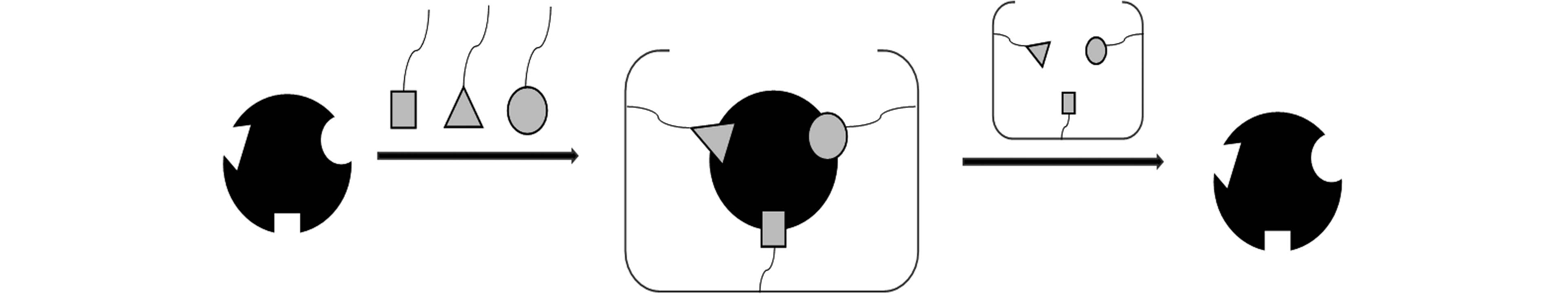
分子印迹技术即用目标分子作为模板分子制备具有印迹腔或结合位点的MIPs;在分子印迹材料上去除模板分子后,会存在与模板分子尺寸结构相匹配、位点互补的孔洞,从而达到对目标分子实现特异性识别的目的. 图1为分子印迹原理示意图.
功能单体与模板分子主要采用非共价结合、共价结合以及半共价结合的结合方式. 由于共价结合较为稳定,模板分子与功能单体之间的存在较强的作用力,不易设计合适的模板-单体复合物且洗脱条件要求较高[2];相反,由于非共价结合的相互作用力较弱,吸附和解离过程容易,大量单体和模板之间可以相互作用,目前多用这种方法制备MIPs;而半共价方法则是结合了以上两种方法的优点,在聚合物制备过程中功能单体与模板分子通过共价作用结合,而在实际应用中通过非共价作用结合 [3]. MIPs由于优良的选择性、稳定性和具有特异性结合等优点,被广泛的应用到复杂环境中的特定分子的分离和富集领域[4].
-
BMMIPs的制备步骤通常包括:(1)功能单体与模板分子通过非共价、共价或者半共价的结合方式形成复合物;(2)反应体系中的交联剂与功能单体发生聚合将模板分子包埋进聚合物内(3)用特定的方法去除包埋在聚合物内的模板分子,之后会留下与模板分子在大小、空间、形状上相匹配的孔穴,在应用的过程中这个孔穴可以与模板分子特异性结合(图2). 与小分子印迹相比,BMMIPs的制备在模板尺寸、合成路线方面要求均更高.
常见的制备MMIPs的方法:
(1)溶胶-凝胶法
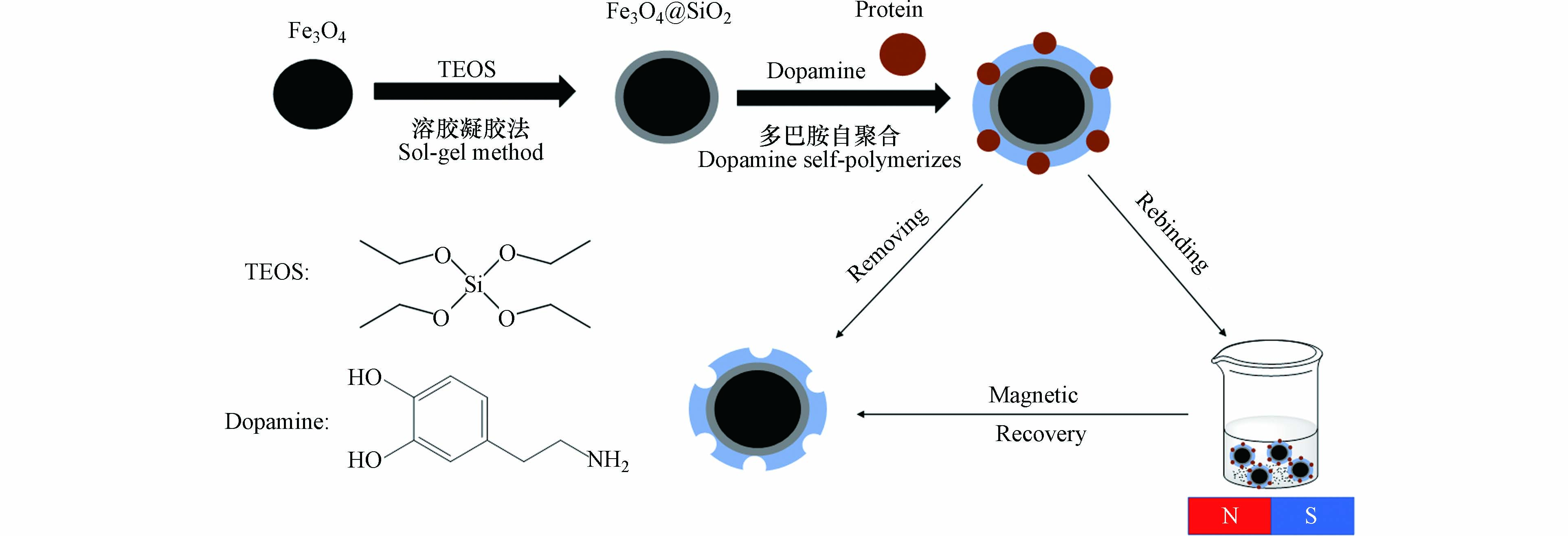
这种方法通常选择的前驱体具有较高的化学活性组分,使其在液相中与原料混合均匀后发生水解缩合反应生成透明胶体,之后经过陈化的胶粒聚合形成凝胶,充满凝胶网络间的溶剂失去了流动性,经过干燥或者固化制备出分子印迹材料. 溶胶-凝胶法在磁性粒子表面包覆SiO2无机层是最常用的保护和修饰的方法,例如Jia等[5]利用溶胶-凝胶法在Fe3O4微粒表面包覆二氧化硅涂层,然后通过多巴胺自聚合在其表面印迹了牛血红蛋白用于分离与富集.
(2)自由基聚合法
①沉淀聚合:是反应生成的聚合物不溶于其单体或者反应介质,从而在反应体系中沉淀出来[6]. 蒸馏沉淀聚合是基于在沉淀聚合的方法加以改良[7],通常以乙腈作为溶剂,具有溶剂需求量少、回收率高的特点. ROSSETTI等[8]使用沉淀聚合法以Pro Gastrin特征肽为模板合成分子印迹聚合物用于临床快速检测和提取样本.
②悬浮聚合:悬浮聚合法有正相和反相悬浮聚合[9]. 正相悬浮聚合是以有机相为聚合相,水相为分散相,单体在搅拌和分散剂的作用下分散成小液滴悬浮在分散相,随后加入引发剂使聚合反应发生. 水溶性单体印迹主要采用反向悬浮聚合法,反相悬浮聚合法的聚合相和有分散相分别是水相和有机相. Yu等[10]以牛血清蛋白(BSA)为模板在甲苯中利用悬浮聚合法制备分子印迹聚合物,结合化学发光技术应用于BSA的检测.
③原子转移自由基聚合:氧化还原反应中夺取去引发剂烷基卤化物中的卤原子,使重金属离子被氧化成高价态的金属配合物和烷基自由基. 然后,烷基自由基与单体发生加成反应生成的中间体再从高价态的金属配合物中夺取卤素. 循环上述过程会生成分子量较大的聚合物 [11]. Gai等[12]在水媒介中用此方法合成溶菌酶蛋白(Lyz)磁性分子印迹聚合物可从标准蛋白和混合蛋清中快速分离样品.
④可逆加成断裂链转移聚合:常以二硫代酯及其衍生物用作链转移剂,链转移和链平衡的反应都朝着正方向进行,随着转移试剂对自由基浓度的抑制,极大地降低了终止反应的概率,使得聚合中活性/可控得以实现. Gai等[13]基于可逆加成断裂链转移聚合法在温和的反应条件下印迹BSA磁性分子印迹聚合物用于牛血清蛋白的快速分离.
(3)除上述方法之外还有本体聚合法、乳液聚合法等[14].
传统方法如本体聚合法和悬浮聚合制备MMIPs有诸多问题,如表面结合位点数量少、聚合物主体内的识别位点难以接近、形态不均匀以及会包藏少量单体不利于清除等,特别是生物大分子(如蛋白质,多糖和核酸等)在印迹材料制备上的问题更为突出. 除传统方法外,新近发展起来的有表面印迹、抗原决定基印迹、金属螯合物印迹法以及硼酸亲和法,将在2.2节详细介绍. 这些新方法在一定程度上解决了以生物大分子为模板所引起的洗脱困难、传质速率低等问题,使得分子印迹技术在生物大分子方面的应用取得了快速发展.
-
过去20年中,分子印迹技术作为一种新型的具有高效选择性吸附分离技术在小分子模板的 MMIPs 制备方面取得了巨大成功[15]. 从表1可以看出,以小分子为模板的磁性分子印迹材料印迹因子和选择因子明显高于以生物大分子为模板的分子印迹材料.
与小分子相比,MMIPs在生物大分子方面的发展相对滞后. 其原因可分为以下几个方面:(1)生物大分子难以到达识别位点及脱附再生存在困难;(2)与普通小分子相比生物大分子拥有巨大的分子量,在设计印迹聚合物的过程中要考虑到模板分子的传质能力;(3)其次是分子印迹材料的制备和特异性识别在水相中进行时会存在问题.
-
经过几十年的探索,尤其是新型纳米材料的出现,以及表面分子印迹技术、抗原决定基印迹技术、有机-无机杂化分子印迹技术等制备新方法的发展,使得BMMIPs 的制备和应用有了实质性的突破.
-
新型纳米材料可以提升MIPs的特异性识别. 新型纳米材料作为载体使用时可以减少识别位点包埋现象从而提高MIPs的特异性识别作用,同时又赋予一些传统材料所不具有的特性,例如SiO2纳米颗粒、磁性纳米粒子、石墨烯以及碳纳米管等(表2). 尤其磁性材料由于具有强顺磁性,在外界磁场的作用下很容易将其从复杂环境中分离出来,在提高MIPs分离或识别效果的同时大大简化了制备过程.
磁性纳米材料由于具有高稳定性、大比表面积、小毒性、低成本、易制备等优点,特别是在制备以生物大分子为模板分子的MIPs方面广泛受到研究者的青睐. 以磁性材料为MIPs的载体,结合特异性识别作用和磁性分离特性,便获得一种新型分子印迹材料—MMIPs. 这种新型分子印迹材料结合磁性材料和分子印迹材料的优点,具有高吸附效率、高选择性、操作方便、利于从复杂样品中快速分离等优点 [29]. 并且磁性纳米材料还可以通过表面功能化修饰表现出多重特性,例如Sun等[30]以使用多孔TiO2,合成新型磁性载体Fe3O4@pTiO2,以糖蛋白辣根过氧化物酶为模板分子,制备了适用于弱酸环境的新型的MIPs,以实现较为复杂的生物样本的对低丰度糖蛋白进行快速检测识别与分离. 这项研究证明了以多孔TiO2作为载体可以有效提高了吸附量,并将其适用范围拓宽至弱酸环境,这项研究为磁性分子印迹技术在弱酸环境下快速识别分析生物样品提供了新思路.
-
(1)表面分子印迹技术可以有效克服空间位阻的影响. 表面分子印迹技术使印迹材料与目标分子的识别点位设计在材料表面或近表面,借助这种方式提高传质效率,有效解决了传统方法的空间位阻大、识别效率低、反应速率慢等弊端[31]. 如Yang[18]等运用表面印迹法制备新型BSA表面印迹磁性碳纳米管,具有优良的再生性能,并且在应用于真实样品胎牛血清中时,可以从较复杂的实际样品中有效分离BSA(IF=1.43).
(2)抗原决定基克服物理化学性质不稳定的影响. 抗原决定基印迹法(又称表位印迹法和固定模板法)是模拟抗体会特异性结合抗原某一特征片段而建立起来的方法[32]. 抗原决定基肽段由于其构象与整蛋白质相比更为稳定,且可以通过人工合成获得,这种以抗原决定基肽段作为模板分子的印迹技术使生物大分子模板难获得、构象不稳定的问题得以解决[33]. 如Li等[34]原决定基印迹法以修饰了His-tag的HSA的 C端九肽为模板,利用His-tag与金属镍之间的特异性配位作用,采用多巴胺自聚合反应,制备了能对HAS特异性识别(IF=2.12)的MMIPs,并且由于锚定的His-tag具有良好的亲水性,这种策略可以应用于不同极性的表面位点的印迹.
(3)金属螯合印迹法加强模板分子固定. 金属螯合印迹法普遍以表面具有暴露的氨基酸残基的蛋白质为模板,因螯合作用的强度比非共价结合要强,有利于模板分子固定在载体上. 金属螯合印迹法通过金属螯合单体或目标蛋白暴露的氨基酸与金属离子的相互作用,在交联剂的存在下交联成聚合物,有效解决了模板分子容易脱落的问题. Li等[24]通过Cu2+和螯合敏感单体在37℃下以Lyz为模板分子合成温敏MIPs,这种有效的方法合成的MIPs具有极高的印迹因子(IF=22.7)和较大的比吸附容量.
(4)硼酸亲和法加强对糖类生物大分子的特异性. 硼酸亲和法是利用硼酸共价结合顺式二醇基团可逆的缩合反应生成功能单体和模板的加成物. 当所处条件的溶液pH值大于硼酸分子的pKa值的时候,硼酸基团与糖类或糖蛋白上的顺式二醇基团发生缩合反应,使模板分子固定在载体上. 当溶液的pH值小于硼酸分子的pKa值的时候,复合物发生解离,利于洗脱并富集吸附的模板生物大分子. 但普通的硼酸亲和法限制了BMMIPs对蛋白质类型的应用,Xing等[35]报道了一种可控定向表面印迹的硼酸盐亲和锚定表位印迹法,先将载体表位进行糖化,之后聚合形成印迹层. 这种新型方法克服了硼酸亲和法对蛋白质类型的应用限制,大大推进了生物大分子印迹技术的发展与创新.
新型分子印迹技术的发展可有效克服空间位阻大和物理化学性质不稳定的影响,同时具有强特异性识别能力和良好的机械强度和稳定性,在化学、医学、环境等许多领域都具有良好的应用前景.
-
有机-无机杂化 MMIPs既有无机组分溶胶-凝胶的稳定性、也有有机聚合物的机械强度以及分子印迹选择性的优点,从而赋予MMIPs良好的机械强度和稳定性,并且克服了分子印迹有机与无机聚合物合成复杂的问题,成为了分子印迹发展的新方向,为BMMIPs的制备提供方法学保障.
有机-无机杂化分子印迹技术制备的MMIPs具有许多新优点:①溶胶-凝胶过程操作条件温和;②杂化 MMIPs 主体多孔,一般具有交联度高、化学稳定和热稳定性高的特点;③材料形状可控度高;④通过控制溶胶-凝胶过程,可以控制MMIPs 的孔径和比表面积. 由于有机-无机杂化分子印迹技术制备的MMIPs同时具备有机与无机的机械强度高和耐溶剂性好的优点,现已经成为一种崭新的分子印迹技术.
表3列举了近年一些以生物大分子为模板的MMIPs的应用,可以看出随着新型纳米材料和新型分子印迹技术突破将大大拓宽其在不同范围内的研究与应用,为制备以大生物分子为模板的磁性分子印迹材料提供方法学保障.
-
MMIPs由于其对模板分子具有极高的特异性吸附效果,可用于高效分离纯化蛋白质、多糖、核酸等生物大分子. Fang等[41]以Fe3O4@TiO2作为载体,磷蛋白溶菌酶作为模板分子,聚多巴胺作为聚合物层制备磁性分子印迹纳米颗粒,这种BMMIPs在标准溶液中显示出极低的检测限,在人类血清和尿液中的分离表现出预期的优异性能,显示了其在分离与纯化磷蛋白生物标记物方面的巨大潜力的. Li等[42]以褐藻糖胶和褐藻酸为模板制备了一种双模板磁性分子印迹材料,并用7种类型的深共晶溶剂对材料进行了改性. 结果表明,一种改性后的磁性分子印迹材料对褐藻糖胶和褐藻酸的实际回收率为89.87%和92.0%,实际提取量为20.6 μg·g−1和18.7 μg·g−1,表现出了优异的分离与纯化效果.
-
MMIPs可作为一种临床免疫分析和医疗诊断的新型技术手段还可以作为靶向药物输送的载体等[43]. 如刘振课题组提出的硼亲和可控定向表面印迹技术[44],具有印迹效率高、通透性好、抗干扰和亲和能力强、适用pH范围广等特点,在生物医药、药物识别与检测等方面有良好的应用前景[45]. Zhou等[46]结合表面和表位印迹技术以及抗原决定基技术,以二氧化硅包覆的磁性氧化铁纳米粒子为载体,3-氨基苯硼酸(APBA)为功能单体,在加入引发剂过硫酸铵后,以人免疫球蛋白G为模板,在其表面聚合制备出一种BMMIPs作为探针,构建了一种快速、经济的电化学发光免疫传感器,用于超灵敏检测人类免疫缺陷病毒1型抗体(抗HIV-1). 该方法简单快捷、成本低、灵敏度高,为临床免疫分析提供了一种新方法.
-
MMIPs作为一种性能良好的固相萃取材料可用于复杂环境中痕量物质的监测. 如Tian等[47]在水溶剂中以Fe3O4纳米颗粒为载体,多巴胺为功能单体,β-雌二醇(E2)为模板分子合成了磁性分子印迹纳米球,结果显示,合成的材料对E2具有较强的特异性结合能力,其中吸附量为41.48 mg·g−1,印迹因子高达9.07,可用于环境中痕量物质的灵敏监测. Ming等[48]结合荧光检测技术制备了一种磁性分子印迹材料,结果显示这种BMMIPs可以对水样中的17β-E2达到快速、灵敏检测的目的,检出限为0.03 μmol·L−1,湖泊和河流水样中17β-E2的回收率 范围为98.2%—103.8%,相对标准偏差在1.1%—3.8%之间. 由于方法简单、可靠、可循环使用,为从复杂水体样本中对17β-E2实施监测提供了一个有效的方法.
-
MMIPs可用于复杂环境中特殊污染物的吸附去除. MMIPs已经广泛应用到了复杂环境中抗生素、农药等小分子物质的吸附去除,如Tan等[49]将多巴胺包覆的氧化石墨烯印迹磁性纳米颗粒,应用于海水中氟喹诺酮类抗生素的吸附,去除率可以达到95%以上,用此种方法制备的磁性分子印迹材料可以有效去除水环境中的抗生素. 近年来随着材料和制备技术方面的突破,在复杂环境中生物大分子的吸附去除也表现出了良好的应用潜力. 作者所在课题组利用MMIPs选择性吸附MBR系统中引起膜污染的多糖、蛋白质等生物大分子,有效降低了膜过滤阻力,从而减缓了膜污染进程. 有趣的是,MBR系统中膜污染物质主要为几类特殊的同源性物质,对MMIPs的精确识别性能不如产品分离纯化要求高,只需能选择性吸附这几类同源性物质即可达到延缓膜污染的目的,更为其在膜污染调控方面的应用提供了可能. 并且,磁性材料的引入还可以显著改善环境微生物的生产和代谢活动,同时实现减缓膜污染和提高生物反应运行效能的目的. 如作者所在课题组将磁性材料引入MBR反应器,发现微纳米磁性粒子的磁致效应引起了污泥混合液特性的变化继而减缓膜污染速率[50];同时发现充分的磁化活性污泥预驯化对于提高MBR的临界通量是非常必要的[51-53].
-
MMIPs还可以作为传感器的敏感材料,如Zhang等[54]提出一种新的分子印迹磁性荧光纳米复合传感器的设计和构建策略可用于人尿和蛋清样品中溶菌酶的检测,Liang等[55]用纳米分子印迹聚合物修饰玻碳电极提出了一种选择性、灵敏的溶菌酶电化学检测传感器,可用于生物样品中微量蛋白质的检测. MMIPs还可用于食品安全风险评估[56]、色谱分析[57]等领域.
-
现阶段,MMIPs在生物大分子分离领域的研究和应用中在材料和制备技术方面均取得了诸多突破,但距离商品化应用仍有很长的路要走,面临着诸多困难和挑战:
(1)吸附容量低、功能单体单一:由于MMIPs的一些识别位点常被埋在聚合物的三维结构中使有效印迹位点减少,从而导致吸附容量较低.
(2)对生物大分子(如蛋白质、糖类、病毒等)精确识别困难:生物大分子的尺寸使得交联度和聚合物网络内的转移得以限制,且对pH、离子浓度以及温度和溶剂种类都较敏感,洗脱过程中容易造成损害(特别是蛋白质的变性).
(3)克服现有的水相识别过程中造成的印迹效率降低的问题,如寻找亲水单体、更合适的交联剂等.
磁性分子印迹材料在生物大分子分离方面的研究及应用
Study and application of magnetic molecularly imprinted polymers in the separation of biomacromolecules
-
摘要: 磁性分子印迹材料(MMIPs)具有识别性强、化学和物理稳定性高、生物兼容性好、回收简单、可重复使用等优点,已发展成为高亲和性、高选择性分离小分子物质的重要手段. 生物大分子,如糖类、蛋白质和核酸等,因其传质阻力大、结构复杂,MMIPs在生物大分子分离方面的研究和应用相对滞后. 本文简要介绍了MMIPs技术的原理、制备方法及其在生物医药、环境监测、环境治理等领域的应用现状,并重点综述了MMIPs分离生物大分子方面的最新进展和有待解决的问题,以期为MMIPs在生物大分子分离领域的发展和应用提供参考.Abstract: Magnetic molecularly imprinted polymers (MMIPs) have been developed as an important method to separate small molecules with high affinity and good selectivity due to their specific recognition, high physical-chemical stability, good biological compatibility, easy recovery and perfect reusability. However, the study and application of MMIPs in the separation of biological macromolecules is behind that of small molecular substances. As the biological macromolecules such as polysaccharides, proteins and nucleic acids, have the high mass transfer resistance and complex structure. In this paper, the principle, the preparation methods and applications of MMIPs are briefly introduced. Following, the latest developments and present problems in the field of biomacromolecule separation by MMIPs are critically reviewed. It is expected to provide references for the development and application of MMIPs in the separation of biological macromolecules.
-
Key words:
- magnetic molecular imprinting polymers /
- biomacromolecules /
- separation /
- protein /
- polysaccharide /
- nanomaterials.
-

-
表 1 MMIPs研究现状
Table 1. Research status of MMIPs
表 2 新型载体在生物大分子分子印迹上的应用
Table 2. Application of novel carriers in molecular imprinting of biomacromolecules
表 3 以生物大分子为模板的MMIPs应用
Table 3. Application of MMIPs targeting biomacromolecules
-
[1] VLATAKIS G, ANDERSSON L I, MÜLLER R, et al. Drug assay using antibody mimics made by molecular imprinting [J]. Nature, 1993, 361(6413): 645-647. doi: 10.1038/361645a0 [2] HU T L, CHEN R, WANG Q, et al. Recent advances and applications of molecularly imprinted polymers in solid-phase extraction for real sample analysis [J]. Journal of Separation Science, 2021, 44(1): 274-309. doi: 10.1002/jssc.202000832 [3] FUCHS Y, SOPPERA O, HAUPT K. Photopolymerization and photostructuring of molecularly imprinted polymers for sensor applications—A review [J]. Analytica Chimica Acta, 2012, 717: 7-20. doi: 10.1016/j.aca.2011.12.026 [4] HUANG C, WANG H W, MA S J, et al. Recent application of molecular imprinting technique in food safety [J]. Journal of Chromatography A, 2021, 1657: 462579. doi: 10.1016/j.chroma.2021.462579 [5] JIA X P, XU M L, WANG Y Z, et al. Polydopamine-based molecular imprinting on silica-modified magnetic nanoparticles for recognition and separation of bovine hemoglobin [J]. The Analyst, 2013, 138(2): 651-658. doi: 10.1039/C2AN36313E [6] NGUYEN H T, VUONG BUI N T, KANHOUNNON W G, et al. Co-precipitation polymerization of dual functional monomers and polystyrene-co-divinylbenzene for ciprofloxacin imprinted polymer preparation [J]. RSC Advances, 2021, 11(54): 34281-34290. doi: 10.1039/D1RA05505D [7] 鹿现永, 黄达, 杨新林, 等. 蒸馏沉淀聚合法制备窄分散聚二乙烯基苯-co-丙烯腈功能聚合物微球 [J]. 高分子学报, 2007(2): 103-107. doi: 10.3321/j.issn:1000-3304.2007.02.002 LU X Y, HUANG D, YANG X L, et al. Preparation of monodisperse poly(divinylbenzene-co-acrylonitrile) microspheres by distillation precipitation polymerization [J]. Acta Polymerica Sinica, 2007(2): 103-107(in Chinese). doi: 10.3321/j.issn:1000-3304.2007.02.002
[8] ROSSETTI C, ŚWITNICKA-PLAK M A, GRØNHAUG HALVORSEN T, et al. Automated protein biomarker analysis: On-line extraction of clinical samples by molecularly imprinted polymers [J]. Scientific Reports, 2017, 7: 44298. doi: 10.1038/srep44298 [9] 赖家平, 孙慧, 陈芳, 等. 分子印迹微米微球的合成方法及在固相萃取中的应用研究进展 [J]. 分析测试学报, 2012, 31(9): 1161-1169. doi: 10.3969/j.issn.1004-4957.2012.09.024 LAI J P, SUN H, CHEN F, et al. Progresses on synthesis methods of molecularly imprinted microspheres and their applications in solid-phase extraction [J]. Journal of Instrumental Analysis, 2012, 31(9): 1161-1169(in Chinese). doi: 10.3969/j.issn.1004-4957.2012.09.024
[10] YU J H, WAN F W, ZHANG C C, et al. Molecularly imprinted polymeric microspheres for determination of bovine serum albumin based on flow injection chemiluminescence sensor [J]. Biosensors and Bioelectronics, 2010, 26(2): 632-637. doi: 10.1016/j.bios.2010.07.009 [11] DADASHI-SILAB S, LORANDI F, FANTIN M, et al. Redox-switchable atom transfer radical polymerization [J]. Chemical Communications, 2019, 55(5): 612-615. doi: 10.1039/C8CC09209E [12] GAI Q Q, QU F, LIU Z J, et al. Superparamagnetic lysozyme surface-imprinted polymer prepared by atom transfer radical polymerization and its application for protein separation [J]. Journal of Chromatography A, 2010, 1217(31): 5035-5042. doi: 10.1016/j.chroma.2010.06.001 [13] GAI Q Q, QU F, ZHANG T, et al. The preparation of bovine serum albumin surface-imprinted superparamagnetic polymer with the assistance of basic functional monomer and its application for protein separation [J]. Journal of Chromatography A, 2011, 1218(22): 3489-3495. doi: 10.1016/j.chroma.2011.03.069 [14] FENG Y G, LIU Q, YE L F, et al. Ordered macroporous quercetin molecularly imprinted polymers: Preparation, characterization, and separation performance [J]. Journal of Separation Science, 2017, 40(4): 971-978. doi: 10.1002/jssc.201601011 [15] MOEIN M M. Advancements of chiral molecularly imprinted polymers in separation and sensor fields: A review of the last decade [J]. Talanta, 2021, 224: 121794. doi: 10.1016/j.talanta.2020.121794 [16] QIN Y P, JIA C, HE X W, et al. Thermosensitive metal chelation dual-template epitope imprinting polymer using distillation-precipitation polymerization for simultaneous recognition of human serum albumin and transferrin [J]. ACS Applied Materials & Interfaces, 2018, 10(10): 9060-9068. [17] QU X, WANG F F, SUN Y, et al. Selective extraction of bioactive glycoprotein in neutral environment through Concanavalin A mediated template immobilization and dopamine surface imprinting [J]. RSC Advances, 2016, 6(89): 86455-86463. doi: 10.1039/C6RA11040A [18] YANG Z T, WANG J Q, SHAH T, et al. Development of surface imprinted heterogeneous nitrogen-doped magnetic carbon nanotubes as promising materials for protein separation and purification [J]. Talanta, 2021, 224: 121760. doi: 10.1016/j.talanta.2020.121760 [19] FAN J P, YU J X, YANG X M, et al. Preparation, characterization, and application of multiple stimuli-responsive rattle-type magnetic hollow molecular imprinted poly (ionic liquids) nanospheres (Fe3O4@void@PILMIP) for specific recognition of protein [J]. Chemical Engineering Journal, 2018, 337: 722-732. doi: 10.1016/j.cej.2017.12.159 [20] KUHN J, AYLAZ G, SARI E, et al. Selective binding of antibiotics using magnetic molecular imprint polymer (MMIP) networks prepared from vinyl-functionalized magnetic nanoparticles [J]. Journal of Hazardous Materials, 2020, 387: 121709. doi: 10.1016/j.jhazmat.2019.121709 [21] 焦琳娟, 徐先燕, 吴晓莹, 等. 基于SI-ATRP技术制备磁性甲基对硫磷分子印迹聚合物及其吸附性能 [J]. 环境化学, 2020, 39(1): 89-100. doi: 10.7524/j.issn.0254-6108.2019070503 JIAO L J, XU X Y, WU X Y, et al. Synthesis of methyl-parathion molecularly imprinted magnetic nanoparticles via surface-initiated atom transfer radical polymerization (SI-ATRP) and its adsorption properties [J]. Environmental Chemistry, 2020, 39(1): 89-100(in Chinese). doi: 10.7524/j.issn.0254-6108.2019070503
[22] 张鑫, 李彦松, 汤波, 等. 磁性分子印迹微球的制备及其对熊果酸的选择性分离 [J]. 分析化学, 2021, 49(4): 628-635. doi: 10.19756/j.issn.0253-3820.201603 ZHANG X, LI Y S, TANG B, et al. Preparation of magnetic molecularly imprinted microspheres for selective separation of ursolic acid [J]. Chinese Journal of Analytical Chemistry, 2021, 49(4): 628-635(in Chinese). doi: 10.19756/j.issn.0253-3820.201603
[23] KONG D L, QIAO N, WANG N, et al. Facile preparation of a nano-imprinted polymer on magnetite nanoparticles for the rapid separation of lead ions from aqueous solution [J]. Physical Chemistry Chemical Physics:PCCP, 2018, 20(18): 12870-12878. doi: 10.1039/C8CP01163J [24] LI W, SUN Y, YANG C C, et al. Fabrication of surface protein-imprinted nanoparticles using a metal chelating monomer via aqueous precipitation polymerization [J]. ACS Applied Materials & Interfaces, 2015, 7(49): 27188-27196. [25] YANG Z T, YANG K, CUI Y H, et al. Synthesis of surface imprinted polymers based on wrinkled flower-like magnetic graphene microspheres with favorable recognition ability for BSA [J]. Journal of Materials Science & Technology, 2021, 74: 203-215. [26] WU X, CHEN X M, ZHONG G Q, et al. A novel Wulff-type boronate acid-functionalized magnetic metal-organic framework imprinted polymer for specific recognition of glycoproteins under physiological pH [J]. Journal of Separation Science, 2020, 43(19): 3785-3792. doi: 10.1002/jssc.202000437 [27] ZHAO Y J, CHEN Y J, FANG M Y, et al. Silanized carbon dot-based thermo-sensitive molecularly imprinted fluorescent sensor for bovine hemoglobin detection [J]. Analytical and Bioanalytical Chemistry, 2020, 412(23): 5811-5817. doi: 10.1007/s00216-020-02803-5 [28] HASHEMI M, NAZARI Z. Preparation of molecularly imprinted polymer based on the magnetic multiwalled carbon nanotubes for selective separation and spectrophotometric determination of melamine in milk samples [J]. Journal of Food Composition and Analysis, 2018, 69: 98-106. doi: 10.1016/j.jfca.2018.02.010 [29] LI J Y, WANG Y R, YU X X. Magnetic molecularly imprinted polymers: Synthesis and applications in the selective extraction of antibiotics [J]. Frontiers in Chemistry, 2021, 9: 706311. doi: 10.3389/fchem.2021.706311 [30] SUN X Y, MA R T, SHI Y P. Preparation and analysis of glycoprotein magnetic imprinted particles in weak acid environment [C]. Proceedings of the 22nd National Chromatography Academic Report and Instrument Exhibition of Chinese Chemical Society (Volume 1), 2012: 202-203. [31] DONG C Y, SHI H X, HAN Y R, et al. Molecularly imprinted polymers by the surface imprinting technique [J]. European Polymer Journal, 2021, 145: 110231. doi: 10.1016/j.eurpolymj.2020.110231 [32] WANG X D, CHEN G, ZHANG P, et al. Advances in epitope molecularly imprinted polymers for protein detection: A review [J]. Analytical Methods:Advancing Methods and Applications, 2021, 13(14): 1660-1671. [33] 杨开广, 李森武, 刘路宽, 等. 抗原决定基印迹材料及其应用 [J]. 科学通报, 2019, 64(13): 1368-1379. doi: 10.1360/N972018-01033 YANG K G, LI S W, LIU L K, et al. Recent advances and application of epitope imprinted materials [J]. Chinese Science Bulletin, 2019, 64(13): 1368-1379(in Chinese). doi: 10.1360/N972018-01033
[34] LI S W, YANG K G, LIU J X, et al. Surface-imprinted nanoparticles prepared with a His-tag-anchored epitope as the template [J]. Analytical Chemistry, 2015, 87(9): 4617-4620. doi: 10.1021/ac5047246 [35] XING R R, MA Y Y, WANG Y J, et al. Specific recognition of proteins and peptides via controllable oriented surface imprinting of boronate affinity-anchored epitopes [J]. Chemical Science, 2018, 10(6): 1831-1835. [36] HUANG W, HOU X Y, TONG Y K, et al. Determination of sialic acid in serum samples by dispersive solid-phase extraction based on boronate-affinity magnetic hollow molecularly imprinted polymer sorbent [J]. RSC Advances, 2019, 9(10): 5394-5401. doi: 10.1039/C9RA00511K [37] LEE M H, LIN C C, THOMAS J L, et al. Epitope recognition of magnetic peptide-imprinted chitosan composite nanoparticles for the extraction of CRISPR/dCas9a proteins from transfected cells [J]. Nanotechnology, 2021, 32(18): 18LT02. doi: 10.1088/1361-6528/abde00 [38] BIE Z J, CHEN Y, YE J, et al. Boronate-affinity glycan-oriented surface imprinting: A new strategy to mimic lectins for the recognition of an intact glycoprotein and its characteristic fragments [J]. Angewandte Chemie International Edition, 2015, 54(35): 10211-10215. doi: 10.1002/anie.201503066 [39] CHEN G N, SHU H, LU W, et al. A surfactant-mediated Sol-gel method for the preparation of molecularly imprinted polymers and its application in a biomimetic immunoassay for the detection of protein [J]. Journal of Pharmaceutical and Biomedical Analysis, 2020, 190: 113511. doi: 10.1016/j.jpba.2020.113511 [40] CHEN F F, MAO M, WANG J Y, et al. A dual-step immobilization/imprinting approach to prepare magnetic molecular imprinted polymers for selective removal of human serum albumin [J]. Talanta, 2020, 209: 120509. doi: 10.1016/j.talanta.2019.120509 [41] FANG X W, WANG Z D, SUN N R, et al. Magnetic metal oxide affinity chromatography-based molecularly imprinted approach for effective separation of serous and urinary phosphoprotein biomarker [J]. Talanta, 2021, 226: 122143. doi: 10.1016/j.talanta.2021.122143 [42] LI G Z, ROW K H. Magnetic molecularly imprinted polymers for recognition and enrichment of polysaccharides from seaweed [J]. Journal of Separation Science, 2017, 40(24): 4765-4772. doi: 10.1002/jssc.201700947 [43] DINC M, ESEN C, MIZAIKOFF B. Recent advances on core-shell magnetic molecularly imprinted polymers for biomacromolecules [J]. TrAC Trends in Analytical Chemistry, 2019, 114: 202-217. doi: 10.1016/j.trac.2019.03.008 [44] WANG S S, YE J, BIE Z J, et al. Affinity-tunable specific recognition of glycoproteins via boronate affinity-based controllable oriented surface imprinting [J]. Chemical Science, 2014, 5(3): 1135. doi: 10.1039/c3sc52986j [45] DAR K K, SHAO S N, TAN T W, et al. Molecularly imprinted polymers for the selective recognition of microorganisms [J]. Biotechnology Advances, 2020, 45: 107640. doi: 10.1016/j.biotechadv.2020.107640 [46] ZHOU J, GAN N, LI T H, et al. A cost-effective sandwich electrochemiluminescence immunosensor for ultrasensitive detection of HIV-1 antibody using magnetic molecularly imprinted polymers as capture probes [J]. Biosensors & Bioelectronics, 2014, 54: 199-206. [47] TIAN X, SONG H J, WANG Y, et al. Hydrophilic magnetic molecularly imprinted nanobeads for efficient enrichment and high performance liquid chromatographic detection of 17beta-estradiol in environmental water samples [J]. Talanta, 2020, 220: 121367. doi: 10.1016/j.talanta.2020.121367 [48] MING W N, WANG X Y, LU W H, et al. Magnetic molecularly imprinted polymers for the fluorescent detection of trace 17β-estradiol in environmental water [J]. Sensors and Actuators B:Chemical, 2017, 238: 1309-1315. doi: 10.1016/j.snb.2016.09.111 [49] TAN F, LIU M, REN S. Preparation of polydopamine-coated graphene oxide/Fe3O4 imprinted nanoparticles for selective removal of fluoroquinolone antibiotics in water [J]. Scientific Reports, 2017, 7: 5735. doi: 10.1038/s41598-017-06303-y [50] 张王超, 郭洪成, 郭冀峰, 等. 微纳米磁性粒子对膜生物反应器运行效能的影响 [J]. 环境工程学报, 2020, 14(10): 2719-2727. doi: 10.12030/j.cjee.201910144 ZHANG W C, GUO H C, GUO J F, et al. Effect of magnetic microparticles and nanoparticles on the performance of membrane bioreactor [J]. Chinese Journal of Environmental Engineering, 2020, 14(10): 2719-2727(in Chinese). doi: 10.12030/j.cjee.201910144
[51] GUO H C, HU J J, LI J X, et al. Systematic insight into the short-term and long-term effects of magnetic microparticles and nanoparticles on critical flux in membrane bioreactors [J]. Journal of Membrane Science, 2019, 582: 284-288. doi: 10.1016/j.memsci.2019.04.015 [52] LIU Y, LIU Q, LI J X, et al. Effect of magnetic powder on membrane fouling mitigation and microbial community/composition in membrane bioreactors (MBRs) for municipal wastewater treatment [J]. Bioresource Technology, 2018, 249: 377-385. doi: 10.1016/j.biortech.2017.10.027 [53] LIU Y, LI J X, GUO W S, et al. Use of magnetic powder to effectively improve the performance of sequencing batch reactors (SBRs) in municipal wastewater treatment [J]. Bioresource Technology, 2018, 248: 135-139. doi: 10.1016/j.biortech.2017.06.069 [54] ZHANG X, TANG B, LI Y S, et al. Molecularly imprinted magnetic fluorescent nanocomposite-based sensor for selective detection of lysozyme [J]. Nanomaterials (Basel, Switzerland), 2021, 11(6): 1575. doi: 10.3390/nano11061575 [55] LIANG A X, TANG B, HOU H P, et al. A novel CuFe2O4 nanospheres molecularly imprinted polymers modified electrochemical sensor for lysozyme determination [J]. Journal of Electroanalytical Chemistry, 2019, 853: 113465. doi: 10.1016/j.jelechem.2019.113465 [56] LI H H, AHMAD W, RONG Y W, et al. Designing an aptamer based magnetic and upconversion nanoparticles conjugated fluorescence sensor for screening Escherichia coli in food [J]. Food Control, 2020, 107: 106761. doi: 10.1016/j.foodcont.2019.106761 [57] ARABI M, OSTOVAN A, BAGHERI A R, et al. Strategies of molecular imprinting-based solid-phase extraction prior to chromatographic analysis [J]. TrAC Trends in Analytical Chemistry, 2020, 128: 115923. doi: 10.1016/j.trac.2020.115923 -



 下载:
下载: