-
铁氧化物广泛的存在于自然界中,常见的有针铁矿、水铁矿、纤铁矿等. 铁氧化物因比表面积大及氧化活性高等特点,影响重金属元素(如Cu、Pb和Zn等)、有机污染物和营养元素(如C、N、P和S等)的迁移、转化和归趋[1]. 因此,自然环境中铁氧化物的形成过程在环境化学和土壤学等领域备受关注. 铁氧化物可由Fe(Ⅱ)氧化或其他铁氧化物转化形成[2-5]. 自然界中的铁氧化物与锰氧化物常交结伴生,它们常以铁锰结核或包覆物的形式存在[6-9]. 锰氧化物是环境中重要的氧化剂,它们直接氧化Fe(Ⅱ)的过程被认为是铁锰结核重要形成途径之一[10]. 通常,Fe(Ⅱ)与四价锰氧化物的反应过程如式(1):
四价锰氧化物被还原,Fe(Ⅱ)被氧化形成铁氧化物. 但Fe(Ⅱ)氧化速率及产物类型受锰氧化物晶体结构影响[11-16]. 例如,在水钠锰矿氧化FeCl2-NH4OH反应中,Fe(Ⅱ)的氧化产物为针铁矿与四方纤铁矿;软锰矿、锰钾矿和黑锰矿氧化Fe(Ⅱ)产物则为纤铁矿、四方纤铁矿和磁铁矿[11-12];六方锰矿(γ-MnO2)与Fe(Ⅱ)氧化产物为MnFe2O4和水铁矿. 因此,不同反应体系中,生成产物及反应机制存在明显差异. 锰氧化物氧化Fe(Ⅱ)速率受pH影响[17-18]. pH < 4.0时,水钠锰矿能快速氧化Fe(Ⅱ),而pH > 4.0时反应速率大幅降低[17]. 现有研究多关注高价态锰氧化物对Fe(Ⅱ)的氧化过程. 黑锰矿由于结构中含有大量的Mn(Ⅲ),既可以在酸性条件下歧化生成高价锰氧化物,又易在碱性条件下发生氧化,因此在环境中难以长期大量稳定存在. 其与Fe(Ⅱ)的相互作用,特别是溶解氧参与的氧化过程有助于认识表生环境铁锰氧化物的形成与共生机理.
本文以典型低价锰氧化物黑锰矿为例,考察其对溶解氧氧化Fe(Ⅱ)过程的影响,采用XRD、FTIR、TEM和XAFS表征过程中间产物以明确黑锰矿氧化Fe(Ⅱ)机理,考察Fe(Ⅱ)浓度、pH和溶解氧对Fe(Ⅲ)氧化物形成过程的影响.
-
借鉴Mckenzie[19]报道的方法合成黑锰矿. 具体过程为:用除氧的超纯水配置等体积的0.2 mol·L−1 MnSO4和0.5 mol·L−1 NaOH溶液,将MnSO4溶液与NaOH溶液利用磁力搅拌混合,并不断通入氮气. 将反应生成Mn(OH)2沉淀用去氧超纯水清洗至pH ≤ 8.5. 用超纯水将沉淀物分散至烧杯中,于室温下通入空气氧化5 h,所得固相产物用超纯水洗涤至上清液电导小于20 μS·cm−1.
合成针铁矿具体过程[1]:将180 mL 5 mol·L−1 NaOH与100 mL 1 mol·L−1 Fe(NO3)3溶液混合于2 L 烧杯,加入超纯水至体积为2.0 L,随后密封并置于70 ℃烘箱老化72 h. 随后用超纯水将终产物洗涤至电导小于20 μS·cm−1. 所得黑锰矿和针铁矿固体经40 ℃真空干燥24 h后研磨过0.165 mm标准筛备用. 利用草酸与KMnO4的氧化还原反应,滴定测得黑锰矿锰平均氧化度为2.69[19].
-
在空气氛围中,将黑锰矿与不同浓度FeSO4在50 mL离心管中混合,黑锰矿浓度为0.5 g·L−1, Fe(Ⅱ)浓度设定为0—10 mmol·L−1,背景电解质为20 mmol·L−1 NaNO3. 溶液总体积为20 mL,反应体系控制在恒温摇床(25 ℃)中进行. 反应过程中用0.1/1.0 mol·L−1 HNO3和0.01/0.1 mol·L−1 NaOH调节pH值为3.0和5.0. 反应完之后在手套箱中用0.22 μm水系滤膜过滤,滤液保留待测. 为降低空气中氧气的影响,溶液配制及材料准备等实验操作均在氮气氛围的手套箱中进行. 配置溶液均采用除氧超纯水(DDW, 18 MΩ·cm),其余实验操作均与上述相同.
考虑到实验的可操作性,使用五口反应瓶研究Fe(Ⅱ)氧化动力学过程. 在500 mL去氧超纯水中加入0.25 g黑锰矿和20 mol·L−1 NaNO3,并持续磁力搅拌,反应过程控制室温持续通入空气,流速保持为气泡持续鼓出. 用浓度为0.1/1.0 mol·L−1 HNO3和0.01/0.1 mol·L−1 NaOH溶液12 h内持续调节pH恒定为5.0. 在不同反应时间点取悬浊液过滤待测. 为考察溶解氧对反应的影响,反应过程中持续鼓入高纯氮气(99.99%)和空气进行实验,利用溶解氧仪测得氮气氛围溶解氧含量接近0,其余实验条件保持一致.
此外,为明确反应过程中的中间产物对Fe(Ⅱ)氧化的影响,在8.0 mmol·L−1 Fe(Ⅱ)溶液中,加入0.86 g·L−1针铁矿和6.5 mmol·L−1 MnSO4考察其对Fe(Ⅱ)氧化的影响.
-
反应过程中过滤所得样品用X-射线衍射仪(XRD,Bruker D8 ,Germany, Cu Kα(λ=0.15406 nm))表征产物组分. 用傅里叶变换红外光谱仪(FTIR,Bruker VERTEX 70,Germany)表征产物的官能团,制样过程采用KBr压片,扫描范围为4000—400 cm−1. 用透射电镜(TEM,Hitachi H-7650,Japan)观察样品的微观形貌. 不同反应阶段的取出的滤液中Fe(Ⅱ)浓度的测定采用邻菲啰啉比色法,释放的Mn(Ⅱ)浓度的测定采用原子吸收(AA240FS),精度为0.01 mg·L−1. XAFS吸收光谱用于分析产物的平均锰氧化度和铁氧化物组分. 在北京同步辐射(1W2B)收集X-射线吸收谱. 采集的Mn K边能量范围为6340—7327 eV,Mn箔用作能量校正(6539 eV). Fe K边能量范围为6953—7884 eV,Fe箔作能量校正(7112 eV). 用Athena软件进行数据处理. 使用Combo方法对黑锰矿及其转化样品归一化的Mn K边X射线吸收近边结构光谱(X-ray absorption near edge structure, XANES)进行最小二乘法线性拟合,以分析锰氧化物中不同价态Mn含量和平均氧化度[20].
-
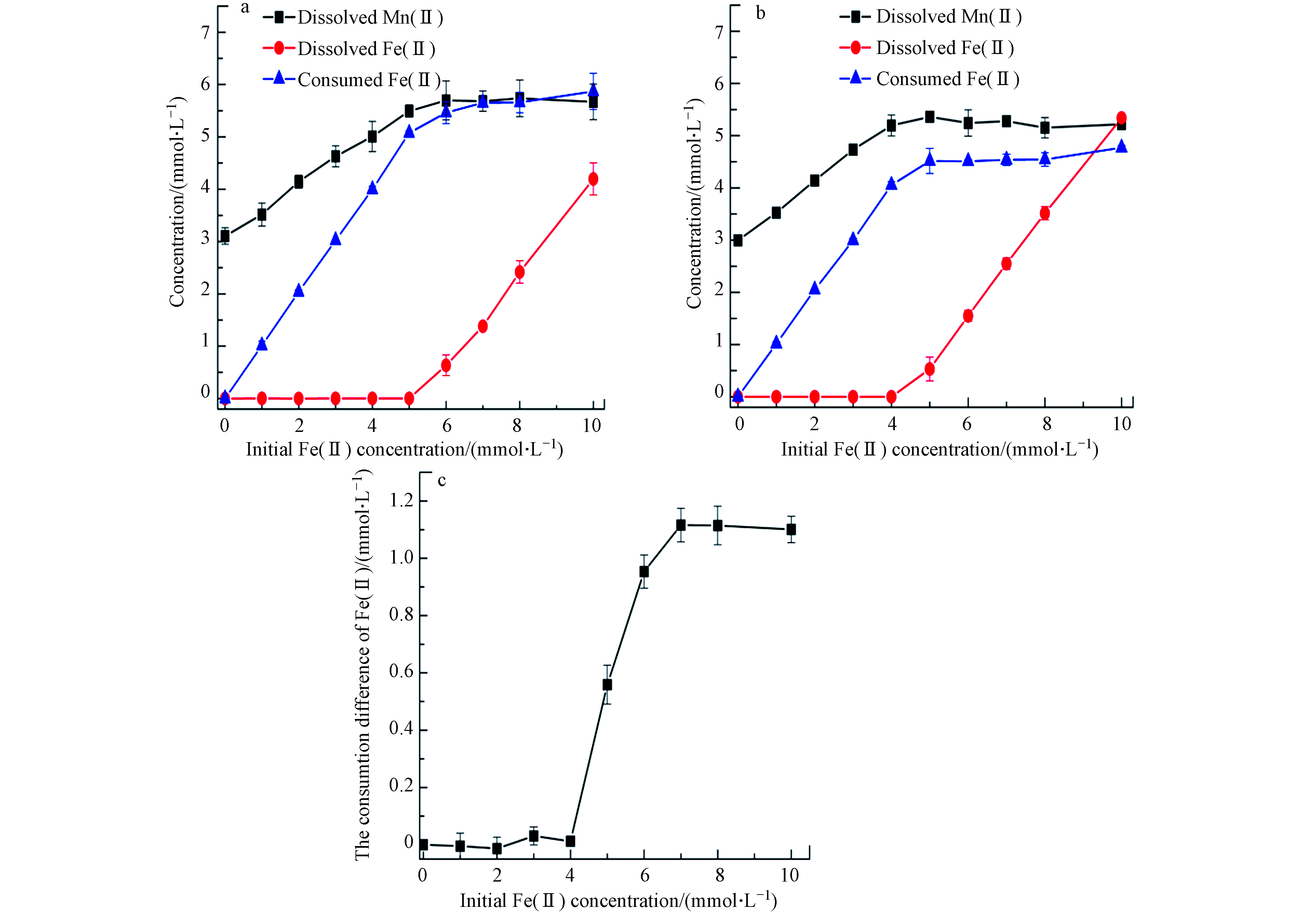
图1为pH 5.0下,不同初始浓度Fe(Ⅱ)(0—10 mmol)与黑锰矿(0.5 g·L−1)在空气和氮气氛围下相互作用24 h后溶液中Mn(Ⅱ)和Fe(Ⅱ)浓度. 在氮气和空气条件下,随初始Fe(Ⅱ)浓度升高,体系中溶解释放的Mn(Ⅱ)浓度先增加后保持平衡. 当初始Fe(Ⅱ)浓度 < 5.0 mmol·L−1时,测得生成的Mn(Ⅱ)与消耗的Fe(Ⅱ)比例接近1:1. 依据电荷守恒,若Fe(Ⅱ)完全被黑锰矿氧化,生成的Mn(Ⅱ)与消耗的Fe(Ⅱ)比例为3:1,表明有过量的溶解态Fe(Ⅱ)被析出,可能是溶解态的Fe(Ⅱ)被黑锰矿吸附所致. 这与Postma报道的水钠锰矿和Fe(Ⅱ)反应也观察到过量的Fe(Ⅱ)消耗反应规律一致[15]. 当Fe(Ⅱ)浓度增至 ≥ 5.0 mmol·L−1时,溶液中释放的Mn(Ⅱ)浓度小于消耗的Fe(Ⅱ)浓度,黑锰矿对Fe(Ⅱ)吸附达到饱和,溶液中有剩余的溶解态Fe(Ⅱ). 与氮气氛围结果比较发现,空气体系下消耗的Fe(Ⅱ)量明显增加,也即溶解氧参与了Fe(Ⅱ)的氧化过程.
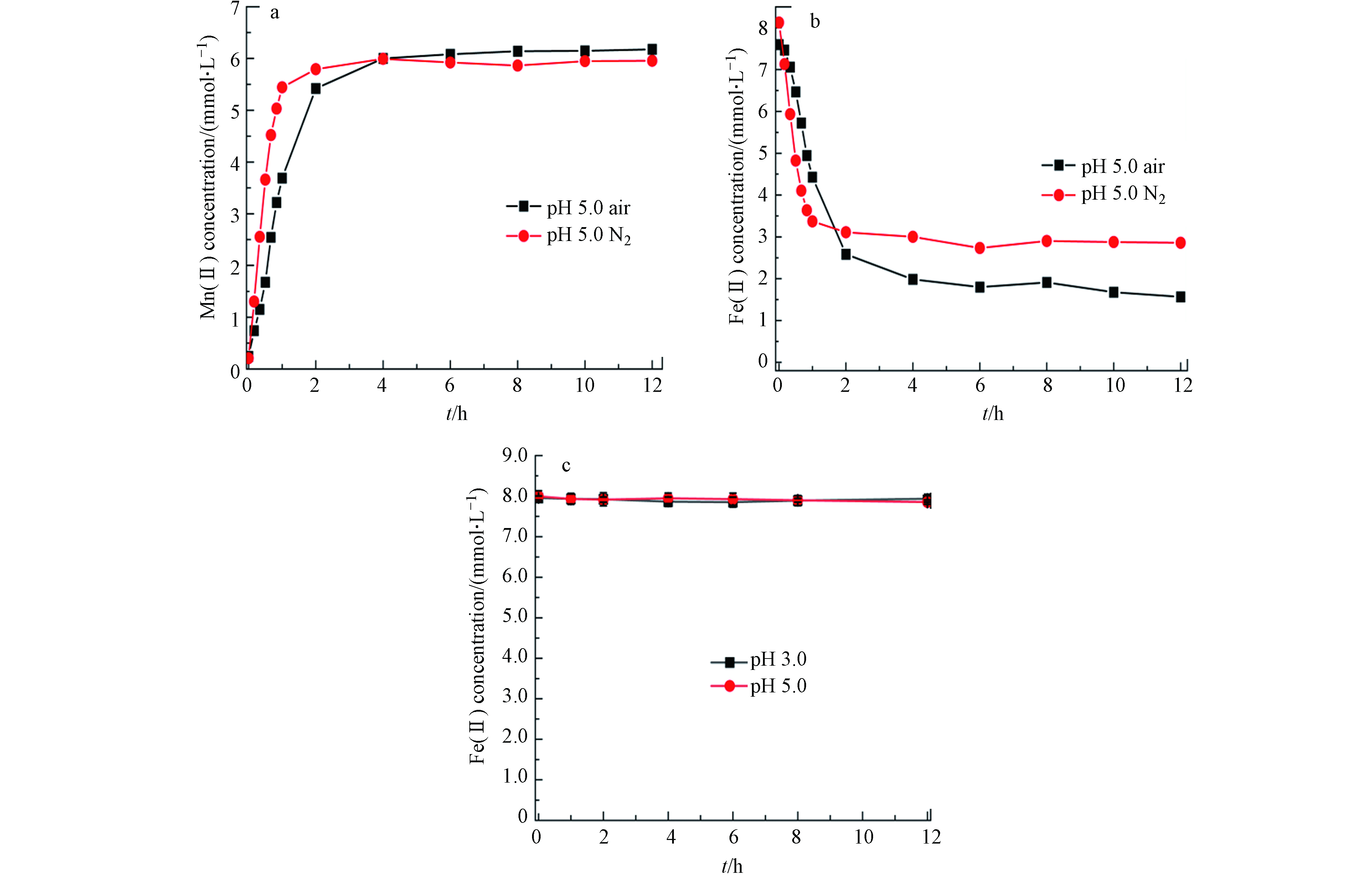
由图1结果可见,当初始Fe(Ⅱ)浓度较低时,Fe(Ⅱ)可被完全吸附和氧化. 为此设定Fe(Ⅱ)初始浓度为8 mmol·L−1研究有溶解氧参与的Fe(Ⅱ)氧化过程与机理. 考察了pH 5.0下、氮气和空气体系中0.5 g·L−1黑锰矿与8.0 mmol·L−1 Fe(Ⅱ)反应不同时间点溶解的Fe(Ⅱ)和Mn(Ⅱ)浓度(图2). 反应开始2 h内,氮气和空气氛围下Mn(Ⅱ)浓度均快速升高后保持平衡(图2a). N2氛围下,在反应开始1 h内Fe(Ⅱ)浓度快速降低,随后趋于平衡,而空气氛围下Fe(Ⅱ)浓度在反应过程中持续降低(图2b). 对比反应开始1h内,空气氛围下消耗的Fe(Ⅱ)速率与释放的Mn(Ⅱ)量均低于氮气氛围,表明溶解氧降低了Fe(Ⅱ)被氧化的速率.
在水锰矿氧化S2−反应过程中也观察到氧气的存在使得锰氧化物氧化S2−速率降低[21]. 在本研究中,由于黑锰矿与溶解氧均可参与Fe(Ⅱ)的氧化,但溶解氧氧化Fe(Ⅱ)的能力弱于黑锰矿,因此空气氛围下氧气竞争吸附在黑锰矿表面导致Fe(Ⅱ)氧化速率下降. 当释放的Mn(Ⅱ)浓度不再增加时,Fe(Ⅱ)仍可在空气氛围下被氧化,而氮气体系下Fe(Ⅱ)氧化没有明显变化.
这些结果表明,溶解氧虽降低Fe(Ⅱ)氧化速率,但可促进Fe(Ⅱ)被氧化的总量. 而Fe(Ⅱ)在单一的溶解氧氛围下的氧化速率几乎可以忽略(图2c),因此Fe(Ⅱ)的进一步氧化可能是中间产物在溶解氧作用下催化氧化的结果.
研究表明,FeCl2溶液在pH 5.0的开放体系中反应可生成纤铁矿,而锰钾矿和黑锰矿存在时Fe(Ⅱ)的氧化产物则分别为四方纤铁矿和磁铁矿[12]. 为阐明黑锰矿氧化Fe(Ⅱ)的机理,用XRD和FTIR表征了0.5 g·L−1黑锰矿和8.0 mmol·L−1 Fe(Ⅱ)在空气条件下不同时间点的固相产物(图3). 黑锰矿特征峰随着反应进行逐渐减弱,Fe(Ⅱ)被氧化主要形成了针铁矿和纤铁矿(图3a). 图3b为不同时间段产物的FTIR图谱,在3430 cm−1和1634 cm−1处为H2O中—OH的伸缩振动吸收峰[22]. 626、520、424 cm−1为黑锰矿中Mn—O的伸缩振动峰,随反应的进行其峰强逐渐减弱[22]. 880 cm−1为Fe(OH)3(s)中Fe—O—H伸缩振动,610 cm−1为针铁矿的特征吸收峰,1116、1054、454 cm−1为纤铁矿的特征吸收峰[23-24].
FTIR分析结果进一步表明,pH 5.0下Fe(Ⅱ)最终氧化产物为针铁矿和纤铁矿的混合物. 研究表明,在MnO2氧化Fe(Ⅱ)与As(Ⅲ)共存的体系中,Fe(Ⅱ)与As(Ⅲ)存在竞争氧化,Fe(Ⅱ)被氧化后可在锰氧化物表面形成了施氏矿物层,这降低了As(Ⅲ)的氧化速率[25]. 施氏矿物是砷酸盐和亚砷酸盐的重要寄主矿物[26],因此溶液中的As(Ⅲ)可以通过施氏矿物涂层并到达MnO2表面进行氧化. 而本工作的研究结果表明,当Fe(Ⅱ)被黑锰矿氧化形成铁氧化物包覆的黑锰矿后,氮气氛围下Fe(Ⅱ)氧化被抑制,即Fe(Ⅱ)并不能穿过铁氧化物包覆层继续被氧化. 但空气氛围下Fe(Ⅱ)可被继续氧化,而单一的Fe(Ⅱ)在溶解氧环境被氧化的速率可以忽略. 因此,反应后期Fe(Ⅱ)的氧化主要是溶解氧存在下形成铁氧化物的催化氧化作用导致.
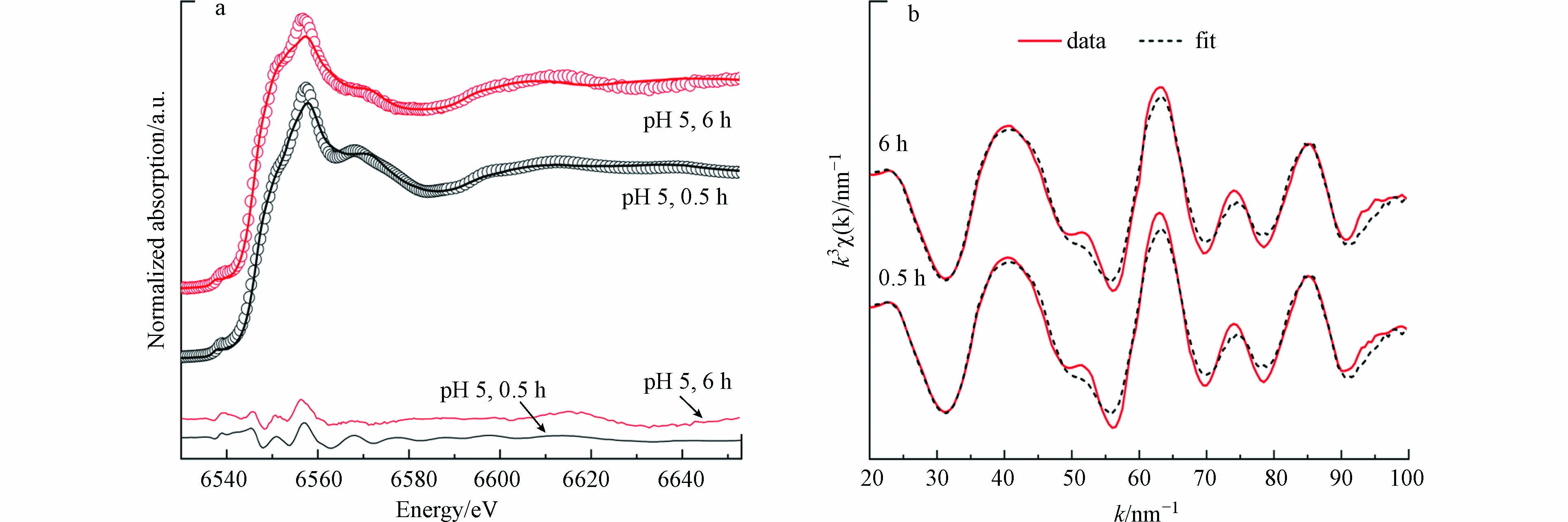
锰平均氧化度常被用于判断锰氧化物氧化程度. 黑锰矿在氧化Fe(Ⅱ)过程中,结构中的Mn(Ⅲ)被还原伴随着Mn(Ⅱ)的释放. 利用XAS表征了pH 5.0条件下,黑锰矿氧化Fe(Ⅱ) 0.5 h和6 h后固相产物Mn的平均价态(图4a). 采用Combo方法分析产物中Mn(Ⅱ、Ⅲ、Ⅳ)的相对含量及平均价态,拟合结果见表1. 当黑锰矿与Fe(Ⅱ)在pH 5.0条件下反应0.5 h后,锰氧化度为2.91,反应6 h后降为2.71,Mn(Ⅲ)的相对含量从75%降至69%,Mn(Ⅱ)相对含量从17%增加至30%,表明黑锰矿只能被部分还原,与体系中形成铁氧化物包覆层后Mn(Ⅱ)的浓度不再增加一致.
利用XRD难以鉴定Fe(Ⅱ)在氧化过程中形成的弱晶态铁氧化物. 因此采用Fe K边EXAFS光谱的线性拟合确定pH 5.0下可能的中间产物(图4b). 拟合过程中所用标样包括针铁矿、纤铁矿和水铁矿. 结果表明黑锰矿氧化Fe(Ⅱ)的中间产物主要为水铁矿及少量纤铁矿和针铁矿. 反0.5 h后产物中水铁矿、纤铁矿和针铁矿的相对含量分别为94.4%、1.2%和4.4%;反应6 h后相对含量分别为96.2%、0%和3.8%. 也即反应后期(6 h)水铁矿的相对含量略有增加. 有研究发现在水钠锰矿氧化Fe(Ⅱ)反应体系中,Fe(Ⅱ)的前期氧化产物为弱晶质铁氧化物,随后转化形成针铁矿和纤铁矿[11]. 也有研究发现Fe(Ⅱ)在弱晶质铁氧化物表面被氧化会生成与原始铁氧化物不同晶相的产物[4,27],因此,本工作中反应前期生成的水铁矿只是针铁矿和纤铁矿形成的前驱体. 反应后期Fe(Ⅱ)进一步被催化氧化,促进了水铁矿向针铁矿和纤铁矿的转化.
图5为pH 5.0空气氛围下0.5 g·L−1黑锰矿和8.0 mmol·L−1 Fe(Ⅱ)在0、1 h、6 h、12 h的透射电镜图片. 黑锰矿的初始形貌为方块状,粒径约50—100 nm. 反应进行1 h后,黑锰矿表面生成少量薄片状颗粒物. 在6 h和12 h时黑锰矿表面形成絮状颗粒物,同时片状颗粒物长大,表明黑锰矿逐渐被还原,生成薄片状针铁矿. XAS和TEM分析结果进一步表明,pH 5.0下Fe(Ⅱ)氧化的中间产物主要为水铁矿,终产物为针铁矿和纤铁矿的混合物.
以上结果表明黑锰矿与Fe(Ⅱ)的氧化体系中,Fe(Ⅱ)被氧化生成水铁矿随后转化成针铁矿和纤铁矿,同时黑锰矿还原释放Mn(Ⅱ)到溶液,总的反应式如下:
当Fe(Ⅱ)不足量时,Fe(Ⅱ)被完全吸附和氧化,过量的Fe(Ⅱ)消耗是溶解态的Fe(Ⅱ)被吸附所致的. 吸附的Fe(Ⅱ)一般可由0.4 mol·L−1 HCl提取[28-29],但黑锰矿在低pH下易溶解并发生歧化反应. 此外,当初始Fe(Ⅱ)浓度较低时,氮气和空气氛围下消耗的Fe(Ⅱ)没有差异,均可被完全吸附或氧化. Fe(Ⅱ)足量时,在反应后期Mn(Ⅱ)浓度平衡后,只有空气氛围下Fe(Ⅱ)才可进一步被溶解氧氧化. 因此本工作中没有单独区分吸附和溶解态Fe(Ⅱ),统一归为消耗的Fe(Ⅱ).
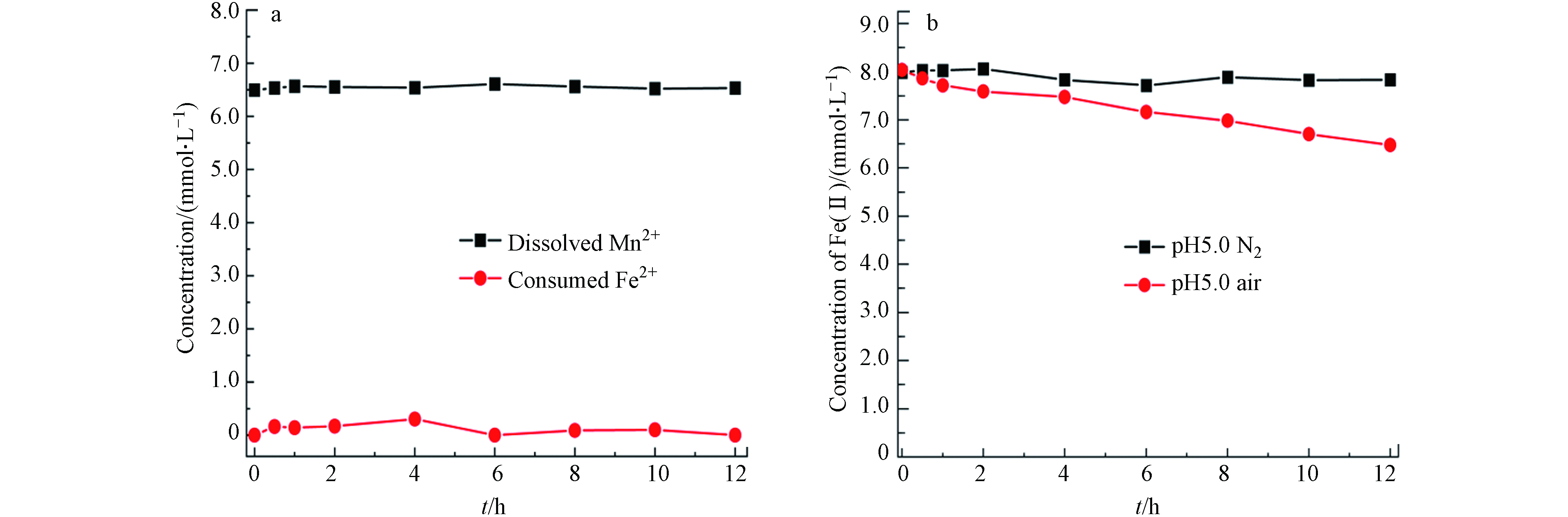
在pH 5.0的空气氛围下,8 mmol·L−1 Fe(Ⅱ)被空气氧化的速率极其缓慢,1 d内的氧化量几乎可忽略. 然而黑锰矿存在的反应体系中,反应前期黑锰矿快速Fe(Ⅱ)氧化,反应后期当体系中有溶解氧存在时,Fe(Ⅱ)才能被进一步缓慢氧化. 在Fe(Ⅱ)与黑锰矿反应后期,Fe(Ⅱ)的氧化产物主要为针铁矿及还原的Mn(Ⅱ). 而反应前期形成水铁矿由于结构不稳定被转化为针铁矿和纤铁矿,故水铁矿是针铁矿形成的前驱体. 为此进一步考察了体系中生成的主要固相产物针铁矿及黑锰矿被还原形成的Mn(Ⅱ)对Fe(Ⅱ)氧化过程的影响,图6a所示为Mn(Ⅱ)和Fe(Ⅱ)共存体系中不同时间段Fe(Ⅱ)和Mn(Ⅱ)浓度. 反应12 h后,Mn(Ⅱ)和Fe(Ⅱ)浓度均没有变化,也即Mn(Ⅱ)对Fe(Ⅱ)的氧化过程无明显影响. 在氮气氛围下,加入针铁矿后对Fe(Ⅱ)的氧化无影响(图6b). 而空气氛围下,随反应进行Fe(Ⅱ)浓度明显降低. 反应12 h后,Fe(Ⅱ)浓度由8.0 mmol·L−1降为6.2 mmol·L−1,这表明生成的针铁矿可在溶解氧作用下催化氧化Fe(Ⅱ),进而促进Fe(Ⅱ)进一步氧化.
-
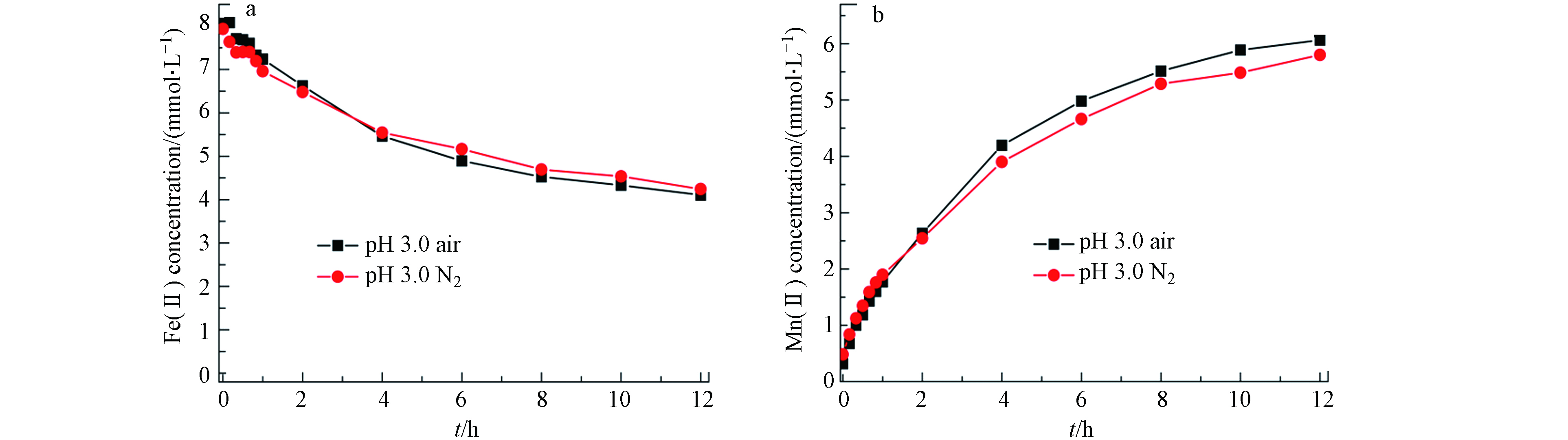
pH显著影响Fe2+的氧化[17]. 图7a—c为低pH(pH 3.0)环境下,0.5 g·L−1黑锰矿与不同浓度Fe(Ⅱ)在空气和氮气氛围下相互作用24 h后溶液中Mn(Ⅱ)、Fe(Ⅱ)浓度和空气与氮气消耗的Fe(Ⅱ)浓度差.
未加入Fe(Ⅱ)时,溶液中就有较高浓度的Mn(Ⅱ),表明黑锰矿发生了溶解. 随初始Fe(Ⅱ)浓度升高,体系中溶解释放的Mn(Ⅱ)浓度先逐渐增加后保持平衡. 且空气氛围下消耗的溶解态Fe(Ⅱ)量大于氮气氛围,即低pH环境溶解氧促进了Fe(Ⅱ)氧化.
图8为pH 3.0下,0.5 g·L−1黑锰矿与8.0 mmol·L−1 Fe(Ⅱ)体系中不同时间点溶解的Fe(Ⅱ)和Mn(Ⅱ)浓度. 随反应进行,溶解的Mn(Ⅱ)浓度逐渐升高且12 h仍未平衡,Fe(Ⅱ)浓度逐渐降低且空气和氮气氛围下Fe(Ⅱ)氧化速率基本一致. 这些结果表明低pH条件下,溶解氧并未影响黑锰矿氧化Fe(Ⅱ)速率,但促进了Fe(Ⅱ)被氧化的总量. 与pH 5.0相比,空气氛围pH 3.0体系消耗的溶解态Fe(Ⅱ)量更少,即pH升高有利于Fe(Ⅱ)氧化. 这与水钠锰矿氧化Fe(Ⅱ)的速率规律不同[29]. 水钠锰矿在pH 3.0和pH 5.0均较稳定,依据能斯特方程可知酸性条件下更有利于Fe(Ⅱ)氧化. 此外,在pH < 4.0时水钠锰矿氧化Fe(Ⅱ)速度快,反应几分钟内就有75%的Fe(Ⅱ)被氧化;当pH > 4.0时,Fe(Ⅱ)初始氧化速率较快. 随着反应的进行,水钠锰矿氧化Fe(Ⅱ)形成的FeOOH沉淀覆盖了锰氧八面体上的活性位点. 因此Fe(Ⅱ)的氧化速率表现出随pH升高而降系[17,30]. 而在黑锰矿与Fe(Ⅱ)反应体系中,pH 3.0时黑锰矿不稳定,易发生歧化反应,生成的产物氧化能力随之减弱. 此外随着反应进行,Fe(Ⅱ)被氧化后在黑锰矿表面形成了铁氧化物包覆层,抑制了Fe(Ⅱ)进一步氧化. 体系中溶解氧在反应后期参与了Fe(Ⅱ)氧化. pH可显著影响Fe(Ⅱ)的氧化速率,pH升高使得Fe(Ⅱ)水解加剧生成Fe(OH)+和Fe(OH)2等,它们与溶解氧反应活性要比游离态Fe(Ⅱ)高几个数量级[31-32]. 因此溶解氧存在时高pH下黑锰矿更能快速氧化Fe(Ⅱ). 另外,pH升高后黑锰矿表面负电荷增加,更多Fe(Ⅱ)吸附在黑锰矿表面,提升了氧化速率.
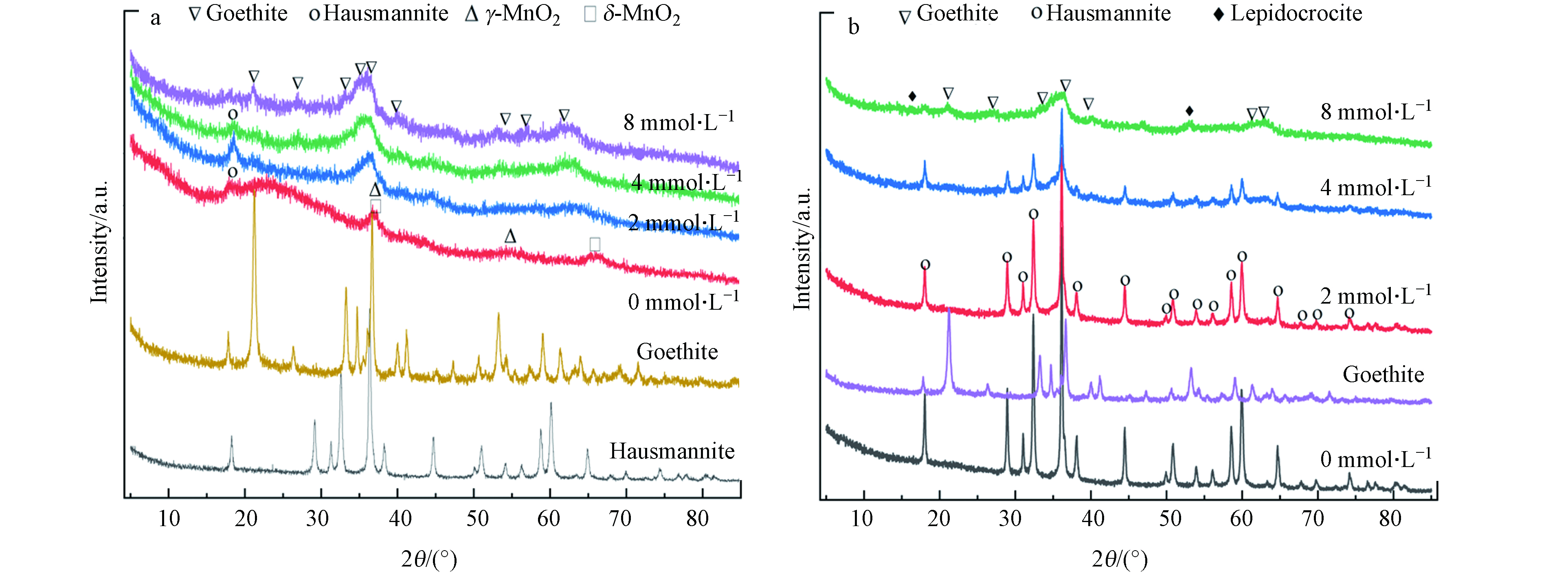
为明确pH对黑锰矿氧化Fe(Ⅱ)产物的影响,利用XRD表征空气氛围下0.5 g·L−1黑锰矿与不同初始浓度Fe(Ⅱ)在pH 3.0和5.0下反应24 h后的固相产物(图9).
先前研究表明在pH 3.0时,初始的黑锰矿会歧化成δ-MnO2,随后转化成γ-MnO2或是β-MnO2[33]. 且Fe(Ⅱ)浓度增加,黑锰矿(JCPDS No. 14-0644)的特征峰逐渐减弱,即使与8.0 mmol·L−1初始Fe(Ⅱ)反应,仍能观察到黑锰矿的晶体结构. Fe(Ⅱ)氧化生成的针铁矿的结晶度随初始Fe(Ⅱ)浓度逐渐增强(图9a). 当pH为5.0时,未加入Fe(Ⅱ)时黑锰矿晶体结构稳定. 随初始Fe(Ⅱ)浓度升高,黑锰矿的特征峰逐渐减弱. 黑锰矿与8.0 mmol·L−1 Fe(Ⅱ)反应的产物主要为针铁矿(α-FeOOH, JCPDS card No. 81-0464)和少量纤铁矿(γ-FeOOH, JCPDS card No. 74-1877)混合物.
-
环境中广泛存在高吸附和氧化活性的铁锰氧化物,它们影响着重金属和有机物的迁移转化[34-35]. 本研究结果也表明,在偏酸性环境Fe(Ⅱ)可被黑锰矿氧化,并在其表面形成包覆层抑制了Fe(Ⅱ)的进一步氧化,同时释放Mn(Ⅱ). 这可能会阻碍一些酸性矿山废水和海水孔隙水环境里有毒元素如Cd(Ⅱ)、Sb(Ⅲ)的吸附固定,增加它们的潜在环境风险[25,33]. 有研究发现β-MnO2氧化Fe(Ⅱ)的反应过程中,Fe(Ⅱ)多次加入后仍可被锰氧化物氧化,且形成的复合物具有较高的氧化活性[36]. 在我们的研究中也发现生成的铁氧化物包覆层具有催化效应,在溶解氧作用下可促进Fe(Ⅱ)的进一步氧化,这可能会影响环境中的一些变价有毒(类)重金属元素如Se(Ⅳ)、Cr(Ⅲ)、As(Ⅲ)及有机物的迁移和毒性[37]. 因此,明确环境中常见的黑锰矿与Fe(Ⅱ)的反应机理及影响因素有助于认识重金属元素和微量元素的循环过程.
-
(1)在偏酸性环境中Fe(Ⅱ)可被黑锰矿氧化,并在其表面形成了以针铁矿为主和少量纤铁矿组成的包覆层,阻碍了Fe(Ⅱ)的进一步氧化.
(2)形成的铁氧化物包覆层具有催化效应,可在溶解氧作用下催化氧化Fe(Ⅱ),促进Fe(Ⅱ)的进一步及铁氧化物生成.
(3)pH 影响Fe(Ⅱ)的氧化速率和产物,Fe(Ⅱ)的氧化速率随pH 升高而升高. 且低pH环境有利于针铁矿的形成.
黑锰矿催化氧化Fe(Ⅱ)生成铁氧化物过程及影响因素
Catalytic oxidation process of Fe(Ⅱ) to iron oxides by hausmannite in the presence of dissolved oxygen and its influence factors
-
摘要: 自然界中的锰氧化物常与铁氧化物交结伴生,其形成和转化过程相互影响. Mn(Ⅳ)氧化物与Fe(Ⅱ)反应过程已有较多研究,然而有氧环境中低价锰氧化物氧化Fe(Ⅱ)生成铁氧化物的过程尚缺乏系统研究. 本工作以黑锰矿为例,研究了开放体系中Fe(Ⅱ)在低价氧化锰矿物表面的氧化行为,分析了Fe(Ⅱ)浓度、溶解氧以及pH对Fe(Ⅲ)氧化物形成的影响. 结果表明,黑锰矿在氧化Fe(Ⅱ)形成针铁矿和纤铁矿的同时,自身被部分还原释放Mn(Ⅱ). 当反应体系pH值为3.0时,溶解氧氧化Fe(Ⅱ)作用弱,主要为黑锰矿氧化Fe(Ⅱ)并在其表面生成针铁矿. 当反应体系pH值升高至5.0,黑锰矿催化加速了溶解氧对低浓度(<5.0 mmol·L−1)Fe(Ⅱ)的氧化并生成水铁矿,随后转化成纤铁矿和针铁矿;Fe(Ⅱ)浓度升高(>5.0 mmol·L−1),反应初期Fe(Ⅱ)直接被黑锰矿氧化,形成了以针铁矿和少量纤铁矿组成的包覆层,并导致氧化速率减弱,而溶解氧在Fe(Ⅱ)后期氧化过程中发挥了主导作用. 这些结果丰富了表生环境铁锰氧化物的形成与共生机理,为土壤矿物形成演化提供了基础数据.Abstract: The formation and transformation processes of manganese oxides are usually associated with iron oxides in soils. The reaction of Fe (Ⅱ) with Mn(Ⅳ) oxides has attracted much attention. However, the oxidation process of dissolved Fe(Ⅱ) to iron oxides on the surface of low-valent manganese oxides still lacks systematic research in aerobic environments. In this work, the oxidation behavior of Fe(Ⅱ) on the surface of a representative low-valent manganese oxide mineral, hausmannite, was investigated in an open system, and the effects of Fe(Ⅱ) concentration, pH and dissolved oxygen on the oxidation processes and kinetics were also analyzed. The results showed that hausmannite was reduced to Mn(Ⅱ) and Fe(Ⅱ) was oxidized with the formation goethite and lepidocrocite. At pH 3.0, the oxidation of Fe(Ⅱ) was mainly mediated by hausmannite to form goethite, and the presence of dissolved oxygen had no significant effect on the increase of Fe(Ⅱ) oxidation rate. When pH was increased to 5.0, the catalytic oxidation of Fe(Ⅱ) of low-concentration (< 5.0 mmol·L−1) occurred by hausmannite in the presence of dissolved oxygen, and only ferrihydrite was formed as intermediate, which was subsequently transformed to goethite and lepidocrocite. When the concentration of Fe(Ⅱ) was increased to above 5.0 mmol·L−1, Fe(Ⅱ) was directly oxidized by hausmannite to generate a coating composed of goethite and a small amount of lepidocrocite at the initial stage, resulting in a decrease in the oxidation rate and then dissolved oxygen played a major role in the oxidation of Fe(Ⅱ) oxidation. These results have a better understanding about the formation and symbiosis mechanism of iron and manganese oxides in supergene environments, and provide the basis data on formation and evolution of soil minerals.
-
Key words:
- manganese oxide /
- iron oxide /
- Fe(Ⅱ) /
- catalytic oxidation /
- dissolved oxygen
-

-
图 1 pH 5.0体系,空气(a)和氮气(b)条件下,0.5 g·L−1黑锰矿与不同初始浓度Fe(Ⅱ)反应24 h后溶液中Fe(Ⅱ)、Mn(Ⅱ)、消耗的Fe(Ⅱ)及空气与氮气消耗的Fe(Ⅱ)浓度差(c)
Figure 1. Concentrations of dissolved Fe(Ⅱ), dissolved Mn(Ⅱ), consumed Fe(Ⅱ) in the systems of 0.5 g·L−1 hausmannite and Fe(Ⅱ) with different initial concentrations in air (a), N2 (b) and the consumtion difference of Fe(Ⅱ) (c) by air and N2 at pH 5.0 for 24 h
图 2 pH 5.0氮气和空气氛围下,0.5 g·L−1黑锰矿与8.0 mmol·L−1 Fe(Ⅱ)体系中不同时间溶解的Mn(Ⅱ) (a),Fe(Ⅱ) (b) 和8.0 mmol·L−1 Fe(Ⅱ)在不同pH,空气氛围下氧化12h后的Fe(Ⅱ) (c)浓度
Figure 2. Concentrations of dissolved Mn(Ⅱ) and Fe(Ⅱ) in the reaction system of 0.5 g·L−1 hausmannite and 8.0 mmol·L−1 Fe(Ⅱ) in air and nitrogen atmosphere at pH 5.0 (a, b) and Fe(Ⅱ) concentration in the reaction system of 8.0 mmol·L−1 Fe(Ⅱ) in air
图 4 用Combo法和线性拟合方法对0.5 g·L−1黑锰矿和8.0 mmol·L−1 Fe(Ⅱ)在pH 5.0的空气氛围下产物的Mn K边XANES谱图(a)和Fe K边 EXAFS 谱图(b)拟合(图4a中圆圈为实验谱,实线为拟合谱,下方实线为残差谱)
Figure 4. Normalized Mn K-edge XANES (a) and the linear combination fitting of Fe K-edge k3-weighted EXAFS (b) spectra of the solid products collected in the rection system of 0.5 g·L−1 hausmannite and 8.0 mmol·L−1 Fe(Ⅱ) in air at pH 5.0
图 6 pH 5.0空气氛围下,6.5 mmol·L−1 Mn(Ⅱ) 和8.0 mmol·L−1 Fe(Ⅱ)(a)和pH 5.0空气、氮气氛围下0.86 g·L−1 针铁矿和8.0 mmol·L−1 Fe(Ⅱ)(b)体系中不同时间点Mn(Ⅱ)和Fe(Ⅱ) 的浓度
Figure 6. Concentrations of dissolved Fe(Ⅱ) and Mn(Ⅱ) in the aqueous system of 6.5 mmol·L−1 Mn(Ⅱ) and 8.0 mmol·L−1 Fe(Ⅱ) (a) and the concentration of dissolved Fe(Ⅱ) in the system of 0.86 g·L−1 goethite and 8.0 mmol·L−1 Fe(Ⅱ) (b) at pH 5.0 in air
图 7 pH 3体系,空气(a)和氮气(b)条件下, 0.5 g·L−1黑锰矿与不同初始浓度Fe(Ⅱ)反应24 h后溶液中Fe(Ⅱ)、Mn(Ⅱ)消耗的Fe(Ⅱ)浓度及空气与氮气消耗的Fe(Ⅱ)浓度差(c)
Figure 7. Concentrations of dissolved Fe(Ⅱ), dissolved Mn(Ⅱ), consumed Fe(Ⅱ) in the systems of 0.5 g·L−1 hausmannite and Fe(Ⅱ) with different initial concentrations in air (a), N2(b) and the consumtion difference of Fe(Ⅱ) by air and N2 (c) at pH 3.0 for 24 h
表 1 pH 5.0空气氛围下,0.5 g·L−1黑锰矿和8.0 mmol·L−1 Fe(Ⅱ)反应产物的Mn(Ⅱ、Ⅲ、Ⅳ)的相对含量及平均锰氧化度
Table 1. Mn AOS and relative content of Mn(Ⅱ, Ⅲ, Ⅳ) of the solid products collected from the reaction of 0.5 g·L−1 hausmannite and 8.0 mmol·L−1 Fe(Ⅱ) for 0.5 and 6 h in air atmosphere at pH 5.0
反应时间/h
Reaction timeMn(Ⅱ) Mn(Ⅲ) Mn(Ⅳ) Mn AOS 0 0.20 0.73 0.07 2.87 0.5 0.17 0.75 0.08 2.91 6 0.30 0.69 0.01 2.71 -
[1] 童蕾, 曾梦玲, 李民敬, 等. 铁锰氧化物对地下水环境中金霉素的降解 [J]. 环境化学, 2016, 35(5): 917-924. doi: 10.7524/j.issn.0254-6108.2016.05.2015120102 TONG L, ZENG M L, LI M J, et al. Degradation of chlorotetracycline by iron and manganese oxides under simulated groundwater environment [J]. Environmental Chemistry, 2016, 35(5): 917-924(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.05.2015120102
[2] 胡敏, 李芳柏. 土壤微生物铁循环及其环境意义 [J]. 土壤学报, 2014, 51(4): 683-698. HU M, LI F B. Soil microbe mediated iron cycling and its environmental implication [J]. Acta Pedologica Sinica, 2014, 51(4): 683-698(in Chinese).
[3] 罗瑶, 李珊, 刘立虎, 等. 水锰矿与Fe2+的相互作用与转化过程 [J]. 岩石矿物学杂志, 2016, 35(4): 703-711. doi: 10.3969/j.issn.1000-6524.2016.04.010 LUO Y, LI S, LIU L H, et al. Interaction and transformation processes of manganite and Fe2+ [J]. Acta Petrologica et Mineralogica, 2016, 35(4): 703-711(in Chinese). doi: 10.3969/j.issn.1000-6524.2016.04.010
[4] LUO Y, LIU L H, QIAO W C, et al. Facile crystal-structure-controlled synthesis of iron oxides for adsorbents and anode materials of lithium batteries [J]. Materials Chemistry and Physics, 2016, 170: 239-245. doi: 10.1016/j.matchemphys.2015.12.044 [5] PEDERSEN H D, POSTMA D, JAKOBSEN R, et al. Fast transformation of iron oxyhydroxides by the catalytic action of aqueous Fe(II) [J]. Geochimica et Cosmochimica Acta, 2005, 69(16): 3967-3977. doi: 10.1016/j.gca.2005.03.016 [6] HOCHELLA M F J, LOWER S K, MAURICE P A, et al. Nanominerals, mineral nanoparticles, and Earth systems [J]. Science, 2008, 319(5870): 1631-1635. doi: 10.1126/science.1141134 [7] PALUMBO B, BELLANCA A, NERI R, et al. Trace metal partitioning in Fe-Mn nodules from Sicilian soils, Italy [J]. Chemical Geology, 2001, 173(4): 257-269. doi: 10.1016/S0009-2541(00)00284-9 [8] TEBO B M, BARGAR J R, CLEMENT B G, et al. BIOGENIC MANGANESE OXIDES: Properties and mechanisms of formation [J]. Annual Review of Earth and Planetary Sciences, 2004, 32: 287-328. doi: 10.1146/annurev.earth.32.101802.120213 [9] 鲁安怀, 卢晓英, 任子平, 等. 天然铁锰氧化物及氢氧化物环境矿物学研究 [J]. 地学前缘, 2000, 7(2): 473-483. doi: 10.3321/j.issn:1005-2321.2000.02.015 LU A H, LU X Y, REN Z P, et al. New advances in environmental mineralogy of natural oxides and hydroxides of iron and manganese [J]. Earth Science Frontiers, 2000, 7(2): 473-483(in Chinese). doi: 10.3321/j.issn:1005-2321.2000.02.015
[10] JUNTA J L, HOCHELLA M F. Manganese (II) oxidation at mineral surfaces: A microscopic and spectroscopic study [J]. Geochimica et Cosmochimica Acta, 1994, 58(22): 4985-4999. doi: 10.1016/0016-7037(94)90226-7 [11] GAO T Y, SHEN Y G, JIA Z H, et al. Interaction mechanisms and kinetics of ferrous ion and hexagonal birnessite in aqueous systems [J]. Geochemical Transactions, 2015, 16(1): 16. doi: 10.1186/s12932-015-0031-3 [12] KRISHNAMURTI G S R, HUANG P M. Influence of manganese oxide minerals on the formation of iron Oxides [J]. Clays and Clay Minerals, 1988, 36(5): 467-475. doi: 10.1346/CCMN.1988.0360513 [13] VILLINSKI J E, O'DAY P A, CORLEY T L, et al. In situ spectroscopic and solution analyses of the reductive dissolution of MnO2 by Fe(II) [J]. Environmental Science & Technology, 2001, 35(6): 1157-1163. [14] NESBITT H W, CANNING G W, BANCROFT G M. XPS study of reductive dissolution of 7Å-birnessite by H3AsO3, with constraints on reaction mechanism [J]. Geochimica et Cosmochimica Acta, 1998, 62(12): 2097-2110. doi: 10.1016/S0016-7037(98)00146-X [15] POSTMA D, APPELO C A J. Reduction of Mn-oxides by ferrous iron in a flow system: Column experiment and reactive transport modeling [J]. Geochimica et Cosmochimica Acta, 2000, 64(7): 1237-1247. doi: 10.1016/S0016-7037(99)00356-7 [16] SIEBECKER M, MADISON A S, LUTHER G W. Reduction kinetics of polymeric (soluble) manganese (IV) oxide (MnO2) by ferrous iron (Fe2+) [J]. Aquatic Geochemistry, 2015, 21(2/3/4): 143-158. [17] POSTMA D. Concentration of Mn and separation from Fe in sediments-I. Kinetics and stoichiometry of the reaction between birnessite and dissolved Fe(II) at 10 ℃ [J]. Geochimica et Cosmochimica Acta, 1985, 49(4): 1023-1033. doi: 10.1016/0016-7037(85)90316-3 [18] MYERS C R, NEALSON K H. Microbial reduction of manganese oxides: Interactions with iron and sulfur [J]. Geochimica et Cosmochimica Acta, 1988, 52(11): 2727-2732. doi: 10.1016/0016-7037(88)90041-5 [19] MCKENZIE R M. The synthesis of birnessite, cryptomelane, and some other oxides and hydroxides of manganese [J]. Mineralogical Magazine, 1971, 38(296): 493-502. doi: 10.1180/minmag.1971.038.296.12 [20] LUO Y, TAN W F, SUIB S L, et al. Dissolution and phase transformation processes of hausmannite in acidic aqueous systems under anoxic conditions [J]. Chemical Geology, 2018, 487: 54-62. doi: 10.1016/j.chemgeo.2018.04.016 [21] 罗瑶, 李珊, 谭文峰, 等. 水锰矿氧化水溶性硫化物过程及其影响因素 [J]. 环境科学, 2016, 37(4): 1539-1545. doi: 10.13227/j.hjkx.2016.04.045 LUO Y, LI S, TAN W F, et al. Oxidation process of dissolvable sulfide by manganite and its influencing factors [J]. Environmental Science, 2016, 37(4): 1539-1545(in Chinese). doi: 10.13227/j.hjkx.2016.04.045
[22] GAO T Y, SHI Y, LIU F, et al. Oxidation process of dissolvable sulfide by synthesized todorokite in aqueous systems [J]. Journal of Hazardous Materials, 2015, 290: 106-116. doi: 10.1016/j.jhazmat.2015.02.018 [23] KIRILLOV S A, ALEKSANDROVA V S, LISNYCHA T V, et al. Oxidation of synthetic hausmannite (Mn3O4) to manganite (MnOOH) [J]. Journal of Molecular Structure, 2009, 928(1/2/3): 89-94. [24] RAHIMI S, MOATTARI R M, RAJABI L, et al. Iron oxide/hydroxide (α, γ-FeOOH) nanoparticles as high potential adsorbents for lead removal from polluted aquatic media [J]. Journal of Industrial and Engineering Chemistry, 2015, 23: 33-43. doi: 10.1016/j.jiec.2014.07.039 [25] HAN X, LI Y L, GU J D. Oxidation of As(Ⅲ) by MnO2 in the absence and presence of Fe(Ⅱ) under acidic conditions [J]. Geochimica et Cosmochimica Acta, 2011, 75(2): 368-379. doi: 10.1016/j.gca.2010.10.010 [26] RICHMOND W R, LOAN M, MORTON J, et al. Arsenic removal from aqueous solution via ferrihydrite crystallization control [J]. Environmental Science & Technology, 2004, 38(8): 2368-2372. [27] CHIRIŢĂ P, DESCOSTES M, SCHLEGEL M L. Oxidation of FeS by oxygen-bearing acidic solutions [J]. Journal of Colloid and Interface Science, 2008, 321(1): 84-95. doi: 10.1016/j.jcis.2008.01.024 [28] REDDY T R, FRIERDICH A J, BEARD B L, et al. The effect of pH on stable iron isotope exchange and fractionation between aqueous Fe(Ⅱ) and goethite [J]. Chemical Geology, 2015, 397: 118-127. doi: 10.1016/j.chemgeo.2015.01.018 [29] 刘承帅, 李芳柏, 陈曼佳, 等. Fe(Ⅱ)催化水铁矿晶相转变过程中Pb的吸附与固定 [J]. 化学学报, 2017, 75(6): 621-628. doi: 10.6023/A17030093 LIU C S, LI F B, CHEN M J, et al. Adsorption and stabilization of lead during Fe(Ⅱ)-catalyzed phase transformation of ferrihydrite [J]. Acta Chimica Sinica, 2017, 75(6): 621-628(in Chinese). doi: 10.6023/A17030093
[30] SCHOTT J, BERNER R A. X-ray photoelectron studies of the mechanism of iron silicate dissolution during weathering [J]. Geochimica et Cosmochimica Acta, 1983, 47(12): 2233-2240. doi: 10.1016/0016-7037(83)90046-7 [31] ROSSO K M, MORGAN J J. Outer-sphere electron transfer kinetics of metal ion oxidation by molecular oxygen [J]. Geochimica et Cosmochimica Acta, 2002, 66(24): 4223-4233. doi: 10.1016/S0016-7037(02)01040-2 [32] KING D W. Role of carbonate speciation on the oxidation rate of Fe(II) in aquatic systems [J]. Environmental Science & Technology, 1998, 32(19): 2997-3003. [33] 李颖, 顾雪元. 土壤中锰氧化物的形态及其化学提取方法综述 [J]. 环境化学, 2022, 41(1): 9-21. doi: 10.7524/j.issn.0254-6108.2021061603 LI Y, GU X Y. Soil manganese oxides and its extraction methods: A review [J]. Environmental Chemistry, 2022, 41(1): 9-21(in Chinese). doi: 10.7524/j.issn.0254-6108.2021061603
[34] SUN Q, CUI P X, FAN T T, et al. Effects of Fe(Ⅱ) on Cd(Ⅱ) immobilization by Mn(Ⅲ)-rich δ-MnO2 [J]. Chemical Engineering Journal, 2018, 353: 167-175. doi: 10.1016/j.cej.2018.07.120 [35] 刘立虎, 樊萍, 孙学成, 等. 电化学驱动水钠锰矿高效吸附去除混合重金属离子 [J]. 环境化学, 2022, 41(2): 740-748. LIU L H, FAN P, SUN X C, et al. High-efficiency adsorption removal for multiple heavy metal ions using birnessite under electrochemical drive [J]. Environmental Chemistry, 2022, 41(2): 740-748(in Chinese).
[36] SCHAEFER M V, HANDLER R M, SCHERER M M. Fe(Ⅱ) reduction of pyrolusite (β-MnO2) and secondary mineral evolution [J]. Geochemical Transactions, 2017, 18: 7. doi: 10.1186/s12932-017-0045-0 [37] RADY O, LIU L H, YANG X, et al. Adsorption and catalytic oxidation of arsenite on Fe-Mn nodules in the presence of oxygen [J]. Chemosphere, 2020, 259: 127503. doi: 10.1016/j.chemosphere.2020.127503 -




 下载:
下载: