-
反渗透(reverse osmosis, RO)作为一种膜分离技术,已经广泛应用于海水淡化、废水处理和中水回用等领域[1-3]. 在RO工艺中,为防止微生物繁殖造成的膜堵塞,杀菌灭藻是不可缺少的预处理步骤[4-5]. 游离氯(HOCl/OCl−)凭借其低廉的成本和广谱的杀菌性成为RO工艺中最常用的消毒药剂[5]. 但是,由于RO膜容易与游离氯发生反应,造成膜结构的破坏,因此,需要在RO膜前加装去除游离氯的装置[6]. 目前,常见的去除游离氯的方法包括活性炭脱氯、还原剂中和以及紫外线脱氯等[7-8]. 其中,紫外线脱氯技术不会滋生微生物,无需外加药剂,同时还能强化消毒效果[9],已经开始在市场上应用[10].
溴离子在海水中的质量浓度高达65 mg·L−1(摩尔浓度为0.81 mmol·L−1),能够与游离氯(HOCl/OCl−)反应生成游离溴(HOBr/OBr−),反应如式(1)—式(2)所示[11-12]. 因此,当RO工艺应用于海水淡化时,脱氯工艺中所需要脱除的氧化性物质为游离溴. Shemer等[12]研究表明,无论是游离氯还是游离溴都会对RO膜的结构产生破坏作用. 游离氯和游离溴在紫外照射下均可以发生分解(式(3)—式(4))[13]. 已有研究表明[11,13],游离氯和游离溴的摩尔吸光系数、量子产率以及光解的自由基反应过程均不相同. 这说明紫外照射下游离氯和游离溴的分解规律可能不同.
近年来,游离氯在紫外照射下的分解规律得到了较为广泛的研究. 田芳等[14]研究了中压紫外照射下游离氯的分解规律,发现游离氯分解速率受到pH、腐殖酸等水质因素的影响,但水中常见的低浓度无机阴离子对游离氯分解的影响不大. Yin等[15]利用LED光源研究了不同波长的紫外线照射对游离氯分解的影响,发现紫外波长和pH对游离氯的分解速率具有重要作用,建立了游离氯分解速率与波长和pH的三维模型. Feng等[16]发现低压紫外灯照射下,游离氯初始浓度和水中pH对游离氯的分解影响不大. 然而,游离溴在紫外照射下分解规律的研究相对较少. Guo等[11]研究发现,在低压紫外照射下,游离溴的初始浓度(20—200 μmol·L−1)对游离溴的分解影响很小. 海水基质成分复杂,无机离子和有机物的存在可能会影响游离氯和游离溴的分解速率,进而影响RO工艺中紫外线去除游离氯和游离溴的效果,但目前针对这一问题尚缺乏深入研究.
低压紫外灯是一种主要发射254 nm短波紫外线的单色光源,凭借其较高的能源转换率和强力的杀菌能力,已经在水处理领域广泛应用[17],对于游离氯和游离溴也具有分解效果[11]. Sperle等[18]研究还发现短波紫外对RO膜生物堵塞的处理也具有重要意义. 因此,本研究通过测定游离氯和游离溴在低压紫外灯照射下的浓度变化,研究了水中pH、阴离子和腐殖酸对游离氯和游离溴分解的影响,且分析了其中可能存在的原因,本研究可为紫外线去除游离氯和游离溴工艺的优化提供数据参考.
-
次氯酸钠溶液、溴化钾、氯化钠、硝酸钾、硫酸钠、碳酸氢钠、氟化钠、磷酸二氢钠、磷酸氢二钠、硼酸和四硼酸钠,均为分析纯,购自国药集团化学试剂有限公司. N,N-二乙基-1,4-苯二胺硫酸盐,为分析纯,购自上海麦克林生化科技有限公司. 腐殖酸,有效含量大于82%,购自天津光复精细化工研究所. 实验中溶液均为超纯水(18.2 MΩ·cm)配置.
实际海水取自青岛近海海域,经0.45 μm滤膜过滤后使用,其基本理化指标如下:盐度为29.7‰,pH为8.02,DOC为1.92 mg·L−1. 人造海水的配置主要参考Mocledon海水配方[19],盐度为33‰,pH为8.01,内含氯离子(530 mmol·L−1)、溴离子(0.8 mmol·L−1)、硫酸根(27 mmol·L−1)、碳酸氢根(2.4 mmol·L−1)、硼酸盐(0.95 mmol·L−1)、磷酸盐(30 μmol·L−1)、硝酸根(30 μmol·L−1)和氟离子(50 μmol·L−1)等无机离子.
-
游离氯和游离溴的光照实验在定制的低压紫外平行光束仪(NLC-PXGY-40W,福建新大陆环保科技有限公司)中进行,反应器为石英玻璃皿(直径d=10 cm,高度h=4 cm),放置于光束仪下方的磁力搅拌器上,实验时可以通过调节搅拌器下方的升降台高度实现反应器内光强的变化. 实验开始前对平行光束仪预热至少15 min,待光强稳定后进行实验. 由于游离氯和游离溴的初始浓度对其在低压紫外照射下的分解速率影响不大[11,16],因此将游离氯和游离溴的初始浓度固定为10 mg·L−1(约140 μmol·L−1),同时将反应器内反应液体积设定为200 mL. 进行实验时,每隔一定时间取样,测定游离氯或游离溴的浓度.
在反应器内加入190 mL的5 mmol·L−1磷酸盐缓冲液(pH=6或8)或硼酸盐缓冲液(pH=10),再加入一定体积的KBr溶液(反应液Br−终浓度为65 mg·L−1)或纯水,之后加入次氯酸钠溶液,搅拌混匀10 min,使之充分反应后进行实验,研究不同pH对游离氯和游离溴分解的影响.
在反应器内加入190 mL的5 mmol·L−1磷酸盐缓冲液(pH=8),再加入一定体积的KBr溶液(反应液Br−终浓度为65 mg·L−1)或纯水,加入次氯酸钠溶液,搅拌混匀10 min,再加入一定浓度的阴离子或腐殖酸溶液,之后进行实验,研究阴离子和腐殖酸对游离氯和游离溴分解的影响.
在反应器内加入一定体积的实际海水或人造海水,再加入次氯酸钠溶液,搅拌混匀10 min,之后进行实验,研究实际海水和人造海水对游离氯和游离溴分解的影响.
-
紫外光强用LS125紫外辐照计(深圳林上科技有限公司)测定,实验中光强稳定在约0.9 mW·cm−2;pH用雷磁PHS-3C型pH计(上海仪电科学仪器股份有限公司)测定;盐度使用AZ8371型盐度计(中国台湾衡欣科技股份有限公司)测定;摩尔吸光系数、游离氯和游离溴浓度利用752N紫外可见分光光度计(上海仪电分析仪器有限公司)测定;DOC用TOC-V总有机碳分析仪(日本岛津公司)测定. 游离氯和游离溴浓度参照DPD分光光度法(HJ 586—2010)测定,以Cl2(mg·L−1)计.
-
利用一级动力学方程(式(5))拟合游离氯或游离溴的分解速率.
式中,C0和Ct分别为游离氯或游离溴的初始浓度和经过t时间后的质量浓度,mg·L−1;Kobs为表观一级反应速率常数,cm2·mJ−1;Q为紫外剂量,mJ·cm−2.
如果假设体系中某化合物W为唯一的吸光物质,那么其在254 nm处的光解速率可以由式(6)描述[20].
式中,Φ为化合物W的量子产率,mol·Einstein−1;I0为光强度,mEinstein·(cm2·s)−1;ε为化合物W在254 nm处的摩尔吸光系数,L·(mol·cm)−1;l为光路长度,cm;z为溶液深度,cm;Cw为化合物W的摩尔浓度,mol·L−1. 本研究中I0为0.191×10−5 mEinstein·(cm2·s)−1,同时由于使用了平行光束仪(l=z),且实验中εCwl较小,根据泰勒一阶展开式,式(6)可近似为式(7),再经过简单变换即式(8)—式(9). 因此,游离氯或游离溴的直接光解速率常数Kact可以通过式(8)计算;表观量子产率Φobs可以通过式(9)计算.
-
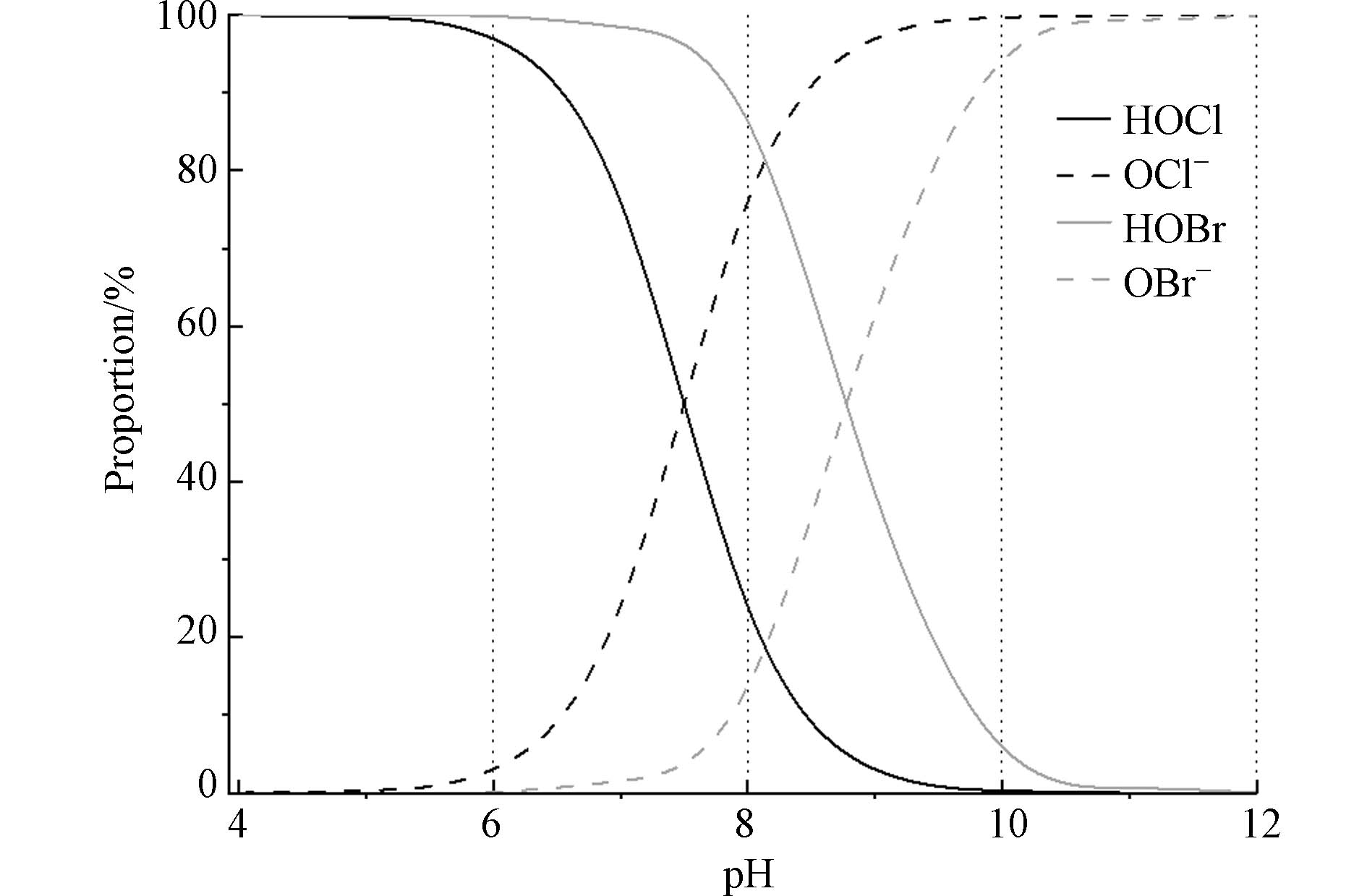
海水的典型pH一般在8.0左右,呈弱碱性. 在常规水处理的pH范围内,游离氯和游离溴主要是以HOX和OX−的形态存在(X=Cl, Br),其比例与pH的具体大小密切相关[16,21](图1). 在pH为6时,游离氯(pKa=7.5)中HOCl占比为96.9%,游离溴(pKa=8.8)中HOBr占比为99.8%. 在pH为8时,游离氯中OCl−占主要部分,占比76.0%;游离溴中HOBr占主要部分,占比86.3%. 在pH为10时,游离氯和游离溴中分别以OCl−和OBr−为主,占比分别为99.7%和94.1%.
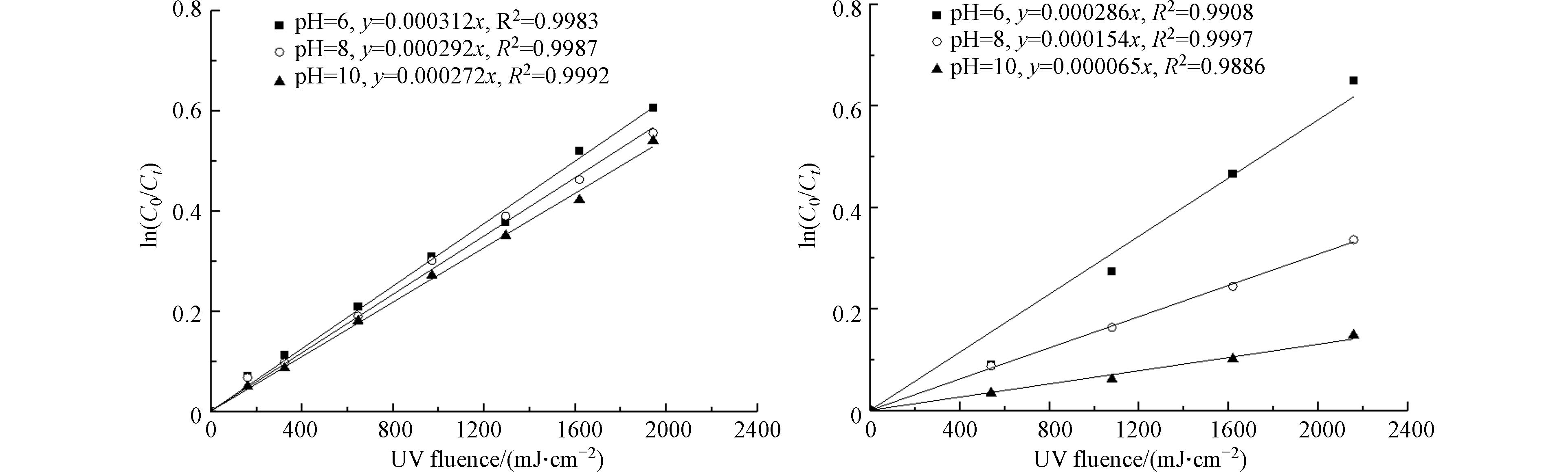
pH的变化引起物质存在形态的变化,进而可能会影响物质分解速率的变化. 因此,考察了游离氯、游离溴在初始质量浓度为10 mg·L−1、不同pH条件下游离氯和游离溴的分解速率,结果如图2所示.
由图2(a)可以看出,在低压紫外的照射下,游离氯的分解速率常数随pH下降略有上升. 当pH为10时,游离氯分解的表观一级反应速率常数Kobs为0.000272 cm2·mJ−1;当pH为6时,游离氯分解的Kobs为0.000312 cm2·mJ−1,上升了14.7%. 这表明在254 nm的紫外波长下,低pH下以HOCl为主要存在形态的游离氯相对容易分解. 由图2(b)可以看出,游离溴的分解速率随pH的下降明显上升. 当pH为10时,游离溴分解的Kobs为0.000065 cm2·mJ−1;当pH为6时,游离氯分解的Kobs为0.000286 cm2·mJ−1,上升了3.4倍. 这表明游离溴的分解速率更容易受到pH变化的影响,且低pH下以HOBr为主要存在形态的游离溴分解速率更快. 这主要是由于不同形态的游离氯和游离溴的摩尔吸光系数和量子产率以及自由基反应过程的不同[11]. 游离氯和游离溴分解的表观一级反应速率常数Kobs是由直接光解速率常数(Kact)和自由基反应速率常数(Kradical)决定的. 其中自由基反应速率常数(Kradical)是由自由基引起的间接光解速率常数(Krad-indirect)和再生成速率常数(Krad-reformation)决定的(式(10))[20].
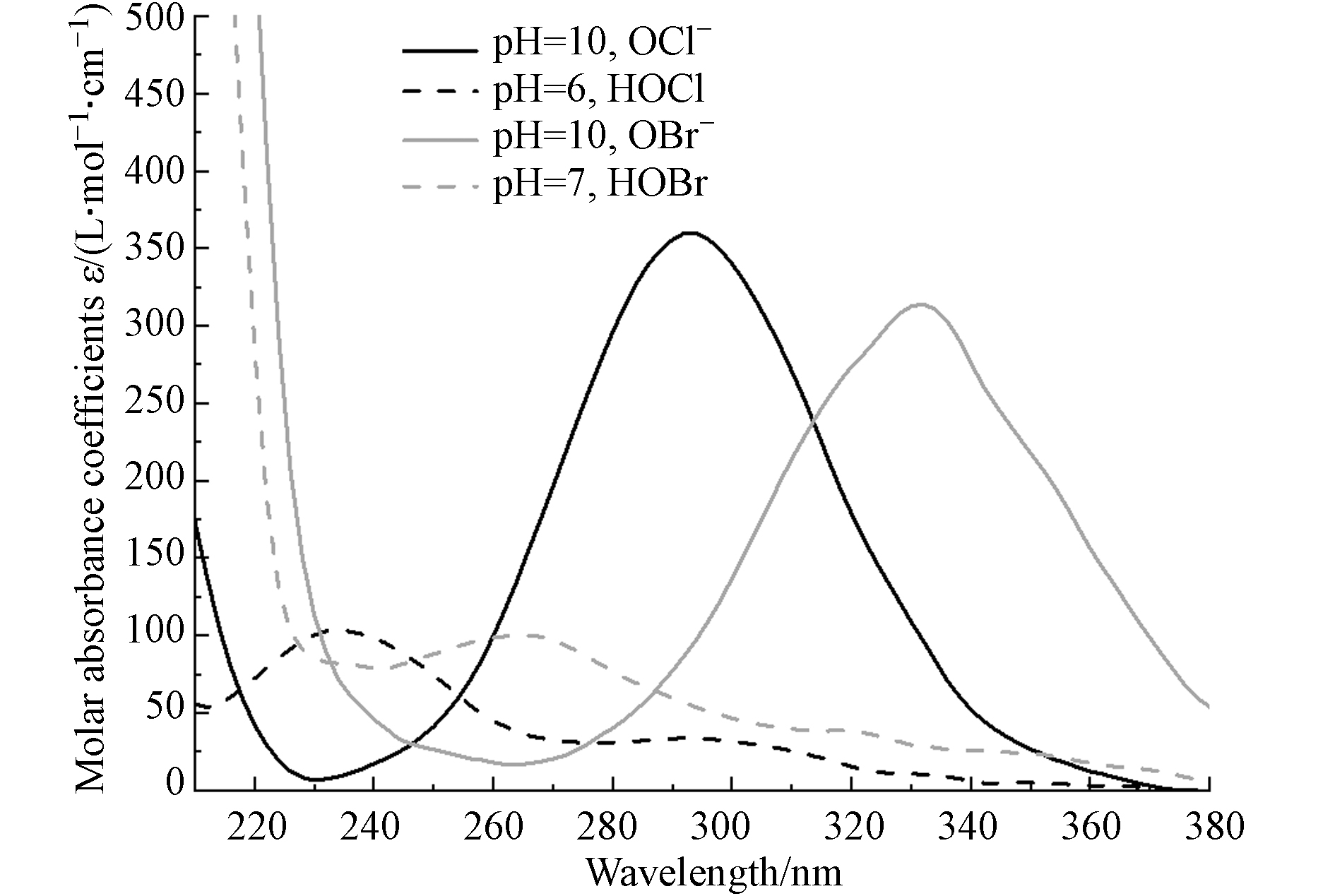
为了进一步验证机理,本研究测定了HOCl、OCl−、HOBr和OBr−的摩尔吸光系数(图3),并利用实验所获得的Kobs和式(9)计算相应物质的表观量子产率(Φobs),利用已有研究所报道的实际量子产率(Φact),通过计算Φact/Φobs获得物质直接光解的比例. 由表1可见,HOCl、OCl−、HOBr和OBr−直接光解分别占比54.4%、54.5%、60.6%和45.6%. 这表明无论是游离氯还是游离溴,直接光解和自由基反应对其分解的影响均不可忽视.
此外,从HOCl到OCl−转变的分解速率变化来看,Kobs下降了0.000040 cm2·mJ−1,而Kact仅下降了0.000022 cm2·mJ−1,说明pH变化不仅仅影响游离氯直接光解(55%)还影响自由基反应(45%). 类似地,从HOBr转变为OBr−,Kobs下降了0.000221 cm2·mJ−1,而Kact下降了0.000144 cm2·mJ−1,也说明了pH通过影响游离溴的直接光解(65.2%)和自由基反应(34.8%)来影响分解速率.
-
地表水,尤其是海水中,存在着各种无机阴离子. 海水中常见的无机阴离子有氯离子、硫酸根、碳酸氢根、硝酸盐、磷酸盐、硼酸盐(以H3BO3的形式存在)和氟离子等. 但这些无机阴离子在紫外照射下对游离氯,尤其是对游离溴的分解速率的影响仍不清晰. 本研究为模拟海水中无机阴离子的影响,除设置氯离子质量浓度为2 g·L−1(56 mmol·L−1)和20 g·L−1(560 mmol·L−1)外,其余离子设置为5 mmol·L−1或50 mmol·L−1进行实验. 由于海水的典型pH在8.0左右,因此实验中pH保持为8.0.
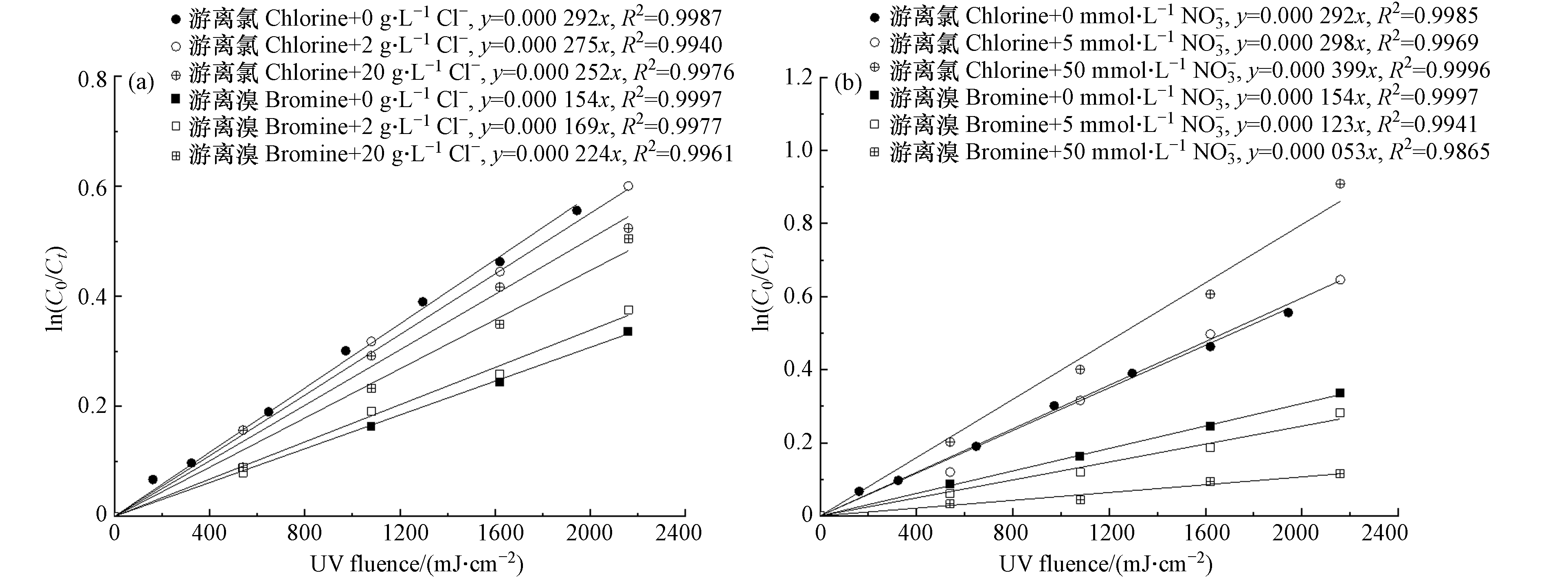
由图4(a)可见,在pH 8时,游离氯在低压紫外照射下的分解速率随着Cl−浓度的增加而降低,与空白对照相比,20 g·L−1 Cl−导致游离氯分解速率降低13.7%. 这可能是Cl−与含氯自由基(Cl·、Cl2−·、ClO·等)和羟基自由基(HO·)反应导致的[20]. 一方面,Cl−的存在能够与游离氯直接光解产生的Cl·反应生成Cl2−·(式(11)),从而减弱了Cl·与游离氯的间接光解反应(式(12)—式(13)),导致分解速率下降;另一方面,高浓度的Cl−对体系内HO·的清除反应(式(14))则抑制了HO·与游离氯的间接光解反应(式(15)—式(16)),也会导致分解速率的下降. 但是Cl−与HO·发生的主要反应(式(14)) 是可逆反应,刘宇程等[22]的理论计算研究表明,当Cl−的浓度大于50 g·L−1时,其正反应(kf)占优势而逆反应(kr)较弱. 由于海水中的Cl−浓度约为20 g·L−1,因此在该浓度条件下,Cl−不能够起到清除HO·的作用.
由图4(b)可见,与Cl−的影响规律相反,游离氯在紫外照射下的分解速率随着
${\rm{NO}}_3^{-} $ 浓度的增加而上升,5 mmol·L−1${\rm{NO}}_3^{-} $ 影响不大,但50 mmol·L−1${\rm{NO}}_3^{-} $ 能够导致游离氯分解速率上升36.6%. 这可能与${\rm{NO}}_3^{-} $ 光解产生的HO·有关(式(17)—式(18)) [11,23]. HO·的增加能够促进游离氯的间接光解过程(式(15)—式(16)),从而导致游离氯的分解速率上升. 此外,${\rm{NO}}_3^{-} $ 在254 nm处有一定的紫外吸收,起到紫外滤层的作用,能够降低直接光解速率[23]. 这是${\rm{NO}}_3^{-} $ 在低浓度时对游离氯分解速率影响不大的可能原因之一.由图4(a)可见,在pH为8时,游离溴的分解速率随着Cl−浓度的增加而上升,20 g·L−1 Cl−导致游离溴分解速率上升45.4%. 这与体系内含溴自由基(Br·、
${\rm{Br}} \cdot _2^- $ 、BrO·等)的生成有关. 由于体系中Br−的摩尔浓度高于游离溴的浓度(约4.7倍),同时Br−与Br·和HO·的反应速率常数(式(19)—式(20))均明显高于游离溴与Br·和HO·的反应速率常数(式(21)—式(22)),所以推测空白体系中的Br·和HO·大多通过式(19)、式(20)和式(23)反应生成了${\rm{Br}} \cdot _2^- $ ,再通过式(24)进行游离溴的再生成反应[11,24]. 当过量的Cl−添加到体系中,其摩尔浓度远高于Br−(70倍和700倍),能够大大促进式(25)的进行,与式(19)竞争Br·抑制${\rm{Br}} \cdot _2^- $ 的生成,而且生成的BrCl·−还能够与HO·反应(式(26)),抑制了游离溴的再生成反应(式(24))[11],从而导致了游离溴的分解速率上升.由图4(b)可见,游离溴的分解速率随着NO3−浓度的增加而下降,50 mmol·L−1
${\rm{NO}}_3^{-} $ 能够导致游离溴的分解速率下降65.6%. 除了${\rm{NO}}_3^{-} $ 对紫外光的吸收导致的直接光解速率降低以外,${\rm{NO}}_3^{-} $ 光解产生的HO·对于抑制游离溴的分解可能也具有重要影响. 在体系中加入${\rm{NO}}_3^{-} $ ,HO·增加,同时体系内过量的Br−保证了${\rm{Br}} \cdot _2^- $ 的大量生成(式(19))[24],从而促进了再生成过程(式(24)),分解速率降低.由图5可见,在pH为8的条件下,水中常见的其他阴离子(
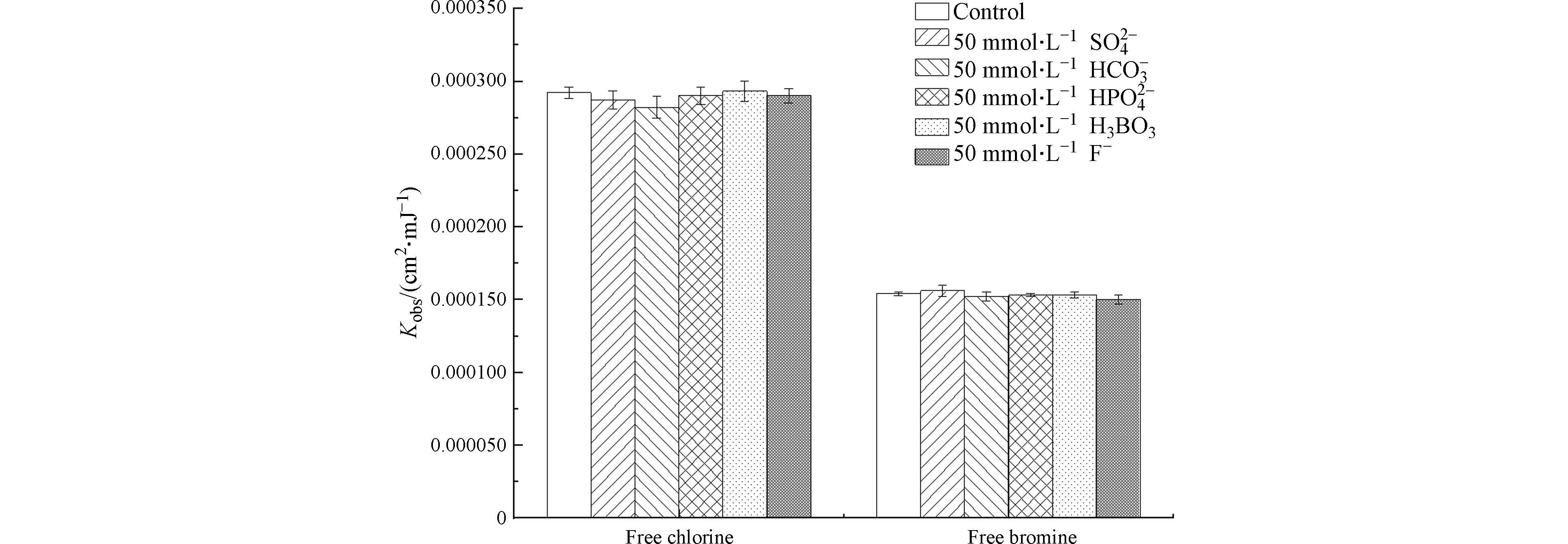
${\rm{SO}}_4^{2-} $ 、${\rm{HCO}}_3^{-} $ 、${\rm{HPO}}_4^{2-} $ 和F−)以及H3BO3,对游离氯和游离溴在紫外照射下的分解速率基本无影响. -
腐殖酸是一种在天然水体中广泛存在的有机物[25],常作为水体环境中有机组分的代表物,其对紫外照射下游离氯分解的影响已经引起了诸多关注. 田芳等[14]研究了在中压紫外照射下腐殖酸对游离氯分解的影响,发现腐殖酸浓度与游离氯的分解速率常数呈线性关系,随腐殖酸浓度的升高其分解速率上升. 但是,在低压紫外照射下,腐殖酸对游离氯分解的影响尚存争议. 一方面,腐殖酸可以作为紫外滤层吸收紫外光而抑制游离氯的分解;另一方面,腐殖酸可以与游离氯反应加速其分解[26]. 同时,腐殖酸对游离溴分解的影响的研究较为缺乏. 因此,本研究以0—4.28 mg·L−1的腐殖酸(以DOC计)作为影响因素研究紫外照射下游离氯和游离溴的分解规律,以进一步明确腐殖酸对游离氯和游离溴分解的影响.
由图6(a)可见,随着腐殖酸浓度的升高,游离氯的分解速率先下降再上升,当腐殖酸浓度为0.11 mg·L−1时,游离氯的分解的Kobs为0.000250 cm2·mJ−1,与空白组相比降低了14.3%;当腐殖酸浓度为4.28 mg·L−1时,分解的Kobs达到0.000336 cm2·mJ−1,与空白组相比升高了15.1%. 由图6(b)可见,游离溴的分解速率常数随腐殖酸浓度的升高先短暂下降后迅速上升. 当腐殖酸浓度为0.11 mg·L−1时,游离溴的分解的Kobs为0.000128 cm2·mJ−1,与空白组相比降低了16.9%;当腐殖酸浓度为4.28 mg·L−1时,其分解的Kobs达到0.000525 cm2·mJ−1,是空白组的3.4倍.
由此可见,腐殖酸在低浓度时可能是以紫外滤层吸收紫外光占据主导地位,随着浓度的升高,腐殖酸作为反应物起到主要作用. 以威海乳山湾近海海域为例[27],该海域海水的DOC含量范围为0.70—3.19 mg·L−1,所以可以推测海水中的有机物主要是起到促进分解的作用.
此外,腐殖酸对游离溴分解的促进作用明显大于游离氯. 造成这种结果的可能原因是腐殖酸与游离溴更容易反应,从而促进了它的分解. 已有研究表明[28-29],相比于游离氯,某些具有特殊结构的有机物更容易被游离溴氧化,如酚类、胺类、含硫类化合物等. 其中,酚羟基是腐殖酸中普遍具有的重要官能团[30]. 为了证明这一假设,在pH为8的条件下,研究了无紫外照射下的游离氯和游离溴与腐殖酸的反应,发现游离溴与腐殖酸的反应速率明显高于游离氯与腐殖酸的反应(图7). 这说明,腐殖酸与游离溴更容易反应是腐殖酸对游离溴分解的促进作用较大的重要原因.
-
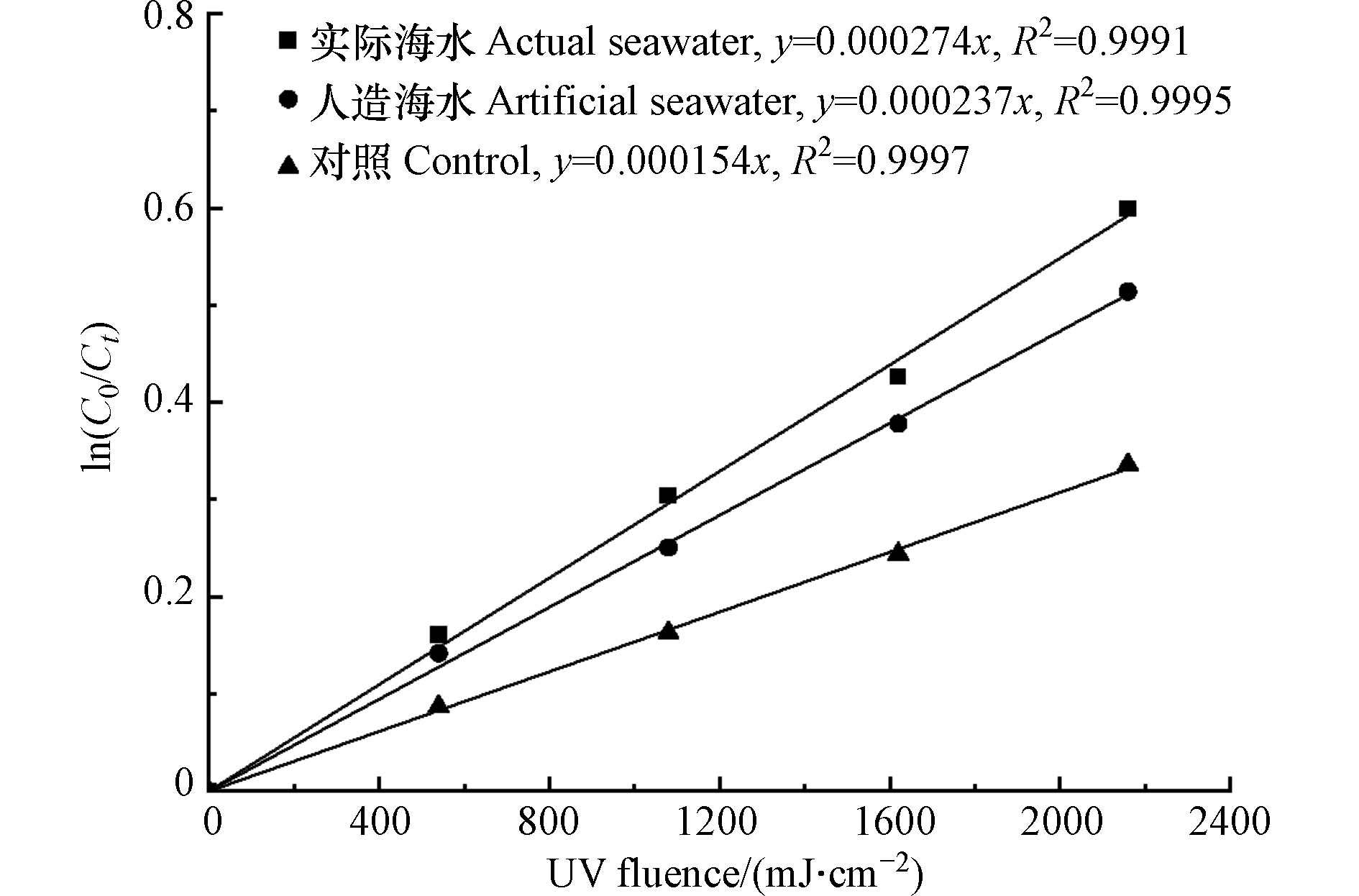
实际海水中同时存在上述研究中所涉及的各类无机阴离子和有机物,能够从多个方面影响游离氯和游离溴的分解速率. 由于海水淡化的RO系统中游离氯的摩尔浓度低于海水中溴离子的摩尔浓度[31],此时系统中的游离氯能够被溴离子完全转化为游离溴. 因此,本研究设置游离溴浓度为10 mg·L−1,以实际海水和人造海水为反应液,研究低压紫外照射工艺在海水中的应用效果,为工艺的实际应用提供参考.
由图8可见,人造海水中游离溴的分解的Kobs为0.000237 cm2·mJ−1,与空白相比升高了53.9%,与添加20 g·L−1 Cl−的游离溴的分解速率差别不大(图4(a)).
这表明海水无机阴离子中Cl−对游离溴的分解起着重要的促进作用. 实际海水中游离溴的分解的Kobs为0.000274 cm2·mJ−1,与人造海水相比升高了15.6%. 这可能是由于海水中的有机物对游离溴分解起到了促进作用. Cho等[31]的研究表明,在低压紫外照射下,实际海水(DOC为2.2 mg·L−1)中游离氯(溴)的分解速率是人造海水的1.6倍. 虽然研究结果有一定的差异,但以上结果均证明在实际海水中,有机物对于游离溴在低压紫外光照射下的分解能够起到一定的促进作用. 这与腐殖酸影响实验中所得的结果基本相符.
-
(1)在低压紫外照射下,随着pH降低,游离氯和游离溴的分解速率升高,其中pH降低对游离溴分解速率促进作用更大. pH通过影响直接光解和自由基反应过程影响游离氯和游离溴的分解速率. 对于海水淡化来说,通过适当降低RO工艺的进水pH,可以提高紫外线去除游离溴的效率.
(2)高浓度Cl−能够抑制游离氯的分解而促进游离溴的分解,高浓度
${\rm{NO}}_3^{-} $ 可促进游离氯的分解而抑制游离溴的分解. 其他阴离子(${\rm{SO}}_4^{2-} $ 、${\rm{HCO}}_3^- $ 、${\rm{HPO}}_4^{2-} $ 和F−)以及H3BO3对游离氯和游离溴分解的影响不大.(3)低浓度腐殖酸可抑制游离溴和游离氯的分解,高浓度腐殖酸则会促进其分解,且对游离溴分解的促进程度强于游离氯.
(4)在实际海水中,一定浓度的Cl−和有机物的存在能够促进游离溴在紫外照射下的分解.
海水基质成分对紫外线去除游离氯和游离溴的影响
Effect of water matrix components in seawater on ultraviolet removal of free chlorine and free bromine
-
摘要: 紫外线照射可以去除反渗透工艺中的游离氯和游离溴,但是海水基质成分对于去除效果的影响尚不清晰. 为解决上述问题,在低压紫外照射下测定了游离氯和游离溴的浓度变化,计算了分解速率常数,分析了水中pH、无机阴离子和腐殖酸对其分解速率的影响. 结果表明,随着pH的降低,游离氯和游离溴的分解速率均升高,且pH对游离溴分解速率的影响更大;无机阴离子中Cl−能够抑制游离氯的分解而促进游离溴的分解,
${\rm{NO}}_3^{-} $ 能够促进游离氯的分解而抑制游离溴的分解;水中腐殖酸在低浓度时抑制游离氯和游离溴的分解,在高浓度时促进分解,对游离溴的促进作用更强. 研究结果可以为反渗透系统中紫外线去除游离氯和游离溴的工艺优化提供数据参考.Abstract: Ultraviolet irradiation is capable of removing free chlorine and free bromine in reverse osmosis process, but the effect of seawater matrix components on the removal is still unclear. In this study, the concentration changes of free chlorine and free bromine under low-pressure UV irradiation were monitored and the decomposition rate constants were calculated. The effects of pH, inorganic anions and humic acid on the decomposition rate were investigated. The results showed that the decomposition rates of free chlorine and free bromine increased with the decrease of pH, and pH posed a greater effect on the decomposition rates of free bromine. Chloride ion inhibited the decomposition of free chlorine while enhanced the decomposition of free bromine. However, nitrate improved the decomposition of free chlorine while suppressed the decomposition of free bromine. Low concentration of humic acid presented inhibition on the decomposition of free chlorine and free bromine, while high concentration of humic acid stimulated their decomposition, especially free bromine. This study provided data support for the design of ultraviolet process for the removal of free chlorine and free bromine in reverse osmosis system.-
Key words:
- seawater /
- low pressure ultraviolet /
- free chlorine /
- free bromine /
- reverse osmosis
-
反渗透(reverse osmosis, RO)作为一种膜分离技术,已经广泛应用于海水淡化、废水处理和中水回用等领域[1-3]. 在RO工艺中,为防止微生物繁殖造成的膜堵塞,杀菌灭藻是不可缺少的预处理步骤[4-5]. 游离氯(HOCl/OCl−)凭借其低廉的成本和广谱的杀菌性成为RO工艺中最常用的消毒药剂[5]. 但是,由于RO膜容易与游离氯发生反应,造成膜结构的破坏,因此,需要在RO膜前加装去除游离氯的装置[6]. 目前,常见的去除游离氯的方法包括活性炭脱氯、还原剂中和以及紫外线脱氯等[7-8]. 其中,紫外线脱氯技术不会滋生微生物,无需外加药剂,同时还能强化消毒效果[9],已经开始在市场上应用[10].
溴离子在海水中的质量浓度高达65 mg·L−1(摩尔浓度为0.81 mmol·L−1),能够与游离氯(HOCl/OCl−)反应生成游离溴(HOBr/OBr−),反应如式(1)—式(2)所示[11-12]. 因此,当RO工艺应用于海水淡化时,脱氯工艺中所需要脱除的氧化性物质为游离溴. Shemer等[12]研究表明,无论是游离氯还是游离溴都会对RO膜的结构产生破坏作用. 游离氯和游离溴在紫外照射下均可以发生分解(式(3)—式(4))[13]. 已有研究表明[11,13],游离氯和游离溴的摩尔吸光系数、量子产率以及光解的自由基反应过程均不相同. 这说明紫外照射下游离氯和游离溴的分解规律可能不同.
$ {\mathrm{O}\mathrm{C}\mathrm{l}}^-+{\mathrm{B}\mathrm{r}}^-\to {\mathrm{O}\mathrm{B}\mathrm{r}}^-+{\mathrm{C}\mathrm{l}}^- \quad k=9.0\times 10^{-4}\; {\rm{L}}\cdot({\rm{mol}}\cdot{\rm{s}})^{-1} $ $ (1) $ $ \mathrm{H}\mathrm{O}\mathrm{C}\mathrm{l}+{\mathrm{B}\mathrm{r}}^-\to \mathrm{H}\mathrm{O}\mathrm{B}\mathrm{r}+{\mathrm{C}\mathrm{l}}^- \quad k=6.8\times 10^{3}\; {\rm{L}}\cdot({\rm{mol}}\cdot{\rm{s}})^{-1} $ $ (2) $ $ \mathrm{H}\mathrm{O}\mathrm{C}\mathrm{l}/{\mathrm{O}\mathrm{C}\mathrm{l}}^-+hv\to \mathrm{H}\mathrm{O}\cdot /{\mathrm{O}}^-\cdot+\mathrm{C}\mathrm{l}\cdot $ $ (3) $ $ \mathrm{H}\mathrm{O}\mathrm{B}\mathrm{r}/{\mathrm{O}\mathrm{B}\mathrm{r}}^-+hv\to \mathrm{H}\mathrm{O}\cdot /{\mathrm{O}}^-\cdot +\mathrm{B}\mathrm{r}\cdot $ $ (4) $ 近年来,游离氯在紫外照射下的分解规律得到了较为广泛的研究. 田芳等[14]研究了中压紫外照射下游离氯的分解规律,发现游离氯分解速率受到pH、腐殖酸等水质因素的影响,但水中常见的低浓度无机阴离子对游离氯分解的影响不大. Yin等[15]利用LED光源研究了不同波长的紫外线照射对游离氯分解的影响,发现紫外波长和pH对游离氯的分解速率具有重要作用,建立了游离氯分解速率与波长和pH的三维模型. Feng等[16]发现低压紫外灯照射下,游离氯初始浓度和水中pH对游离氯的分解影响不大. 然而,游离溴在紫外照射下分解规律的研究相对较少. Guo等[11]研究发现,在低压紫外照射下,游离溴的初始浓度(20—200 μmol·L−1)对游离溴的分解影响很小. 海水基质成分复杂,无机离子和有机物的存在可能会影响游离氯和游离溴的分解速率,进而影响RO工艺中紫外线去除游离氯和游离溴的效果,但目前针对这一问题尚缺乏深入研究.
低压紫外灯是一种主要发射254 nm短波紫外线的单色光源,凭借其较高的能源转换率和强力的杀菌能力,已经在水处理领域广泛应用[17],对于游离氯和游离溴也具有分解效果[11]. Sperle等[18]研究还发现短波紫外对RO膜生物堵塞的处理也具有重要意义. 因此,本研究通过测定游离氯和游离溴在低压紫外灯照射下的浓度变化,研究了水中pH、阴离子和腐殖酸对游离氯和游离溴分解的影响,且分析了其中可能存在的原因,本研究可为紫外线去除游离氯和游离溴工艺的优化提供数据参考.
1. 实验部分(Experiment section)
1.1 主要试剂
次氯酸钠溶液、溴化钾、氯化钠、硝酸钾、硫酸钠、碳酸氢钠、氟化钠、磷酸二氢钠、磷酸氢二钠、硼酸和四硼酸钠,均为分析纯,购自国药集团化学试剂有限公司. N,N-二乙基-1,4-苯二胺硫酸盐,为分析纯,购自上海麦克林生化科技有限公司. 腐殖酸,有效含量大于82%,购自天津光复精细化工研究所. 实验中溶液均为超纯水(18.2 MΩ·cm)配置.
实际海水取自青岛近海海域,经0.45 μm滤膜过滤后使用,其基本理化指标如下:盐度为29.7‰,pH为8.02,DOC为1.92 mg·L−1. 人造海水的配置主要参考Mocledon海水配方[19],盐度为33‰,pH为8.01,内含氯离子(530 mmol·L−1)、溴离子(0.8 mmol·L−1)、硫酸根(27 mmol·L−1)、碳酸氢根(2.4 mmol·L−1)、硼酸盐(0.95 mmol·L−1)、磷酸盐(30 μmol·L−1)、硝酸根(30 μmol·L−1)和氟离子(50 μmol·L−1)等无机离子.
1.2 光照实验
游离氯和游离溴的光照实验在定制的低压紫外平行光束仪(NLC-PXGY-40W,福建新大陆环保科技有限公司)中进行,反应器为石英玻璃皿(直径d=10 cm,高度h=4 cm),放置于光束仪下方的磁力搅拌器上,实验时可以通过调节搅拌器下方的升降台高度实现反应器内光强的变化. 实验开始前对平行光束仪预热至少15 min,待光强稳定后进行实验. 由于游离氯和游离溴的初始浓度对其在低压紫外照射下的分解速率影响不大[11,16],因此将游离氯和游离溴的初始浓度固定为10 mg·L−1(约140 μmol·L−1),同时将反应器内反应液体积设定为200 mL. 进行实验时,每隔一定时间取样,测定游离氯或游离溴的浓度.
在反应器内加入190 mL的5 mmol·L−1磷酸盐缓冲液(pH=6或8)或硼酸盐缓冲液(pH=10),再加入一定体积的KBr溶液(反应液Br−终浓度为65 mg·L−1)或纯水,之后加入次氯酸钠溶液,搅拌混匀10 min,使之充分反应后进行实验,研究不同pH对游离氯和游离溴分解的影响.
在反应器内加入190 mL的5 mmol·L−1磷酸盐缓冲液(pH=8),再加入一定体积的KBr溶液(反应液Br−终浓度为65 mg·L−1)或纯水,加入次氯酸钠溶液,搅拌混匀10 min,再加入一定浓度的阴离子或腐殖酸溶液,之后进行实验,研究阴离子和腐殖酸对游离氯和游离溴分解的影响.
在反应器内加入一定体积的实际海水或人造海水,再加入次氯酸钠溶液,搅拌混匀10 min,之后进行实验,研究实际海水和人造海水对游离氯和游离溴分解的影响.
1.3 测定方法
紫外光强用LS125紫外辐照计(深圳林上科技有限公司)测定,实验中光强稳定在约0.9 mW·cm−2;pH用雷磁PHS-3C型pH计(上海仪电科学仪器股份有限公司)测定;盐度使用AZ8371型盐度计(中国台湾衡欣科技股份有限公司)测定;摩尔吸光系数、游离氯和游离溴浓度利用752N紫外可见分光光度计(上海仪电分析仪器有限公司)测定;DOC用TOC-V总有机碳分析仪(日本岛津公司)测定. 游离氯和游离溴浓度参照DPD分光光度法(HJ 586—2010)测定,以Cl2(mg·L−1)计.
1.4 计算方法
利用一级动力学方程(式(5))拟合游离氯或游离溴的分解速率.
$ \mathrm{ln}\left(\frac{{C}_{0}}{{C}_{t}}\right)={K}_{\mathrm{o}\mathrm{b}\mathrm{s}}Q $ $ (5) $ 式中,C0和Ct分别为游离氯或游离溴的初始浓度和经过t时间后的质量浓度,mg·L−1;Kobs为表观一级反应速率常数,cm2·mJ−1;Q为紫外剂量,mJ·cm−2.
如果假设体系中某化合物W为唯一的吸光物质,那么其在254 nm处的光解速率可以由式(6)描述[20].
$ \frac{\mathrm{d}{C}_{\mathrm{w}}}{\mathrm{d}t}=-\frac{\varPhi {I}_{0}\left(1-{10}^{-\epsilon {C}_{\mathrm{w}}l}\right)}{{\textit{z}}} $ $ (6) $ 式中,Φ为化合物W的量子产率,mol·Einstein−1;I0为光强度,mEinstein·(cm2·s)−1;ε为化合物W在254 nm处的摩尔吸光系数,L·(mol·cm)−1;l为光路长度,cm;z为溶液深度,cm;Cw为化合物W的摩尔浓度,mol·L−1. 本研究中I0为0.191×10−5 mEinstein·(cm2·s)−1,同时由于使用了平行光束仪(l=z),且实验中εCwl较小,根据泰勒一阶展开式,式(6)可近似为式(7),再经过简单变换即式(8)—式(9). 因此,游离氯或游离溴的直接光解速率常数Kact可以通过式(8)计算;表观量子产率Φobs可以通过式(9)计算.
$ \frac{\mathrm{d}{C}_{\mathrm{w}}}{\mathrm{d}t}=-2.303\varPhi {{I}}_{0}\varepsilon {C}_{\mathrm{w}}=-K{C}_{\mathrm{w}} $ $ (7) $ $ {K}_{\mathrm{a}\mathrm{c}\mathrm{t}}=2.303{\varPhi }_{\mathrm{a}\mathrm{c}\mathrm{t}}{{ I}}_{0}\varepsilon $ $ (8) $ $ {\varPhi }_{\mathrm{o}\mathrm{b}\mathrm{s}}=\frac{{K}_{\mathrm{o}\mathrm{b}\mathrm{s}}}{2.303{{I}}_{0}\varepsilon } $ $ (9) $ 2. 结果与讨论 (Results and discussion)
2.1 pH对游离氯和游离溴分解的影响
海水的典型pH一般在8.0左右,呈弱碱性. 在常规水处理的pH范围内,游离氯和游离溴主要是以HOX和OX−的形态存在(X=Cl, Br),其比例与pH的具体大小密切相关[16,21](图1). 在pH为6时,游离氯(pKa=7.5)中HOCl占比为96.9%,游离溴(pKa=8.8)中HOBr占比为99.8%. 在pH为8时,游离氯中OCl−占主要部分,占比76.0%;游离溴中HOBr占主要部分,占比86.3%. 在pH为10时,游离氯和游离溴中分别以OCl−和OBr−为主,占比分别为99.7%和94.1%.
pH的变化引起物质存在形态的变化,进而可能会影响物质分解速率的变化. 因此,考察了游离氯、游离溴在初始质量浓度为10 mg·L−1、不同pH条件下游离氯和游离溴的分解速率,结果如图2所示.
由图2(a)可以看出,在低压紫外的照射下,游离氯的分解速率常数随pH下降略有上升. 当pH为10时,游离氯分解的表观一级反应速率常数Kobs为0.000272 cm2·mJ−1;当pH为6时,游离氯分解的Kobs为0.000312 cm2·mJ−1,上升了14.7%. 这表明在254 nm的紫外波长下,低pH下以HOCl为主要存在形态的游离氯相对容易分解. 由图2(b)可以看出,游离溴的分解速率随pH的下降明显上升. 当pH为10时,游离溴分解的Kobs为0.000065 cm2·mJ−1;当pH为6时,游离氯分解的Kobs为0.000286 cm2·mJ−1,上升了3.4倍. 这表明游离溴的分解速率更容易受到pH变化的影响,且低pH下以HOBr为主要存在形态的游离溴分解速率更快. 这主要是由于不同形态的游离氯和游离溴的摩尔吸光系数和量子产率以及自由基反应过程的不同[11]. 游离氯和游离溴分解的表观一级反应速率常数Kobs是由直接光解速率常数(Kact)和自由基反应速率常数(Kradical)决定的. 其中自由基反应速率常数(Kradical)是由自由基引起的间接光解速率常数(Krad-indirect)和再生成速率常数(Krad-reformation)决定的(式(10))[20].
$ {K}_{\mathrm{o}\mathrm{b}\mathrm{s}}={K}_{\mathrm{a}\mathrm{c}\mathrm{t}}+{K}_{\mathrm{r}\mathrm{a}\mathrm{d}\mathrm{i}\mathrm{c}\mathrm{a}\mathrm{l}}={K}_{\mathrm{a}\mathrm{c}\mathrm{t}}+{K}_{\mathrm{r}\mathrm{a}\mathrm{d}-\mathrm{i}\mathrm{n}\mathrm{d}\mathrm{i}\mathrm{r}\mathrm{e}\mathrm{c}\mathrm{t}}-{K}_{\mathrm{r}\mathrm{a}\mathrm{d}-\mathrm{r}\mathrm{e}\mathrm{f}\mathrm{o}\mathrm{r}\mathrm{m}\mathrm{a}\mathrm{t}\mathrm{i}\mathrm{o}\mathrm{n}} $ $ (10) $ 为了进一步验证机理,本研究测定了HOCl、OCl−、HOBr和OBr−的摩尔吸光系数(图3),并利用实验所获得的Kobs和式(9)计算相应物质的表观量子产率(Φobs),利用已有研究所报道的实际量子产率(Φact),通过计算Φact/Φobs获得物质直接光解的比例. 由表1可见,HOCl、OCl−、HOBr和OBr−直接光解分别占比54.4%、54.5%、60.6%和45.6%. 这表明无论是游离氯还是游离溴,直接光解和自由基反应对其分解的影响均不可忽视.
表 1 游离氯和游离溴的量子产率和分解速率常数Table 1. Quantum yields and decomposition rate constants for free chlorine and free bromine此外,从HOCl到OCl−转变的分解速率变化来看,Kobs下降了0.000040 cm2·mJ−1,而Kact仅下降了0.000022 cm2·mJ−1,说明pH变化不仅仅影响游离氯直接光解(55%)还影响自由基反应(45%). 类似地,从HOBr转变为OBr−,Kobs下降了0.000221 cm2·mJ−1,而Kact下降了0.000144 cm2·mJ−1,也说明了pH通过影响游离溴的直接光解(65.2%)和自由基反应(34.8%)来影响分解速率.
2.2 无机阴离子对游离氯和游离溴分解的影响
地表水,尤其是海水中,存在着各种无机阴离子. 海水中常见的无机阴离子有氯离子、硫酸根、碳酸氢根、硝酸盐、磷酸盐、硼酸盐(以H3BO3的形式存在)和氟离子等. 但这些无机阴离子在紫外照射下对游离氯,尤其是对游离溴的分解速率的影响仍不清晰. 本研究为模拟海水中无机阴离子的影响,除设置氯离子质量浓度为2 g·L−1(56 mmol·L−1)和20 g·L−1(560 mmol·L−1)外,其余离子设置为5 mmol·L−1或50 mmol·L−1进行实验. 由于海水的典型pH在8.0左右,因此实验中pH保持为8.0.
由图4(a)可见,在pH 8时,游离氯在低压紫外照射下的分解速率随着Cl−浓度的增加而降低,与空白对照相比,20 g·L−1 Cl−导致游离氯分解速率降低13.7%. 这可能是Cl−与含氯自由基(Cl·、Cl2−·、ClO·等)和羟基自由基(HO·)反应导致的[20]. 一方面,Cl−的存在能够与游离氯直接光解产生的Cl·反应生成Cl2−·(式(11)),从而减弱了Cl·与游离氯的间接光解反应(式(12)—式(13)),导致分解速率下降;另一方面,高浓度的Cl−对体系内HO·的清除反应(式(14))则抑制了HO·与游离氯的间接光解反应(式(15)—式(16)),也会导致分解速率的下降. 但是Cl−与HO·发生的主要反应(式(14)) 是可逆反应,刘宇程等[22]的理论计算研究表明,当Cl−的浓度大于50 g·L−1时,其正反应(kf)占优势而逆反应(kr)较弱. 由于海水中的Cl−浓度约为20 g·L−1,因此在该浓度条件下,Cl−不能够起到清除HO·的作用.
$ \mathrm{C}\mathrm{l}\cdot +{\mathrm{C}\mathrm{l}}^-\to {\mathrm{C}\mathrm{l}}_{2}^-\cdot \quad k=8.5\times 10^{9} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (11) $ $ \mathrm{C}\mathrm{l}\cdot +\mathrm{H}\mathrm{O}\mathrm{C}\mathrm{l}\to {\mathrm{H}}^++{\mathrm{C}\mathrm{l}}^-+\mathrm{C}\mathrm{l}\mathrm{O}\cdot \quad k=3.0\times 10^{9}\; {\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (12) $ $ \mathrm{C}\mathrm{l}\cdot +{\mathrm{O}\mathrm{C}\mathrm{l}}^-\to {\mathrm{C}\mathrm{l}}^-+\mathrm{C}\mathrm{l}\mathrm{O}\cdot \quad k=8.2\times 10^{9} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (13) $ $ \mathrm{H}\mathrm{O}\cdot +{\mathrm{C}\mathrm{l}}^-\leftrightarrows {\mathrm{C}\mathrm{l}\mathrm{O}\mathrm{H}\cdot }^-\quad k_{f}=4.3\times 10^{9}\; {\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1},\; k_{r}=6.1\times 10^{9} \;{\rm{s}}^{-1} $ $ (14) $ $ \mathrm{H}\mathrm{O}\cdot +\mathrm{H}\mathrm{O}\mathrm{C}\mathrm{l}\to {\mathrm{H}}_{2}\mathrm{O}+\mathrm{C}\mathrm{l}\mathrm{O}\cdot \quad k=2.0\times 10^{9}\; {\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (15) $ $ \mathrm{H}\mathrm{O}\cdot +{\mathrm{O}\mathrm{C}\mathrm{l}}^-\to {\mathrm{O}\mathrm{H}}^-+\mathrm{C}\mathrm{l}\mathrm{O}\cdot \quad k=8.8\times 10^{9} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (16) $ 由图4(b)可见,与Cl−的影响规律相反,游离氯在紫外照射下的分解速率随着
${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ $ {\mathrm{N}\mathrm{O}}_{3}^-+hv\to {\mathrm{N}\mathrm{O}}_{2}\cdot +{\mathrm{O}}^-\cdot $ $ (17) $ $ {\mathrm{O}}^-\cdot +{\mathrm{H}}_{2}\mathrm{O}\to \mathrm{H}\mathrm{O}\cdot +{\mathrm{O}\mathrm{H}}^- \quad k=9.4\times 10^{7}\; {\rm{s}}^{-1} $ $ (18) $ 由图4(a)可见,在pH为8时,游离溴的分解速率随着Cl−浓度的增加而上升,20 g·L−1 Cl−导致游离溴分解速率上升45.4%. 这与体系内含溴自由基(Br·、
${\rm{Br}} \cdot _2^- $ ${\rm{Br}} \cdot _2^- $ ${\rm{Br}} \cdot _2^- $ 由图4(b)可见,游离溴的分解速率随着NO3−浓度的增加而下降,50 mmol·L−1
${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{NO}}_3^{-} $ ${\rm{Br}} \cdot _2^- $ $ \mathrm{B}\mathrm{r}\cdot +{\mathrm{B}\mathrm{r}}^-\to {\mathrm{B}\mathrm{r}\cdot }_{2}^- \quad k=1.2\times 10^{10}\; {\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (19) $ $ \mathrm{H}\mathrm{O}\cdot +{\mathrm{B}\mathrm{r}}^-\to {\mathrm{B}\mathrm{r}\mathrm{O}\mathrm{H}\cdot }^- \quad k=1.1\times 10^{10}\;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (20) $ $ \mathrm{B}\mathrm{r}\cdot +\mathrm{H}\mathrm{O}\mathrm{B}\mathrm{r}\to \mathrm{B}\mathrm{r}\mathrm{O}\cdot +\mathrm{H}\mathrm{B}\mathrm{r} \quad k=1.0\times 10^{8} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (21) $ $ \mathrm{H}\mathrm{O}\cdot +\mathrm{H}\mathrm{O}\mathrm{B}\mathrm{r}\to \mathrm{B}\mathrm{r}\mathrm{O}\cdot +{\mathrm{H}}_{2}\mathrm{O} \quad k=2.0\times 10^{9} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (22) $ $ {\mathrm{B}\mathrm{r}\mathrm{O}\mathrm{H}\cdot }^-+{\mathrm{B}\mathrm{r}}^-\to {\mathrm{B}\mathrm{r}\cdot }_{2}^-+{\mathrm{O}\mathrm{H}}^- \quad k=1.9\times 10^{8} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (23) $ $ {\mathrm{B}\mathrm{r}\cdot }_{2}^-+\mathrm{H}\mathrm{O}\cdot \to \mathrm{H}\mathrm{O}\mathrm{B}\mathrm{r}+{\mathrm{B}\mathrm{r}}^- \quad k=1.0\times 10^{9} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (24) $ $ \mathrm{B}\mathrm{r}\cdot +{\mathrm{C}\mathrm{l}}^-\to {\mathrm{B}\mathrm{r}\mathrm{C}\mathrm{l}\cdot }^- \quad k=1.0\times 10^{8} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (25) $ $ {\mathrm{B}\mathrm{r}\mathrm{C}\mathrm{l}\cdot }^-+\mathrm{H}\mathrm{O}\cdot \to \mathrm{B}\mathrm{r}\mathrm{C}\mathrm{l}+{\mathrm{H}}_{2}\mathrm{O} \quad k=1.0\times 10^{9} \;{\rm{L}}\cdot ({\rm{mol}}\cdot {\rm{s}})^{-1} $ $ (26) $ 由图5可见,在pH为8的条件下,水中常见的其他阴离子(
${\rm{SO}}_4^{2-} $ ${\rm{HCO}}_3^{-} $ ${\rm{HPO}}_4^{2-} $ 2.3 腐殖酸对游离氯和游离溴分解的影响
腐殖酸是一种在天然水体中广泛存在的有机物[25],常作为水体环境中有机组分的代表物,其对紫外照射下游离氯分解的影响已经引起了诸多关注. 田芳等[14]研究了在中压紫外照射下腐殖酸对游离氯分解的影响,发现腐殖酸浓度与游离氯的分解速率常数呈线性关系,随腐殖酸浓度的升高其分解速率上升. 但是,在低压紫外照射下,腐殖酸对游离氯分解的影响尚存争议. 一方面,腐殖酸可以作为紫外滤层吸收紫外光而抑制游离氯的分解;另一方面,腐殖酸可以与游离氯反应加速其分解[26]. 同时,腐殖酸对游离溴分解的影响的研究较为缺乏. 因此,本研究以0—4.28 mg·L−1的腐殖酸(以DOC计)作为影响因素研究紫外照射下游离氯和游离溴的分解规律,以进一步明确腐殖酸对游离氯和游离溴分解的影响.
由图6(a)可见,随着腐殖酸浓度的升高,游离氯的分解速率先下降再上升,当腐殖酸浓度为0.11 mg·L−1时,游离氯的分解的Kobs为0.000250 cm2·mJ−1,与空白组相比降低了14.3%;当腐殖酸浓度为4.28 mg·L−1时,分解的Kobs达到0.000336 cm2·mJ−1,与空白组相比升高了15.1%. 由图6(b)可见,游离溴的分解速率常数随腐殖酸浓度的升高先短暂下降后迅速上升. 当腐殖酸浓度为0.11 mg·L−1时,游离溴的分解的Kobs为0.000128 cm2·mJ−1,与空白组相比降低了16.9%;当腐殖酸浓度为4.28 mg·L−1时,其分解的Kobs达到0.000525 cm2·mJ−1,是空白组的3.4倍.
由此可见,腐殖酸在低浓度时可能是以紫外滤层吸收紫外光占据主导地位,随着浓度的升高,腐殖酸作为反应物起到主要作用. 以威海乳山湾近海海域为例[27],该海域海水的DOC含量范围为0.70—3.19 mg·L−1,所以可以推测海水中的有机物主要是起到促进分解的作用.
此外,腐殖酸对游离溴分解的促进作用明显大于游离氯. 造成这种结果的可能原因是腐殖酸与游离溴更容易反应,从而促进了它的分解. 已有研究表明[28-29],相比于游离氯,某些具有特殊结构的有机物更容易被游离溴氧化,如酚类、胺类、含硫类化合物等. 其中,酚羟基是腐殖酸中普遍具有的重要官能团[30]. 为了证明这一假设,在pH为8的条件下,研究了无紫外照射下的游离氯和游离溴与腐殖酸的反应,发现游离溴与腐殖酸的反应速率明显高于游离氯与腐殖酸的反应(图7). 这说明,腐殖酸与游离溴更容易反应是腐殖酸对游离溴分解的促进作用较大的重要原因.
2.4 实际海水对游离氯和游离溴分解的影响
实际海水中同时存在上述研究中所涉及的各类无机阴离子和有机物,能够从多个方面影响游离氯和游离溴的分解速率. 由于海水淡化的RO系统中游离氯的摩尔浓度低于海水中溴离子的摩尔浓度[31],此时系统中的游离氯能够被溴离子完全转化为游离溴. 因此,本研究设置游离溴浓度为10 mg·L−1,以实际海水和人造海水为反应液,研究低压紫外照射工艺在海水中的应用效果,为工艺的实际应用提供参考.
由图8可见,人造海水中游离溴的分解的Kobs为0.000237 cm2·mJ−1,与空白相比升高了53.9%,与添加20 g·L−1 Cl−的游离溴的分解速率差别不大(图4(a)).
这表明海水无机阴离子中Cl−对游离溴的分解起着重要的促进作用. 实际海水中游离溴的分解的Kobs为0.000274 cm2·mJ−1,与人造海水相比升高了15.6%. 这可能是由于海水中的有机物对游离溴分解起到了促进作用. Cho等[31]的研究表明,在低压紫外照射下,实际海水(DOC为2.2 mg·L−1)中游离氯(溴)的分解速率是人造海水的1.6倍. 虽然研究结果有一定的差异,但以上结果均证明在实际海水中,有机物对于游离溴在低压紫外光照射下的分解能够起到一定的促进作用. 这与腐殖酸影响实验中所得的结果基本相符.
3. 结论(Conclusion)
(1)在低压紫外照射下,随着pH降低,游离氯和游离溴的分解速率升高,其中pH降低对游离溴分解速率促进作用更大. pH通过影响直接光解和自由基反应过程影响游离氯和游离溴的分解速率. 对于海水淡化来说,通过适当降低RO工艺的进水pH,可以提高紫外线去除游离溴的效率.
(2)高浓度Cl−能够抑制游离氯的分解而促进游离溴的分解,高浓度
${\rm{NO}}_3^{-} $ ${\rm{SO}}_4^{2-} $ ${\rm{HCO}}_3^- $ ${\rm{HPO}}_4^{2-} $ (3)低浓度腐殖酸可抑制游离溴和游离氯的分解,高浓度腐殖酸则会促进其分解,且对游离溴分解的促进程度强于游离氯.
(4)在实际海水中,一定浓度的Cl−和有机物的存在能够促进游离溴在紫外照射下的分解.
-
表 1 游离氯和游离溴的量子产率和分解速率常数
Table 1. Quantum yields and decomposition rate constants for free chlorine and free bromine
-
[1] SHENVI S S, ISLOOR A M, ISMAIL A F. A review on RO membrane technology: Developments and challenges [J]. Desalination, 2015, 368: 10-26. doi: 10.1016/j.desal.2014.12.042 [2] LI Y F, SIM L N, HO J S, et al. Integration of an anaerobic fluidized-bed membrane bioreactor (MBR) with zeolite adsorption and reverse osmosis (RO) for municipal wastewater reclamation: Comparison with an anoxic-aerobic MBR coupled with RO [J]. Chemosphere, 2020, 245: 125569. doi: 10.1016/j.chemosphere.2019.125569 [3] BUNANI S, YÖRÜKOĞLU E, SERT G, et al. Utilization of reverse osmosis (RO) for reuse of MBR-treated wastewater in irrigation-preliminary tests and quality analysis of product water [J]. Environmental Science and Pollution Research International, 2018, 25(4): 3030-3037. doi: 10.1007/s11356-015-4199-y [4] 郑利兵, 张春, 夏森, 等. 热电厂双膜法中水深度处理回用系统膜污染机制分析 [J]. 环境工程学报, 2019, 13(5): 1038-1047. doi: 10.12030/j.cjee.201812039 ZHENG L B, ZHANG C, XIA S, et al. Membrane fouling characterization and mechanism of a full-scale dual membrane process for advanced treatment and reuse of reclaimed water in a thermal power plant [J]. Chinese Journal of Environmental Engineering, 2019, 13(5): 1038-1047(in Chinese). doi: 10.12030/j.cjee.201812039
[5] 李睿涵, 黄李金鸿, 黄万抚, 等. 影响反渗透膜生物污染的因素及控制方法 [J]. 水处理技术, 2019, 45(12): 19-25. doi: 10.16796/j.cnki.1000-3770.2019.12.004 LI R H, HUANG L, HUANG W F, et al. Factors affecting biofouling of reverse osmosis membrane and control methods [J]. Technology of Water Treatment, 2019, 45(12): 19-25(in Chinese). doi: 10.16796/j.cnki.1000-3770.2019.12.004
[6] GARCÍA-PACHECO R, LANDABURU-AGUIRRE J, LEJARAZU-LARRAÑAGA A, et al. Free chlorine exposure dose (ppm·h) and its impact on RO membranes ageing and recycling potential [J]. Desalination, 2019, 457: 133-143. doi: 10.1016/j.desal.2019.01.030 [7] JAMES R. Dechlorination by ultraviolet radiation: A suitable alternative to activated carbon in dialysis water systems? [J]. Journal of Renal Care, 2009, 35(4): 205-210. doi: 10.1111/j.1755-6686.2009.00117.x [8] 佘肖伟. 双膜法处理沿海城市污水处理厂出水的中试实验研究[D]. 广州: 广州大学, 2017. SHE X W. Pilot study on UF-RO process for advanced treatment of coastal WWTP effluent[D]. Guangzhou: Guangzhou University, 2017(in Chinese).
[9] WANG X J, HU X X, WANG H B, et al. Synergistic effect of the sequential use of UV irradiation and chlorine to disinfect reclaimed water [J]. Water Research, 2012, 46(4): 1225-1232. doi: 10.1016/j.watres.2011.12.027 [10] NICKELS R A. Evaluation of long-term membrane performance with continuous use of hydro-optic UV dechlorination at Plant Bowen. [J]. Power Engineering, 2017, 121(11): 80-87. [11] GUO K H, ZHENG S S, ZHANG X W, et al. Roles of bromine radicals and hydroxyl radicals in the degradation of micropollutants by the UV/bromine process [J]. Environmental Science & Technology, 2020, 54(10): 6415-6426. [12] SHEMER H, SEMIAT R. Impact of halogen based disinfectants in seawater on polyamide RO membranes [J]. Desalination, 2011, 273(1): 179-183. doi: 10.1016/j.desal.2010.05.056 [13] LEE W, LEE Y R, ALLARD S, et al. Mechanistic and kinetic understanding of the UV254 photolysis of chlorine and bromine species in water and formation of oxyhalides [J]. Environmental Science & Technology, 2020, 54(18): 11546-11555. [14] 田芳, 陆昱, 郭光, 等. 中压紫外/氯水处理工艺过程中氯的分解规律 [J]. 环境工程学报, 2021, 15(2): 572-579. doi: 10.12030/j.cjee.202005059 TIAN F, LU Y, GUO G, et al. Decomposition of chlorine during medium pressure UV/chlorine water treatment process [J]. Chinese Journal of Environmental Engineering, 2021, 15(2): 572-579(in Chinese). doi: 10.12030/j.cjee.202005059
[15] YIN R, LING L, SHANG C. Wavelength-dependent chlorine photolysis and subsequent radical production using UV-LEDs as light sources [J]. Water Research, 2018, 142: 452-458. doi: 10.1016/j.watres.2018.06.018 [16] FENG Y G, SMITH D W, BOLTON J R. Photolysis of aqueous free chlorine species (HOCl and OCl-) with 254 nm ultraviolet light [J]. Journal of Environmental Engineering and Science, 2007, 6(3): 277-284. doi: 10.1139/s06-052 [17] 文尚胜, 左文财, 周悦, 等. 紫外线消毒技术的研究现状及发展趋势 [J]. 光学技术, 2020, 46(6): 664-670. doi: 10.13741/j.cnki.11-1879/o4.2020.06.006 WEN S S, ZUO W C, ZHOU Y, et al. Research status and development trend of ultraviolet disinfection technology [J]. Optical Technique, 2020, 46(6): 664-670(in Chinese). doi: 10.13741/j.cnki.11-1879/o4.2020.06.006
[18] SPERLE P, WURZBACHER C, DREWES J E, et al. Reducing the impacts of biofouling in RO membrane systems through in situ low fluence irradiation employing UVC-LEDs [J]. Membranes, 2020, 10(12): 415. doi: 10.3390/membranes10120415 [19] LU Z, ZHANG K, SHI Y, et al. Efficient removal of Escherichia coli from ballast water using a combined high-gradient magnetic separation-ultraviolet photocatalysis (HGMS-UV/TiO2) system [J]. Water, Air, & Soil Pollution, 2018, 229(8): 1-8. [20] CHUANG Y H, CHEN S, CHINN C J, et al. Comparing the UV/monochloramine and UV/free chlorine advanced oxidation processes (AOPs) to the UV/hydrogen peroxide AOP under scenarios relevant to potable reuse [J]. Environmental Science & Technology, 2017, 51(23): 13859-13868. [21] HEEB M B, CRIQUET J, ZIMMERMANN-STEFFENS S G, et al. Oxidative treatment of bromide-containing waters: Formation of bromine and its reactions with inorganic and organic compounds—A critical review [J]. Water Research, 2014, 48: 15-42. doi: 10.1016/j.watres.2013.08.030 [22] 刘宇程, 杨冰, 李沁蔓, 等. Cl-和pH对高级氧化工艺去除含盐废水中有机物的影响及机理 [J]. 环境工程学报, 2021, 15(5): 1487-1499. doi: 10.12030/j.cjee.202009046 LIU Y C, YANG B, LI Q M, et al. Effects and mechanism of Cl- and pH on organic matter removal in salt-containing wastewater treatment by advanced oxidation processes [J]. Chinese Journal of Environmental Engineering, 2021, 15(5): 1487-1499(in Chinese). doi: 10.12030/j.cjee.202009046
[23] 张文兵, 肖贤明, 傅家谟, 等. 溶液中阴离子对UV/H2O2降解4-硝基酚的影响 [J]. 中国环境科学, 2002, 22(4): 301-304. doi: 10.3321/j.issn:1000-6923.2002.04.004 ZHANG W B, XIAO X M, FU J M, et al. Effect of anions in aqueous solution on the degradation of 4-nitrophenol by UV/H2O2 process [J]. China Environmental Science, 2002, 22(4): 301-304(in Chinese). doi: 10.3321/j.issn:1000-6923.2002.04.004
[24] CHENG S S, ZHANG X R, YANG X, et al. The multiple role of bromide ion in PPCPs degradation under UV/chlorine treatment [J]. Environmental Science & Technology, 2018, 52(4): 1806-1816. [25] 王亚军, 马军. 水体环境中天然有机质腐殖酸研究进展 [J]. 生态环境学报, 2012, 21(6): 1155-1165. doi: 10.3969/j.issn.1674-5906.2012.06.029 WANG Y J, MA J. Research advances of humic acid in aquatic environments [J]. Ecology and Environmental Sciences, 2012, 21(6): 1155-1165(in Chinese). doi: 10.3969/j.issn.1674-5906.2012.06.029
[26] LIU Y Z, TANG Y Q, WU Y X, et al. Degradation of naproxen in chlorination and UV/chlorine processes: Kinetics and degradation products [J]. Environmental Science and Pollution Research International, 2019, 26(33): 34301-34310. doi: 10.1007/s11356-019-04472-z [27] 臧家业, 赵晨英, 刘军, 等. 乳山湾邻近海域有机碳的分布与底界面过程 [J]. 中国环境科学, 2017, 37(3): 1089-1102. ZANG J Y, ZHAO C Y, LIU J, et al. Characteristics and benthic processes of organic carbon in the adjacent area of Rushan Bay [J]. China Environmental Science, 2017, 37(3): 1089-1102(in Chinese).
[28] CRIQUET J, RODRIGUEZ E M, ALLARD S, et al. Reaction of bromine and chlorine with phenolic compounds and natural organic matter extracts - Electrophilic aromatic substitution and oxidation [J]. Water Research, 2015, 85: 476-486. doi: 10.1016/j.watres.2015.08.051 [29] INABA K, DOI T, ISOBE N, et al. Formation of bromo-substituted triclosan during chlorination by chlorine in the presence of trace levels of bromide [J]. Water Research, 2006, 40(15): 2931-2937. doi: 10.1016/j.watres.2006.05.031 [30] 贺婧, 颜丽, 杨凯, 等. 不同来源腐殖酸的组成和性质的研究 [J]. 土壤通报, 2003, 34(4): 343-345. doi: 10.3321/j.issn:0564-3945.2003.04.026 HE J, YAN L, YANG K, et al. Study on component and character of humic acids from different sources [J]. Chinese Journal of Soil Science, 2003, 34(4): 343-345(in Chinese). doi: 10.3321/j.issn:0564-3945.2003.04.026
[31] CHO K, JEONG S, KIM H, et al. Simultaneous dechlorination and disinfection using vacuum UV irradiation for SWRO process [J]. Desalination, 2016, 398: 22-29. doi: 10.1016/j.desal.2016.07.012 -







 下载:
下载: