-
铅是有毒的环境污染物,被世界卫生组织列为十大危害公共卫生安全的化学物质之一. 环境铅污染主要来源于工业生产和应用. 尽管从20世纪末开始,全世界各个国家先后禁止使用含铅汽油以及含铅钢管和硬聚氯乙烯(PCV)塑料管材,但是由于社会工业的快速发展,铅的使用量仍然逐年增加. 根据2021年3月Statista研究部门的数据统计,全球铅消费量从2004年至2020年由7297万吨增加至11545万吨[1],增长了58.2%,其主要应用领域是铅蓄电池生产,是铅总消费量的80%左右[2]. 铅蓄电池的生产及回收过程使得铅以蒸气和烟尘形式逸散在空气中,并通过呼吸摄入方式进入人体肺部,进一步进入血液循环系统. 当血液中铅含量超过正常范围(400 mg·L−1)[3],可引起铅中毒.
铅中毒已被认为是重大的公共健康问题,尤其在发展中国家. 铅可以随着血液循环转移至身体全身的各个组织器官[4-5],引起神经系统、造血系统、肾脏系统、心血管系统、生殖系统以及骨骼系统等病变[6]. 大脑的中枢神经系统是铅毒性最敏感的器官,与神经退行性疾病(比如阿尔兹海默症)的发生密切相关[7]. 铅暴露对儿童的大脑发育系统具有更显著的毒性效应. 大量研究表明,儿童铅中毒可引起大脑发育障碍、认知能力和智商降低等症状,且这种毒性效应具有持久性甚至永久性[8-9]. 铅对生殖系统具有毒性损伤作用,对男性常见的危害包括降低精子运动性能、减少精子数量、损伤染色体,导致不育、前列腺功能异常和血清睾酮变化等,对女性的危害包括患不孕症、流产、胎膜早破、妊娠高血压和早产等[10]. 此外,孕期铅暴露可直接影响胎儿的正常发育,可能会改变大脑中髓鞘形成的时间,对儿童后期的学习或其他认知功能产生长期的有害影响[11-12]. 综上,铅中毒可严重危害人体健康.
驱铅治疗可以缓解铅中毒的损伤效应. 依地酸二钠钙(CaNa2EDTA)是目前常用的驱铅治疗药物,其原理是利用EDTA与铅离子发生络合反应,形成稳定的水溶性依地酸铅,从而通过肾脏系统随尿液排出[13]. 但是目前临床上铅中毒患者在治疗过程中铅的脱除效率较低,血液中仅部分铅通过尿液排出[14]. 此外,该方法存在血液中铅(血铅)浓度回升的现象,即在治疗初期血铅水平降低,但是一段时间后血铅浓度回升,导致治疗效果较差. 影响铅中毒患者治疗效果的因素来自多方面,可能包括用药因素和个体的生理状态等,具体的影响因素目前还有待研究.
本文以使用CaNa2EDTA进行驱铅治疗的铅中毒患者作为研究对象,分别在用药前、用药后24 h、用药后72 h对全血、血浆以及尿液中的铅含量进行检测,同时检测尿液的pH值,分析铅中毒患者在治疗过程中,血铅、血浆铅和尿铅的变化趋势以及他们的铅脱除率,进一步分析不同体系中铅脱除率与尿液pH值的相关性,进而探究驱铅治疗效果的影响因素.
-
本试验共收集24名来中国广东惠州市的铅中毒患者。患者在惠州市职业病防治院接受驱铅治疗,治疗方法为静脉注射CaNa2EDTA,同时口服补充维生素C,其中有3名患者接受了两次驱铅治疗. 分别在患者用药前24 h、用药后24 h、用药后72 h收集血液和尿液样品,共收集了81份. 以上实验由惠州市职业病防治院的伦理委员会批准,并且征得所有患者的同意. 铅中毒患者的信息见表1.
-
实验仪器:离心机(安徽中科中佳科学仪器有限公司);电感耦合等离子体质谱(ICP-MS 8800;安捷伦科技有限公司);石墨烯微波消解仪(JRY-X350;湖南金蓉园仪器设备有限公司);pH测量仪(SevenCompact;梅特勒托利多);超低温冰箱(赛默飞世尔科技公司).
试剂:65%浓硝酸(EMPARTA;德国Merck);30%过氧化氢(优级纯;国药集团化学试剂有限公司);铅标准溶液(Multi-element calibration standard 2A;美国安捷伦科技有限公司);内标溶液(ICP-MS Internal Std Mix;安捷伦科技有限公司).
-
血液样品:使用肝素钠抗凝管采集铅中毒患者的血液样品(2 mL),常温放置(25 ℃左右),6 h内进行以下前处理:取0.5 mL全血至1.5 mL离心管,用于全血中总铅含量检测,保存于-80 ℃冰箱;对剩余全血样品(1.5 mL)进行离心处理(500 r·min−1,10 min),转移上层血浆至新的1.5 mL离心管中,再次离心(3000 r·min−1,10 min),将上层血浆转移至新的1.5 mL离心管,保存于-80 ℃冰箱,用于血浆中铅含量的检测.
尿液样品:将收集的尿液样品转移至15 mL离心管中,直接冻存于-80 ℃冰箱,用于尿液中铅含量的检测和尿液pH值检测.
-
全血和血浆样本:取200 μL样品,加200 μL浓硝酸消解和60 μL 30%的过氧化氢,95 ℃加热2 h,冷却后使用去离子水定容至10 mL,使用滤网(0.22 μm)进行过滤处理,最后使用ICP-MS测定铅浓度.
尿液样本:使用含2%硝酸的水溶液直接将尿液样品稀释10倍,再使用滤网(0.22 μm)进行过滤处理,最后使用ICP-MS测定铅浓度.
样品检测过程中采用方法空白、空白加标、平行测试来控制测试质量,该方法测定铅浓度的回收率为111.5% ± 1.4%.
-
pH校准:使用3种pH标准缓冲溶液(pH4.01、pH7.00、pH9.21)依次进行pH校准,并保存校准结果. 校正不同标准缓冲溶液之间,使用去离子水冲洗电极,并用无尘纸吸取电极表面残留的水分.
尿液样品的pH测定:使用去离子水冲洗电极,使用无尘纸吸取电极表面残留的水分,将电极放入样品中,按读数键开始测量,在读数稳定后,记录数据;随后进行下一个样品的测定. 按照此方法测定所有尿液样品的pH值.
-
使用Excel(Microsoft Office 2016)进行数据处理和分析,使用Graphpad软件(GraphPad Prism 8)进行图表绘制,具有显著性差异结果的标准是P < 0.05.
-
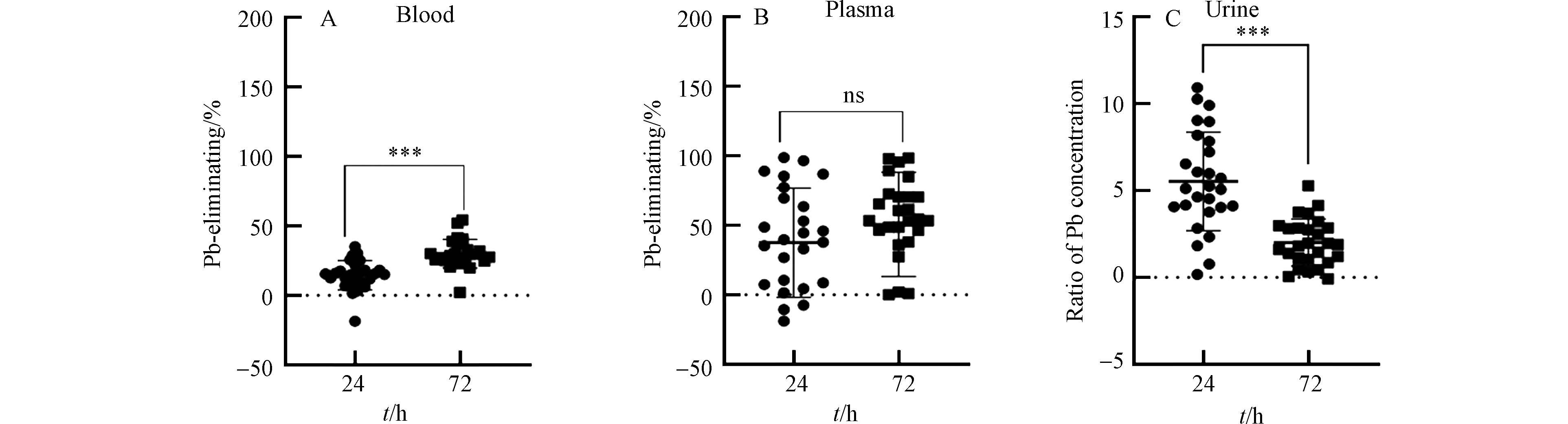
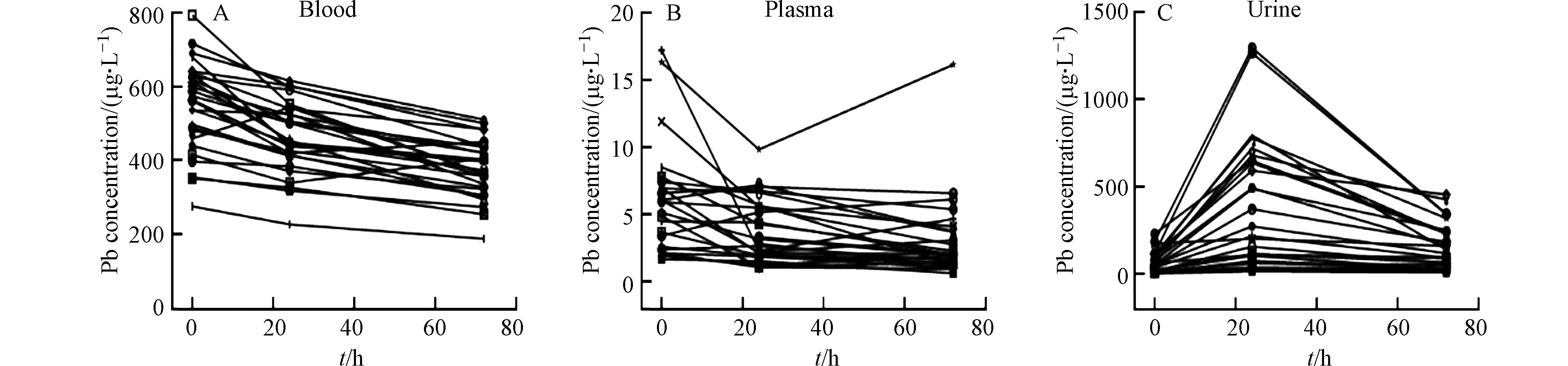
铅中毒患者血铅含量较高,通过使用驱铅药物,可以促进血铅通过肾脏系统随尿液排出体外,从而降低人体血液系统中的铅含量. 本次铅中毒患者在治疗过程中,血铅浓度呈现明显的下降趋势(图1A). 铅中毒患者的血铅含量分布范围广,在用药前其浓度范围为276.00—727.29 μg·L−1;用药后24 h和72 h,血铅浓度范围分别为227.20—615.20 μg·L−1和188.00—510.40 μg·L−1. 从用药前至用药后24 h,血铅浓度显著降低(P < 0.01);从用药后24 h至用药后72 h,血铅浓度也显著下降(P < 0.001). 大部分病人的血浆铅浓度也具有明显的连续降低趋势,而少部分病人的血浆铅浓度先降低后升高(图1B). 在用药前、用药后24 h和用药后72 h,血浆铅的浓度范围分别为1.76—17.18 μg·L−1、1.10—9.84 μg·L−1和0.67—16.13 μg·L−1. 在驱铅治疗的不同阶段血浆铅的变化趋势不具备统一性,这可能与不同病人具有个体差异有关. 此外,血浆铅的浓度是血铅的1.2%左右,说明在血液系统中仅有少部分铅存在于血浆中,而大部分铅赋存于血细胞中,这与之前相关的研究结果是一致的[15]. 几乎所有铅中毒患者的尿铅浓度,在治疗过程中均呈现先升高后降低的趋势(图1C). 在用药前、用药后24 h和用药后72 h,尿铅的浓度范围分别为2.92—230.04 μg·L−1、17.68—1294.26 μg·L−1和10.13—454.91 μg·L−1. 从用药前至用药后24 h,尿铅浓度显著升高(P < 0.001),从用药后24 h至用药后72 h,尿铅浓度显著下降(P < 0.01),说明在用药后24 h,通过尿液排出体外的铅含量比在用药后72 h高. 这可能是因为在用药前期,CaNa2EDTA的浓度较高,其通过络合反应结合的铅的含量较高. CaNa2EDTA是乙二胺四酸(EDTA)的二钠钙盐,可以与多种金属结合生成稳定的可溶络合物. 上述结果显示使用CaNa2EDTA治疗铅中毒患者,血铅和血浆铅的浓度均逐渐降低,同时尿铅含量增加.
-
尽管用药具有一定的驱铅效果,但是不同病人的铅脱除率参差不齐,且在不同治疗阶段的铅脱除率不同. 本文定义铅脱除率为相对于用药前的铅浓度降低的百分比,定义铅排出比例为用药后尿铅浓度与用药前尿铅浓度的比值. 在用药后24 h和72 h,血铅中的脱除率分别为(15.92 ± 8.30)%和(30.02 ± 10.32)%,且具有显著差异(图2A). 在用药后24 h和72 h,血浆铅中的脱除率分别为(37.51 ± 39.27)%和(50.62 ± 37.36)%(图2B). 在用药后24 h和72 h,铅的排出比例分别为5.52 ± 2.82和2.01 ± 1.34,且具有显著差异(图2C). 上述结果显示,铅中毒患者治疗过程中,血液系统中铅的整体脱除效果较差,最高的平均脱除率只有50.62%. 铅脱除率可以直接反应铅中毒患者的治疗效果. 上述结果说明,铅中毒患者的驱铅治疗效果较差. 这可能是因为大部分铅中毒患者属于慢性铅中毒,超过90%铅赋存于骨骼系统或其他软组织中[16]. 慢性铅中毒患者在使用驱铅药物后,尽管血铅可以随尿液排出体外,但体内其他部位(骨骼、软组织)的铅可能又转移至血液系统中,从而导致血铅的脱除率较低. 因此,慢性铅中毒患者的驱铅治疗更具挑战性.
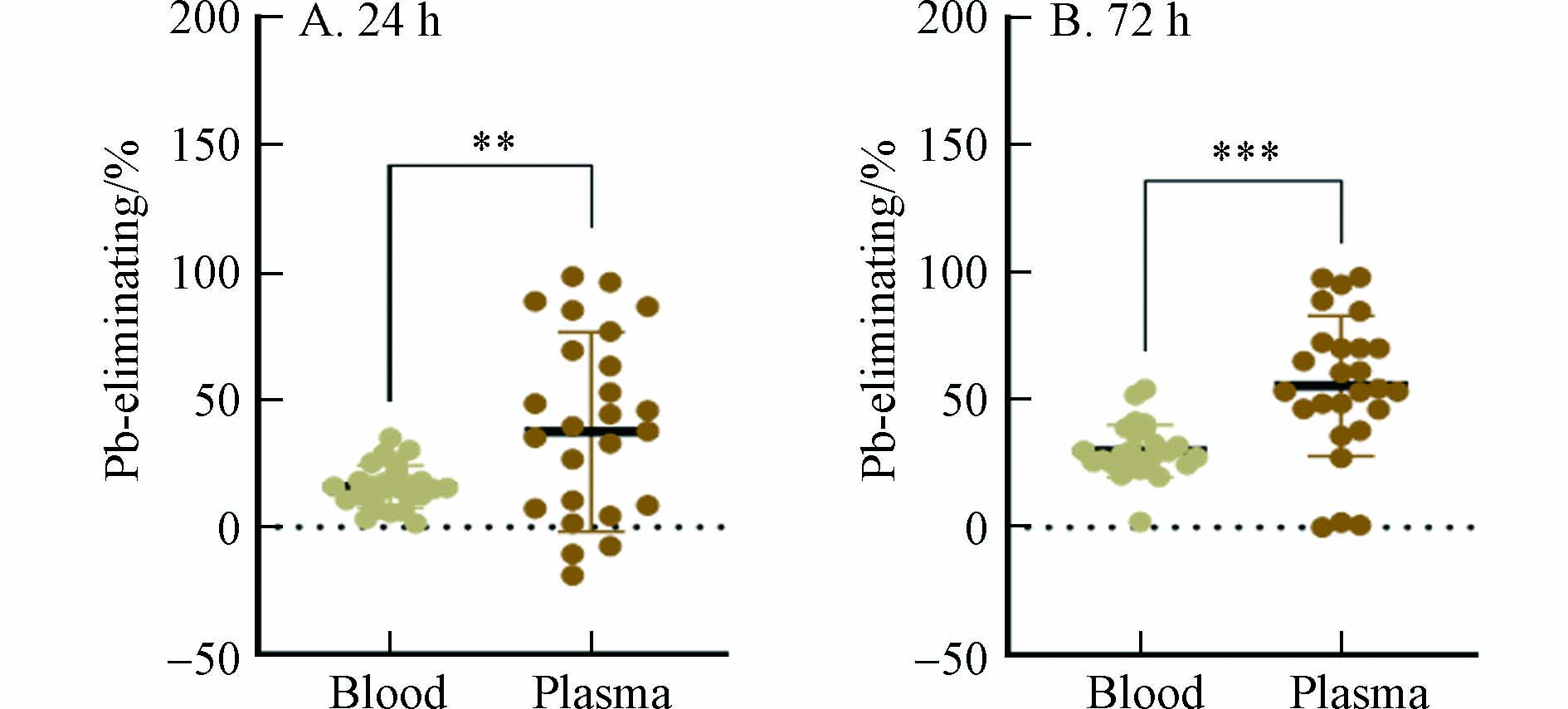
进一步研究发现,血铅和血浆铅的脱除率具有显著差异. 在用药后24 h,血浆铅的脱除率显著高于血铅,同样在用药后72 h,也存在类似的差别(图3). 说明血浆铅与EDTA的络合效率高于血细胞中铅. 血细胞中的铅主要与红细胞中的血红蛋白结合. 尽管EDTA与铅的络合物(结合常数为18.0)比血红蛋白与铅的络合物(结合常数为4.08)稳定[17],但是由于红细胞膜的空间隔离作用,EDTA较难与红细胞中的铅接触发生反应,而更易与血浆铅发生络合,因此,使得血浆铅的脱除率较高.
-
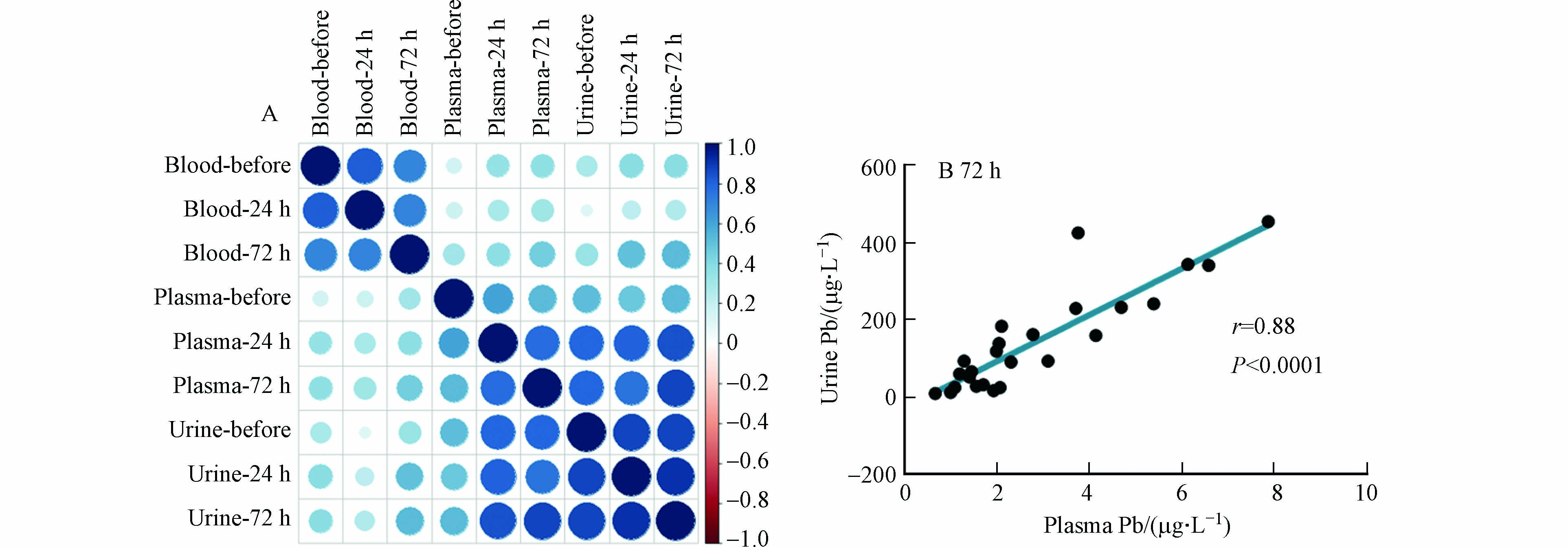
进一步研究显示,尿铅与血浆铅的相关性较强,而与血铅的相关性较弱(图4). 在用药后72 h,血浆铅和尿铅的皮尔逊相关系数高达0.88(P < 0.0001). 对比不同治疗阶段,用药后24 h和72 h的血浆铅与尿铅的相关性比用药前的强,这说明用药治疗促使血浆铅与尿铅的关联性增强. 用药后,EDTA主要与血浆铅发生络合反应,致使血浆铅优先通过尿液排出,因此血浆铅与尿铅的相关性增强. 已有研究显示,血铅和血浆铅之间以及血铅和尿铅之间均呈对数关系[18],这也说明血浆铅与尿铅具有线性相关性. 尽管血浆铅含量较低,但是其流动性和健康危害更大,可以穿过血脑屏障进入大脑组织,也可能穿过胎盘屏障进入胎儿体内. 研究表明,在母体血铅水平升高的情况下,发育中的胎儿可能因母体血浆铅升高而暴露于铅的风险高于全血铅水平所预测的风险[19]. 上述结果说明血浆铅可能是尿铅的直接来源,血浆铅的含量及变化是影响铅中毒患者治疗效果的重要因素.
血浆铅可以与其他组织器官直接进行物质交换,通过环境暴露从肺部或肠道吸收的铅,首先被吸收进入血浆,进一步可能被血细胞吸收,可能直接从血浆转移至骨骼、肝脏、脾脏或大脑,也可能进入肾脏,通过尿液排出体外. 同时,对于长期铅暴露人群,铅可能从骨骼或其他组织转移至血浆,成为血浆铅[20]. 血浆铅就如一个交换池,血浆铅的易变性也直接影响了铅中毒患者的治疗效果,比如急性铅暴露人群的血浆铅在较短时间内迅速升高,而后逐渐转移至骨骼或其他组织器官,因此对于急性暴露人群的治疗,越快接受治疗,其铅脱除效率可能越好. 铅在血浆和血细胞中的分配平衡可以显著影响血浆铅的含量及其变化. 由于血铅和血浆铅呈现对数关系,因此,当血铅含量较低时,血浆铅随血铅的升高而增加;当血铅含量较高时,血浆铅随着血铅的升高而迅速增加[18],这是因为血细胞中铅的结合接近或处于饱和状态,增加的血铅几乎全部分配于血浆中. 由此,可以推断当血铅含量超过血细胞的铅饱和状态时,铅中毒患者的治疗效果较好.
-
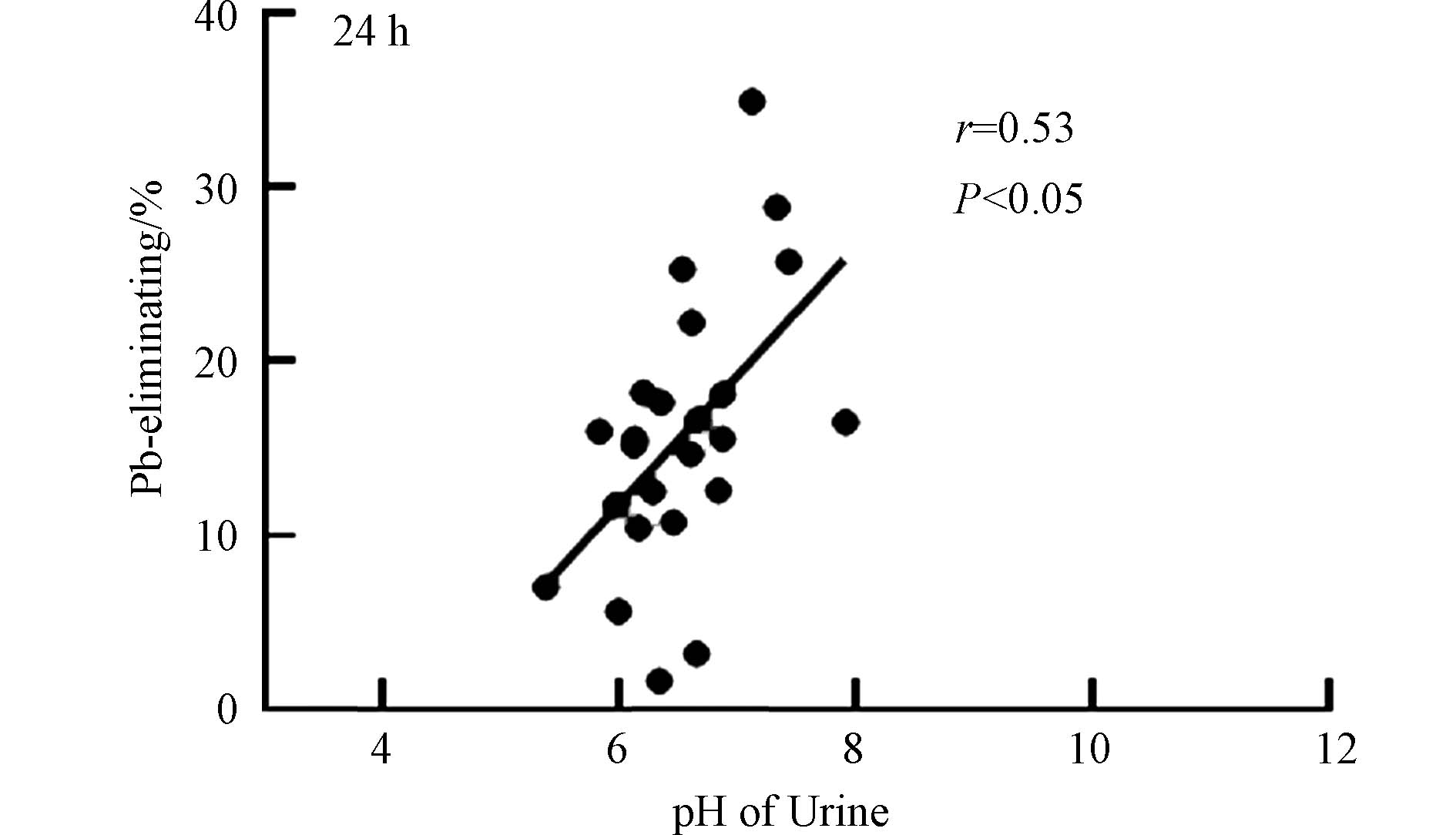
溶液pH是影响EDTA与Pb络合的重要参数. 尿液pH值也是重要的生物化学指标,反映肾脏调节体液酸碱平衡的能力,其变化与多种因素有关,包括每日摄入的食物酸碱性、糖尿病、肾炎等. 实验进一步测定了尿液的pH值,探究了尿液pH与铅中毒患者治疗效果的关系. 研究结果显示,尿液pH值与血铅的脱除率具有关联性,用药后24 h,血铅脱除率与pH值具有显著正相关(r = 0.53,P < 0.05)(图5),说明尿液pH增加可以促进血液中的铅排出体外. 已有较多研究工作探究了土壤pH对重金属的吸附以及生物利用性的影响,一般来说,随着pH值的增加,铅在土壤中的吸附量均呈现明显的上升趋势[21]. 在溶液的酸碱度呈碱性时,铅离子形成氢氧化铅沉淀[22]. 但目前关于人体体液pH值与铅含量变化的研究较少,pH值是影响人体生物化学反应的重要参数,也是评估人体健康的重要指标,因此pH值对铅脱除的影响值得更多的关注和研究.
驱铅治疗的效果与多种因素有关[23-24]. 血铅可以与其他组织器官发生铅交换. 当体内生理状态发生改变时,比如怀孕、骨骼中酸碱环境变化等,铅可能从骨骼中释放,转移至血液系统或其他软组织器官中[25]. 此外,CaNa2EDTA与铅的络合反应与多种生理因素有关,比如血液的酸碱度、血脂含量、其他二价金属含量等. 当血液中酸碱度发生变化,EDTA与铅的络合反应效率会发生变化;当其他二价金属含量较高时,也会与EDTA发生络合反应,从而降低了铅脱除率.
-
铅是广泛分布于环境中的有毒重金属,长期铅暴露可导致铅中毒. 本文对铅中毒患者治疗过程中的血铅、血浆铅、尿铅以及尿液pH值进行测定,分析铅浓度的变化趋势以及铅的脱除效率,进一步探究了铅中毒患者治疗效果的影响因素. 本次铅中毒患者在治疗过程中(用药前、用药后24 h、用药后72 h),血铅浓度呈现明显的下降趋势;大部分病人的血浆铅浓度也具有明显的连续降低趋势,而少部分血浆铅浓度先降低后升高;尿铅浓度呈现先升高后降低的趋势. 血液中铅的脱除率整体较低,不超过50%,血浆铅的脱除率显著高于血铅的脱除率. 血浆铅和尿液酸碱度是是影响铅中毒病人驱铅治疗效果的重要因素. 研究发现,尿铅与血浆铅的相关性较强,而与血铅的相关性较弱. 在用药后72 h,血浆铅和尿铅的皮尔逊相关系数高达0.88(P < 0.0001). 尿液pH值与血铅的脱除率具有关联性. 在用药后24 h,血铅脱除率与pH值具有显著正相关(r = 0.53,P < 0.05). 本研究可为提高铅中毒病人的驱铅治疗效果提供科学依据.
铅中毒患者驱铅治疗效果的影响因素
Factors on the effect of lead-elimination treatment in lead-poisoned patients
-
摘要: 铅是有毒的环境污染物,铅中毒严重危害人体健康. 静脉注射依地酸二钠钙(CaNa2EDTA)是目前临床上最常使用的驱铅治疗方法,但其治疗效果不令人满意,治疗效果的影响因素有待进一步探究. 本文以铅中毒患者作为研究对象,使用CaNa2EDTA进行驱铅治疗,分别在用药前、用药后24 h以及用药后72 h测定全血、血浆和尿液中的铅含量以及尿液的酸碱度(pH值),分析了铅中毒患者在驱铅治疗过程中,血铅、血浆铅和尿铅的变化趋势和铅脱除率,并进一步探究了影响铅脱除率的因素. 实验结果显示,随着用药治疗,血铅和血浆铅逐渐降低,同时尿铅升高;血浆铅的脱除率显著高于血铅,说明血浆铅与EDTA的络合效率高于血细胞中铅;尿铅与血浆铅呈正相关关系,而与血铅的相关性较弱,说明血浆铅是影响驱铅治疗效果的重要因素;用药后24 h,尿液pH值与血铅脱除率呈显著正相关关系,说明尿液酸碱度可能是影响驱铅治疗效果的重要参数. 本研究为提高铅中毒患者驱铅治疗效果提供了重要依据.Abstract: Lead (Pb) is a toxic environmental pollutant, and Pb poisoning seriously threatens human health. The most commonly used Pb-eliminating treatment in clinical practice is intravenous injection of calcium disodium edetate (CaNa2EDTA). However, the therapeutic effect is unsatisfactory, and the factors that influence it need to be investigated further. Pb-poisoned patients were used as research subjects in this paper and CaNa2EDTA was used in the Pb-eliminating treatment. The Pb concentration in whole blood, plasma, urine, and urine pH were all measured before medication, as well as 24 and 72 hours later. The changing trend of blood Pb, plasma Pb, urine Pb, and their Pb elimination rate during Pb-eliminating treatment and the factors influencing Pb elimination rate were investigated. The results showed that the elimination rate of plasma Pb was significantly higher than that of blood Pb, indicating that the complexation efficiency of plasma Pb and EDTA was higher than that of Pb in blood cells. Urine Pb was found to be positively related to plasma Pb, whereas the correlation between urine Pb and blood Pb was weak, indicating that plasma Pb is an important factor influencing the treatment effect of Pb elimination. The urine pH was found to be positively correlated with the blood Pb elimination rate 24 hours after medication, indicating that urine pH could be an important factor influencing the therapeutic effect of Pb elimination. This study provides an important basis for improving the therapeutic effect of Pb poisoning.
-
Key words:
- Pb poisoning /
- treatment effect /
- factors /
- plasma Pb /
- blood Pb /
- urine Pb /
- pH.
-

-
表 1 铅中毒患者的统计数据
Table 1. Demographic data of the participants
年龄
Age身体质量指数/(kg·m−2)
Body mass index男
Male女
Female40.2 ± 7.2 22.4 ± 2.3 19 (79.2%) 5 (20.8%) -
[1] World lead consumption 2004-2020[EB/OL]. [2022-3-4] Statista Research Department, 2021. [2] World lead consumption 2004-2020[EB/OL]. [2022-3-4]. Statista Research Department, 2012. [3] 王玺凯, 刘媛, 沈敏, 等. 铅接触工人血铅水平对职业健康检查指标的影响 [J]. 临床医学研究与实践, 2019, 4(11): 78-79. WANG X K, LIU Y, SHEN M, et al. Effect of blood lead level on occupational health examination indicators in lead exposed workers [J]. Clinical Research and Practice, 2019, 4(11): 78-79(in Chinese).
[4] 窦建瑞. 职业性铅中毒的预防 [J]. 劳动保护, 2020(8): 74-76. doi: 10.3969/j.issn.1000-4335.2020.08.033 DOU J R. Prevention of occupational lead poisoning [J]. Labour Protection, 2020(8): 74-76(in Chinese). doi: 10.3969/j.issn.1000-4335.2020.08.033
[5] KASTURY F, SMITH E, LOMBI E, et al. Dynamics of lead bioavailability and speciation in indoor dust and X-ray spectroscopic investigation of the link between ingestion and inhalation pathways [J]. Environmental Science & Technology, 2019, 53(19): 11486-11495. [6] FLORA G, GUPTA D, TIWARI A. Toxicity of lead: A review with recent updates [J]. Interdisciplinary Toxicology, 2012, 5(2): 47-58. doi: 10.2478/v10102-012-0009-2 [7] ZHOU C C, GAO Z Y, WANG J, et al. Lead exposure induces Alzheimers's disease (AD)-like pathology and disturbes cholesterol metabolism in the young rat brain [J]. Toxicology Letters, 2018, 296: 173-183. doi: 10.1016/j.toxlet.2018.06.1065 [8] WAN C, PAN S X, LIN L F, et al. DNA methylation biomarkers of IQ reduction are associated with long-term lead exposure in school aged children in Southern China [J]. Environmental Science & Technology, 2021, 55(1): 412-422. [9] 张晴, 张斌, 赵静, 等. 环境相关浓度铅暴露诱导斑马鱼仔鱼神经行为毒性 [J]. 环境化学, 2018, 37(3): 445-452. doi: 10.7524/j.issn.0254-6108.2017080905 ZHANG Q, ZHANG B, ZHAO J, et al. Neurobehavioral toxicity of zebrafish larvae caused by lead exposure at environmentally relevant concentrations [J]. Environmental Chemistry, 2018, 37(3): 445-452(in Chinese). doi: 10.7524/j.issn.0254-6108.2017080905
[10] FLORA S J S, AGRAWAL S. Chapter 31-Arsenic, Cadmium, and Lead//GUPTA R C, ed. Reproductive and Developmental Toxicology (Second Edition) [M]. Academic Press, 2017: 537-566. [11] SILVER M K, LI X Q, LIU Y H, et al. Low-level prenatal lead exposure and infant sensory function [J]. Environmental Health:a Global Access Science Source, 2016, 15(1): 65. [12] LANPHEAR B P, RAUCH S, AUINGER P, et al. Low-level lead exposure and mortality in US adults: A population-based cohort study [J]. The Lancet Public Health, 2018, 3(4): e177-e184. doi: 10.1016/S2468-2667(18)30025-2 [13] 乔增运, 李昌泽, 周正, 等. 铅毒性危害及其治疗药物应用的研究进展 [J]. 毒理学杂志, 2020, 34(5): 416-420. doi: 10.16421/j.cnki.1002-3127.2020.05.016 QIAO Z Y, LI C Z, ZHOU Z, et al. Progress in lead toxicity research and therapeutic drug development [J]. Journal of Toxicology, 2020, 34(5): 416-420(in Chinese). doi: 10.16421/j.cnki.1002-3127.2020.05.016
[14] WAN M M, XU T T, CHI B, et al. A safe and efficient strategy for the rapid elimination of blood lead In Vivo based on a capture-fix-separate mechanism [J]. Angewandte Chemie International Edition, 2019, 58(31): 10582-10586. doi: 10.1002/anie.201904044 [15] KWON S Y, BAE O N, NOH J Y, et al. Erythrophagocytosis of lead-exposed erythrocytes by renal tubular cells: Possible role in lead-induced nephrotoxicity [J]. Environmental Health Perspectives, 2015, 123(2): 120-127. doi: 10.1289/ehp.1408094 [16] HU H, RABINOWITZ M, SMITH D. Bone lead as a biological marker in epidemiologic studies of chronic toxicity: Conceptual paradigms [J]. Environmental Health Perspectives, 1998, 106(1): 1-8. doi: 10.1289/ehp.981061 [17] BARLTROP D, SMITH A. Lead binding to human haemoglobin [J]. Experientia, 1972, 28(1): 76-77. doi: 10.1007/BF01928273 [18] SOMMAR J N, HEDMER M, LUNDH T, et al. Investigation of lead concentrations in whole blood, plasma and urine as biomarkers for biological monitoring of lead exposure [J]. Journal of Exposure Science & Environmental Epidemiology, 2014, 24(1): 51-57. [19] LAMADRID-FIGUEROA H, MARÍA TÉLLEZ-ROJO M, HERNÁNDEZ-CADENA L, et al. Biological markers of fetal lead exposure at each stage of pregnancy [J]. Journal of Toxicology and Environmental Health, Part A, 2006, 69(19): 1781-1796. doi: 10.1080/15287390600630195 [20] SILBERGELD E K, SAUK J, SOMERMAN M, et al. Lead in bone: Storage site, exposure source, and target organ [J]. Neurotoxicology, 1993, 14(2/3): 225-236. [21] YOU X J, LIU S G, DAI C M, et al. Effects of EDTA on adsorption of Cd(II) and Pb(II) by soil minerals in low-permeability layers: Batch experiments and microscopic characterization [J]. Environmental Science and Pollution Research International, 2020, 27(33): 41623-41638. doi: 10.1007/s11356-020-10149-9 [22] KIM S H, CHUNG H, JEONG S, et al. Identification of pH-dependent removal mechanisms of lead and arsenic by basic oxygen furnace slag: Relative contribution of precipitation and adsorption [J]. Journal of Cleaner Production, 2021, 279: 123451. doi: 10.1016/j.jclepro.2020.123451 [23] POTULA V, KAYE W. The impact of menopause and lifestyle factors on blood and bone lead levels among female former smelter workers: The Bunker Hill Study [J]. American Journal of Industrial Medicine, 2006, 49(3): 143-152. doi: 10.1002/ajim.20262 [24] WEYERMANN M, BRENNER H. Factors affecting bone demineralization and blood lead levels of postmenopausal women—A population-based study from Germany [J]. Environmental Research, 1998, 76(1): 19-25. doi: 10.1006/enrs.1997.3780 [25] LIU N, HUANG Y S, ZHANG H Z, et al. Unified probability distribution and dynamics of lead contents in human erythrocytes revealed by single-cell analysis [J]. Environmental Science & Technology, 2021, 55(6): 3819-3826. -



 下载:
下载: