-
目前国内对渗滤液处理大多采用“预处理+生物处理+膜深度处理”的主流工艺. 其中,采用纳滤或反渗透滤等膜分离系统不可避免会产生占渗滤液处理总量约20%—30%的浓缩液[1]. 其中反渗透膜滤浓缩液中COD的浓度范围在500—1500 mg·L−1,其中腐殖质含量较高,占总TOC的27.4%—52.3%,总氮100—200 mg·L−1,其中有机氮含量较高,占总氮的50%—60%,同时浓缩液含盐量较高,电导率为7.53—20.05 ms·cm−1,处理难度极大,是众多垃圾填埋场面临的难题之一.
目前,对于浓缩液中有机物的处理已形成比较成熟的技术,如两级物料膜技术,臭氧高级氧化技术可以对有机物中腐殖质进行有效的分离和降解[2-3],而总氮的去除依然是处理的重点和难点. 对于总氮的去除,目前普遍采用的是生物处理技术,如A2/O技术[4],由于浓缩液可生化性差、有机氮含量高且盐度极高,导致传统脱氮微生物难以在极端环境下有效脱氮[5-7];耐盐微生物和嗜盐微生物在处理高含盐废水中发挥积极作用,通过耐盐菌或嗜盐菌接种强化活性污泥是处理含盐废水的最佳方法. 利用耐盐菌强化活性污泥处理硫酸钠质量分数为38%的精细化工行业产生的废水,其对COD的去除率大于95%[8];郭立[9]分离筛选出针对高含盐垃圾渗滤液中COD的降解菌种. 大多数的研究只关注COD的去除,对脱氮的关注较少,仅有的强化耐盐菌,也是传统的强化硝化菌和反硝化菌,由于渗滤液浓缩液水质差异较大,本研究处理的RO浓液有机氮含量较高,而对于强化有机氮氨化和好氧反硝化强化菌研究鲜有报道. 此外,目前对于高级氧化处理前后有机物变化研究较多,厌氧/好氧生物处理过程中有机物的去除效果研究较多,而对于处理过程中有机物成分的变化研究较少[8-10]. 因此,如何脱除渗滤液浓缩液中有机物和总氮,使渗滤液浓缩液达标排放仍是迫切需要解决的问题.
团队前期研究中开发了在高盐条件下仍具有良好的生长态势和污染物降解效果的厌氧耐盐菌TN-YN和好氧耐盐菌TP-HN,将耐盐菌与活性污泥法相结合耦合催化臭氧氧化,构建一种垃圾渗滤液反渗透膜滤浓缩液的处理方法. 在高盐条件下,通过厌氧耐盐菌的氨化作用先将浓缩液中有机氮转化为氨氮,再通过具有好氧反硝化功能的好氧耐盐菌强化好氧活性污泥,在好氧条件下实现NH4+-N、TN的同步去除[11],解决传统A2/O技术在高盐条件下反硝化受到抑制的问题,再通过催化臭氧氧化对难降解有机物的去除,确保出水中COD、TN达标排放. 同时,对比活性污泥、耐盐菌剂、活性污泥+耐盐菌剂3个体系的污染物去除效果、有机物去除效果和生物多样性变化,进一步探讨体系的脱氮机理,为揭示耐盐菌强化机理提供科学依据.
-
本实验采用A/O+催化臭氧氧化处理垃圾渗滤液RO浓液,实验装置如图1所示. 图1(a)为厌氧实验装置,3组500 mL锥形瓶,磁力搅拌水浴锅进行加热搅拌. 图1(b)为好氧实验装置,3组500 mL锥形瓶,磁力搅拌水浴锅进行加热搅拌,曝气泵提供曝气. 图1(c)为催化臭氧氧化实验装置,包括纯氧钢瓶(浓度为99.999%)、臭氧发生器(广州创环,CH-ZTWSG)、催化臭氧氧化反应主体及尾气处理装置,反应器主体为有效容积500 mL的锥形瓶,尾气采用30% KI溶液吸收后排入空气.
-
实验用水为某垃圾填埋场垃圾渗滤液RO浓液,水质情况见下表1.
-
本实验中的耐盐厌氧菌(产品型号:TN-YN,主要成分含深红红球菌C1、莱比托游动球菌、铜绿假单胞菌、粪产杆菌和不动杆菌,专利申请号: 202110419569.1)和耐盐好氧菌(产品型号: TP-HN,主要成分含醋酸钙-不动杆菌TAJ-1、施氏假单胞菌、反硝化盐单胞菌和贪铜菌SWA1,专利申请号: 201911106185.3)均为团队前期研发,其中耐盐好氧菌剂中含有具有异养硝化-好氧反硝化功能的菌株,可在好氧条件下实现NH4+-N、TN同步去除.
-
实验污泥取自巴南区高速公路服务区污水处理设备. 厌氧活性污泥体系中污泥浓度4—6 g·L−1,污泥沉降比(SV30)60%—70%;好氧活性污泥体系中污泥浓度2.5—4.0 g·L−1,SV30范围30%—40%.
-
催化臭氧氧化所用催化剂为制备的粉末活性炭负载金属铈. 其制备采用传统的浸渍-低温灼烧法,对粉末活性炭进行改性. 活性炭于5%稀盐酸溶液中煮沸1 h,过滤并用去离子水冲洗至中性,110 ℃烘箱中烘干保存备用. 将1% wt的 Ce(NO3)3浸渍液3 mL均匀的滴在AC粉末上,风干后制备催化剂. 最后将风干的催化剂放入管式炉中,氮气作为保护气,以3 ℃·min−1升温至450 ℃并恒温煅烧2 h,冷却后得到Ce-AC催化剂(催化剂制备中所使用的粉末活性炭采购自上海泰坦科技,规格为200 目,所使用的负载物 Ce(NO3)3·6H2O 晶体采购自成都科隆).
-
研究过程中水质和污泥的检测均参照水和废水监测方法第四版中国标法进行,具体方法如表2所示.
-
厌氧生物强化对比实验:首先向3组锥形瓶中加入垃圾渗滤液浓缩液500 mL(每组试验分别进行3组平行试验),分别向3组锥形瓶中加入体积比1%的活化厌氧耐盐菌剂、10%体积的厌氧活性污泥、1%的活化厌氧耐盐菌剂+10%体积的厌氧活性污泥,最后分别向3组锥形瓶加入1 g无水亚硫酸钠(创造厌氧环境),用橡胶塞密封,由伸入液面以下的水样采集管向锥形瓶中持续通入氮气30 min去除水中溶解氧. 置于磁力搅拌水浴锅中加热搅拌,在溶解氧<0.1 mg·L−1,温度(30±1)℃,磁力搅拌转速10—20 r·min−1条件下运行,运行处理8 d后达到稳定状态,每24 小时取样检测.
厌氧耐盐菌的活化的具体步骤如下:称量5 g的耐盐厌氧菌剂(TN-YN)粉末加入装有100 mL自来水的锥形瓶中,加入1 mL菌种激活剂(采购重庆士继生态环境科技有限公司,产品型号:JH-1,主要成分含产甲烷细菌、假单胞菌、乳酸菌、酵母菌、活化剂等,活菌含量≥100亿·g−1),加入5 g的葡萄糖(一水,分析纯,采购自成都市科隆化学品有限公司),加0.6 g的无水亚硫酸钠(分析纯,采购自成都市科隆化学品有限公司),放置在30 ℃的恒温水浴锅静置活化24 h,每隔6—8 h混匀1次,最终形成活化好的菌液,菌液浓度OD值为1.4—1.5.
好氧生物强化对比实验:将厌氧处理稳定后的出水400 mL倒入锥形瓶中,以无水乙酸钠补加200 mg·L−1碳源,向厌氧耐盐菌体系及厌氧耐盐菌+活性污泥体系中各加入体积比0.2%的活化好氧耐盐菌剂. 置于磁力搅拌水浴锅中加热搅拌,在溶解氧2—3 mg·L−1,温度(30±1)℃,磁力搅拌转速600—620 r·min−1条件下运行,运行处理4 d后达到稳定,每24 小时取样检测.
好氧耐盐菌活化的具体步骤如下:称量5 g的耐盐好氧菌TP-HN粉末加入装有100 mL自来水的锥形瓶中,加入1 mL菌种激活剂(采购自重庆士继生态环境科技有限公司,产品型号:JH-1,主要成分由能形成芽孢(内生孢子)的杆菌或球菌组成,活菌含量≥100亿·g−1),加入5 g的葡萄糖(一水,分析纯,采购自成都市科隆化学品有限公司),放置在30 ℃的恒温摇床进行活化,摇床转速150 r·min−1,活化24 h,最后形成活化好的菌液,菌液浓度OD值为1.7—1.8.
-
臭氧催化氧化反应在图1(c)所示反应装置中进行,取好氧反应出水300 mL于500 mL锥形瓶中,加入5 g Ce-AC,进气臭氧浓度为90 mg·L−1,臭氧流量为1 L·min−1[12],在恒定温度30 ℃条件下反应3 h.
-
获取活性污泥、耐盐菌和活性污泥+耐盐菌体系稳定运行的生物样样品,储存在−80 ℃环境下的0.9%生理盐水中,分别标记为:A1、A2、A3、B1、B2和B3,利用MobioPowerSoil® DNA Isolation Kit提取固定化菌液总基因组DNA后采用MiSeq平台对16S rDNA基因高变区序列进行测序以进行生物多样性分析,考察不同体系对系统中微生物群落结构的影响. 为了确保每个扩增子的长度大于550 bp,使用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)扩增16S rRNA V3/V4区域. 采用Trimmomatic和FLAH获得清晰的读取,并使用uparse方法在usearch平台上根据97%的相似阈值将序列划分为多个组.
-
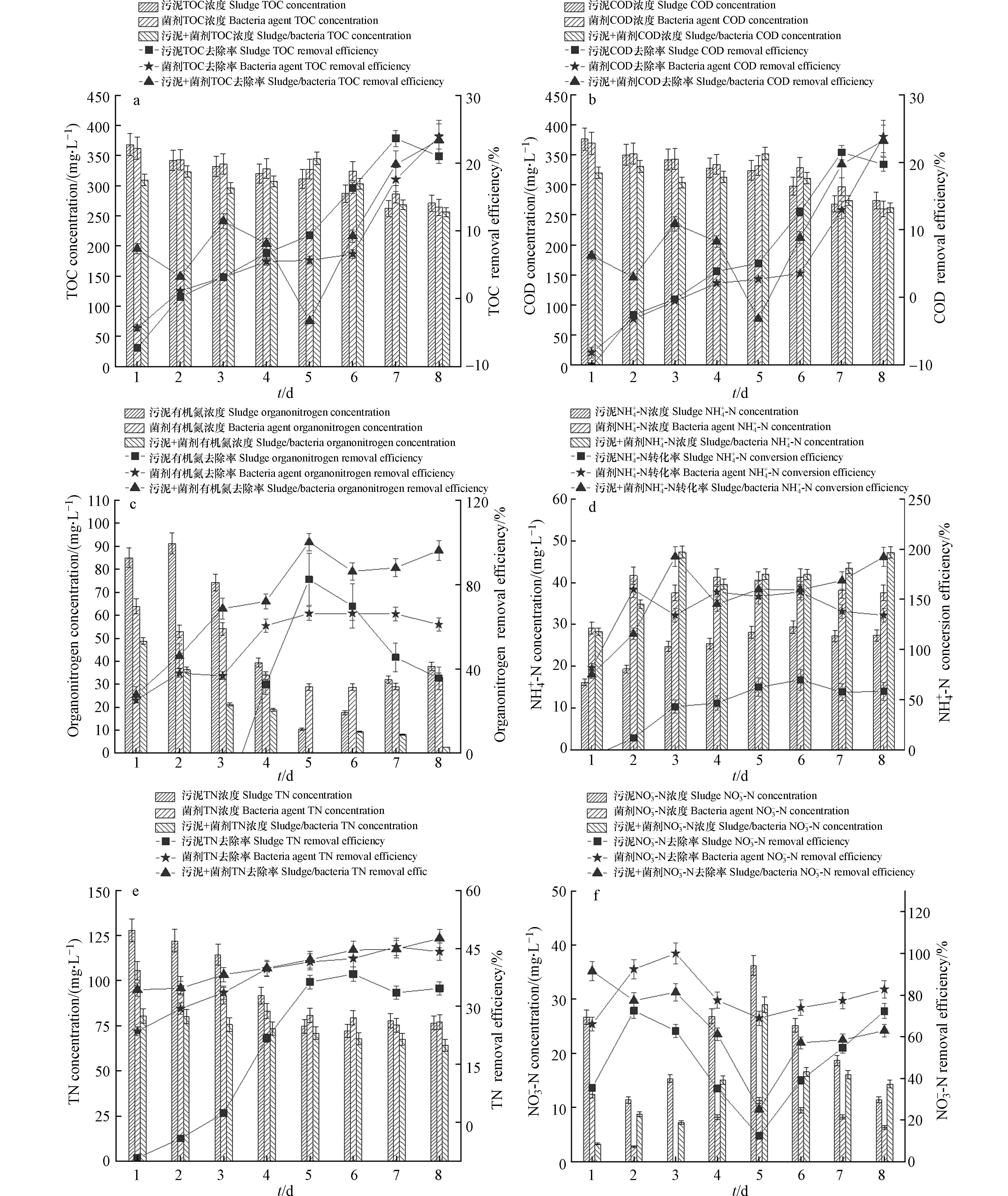
厌氧条件下,如图2(a,b),厌氧耐盐菌、厌氧活性污泥和厌氧耐盐菌+厌氧活性污泥3个体系的TOC和COD去除效果无明显差别. 3个体系出水稳定后,如图2(c)所示,有机氮含量分别为37.7、33.2、2.7 mg·L−1,厌氧耐盐菌+厌氧活性污泥有机氮的转化率最高为97%,较单独厌氧活性污泥和耐盐菌体系有机氮的转化率分别提高了42%和37%,从图2(d)中可以看出,3个体系的NH4+-N浓度均出现上升趋势,出水NH4+-N浓度分别提高了62%、160%和193%,可能是厌氧氨氧化细菌的氨化作用,将有机氮转化为NH4+-N[13];盐度会对体系的氨氧化效率产生影响[14],而厌氧耐盐菌体系+厌氧活性污泥体系对有机氮的转化效果最好,可能是在厌氧环境中,厌氧耐盐菌强化厌氧活性污泥体系,提高体系微生物耐盐耐毒性,使体系中厌氧微生物增多,氨化细菌对有机氮实现氨化作用,将其转化为NH4+-N[15].
如图2(e, f)所示,厌氧耐盐菌体系、厌氧耐盐菌体系+厌氧活性污泥体系的TN去除率无显著差别,TN的去除主要是由于厌氧过程中的反硝化作用去除NO3−-N使得出水TN降低.
-
对厌氧出水进行好氧处理. 如图3(a,b)所示,好氧耐盐菌、好氧活性污泥和好氧耐盐菌+好氧活性污泥3个体系对TOC和COD的去除效率无明显差别,均为37%左右. 根据图3(c, d, e)所示,3个体系的NH4+-N去除率分别为88%、92%、97%,姜海凤等[10]研究表明,当进水盐度从1%增加至5%,其NH4+-N的去除率由90%降至45%以下,将蜡状芽孢杆菌耐盐菌引入活性污泥中,强化体系对盐度的耐受性,当盐度为5%,其NH4+-N的去除率高于70%,这一结果说明蜡状芽孢杆菌生物强化能显著提高体系的耐盐特性和污染物去除效果;NO3−-N最大去除率分别为-169%、49%、61%;好氧耐盐菌+好氧活性污泥体系对TN去除率最高为85%,较单独好氧活性污泥和耐盐菌体系TN去除率分别分别提升了37%和77%. 其中好氧耐盐菌+好氧活性污泥体系对NH4+-N、NO3−-N、TN的去除效果明显高于另外两个体系,出水浓度分别为1.4 mg·L−1、5.6 mg·L−1、9.4 mg·L−1. 本研究将好氧耐盐菌加入活性污泥体系中,能够显著提高NH4+-N、TN的去除效果,推测好氧耐盐菌强化活性污泥体系,提高其体系中耐盐硝化、反硝化菌的丰度,在高盐条件下对系统脱氮发挥关键作用,从而显著提高脱氮效果.
-
渗滤液浓缩液经过厌氧/好氧处理后,出水NH4+-N、TN均满足我国制定的《生活垃圾填埋场污染控制标准》(GB16889—2008)中表2规定水污染物排放浓度限值,但COD依然无法达到排放要求,因此,对好氧活性污泥+好氧耐盐菌体系的出水进行催化臭氧氧化实验,臭氧在催化剂的作用下,产生氧化还原电位更高的羟基自由基(·OH),实现COD和TN的同步去除. 在这一过程中,难降解有机物结构被破坏,有机氮被分解,并对氮素有一定吹脱,实现总氮的去除. 如表3所示,经过耐盐菌生物强化耦合催化臭氧氧化处理渗滤液RO浓缩液,其出水COD、NH4+-N、TN均低于排放浓度限值.
-
由表4可知原水中含有苯、碳碳双键、碳氧双键等不饱和结构的化合物,其余多为烷烃类物质,这些化学结构的有机污染物属于难生物降解的物质,其中一些有毒有害物质会对微生物产生毒害作用,导致渗滤液RO浓缩液难生物降解[16]. RO浓液经厌氧、好氧处理后,废水中的直链长烷烃有所减少,好氧出水经催化臭氧氧化后,由于直链长烷烃的不完全氧化,分子量较大,难进一步降解,长链烷烃被氧化为醇类、酮类等物质,水中的一些不饱和键断裂,以及一些含有苯环结构的化合物被转化为苯的同系物,说明废水中的有些物质只能被转化,不能被彻底降解[17];催化臭氧氧化对难降解的大分子物质断裂成小分子化合物,可以提高对有机物的处理效果,从而达到对有机物的降解作用.
-
多样性指数分析系统中生物群落均匀度和丰富度的多样性特征,微生物α多样性结果如表5所示,其中A1、A2、A3、B1、B2、B3分别代表厌氧污泥体系、厌氧耐盐菌体系、厌氧活性污泥+厌氧耐盐菌体系、好氧污泥体系、好氧耐盐菌体系、好氧活性污泥+好氧耐盐菌体系. 6个样品的覆盖率均在99.7%以上,表明所获得的序列可以覆盖大部分微生物,Shannon指数和Simpson指数结果表明,在厌氧污泥体系中,微生物种类相对较少,说明厌氧耐盐菌的加入可以提高体系微生物多样性;好氧污泥+好氧耐盐菌体系微生物种类相对较高. Ace和Chao指数表明,厌氧活性污泥+厌氧耐盐菌和好氧污泥+好氧耐盐菌体系微生物的丰富度和多样性较高,与污染物的去除规律相一致.
图4分别为厌氧和好氧条件下,各体系中的微生物多样性结果,如图4(b、e)所示,随着测序深度增加,稀释曲线趋于平坦,表明可以准确地描述各体系的物种多样性. Venn图结果表明各个体系中共有和独有的OTUs分布. 图4(c)的结果表明,厌氧体系中观察到的OTUs为581个,其中,14.28%为各个体系中均存在的,而37.86%的OTUs是特定体系所独有的. 图4(f)的结果表明,好氧系统中共检测到的OTUs为631个,各个体系中均存在的占27.73%,不同体系中独有的占比为33.91%.
-
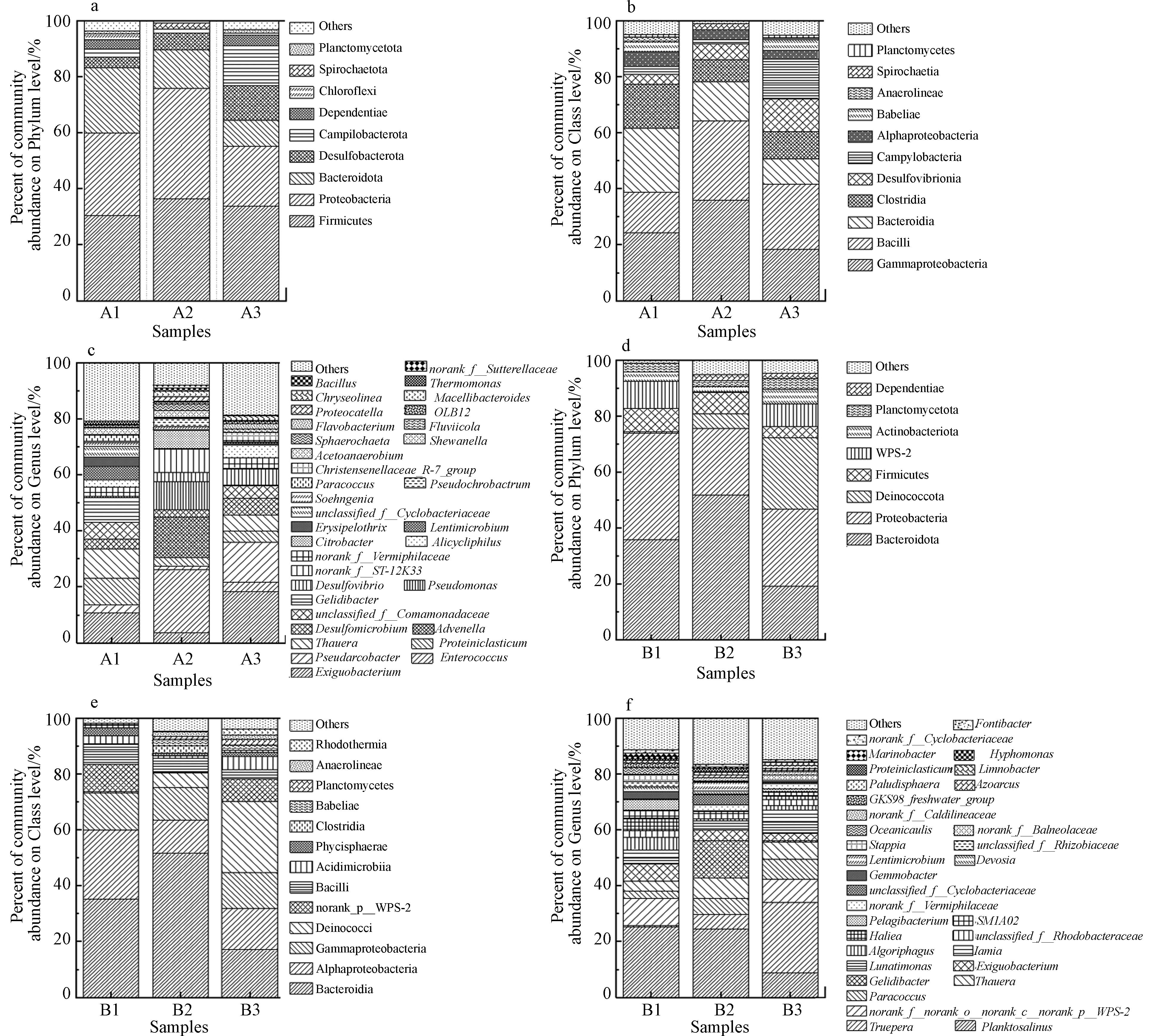
如图5(a)所示,厌氧活性污泥+厌氧耐盐菌体系优势菌门中,Desulfobacterota(12.45%)包含大量反硝化脱硫菌,部分菌属还具有耐盐特性[18-20];Campilobacterota(14.28%)含有大量氨化细菌以实现有机氮的转化[21],Desulfobacterota、Campilobacterota为高盐条件下有机氮转化发挥关键作用. 如图5(d)所示,好氧活性污泥+好氧耐盐菌体系优势菌门中,Proteobacteria(27.77%)是反硝化细菌中种类中最多的一类[22],Deinococcota(25.32%)、Actinobacteriota(5.34%)中包含大量具有耐盐能力的异养硝化细菌[23],可以维持体系的高效脱氮.
如图5(b)所示,厌氧活性污泥+厌氧耐盐菌体系中相对丰度最高的4个菌纲为Gammaproteobacteria(γ-变形菌纲)、Bacilli(芽孢杆菌纲)[24]、Desulfovibrionia(脱硫弧菌纲)、Campylobacteria(弯曲菌纲),其相对丰度分别为18.33%、23.32%、9.05%和9.69%,其中Gammaproteobacteria[25]在有机物的去除过程中起着重要作用. 如图5(e)所示,好氧活性污泥+好氧耐盐菌体系中的优势菌纲中,Alphaproteobacteria是体系中主要好氧反硝化菌,Deinococci(异常球菌纲)中的Truepera,能在碱、盐及高温的条件中生长[26]. 因此,推测Alphaproteobacteria(14.87%)、Deinococci(25.32%)为高盐条件下保障体系NH4+-N、TN去除效果的主要菌纲.
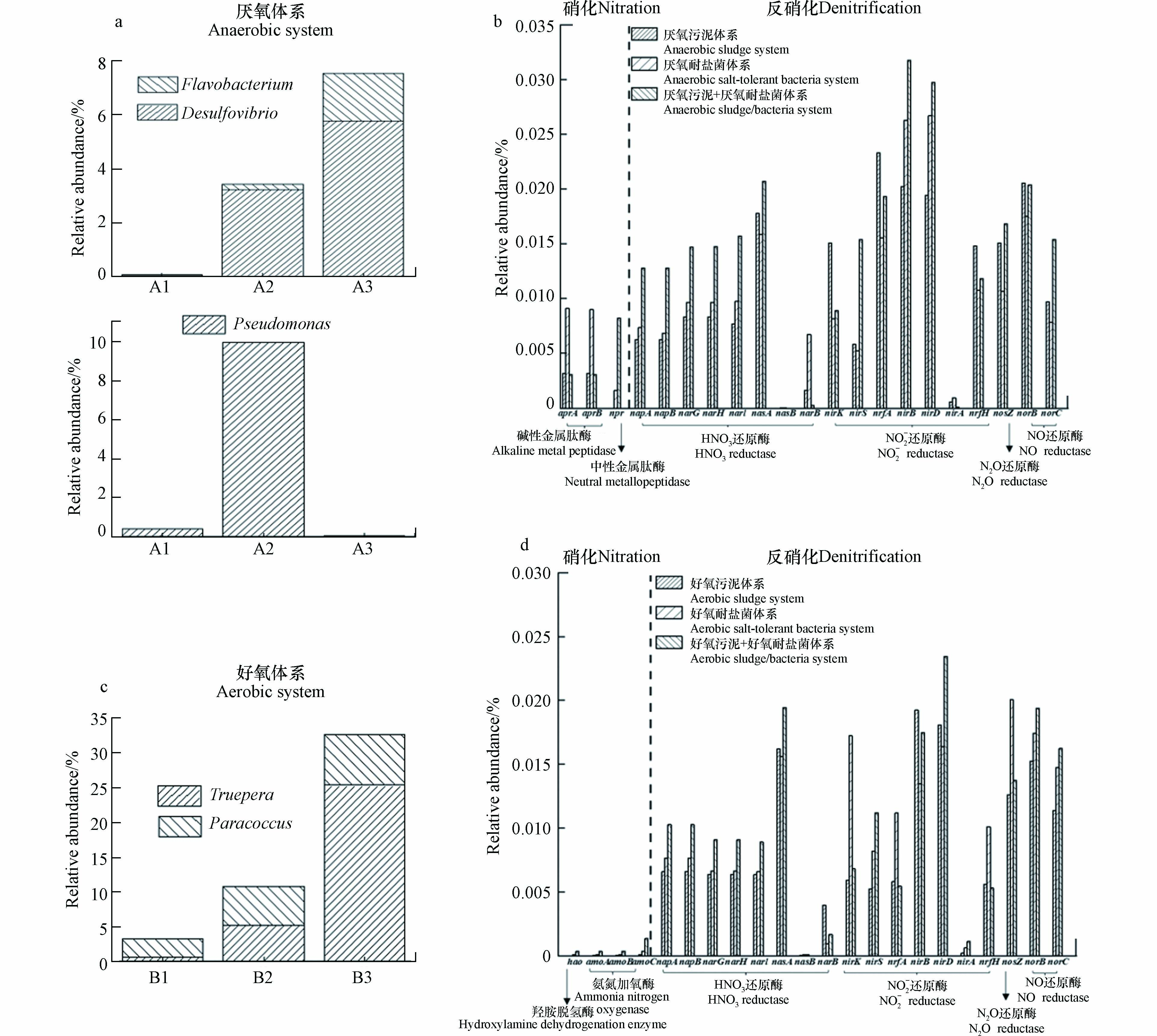
由图5(c)可见,厌氧耐盐菌强化厌氧活性污泥体系后优势菌属丰度增加,Flavobacterium(黄杆菌属)、Desulfovibrio(脱硫弧菌属)相对丰度上升,其相对丰度分别为1.78%和5.77%,其中,Flavobacterium是环境中的主导蛋白水解细菌,可以有效降解环境中的有机氮,同时,也具有一定的耐盐特性[27-28]. 结合各体系对污染物的去除效果,推测Flavobacterium是高盐条件下有机氮转化过程中发挥关键作用的菌属. 如图5(f)所示,好氧活性污泥+好氧耐盐菌体系中Paracoccus(副球菌属)、Truepera(特吕珀菌属)的相对丰度较另外两个体系均有所上升,其相对丰度分别为7.27%和25.32%,且均有耐盐的特性,其中Paracoccus为异养硝化-好氧反硝化菌[29],Truepera是好氧异养菌,能耐受极端环境[30],随着好氧耐盐菌加入好氧活性污泥体系中,系统优势菌属发生显著变化,与系统污染物去除规律相一致,推测Truepera、Paracoccus是高盐条件下高效脱氮的主要菌属.
-
根据京都基因和基因组百科全书(KEGG)数据库(http://www.genome.jp/kegg/),采用PICRUST2对6组体系中氮的迁移进行了研究. 如图6所示,有4种与硝化相关功能基因:羟胺脱氢酶和氨单加氧酶,11种反硝化相关功能基因,包括硝酸还原酶、一氧化氮还原酶、亚硝酸盐还原酶和一氧化二氮还原酶有关的基因.
氨化过程最终由微生物功能基因控制,蛋白酶在氨化过程中起重要作用,蛋白酶基因包括apr、npr等基因. 由图6(b)可知,厌氧耐盐菌体系中的apr基因(0.0181%)相对丰度最高,而apr存在于Pseudomonas中;Flavobacterium是许多土壤中的主导蛋白水解细菌,可以分泌中性金属蛋白酶[31],而厌氧活性污泥+厌氧耐盐菌体系中npr基因(0.0082%)的相对丰度最高,也在基因水平上进一步证明Flavobacterium是有机氮降解的关键菌属,因此,推测npr基因表达更有利于高盐条件下有机氮的降解.
如图6(c)所示,Truepera、Paracoccus为好氧体系中的优势菌属,其在不同体系下的相对丰度变化情况与污染物去除效果保持一致. 氨单加氧酶是氨氮氧化成亚硝酸盐的硝化作用中限制性步骤的关键酶,由amoA,amoB和amoC编码的3个亚基组成,有研究发现,自养硝化菌中存在amoA基因[32],编码羟胺氧化酶的编码基因hao是硝化过程中关键基因,能将羟胺氧化成亚硝酸盐[33]. 如图6(d)所示,好氧活性污泥+好氧耐盐菌体系中amo、hao基因,硝酸盐还原基因napA、napB、nasA、narG、narF、narI的相对丰度均高于另外两个体系,其相对总丰度分别为0.0023%和0.0476%,硝酸盐还原酶可将硝酸盐还原为亚硝酸盐[34];好氧耐盐菌强化活性污泥体系后,其亚硝酸盐还原基因nirS、nirA、nirD相对丰度均有显著上升,相对丰度为0.0357%,亚硝酸盐还原酶也是反硝化过程的关键酶,将亚硝态氮还原转化为NO[35]. 综上所述,好氧耐盐菌强化活性污泥体系后各基因的相对丰度都有明显的优势,脱氮效率显著提高.
-
(1)厌氧耐盐菌+厌氧活性污泥体系对有机氮转化率可以达到97%,好氧耐盐菌+好氧活性污泥体系出水NH4+-N、TN浓度分别为1.4 mg·L−1、9.4 mg·L−1,好氧出水经臭氧催化氧化后,最终出水COD浓度为56 mg·L−1,均满足《生活垃圾填埋场污染控制标准》(GB16889—2008)中表2规定水污染物排放浓度限值. GC-MS结果可以进一步得出,臭氧催化氧化可以提高对有机物的处理效果,降低出水有机物的浓度.
(2)微生物群落分析表明,厌氧条件下,Flavobacterium是反应体系在高盐条件下有机氮转化过程中发挥关键作用的菌属;好氧条件下,Truepera、Paracoccus是高盐条件下维持较高的氨氮、总氮去除效果的主要菌属.
(3)厌氧体系中,耐盐菌的强化提高了npr基因的相对丰度,推测该基因表达更有利于高盐条件下有机氮的降解;好氧体系中,耐盐菌强化后,硝化(amo、hao)与反硝化基因(nap、nar、nir、nor)的相对丰度较其他两个体系均有明显上升,更有利于维持NH4+-N、TN的高效去除效果.
耐盐菌生物强化耦合催化臭氧氧化处理渗滤液RO浓液及微生物特性分析
Treatment of RO concentrate of leachate by salt-tolerant bacteria enhanced biotechnology coupled catalytic ozonation and analysis of microbial characteristics
-
摘要: 针对传统生物工艺处理RO浓液耐盐性差、处理效率低等问题,本研究利用耐盐菌强化厌氧/好氧(A/O)活性污泥耦合催化臭氧氧化工艺以提升有机物和总氮的去除,对比活性污泥、耐盐菌剂、活性污泥+耐盐菌剂的3种体系对RO浓液中污染物去除效果、处理前后有机物成分变化以及微生物特性差异. 结果表明,较单独厌氧活性污泥和耐盐菌体系,厌氧强化体系有机氮的转化率分别提高了42%和37%;较单独好氧活性污泥和耐盐菌体系,好氧强化体系总氮去除率提升了37%和77%. 气质联用分析显示,原水有机物经生物和臭氧氧化处理后促使一些不饱和键断裂,提高了难降解有机物的降解. 处理后,水质指标可达《生活垃圾填埋场污染控制标准》表2标准. 高通量测序结果表明,Flavobacterium可能在厌氧强化体系高盐条件下的氨化过程中发挥关键作用;而Truepera、Paracoccus是好氧强化体系高盐条件下总氮高效去除的关键功能菌属. 功能基因预测结果显示,氨化基因npr是Flavobacterium菌属的关键基因,进一步证实测序结果推测;好氧强化体系中nap、nar、nir、nor反硝化基因的相对丰度均高于单独体系,揭示了强化体系总氮高效去除的机理.Abstract: Aiming at the problems of poor salt tolerance and low treatment efficiency of RO concentrated solution treated by traditional biological treatment process, this study used salt-tolerant bacteria to strengthen the anaerobic/aerobic (A/O) activated sludge coupled catalytic ozonation process to improve the removal of organic matter and total nitrogen. The removal efficiency of pollutants in RO concentrate, the change of organic matter composition before and after treatment, and the differences in microbial characteristics of the three systems of activated sludge, salt-tolerant bacteria and activated sludge/salt-tolerant bacteria were compared. The results showed that the conversion rate of organic nitrogen in anaerobic enhanced system was increased by 42% and 37%, respectively, compared with single anaerobic activated sludge and salt-tolerant bacteria system, and compared with the single aerobic activated sludge and salt - tolerant bacteria system, the total nitrogen removal rate of aerobic enhanced system increased by 37% and 77%. GC-MS analysis showed that some unsaturated bonds were broken after biological and ozone oxidation treatment of raw water organic matter, which improved the degradation of refractory organics. After treatment, the water quality index can reach the Table 2 standard of “Standard for Pollution Control of Domestic Waste Landfill”. High-throughput sequencing results showed that Flavobacterium may play a key role in the ammoniation process under high salt conditions in the anaerobic enhanced system; while Truepera and Paracoccus are the key functional bacteria for efficient removal of total nitrogen under high salinity conditions in aerobic enhanced system. The functional gene prediction results showed that the ammoniation gene npr was the key gene of Flavobacterium, which further confirmed the sequencing results. The relative abundances of nap, nar, nir and nor denitrification genes in the aerobic strengthening system were higher than those in the single system, revealing the mechanism of efficient removal of total nitrogen in the strengthening system.
-

-
表 1 实验用水水质
Table 1. Water quality for experimental use
水质指标
Water quality indexes浓度
ConcentrationTOC/(mg·L−1) 330.1 COD/(mg·L−1) 341.2 NH4+-N/(mg·L−1) 15.4 TN/(mg·L−1) 140.5 NO3-N/(mg·L−1) 41.2 有机氮/(mg·L−1) 83.9 盐度/% 1.8—2.1 表 2 检测项目及方法
Table 2. Detection Items and Methods
指标
Index检测方法
Detection methods有机污染物
TOC气相色谱-质谱联用(GC-MS)
TOC分析仪COD 碘化钾碱性高锰酸钾法 NH4+-N 纳氏试剂比色法 TN 碱性过硫酸钾消解分光光度法 NO3−-N 紫外分光光度法 DO 哈希溶氧仪 温度 温度计 污泥浓度 重量法 盐度 盐度计 表 3 臭氧催化氧化结果与排放标准
Table 3. Ozone catalytic oxidation results and emission standards
COD NH4+-N TN 排放标准/(mg·L−1) 100 40 25 臭氧催化氧化进水/(mg·L−1) 259 1.4 9.4 臭氧催化氧化出水/(mg·L−1) 56 — 4.3 去除率/% 78.37 100 54.25 表 4 有机物GC-MS结果分析
Table 4. Analysis of organic GC-MS results
渗滤液RO浓液
RO concentrated
solution of leachate厌氧出水
Anaerobic effluent好氧出水
Aerobic effluent臭氧出水
Ozone effluent有机物成分
Organic
components占比/%
Proportion有机物成分
Organic
components占比/%
Proportion有机物成分
Organic
components占比/%
Proportion有机物成分
Organic
components占比/%
ProportionUndecane 11.75 Silane,
cyclohexyldimethoxymethyl-5.122 Benzene,
1,4-dichloro-0.74 Cyclopentanl,
2-chloro-, trans-25.12 Dodecane 13.37 Dodecane 13.04 Decane,
2,4,6-trimethyl-3.33 Benzene,
1,3-dichloro-5.46 Tridecane 17.07 Tridecane 15.37 Benzene,
1,2,3-trichloro2.33 Benzene,
1,3,5-trichloro-2.46 Silane,
diethyl(2-decyloxy)pentadecyloxy-21.66 Bis(2-ethylhexyl) phthalate 18.67 Tridecane 14.02 Decane,
2,4,6-trimethyl-7.44 Silane,
trimethyl[5-methyl-2-(1-methylethyl)phenoxy]-6.921 Silane,
diethylheptyloxyoctadecyloxy-10.84 7,9-Di-tertbutyl-1-oxaspiro [4,5]deca-6,9-dien-8-one 0.87 N-Ethoxyisobuten-3-imine N- 0.44 Trimethylene oxide 13.22 Tetradecane,
2,6,10-trimethyl -0.90 Acetophenone 5.87 1-Silacyclo-3-pentene1- 2.70 1-Decanol,
2-5,9-dimethyl -0.81 Acetic acid, dichloro- 10.58 Benzoic acid,
3,5dicyclohexyl-4-hydroxy-, methyl ester1.42 1,3-Dioxane-2-propanol,
2-methyl-1,3-2.27 Diisooctyl phthalate 0.18 表 5 多样性指数表
Table 5. Diversity index table
样本
SampleAce Chao Coverage Shannon Simpson A1 541.446505 548.245283 0.997489 3.81816 0.046318 A2 185.890359 193.25 0.998998 3.021566 0.094163 A3 474.989895 480.784314 0.997192 3.599504 0.068381 B1 370.688575 384.965517 0.998404 3.441829 0.086591 B2 556.407202 567.053571 0.997048 3.492143 0.086164 B3 512.315624 525.636364 0.998111 3.492753 0.090136 -
[1] ZHANG Q Q, TIAN B H, ZHANG X, et al. Investigation on characteristics of leachate and concentrated leachate in three landfill leachate treatment plants [J]. Waste Management, 2013, 33(11): 2277-2286. doi: 10.1016/j.wasman.2013.07.021 [2] 邓阳, 冯传平, 胡伟武, 等. 电化学氧化垃圾渗滤液生化出水过程中溶解性有机物形态及可生化性 [J]. 环境化学, 2018, 37(7): 1647-1659. doi: 10.7524/j.issn.0254-6108.2017100902 DENG Y, FENG C P, HU W W, et al. DOM composition and biodegradability of biologically treated landfill leachate during electrochemical oxidation degradation [J]. Environmental Chemistry, 2018, 37(7): 1647-1659(in Chinese). doi: 10.7524/j.issn.0254-6108.2017100902
[3] 周俊, 徐辉, 蔡斌, 等. 垃圾渗滤液纳滤膜浓缩液减量中试处理研究 [J]. 工业水处理, 2018, 38(4): 46-48,56. ZHOU J, XU H, CAI B, et al. Research on the pilot-scale treatment of the decrement of nanofiltration membrane concentrated solution of landfill leachate [J]. Industrial Water Treatment, 2018, 38(4): 46-48,56(in Chinese).
[4] ZHANG B, YU Q W, YAN G Q, et al. Seasonal bacterial community succession in four typical wastewater treatment plants: Correlations between core microbes and process performance [J]. Scientific Reports, 2018, 8: 4566. doi: 10.1038/s41598-018-22683-1 [5] ZHANG L, LI A M, LU Y F, et al. Characterization and removal of dissolved organic matter (DOM) from landfill leachate rejected by nanofiltration [J]. Waste Management, 2009, 29(3): 1035-1040. doi: 10.1016/j.wasman.2008.08.020 [6] 付玉洁, 李思敏, 杨辉, 等. 垃圾渗滤液有机物特征及臭氧对其结构的影响 [J]. 环境工程学报, 2021, 15(8): 2651-2660. doi: 10.12030/j.cjee.202104171 FU Y J, LI S M, YANG H, et al. Characteristics of organic matter in landfill leachate and the effect of ozonation on its structure [J]. Chinese Journal of Environmental Engineering, 2021, 15(8): 2651-2660(in Chinese). doi: 10.12030/j.cjee.202104171
[7] ZHAO W, WANG Y Y, LIU S H, et al. Denitrification activities and N2O production under salt stress with varying COD/N ratios and terminal electron acceptors [J]. Chemical Engineering Journal, 2013, 215/216: 252-260. doi: 10.1016/j.cej.2012.10.084 [8] 张文武. 污水中耐盐细菌新种的分离与鉴定及工业污水耐盐生物处理技术[D]. 杭州: 浙江大学, 2015. ZHANG W W. Isolation and identification of new species of salt-tolerant bacteria in sewage and salt-tolerant biological treatment technology of industrial sewage[D]. Hangzhou: Zhejiang University, 2015(in Chinese).
[9] 郭立. 高盐渗滤液COD降解优势菌的筛选及相关基因消减文库的构建[D]. 天津: 天津大学, 2010. GUO L. Screening of dominant strains for high-salinity landfill leachate degradation and construction of subtractive library related to COD degradation[D]. Tianjin: Tianjin University, 2010(in Chinese).
[10] 姜海凤, 周豪, 于宗然, 等. 耐盐菌强化MBR工艺处理高含盐渗滤液的研究 [J]. 磷肥与复肥, 2020, 35(8): 19-24,29. doi: 10.3969/j.issn.1007-6220.2020.08.006 JIANG H F, ZHOU H, YU Z R, et al. Treating landfill leachate with high salinity via salt-tolerant bacteria enhanced membrane bioreactor process [J]. Phosphate & Compound Fertilizer, 2020, 35(8): 19-24,29(in Chinese). doi: 10.3969/j.issn.1007-6220.2020.08.006
[11] 袁建华, 赵天涛, 彭绪亚. 极端条件下异养硝化-好氧反硝化菌脱氮的研究进展 [J]. 生物工程学报, 2019, 35(6): 942-955. doi: 10.13345/j.cjb.180427 YUAN J H, ZHAO T T, PENG X Y. Advances in heterotrophic nitrification-aerobic denitrifying bacteria for nitrogen removal under extreme conditions [J]. Chinese Journal of Biotechnology, 2019, 35(6): 942-955(in Chinese). doi: 10.13345/j.cjb.180427
[12] 张正义, 张千, 楼紫阳, 等. 催化臭氧氧化处理渗滤液RO浓液的氧化特性及光谱分析 [J]. 化工学报, 2021, 72(10): 5362-5371. doi: 10.11949/0438-1157.20210400 ZHANG Z Y, ZHANG Q, LOU Z Y, et al. Oxidation characteristics and spectral analysis of leachate reverse osmosis concentrate by catalytic ozonation [J]. CIESC Journal, 2021, 72(10): 5362-5371(in Chinese). doi: 10.11949/0438-1157.20210400
[13] HOFFMANN T, FRANKENBERG N, MARINO M, et al. Ammonification in Bacillus subtilis utilizing dissimilatory nitrite reductase is dependent on resDE [J]. Journal of Bacteriology, 1998, 180(1): 186-189. doi: 10.1128/JB.180.1.186-189.1998 [14] 刘甜甜, 彭永臻, 王淑莹, 等. 盐度对垃圾渗滤液短程脱氮性能及其N2O产量的影响 [J]. 化工学报, 2012, 63(10): 3269-3276. doi: 10.3969/j.issn.0438-1157.2012.10.037 LIU T T, PENG Y Z, WANG S Y, et al. Impact of salinity Shock on nitrogen removal and N2O output in treating landfill leachate [J]. CIESC Journal, 2012, 63(10): 3269-3276(in Chinese). doi: 10.3969/j.issn.0438-1157.2012.10.037
[15] 刘志刚. 复合菌剂强化SBR处理垃圾渗滤液的研究[D]. 成都: 西南交通大学, 2014. LIU Z G. Study on SBR reinforced by compound bacterium agen to treat landfill leachate[D]. Chengdu: Southwest Jiaotong University, 2014(in Chinese).
[16] 范举红. 活性炭催化臭氧氧化垃圾渗滤液生物处理出水的研究[D]. 北京: 清华大学, 2016. FAN J H. Catalytic ozonation of landfill leachate biological treatment effluent with activated carbon[D]. Beijing: Tsinghua University, 2016(in Chinese).
[17] 黄莉婷, 韩昫身, 金艳, 等. 煤化工反渗透浓水的高效降解菌株筛选、鉴定及应用研究 [J]. 化工学报, 2021, 72(9): 4881-4891. HUANG L T, HAN X S, JIN Y, et al. Isolation, identification and application of highly efficient halotolerant strains for coal chemical reverse osmosis concentrate treatment [J]. CIESC Journal, 2021, 72(9): 4881-4891(in Chinese).
[18] 袁莹, 周伟丽, 王晖, 等. 不同电子供体的硫自养反硝化脱氮实验研究 [J]. 环境科学, 2013, 34(5): 1835-1844. YUAN Y, ZHOU W L, WANG H, et al. Study on sulfur-based autotrophic denitrification with different electron donors [J]. Environmental Science, 2013, 34(5): 1835-1844(in Chinese).
[19] 李巍, 赵庆良, 刘颢, 等. 兼养同步脱硫反硝化工艺及影响因素 [J]. 中国环境科学, 2008, 28(4): 345-349. LI W, ZHAO Q L, LIU H, et al. The mixotrophic simultaneous desulfurization-denitrification technique and influence factors [J]. China Environmental Science, 2008, 28(4): 345-349(in Chinese).
[20] 李琳, 赵朝成, 刘其友, 等. 降解含硫杂环芳烃中度嗜盐菌的筛选及降解特性研究 [J]. 化学与生物工程, 2014, 31(2): 44-47. doi: 10.3969/j.issn.1672-5425.2014.02.012 LI L, ZHAO C C, LIU Q Y, et al. Study on screening and degradation characteristics of moderately halophilic bacteria degrading PASHs [J]. Chemistry & Bioengineering, 2014, 31(2): 44-47(in Chinese). doi: 10.3969/j.issn.1672-5425.2014.02.012
[21] 郑艳玲, 侯立军, 陆敏, 等. 崇明东滩夏冬季表层沉积物细菌多样性研究 [J]. 中国环境科学, 2012, 32(2): 300-310. doi: 10.3969/j.issn.1000-6923.2012.02.017 ZHENG Y L, HOU L J, LU M, et al. The bacterial diversity in surface sediments from Chongming Eastern tidal flat in summer and winter [J]. China Environmental Science, 2012, 32(2): 300-310(in Chinese). doi: 10.3969/j.issn.1000-6923.2012.02.017
[22] HUANG W Y, SHE Z L, GAO M C, et al. Effect of anaerobic/aerobic duration on nitrogen removal and microbial community in a simultaneous partial nitrification and denitrification system under low salinity [J]. Science of the Total Environment, 2019, 651: 859-870. doi: 10.1016/j.scitotenv.2018.09.218 [23] ZHENG Z J, ZHANG D Y, LI W G, et al. Substrates removal and growth kinetic characteristics of a heterotrophic nitrifying-aerobic denitrifying bacterium, Acinetobacter harbinensis HITLi7T at 2 ℃ [J]. Bioresource Technology, 2018, 259: 286-293. doi: 10.1016/j.biortech.2018.03.065 [24] 吴等等, 宋志文, 王琳, 等. 人工湿地污水处理系统春季空气微生物群落结构分析? [J]. 中国环境科学, 2014, 34(12): 3164-3174. WU D D, SONG Z W, WANG L, et al. Community structure of airborne microbes in spring in a constructed wetland system for sewage treatment [J]. China Environmental Science, 2014, 34(12): 3164-3174(in Chinese).
[25] CHEN Y, MI T Z, LIU Y T, et al. Microbial community composition and function in sediments from the Pearl River mouth basin [J]. Journal of Ocean University of China, 2020, 19(4): 941-953. doi: 10.1007/s11802-020-4225-7 [26] LI X F, BOND P L, van NOSTRAND J D, et al. From lithotroph- to organotroph-dominant: Directional shift of microbial community in sulphidic tailings during phytostabilization [J]. Scientific Reports, 2015, 5: 12978. doi: 10.1038/srep12978 [27] BACH H J, MUNCH J C. Identification of bacterial sources of soil peptidases [J]. Biology and Fertility of Soils, 2000, 31(3/4): 219-224. [28] 李新, 焦燕, 代钢, 等. 内蒙古河套灌区不同盐碱程度的土壤细菌群落多样性 [J]. 中国环境科学, 2016, 36(1): 249-260. LI X, JIAO Y, DAI G, et al. Soil bacterial community diversity under different degrees of saline-alkaline in the Hetao Area of Inner Mongolia [J]. China Environmental Science, 2016, 36(1): 249-260(in Chinese).
[29] 李贵珍, 赖其良, 邵宗泽, 等. 异养硝化-好氧反硝化细菌的研究进展 [J]. 生物资源, 2018, 40(5): 419-429. LI G Z, LAI Q L, SHAO Z Z, et al. Research progress of heterotrophic nitrification-aerobic denitrification bacteria [J]. Biotic Resources, 2018, 40(5): 419-429(in Chinese).
[30] ALBUQUERQUE L, SIMÕES C, NOBRE M F, et al. Truepera radiovictrix gen. nov., sp. Nov., a new radiation resistant species and the proposal of Trueperaceae fam. nov [J]. FEMS Microbiology Letters, 2005, 247(2): 161-169. doi: 10.1016/j.femsle.2005.05.002 [31] BACH H J, HARTMANN A, SCHLOTER M, et al. PCR primers and functional probes for amplification and detection of bacterial genes for extracellular peptidases in single strains and in soil [J]. Journal of Microbiological Methods, 2001, 44(2): 173-182. doi: 10.1016/S0167-7012(00)00239-6 [32] HOOPER A B, VANNELLI T, BERGMANN D J, et al. Enzymology of the oxidation of ammonia to nitrite by bacteria [J]. Antonie Van Leeuwenhoek, 1997, 71(1/2): 59-67. doi: 10.1023/A:1000133919203 [33] YU C D, HOU L J, ZHENG Y L, et al. Evidence for complete nitrification in enrichment culture of tidal sediments and diversity analysis of clade a comammox Nitrospira in natural environments [J]. Applied Microbiology and Biotechnology, 2018, 102(21): 9363-9377. doi: 10.1007/s00253-018-9274-0 [34] 郑林雪, 李军, 胡家玮, 等. 同步硝化反硝化系统中反硝化细菌多样性研究 [J]. 中国环境科学, 2015, 35(1): 116-121. ZHENG L X, LI J, HU J W, et al. Analysis of denitrifying bacteria community composition in simultaneous nitrification and denitrification systems [J]. China Environmental Science, 2015, 35(1): 116-121(in Chinese).
[35] ZHAO B, CHENG D Y, TAN P, et al. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal [J]. Bioresource Technology, 2018, 250: 564-573. doi: 10.1016/j.biortech.2017.11.038 -




 下载:
下载: