-
纳米氧化铈(CeO2NPs)是一种重要的纳米稀土化合物,具有较强的静电吸引力、较高的氧亲和力和氧化还原电位等独特的理化性质,被广泛用于抛光材料、吸附剂、汽车尾气催化剂、氧传感器等[1 − 4]. 此外,CeO2NPs在氧化应激相关疾病的药物治疗上具有较好的应用前景,如神经退行性疾病、自身免疫性疾病、糖尿病和癌症[5]. CeO2NPs是生产最多的纳米颗粒之一,全球年产量约10000 t[6]. CeO2NPs及其相关产品的大规模生产和使用,必然会导致越来越多CeO2NPs通过各种途径进入大气、土壤和水等环境介质及生物体中. 由于纳米颗粒的特殊性质(如粒径为1—100 nm),目前的分离和分析技术还很难检测环境中CeO2NPs的真实背景浓度. Giese等[6]结合科学模型和经济模型,评估了2017—2050年自然介质中CeO2NPs的浓度,预计2050年大气、地表水、沉积物和土壤中的CeO2NPs浓度分别为0.60—30.93 ng·m−3、4.49—148.93 ng·L−1、2.35—1844.20 μg·kg−1、680.81—17792.55 ng·kg−1.
无脊椎动物是生物类群的重要组成,其中大多数物种是低营养级动物. 相较脊椎动物具有易富集污染物、对环境变化更敏感、不占用空间便于大量饲养、个体较小便于操作、生活史短等特点[7]. 具有较多的生态、环境和动物毒理实验用模式动物,如线虫、蚯蚓、水溞、果蝇等. 近年来,越来越多的学者以无脊椎动物为研究材料开展了一系列CeO2NPs生物毒性研究. 但关于CeO2NPs对无脊椎动物影响综述性内容非常有限,现有的资料也仅局限于各类纳米颗粒对土壤或海洋无脊椎动物的影响,且侧重于CeO2NPs理化性质对生物体的影响[8 − 13].
本文从生物累积、行为反应、组织损伤、生长发育毒性、免疫毒性、生殖毒性和遗传毒性等方面综述了CeO2NPs对无脊椎动物的影响以及CeO2NPs毒性效应的影响因素,总结了CeO2NPs对无脊椎动物的毒性机制,最后基于目前研究不足提出CeO2NPs对无脊椎动物毒性研究建议,以期为CeO2NPs的毒性评价、安全生产、排放和商品化等提供参考.
-
研究表明,纳米材料的生物累积与毒性效应之间存在相关性,是前期毒性研究基础[14]. CeO2NPs可以通过无脊椎动物的表皮接触和摄食等途径在动物体内积累(表1),并可通过生物链逐级传递.
一般来说,消化道是无脊椎动物累积CeO2NPs最高的部位. 王婧坤等[28]研究发现,大型溞(Daphnia magna)暴露于1—1000 mg·L−1 CeO2NPs 24 h可以明显观察到体内纳米颗粒的累积,且随时间延长,大型溞对CeO2NPs的摄入量显著增加,充满整个消化道. 滤食性动物斑马贻贝(Dreissena polymorpha)可以利用覆盖在鳃上的纤毛捕获CeO2NPs,然后经口到胃,最终在消化腺累积[29]. 此外,Cross等[30]研究发现,Ce3+比CeO2NPs更容易在夹杂带丝蚓(Lumbriculus variegatus)的皮肤上累积. Lahive等[24]对比了Ce盐及不同粒径的CeO2NPs(5—80 nm和300 nm)对蚯蚓的毒性作用. 结果发现,蚯蚓体内的Ce含量均随暴露浓度增加而显著增加,且暴露于CeO2NPs的蚯蚓体内Ce累积量显著高于暴露于离子态Ce的蚯蚓.
Hawthorne等[25]研究发现,用1228 μg·g−1 CeO2NPs处理过的叶片喂食蟋蟀(Acheta domesticus),14 d后再将其喂食狼蛛(Family lycosidae),在蟋蟀和狼蛛体内均发现不同程度Ce累积. Majumdarm等使用种植在1000—2000 mg·kg−1 CeO2NPs污染土壤中的芸豆喂食墨西哥豆甲虫(Epilachna varivestis),再将其喂食刺肩蝽(Podisus maculiventris),Ce的含量从植物到甲虫再到刺肩蝽被生物放大了5.3倍,但未观察到毒性效应[26]. 这表明CeO2NPs会通过食物链进行营养转移,且不同物种的摄食习惯可能是导致Ce累积差异的主要原因,但现有资料并不表明CeO2NPs通过食物链在生物体内累积会导致毒性效应. 此外,CeO2NPs一旦进入水体会迅速沉降,导致底栖无脊椎动物吸收和累积[31]. Bour等[32]将摇蚊(Chironomus riparius)幼虫暴露于1 mg·L−1 CeO2NPs,发现体内有大量Ce累积,但对其存活率无显著影响. 进一步研究表明,摇蚊体内累积的大量CeO2NPs,可能成为两栖动物幼体的污染载体,导致遗传毒性[27]. Jacinto-Maldonado等[33]对一条可能受到交通污染的河流中携带螨虫(Hannemania)的两栖动物进行了采样,结果表明,螨虫体内存在CeO2累积,对两栖动物有潜在毒性,螨虫可能是两栖动物接触污染物的途径. 上述研究表明无脊椎动物确实能通过体外暴露和食物链传递蓄积CeO2NPs,在水生和陆生动物体中都存在生物富集现象. 在探究CeO2NPs毒性过程中,应考虑CeO2NPs的靶向性和其在无脊椎动物体内的累积状况.
-
半数效应浓度(Medium effective concentration,EC50)和半数致死浓度(50% lethal concentration,LC50)是CeO2NPs对无脊椎动物急性毒性的基本指标(表2). 研究表明EC50和LC50因CeO2NPs物化性质和物种差异而不同[41 − 42]. Van Hoecke等[39]将大型溞暴露于14、20、29 nm CeO2NPs悬液21 d,发现对于2种较小粒径CeO2NPs的LC50为40 mg·L−1,而29 nm的LC50为71 mg·L−1. 相较于蚤状溞(Daphnia pulex),同形溞(Daphnia similis)对CeO2NPs具有更强的毒性耐受力. 蚤状溞和同形溞同时暴露1 mg·L−1 CeO2NPs 48 h,同形溞LC50值是蚤状溞的350倍[40].
陆生无脊椎动物受到CeO2NPs胁迫时其敏感性低于水生无脊椎动物. 研究发现,CeO2NPs对一些典型的陆生无脊椎动物存活无显著影响,如赤子爱胜蚓(Eisenia fetida)[24]、白符䖴(Folsomia candida)[43]和多霜腊鼠妇(Porcellionides pruinosus)[43]等. Lahive等[24]将赤子爱胜蚓暴露在41—10000 mg·kg−1 CeO2NPs土壤中28 d,发现CeO2NPs对赤子爱胜蚓的死亡率没有影响.
-
行为终点是评估污染物毒性的一个重要研究指标. 其中,游泳行为被证实是评估水生无脊椎动物生态毒性合适和准确的终点[44]. 研究表明CeO2NPs对水生无脊椎动物的游泳性能会产生显著影响[28, 40, 45]. 大型溞暴露于1—1000 mg·L−1 CeO2NPs 48 h在其体表上观察到大量纳米颗粒,尤其在触角上吸附的纳米颗粒较多,显著抑制了大型溞的游泳速度[28]. Artells等[40]研究发现,相同浓度CeO2NPs暴露下,不同溞类品种表现出的游泳性能会有明显差异. 蚤状溞和同形溞分别暴露于1 mg·L−1 CeO2NPs 48 h,其游泳速度分别较对照组显著下降了30%和40%. 研究认为CeO2NPs导致水溞游泳能力降低的原因可能是摄食减少和蜕皮的影响[46].
在CeO2NPs污染土壤中,利用动物趋利避害的本能,通过测定CeO2NPs对无脊椎动物个体行为的影响程度来判定其毒性大小[8, 47]. Zidar等[47]在土壤中添加(203.6±4.03)nm 100—2000 mg·kg−1 CeO2NPs,观察鼠妇对CeO2NPs的回避行为. 结果表明在1000 mg·kg−1 CeO2NPs处理组下,鼠妇的摄食率下降,鼠妇对CeO2NPs处理组食物的回避行为并不明显. 而在Malev等[48]类似实验中,鼠妇食用15 nm 1000 mg·kg−1 CeO2NPs处理的榛树叶摄食率较对照组显著增加,食用2000—5000 mg·kg−1 CeO2NPs处理的榛树叶鼠妇摄食率较对照组显著下降. 这表明不同粒径的CeO2NPs对鼠妇的行为反应具有一定差异,粒径越小,毒性越大. 土壤无脊椎动物对污染物的行为反应可能是污染物使土壤中微生物群发生变化,导致动物适口性的改变,土壤无脊椎动物特有的化学和机械感受器使它们主动避开有害环境;也可能是污染物进入到土壤无脊椎动物体内,引起动物体不适而产生回避反应.
-
CeO2NPs对无脊椎动物组织损伤的研究较少. CeO2NPs可以通过体壁接触或肠壁运输等方式进入无脊椎动物的体腔,引起组织损伤. Lahive等[24]研究发现,赤子爱胜蚓暴露于41—10000 mg·kg−1 CeO2NPs 28 d,会导致蚯蚓体壁角质层缺失和肠道上皮细胞完整性遭到破坏. 与之相似,Chen等[15]研究表明CeO2NPs会对蚯蚓消化道产生不良影响. 蚯蚓通过被动的表皮渗透和主动的肠道吸收等方式在其体内积累CeO2NPs,导致体腔组织和肠道上皮损伤. 经1000 mg·kg−1 CeO2NPs处理后蚯蚓肠粘膜上皮细胞结构模糊有空洞,细胞器自溶和扩散. Rossbach等[49]研究发现,0.5—34.96 mg·L−1 CeO2NPs会导致线虫咽部严重畸形,尤其是食道球以及咽瓣后方出现肿胀,但是并不损害线虫咽功能和摄食能力. 可能是线虫摄入CeO2NPs时导致咽部角质层的机械损伤. 由于CeO2NPs的独特性质,能够躲避无脊椎动物的防御机制,可能会通过在体内累积而对器官产生影响. 目前CeO2NPs对无脊椎动物组织损伤方面的影响还需进一步研究.
-
在无脊椎动物早期发育阶段,CeO2NPs暴露会导致幼体生长率改变、发育异常等. Arnold等[50]研究发现,秀丽隐杆线虫(Caenorhabditis elegans)暴露于5 mg·L−1 CeO2NPs 3 d后,生长率显著降低90.6%. Stowers等[51]进一步研究表明,不同浓度CeO2NPs对秀丽隐杆线虫的生长情况具有不同影响,100 mg·kg−1 CeO2NPs会促进秀丽隐杆线虫生长,而500 mg·kg−1 CeO2NPs则抑制秀丽隐杆线虫生长. 蜕皮是无脊椎动物体型增长和发育成熟的一种正常生理过程. 水溞暴露于10 mg·L−1 CeO2NPs 21 d后,其幼虫体型明显缩小,蜕皮频率显著下降[52]. Auffan等[53]进一步研究发现,水溞蜕皮是控制CeO2NPs释放的关键因素,这在很大程度上降低了向其捕食者转移CeO2NPs的可能性. 此外,有研究表明,CeO2NPs会显著抑制水溞的体长. Van Hoecke等[39]将大型溞暴露于100 mg·L−1不同粒径的CeO2NPs 7 d后,大型溞平均体长与对照组相比均显著下降50%以上. 但是Bour等[46]研究发现,摇蚊幼虫暴露在0.01—100 mg·L−1 CeO2NPs 48 h后,其发育历期、羽化率、口部畸形等生长发育特性无显著变化. 这可能是由于摇蚊幼虫摄食纳米颗粒后会分泌粘液,导致颗粒聚集,进而降低了CeO2NPs的毒性效应. 总体来说,CeO2NPs暴露对无脊椎动物生长发育的影响通常可直接观察.
-
免疫系统是机体抵御外源物质侵扰的首道防线,相比其他系统具有更高的反应性和灵敏性,也是CeO2NPs的敏感靶点[54]. 不同于脊椎动物抗体介导的获得性免疫系统,无脊椎动物的免疫系统是非特异性的,外源污染物入侵后会激活血细胞的吞噬作用和细胞毒性反应介导的免疫行为[55 − 56]. Garaud等[22]评估了紫贻贝暴露于CeO2NPs对其免疫功能的影响. 结果显示,10 mg·mL−1 CeO2NPs显著诱导紫贻贝血细胞中溶菌酶、活性氧(Reactive oxygen species,ROS)和NO生成,同时抑制吞噬活性,这表明CeO2NPs使紫贻贝产生炎症和免疫抑制作用. 另一方面,CeO2NPs可以通过鳃直接进入贻贝的循环系统并激活血细胞,通过释放溶酶菌、上调免疫和抗氧化基因等多种防御机制作出反应[57]. 这表明CeO2NPs在生物不同组织水平上具有免疫调节和抗氧化作用.
-
CeO2NPs对无脊椎动物生殖细胞的活力、数量和受精率等产生不利影响,从而诱导生殖毒性. Castro等[58]用含1—100 mg·L−1 CeO2NPs饲料喂食甜菜夜蛾(Spodoptera frugiperda),CeO2NPs会显著影响雌性甜菜夜蛾的生殖能力,其中10 mg·L−1 CeO2NPs导致甜菜夜蛾卵子活力下降60%. 将秀丽隐杆线虫分别暴露于15 nm和45 nm CeO2NPs,秀丽隐杆线虫卵子数量较对照组分别下降了28%和11%,CeO2NPs显著降低秀丽隐杆线虫的生殖能力[59]. 可能是CeO2NPs诱导了代谢酶基因cyp35a2的表达,cyp35a2对线虫的生殖能力具有负面影响,线虫通过降低生殖能力作为一种防御机制以代偿CeO2NPs引起的毒性. Oral等[60]将受精5 h后的海胆胚胎暴露于10−8—10−5 mol·L−1 CeO2NPs,CeO2NPs会抑制海胆的有丝分裂,诱导有丝分裂畸变,多极纺锤体显著增多,受精率显著下降,10−5 mol·L−1 CeO2NPs导致胚胎全部死亡.
-
遗传毒性是化学毒性测试和风险评估中重要的毒性终点之一[61 − 62]. CeO2NPs主要通过诱导无脊椎动物DNA损伤而产生遗传毒性. Savić‐Zdravković等[63]研究发现,CeO2NPs对摇蚊具有显著的遗传毒性,且有浓度梯度效应. 彗星实验结果表明暴露于2500 mg·kg−1 CeO2NPs的摇蚊四龄幼虫,DNA损伤较低浓度组显著增加. 与之相似,Koehlé-Divo等[64]通过彗星实验探究了低浓度CeO2NPs暴露下河蚬(Corbicula fluminea)的遗传毒性. 河蚬暴露于10 μg·L−1 CeO2NPs已表现出DNA损伤,且随暴露时间和浓度的增加DNA损伤加剧. CeO2NPs可以通过直接的物理相互作用以及间接的ROS生成两种途径损害遗传物质[65],即使组织内CeO2NPs和ROS含量很低,也可能引起遗传毒性. CeO2NPs作为一种潜在的纳米污染物正受到越来越多的关注,但关于其对无脊椎动物遗传影响的报道较少,潜在的毒性机制仍需进一步探究.
总体来说,CeO2NPs对无脊椎动物毒性效应存在种间差异性,同时受物种的不同发育阶段、不同的毒性终点影响. 值得注意的是,目前在CeO2NPs的生物累积和毒性效应研究中,实验室暴露浓度多是μmol·L−1—mmol·L−1不等,远高于环境浓度,差异很大. 表明研究结果可能不代表在现实环境中的毒性影响. 据我们所知,Zhang等[66]首次在环境相关浓度(1—100 nmol·L−1)下,评估了CeO2NPs(8.5 nm)自然暴露模式下对秀丽杆线虫的影响. 结果表明,CeO2NPs可诱导线虫ROS积累和氧化损伤,最终导致寿命缩短. 在1 nmol·L−1的暴露水平下,线虫的平均寿命已显著降低了12%. 因此为了避免关于CeO2NPs对无脊椎动物毒性的误导性解读,CeO2NPs的毒理研究今后应在与环境相关的模式下使用适当的浓度和自然暴露途径会更有生态指导性.
-
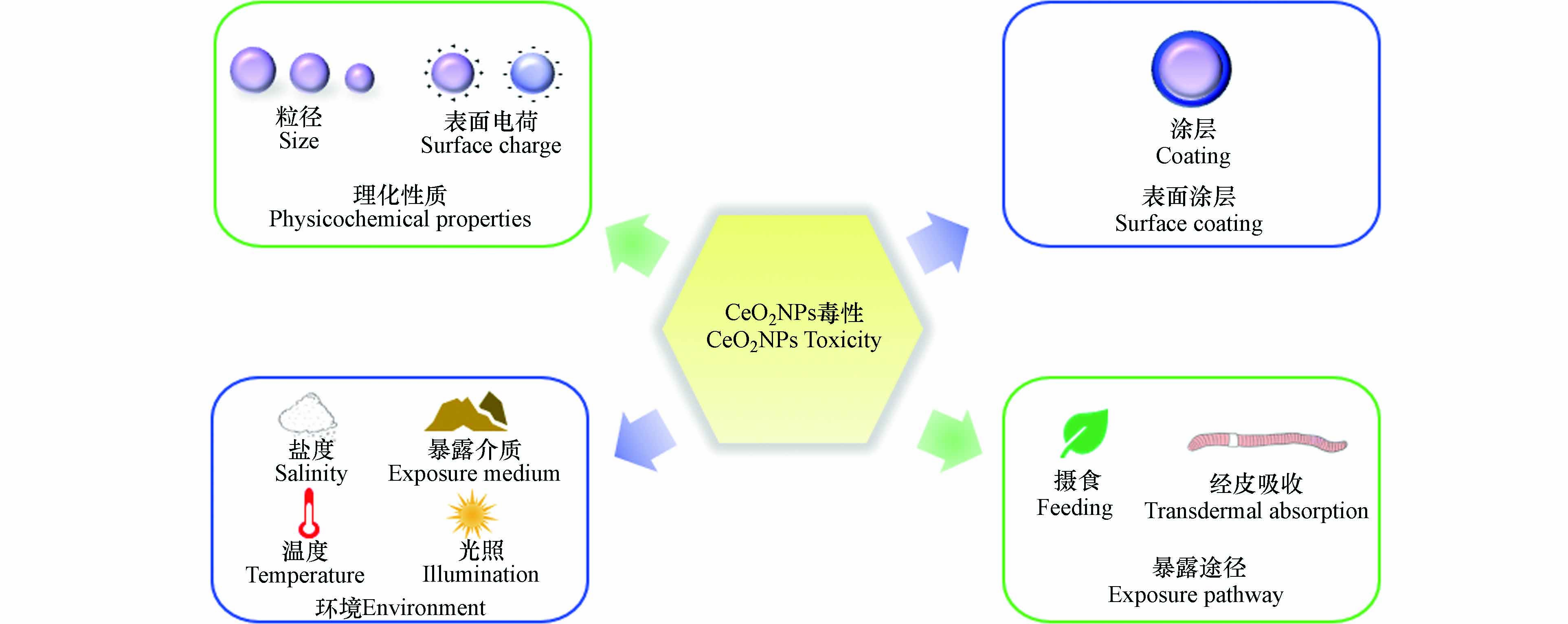
研究表明CeO2NPs对无脊椎动物的毒性与理化性质[23, 35](粒径、表面电荷)、表面涂层[19, 21]、环境[15 − 16, 67 − 68](暴露介质、盐度、温度)和暴露途径[30]等因素有一定相关性(图1). 表3集中汇总了部分CeO2NPs对无脊椎动物毒性的影响因素.
-
一些无脊椎动物毒性效应研究表明,粒径是影响CeO2NPs毒性的主要因素之一. 一般而言,较小粒径的CeO2NPs具有更大的表面体积比和Ce3+/Ce4+表面比,使其更具活性和毒性[73]. Castro等[58]研究证实,CeO2对甜菜夜蛾的毒性效应具有粒径依赖性,CeO2NPs会导致蛹重量降低,而微米CeO2处理的蛹重与对照组蛹重相似;Roh等[59]比较了纳米颗粒大小对秀丽隐杆线虫的毒性影响. 在15 nm和45 nm CeO2NPs实验组中,外源代谢酶cyp35a2基因表达都增加,繁殖率和存活率下降,但15 nm CeO2NPs对秀丽隐杆线虫的毒性更大. 然而,Lahive等[24]研究发现,蚯蚓暴露在10—300 nm CeO2NPs中,蚯蚓的存活、生殖和累积效应较对照组都没有明显差异,表明CeO2NPs粒径大小对蚯蚓没有影响.
-
表面电荷可以通过调节一些参数决定CeO2NPs在环境和生物系统中的稳定性、分散和转运[35],如与血浆蛋白结合、纳米粒子的选择性吸附和跨膜渗透等[74],一般来说,带正电的NPs更容易被细胞吸收并产生更强的毒性[75]. Collin等[35]研究表明,CeO2NPs表面电荷对秀丽隐杆线虫具有毒性效应. 带正电荷的CeO2NPs比带中性和负电荷的CeO2NPs表现出更强的毒性和生物蓄积. 与之类似,Arndt等[76]研究发现,带正电荷CeO2NPs暴露下线虫的死亡率和生殖毒性比带中性和负电荷的CeO2NPs高出两个数量级,并且正电荷CeO2NPs处理组具有最大生物累积量,生物累积的差异可能是不同电荷CeO2NPs毒性差异的主要原因. 但也有研究表明带负电的CeO2NPs比带中性和正电荷的CeO2NPs更易被溶酶体内化而使毒性更强[77]. Sendra等[70]研究发现,带负电荷的CeO2NPs比带中性电荷的CeO2NPs对离体培养紫贻贝血细胞免疫功能抑制更强.
-
涂层剂覆盖在CeO2NPs表面可以防止纳米颗粒聚集,影响CeO2NPs的Zete电势、生物相容性和Ce3+/Ce4+比例等. CeO2NPs的涂层不同对无脊椎动物毒性也不一致. 有研究表明,涂有壳聚糖的CeO2NPs会更稳定,涂有海藻酸盐的CeO2NPs会增强其聚集性和沉降率. Della等[69]比较了无涂层、涂有海藻酸或壳聚糖CeO2NPs对斑马贻贝的毒性. 研究发现,涂有海藻酸CeO2NPs显著降低了斑马贻贝体内ROS水平、超氧化物岐化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)和谷胱甘肽S-转移酶(Glutathione-S-transferase,GST)的活性. Nigro等[19]研究了海藻酸钠和壳聚糖两种不同涂层包覆CeO2NPs对紫贻贝的影响. 结果表明,贻贝在1 μg·L−1和100 μg·L−1 CeO2NPs中分别暴露7 d和28 d,涂有壳聚糖CeO2NPs会显著增强贻贝体内抗氧化酶活性,而涂有海藻酸盐CeO2NPs导致贻贝氧化损伤. 表明生物大分子包覆CeO2NPs,会使其带有负电荷,增强CeO2NPs的生物效应. Bour等[32]比较了有或无涂层CeO2NPs对摇蚊幼虫的致畸作用. 研究发现,三柠檬酸铵包覆的CeO2NPs会降低幼虫口器畸形率,对摇蚊具有保护作用. 而裸露CeO2NPs表面粗糙、有棱角,可能具有更强的细胞毒性.
-
环境中物理化学等变量(盐度、温度、暴露介质等)都可能影响CeO2NPs对无脊椎动物的毒性[78]. Koehlé-Divo等[67]在分子水平上评估了CeO2NPs对暴露于不同盐度(1.5 psu、15 psu)河蚬的潜在毒性. 结果表明,在1.5 psu盐度胁迫下,CeO2NPs显著诱导河蚬基因表达,而在高盐度(15 psu)处理下,河蚬的基因表达接近于对照组. 作者认为盐度可能强烈影响并改变了CeO2NPs的行为,从而限制了CeO2NPs的生物利用度. 盐水中的高离子强度会促使CeO2NPs沉淀,并迅速从水体中清除,减少河蚬的生物累积[79]. 在高盐度条件下,渗透调节过程被激活,代谢平衡的调节可能导致基因表达受到干扰,因此某些通路被抑制或关闭. 此外,作者还发现,CeO2NPs经850 ℃燃烧后,理化性质发生了改变,由原来的球形变成多面体,燃烧后的CeO2NPs生物利用度显著降低. Nederstigt等[80]研究了UV辐射和无UV辐射下CeO2NPs暴露对大型溞的毒性效应. 结果表明,无论是否存在UV辐射,CeO2NPs均会损害大型溞的繁殖能力. 无UV辐射时,CeO2NPs对大型溞的毒性更严重,0.02 mg·L−1 CeO2NPs会导致大型溞新生个体数量显著降低. 此外,UV辐射还会导致成年大型溞体型缩小,而无UV辐射未观察到此现象. 说明毒性测试在实验室条件下还是在环境暴露条件下进行,可能会对研究结果产生重大影响.
土壤性质的复杂性会导致纳米材料毒性的显著差异. Chen等[15]研究发现,与黏土相比,CeO2NPs在沙壤土中对蚯蚓的毒性更大. 暴露于10—1000 mg·kg−1 CeO2NPs沙壤土的蚯蚓体内产生过量ROS,诱导氧化应激,过氧化氢酶(Catalase,CAT)活性、蛋白质羰基(Protein carbonylation,PCO)和丙二醛(Malondialdehyde,MDA)含量显著增加. 而暴露于含同浓度CeO2NPs粘土中的蚯蚓发现了相反的结果,黏土会增强CeO2NPs的聚集,并形成团块,减少离子释放进而降低CeO2NPs对蚯蚓的毒性作用[81]. CeO2NPs的生物效应与暴露介质具有复杂相关性,但迄今为止,大多数实验室研究使用简化和标准化的暴露介质. 因此在今后的研究中,应使用更接近环境的暴露条件评估低水平CeO2NPs的影响[82].
-
CeO2NPs对无脊椎动物的毒性与其暴露途径存在相关性. Conway等[72]将贻贝暴露于接近环境浓度(1 mg·L−1、2 mg·L−1、3 mg·L−1)CeO2NPs 37 d,对比了直接暴露和饮食暴露两种途径下CeO2NPs对贻贝清除率的影响. 饮食暴露CeO2NPs下贻贝的清除率与暴露浓度呈正相关,而直接暴露于CeO2NPs的处理中,清除率随时间推移而下降. 贻贝不能食用CeO2NPs,通过增加排泄物以减少CeO2NPs内化产生的影响,因此提高了贻贝的清除率. Cross等[30]研究了摄食和经皮吸收两种方式对夹杂带丝蚓生物累积的影响. 发现夹杂带丝蚓通过摄食CeO2NPs,会导致体内Ce含量显著高于空白对照组,而经皮吸收CeO2NPs的夹杂带丝蚓体内Ce含量则与空白对照组无显著差异. 这表明夹杂带丝蚓仅通过摄食这一种途径内化CeO2NPs. 然而,目前尚不能对CeO2NPs的暴露途径与其在无脊椎动物体内引起的毒性效应建立关系,后续需对CeO2NPs不同暴露途径下对无脊椎动物诱导的毒性机制进行深入探究.
综上,CeO2NPs对无脊椎动物毒性效应的影响因素主要有CeO2NPs自身特性(粒径、表面电荷、表面涂层等)和外界条件(环境、暴露途径等)等两方面. CeO2NPs对不同无脊椎动物的毒性大小不一,同一无脊椎动物对不同性质CeO2NPs的毒性反应也不相同. 因此,在研究CeO2NPs对无脊椎动物毒性效应时,不仅要选择合适的受试动物,也要考虑各种因素差异.
-
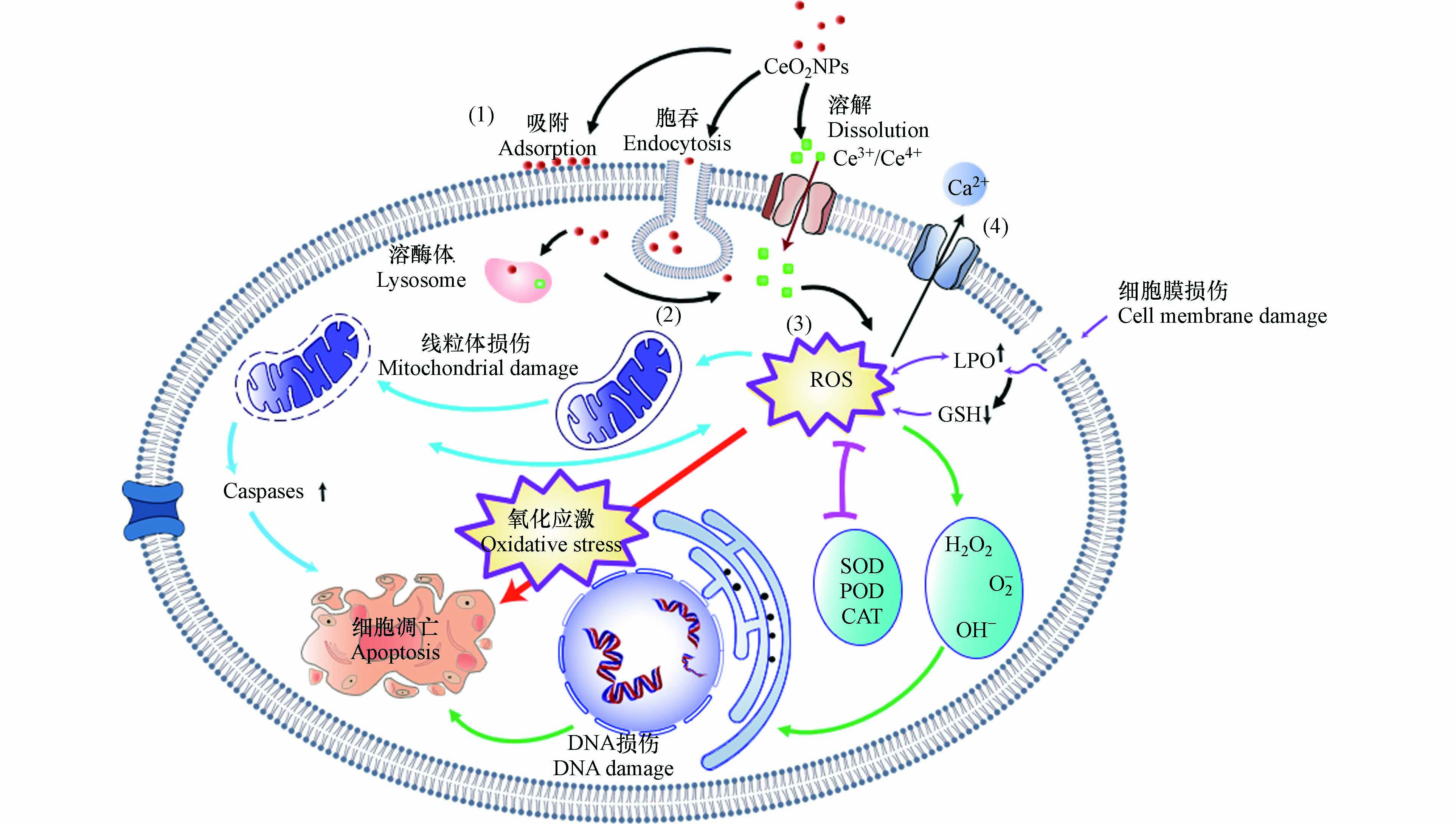
目前,关于CeO2NPs对无脊椎动物的毒性机制尚无一致、明确的定论. 根据现有研究总结其可能的机制如图2所示. 主要包括细胞膜损伤、氧化损伤、诱导细胞凋亡及Ca2+调节等.
-
CeO2NPs会吸附在细胞膜上,并对生物产生较强的毒性效应,其作用机理包括2个方面. (1)CeO2NPs吸附在细胞表面,堵塞细胞膜上的各种离子通道,干扰营养物质向细胞内部迁移扩散,进而引起细胞生存环境pH或氧化还原电势(EH)的改变并导致细胞营养缺乏[35, 65];(2)CeO2NPs不规则形状和粗糙的外表面会造成细胞机械损伤,破坏细胞膜完整性,进而改变细胞膜的粘性及流动性、细胞渗透压失衡、能量传导中断,使得胞内物质流出、干扰细胞与外部环境的物质交换过程,影响细胞功能,最终导致细胞失活[69, 72].
-
氧化损伤是目前学者们广泛认可的CeO2NPs可能致毒机制[83 − 84]. CeO2NPs具有独特的氧储存和释放能力,在CeO2NPs被还原时,位于CeO2NPs四面体空隙的氧会逸出,所剩余的两个电子被离其最近的两个Ce4+获得,Ce4+被还原成Ce3+[85],进而在细胞内产生O-2·和·OH等不同形式的ROS. 过量的ROS如不能被及时清除会在体内大量累积,进而引起氧化损伤. Zhang等[66]研究发现,1—100 nmol·L−1 CeO2NPs可以引起线虫体内ROS积累和氧化损伤,最终缩短线虫的寿命. 在CeO2NPs浓度低于1 nmol·L−1时就能引起线虫生命周期缩短12%. Sendra等[70]将紫贻贝暴露于100 μg·L−1 CeO2NPs 7 d,紫贻贝体内氧化还原失衡,代谢能力降低. 作者认为,CeO2NPs中的Ce3+与Ce4+之间的相互转化,导致了ROS和H2O2的生成,干扰细胞膜的营养输送功能,进而造成氧化损伤,引起毒性效应. Li等利用多组学方法,证明了CeO2NPs可以在多分子水平上诱发蚯蚓的氧化应激. CeO2NPs(50 mg·kg−1、500 mg·kg−1)能显著增加蚯蚓体内丙二醛、铁和钾的含量,降低与甘油磷脂和甘油磷脂代谢相关的某些基因和代谢产物的水平,这可能与肠道菌群失调密切相关[86].
-
CeO2NPs可以通过网格素蛋白介导的内吞作用进入细胞,分布在线粒体上,激活线粒体相关的caspase-3通路,最终诱导细胞凋亡[64, 87]. 此外,细胞凋亡可以通过NPs与DNA、DNA修复和胞内酶的直接相互作用来激活;也可能通过间接方式,如CeO2NPs与H2O2反应产生ROS,并诱导质粒DNA单链和双链断裂,DNA链损伤导致生物受到严重影响,甚至死亡[64, 88 − 89].
-
Ce3+与Ca2+具有相近的结构和离子半径(分别为101 pm和100 pm)[90],所以CeO2NPs可能会影响细胞中Ca2+与生物大分子的结合,干扰细胞的正常功能以及细胞内钙稳态[91]. Garaud等[22]研究发现,100 μg·L−1的CeO2NPs会导致贻贝体内Ca2+浓度显著下降. 这是双壳类中常见的金属解毒机制,Ca2+在细胞内形成钙结核,可以固定和消除CeO2NPs减轻其影响. 目前关于CeO2NPs针对无脊椎动物通过Ca2+调节途径影响机制今后可以增加相关研究,为揭示CeO2NPs对无脊椎动物胞内致毒机理提供参考.
鉴于CeO2NPs暴露对无脊椎动物影响的复杂性,当前CeO2NPs对无脊椎动物毒性机制的认识并不全面,后续研究应发挥多组学的优势,与典型生物标志物相结合来深入探索CeO2NPs致毒机制. 同时,进一步研究生物标志物及其信号传导途径对于控制CeO2NPs毒性也具重要意义.
-
随着CeO2NPs产量和终端产品快速增长,其在环境中的风险和生物毒性引起学者越来越多的关注. 迄今为止,国内外已开展了较多CeO2NPs对无脊椎动物的毒性调查,但相关研究结果并不一致甚至相反,深度和广度都有待提高. 本文结合文献中的相关研究结果,系统综述了CeO2NPs对无脊椎动物的影响及对其毒性影响因素. CeO2NPs在环境和食物链中迁移转化,可在无脊椎动物体内累积,引起急性或亚慢性毒性,影响无脊椎动物的生长发育、破坏组织结构并损害其系统功能. CeO2NPs诱导细胞氧化应激,造成无脊椎动物DNA损伤、线粒体损坏、染色体畸变以及细胞凋亡. 此外,理化性质和环境等因素都会影响CeO2NPs对无脊椎动物的毒性. 最后基于目前的研究提出一些展望,为CeO2NPs对无脊椎动物毒性的研究提供新的思路.
(1)关于CeO2NPs毒性效应的研究中,更多表现为对无脊椎动物的长期毒性影响,且CeO2NPs的暴露浓度远高于实际环境浓度值. 因此,未来需要在更接近真实环境条件下,开展无脊椎动物长期接触和多途径(如皮肤、摄食、呼吸等)暴露CeO2NPs的毒理研究.
(2)因CeO2NPs对无脊椎动物毒性效应涉及到较多的因素,如不同粒径、形貌的CeO2NPs在环境介质中溶解、释放进入生物体后迁移转化及毒性效应不尽相同,这就导致不同研究中的差异性结果很难得到合理的解释和明确结论. 为了获得可重复和比较的实验结果,有必要建立一个标准方法来评价CeO2NPs毒性,比如在标准中考虑到CeO2NPs的理化特性、实验设计和毒性评价方法等. 以完善CeO2NPs的生态毒性安全评价系统,便于政府规范CeO2NPs的生产和使用.
(3)自然环境中污染物并不是单独存在的,往往是多种污染物共存,其之间可能会发生相互作用. 目前,CeO2NPs对无脊椎动物毒性效应研究中很少涉及到复合污染,具体的毒性机制尚未明确. 因此,为客观揭示环境中污染物的行为,深入探究CeO2NPs与其他化学物复合污染的无脊椎动物毒性具有重要意义.
纳米氧化铈对无脊椎动物的毒性效应
Toxic effects of cerium oxide nanoparticles in invertebrates: A review
-
摘要: 近年来,纳米氧化铈(CeO2NPs)独特的理化性质使其生产规模和应用范围逐渐扩大,但CeO2NPs在生产、运输和商品化过程中不可避免地被释放到环境中,具有环境污染的潜在风险,其生物安全性受到越来越多的关注. 无脊椎动物是生物类群的重要组成,本文研究了国内外近十年的科学文献,综述了CeO2NPs在生物累积、行为反应、组织损伤、生长发育毒性、免疫毒性、生殖毒性、遗传毒性等方面对无脊椎动物的影响以及CeO2NPs毒性效应影响因素,总结了CeO2NPs对无脊椎动物的毒性机制,最后对未来研究方向进行了展望,以期为CeO2NPs的毒性评价、安全生产与应用提供参考.Abstract: In recent years, due to the unique physicochemical properties of cerium oxide nanoparticles (CeO2NPs), the production scale and application range of these particles have gradually expanded. However, CeO2NPs are inevitably released into the environment during production, transportation, and commercialization, which can cause environmental pollution, and their biosafety has received increasing attention. Invertebrates are an important component of biological taxa. In this review, studies performed in China and other countries and published in the past 10 years are studied. The effects of CeO2NPs on invertebrates in terms of bioaccumulation, behavioral response, tissue damage, growth and development toxicity, immunotoxicity, reproductive toxicity, genotoxicity, and the influencing factors of CeO2NPs toxicity are reviewed. Furthermore, the toxicity mechanism of CeO2NPs in invertebrates is discussed. Finally, new research direction are proposed to study the toxicity, safe production, and application of CeO2NPs in the future.
-
Key words:
- cerium oxide nanoparticles /
- invertebrate /
- toxic effect /
- influencing factor.
-

-
表 1 CeO2NPs在无脊椎动物中的生物累积
Table 1. Bioaccumulation of CeO2NPs in invertebrates
受试生物
Tested organism粒径/nm
Size暴露时长
Exposure
duration暴露途径
Exposure
pathway浓度
Concentration生物累积量
Bioaccumulation参考文献
Reference赤子爱胜蚓
(Eisenia fetida)<25 14 d 表皮 50 mg·kg−1 2.3 mg·kg−1 [15] 赤子爱胜蚓
(Eisenia fetida)20—200 28 d 表皮 1000 mg·kg−1和
2000 mg·kg−1BC-350:1.36—36.02 mg·kg−1;
BC-600:4.87—100.28 mg·kg−1[16] 赤子爱胜蚓
(Eisenia fetida)50—105 28 d 表皮 346.6 mg·kg−1 (1.5±0.0036)mg·g−1 [17] 粉正蚓
(Lumbricus rubellus)— 7 d 表皮 5000 mg·kg−1 5.3 µg·g−1 [18] 紫贻贝
(Mytilus galloprovincialis)5、50 28 d 水体 100 μg·L−1 Ce Naked:(0.25±0.113)µg·g−1;
Ce@Chitosan:(0.26±0.029)µg·g−1;
Ce@Alginate:(0.21±0.030)µg·g−1[19] 紫贻贝
(Mytilus galloprovincialis)231±16 4 d 水体 10 mg·L−1 62 µg·g−1 [20] 斑马贻贝
(Dreissena polymorpha)3—4 21 d 水体 1 mg·L−1 ba-CeO2:(10.2±1.3)μg·g−1;
ci-CeO2:(29.1±10.3)µg·g−1[21] 斑马贻贝
(Dreissena polymorpha)8 4 d 水体 100 μg·L−1 15 µg·g−1 [22] 钩虾
(Gammarus roeseli)8 4 d 水体 100 μg·L−1 59 µg·g−1 [22] 静水椎实螺
(Lymnaea stagnalis)3.8、185 270 d 摄食 5 mg·L−1 3.8 nm:(44±18)ng;
185 nm:(2.6±0.4)ng[23] 赤子爱胜蚓
(Eisenia fetida)5—80 28 d、56 d 表皮 256 mg·kg−1 NM-213 CeO2:4.82 mg·g−1;
NM-212 CeO2:4.41 mg·g−1;
NM-211 CeO2:4.56 mg·g−1[24] 蟋蟀
(Acheta domesticus)<10 14 d 摄食 707 ng·g−1 33.6 ng·g−1 [25] 墨西哥豆甲虫
(Epilacha vanvestis)8±1 36 d 摄食 2000 mg·kg−1 21.40 mg·kg−1 [26] 摇蚊
(Chironomus riparius)2—5 28 d 摄食 1 mg·L−1 柠檬酸涂层:606 mg·kg−1;
裸露:282 mg·kg−1[27] 注:BC-350和BC-600代表由核桃壳在350 ℃和600 ℃裂解产生的生物炭;NM-213、NM-212、NM-211为CeO2NPs特定代码,分别为CeO2(100—300 nm)、CeO2(10—80 nm)、CeO2(10—50 nm);Ce Naked代表裸露CeO2NPs、Ce@Chitosan代表海藻酸包覆的CeO2NPs、Ce@Alginate代表壳聚糖包覆的CeO2NPs;ci-CeO2代表柠檬酸包覆的CeO2NPs、ba-CeO2代表裸露的CeO2NPs;表中暴露浓度仅适用于受试生物的生物累积.
Note: BC-350 and BC-600 refers to biochar produced by cracking walnut shells at 350 ℃ and 600 ℃; NM-213, NM-212, and NM-211 are CeO2NPs specific codes for CeO2 (100—300 nm), CeO2 (10—80 nm), and CeO2 (10—50 nm), respectively; Ce Naked refers to naked CeO2NPs, Ce@Chitosan refers to alginate-coated CeO2NPs, Ce@Alginate refers to chitosan-coated CeO2NPs; ci-CeO2 refers to citric acid-coated CeO2NPs, ba-CeO2 refers to naked CeO2NPs; The exposure concentration in the table apply only to the bioaccumulation of the tested organisms.表 2 CeO2NPs对无脊椎动物的EC50/LC50
Table 2. EC50/LC50 of CeO2NPs in invertebrates
受试生物
Tested organism粒径/nm
Size暴露时长
Exposure durationEC50/LC50 参考文献
Reference蚯蚓(Eisenia hortensis) 22 48 h LC50:80 μg·mL−1 [34] 秀丽隐杆线虫(Caenorhabditis elegans) 4 48 h L1期 LC50:15.5 mg·L−1;L3期 LC50:272 mg·L−1 [35] 大型溞(Daphnia magna) 8 48 h LC50:0.012 mg·mL−1(0.011—0.015) [36] 大型溞(Daphnia magna) 50 48 h EC50:20.08 mg·L−1 [37] 大型溞(Daphnia magna) 6.44±0.42 24 h EC50 :430.2 mg·L−1(239.8—587.4) [28] 大型溞(Daphnia magna) 6.44±0.42 48 h EC50 :142.7 mg·L−1(85.7—210.9) [28] 卤虫(Artemia salina) 15±3.5 48 h LC50:30.8 mg·L−1(27.32—52.85) [38] 大型溞(Daphnia magna) 14 nm 21 d EC50:40.7 mg·L−1(33.6—49.3) [39] 大型溞(Daphnia magna) 20 nm 21 d EC50:36.9 mg·L−1(27.6—49.3) [39] 大型溞(Daphnia magna) 29 nm 21 d EC50:71.1 mg·L−1(61.0—82.8) [39] 同形溞(Daphnia similis) 8 48 h EC50:0.26 mg·L−1 [40] 蚤状溞(Daphnia pulex) 8 48 h EC50:91.79 mg·L−1 [40] 蚤状溞(Daphnia pulex) 8 72 h EC50 :0.94 mg·L−1 [40] 蚤状溞(Daphnia pulex) 8 96 h EC50 :0.78 mg·L−1 [40] 注:EC50/LC50括号中数字代表95%置信区间. Numbers in parentheses refers to 95% confidence intervals. 表 3 CeO2NPs对无脊椎动物毒性的主要影响因素
Table 3. Main influencing factors of CeO2NPs toxicity in invertebrates
受试生物
Tested organism影响因素
Influencing factor结果
Result参考文献
Reference大型溞
(Daphnia magna)粒径 毒性:14 nm>29 nm [39] 秀丽隐杆线虫
(Caenorhabditis elegans)粒径 毒性:15 nm>45 nm [59] 静水椎实螺
(Lymnaea stagnalis)粒径 生物利用率:3.8 nm>185 nm [23] 摇蚊
(Chironomus riparius)粒径、涂层 毒性:NP2(无包覆2—5 nm)>NP3
(无包覆20—60 nm)>NP1(三柠檬酸铵包覆)[32] 斑马贻贝
(Dreissena polymorpha)涂层 毒性:Alginate(海藻酸)>Chit(壳聚糖) [69] 斑马贻贝
(Dreissena polymorpha)涂层 生物累积量:柠檬酸>裸露 [21] 紫贻贝
(Mytilus galloprovincialis)涂层 毒性:Alginate(海藻酸)>Chit(壳聚糖) [19] 紫贻贝
(Mytilus galloprovincialis)表面电荷 毒性:负电荷>正电荷 [70] 秀丽隐杆线虫
(Caenorhabditis elegans)表面电荷 毒性:正电荷>中性、负电荷 [35] 赤子爱胜蚓
(Eisenia fetida)暴露介质 毒性:人工土壤>矿区土壤 [71] 赤子爱胜蚓
(Eisenia fetida)暴露介质 Ce累积:农业土壤>生物炭改良土壤 [16] 赤子爱胜蚓
(Eisenia fetida)暴露介质 氧化损伤:砂质土>粘土 [15] 河蚬
(Corbicula fluminea)盐度 基因表达:低盐度(1.5 psu)>高盐度(15 psu) [67] 卡尼鄂拉蜜蜂
(Apis mellifera carnica)温度 生物酶活性:夏季>冬季 [68] 紫贻贝
(Mytilus galloprovincialis)暴露途径 清除率:饮食暴露>直接暴露 [72] 夹杂带丝蚓
(Lumbriculus variegatus)暴露途径 累积:摄食>经皮吸收 [30] -
[1] KONSOLAKIS M, LYKAKI M. Recent advances on the rational design of non-precious metal oxide catalysts exemplified by CuOx/CeO2 binary system: Implications of size, shape and electronic effects on intrinsic reactivity and metal-support interactions[J]. Catalysts, 2020, 10(2): 160. doi: 10.3390/catal10020160 [2] SARKAR A, MAHENDRAN T S, MEENAKSHISUNDARAM A, et al. Role of cerium oxide nanoparticles in improving oxidative stress and developmental delays in Drosophila melanogaster as an in-vivo model for bisphenol a toxicity[J]. Chemosphere, 2021, 284: 131363. doi: 10.1016/j.chemosphere.2021.131363 [3] SUNDARARAJAN V, DAN P, KUMAR A, et al. Drosophila melanogaster as an in vivo model to study the potential toxicity of cerium oxide nanoparticles[J]. Applied Surface Science, 2019, 490: 70-80. doi: 10.1016/j.apsusc.2019.06.017 [4] YOU G X, XU Y, WANG P F, et al. Deciphering the effects of CeO2 nanoparticles on Escherichia coli in the presence of ferrous and sulfide ions: Physicochemical transformation-induced toxicity and detoxification mechanisms[J]. Journal of Hazardous Materials, 2021, 413: 125300. doi: 10.1016/j.jhazmat.2021.125300 [5] CHEN B H, STEPHEN INBARAJ B. Various physicochemical and surface properties controlling the bioactivity of cerium oxide nanoparticles[J]. Critical Reviews in Biotechnology, 2018, 38(7): 1003-1024. doi: 10.1080/07388551.2018.1426555 [6] GIESE B, KLAESSIG F, PARK B, et al. Risks, release and concentrations of engineered nanomaterial in the environment[J]. Scientific Reports, 2018, 8(1): 1565. doi: 10.1038/s41598-018-19275-4 [7] 王晓科, 石清清, 邓代莉, 等. 基于土壤模式生物的纳米材料毒理研究进展[J]. 生态毒理学报, 2018, 13(3): 31-41. doi: 10.7524/AJE.1673-5897.20171207001 WANG X K, SHI Q Q, DENG D L, et al. Review on toxicology of nanomaterials based on soil model organisms[J]. Asian Journal of Ecotoxicology, 2018, 13(3): 31-41 (in Chinese). doi: 10.7524/AJE.1673-5897.20171207001
[8] TOURINHO P S, van GESTEL C A M, LOFTS S, et al. Metal-based nanoparticles in soil: Fate, behavior, and effects on soil invertebrates[J]. Environmental Toxicology and Chemistry, 2012, 31(8): 1679-1692. doi: 10.1002/etc.1880 [9] ADEEL M, SHAKOOR N, SHAFIQ M, et al. A critical review of the environmental impacts of manufactured nano-objects on earthworm species[J]. Environmental Pollution, 2021, 290: 118041. doi: 10.1016/j.envpol.2021.118041 [10] BAKER A J. Bioaccumulation, biological effects and trophic transfer of metal (oxide) nanoparticles in marine invertebrates[D]. Exeter, South West England, UK: University of Exeter, 2017. [11] MORTAZAVI MILANI Z, CHARBGOO F, DARROUDI M. Impact of physicochemical properties of cerium oxide nanoparticles on their toxicity effects[J]. Ceramics International, 2017, 43(17): 14572-14581. doi: 10.1016/j.ceramint.2017.08.177 [12] MUKHERJEE K, ACHARYA K. Toxicological effect of metal oxide nanoparticles on soil and aquatic habitats[J]. Archives of Environmental Contamination and Toxicology, 2018, 75(2): 175-186. doi: 10.1007/s00244-018-0519-9 [13] 张萌, 罗雅琪, 段天欣, 等. 土壤中纳米颗粒的生物效应研究进展[J]. 环境化学, 2022, 41(11): 3613-3628. doi: 10.7524/j.issn.0254-6108.2021071904 ZHANG M, LUO Y Q, DUAN T X, et al. Research progress on biological effects of nanoparticles in soil[J]. Environmental Chemistry, 2022, 41(11): 3613-3628 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021071904
[14] 胡奕, 王艳龙, 林道辉. 纳米颗粒对大型蚤毒性效应的研究进展[J]. 科学通报, 2017, 62(24): 2734-2748. doi: 10.1360/N972017-00476 HU Y, WANG Y L, LIN D H. A review of the toxicity of nanoparticles to Daphnia magna[J]. Chinese Science Bulletin, 2017, 62(24): 2734-2748 (in Chinese). doi: 10.1360/N972017-00476
[15] CHEN D, XU W X, CAO S L, et al. Divergent responses of earthworms (Eisenia fetida) in sandy loam and clay soils to cerium dioxide nanoparticles[J]. Environmental Science and Pollution Research, 2023, 30(2): 5231-5241. doi: 10.1007/s11356-022-22448-4 [16] SERVIN A D, CASTILLO-MICHEL H, HERNANDEZ-VIEZCAS J A, et al. Bioaccumulation of CeO2 nanoparticles by earthworms in biochar-amended soil: A synchrotron microspectroscopy study[J]. Journal of Agricultural and Food Chemistry, 2018, 66(26): 6609-6618. doi: 10.1021/acs.jafc.7b04612 [17] CARBONE S, HERTEL-AAS T, JONER E J, et al. Bioavailability of CeO2 and SnO2 nanoparticles evaluated by dietary uptake in the earthworm Eisenia fetida and sequential extraction of soil and feed[J]. Chemosphere, 2016, 162: 16-22. doi: 10.1016/j.chemosphere.2016.07.044 [18] ANTISARI L V, CARBONE S, GATTI A, et al. Toxicological effects of engineered nanoparticles on earthworms (Lumbricus rubellus) in short exposure[J]. EQA-International Journal of Environmental Quality, 2012, 8: 51-60. [19] NIGRO L, FREITAS R, MAGGIONI D, et al. Coating with polysaccharides influences the surface charge of cerium oxide nanoparticles and their effects to Mytilus galloprovincialis[J]. NanoImpact, 2021, 24: 100362. doi: 10.1016/j.impact.2021.100362 [20] MONTES M O, HANNA S K, LENIHAN H S, et al. Uptake, accumulation, and biotransformation of metal oxide nanoparticles by a marine suspension-feeder[J]. Journal of Hazardous Materials, 2012, 225/226: 139-145. doi: 10.1016/j.jhazmat.2012.05.009 [21] GARAUD M, AUFFAN M, DEVIN S, et al. Integrated assessment of ceria nanoparticle impacts on the freshwater bivalve Dreissena polymorpha[J]. Nanotoxicology, 2016, 10(7): 935-944. doi: 10.3109/17435390.2016.1146363 [22] GARAUD M, TRAPP J, DEVIN S, et al. Multibiomarker assessment of cerium dioxide nanoparticle (nCeO2) sublethal effects on two freshwater invertebrates, Dreissena polymorpha and Gammarus roeseli[J]. Aquatic Toxicology, 2015, 158: 63-74. doi: 10.1016/j.aquatox.2014.11.004 [23] GEITNER N K, COOPER J L, AVELLAN A, et al. Size-based differential transport, uptake, and mass distribution of ceria (CeO2) nanoparticles in wetland mesocosms[J]. Environmental Science & Technology, 2018, 52(17): 9768-9776. [24] LAHIVE E, JURKSCHAT K, SHAW B J, et al. Toxicity of cerium oxide nanoparticles to the earthworm Eisenia fetida: Subtle effects[J]. Environmental Chemistry, 2014, 11(3): 268. doi: 10.1071/EN14028 [25] HAWTHORNE J, deLa TORRE ROCHE R, XING B S, et al. Particle-size dependent accumulation and trophic transfer of cerium oxide through a terrestrial food chain[J]. Environmental Science & Technology, 2014, 48(22): 13102-13109. [26] MAJUMDAR S, TRUJILLO-REYES J, HERNANDEZ-VIEZCAS J A, et al. Cerium biomagnification in a terrestrial food chain: Influence of particle size and growth stage[J]. Environmental Science & Technology, 2016, 50(13): 6782-6792. [27] BOUR A, MOUCHET F, CADARSI S, et al. CeO2 nanoparticle fate in environmental conditions and toxicity on a freshwater predator species: A microcosm study[J]. Environmental Science and Pollution Research, 2017, 24(20): 17081-17089. doi: 10.1007/s11356-017-9346-1 [28] 王婧坤, 马宇辉, 赵鑫, 等. 纳米二氧化铈对蛋白核小球藻和大型溞的毒性及其在大型溞体内的形态转化[J]. 生态毒理学报, 2016, 11(1): 362-368. WANG J K, MA Y H, ZHAO X, et al. Toxicity of CeO2 nanoparticles to Chlorella pyrenoidosa and Daphnia magna, and its transformation inside the Daphnia magna[J]. Asian Journal of Ecotoxicology, 2016, 11(1): 362-368 (in Chinese).
[29] CANESI L, FABBRI R, GALLO G, et al. Biomarkers in Mytilus galloprovincialis exposed to suspensions of selected nanoparticles (Nano carbon black, C60 fullerene, Nano-TiO2, Nano-SiO2)[J]. Aquatic Toxicology, 2010, 100(2): 168-177. doi: 10.1016/j.aquatox.2010.04.009 [30] CROSS R K, TYLER C R, GALLOWAY T S. The fate of cerium oxide nanoparticles in sediments and their routes of uptake in a freshwater worm[J]. Nanotoxicology, 2019, 13(7): 894-908. doi: 10.1080/17435390.2019.1593540 [31] SELCK H, HANDY R D, FERNANDES T F, et al. Nanomaterials in the aquatic environment: A European Union-United States perspective on the status of ecotoxicity testing, research priorities, and challenges ahead[J]. Environmental Toxicology and Chemistry, 2016, 35(5): 1055-1067. doi: 10.1002/etc.3385 [32] BOUR A, MOUCHET F, CADARSI S, et al. Impact of CeO2 nanoparticles on the functions of freshwater ecosystems: A microcosm study[J]. Environmental Science: Nano, 2016, 3(4): 830-838. doi: 10.1039/C6EN00116E [33] JACINTO-MALDONADO M, MEZA-FIGUEROA D, PEDROZA-MONTERO M, et al. Mites as a potential path for Ce-Ti exposure of amphibians[J]. Frontiers in Environmental Science, 2022, 10: 870645. doi: 10.3389/fenvs.2022.870645 [34] GÜNEŞ M, YALÇıN B, ALI M M, et al. Genotoxic assessment of cerium and magnesium nanoparticles and their ionic forms in Eisenia hortensis coelomocytes by alkaline comet assay[J]. Microscopy Research and Technique, 2022, 85(9): 3095-3103. doi: 10.1002/jemt.24168 [35] COLLIN B, OOSTVEEN E, TSYUSKO O V, et al. Influence of natural organic matter and surface charge on the toxicity and bioaccumulation of functionalized ceria nanoparticles in Caenorhabditis elegans[J]. Environmental Science & Technology, 2014, 48(2): 1280-1289. [36] GARCÍA A, ESPINOSA R, DELGADO L, et al. Acute toxicity of cerium oxide, titanium oxide and iron oxide nanoparticles using standardized tests[J]. Desalination, 2011, 269(1/2/3): 136-141. [37] ERDINçMER N, SPONZA D T. Evaluation of the effects of nano-metal oxide (Nano-SiO2, Nano-HfO2, Nano-CeO2, Nano-Ta2O5) on Microtox, Algae and Daphnia magna[J]: Asian Basic and Applied Research Journal, 2020: 37-42. [38] DAVID E M D S, ROYAM M M, SEKAR S K R, et al. Toxicity, uptake, and accumulation of nano and bulk cerium oxide particles in Artemia salina[J]. Environmental Science and Pollution Research, 2017, 24(31): 24187-24200. doi: 10.1007/s11356-017-9975-4 [39] van HOECKE K, QUIK J T K, MANKIEWICZ-BOCZEK J, et al. Fate and effects of CeO2 nanoparticles in aquatic ecotoxicity tests[J]. Environmental Science & Technology, 2009, 43(12): 4537-4546. [40] ARTELLS E, ISSARTEL J, AUFFAN M, et al. Exposure to cerium dioxide nanoparticles differently affect swimming performance and survival in two daphnid species[J]. PLoS One, 2013, 8(8): e71260. doi: 10.1371/journal.pone.0071260 [41] KARIMI S, TROEUNG M, WANG R, et al. Acute and chronic toxicity to Daphnia magna of colloidal silica nanoparticles in a chemical mechanical planarization slurry after polishing a gallium arsenide wafer[J]. NanoImpact, 2019, 13: 56-65. doi: 10.1016/j.impact.2018.12.004 [42] FARIAS I A P, SANTOS C C L, XAVIER A L, et al. Synthesis, physicochemical characterization, antifungal activity and toxicological features of cerium oxide nanoparticles[J]. Arabian Journal of Chemistry, 2021, 14(1): 102888. doi: 10.1016/j.arabjc.2020.10.035 [43] TOURINHO P S, WAALEWIJN-KOOL P L, ZANTKUIJL I, et al. CeO2 nanoparticles induce no changes in phenanthrene toxicity to the soil organisms Porcellionides pruinosus and Folsomia candida[J]. Ecotoxicology and Environmental Safety, 2015, 113: 201-206. doi: 10.1016/j.ecoenv.2014.12.006 [44] FAIMALI M, GAMBARDELLA C, COSTA E, et al. Old model organisms and new behavioral end-points: Swimming alteration as an ecotoxicological response[J]. Marine Environmental Research, 2017, 128: 36-45. doi: 10.1016/j.marenvres.2016.05.006 [45] GAMBARDELLA C, MESARIČ T, MILIVOJEVIĆ T, et al. Effects of selected metal oxide nanoparticles on Artemia salina larvae: Evaluation of mortality and behavioural and biochemical responses[J]. Environmental Monitoring and Assessment, 2014, 186(7): 4249-4259. doi: 10.1007/s10661-014-3695-8 [46] BOUR A, MOUCHET F, VERNEUIL L, et al. Toxicity of CeO2 nanoparticles at different trophic levels–Effects on diatoms, chironomids and amphibians[J]. Chemosphere, 2015, 120: 230-236. doi: 10.1016/j.chemosphere.2014.07.012 [47] ZIDAR P, KOS M, ILIČ E, et al. Avoidance behaviour of isopods (Porcellio scaber) exposed to food or soil contaminated with Ag- and CeO2- nanoparticles[J]. Applied Soil Ecology, 2019, 141: 69-78. doi: 10.1016/j.apsoil.2019.05.011 [48] MALEV O, TREBŠE P, PIECHA M, et al. Effects of CeO2 nanoparticles on terrestrial isopod Porcellio scaber: Comparison of CeO2 biological potential with other nanoparticles[J]. Archives of Environmental Contamination and Toxicology, 2017, 72(2): 303-311. doi: 10.1007/s00244-017-0363-3 [49] ROSSBACH L M, BREDE D A, NUYTS G, et al. Synchrotron XRF analysis identifies cerium accumulation colocalized with pharyngeal deformities in CeO2 NP-exposed Caenorhabditis elegans[J]. Environmental Science & Technology, 2022, 56(8): 5081-5089. [50] ARNOLD M C, BADIREDDY A R, WIESNER M R, et al. Cerium oxide nanoparticles are more toxic than equimolar bulk cerium oxide in Caenorhabditis elegans[J]. Archives of Environmental Contamination and Toxicology, 2013, 65(2): 224-233. doi: 10.1007/s00244-013-9905-5 [51] STOWERS C, KING M, ROSSI L, et al. Initial sterilization of soil affected interactions of cerium oxide nanoparticles and soybean seedlings (Glycine max (L. ) merr. ) in a greenhouse study[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(8): 10307-10314. [52] GAISER B K, BISWAS A, ROSENKRANZ P, et al. Effects of silver and cerium dioxide micro- and nano-sized particles on Daphnia magna[J]. Journal of Environmental Monitoring, 2011, 13((5): ): 1227-1235. doi: 10.1039/c1em10060b [53] AUFFAN M, BERTIN D, CHAURAND P, et al. Role of molting on the biodistribution of CeO2 nanoparticles within Daphnia pulex[J]. Water Research, 2013, 47(12): 3921-3930. doi: 10.1016/j.watres.2012.11.063 [54] MAYALL C, DOLAR A, JEMEC KOKALJ A, et al. Stressor-dependant changes in immune parameters in the terrestrial isopod crustacean, Porcellio scaber: A focus on nanomaterials[J]. Nanomaterials, 2021, 11((4): ): 934. doi: 10.3390/nano11040934 [55] BALLARIN L, KARAHAN A, SALVETTI A, et al. Stem cells and innate immunity in aquatic invertebrates: Bridging two seemingly disparate disciplines for new discoveries in biology[J]. Frontiers in Immunology, 2021, 12: 688106. doi: 10.3389/fimmu.2021.688106 [56] AYHAN M M, KATALAY S, GÜNAL A Ç. How pollution effects the immune systems of invertebrate organisms (Mytilus galloprovincialis Lamark, 1819)[J]. Marine Pollution Bulletin, 2021, 172: 112750. doi: 10.1016/j.marpolbul.2021.112750 [57] AUGUSTE M, BALBI T, MONTAGNA M, et al. In vivo immunomodulatory and antioxidant properties of nanoceria (nCeO2) in the marine mussel Mytilus galloprovincialis[J]. Comparative Biochemistry and Physiology. Toxicology & Pharmacology: CBP, 2019, 219: 95-102. [58] CASTRO B M M, SANTOS-RASERA J R, ALVES D S, et al. Ingestion and effects of cerium oxide nanoparticles on Spodoptera frugiperda (Lepidoptera: Noctuidae)[J]. Environmental Pollution, 2021, 279: 116905. doi: 10.1016/j.envpol.2021.116905 [59] ROH J Y, PARK Y K, PARK K, et al. Ecotoxicological investigation of CeO2 and TiO2 nanoparticles on the soil nematode Caenorhabditis elegans using gene expression, growth, fertility, and survival as endpoints[J]. Environmental Toxicology and Pharmacology, 2010, 29(2): 167-172. doi: 10.1016/j.etap.2009.12.003 [60] ORAL R, BUSTAMANTE P, WARNAU M, et al. Cytogenetic and developmental toxicity of cerium and lanthanum to sea urchin embryos[J]. Chemosphere, 2010, 81(2): 194-198. doi: 10.1016/j.chemosphere.2010.06.057 [61] NAIR P M G, PARK S Y, LEE S W, et al. Differential expression of ribosomal protein gene, gonadotrophin releasing hormone gene and Balbiani ring protein gene in silver nanoparticles exposed Chironomus riparius[J]. Aquatic Toxicology, 2011, 101(1): 31-37. doi: 10.1016/j.aquatox.2010.08.013 [62] YALÇıN B, GÜNEŞ M, KURŞUN A Y, et al. Genotoxic hazard assessment of cerium oxide and magnesium oxide nanoparticles in Drosophila[J]. Nanotoxicology, 2022, 16(3): 393-407. doi: 10.1080/17435390.2022.2098072 [63] SAVIĆ-ZDRAVKOVIĆ D, MILOŠEVIĆ D, ULUER E, et al. A multiparametric approach to cerium oxide nanoparticle toxicity assessment in non-biting midges[J]. Environmental Toxicology and Chemistry, 2020, 39(1): 131-140. doi: 10.1002/etc.4605 [64] KOEHLÉ-DIVO V, COSSU-LEGUILLE C, PAIN-DEVIN S, et al. Genotoxicity and physiological effects of CeO2 NPs on a freshwater bivalve (Corbicula fluminea)[J]. Aquatic Toxicology, 2018, 198: 141-148. doi: 10.1016/j.aquatox.2018.02.020 [65] PENG C, ZHANG W, GAO H P, et al. Behavior and potential impacts of metal-based engineered nanoparticles in aquatic environments[J]. Nanomaterials (Basel, Switzerland), 2017, 7(1): 21. doi: 10.3390/nano7010021 [66] ZHANG H F, HE X, ZHANG Z Y, et al. Nano-CeO2 exhibits adverse effects at environmental relevant concentrations[J]. Environmental Science & Technology, 2011, 45(8): 3725-3730. [67] KOEHLÉ-DIVO V, PAIN-DEVIN S, BERTRAND C, et al. Corbicula fluminea gene expression modulated by CeO2 nanomaterials and salinity[J]. Environmental Science and Pollution Research, 2019, 26(15): 15174-15186. doi: 10.1007/s11356-019-04927-3 [68] KOS M, JEMEC KOKALJ A, GLAVAN G, et al. Cerium(iv) oxide nanoparticles induce sublethal changes in honeybees after chronic exposure[J]. Environmental Science: Nano, 2017, 4(12): 2297-2310. doi: 10.1039/C7EN00596B [69] DELLA TORRE C, MAGGIONI D, NIGRO L, et al. Alginate coating modifies the biological effects of cerium oxide nanoparticles to the freshwater bivalve Dreissena polymorpha[J]. The Science of the Total Environment, 2021, 773: 145612. doi: 10.1016/j.scitotenv.2021.145612 [70] SENDRA M, VOLLAND M, BALBI T, et al. Cytotoxicity of CeO2 nanoparticles using in vitro assay with Mytilus galloprovincialis hemocytes: Relevance of Zeta potential, shape and biocorona formation[J]. Aquatic Toxicology, 2018, 200: 13-20. doi: 10.1016/j.aquatox.2018.04.011 [71] TANG W T, WANG G Y, ZHANG S R, et al. Physiochemical responses of earthworms (Eisenia fetida) under exposure to lanthanum and cerium alone or in combination in artificial and contaminated soils[J]. Environmental Pollution, 2022, 296: 118766. doi: 10.1016/j.envpol.2021.118766 [72] CONWAY J R, HANNA S K, LENIHAN H S, et al. Effects and implications of trophic transfer and accumulation of CeO2 nanoparticles in a marine mussel[J]. Environmental Science & Technology, 2014, 48(3): 1517-1524. [73] YOKEL R A, HUSSAIN S, GARANTZIOTIS S, et al. The Yin: An adverse health perspective of nanoceria: Uptake, distribution, accumulation, and mechanisms of its toxicity[J]. Environmental Science. Nano, 2014, 1(5): 406-428. doi: 10.1039/C4EN00039K [74] AHMAD GATOO M, NASEEM S, ARFAT M Y, et al. Physicochemical properties of nanomaterials: Implication in associated toxic manifestations[J]. BioMed Research International, 2014, 2014: 498420. [75] FRÖHLICH E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles[J]. International Journal of Nanomedicine, 2012, 7: 5577-5591. [76] ARNDT D A, OOSTVEEN E K, TRIPLETT J, et al. The role of charge in the toxicity of polymer-coated cerium oxide nanomaterials to Caenorhabditis elegans[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2017, 201: 1-10. [77] ASATI A, SANTRA S, KAITTANIS C, et al. Surface-charge-dependent cell localization and cytotoxicity of cerium oxide nanoparticles[J]. ACS Nano, 2010, 4(9): 5321-5331. doi: 10.1021/nn100816s [78] VILLA S, MAGGIONI D, HAMZA H, et al. Natural molecule coatings modify the fate of cerium dioxide nanoparticles in water and their ecotoxicity to Daphnia magna[J]. Environmental Pollution, 2020, 257: 113597. doi: 10.1016/j.envpol.2019.113597 [79] DEVOILLE L, REVEL M, BATANA C, et al. Combined influence of oxygenation and salinity on aggregation kinetics of the silver reference nanomaterial NM-300K[J]. Environmental Toxicology and Chemistry, 2018, 37(4): 1007-1013. doi: 10.1002/etc.4052 [80] NEDERSTIGT T A P, PEIJNENBURG W J G M, BLEEKER E A J, et al. Applicability of nanomaterial-specific guidelines within long-term Daphnia magna toxicity assays: A case study on multigenerational effects of nTiO2 and nCeO2 exposure in the presence of artificial daylight[J]. Regulatory Toxicology and Pharmacology, 2022, 131: 105156. doi: 10.1016/j.yrtph.2022.105156 [81] van KOETSEM F, WOLDETSADIK G S, FOLENS K, et al. Partitioning of Ag and CeO2 nanoparticles versus Ag and Ce ions in soil suspensions and effect of natural organic matter on CeO2 nanoparticles stability[J]. Chemosphere, 2018, 200: 471-480. doi: 10.1016/j.chemosphere.2018.02.133 [82] BOTTERO J Y, AUFFAN M, BORSCHNEK D, et al. Nanotechnology, global development in the frame of environmental risk forecasting. A necessity of interdisciplinary researches[J]. Comptes Rendus Geoscience, 2015, 347(1): 35-42. doi: 10.1016/j.crte.2014.10.004 [83] MISHRA M, PANDA M. Reactive oxygen species: The root cause of nanoparticle-induced toxicity in Drosophila melanogaster[J]. Free Radical Research, 2021, 55(8): 919-935. doi: 10.1080/10715762.2021.1914335 [84] KUMAR A S, SUNDARARAJAN V, G VENKATASUBBU D, et al. To comprehend the influence of annealing temperature on cerium oxide nanoparticles and its subsequent toxic effects using Drosophila melanogaster model[J]. Materials Today: Proceedings, 2022, 65: 207-214. doi: 10.1016/j.matpr.2022.06.117 [85] SHOKO E, SMITH M F, McKENZIE R H. Charge distribution near bulk oxygen vacancies in cerium oxides[J]. Journal of Physics. Condensed Matter: an Institute of Physics Journal, 2010, 22(22): 223201. [86] LI W X, HE E K, ZHANG P H, et al. Multiomics analyses uncover nanoceria triggered oxidative injury and nutrient imbalance in earthworm Eisenia fetida[J]. Journal of Hazardous Materials, 2022, 437: 129354. doi: 10.1016/j.jhazmat.2022.129354 [87] SINGH S, KUMAR A, KARAKOTI A, et al. Unveiling the mechanism of uptake and sub-cellular distribution of cerium oxide nanoparticles[J]. Molecular BioSystems, 2010, 6(10): 1813-1820. doi: 10.1039/c0mb00014k [88] NOVENTA S, HACKER C, ROWE D, et al. Dissolution and bandgap paradigms for predicting the toxicity of metal oxide nanoparticles in the marine environment: An in vivo study with oyster embryos[J]. Nanotoxicology, 2018, 12(1): 63-78. doi: 10.1080/17435390.2017.1418920 [89] DOGRA Y, ARKILL K P, ELGY C, et al. Cerium oxide nanoparticles induce oxidative stress in the sediment-dwelling amphipod Corophium volutator[J]. Nanotoxicology, 2016, 10(4): 480-487. doi: 10.3109/17435390.2015.1088587 [90] PLAKHOVA T V, ROMANCHUK A Y, YAKUNIN S N, et al. Solubility of nanocrystalline cerium dioxide: Experimental data and thermodynamic modeling[J]. The Journal of Physical Chemistry C, 2016, 120(39): 22615-22626. doi: 10.1021/acs.jpcc.6b05650 [91] HORIE M, NISHIO K, KATO H, et al. Cellular responses induced by cerium oxide nanoparticles: Induction of intracellular calcium level and oxidative stress on culture cells[J]. The Journal of Biochemistry, 2011, 150(4): 461-471. doi: 10.1093/jb/mvr081 -



 下载:
下载: