-
对硝基苯酚(p-nitrophenol,p-NP)是一种重要的有机合成材料,同时也是典型内分泌干扰物和难降解有机污染物,在自然环境中半衰期较长,对水生生物、水体环境和人体健康均有不利影响[1 − 3]. 美国环境保护署将p-NP列为水体中的优先控制污染物,同时p-NP也是我国饮用水水质标准中的污染物控制指标之一[4 − 6].
p-NP具有雌激素活性和抗雄激素活性, 研究表明p-NP可能分别与雌激素受体和雄激素受体相互作用[7]. Li等[8]通过体内实验发现每天向未成熟雌性大鼠注射p-NP会导致子宫重量显著增加,而向未成熟雄性大鼠施用p-NP则会导致生长依赖雄激素的副性腺重量减少. 而Zhang等[9]研究发现,经p-NP治疗的未成熟雄性大鼠的血清雄激素浓度和雄激素受体表达水平均上调,这表明p-NP抗雄激素活性的分子机制是复杂的. 雄激素受体活性通过直接蛋白-蛋白相互作用调节,应激诱导的热激蛋白(heat shock protein 90,HSP)与伴侣蛋白FK506结合蛋白(FK506 binding protein,FKBP5)通过形成FKBP5-Hsp90超复合物来调节雄激素受体活性[10]. 尽管p-NP在体内具有抗雄激素作用,但p-NP抑制雄激素受体信号的分子机制仍不十分清楚. Wu等[11]来用微摩尔亲和力(micromolar affinity)表征了p-NP与FKBP51的结合,实验和分子动力学模拟结果发现p-NP稳定地结合在FK1区域,p-NP结合的热点残基主要是疏水性官能团,p-NP可能通过下调雄激素受体活性激活下游基因的表达水平抑制人类前列腺癌细胞的雄激素依赖性生长,研究结果可以为评估p-NP的潜在健康影响提供新的指导.
近年来,分子对接技术作为计算生物学重要组成部分,在药物研发、生物修复以及计算毒理学等领域起到重要作用[12 − 13]. Ding等[14]利用分子对接技术研究了对羟基苯甲酸酯类物质侧链官能团对其抗雄激素活性的影响,结果表明侧链官能团的种类和长度对抗雄激素活性存在显著影响,同时对羟基苯甲酸酯类物质抗雄激素活性与结合能呈线性关系. Ng等[15]为了研究全氟化合物的生物累积性,利用分子对接技术预测其结合强度和生物半衰期,结果表明全氟辛烷磺酸能够成功对接到人血清白蛋白上且偏差小于2 Å,为新污染物的环境风险管控提供新的思路. 江文婷等[16]利用分子对接技术研究抗冻多肽与海鲈鱼肌球蛋白重链的作用位点及可能的作用机制,结果表明肽段GPR和GPAGGK能够通过碳氢键、氢键和范德华力等分子作用力对海鲈鱼肌球蛋白的结构及聚集行为产生影响,阻碍蛋白侧链聚集、结构改变和冰晶的位移等.
有关研究已经对p-NP在环境中的降解路径和降解产物进行了研究,然而环境中p-NP降解产物(p-NP degradation products,p-NP-DPs)与FKBP5相互作用及其分子水平机制的研究尚未开展. 赵子晗[17]利用紫外全谱扫描和液质联用测定p-NP-DPs,主要有对苯二酚、邻苯二酚、4-硝基邻苯二酚、1,2,4-苯三酚、对苯醌、苯酚等6种物质. Yang等[18]发现环境中p-NP-DPs主要包括对苯二酚、邻苯二酚、4-硝基邻苯二酚、对苯醌、苯酚以及小分子有机酸. p-NP-DPs与和FKBP5相互作用机理尚不清晰,而p-NP-DPs与FKBP5相互作用性能和机理对于理解和防控环境中p-NP对人体的健康风险十分重要. 小分子污染物的降解产物由于具有污染物类似的结构而具有相似的环境效应,污染物与受体蛋白的相互作用受到官能团和分子量等理化性质的影响[19 − 22]. Anzelle等[23]通过研究亚甲基蓝结构类似物对单胺氧化酶抑制作用的影响,结果发现亚甲基蓝、Azure B和ethylthioninium chloride(ETC)对单胺氧化酶A(monoamine oxidase A,MAOA)和单胺氧化酶B(monoamine oxidase B,MAOB)的半数抑制浓度(half maximal inhibitory concentration,IC50)分别为0.07 μmol·L−1(亚甲基蓝-MAOA)、0.01 μmol·L−1(Azure B-MAOA)和0.51 μmol·L−1(ETC-MAOA),4.47 μmol·L−1(亚甲基蓝-MAOB)、0.97 μmol·L−1(Azure B-MAOB)和0.59 μmol·L−1(ETC-MAOB). 袁霞等[24]通过HRMS Orbitrap和GC-MS鉴定出UV/氯高级氧化工艺降解卡马西平的10种降解产物,并利用发光细菌毒性实验和ECOSAR预测卡马西平降解产物的毒性,结果表明卡马西平在UV/氯高级氧化工艺中产生更高毒性的中间产物,对水质安全和污染物毒性管控造成潜在风险.
环境中p-NP-DPs与FKBP5结合形成p-NP-DPs-FKBP5加合物是产生雌激素和抗雄激素活性的主要机制[8 − 10],而p-NP-DPs与FKBP5结合的分子水平机制亟需阐述清楚. 基于此,本文采用通过分子对接技术模拟计算p-NP-DPs与FKBP5相互作用的结合能和结合面积. 在此基础上,通过Spearman相关性和Pearson相关性分析探讨p-NP-DPs理化性质对p-NP-DPs与FKBP5结合的影响,剖析影响p-NP-DPs与FKBP5结合的关键因子,从分子水平阐述p-NP-DPs与FKBP5相互作用的本质. 研究结果有助于增进人们对水环境中p-NP-DPs新污染物分子水平健康效应和环境风险的认识和理解.
-
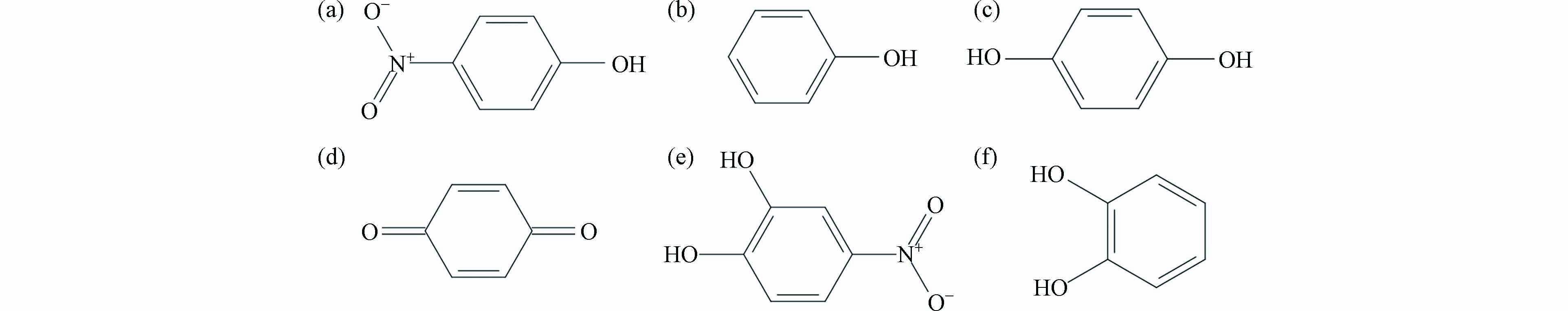
选择用于分子对接研究的p-NP-DPs为p-NP、苯酚、对苯二酚、对苯醌、4-硝基邻苯二酚和邻苯二酚,化学结构式及其理化性质分别见图1和表1. 根据p-NP-DPs的CAS号,通过PubChem网站(https://pubchem.ncbi.nlm.nih.gov/)下载小分子三维结构,利用分子可视化软件分别对配体小分子进行电荷、质子化状态确认. 通过AutoDock 4.2软件Minimized模块对小分子进行能量最优化、加氢、加电荷及完善结构处理实现小分子的结构修饰,最后将p-NP-DPs的三维结构分别保存为pdb格式文件作为配体结构.
FKBP5原始结构(PDB: 5OMP)从国际标准蛋白质数据库(http://www.rcsb.org/)下载[25]. 通过分子可视化软件对FKBP5进行去除水分子和不需要的杂原子等操作处理,然后通过AutoDock 4.2软件Minimized模块将目的蛋白结构进行能量最优化,同时进行加氢、加电荷及补充大分子的氨基酸残缺结构等完善蛋白结构,最后将FKBP5的晶体结构保存为pdb格式作为受体结构.
打开AutoDock 4.2软件,导入受体结构,确定分子对接口袋区;导入配体结构,通过Dock模块进行分子对接. 通过给出配体与受体结合时氢键、疏水作用、结合面积、能量变化、药效团等参数,对p-NP-DPs与FKBP5相互作用及其分子机制进行解析.
-
采用SPSS 25.0软件(IBM, Armonk,NY,美国)对实验结果进行统计分析. 采用Pearson相关性和Spearman相关性对p-NP-DPs与FKBP5相互作用参数和p-NP-DPs理化性质之间的相关性进行分析,P<0.05被认为具有统计学意义. 根据公式(1)—(4)计算 Pearson 相关性:
式中SX i 和SY j是样本Xi和样本Yj的标准差,Cov(Xi,Yj)是样本Xi和样本Yj的协方差,m表示样本中个体的序号,n表示样本的容量. 样本Xi代表p-NP-DPS的11种理化性质,当i=1, 2…11时分别对应分子量、熔点、沸点、闪点、密度、lgSw、亨利常数、lgP、拓扑极表面积、氢键供体数量和氢键受体数量. 样本Yj代表p-NP-DPS与FKBP5相互作用强度,当j=1, 2时分别对应结合能绝对值和结合面积.
根据公式(5)计算Spearman相关性:
式中,dm是样本Xi和Yj中的第m个体的等级差,n表示样本的容量. 样本Xi代表p-NP和p-NP-DPS的11种理化性质,当i=1, 2…11时分别对应分子量、熔点、沸点、闪点、密度、lgSw、亨利常数、lgP、拓扑极表面积、氢键供体数量和氢键受体数量. 样本Yj代表p-NP-DPS与FKBP5相互作用强度,当j=1, 2时分别对应结合能绝对值和结合面积.
-
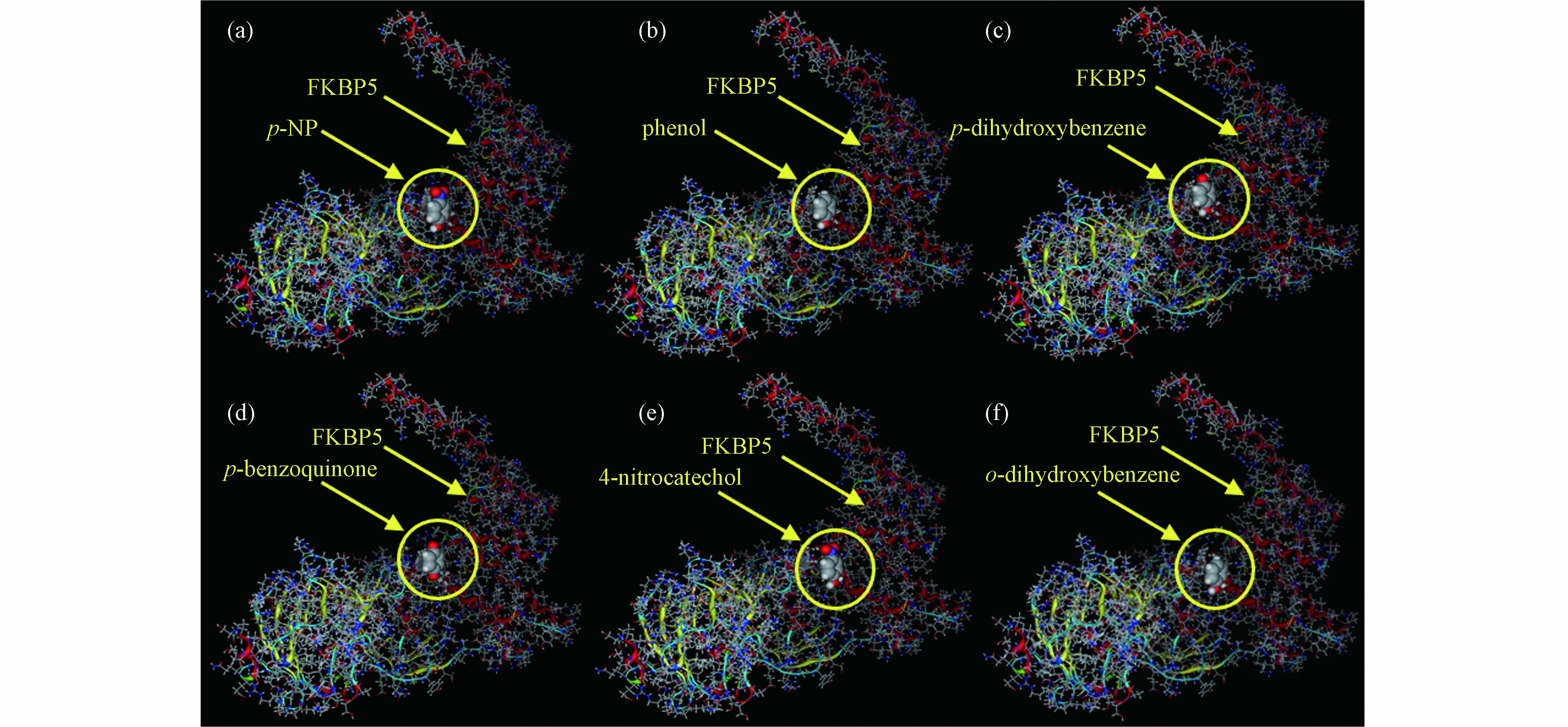
分子对接是目前计算化学中一种重要的研究方法,可用于p-NP-DPs与FKBP5相互作用结合位点和相互作用的研究[26 − 27]. p-NP-DPs与FKBP5分子对接后的最优位置如图2所示. 由图2(a)可知,p-NP与FKBP5相互作用的关键氨基酸为Glu227、Ala228、Lys254、Glu255、Gly282、Met285、Gln286和Trp297. p-NP与FKBP5的相互作用包括—OH→Gly282(氢键)、—OH→Glu227(氢键)、—NO2←Met285(氢键)、—OH→Gln286(氢键)、—OH→Lys254(氢键)、苯环-Trp297(π-π/范德华力相互作用)、苯环-Glu227(范德华力相互作用)、—OH→Glu255(氢键)和苯环-Ala228(范德华力相互作用). 受体和供体相互作用的强度由结合能和结合面积决定,p-NP与FKBP5相互作用的结合能和结合面积分别为−3.76 kcal·mol−1和200 Å2.
如图2(b)所示,苯酚与FKBP5相互作用的关键氨基酸为Pro221、Glu227、Lys254、Glu255、Lys283、Met285、Gln286和Trp297. 苯酚与FKBP5的相互作用包括—OH→Gln286(氢键)、—OH→Pro221(氢键)、—OH→Lys254(氢键)、苯环-Trp297(π-π/范德华力相互作用)、—OH→Glu227(氢键)、苯环-Met285(范德华力相互作用)、苯环-Lys283(范德华力相互作用)、苯环-Glu227(范德华力相互作用)和—OH→Glu255(氢键). 苯酚与FKBP5相互作用的结合能和结合面积分别为−3.91 kcal·mol−1和173 Å2.
如图2(c)所示,对苯二酚与FKBP5相互作用的关键氨基酸为Pro221、Glu227、Gly282、Gln286和Arg331. 对苯二酚与FKBP5的相互作用包括—OH→Gln286(氢键)、—OH→Pro221(氢键)、—OH→Glu227(氢键)、—OH→Gly282(氢键)和—OH←Arg331(氢键). 对苯二酚与FKBP5相互作用的结合能和结合面积分别为-3.81 kcal·mol−1和175 Å2.
如图2(d)所示,对苯醌与FKBP5相互作用的关键氨基酸为Lys204、Ala228、Met285、Arg331和Lys335. 对苯醌与FKBP5的相互作用包括C=O←Met285(氢键)、C=O←Arg331(氢键)、C=O←Ala228(氢键)、苯环-Ala228(范德华力相互作用)、C=O←Lys204(氢键)和C=O←Lys335(氢键). 对苯醌与FKBP5相互作用的结合能和结合面积分别为−3.83 kcal·mol−1和171 Å2.
如图2(e)所示,4-硝基邻苯二酚与FKBP5相互作用的关键氨基酸为Gly224、Asn238、Gly282、Met285和Gln286. 4-硝基邻苯二酚与FKBP5的相互作用包括—OH→Gly282(氢键)、—NO2 ←Met285(氢键)、—NO2←Asn238(氢键)、—OH→Gln286(氢键)和—OH→Gly224(氢键). 4-硝基邻苯二酚与FKBP5相互作用的结合能和结合面积分别为−3.69 kcal·mol−1和213 Å2.
如图2(f)所示,邻苯二酚与FKBP5相互作用的关键氨基酸为Gly224、Glu227、Ala228、Gly282、Tyr284和Gln286. 邻苯二酚与FKBP5的相互作用包括—OH→Gln286(氢键)、—OH→Gly224(氢键)、—OH→Gly282(氢键)、苯环-Ala228(范德华力相互作用)、—OH→Glu227(氢键)和苯环-Tyr284(π-π/范德华力相互作用). 邻苯二酚与FKBP5相互作用的结合能和结合面积分别为−3.81 kcal·mol−1和184 Å2.
-
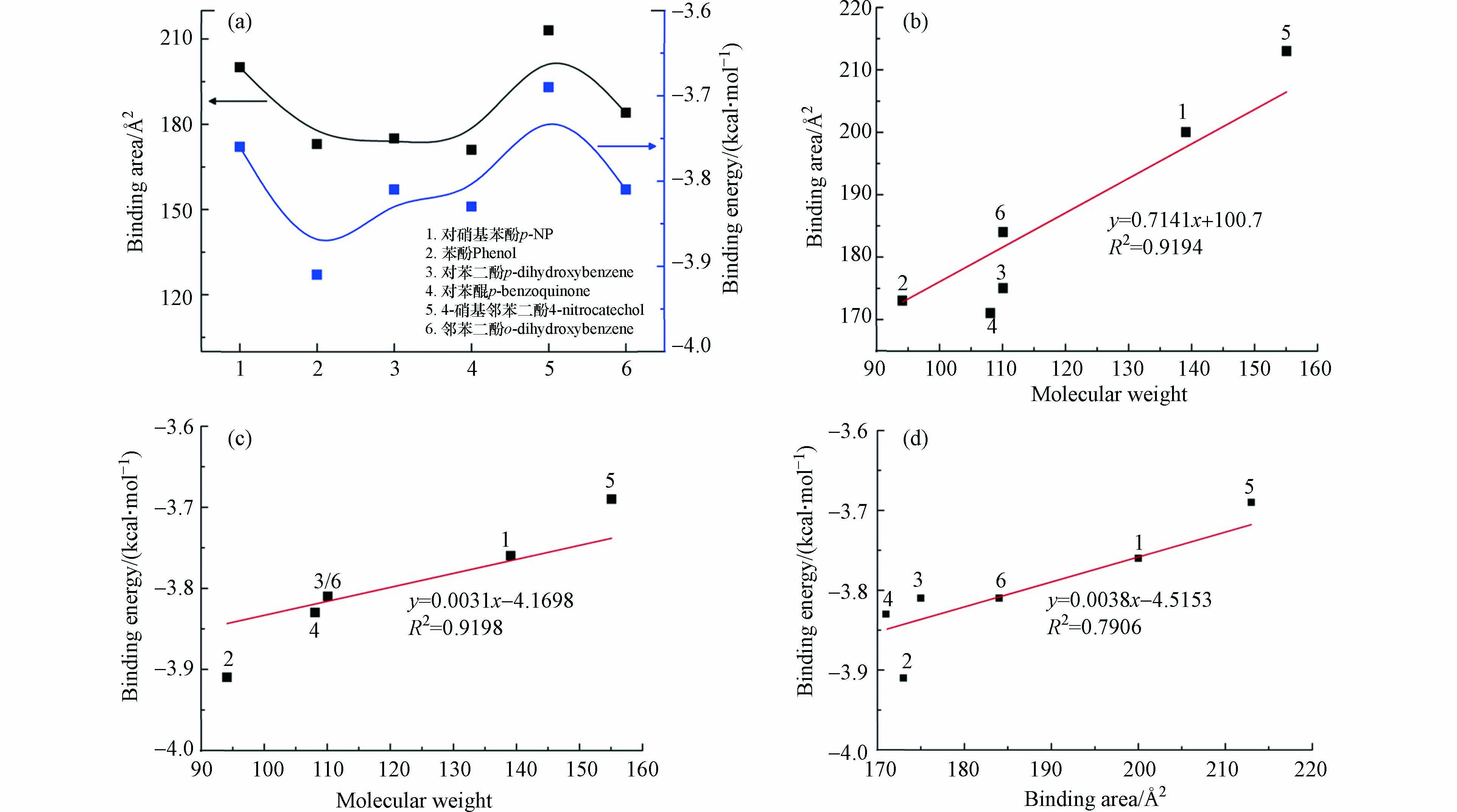
p-NP-DPs与FKBP5相互作用结果如图3(a)所示. p-NP-DPs与FKBP5相互作用的结合面积顺序为213 Å2(4-硝基邻苯二酚)> 200 Å2(p-NP)> 184 Å2(邻苯二酚)> 175 Å2(对苯二酚)> 173 Å2(苯酚)> 171 Å2(对苯醌),而p-NP-DPs与FKBP5相互作用的结合能顺序为−3.69 kcal·mol−1(4-硝基邻苯二酚)> −3.76 kcal·mol−1(p-NP)> −3.81 kcal·mol−1(对苯二酚/邻苯二酚)> −3.83 kcal·mol−1(对苯醌)> −3.91 kcal·mol−1(苯酚).
结合面积的数值越正意味着p-NP-DPs与FKBP5相互作用越强,而结合能的数值越负意味着p-NP-DPs与FKBP5相互作用越强,基于结合面积因素,p-NP-DPs与FKBP5相互作用强度大小顺序为4-硝基邻苯二酚 > p-NP > 邻苯二酚 > 对苯二酚 > 苯酚 > 对苯醌;基于结合能因素,p-NP-DPs与FKBP5相互作用强度大小顺序为苯酚 > 对苯醌 > 对苯二酚/邻苯二酚 > p-NP > 4-硝基邻苯二酚. 因此,结合能和结合面积对p-NP-DPs与FKBP5相互作用的影响是复杂的,p-NP-DPs与FKBP5相互作用的强度取决于结合能和结合面积复合作用的结果[28].
影响p-NP-DPs与FKBP5相互作用的关键因素可能是小分子的种类,而分子量是决定小分子性能和结构的关键因素,因此,研究p-NP-DPs分子量对p-NP-DPs与FKBP5相互作用的影响十分必要. p-NP-DPs分子量对p-NP-DPs与FKBP5相互作用结合面积的影响如图3(b)所示,结果表明p-NP-DPs分子量越大,p-NP-DPs与FKBP5相互作用结合面积越大,二者呈正相关关系,线性相关系数R2=0.9194,表明污染物分子量越大,污染物与受体蛋白相互作用越强,污染物环境风险越大. 而p-NP-DPs分子量对p-NP-DPs与FKBP5相互作用结合能的影响如图3(c)所示,p-NP-DPs分子量越大,p-NP-DPs与FKBP5相互作用结合能越大,二者呈正相关关系,线性相关系数R2=0.9198,表明污染物分子量越小,污染物与受体蛋白相互作用越强,污染物环境风险越大. p-NP-DPs与FKBP5相互作用结合面积和结合能的影响如图3(d)所示,结果表明结合面积和结合能呈正相关关系,线性相关系数R2=0.7906,因此分子量对p-NP-DPs与FKBP5相互作用强度影响随分子量增加呈“先升后降”趋势,过大的分子量导致污染物空间结构变大,受体蛋白空间位阻抑制p-NP-DPs与FKBP5相互结合,而过小的分子量则因为官能团和药效团减少抑制了p-NP-DPs与FKBP5相互结合[29 − 30].
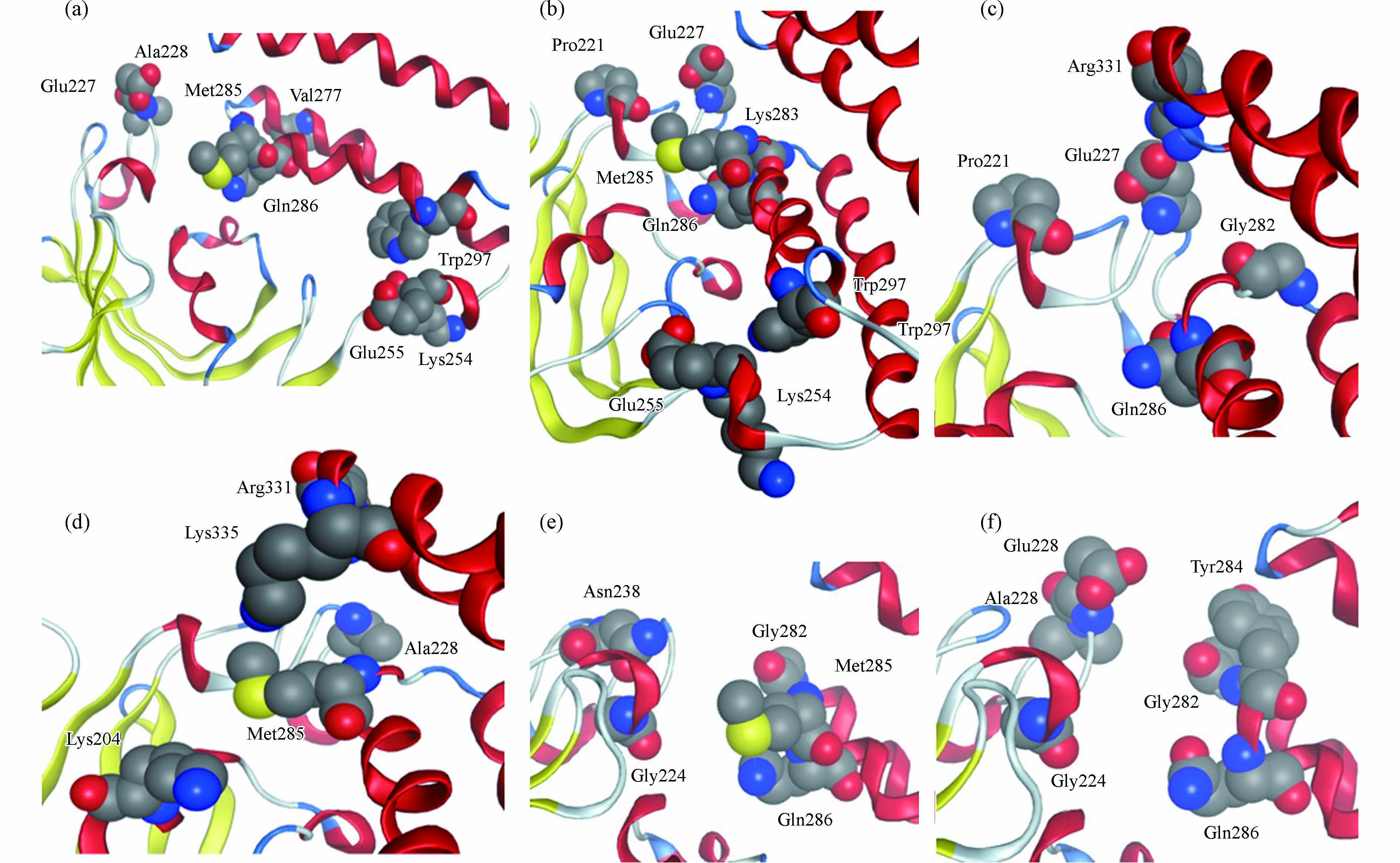
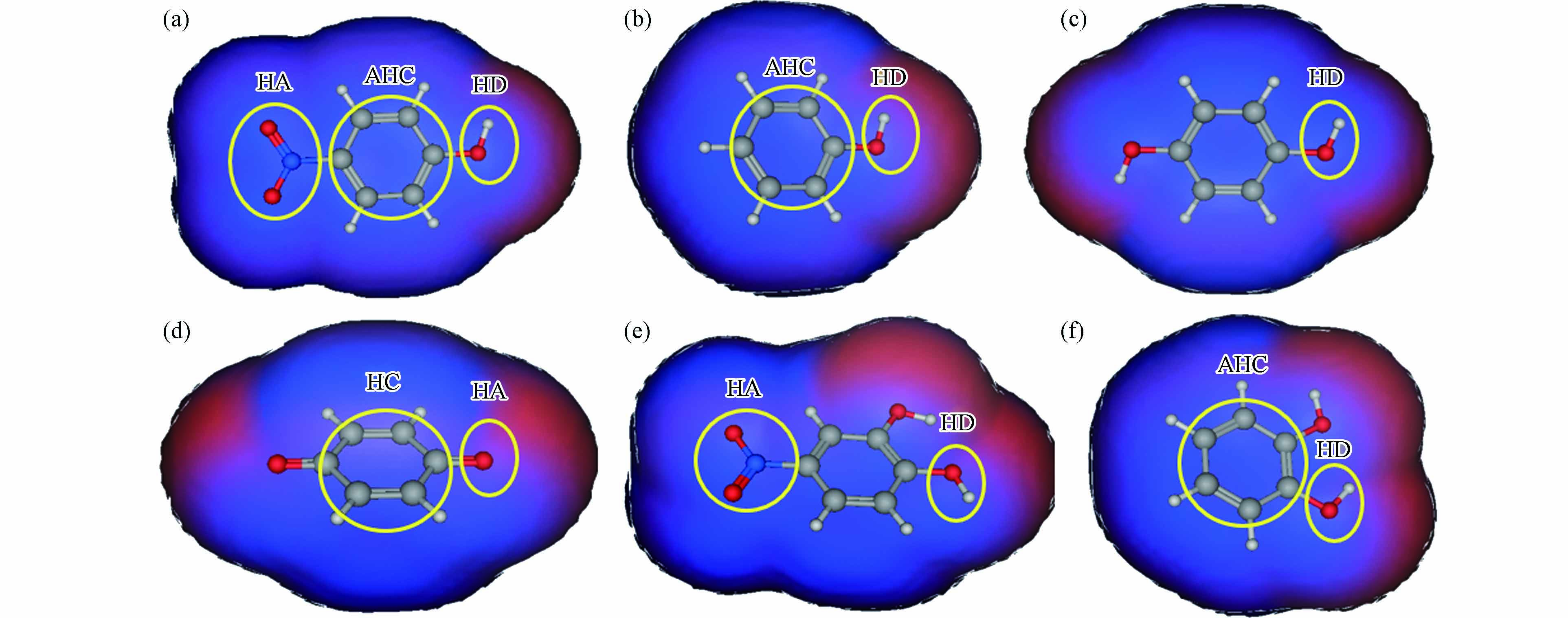
p-NP-DPs与FKBP5相互作用的结合区域如图4所示,p-NP-DPs药效团如图5所示. p-NP与FKBP5相互作用结合区域由Glu227、Ala228、Lys254、Glu255、Gly282、Met285、Gln286和Trp297组成,结合面积200 Å2(图4a),p-NP的药效团为氢键供体(—OH)、氢键受体(—NO2)和芳香中心-疏水中心(苯环及其C原子),如图5a所示. 苯酚与FKBP5相互作用结合区域由Pro221、Glu227、Lys254、Glu255、Lys283、Met285、Gln286和Trp297组成,结合面积173 Å2(图4b),苯酚的药效团为氢键供体(—OH)、芳香中心(苯环)和芳香中心-疏水中心(苯环上C原子),如图5b所示. 对苯二酚与FKBP5相互作用结合区域由Pro221、Glu227、Gly282、Gln286和Arg331组成,结合面积175 Å2(图4c),对苯二酚的药效团为氢键供体(—OH),如图5c所示. 对苯醌与FKBP5相互作用结合区域由Lys204、Ala228、Met285、Arg331和Lys335组成,结合面积171 Å2(图4d),对苯醌的药效团为氢键受体(C=O)和疏水中心(苯环),如图5d所示. 4-硝基邻苯二酚与FKBP5相互作用结合区域由Gly224、Asn238、Gly282、Met285和Gln286组成,结合面积213 Å2(图4e),4-硝基邻苯二酚的药效团为氢键供体(—OH)和氢键受体(—NO2),如图5e所示. 邻苯二酚与FKBP5相互作用结合区域由Gly224、Glu227、Ala228、Gly282、Tyr284和Gln286组成,结合面积184 Å2(图4f),邻苯二酚的药效团为氢键供体(—OH)和芳香中心-疏水中心(苯环),如图5f所示.
p-NP-DPs与FKBP5相互作用的氨基酸残基分布如图6所示,结果表明氨基酸残基分布区间为Lys204(对苯醌和FKBP5)到Lys335(对苯醌和FKBP5),其中高频氨基酸残基主要由两个区域组成,包括氨基酸残基序号221—228(Pro221、Gly224、Glu227、Ala228)和氨基酸残基序号282—286(Gly282、Lys283、Tyr284、Met285、Gln286).
-
p-NP-DPs分子结构的不同导致其理化性质(分子量、熔点、沸点、闪点、密度、lgSw、lgP、拓扑极表面积、氢键供体数量和氢键受体数量,表1)差异显著[31 − 32]. 为了明确p-NP-DPs与FKBP5相互作用强度与p-NP-DPs物理化学性质之间的关系,分别采用SPSS软件中的Spearman相关性和Pearson相关性分析了分子量、熔点、沸点、闪点、密度、lgSw、lgP、拓扑极表面积、氢键供体数量和氢键受体数量分别与结合面积和结合能绝对值之间的相关性. 表2为利用Spearman相关性分析理化性质对p-NP-DPs与FKBP5相互作用的影响,结果表明结合能绝对值与分子量和拓扑极表面积在0.01水平的相关系数均达到-1,与闪点、密度和氢键受体数量在0.05水平的相关系数达到-0.9747、-0.9747和-0.9549,表明结合能绝对值与分子量、拓扑极表面积、闪点、密度和氢键受体数量呈显著的负相关关系. 结合能绝对值与熔点、沸点、lgSw、lgP和氢键供体数量的相关系数分别为-0.6377、-0.7182、0.5000、-0.5798和-0.5323,且P>0.05,结合能绝对值与熔点、沸点、lgSw、lgP和氢键供体数量无相关性. 而结合面积仅与分子量和拓扑极表面积在0.05水平的相关系数均达到0.9276,表明结合面积仅与分子量和拓扑极表面积呈显著的正相关关系.
表3为利用Pearson相关性分析理化性质对p-NP-DPs与FKBP5相互作用的影响,结果表明结合能绝对值与分子量在0.01水平的相关系数达到−0.9591,与密度、拓扑极表面积和氢键受体数量在0.001水平的相关系数分别达到−0.9928、−0.9743和−0.9860,表明结合能绝对值与分子量、密度、拓扑极表面积和氢键受体数量呈显著的负相关关系. 结合面积与分子量、拓扑极表面积和氢键受体数量在0.01水平的相关系数达到0.9589、0.9597和0.9230,表明结合面积与分子量、拓扑极表面积和氢键受体数量呈显著的正相关关系. 结果表明,p-NP-DPs分子结构及理化性质对p-NP-DPs与FKBP5相互作用强度的影响主要取决于分子量和拓扑极表面积(100%)> 氢键受体数量(75%)> 密度(50%)> 闪点(25%).
-
(1)p-NP-DPs与FKBP5相互作用结合面积顺序为213 Å2(4-硝基邻苯二酚)> 200 Å2(p-NP)> 184 Å2(邻苯二酚)> 175 Å2(对苯二酚)> 173 Å2(苯酚)> 171 Å2(对苯醌),结合能顺序为−3.69 kcal·mol−1(4-硝基邻苯二酚)> −3.76 kcal·mol−1(p-NP)> −3.81 kcal·mol−1(对苯二酚/邻苯二酚)> −3.83 kcal·mol−1(对苯醌)> −3.91 kcal·mol−1(苯酚).
(2)p-NP-DPs与FKBP5相互作用高频氨基酸残基为Pro221、Gly224、Glu227、Ala228(221-228)和Gly282、Lys283、Tyr284、Met285、Gln286(282-286),p-NP-DPs的药效团主要包括氢键供体、氢键受体、芳香中心和疏水中心.
(3)p-NP-DPs理化性质对p-NP-DPs与FKBP5相互作用强度的影响主要取决于分子量和拓扑极表面积(100%)> 氢键受体数量(75%)> 密度(50%)> 闪点(25%).
对硝基苯酚降解产物与FK506结合蛋白相互作用分子机制
Molecular mechanism on interaction between p-nitrophenol degradation products and FK506 binding protein
-
摘要: 对硝基苯酚(p-nitrophenol,p-NP)作为典型内分泌干扰物,其环境污染与人体健康问题一直是环境领域的研究热点. 环境中对硝基苯酚降解产物(p-NP degradation products,p-NP-DPs)与FK506结合蛋白(FK506 binding protein,FKBP5)结合形成p-NP-DPs-FKBP5加合物是p-NP-DPs产生雌激素和抗雄激素活性的主要机制. 然而,p-NP-DPs与FKBP5相互作用的分子水平机制尚未引起足够的重视. 本文采用分子对接技术模拟计算p-NP-DPs与FKBP5相互作用的结合能和结合面积. 结果表明,p-NP-DPs与FKBP5相互作用结合面积顺序为213 Å2(4-硝基邻苯二酚)>200 Å2(p-NP)>184 Å2(邻苯二酚)>175 Å2(对苯二酚)>173 Å2(苯酚)>171 Å2(对苯醌),结合能顺序为−3.69 kcal·mol−1(4-硝基邻苯二酚)> −3.76 kcal·mol−1(p-NP)> −3.81 kcal·mol−1(对苯二酚/邻苯二酚)>−3.83 kcal·mol−1(对苯醌)> −3.91 kcal·mol−1(苯酚),高频氨基酸残基为Pro221、Gly224、Glu227、Ala228、Gly282、Lys283、Tyr284、Met285和Gln286,p-NP-DPs药效团主要包括氢键供体(—OH)、氢键受体(—NO2和C=O)、芳香中心(苯环)和疏水中心(C原子). p-NP-DPs理化性质对p-NP-DPs与FKBP5相互作用强度的影响主要取决于分子量和拓扑极表面积(100%)、氢键受体数量(75%)、密度(50%)和闪点(25%). 本研究对认识水环境中p-NP-DPs分子水平健康效应和环境风险具有重要科学意义.Abstract: P-nitrophenol (p-NP), as typical endocrine disruption chemicals (EDCs), their environmental pollution and human health issues have always been hotspots in the environmental field. The p-NP-DPs-FKBP5 adducts, formed by p-NP degradation products (p-NP-DPs) and FK506 binding protein (FKBP5), is the main estrogenic and anti-androgenic mechanism. However, this molecular-level mechanism between p-NP-DPs and FKBP5 has not attracted enough attention. In this study, the molecular docking technology was used to simulate the binding energy and binging area between p-NP-DPs and FKBP5 interaction. The results indicated that the order of binging area between p-NP-DPs and FKBP5 interaction was 213 Å2 (4-nitrocatechol) > 200 Å2 (p-NP) > 184 Å2 (o-dihydroxybenzene) > 175 Å2 (p-dihydroxybenzene) > 173 Å2 (phenol) > 171 Å2 (p-benzoquinone), but the order of binding energy between p-NP-DPs and FKBP5 interaction was −3.69 kcal·mol−1 (4-nitrocatechol) > −3.76 kcal·mol−1 (p-NP) > −3.81 kcal·mol−1 (p-/o-dihydroxybenzene) > −3.83 kcal·mol−1 (p-benzoquinone) > −3.91 kcal·mol−1 (phenol). The high frequency amino acid residues were included Pro221, Gly224, Glu227, Ala228, Gly282, Lys283, Tyr284, Met285 and Gln286. The pharmacophores of p-NP-DPs were included hydrogen-bond donor (—OH), hydrogen-bond acceptor (—NO2 and C=O), aromatic center (benzene ring) and hydrophobic center (C atom). The physicochemical properties of p-NP-DPs were dependent on molecular weight and topological polar surface area (100%), hydrogen bond donor count (75%), density (50%) and flash point (25%). The research results probably enhance people’s knowledge and understanding of molecular-level health effects and environmental risks of p-NP-DPs in the water environmental system in the future.
-
Key words:
- p-NP /
- FKBP5 /
- molecular docking /
- pharmacophore /
- structure-activity relationship
-

-
图 5 p-NP-DPs与FKBP5相互作用药效团:p-NP(a)、苯酚(b)、对苯二酚(c)、对苯醌(d)、4-硝基邻苯二酚(e)和邻苯二酚(f)氢键受体: hydrogen-bond acceptor(HA);氢键供体: hydrogen-bond donor(HD);芳香-疏水中心: aromatic-hydrophobic center(AHC);疏水中心: hydrophobic center(HC)
Figure 5. Pharmacophores between p-NP-DPs and FKBP5: p-NP (a), phenol (b), p-dihydroxybenzene (c), p-benzoquinone (d), 4-nitrocatechol (e) and o-dihydroxybenzene (f)
表 1 p-NP-DPs的理化性质
Table 1. Physicochemical property of p-NP-DPs
名称
SampleCAS 熔点/°C
Melting point沸点/°C
Boiling poin闪点/°C
Flash point密度/(g·cm−3)
DensitylgSw p-NP 100—02—7 113—114 279 169 1.480—1.50 -0.74 苯酚
Phenol108—95—2 40.9 181.8 79 1.04—1.07 0 对苯二酚
p-dihydroxybenzene123—31—9 170—173 285—287 165 1.330—1.332 N/A 对苯醌
p-benzoquinone106—51—4 114—116 180 93 1.318—1.320 N/A 4-硝基邻苯二酚
4-nitrocatechol3316—09—4 174—176 N/A N/A N/A N/A 邻苯二酚
o-dihydroxybenzene120—80—9 105 245 127 1.344 0.62 名称
Sample相对分子质量
Molecular weightlgP 拓扑极表面积/Å2
Topological polar
surface area氢键供体数量
Hydrogen bond
donor count氢键受体数量
Hydrogen bond
acceptor countp-NP 139.1100 1.91 66 1 3 苯酚
Phenol94.1130 1.46 20.2 1 1 对苯二酚
p-dihydroxybenzene110.1120 0.59 40.5 2 2 对苯醌
p-benzoquinone108.0960 0.2 34.1 0 2 4-硝基邻苯二酚
4-nitrocatechol155.1090 1.66 86.3 2 4 邻苯二酚
o-dihydroxybenzene110.1120 0.88 40.5 2 2 说明:N/A为数据未查到 表 2 p-NP-DPs与FKBP5相互作用和理化性质Spearman相关性分析
Table 2. Spearman correlation between physicochemical property and interaction of p-NP-DPs and FKBP5
理化性质
Physicochemical property结合能
Absolute value of binding energy结合面积
Binding area相关性系数
Correlation coefficientP 相关性系数
Correlation coefficientP 分子量
Molecular weight−1** 0.0056 0.9276* 0.0167 熔点
Melting point−0.6377 0.2000 0.3714 0.4972 沸点
Boiling point−0.7182 0.1667 0.7000 0.2333 闪点
Flash point−0.9747* 0.0333 0.8000 0.1333 密度
Density−0.9747* 0.0333 0.9000 0.0833 lgSw 0.5000 1.0000 −0.5000 1.0000 lgP −0.5798 0.2389 0.7714 0.1028 拓扑极表面积
Topological polar surface area−1** 0.0056 0.9276* 0.0167 氢键供体数量
Hydrogen bond donor count−0.5323 0.3000 0.6172 0.2333 氢键受体数量
Hydrogen bond acceptor count−0.9549* 0.0167 0.8197 0.0667 * P < 0.1,** P < 0.05. 表 3 p-NP-DPs与FKBP5相互作用和理化性质Pearson相关性分析
Table 3. Pearson correlation between physicochemical property and interaction of p-NP-DPs and FKBP5
理化性质
Physicochemical property结合能
Absolute value of binding energy结合面积
Binding area相关性系数
Correlation coefficientP 相关性系数
Correlation coefficientP 分子量
Molecular weight−0.9591** 0.0025 0.9589** 0.0025 熔点
Melting point−0.7880 0.0626 0.4672 0.3502 沸点
Boiling point−0.7669 0.1303 0.6279 0.2567 闪点
Flash point−0.8471 0.0701 0.6638 0.2218 密度
Density−0.9928*** 0.0000 0.6887 0.1985 lgSw 0.3750 0.7553 −0.6296 0.5665 lgP −0.3641 0.4780 0.7306 0.0991 拓扑极表面积
Topological polar surface area−0.9743*** 0.0000 0.9597** 0.0024 氢键供体数量
Hydrogen bond donor count−0.4120 0.4170 0.4180 0.4095 氢键受体数量
Hydrogen bond acceptor count−0.9860*** 0.0000 0.9230** 0.0087 ** P < 0.05,*** P < 0.01. -
[1] 李易, 陆锐, 沈锦优, 等. 废水中硝基芳香化合物检测方法研究进展[J]. 环境化学, 2016, 35(7): 1474-1485. doi: 10.7524/j.issn.0254-6108.2016.07.2015113001 LI Y, LU R, SHEN J Y, et al. Detection methods for nitroaromatic compounds in wastewater[J]. Environmental Chemistry, 2016, 35(7): 1474-1485 (in Chinese). doi: 10.7524/j.issn.0254-6108.2016.07.2015113001
[2] JING Q F, YI Z L, LIN D H, et al. Enhanced sorption of naphthalene and p-nitrophenol by nano-SiO2 modified with a cationic surfactant[J]. Water Research, 2013, 47(12): 4006-4012. doi: 10.1016/j.watres.2012.09.057 [3] GHOSH A, KHURANA M, CHAUHAN A, et al. Degradation of 4-nitrophenol, 2-chloro-4-nitrophenol, and 2, 4-dinitrophenol by Rhodococcus imtechensis strain RKJ300[J]. Environmental Science & Technology, 2010, 44(3): 1069-1077. [4] 马锋锋, 赵保卫. 玉米芯生物炭吸附水中对硝基苯酚的特性[J]. 环境化学, 2017, 36(4): 898-906. doi: 10.7524/j.issn.0254-6108.2017.04.2016080701 MA F F, ZHAO B W. Adsorption characteristics of p-nitrophenol in aqueous solution by corncob biochar[J]. Environmental Chemistry, 2017, 36(4): 898-906 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017.04.2016080701
[5] 许婉馨, 杨波, 陈子伦, 等. 聚乙烯醇海绵负载铑催化剂催化还原对硝基苯酚[J]. 环境化学, 2020, 39(9): 2576-2583. doi: 10.7524/j.issn.0254-6108.2020050803 XU W X, YANG B, CHEN Z L, et al. Polyvinyl sponge supported RH catalysts for catalytic reduction of P-nitrophenol[J]. Environmental Chemistry, 2020, 39(9): 2576-2583 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020050803
[6] KADAM V V, SHANMUGAM S D, ETTIYAPPAN J P, et al. Photocatalytic degradation of p-nitrophenol using biologically synthesized ZnO nanoparticles[J]. Environmental Science and Pollution Research, 2021, 28(10): 12119-12130. doi: 10.1007/s11356-020-10833-w [7] TANEDA S, MORI Y, KAMATA K, et al. Estrogenic and anti-androgenic activity of nitrophenols in diesel exhaust particles (DEP)[J]. Biological & Pharmaceutical Bulletin, 2004, 27(6): 835-837. [8] LI C M, TANEDA S, SUZUKI A K, et al. Estrogenic and anti-androgenic activities of 4-nitrophenol in diesel exhaust particles[J]. Toxicology and Applied Pharmacology, 2006, 217(1): 1-6. doi: 10.1016/j.taap.2006.06.010 [9] ZHANG Y H, PIAO Y G, LI Y S, et al. 4-Nitrophenol induces Leydig cells hyperplasia, which may contribute to the differential modulation of the androgen receptor and estrogen receptor-α and-β expression in male rat testes[J]. Toxicology Letters, 2013, 223(2): 228-235. doi: 10.1016/j.toxlet.2013.09.011 [10] NI L, YANG C S, GIOELI D, et al. FKBP51 promotes assembly of the Hsp90 chaperone complex and regulates androgen receptor signaling in prostate cancer cells[J]. Molecular and Cellular Biology, 2010, 30(5): 1243-1253. doi: 10.1128/MCB.01891-08 [11] WU D, TAO X Y, CHEN Z P, et al. The environmental endocrine disruptor p-nitrophenol interacts with FKBP51, a positive regulator of androgen receptor and inhibits androgen receptor signaling in human cells[J]. Journal of Hazardous Materials, 2016, 307: 193-201. doi: 10.1016/j.jhazmat.2015.12.045 [12] 李博, 刘书霞, 房森彪, 等. 分子对接与分子动力学计算模拟概论[J]. 比较化学, 2019(1): 1-10. LI B, LIU S X, FANG S B, et al. Progress in molecular docking and molecular dynamics simulation[J]. Journal of Comparative Chemistry, 2019(1): 1-10 (in Chinese).
[13] ZHANG Y, ZENG Z T, ZENG G M, et al. Effect of Triton X-100 on the removal of aqueous phenol by laccase analyzed with a combined approach of experiments and molecular docking[J]. Colloids and Surfaces B: Biointerfaces, 2012, 97: 7-12. doi: 10.1016/j.colsurfb.2012.04.001 [14] DING K K, KONG X T, WANG J P, et al. Side chains of parabens modulate antiandrogenic activity: in vitro and molecular docking studies[J]. Environmental Science & Technology, 2017, 51(11): 6452-6460. [15] NG C A, HUNGERBUEHLER K. Exploring the use of molecular docking to identify bioaccumulative perfluorinated alkyl acids (PFAAs)[J]. Environmental Science & Technology, 2015, 49(20): 12306-12314. [16] 江文婷, 陈旭, 蔡茜茜, 等. 基于分子对接技术研究鱼源抗冻多肽与鱼肌球蛋白的相互作用[J]. 食品工业科技, 2022, 43(20): 29-38. doi: 10.13386/j.issn1002-0306.2022010078 JIANG W T, CHEN X, CAI X X, et al. Prediction of interaction between fish-derived antifreeze peptides and fish myosin by molecular docking[J]. Science and Technology of Food Industry, 2022, 43(20): 29-38 (in Chinese). doi: 10.13386/j.issn1002-0306.2022010078
[17] 赵子晗. CoS2-N/nano-G气体扩散电极电Fenton氧化对硝基苯酚研究[D]. 哈尔滨: 哈尔滨工业大学, 2021. ZHAO Z H. Study on electro-Fenton oxidation of P-nitrophenol by CoS2-N/nano-G gas diffusion electrode[D]. Harbin: Harbin Institute of Technology, 2021 (in Chinese).
[18] YANG J, PAN B, LI H, et al. Degradation of p-nitrophenol on biochars: Role of persistent free radicals[J]. Environmental Science & Technology, 2016, 50(2): 694-700. [19] DELPORT A, HARVEY B H, PETZER A, et al. The monoamine oxidase inhibition properties of selected structural analogues of methylene blue[J]. Toxicology and Applied Pharmacology, 2017, 325: 1-8. doi: 10.1016/j.taap.2017.03.026 [20] RAMSAY R R, DUNFORD C, GILLMAN P K. Methylene blue and serotonin toxicity: Inhibition of monoamine oxidase A (MAO A) confirms a theoretical prediction[J]. British Journal of Pharmacology, 2007, 152(6): 946-951. doi: 10.1038/sj.bjp.0707430 [21] LU C J, ZHOU Q, YAN J, et al. A novel series of tacrine-selegiline hybrids with cholinesterase and monoamine oxidase inhibition activities for the treatment of Alzheimer’s disease[J]. European Journal of Medicinal Chemistry, 2013, 62: 745-753. doi: 10.1016/j.ejmech.2013.01.039 [22] PARK S E, PAUDEL P, WAGLE A, et al. Luteolin, a potent human monoamine oxidase-a inhibitor and dopamine D4 and vasopressin V1A receptor antagonist[J]. Journal of Agricultural and Food Chemistry, 2020, 68(39): 10719-10729. doi: 10.1021/acs.jafc.0c04502 [23] DELPORT A, HARVEY B H, PETZER A, et al. Methylene blue analogues with marginal monoamine oxidase inhibition retain antidepressant-like activity[J]. ACS Chemical Neuroscience, 2018, 9(12): 2917-2928. doi: 10.1021/acschemneuro.8b00042 [24] 袁霞, 徐建业, 吕贞, 等. 卡马西平在UV/氯高级氧化工艺中的去除、转化与毒性评价[J]. 环境化学, 2021, 40(10): 3158-3170. doi: 10.7524/j.issn.0254-6108.2020062701 YUAN X, XU J Y, LYU Z, et al. Removal, transformation and toxicity evaluation of carbamazepine by the UV/chlorine advanced oxidation process [J]. Environmental Chemistry, 2021, 40(10): 3158-3170 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020062701
[25] KUMAR R, MOCHE M, WINBLAD B, et al. Combined X-ray crystallography and computational modeling approach to investigate the Hsp90 C-terminal peptide binding to FKBP51[J]. Scientific Reports, 2017, 7: 14288. doi: 10.1038/s41598-017-14731-z [26] LIU Z F, LIU Y J, ZENG G M, et al. Application of molecular docking for the degradation of organic pollutants in the environmental remediation: A review[J]. Chemosphere, 2018, 203: 139-150. doi: 10.1016/j.chemosphere.2018.03.179 [27] WANG X N, YANG C X, SUN Y Y, et al. A novel screening strategy of anti-SARS-CoV-2 drugs via blocking interaction between Spike RBD and ACE2[J]. Environment International, 2021, 147: 106361. doi: 10.1016/j.envint.2020.106361 [28] YANG C X, WANG X N, ZHANG L L, et al. Investigation of kinetics and mechanism for the degradation of antibiotic norfloxacin in wastewater by UV/H2O2[J]. Journal of the Taiwan Institute of Chemical Engineers, 2020, 115: 117-127. doi: 10.1016/j.jtice.2020.09.036 [29] WANG X N, SUN Y Y, WANG Q, et al. Potential common mechanisms of cytotoxicity induced by amide herbicides via TRPA1 channel activation[J]. International Journal of Environmental Research and Public Health, 2022, 19(13): 7985. doi: 10.3390/ijerph19137985 [30] ZONG W S, WANG X N, DU Y G, et al. Molecular mechanism for the regulation of microcystin toxicity to protein phosphatase 1 by glutathione conjugation pathway[J]. BioMed Research International, 2017, 2017: 9676504. [31] 秦超, 杨兵, 程浩, 等. 多环芳烃与胞外DNA非共价结合及机制[J]. 科学通报, 2022, 67(1): 74-87. doi: 10.1360/TB-2021-0927 QIN C, YANG B, CHENG H, et al. Non-covalent binding interaction and mechanism between polycyclic aromatic hydrocarbons and extracellular DNA[J]. Chinese Science Bulletin, 2022, 67(1): 74-87 (in Chinese). doi: 10.1360/TB-2021-0927
[32] 杨先海, 蔡喜运, 陈景文, 等. 含卤有机化合物与甲状腺素转运蛋白相互作用的卤代效应[J]. 科学通报, 2014, 59(27): 2673-2681. doi: 10.1360/N972013-00059 YANG X H, CAI X Y, CHEN J W, et al. Effects of halogenation on binding interaction between halogenated thyroid disrupting chemicals and transthyretin[J]. Chinese Science Bulletin, 2014, 59(27): 2673-2681 (in Chinese). doi: 10.1360/N972013-00059
-



 下载:
下载: