-
植物根系分泌物是植物在生长过程中根系向生长介质分泌质子和大量有机物质的总称[1],是物质交换、能量流动和信息传递过程中的媒介,影响植物对养分、重金属的吸收以及对重金属胁迫的应对能力. 其中,植物根系释放的小分子分泌物是具有高活性官能团的有机非均相混合物,如氨基酸、有机酸、糖、酚类等低分子量化合物[2],具有一定的亲水性和芳香性. 它们可以通过酸化、络合和吸附等作用与重金属离子形成稳定性不同的金属-有机配合物 [3 − 4],从而改变重金属的活性及风险. 目前根系分泌物与重金属的化学行为的研究主要集中于有机酸[2],酸性官能团能解离出H+,改变根-土界面重金属离子的迁移能力,而芳香类化合物在根际与重金属的行为探究较少被人关注[5].
有机物与重金属的相互作用也受到有机物浓度和种类、土壤理化性质和重金属形态等因素的影响 [6 − 7]. 其中,有机物分子间和分子内相互作用不仅会改变重金属的迁移率和性质,还会改变其与重金属的相互作用[8]. 先前的研究表明溶解性有机物分子可以相互作用从而聚集[9 − 10]. Sutton和Sposito[11]提出相对较弱的疏水和氢键相互作用促进了有机分子的自组装,芳香环的极性相互作用可能稳定得到超分子结构. Tikhonov等[12]通过膜超滤和粒径排除色谱技术发现在Cu(Ⅱ)和腐殖酸(HA)系统中, HA分子间由弱分子间相互作用形成的超分子结构可以将Cu(Ⅱ) 与HA形成的二元配合物分离. 研究表明有机物与重金属的结合不能单一认为是供体-受体键或离子相互作用,有机物分子间和分子内相互作用更应该被关注. 有机分子和金属离子形成的超分子结构对环境的物理化学参数更为敏感[13].
根系分泌物在决定根际相互作用以及土壤重金属风险和微生物群落动态方面起着重要作用,但根系分泌的有机物组分与重金属之间具体作用机理的研究仍存在不足,这可能会导致重金属行为建模和风险评估中的不确定性[14 − 15].
本研究选定了根系分泌物中代表性小分子有机酸乙酸和芳香化合物香豆素,探究不同结构的有机物与Cu(Ⅱ)络合的行为机理以及有机物分子间存在的相互作用,这将为根系有机物分子间相互作用机制提供基础信息,增强对土壤环境的深入认识,进一步为根系分泌物在介导重金属生物有效性和环境迁移转化研究提供科学依据.
-
本实验的试剂香豆素(CM,分析纯)、乙酸(AA,分析纯)、硝酸铜(分析纯)、硝酸钠(分析纯)、浓盐酸(分析纯)、氢氧化钠(分析纯)均购于阿拉丁试剂有限公司,实验用水均为去离子水.
仪器主要使用了复合 Cu(Ⅱ)选择电极(上海雷磁仪器公司)、离子计(上海雷磁仪器公司)、pH计(上海雷磁仪器公司)、美国Xigo湿式比表面分析仪(仪思奇北京科技有限公司).
-
土壤中有机酸浓度范围在1—100 mmol·kg-1[3],为了更好地进行理论探究,本实验将有机物浓度设置成1—100 mg·L−1. 将500 mg香豆素、乙酸分别溶解于1 L背景溶液(0.01 mol·L−1 NaNO3)中作为储备溶液(500 mg·L−1). 这些储备溶液在100 mL容量瓶中稀释至3种浓度,分别为1、10、100 mg·L−1,然后转移到 250 mL 烧杯中进行与 Cu(Ⅱ)络合电位滴定实验. 将烧杯放在磁力搅拌器上,转速为 200 r·min−1 速率,以确保铜离子络合平衡,放入 Cu(Ⅱ)复合离子选择电极和 pH 计对溶液进行监测. 待初始电位稳定后,用移液枪向烧杯中加入 0.01 mol·L−1 Cu(NO3)2,使溶液中的 Cu(Ⅱ)浓度从 1×10−6 mol·L−1 变化至 1×10−4 mol·L−1. 每次滴加 Cu(NO3)2后,待离子计稳定后记录电位和 pH 值,再次滴加直至实验结束.
在 pH 计的辅助下用 0.01mol·L−1的 NaOH 或 HNO3 将3种浓度的有机物溶液pH 值调至2,再重复之前的步骤进行有机物与 Cu(Ⅱ)络合电位滴定实验. 游离Cu(Ⅱ)浓度(mol·L−1)和有机物结合的Cu(Ⅱ)浓度之间的关系通过有机物浓度(mol·g−1)归一化. 利用不同有机物与 Cu(Ⅱ)络合反应的电位滴定的数据,通过单配体模型的形成函数公式(1)对实验数据进行分析.
其中,Mf代表游离金属浓度,LOM代表以络合金属浓度表示的游离配体(OM),ML 代表 OM-Cu(Ⅱ)配合物浓度,K为条件稳定常数. 通过利用公式(1)来计算可以得到有机物与 Cu(Ⅱ)络合反应的条件稳定常数K.
-
基于1H NMR技术,利用美国Xigo湿式比表面分析仪测量不同浓度的样品溶液的弛豫时间,并利用公式(2)计算样品的弛豫率(Rsp).
其中,Rsp代表样品弛豫率;Tb代表样品弛豫时间的倒数;Tav代表溶剂弛豫时间的倒数.
-
利用Materials Studio 2017R2软件绘制了香豆素、乙酸的分子表面静电势图,并构建了不同有机物分子和Cu(Ⅱ)共存的初始模型,通过几何优化后,使用软件中Forcite模块进行分子动力学(MD)模拟. 不同模型盒子中放入的有机物分子、水分子以及硝酸铜的数量相同. 整个仿真过程在COMPASS II力场和常规系综NVT条件下实现. 每个体系模拟2000 ps以达到平衡状态,模拟步骤为1 fs.
-
香豆素、乙酸储备溶液均稀释至1、10、100 mg·L−1的3种梯度浓度. 取相同体积的每个浓度样品分别装到50 mL棕色小瓶中,测定pH值,每个梯度设置3个平行. 同一浓度样品分为两组,一种保持原pH值不经调整,另一种pH值调至为4,将这两个具有不同pH值的样品混合,理论pH值根据两瓶溶液初始pH值和体积,通过公式(3)计算得出理论pH值,利用pH计测定混合溶液的最终pH值即为实际pH值.
其中,pH1、V1分别指的是第一种溶液测定的pH值和体积;pH2、V2为第二种调整pH值为4后的溶液pH值和体积.
-
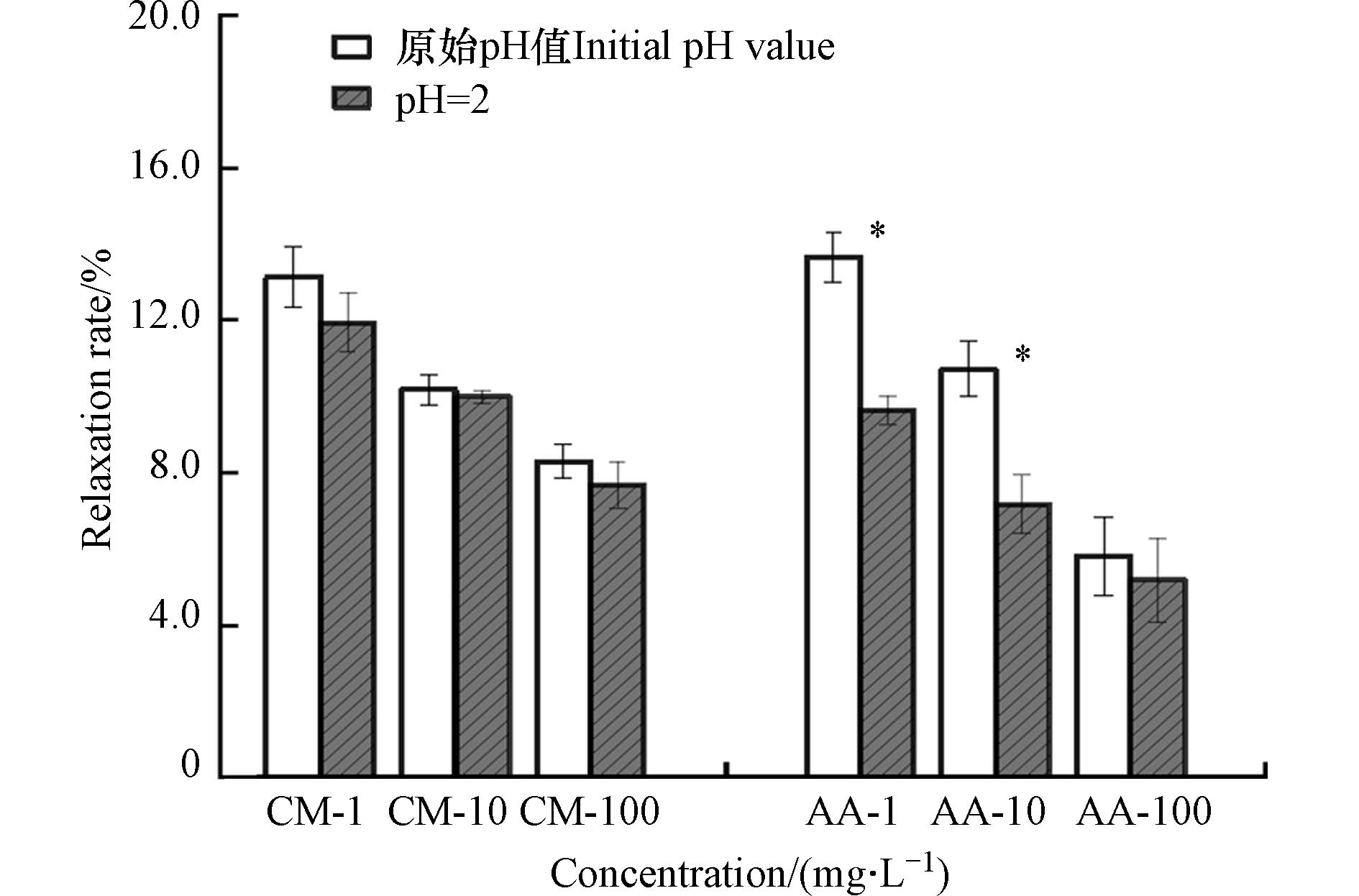
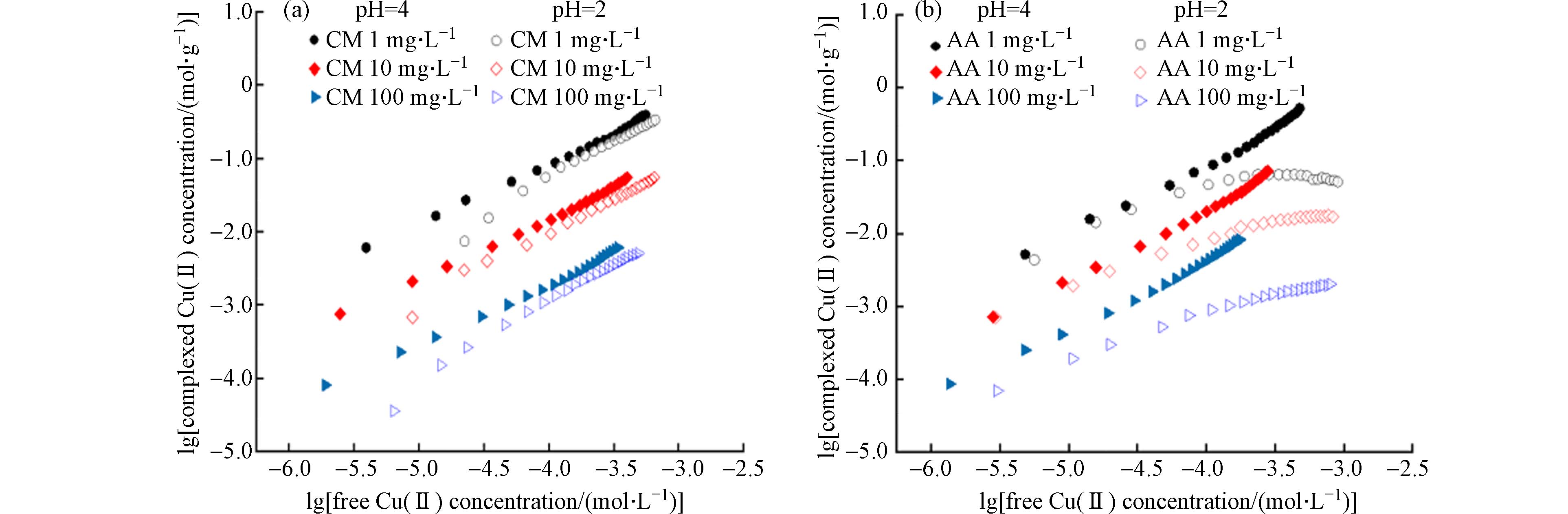
将不同浓度(1、10、100 mg·L−1)的香豆素和乙酸溶液分别与Cu(Ⅱ)络合滴定,并与调整溶液pH值为2后的络合数据进行对比. 如图1所示,随着有机物浓度增加有机物与Cu(Ⅱ)络合量反而降低. 这种现象说明有机物分子之间存在着相互作用. 这种相互作用使有机物分子间联系更加紧密,随着有机物浓度的增加,由有机物分子间相作用形成超分子结构,Cu(Ⅱ)在络合反应体系中的竞争力降低,进而有机物与Cu(Ⅱ)的络合量随之降低[12].
两种有机物与Cu(Ⅱ)络合滴定数据通过单配体模型的形成函数公式(1)拟合结果如表1所示. 反应溶液中形成络合物的平衡常数用条件稳定常数lg K 表示,lg K值愈大络合物愈稳定[16]. 由拟合结果可知,香豆素、乙酸与Cu(Ⅱ)反应的lg K值均随着浓度增加而降低. 在同一浓度下,香豆素在两种pH环境中与Cu(Ⅱ)反应的lg K值差异不大,而乙酸在pH值为2时与Cu(Ⅱ)反应的lg K值均低于原始pH环境,这与两种有机物归一化后的络合曲线图现象一致. 这可能是归因于不同pH值影响有机物的羧基或羟基中H的解离程度,pH值愈高则解离程度愈大[17].
1H NMR弛豫技术可用于测量水相中颗粒的分散程度. 通常,相同质量分数颗粒弛豫时间越短,分散程度越高,对应的弛豫率越高[18]. 由图2可知,原始pH环境中的香豆素、乙酸的弛豫率均随着有机物浓度的增加而降低,弛豫率越低,溶液中的粒子分散程度越低. 香豆素弛豫率受pH值影响较小,同一浓度乙酸在不同pH条件下弛豫率波动比香豆素更显著.
由此表明,这两种小分子有机物随着浓度的增加,分子间存在团聚现象,低pH环境下乙酸团聚更明显,其分子间作用力受pH影响更大. 先前学者通过分子动力学、动态光散射(DLS)测量等手段验证有机物分子在水环境中的分子团聚或自形态的转变[19 − 20],但有机物分子间作用力机制仍需进一步探讨.
-
为了更直观地探究有机物分子作用力机制,建立以水分子为基体,不同小分子有机物和硝酸铜共存的模型,并通过分子动力学(MD)模拟研究了不同小分子有机物在体系中的运动状态. 图3、4分别显示了香豆素、乙酸与Cu(Ⅱ)反应体系最初与最终稳定的状态(水分子隐藏). 通过模拟前后对比,可以观察到两个体系最终状态均出现团聚现象.
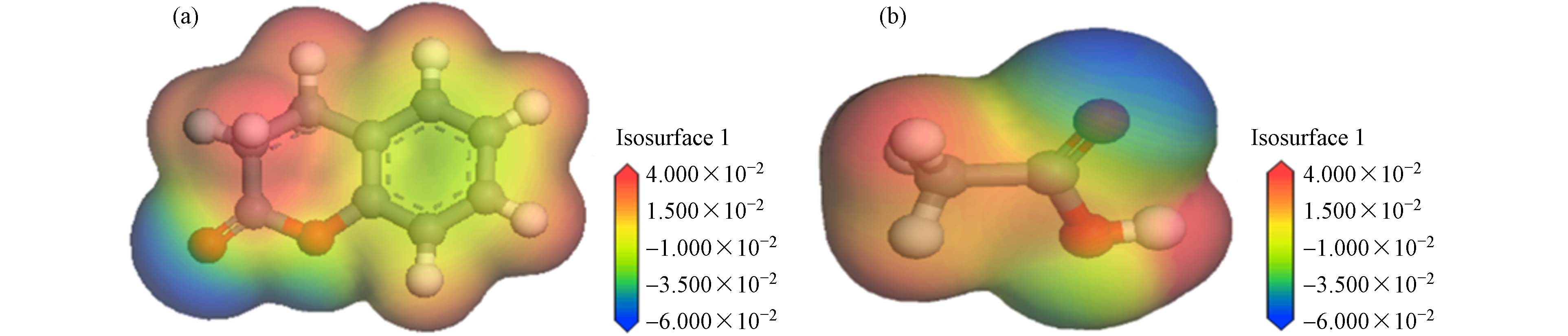
由于小分子根系有机物与Cu(Ⅱ)络合体系中没有其他物质参与,香豆素、乙酸出现团聚现象应归因于有机物分子间的相互作用力. 静电势能分布是用来研究分子间相互作用的工具. 静电势能分布图可以直观看到分子的电荷分布和电荷相关的性质,通过分子表面上的静电势可以估计当前分子与其他分子的静电作用,同时可以预测和解释氢键的结合模式、强度和电荷分布[20]. 由图5所示,香豆素分子静电势正值区域均匀的分布在—C—H区域周围,静电势负值区域分布在两个氧原子表面,静电势的极小值点出现在—C=O区域的氧原子上方. 乙酸分子静电势正值区域极大值点出现在—O—H区域,其次分布在—C—H区域,在—C=O区域的静电势能最低,这些原子周围的区域具有较高的负电性. 正静电势区域与负静电势区域更易形成相互作用[21].
根据有机物静电势能分布图及模拟体系最终状态,说明香豆素分子的静电势极小值位置吸引另一个分子静电势极大值位置相互结合,从而明显导致其发生分子团聚. 如图6(a)所示,香豆素分子中稳定的含氧六元环不易开环,—C=O与环中的O区域有较高的负静电势能,由于分子中的氧原子附近没有连接氢原子,分子间未形成氢键作用,这表明香豆素分子间负静电势—C=O和环中O区域与正静电势区域—C—H区域形成静电吸引作用. 乙酸分子间作用力如图6(b)所示,负静电势—C=O区域与正静电势—C—H区域相互结合,即乙酸分子间形成O…H—O氢键作用. pH环境会影响分子间的氢键作用[22,23],pH值越低,乙酸分子中羧基不易电离,分子间氢键作用力愈强,因此在pH值为2的环境中,同一浓度乙酸与Cu(Ⅱ)的络合量相比于原始pH环境中的络合量更低.
在体系中由于有机物分子间的氢键作用或静电吸引作用力的存在,有机物发生团聚,导致其与Cu(Ⅱ)络合力下降. 这也解释了实验结果中随有机物浓度的提高,其与Cu(Ⅱ)络合量减少的现象. 氢键、静电相互作用力是有机物分子间常见的作用力,在影响有机物质构特性方面起着重要的作用[10]. Beltran-villegas等[24]和Naassaoui[25]的研究证实α-1,3-葡聚糖和聚赖氨酸(PLL)构型的转变分别是氢键作用力和静电斥力主导的结果,分子间相互作用力对有机物构象稳定性起着决定性作用.
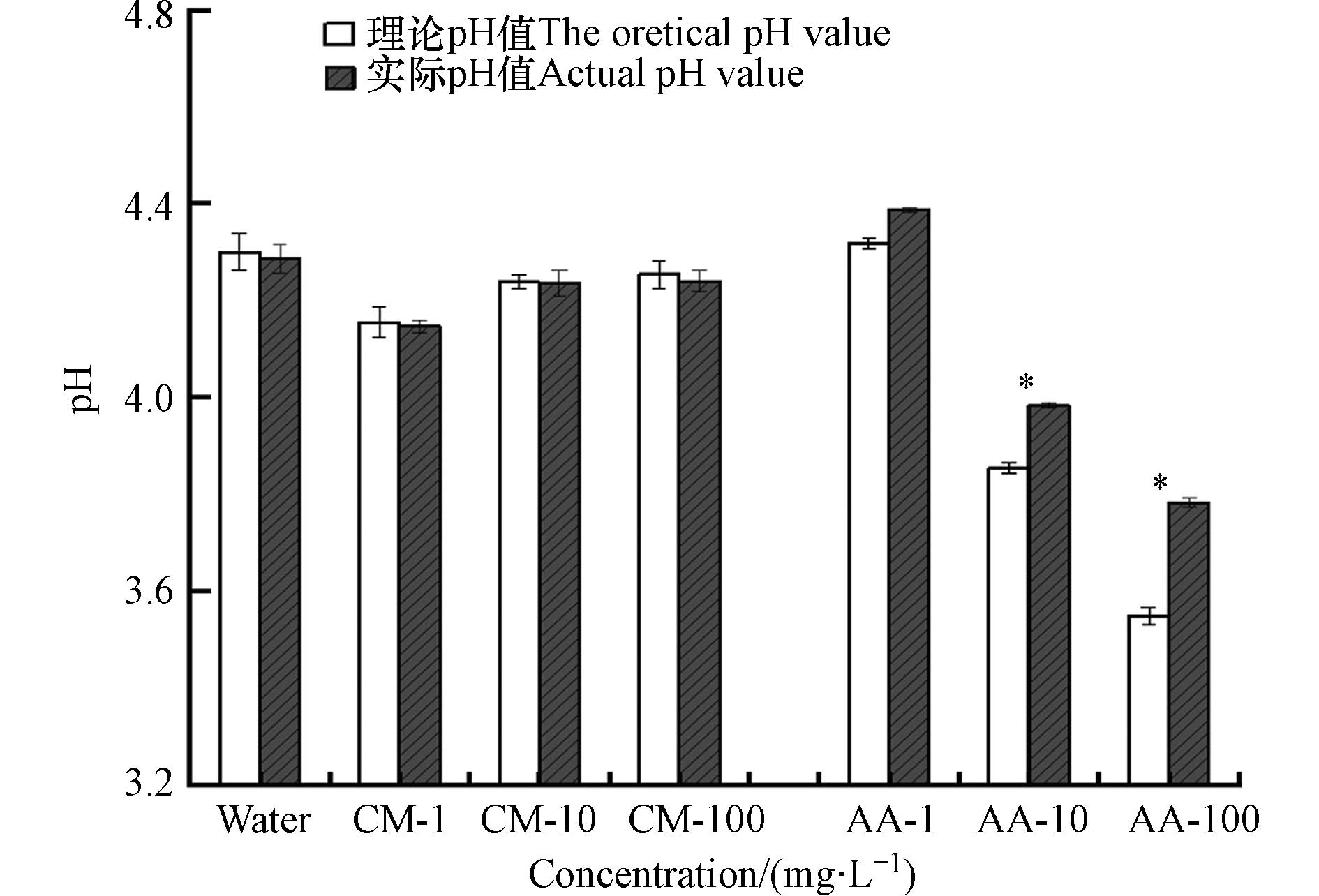
为进一步证实这两种有机物分子间不同作用力的机制,本研究参照赵婧等[9]学者的方法,比较了理论和实测的香豆素和乙酸溶液pH值变化. 如图7所示,不同浓度乙酸溶液的实测pH值始终高于理论pH值,而香豆素溶液中实测和理论pH值相差不大. 由于系统中没有其他分子参与,pH值的差异与分子间相互作用有关. 乙酸溶液实测pH值高于理论pH值,归因于乙酸分子间—O—H与—C=O形成氢键作用力,浓度越高实测pH值与理论pH值差异越显著,说明pH值越低,分子间氢键作用力越强. 而香豆素溶液混合后的理论pH值与实际pH值差异不大,则说明它分子间的作用力与氢键无关,根据分子动力学模拟及静电势分析,它的团聚归因于分子中正静电势的区域与负静电势区域的静电吸引作用力.
-
本研究表明静电吸引作用力和氢键作用力分别是香豆素和乙酸在与Cu(Ⅱ)络合体系中出现分子团聚的主要作用力. 随着香豆素、乙酸浓度的增加,其与Cu(Ⅱ)单位络合量显著减少,条件稳定常数(lg K)也相应降低. 通过弛豫率的测定以及分子动力学模拟,本研究证实小分子有机物之间存在相互作用力而团聚,并利用静电势分析、氢键佐证实验,证实乙酸分子间—O—H与—C=O形成氢键作用力,因此乙酸与Cu(Ⅱ)络合表现出较明显的pH依赖性. 同一浓度下,pH值越低,其与Cu(Ⅱ)单位络合量越低. 而香豆素分子间—C=O与—C—H形成的静电吸引作用力几乎不受pH影响.
不同土壤环境有机物的分子结构与分子间相互作用特征在有机物与重金属之间行为体系中并没有完整的记录,因此深入了解土壤根系不同有机物与重金属结合行为以及有机物分子间作用力机制,能为根系分泌物在介导重金属生物有效性和迁移中的环境风险评估提供科学信息,有效降低重金属行为建模和风险评估的不确定性.
分子间作用力对香豆素和乙酸与Cu(Ⅱ)络合能力的影响
Effect of intermolecular forces of coumarin and acetic acid to complex with Cu(Ⅱ)
-
摘要: 植物根系分泌物是影响植物对重金属吸收以及对重金属胁迫响应的重要因素. 根系分泌物中的小分子有机酸、酚等有机物与重金属具有强结合力,从而影响重金属在根际土壤中的迁移和转化. 因此,本研究探究了根系分泌物中小分子有机物香豆素和乙酸与Cu(Ⅱ)络合的行为,通过Xigo湿式比表面分析仪测定弛豫时间、分子动力学模拟等方法探究了分子间存在的相互作用力. 结果表明,随有机物浓度增加,香豆素和乙酸与Cu(Ⅱ)单位络合量及条件稳定常数均降低,这归因于乙酸分子间—O—H与—C=O形成氢键作用力,香豆素分子间—C=O与苯环上—C—H形成静电吸引力,这两种分子间的作用力强于它们与Cu(Ⅱ)结合的作用力. 乙酸与Cu(Ⅱ)络合表现出明显的pH依赖性,pH值越低,羧基中H不易解离,氢键作用增强,与Cu(Ⅱ)络合能力降低. 而香豆素分子间静电吸引作用力几乎不受pH条件影响. 本研究通过解析根系小分子有机物与重金属络合行为,为探究根系分泌物在介导重金属生物有效性和迁移转化中的环境作用提供有效信息.Abstract: Plant root exudates play a significant role in plants' uptake of heavy metals and their response to heavy metal stress. Small organic compounds such as phenols and organic acids in root exudates have a strong affinity with heavy metals, making them crucial in the migration and transformation of heavy metals in inter-root soil. This study explores the complexation behavior of Cu(Ⅱ) with small organic compounds such as coumarin and acetic acid in the root system. The interaction force between organic molecules was explored by measuring relaxation time using Xigo wet-specific surface analyzer and molecular dynamics simulation. The results indicate that as the concentration of organic matter increases, the amount of complexation and the stability constant of coumarin, acetic acid, and Cu(Ⅱ) decrease. This is due to the hydrogen bonding force formed between acetic acid molecules —O—H and —C=O, and the electrostatic attraction between coumarin molecules —C=O and —C—H on the benzene ring. These forces are more substantial than those that bind to Cu(Ⅱ). The complexation of acetic acid with Cu(Ⅱ) is pH dependent. The amount of acetic acid that complexes with Cu(Ⅱ) decreases as the pH decreases. This is because the H in the carboxyl group is less likely to dissociate, which enhances the hydrogen bonding effect and reduces the complexing ability with Cu(Ⅱ). The electrostatic attraction force between coumarin molecules is not significantly affected by pH conditions. This study provides effective information for exploring the environmental role of root exudates in mediating the bioavailability and migration transformation of heavy metals by analyzing the complex behavior of small organic compounds in the root system and heavy metals.
-

-
图 3 模拟箱体中香豆素与Cu(Ⅱ)最初与最终的稳定状态
Figure 3. The initial and final steady states of coumarin and Cu(Ⅱ) in the simulation boxes (Figures A, B and C show the top, front, and side views of the initial system state in the simulation box; Figures D, E, and F show the top, front, and side views of the final steady state)
图 4 模拟箱体中乙酸与Cu(Ⅱ)最初与最终的稳定状态
Figure 4. The initial and final steady states of acetic acid and Cu(Ⅱ) in the simulation boxes (Figures A, B and C show the top, front, and side views of the initial system state in the simulation box; Figures D, E, and F show the top, front, and side views of the final steady state)
表 1 单配体模型的形成函数拟合结果
Table 1. Formation function fitting results of single-ligand model
类别
Category浓度 /(mg·L−1)
ConcentrationCM AA lg K R2 lg K R2 原始pH值 1 5.05 0.9088 5.56 0.9885 10 4.72 0.9999 4.07 0.9652 100 4.57 0.9999 3.84 0.9962 pH=2 1 4.97 0.9754 5.31 0.9556 10 4.72 0.9941 3.78 0.9352 100 4.51 0.9944 3.23 0.9962 -
[1] 徐卫红, 黄河, 王爱华, 等. 根系分泌物对土壤重金属活化及其机理研究进展[J]. 生态环境, 2006, 15(1): 184-189. XU W H, HUANG H, WANG A H, et al. Advance in studies on activation of heavy metal by root exudates and mechanism[J]. Ecology and Environment, 2006, 15(1): 184-189 (in Chinese).
[2] 王亚, 冯发运, 葛静, 等. 植物根系分泌物对土壤污染修复的作用及影响机理[J]. 生态学报, 2022, 42(3): 829-842. WANG Y, FENG F Y, GE J, et al. Effects and mechanisms of plant root exudates on soil remediation[J]. Acta Ecologica Sinica, 2022, 42(3): 829-842 (in Chinese).
[3] 周松, 杨健豪, 晏士玮, 等. 根际有机酸对土壤中重金属化学行为和生物有效性的影响研究进展[J]. 生物学杂志, 2022, 39(3): 103-106,124. doi: 10.3969/j.issn.2095-1736.2022.03.103 ZHOU S, YANG J H, YAN S W, et al. Research progress on the effects of rhizosphere organic acids on the chemical behavior and bioavailability of heavy metals in soil[J]. Journal of Biology, 2022, 39(3): 103-106,124 (in Chinese). doi: 10.3969/j.issn.2095-1736.2022.03.103
[4] 秦晴晴, 张琢, 宋子文. 腐殖质来源、特征及其与土壤中重金属作用机制的研究进展[J]. 环境化学, 2023, 42(6): 1899-1910. doi: 10.7524/j.issn.0254-6108.2022010801 QIN Q Q, ZHANG Z, SONG Z W. Research progress on sources, characteristics of humus and mechanism of interaction with heavy metals in soil[J]. Environmental Chemistry, 2023, 42(6): 1899-1910 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022010801
[5] 刘梓清, 杨继刚, 吴子涵, 等. 植物根系限制重(类)金属吸收/转运的因素及其机制[J]. 农业现代化研究, 2021, 42(2): 284-293. LIU Z Q, YANG J G, WU Z H, et al. Factors restraining uptake/translocation of heavy metals (metalloids) related with plant roots and its mechanisms[J]. Research of Agricultural Modernization, 2021, 42(2): 284-293 (in Chinese).
[6] 吴文雨, 唐剑锋, 郑思俊, 等. 生活垃圾生物炭源溶解性有机质分馏和络合重金属的作用[J]. 环境化学, 2023, 42(7): 2382-2391. doi: 10.7524/j.issn.0254-6108.2022022203 WU W Y, TANG J F, ZHENG S J, et al. Fractionation of dissolved organic matter from domestic waste biochar and its complexation with heavy metals[J]. Environmental Chemistry, 2023, 42(7): 2382-2391 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022022203
[7] PAN X L, YANG J Y, ZHANG D Y, et al. Lead complexation behaviour of root exudates of salt marsh plantSalicornia europaeaL[J]. Chemical Speciation & Bioavailability, 2012, 24(1): 60-63. [8] PAN B, GHOSH S, XING B S. Dissolved organic matter conformation and its interaction with pyrene as affected by water chemistry and concentration[J]. Environmental Science & Technology, 2008, 42(5): 1594-1599. [9] ZHAO J, CHU G, PAN B, et al. Homo-conjugation of low molecular weight organic acids competes with their complexation with Cu(Ⅱ)[J]. Environmental Science & Technology, 2018, 52(9): 5173-5181. [10] LAN T, WU P, LIU Z Y, et al. Understanding the effect of pH on the solubility and aggregation extent of humic acid in solution by combining simulation and the experiment[J]. Environmental Science & Technology, 2022, 56(2): 917-927. [11] SUTTON R, SPOSITO G. Molecular structure in soil humic substances: The new view[J]. Environmental Science & Technology, 2005, 39(23): 9009-9015. [12] TIKHONOV V, DROZDOVA O, KARPUKHIN M, et al. Participation of cadmium (II) and copper (II) ions in intermolecular forces of humic acids in solutions[J]. IOP Conference Series: Earth and Environmental Science, 2019, 368(1): 012053. doi: 10.1088/1755-1315/368/1/012053 [13] KEILUWEIT M, KLEBER M. Molecular-level interactions in soils and sediments: The role of aromatic pi-systems[J]. Environmental Science & Technology, 2009, 43(10): 3421-3429. [14] 刘翠, 牟凤利, 王吉秀, 等. 低分子量有机酸对植物吸收和累积重金属的影响综述[J]. 江苏农业科学, 2021, 49(8): 38-43. LIU C, MU F L, WANG J X, et al. Effect of low molecular weight organic acids on plant absorption and accumulation of heavy metals: A review[J]. Jiangsu Agricultural Sciences, 2021, 49(8): 38-43 (in Chinese).
[15] CHEN Y T, WANG Y, YEH K C. Role of root exudates in metal acquisition and tolerance[J]. Current Opinion in Plant Biology, 2017, 39: 66-72. doi: 10.1016/j.pbi.2017.06.004 [16] 张玉涛, 李琪琪, 张晓娟, 等. 汞离子与土壤富里酸的络合反应及影响因素[J]. 江苏农业科学, 2017, 45(21): 272-274. ZHANG Y T, LI Q Q, ZHANG X J, et al. Complexation reaction between mercury ion and soil fulvic acid and its influencing factors[J]. Jiangsu Agricultural Sciences, 2017, 45(21): 272-274 (in Chinese).
[17] 夏扎旦·阿不力克木, 艾克拜尔·伊拉洪, 吐尔逊·吐尔洪, 等. pH值对胡敏酸、富里酸与Cd2+络合反应的影响[J]. 新疆农业科学, 2012, 49(9): 1701-1706. doi: 10.6048/j.issn.1001-4330.2012.09.020 XIAZHADAN A, AIKEBAIER Y, TURSUN T, et al. Effect of pH on the complex reaction of humic acid, fulvic acid with Cd2+[J]. Xinjiang Agricultural Sciences, 2012, 49(9): 1701-1706 (in Chinese). doi: 10.6048/j.issn.1001-4330.2012.09.020
[18] XING J, QI Z X, DONG W, et al. Aggregation of biochar nanoparticles and the impact on bisphenol A sorption: Experiments and molecular dynamics simulations[J]. Science of the Total Environment, 2023, 875: 162724. doi: 10.1016/j.scitotenv.2023.162724 [19] YONG C W, BARRON V W, SLOWEY A, et al. Data on the intermolecular interactions of 1, 1, 1, 2-tetrafluoroethane liquids from molecular dynamics simulations[J]. Data in Brief, 2023, 50: 109485. doi: 10.1016/j.dib.2023.109485 [20] 徐志强, 刘向阳, 涂亚楠, 等. 褐煤与水分子相互作用的量子化学计算[J]. 中国矿业大学学报, 2022, 51(3): 554-561. doi: 10.3969/j.issn.1000-1964.2022.3.zgkydxxb202203017 XU Z Q, LIU X Y, TU Y N, et al. Quantum chemical calculation of the interaction between lignite and water molecules[J]. Journal of China University of Mining & Technology, 2022, 51(3): 554-561 (in Chinese). doi: 10.3969/j.issn.1000-1964.2022.3.zgkydxxb202203017
[21] CHEN T, YU L X, LI Z, et al. Application of terahertz spectroscopy combined with density functional theory to analysis of intermolecular weak interactions for coumarin and 6-methylcoumarin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2021, 263: 120159. doi: 10.1016/j.saa.2021.120159 [22] 王宗乾, 杨海伟. pH值对海藻酸钠溶液黏度及体系中氢键的影响规律[J]. 材料导报, 2019, 33(8): 1289-1292,1306. doi: 10.11896/cldb.18020101 WANG Z Q, YANG H W. Impact of pH values on viscosity of sodium alginate solution and hydrogen bonds in the system[J]. Materials Reports, 2019, 33(8): 1289-1292,1306 (in Chinese). doi: 10.11896/cldb.18020101
[23] 李飞, 董金桥, 沈青. 高分子共混物中氢键的作用Ⅰ. 氢键的特征描述以及影响因素[J]. 高分子通报, 2009(7): 45-52. LI F, DONG J Q, SHEN Q. The function of hydrogen bond in polymer BlendsⅠ. Characters and affecting factors of hydrogen bond[J]. Polymer Bulletin, 2009(7): 45-52 (in Chinese).
[24] BELTRAN-VILLEGAS D J, INTRIAGO D, KIM K H C, et al. Coarse-grained molecular dynamics simulations of α-1, 3-glucan[J]. Soft Matter, 2019, 15(23): 4669-4681. doi: 10.1039/C9SM00580C [25] NAASSAOUI I, ASCHI A. Evaluation of properties and structural transitions of poly-L-lysine: Effects of pH and temperature[J]. Journal of Macromolecular Science, Part B, 2019, 58(8): 673-688. doi: 10.1080/00222348.2019.1638593 -



 下载:
下载: