-
诺氟沙星(NOF)又名氟哌酸,是第三代喹诺酮类抗菌药,是一种难降解性有机物[1]. NOF具有抗菌谱广和作用性强的特点,已广泛用于人类和兽医学,以预防和治疗细菌引起的感染[2]. 而NOF并不被人类和牲畜完全代谢,因此,NOF可能会通过尿液和粪便的方式被排放到城市污水中[3],容易在环境中累积[4 − 5],导致人类生活环境风险的增加. 有研究表明,NOF对植物和水生生物具有毒性[6 − 7],会对水生环境造成不利的生态影响. 显然,为了保证人类及生态环境健康发展,对NOF进行降解减毒研究具有重要意义. 废水中喹诺酮类抗生素的传统去除方法可分为生物降解[8]、物理吸附[9]、和化学氧化,但存在降解时间长、矿化度不高、易造成二次污染等缺点. 近年来,臭氧[10]、过硫酸盐[11]、电化学[12]等高级氧化过程(AOPs)氧化技术引起了广泛的关注. AOPs已被证明可有效降解抗生素药物[13 − 14]. 其中,臭氧氧化具有无二次污染、反应效率高和成本低的优势. 臭氧在水溶液中可由链式反应[15]分解产生活性氧物质(ROS),如·OH、1O2、·O2-等,·OH具有强氧化性(E0 = 2.80 eV)和非选择性的特点,可以与溶液中大多数抗生素药物发生快速反应. 但单独臭氧氧化在利用率和矿化能力上存在缺点,限制了其应用. 微气泡(MB,平均直径<50 μm)技术的研究为单独臭氧化过程的不足提供了解决办法. MB不同于传统气泡(CB),MB表面张力会引起较高的内部压力,使得臭氧溶解在水中,并发生MB的收缩和塌陷[16]. MB的界面面积更大,导致其在水中上升速度变慢. 因此,这增加了臭氧从气相转移到液相的效率,进而增加抗生素与臭氧微气泡发生氧化反应的可能性[17]. 微气泡臭氧化(MB/O3)体系利用MB与臭氧耦合产生ROS,依据已有报道,该系统主要ROS为·OH[15,18 − 19]. 密度泛函理论(DFT)是一种研究物质结构统计性的理论,既可以用于研究微观结构,也可以用于研究宏观结构,是提供原子、分子以及晶体和表面的结构,并得到相应结构特性的基本工具[20]. 近年来,基于DFT应用Gaussian模型预测优先反应位点并推测降解产物的研究者逐渐增多,卢志磊等[21]和Pablo等[22]使用Gaussian模型预测有机物活性位点推测降解产物路径. 但降解产物毒性鉴定需要昂贵或复杂的仪器进行分析[23].
因此,本研究基于密度泛函理论(DFT)方法,采用Gaussian模型和Multiwfn程序计算NOF的各拉普拉斯键级(Laplacian bond order, LBO)、平均局部离子化能(average local ionization energy, ALIE)和简缩Fukui函数确定MB/O3体系中NOF优先发生反应的活性位点,与MB/O3工艺降解NOF实验所得LC-MS/MS的结果相结合,从而预测可能的反应路径. 最后,通过定量构效关系(QSAR)考察降解中间产物的毒性[24],利用T.E.S.T.模型评估NOF及其中间体的生态毒性,为NOF在MB/O3体系下的降解途径与中间产物毒性预测提供新思路.
-
诺氟沙星(NOF,≥98%)购自麦克林生化科技股份有限公司(上海,中国),靛蓝二磺酸钠(90%)从易恩化学技术有限公司购买(上海,中国). 碘化钾和硫代硫酸钠购于永大试剂有限公司(天津,中国). 去离子水由Milli-Q超纯水机制备. 所有化学试剂均为分析纯.
-
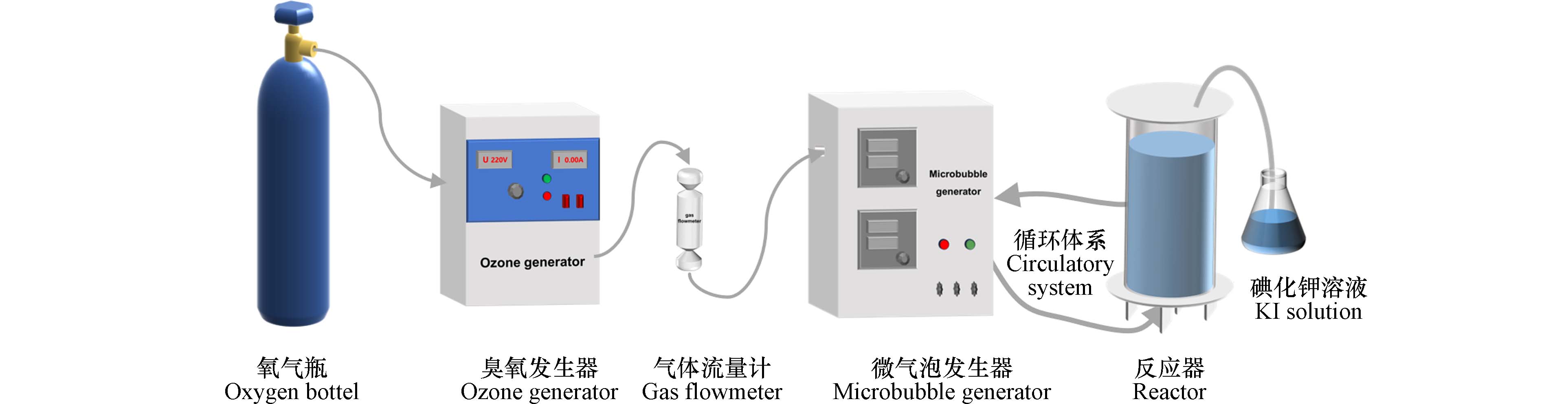
实验装置如图1所示,在臭氧浓度12 mg·min−1、气流量0.3 L·min−1、初始NOF浓度为50 mg·L−1、有效体积为10 L的实验条件下,进行MB/O3降解NOF废水实验. 实验时间90 min,前30 分钟每隔5 min取适量NOF水样,后30 min每隔10 min取样1次,水样经有机滤膜(0.45 μm,有机尼龙66)过滤后,进行LC-MS/MS测定.
-
本研究采用液相色谱(
1290 UPLC,安捷伦)与质谱(Q-TOF6550 ,安捷伦)联用测定中间产物的质核比进而与模拟结果相对比,确定降解中间产物.色谱条件:Waters BEH C18(2.1 mm×100 mm 1.7 μm);流速0.3 mL·min−1;进样量5μL;流动相A:0.1%甲酸-水溶液;流动相B:甲醇溶液. 梯度洗脱程序见表1.
质谱条件:ESI+模式电压4000V;一级扫描50—600 m/z;二级扫描起始离子50 m/z;鞘气温度:350 ℃;鞘气流量:12 L·min−1.
-
借助Gauss View 6.0对NOF分子进行几何结构构建,以DFT为基础,溶剂化效应选取Solvation Model Based on Density (SMD)溶剂模型[25] (solvent=water),使用B3LYP-D3泛函,选择6-311 G (d,p)基组,采用Gaussian 16W[26]进行NOF分子振动频率和几何结构优化计算.
-
在对NOF分子的化学键键级计算时,选用LBO键级. LBO比Mayer bond order和natural localized molecular orbital bond order更具有区分键强度的能力,这使得LBO可以更准确地描述和预测化学键的性质和行为. LBO与键极性和键解离能之间存在直接的相关性,它已被证明具有合理性和实用性[27]. 因此,使用Multiwfn 3.8[28]程序进行LBO键级计算.
-
ALIE被定义为由轨道密度加权的轨道能量的总和,用于理解分子的化学反应性[29]. ALIE方法可用于分子反应位点的定量分析,其中可能更倾向于亲电攻击. ALIE极值点分布图可以使用Multiwfn程序可视化,利用Visual Molecular Dynamics (VMD 1.9.3)[30]程序对ALIE极值点分布图进行渲染. ALIE的极小值表示电子结合更松散且容易与亲电试剂反应的区域.
-
Fukui函数是指分子中电子密度函数的变化[31]. 为了便于在定量层面上比较各个位点的福井函数,定义了简缩Fukui函数(CFF),CFF是基于Hirshfeld电荷(q)来计算的,是将Fukui函数收缩到各个原子上,使每个原子具有一个确定的数值. 使用Multiwfn采用了Hirshfeld电荷计算NOF分子的CFF. 结合VMD软件绘制了NOF分子的CFF原子着色图来预测NOF分子亲电或自由基反应活性位点.
-
采用QSAR计算NOF及其降解产物的生态毒性. 通过美国环境保护署开发的T.E.S.T.软件(版本5.1.2)评估氧化产物的急性毒性、生物累积因子、发育毒性和致突变性. 将CAS登录号或物质名称或分子结构输入T.E.S.T.程序中,随后得出LC50(96 h/48 h内对半数暴露于水中的胖头鱼/水蚤致死的浓度)、LD50(大鼠口服该化学品后,半数致死的数量)、生物累积因子、发育毒性和致突变性[32]. 所采用的方法是共识方法,因为此方法在外部验证过程中获得了最佳的预测结果[33].
-
借助Gauss View 6.0对NOF分子进行几何结构构建,NOF分子几何结构优化如图2所示. 键级又称为键序,属于对原子之间化学键的定量分析,适用于有机体系,可以被用来预测分子的断键强度[34]. LBO与键解离能有直接关系,可以用来评估两个原子之间的化学键强弱[27,35],且LBO与原子之间的键长呈正相关[36]. LBO计算所得数值如表2所示,1C-19F的键级值最小,为0.120. 其次为21C-23O和24N-25C,分别为0.547和0.548. 苯环上的碳碳双键的键级在1.31—1.38的范围内,键级值较高. 因此,C(1)和F(19)之间的键最容易断裂,发生脱氟反应. 其次为O(21)-O(23)和N(24)-C(25)之间的共价键容易受到影响被破坏. 苯环的共价键由于其较高的键级值不容易发生断裂.
-
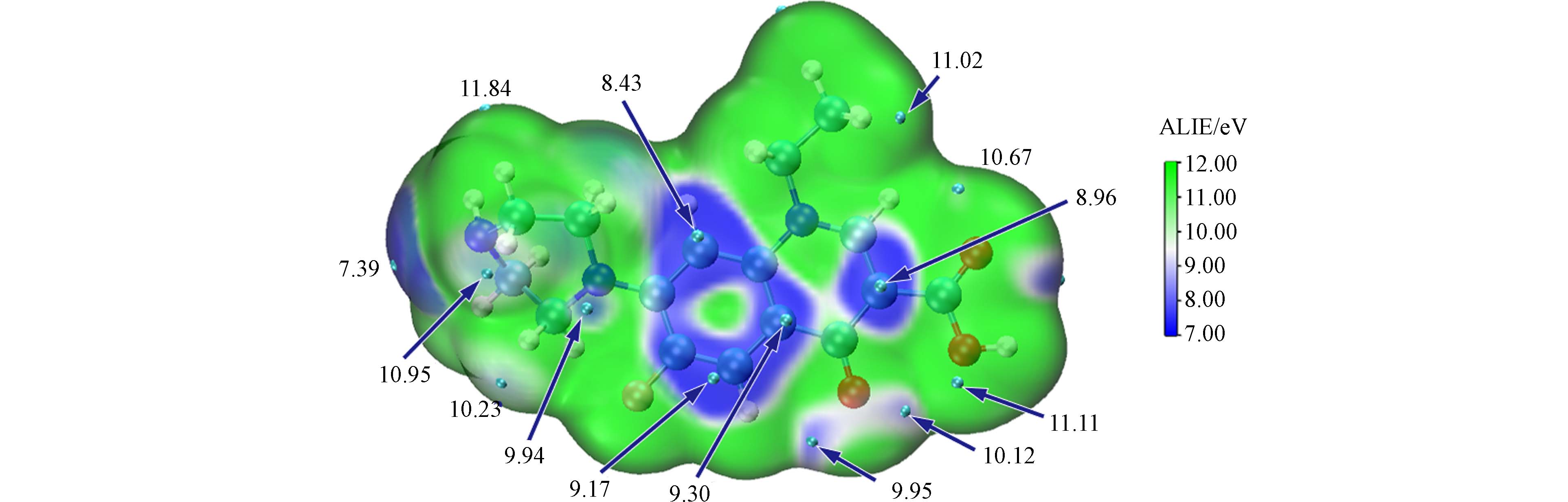
ALIE是指分子失去电子变成离子的能量,所需能量越小,表示电子解离能越低,更易发生亲电和自由基反应. ALIE可弥补分子表面静电势在分析亲电反应活性位点方面的不足. 如图3所示,极小值点已经标出,以便直观地表达所有位置的情况. 蓝色代表较小的ALIE,绿色代表较大的ALIE,白色充当从蓝色到绿色的过渡颜色. 青色代表等表面上的ALIE极小值,可能为亲电攻击的有利位置. NOF分子的哌嗪环上的N(18)原子、苯环和喹诺酮环上的C(11)原子附近的蓝色区域尤为明显,分子哌嗪环上N(15)原子和喹诺酮环上3个O(20)、O(22)和O(23)原子处也存在蓝色区域. N原子附近存在整体ALIE的最小值是7.39 eV,表明N原子处最容易发生亲电反应或者自由基反应. C(10)和C(11)之间的双键、N(15)和喹诺酮环上3个O(20)、O(22)和O(23)原子附近ALIE数值较小,亲电反应也可能在这些地方发生. 这是由于这些原子存在孤对电子从而容易发生亲电反应. 而苯环为π-π共轭体系,比其他键反应活性弱,不易于发生亲电反应.
-
CFF中f-表示为NOF分子体系中各原子可以作为亲电反应位点的程度,f0体现的是自由基攻击NOF分子上的各原子的程度,数值越正越容易发生相应类型的反应[37]. 如图4所示为根据CFF的数值大小对NOF分子上的原子进行着色,红色为正值,蓝色为负值. 各原子的颜色越红表明数值越大,数值越小颜色越蓝. NOF不同位点的CFF计算结果如表2所示,根据表3描述亲电反应的数值由大到小排序为:15(N) > 5(C) > 3(C) >1(C) > 20(O) >6(C) >2(C) > 19(F) > 4(C) > 14(C)>16(C) > 8(C) > 10(C ) > 11(C)> 13(C) > 22(O) > 17(C) > 18(N) > 21(C) > 24(N) > 23(O) > 27(H) > 25(C) > 26(C). 描述自由基反应的数值由大到小排序为:10(C) > 15(N) > 5(C) > 20(O) > 1(C) > 3(C) > 2(C) > 8(C) > 6(C) > 11(C) > 19(F) > 24(N) > 4(C) > 22(O) > 21(C) > 16(C) > 14(C) > 23(O) > 13(C) > 25(C) > 17(C) > 26(C) > 18(N).
综上所述,N15(f-=0.148)、C5(f-=0.075)、O20(f-=0.047)、F19(f-=0.033)容易受到亲电试剂的攻击,C10(f0 = 0.081)、N15(f0 = 0.081)、C5(f0 = 0.063)和O20(f0 = 0.060)容易受到自由基攻击.
-
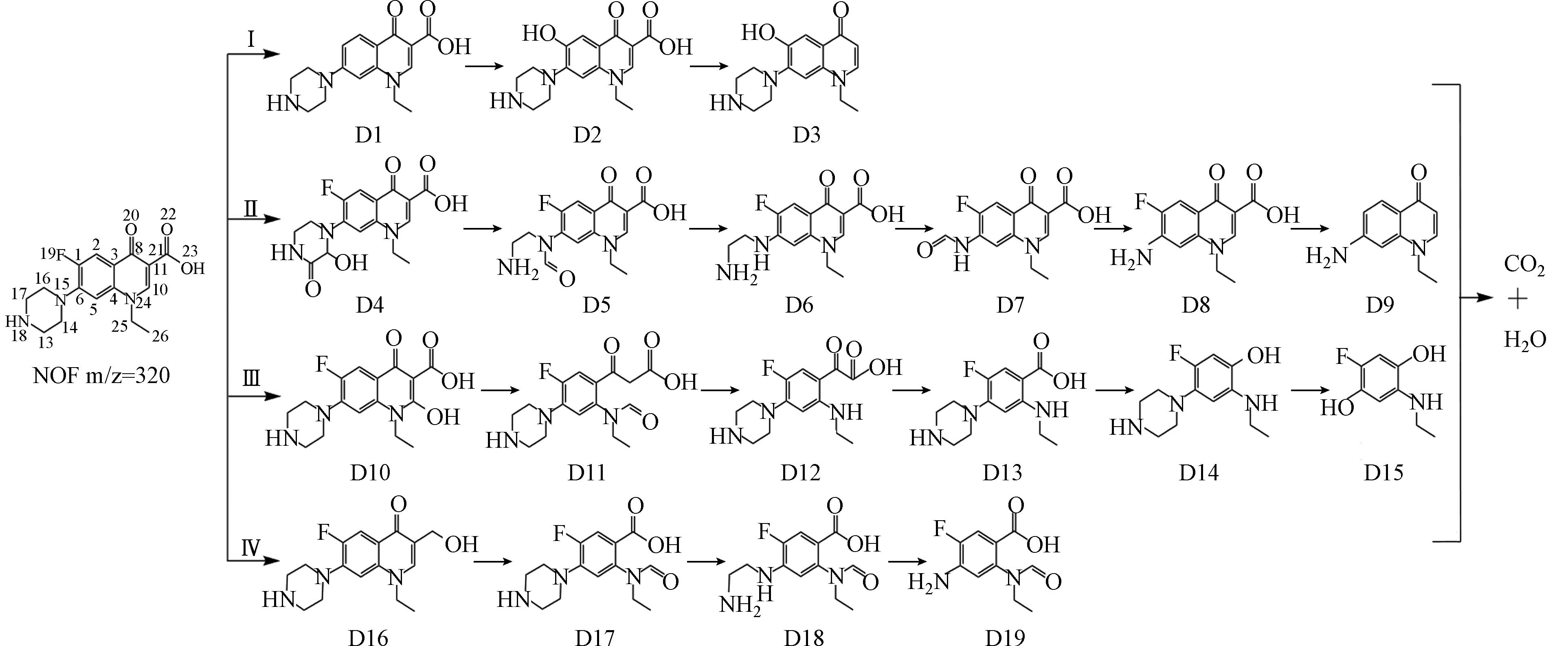
在MB/O3体系中,·OH起主要降解作用. 采用LC-MS/MS检测MB/O3过程中的NOF降解中间产物和粗略的定量分析,在MB/O3降解实验中检测到19种中间体如表4所示. DFT预测结果结合LC-MS/MS检测的结果,可获得MB/O3降解NOF主要通过3种反应类型:(1)脱氟反应;(2)哌嗪环转化;(3)喹诺酮环氧化. MB/O3降解NOF反应途径如图5所示.
途径Ⅰ:由于NOF分子的1(C)-19(F)键的不稳定性,该键发生断裂,导致脱氟反应的发生,并生成D1,与上述计算所得出1(C)-19(F)的LBO键级是最小的一致,CFF预测1(C)-19(F)之间的共价键容易断裂. 随后在1(C)上发生羟基化反应生成羟基化产物D2,进一步通过脱羧反应生成D3. Wu等[38]报道了使用MnO2/GO纳米材料活化过一硫酸盐技术降解诺氟沙星过程中有类似的途径. 在本研究中降解30 min和80 min时,通过总离子色谱仪(TIC)模式观察,发现D2的峰有明显的增加趋势. 在80 min时,观察到D3的峰最为显著,这可能进一步证明了途径Ⅰ为主要途径.
途径Ⅱ:哌嗪环部分被·OH氧化生成中间产物D4. 根据计算CFF的亲电反应,13(C)和14(C)原子处具有较高的f-,易亲电试剂所攻击. 然后哌嗪环被氧化发生裂解和结构重排形成含有醛基产物D5,醛基被氧化失去后形成D6. 消除反应发生在N原子上,16(C)-17(C)被氧化形成带醛基的产物D7. 哌嗪环被活性氧氧化消失,剩下一个氨基生成D8. 然后发生脱羧和脱氟反应生成D9. 在Deng等[39]和Li等[40]的研究结果中,发现了与此途径类似的中间产物.
途径Ⅲ:10(C)处CFF的f0=
0.0814 ,数值最大,也最有可能在此处发生自由基反应. ·OH通过抽氢反应和自由基结合形成产物D10,Xu等[41]报道·OH容易攻击NOF喹诺酮环中羧酸基的C=C键. D11是C=C被ROS氧化喹诺酮环开环的产物,喹诺酮环再进行氧化失去羰基生成D12和D13,然后脱去羧基形成D14和CO2,哌嗪环被氧化完全后再发生羟基加成形成D15. 通过30 min时的TIC模式观察,D11的丰度仅次于D3,途径Ⅲ中的各中间产物(除了D15)均在30 min时被观察到. 在30 min降解过程中,途径Ⅲ中的喹诺酮环氧化是MB/O3过程中仅次于途径Ⅰ的降解途径.途径Ⅳ:由ALIE方法得出22号O原子可以被ROS所攻击发生亲电反应. NOF发生脱羧反应生成D16[42]. D17是在D16的喹诺酮环上面的C=C处发生氧化反应形成的. D17的哌嗪环上发生氧化开环反应形成D18. D19是哌嗪环全部被氧化完全得到的结果. 通过观察降解实验发生30 min和80 min的TIC,可以发现在所有途径中,途径Ⅳ的产物离子丰度都是最低的,甚至远远低于途径Ⅰ. 相比之下,途径Ⅰ和Ⅲ的产物离子丰度较高,说明在MB/O3过程中它们是主导的反应途径. 因此,根据这些观察结果,可以得出途径Ⅳ是MB/O3过程中最次要的降解途径.
-
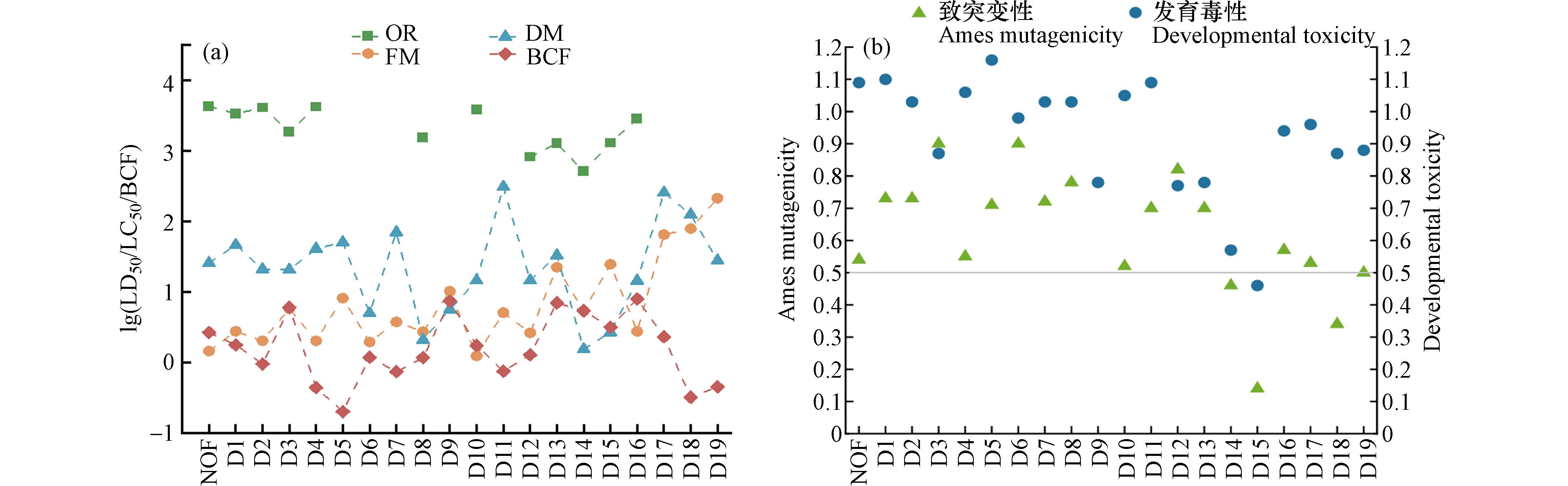
基于QSAR,使用T.E.S.T毒性评估工具预测MB/O3体系中的NOF和其中间产物的生态毒性. QSAR模型根据分子理化性质参数或化学结构参数与其毒理活性之间的定量关系预测相应的毒性数据[43]. 通过T.E.S.T.软件可计算出导致50%的口服大鼠(OR)死亡的化学物质剂量LD50、导致50%的胖头鱼(FM)在96 h后死亡的化学物质浓度LC50、导致50%的水蚤(DM)在48 h后死亡的化学物质浓度LC50、生物富集因子(BCF)、致突变性和发育毒性. 根据全球化学品统一分类和标签制度(GHS)和上述计算所得值,进而评估NOF及降解产物的毒性.
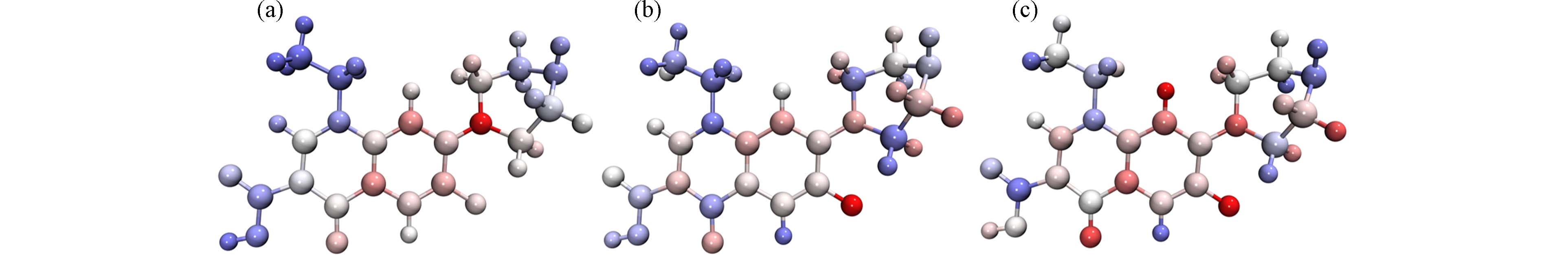
在MB/O3体系下NOF及降解产物的毒性如图6(a)所示. 可以看到,一些OR的LD50没有预测数值,这可能是缺乏相应的实验数据[44]. 对于OR,NOF被认定具有轻度危害. 而在MB/O3过程中产生的降解中间体的LD50均小于母体化合物(NOF),表明在降解过程中产生了毒性略强的中间体,尤其是D14对于口服大鼠被认定具有中度危害. 导致FM和DM在96 h和48 h后死亡的化学物质浓度小于1 mg·L−1、1—10 mg·L−1、10—100 mg·L−1和大于100 mg·L−1,分别被定义为“剧毒”、“有毒”、“有害”和“无害”. NOF对FM表现为有毒作用,而对DM表现为有害作用. 对于FM,大多数臭氧氧化中间体被定义为“有毒”化合物,对水生生物构成了威胁,这可能是因为这些产物中含有脂肪族胺结构或者酰胺结构. 但这些产物的毒性小于母体化合物,D19对于FM是没有毒害作用的. 对于DM,D6、D8、D9、D14和D15被定义为“有毒”化合物,其毒性大于母体化合物. D11、D17和D18被定义为“无害”化合物,因为它们的急性毒性均高于100 mg·L−1. 此外,BCF可以用来衡量生物从环境之中吸收并积累某种物质的程度,除D3、D9、D13、D14、D15和D16外,其余产物的生物累积因子值均低于母体化合物,表明NOF的降解过程伴随着累积毒性.
发育毒性是受到环境因素(如药物、环境中的有毒化学物质)的影响导致生物体不能够正常生长、分化和发育[45]. 如图6(b)所示,NOF的发育毒性为1.09,高于毒性阈值0.5. 表明NOF是一种发育毒性化合物. 这与NOF本身药物使用事的注意事项一致,18岁以下儿童患者不能服用,否则会延缓未成年人的骨骼形成,会影响到发育. 尽管NOF的降解中间产物的发育毒性有所降低,但仍处于发育毒性水平(D15除外). 此外,根据致突变性结果,除D14、D15、D18和D19外,NOF及其他降解中间产物致突变性均高于0.5[46],并不具有致突变性. 随着NOF的降解,降解产物中仅少部分为诱变毒性化合物. 急性毒性,生物富集因子,致突变性和发育毒性是综合毒性的决定因素. 一些降解中间产物,如D6、D8、D10、D14和D15,由于其较高的综合毒性,具有较高的环境风险,我们应更加重视降解产物的毒性.
-
(1) 采用Gaussian模型计算典型抗生素NOF的LBO键级,利用Multiwfn程序计算平均局部离子化能和简缩Fukui函数,其中C(1)和F(19)之间的键最容易断裂,发生脱氟反应;哌嗪环上的N(18)原子、苯环和喹诺酮环上的C(11)原子最易发生亲电反应和自由基反应;C5 (f 0 = 0.063)和O20 (f 0 =
0.0598 )既容易受到亲电攻击又容易受到自由基攻击. 基于模型预测,结合LC-MS/MS分析推测得到MB/O3体系下NOF的降解途径主要包括:脱氟、哌嗪环转化和喹诺酮环氧化反应.(2) 利用T.E.S.T.软件对上述降解产物的毒性进行评估,得出NOF对大鼠、胖头鱼和水蚤有害,NOF具有发育毒性但无致突变性;NOF降解过程中会产生毒性比母体强的产物,并且降解过程中可能会伴随毒性累积.
基于密度泛函理论的微气泡臭氧化诺氟沙星降解途径与毒性评估
Degradation pathway and toxicity assessment of microbubble ozonation of Norfloxacin based on Density Functional Theory
-
摘要: 诺氟沙星(Norfloxacin,NOF)为第三代喹诺酮类抗菌药被广泛应用,易在环境中积累,威胁人类健康和环境安全. 本研究采用Gaussian与Toxicity Estimation Software Tool(T.E.S.T.)软件预测在微气泡臭氧化(MB/O3)体系中NOF的降解途径与降解产物的生态毒性. 结果表明,MB/O3体系中的羟基自由基等活性氧物质易对NOF分子结构上键级较小、平均局部离子化能较低以及简缩Fukui函数较高的反应位点进行攻击;液相色谱-串联质谱法(LC-MS/MS)分析结果结合模型计算推测,MB/O3处理NOF降解途径包括:脱氟反应、哌嗪环转化、羟基取代反应和喹诺酮环氧化;利用T.E.S.T.软件评估NOF及降解产物的毒性,发现NOF对口服大鼠、胖头鱼、水蚤均存在负面影响,具有发育毒性,无致突变性,且降解过程中可能会产生比NOF毒性大的产物. 本研究采用模型预测NOF降解途径与生态毒性的方法便捷有效,可为MB/O3体系降解复杂有机分子的降解途径和生态毒性研究提供理论依据.Abstract: Norfloxacin (NOF) is widely used as a third-generation quinolone antimicrobial drug and is prone to accumulate in the environment. It threatens human health and environmental safety. In this study, the degradation pathway of NOF and the ecotoxicity of the degradation products in the microbubble ozonization (MB/O3) system were predicted by Gaussian with Toxicity Estimation Software Tool (T.E.S.T.) software. The results showed that reactive oxygen species such as hydroxyl radicals in the MB/O3 system easily attacked the reaction sites with smaller bond levels, lower average local ionization energies, and higher abbreviated Fukui functions on the structure of NOF molecules. The analytical results of liquid chromatography-tandem mass spectrometry (LC-MS/MS) combined with model calculations inferred that the degradation pathways of NOF from MB/O3 treatment include: defluorination reaction, piperazine ring transformation, hydroxyl substitution reaction, and quinolone epoxidation. The toxicity of NOF and degradation products were evaluated using T.E.S.T. software and it found that NOF had negative effects on orally administered rats, fathead minnows, and daphnia. It is developmentally toxic and non-mutagenic. The degradation process may produce products that are more toxic than NOF. In this study, the modeling method to predict the degradation pathway and ecotoxicity of NOF is convenient and effective. It can provide a theoretical basis for the study of the degradation pathway and ecotoxicity of complex organic molecules degraded by MB/O3 system.
-
Key words:
- norfloxacin /
- Gaussian /
- T.E.S.T. /
- degradation pathway /
- ecotoxicity.
-

-
表 1 梯度洗脱程序
Table 1. Gradient elution program
时间/min
TimeA相比例/%
Proportion of mobile phase AB相比例/%
Proportion of mobile phase B0 95 5 1 95 5 8 5 95 13 5 95 14 95 5 15 95 5 表 2 NOF不同位点键级分布
Table 2. Bond level distribution of different sites of NOF
键
BondLBO键级
Laplacian bond order键
BondLBO键级
Laplacian bond order键
BondLBO键级
Laplacian bond order1C-19F 0.120 6C-15N 0.957 2C-3C 1.317 21C-23O 0.547 16C-17C 0.995 3C-4C 1.332 24N-25C 0.548 13C-14C 0.998 1C-6C 1.344 14C-15N 0.570 25C-26C 1.004 5C-6C 1.350 15N-16C 0.616 21C-22O 1.029 4C-5C 1.377 13C-18N 0.663 10C-24N 1.119 10C-11C 1.460 17C-18N 0.665 11C-21C 1.143 1C-2C 1.601 4C-24N 0.840 3C-8C 1.151 8C-20O 0.893 8C-11C 1.193 表 3 NOF不同位点的CFF
Table 3. CFF at different sites of NOF
原子
Atom序号
Serial numberq(N) q(N+1) q(N−1) f− f+ f0 C 1 0.074 0.021 0.131 0.056 0.053 0.055 C 2 −0.054 −0.110 −0.018 0.036 0.056 0.046 C 3 −0.048 −0.071 0.026 0.073 0.024 0.048 C 4 0.046 0.024 0.075 0.029 0.023 0.026 C 5 −0.074 −0.125 0.001 0.075 0.051 0.063 C 6 0.047 0.015 0.087 0.040 0.032 0.036 C 8 0.091 0.029 0.115 0.024 0.061 0.043 C 10 0.061 −0.084 0.079 0.019 0.144 0.081 C 11 −0.075 −0.126 −0.059 0.016 0.052 0.034 C 13 −0.009 −0.011 0.006 0.015 0.003 0.009 C 14 −0.001 −0.006 0.026 0.028 0.004 0.016 N 15 −0.045 −0.060 0.103 0.148 0.015 0.081 C 16 0.002 −0.003 0.029 0.027 0.005 0.016 C 17 −0.009 −0.011 0.002 0.010 0.002 0.006 N 18 −0.183 −0.185 −0.175 0.008 0.002 0.005 F 19 −0.105 −0.130 −0.071 0.033 0.025 0.029 O 20 −0.396 −0.468 −0.349 0.047 0.072 0.060 C 21 0.195 0.157 0.203 0.008 0.039 0.023 O 22 −0.352 −0.392 −0.341 0.012 0.040 0.026 O 23 −0.186 −0.211 −0.180 0.006 0.025 0.015 N 24 0.028 −0.021 0.035 0.007 0.049 0.028 C 25 0.028 0.016 0.033 0.004 0.013 0.009 C 26 −0.070 −0.078 −0.067 0.003 0.008 0.005 表 4 MB/O3体系降解NOF过程中主要中间产物
Table 4. The main intermediate products in the degradation of NOF in MB/O3 system
产物
Product保留时间/min
tR质核比
Mass (m/z)峰强度
Peak intensity分子式
Molecular formula结构式
Structural formulaNOF 4.33 320.14 6.85×106 C16H18FN3O3 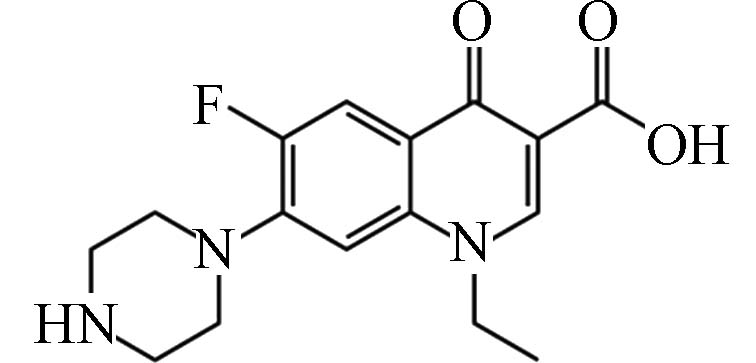
D1 4.33 302.13 5.75×105 C16H19N3O3 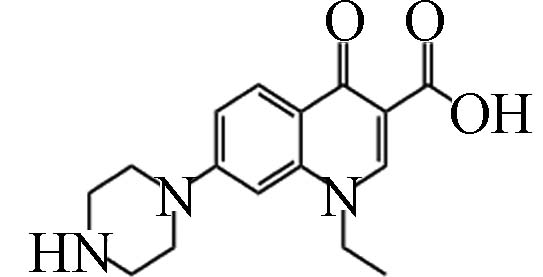
D2 7.55 318.30 3.11×106 C16H19N3O4 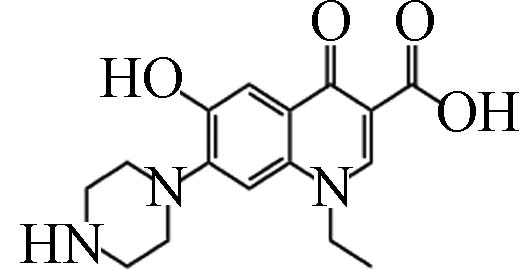
D3 7.55 274.28 6.13×106 C15H19N3O2 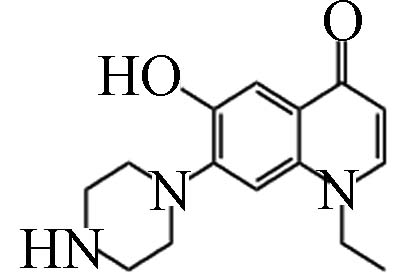
D4 4.80 350.12 1.89×105 C16H16FN3O5 
D5 4.33 322.25 1.98×105 C15H16FN3O4 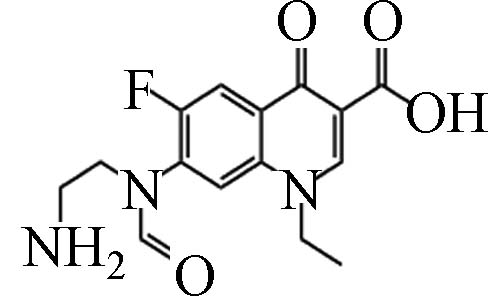
D6 4.06 294.13 2.04×105 C14H16FN3O3 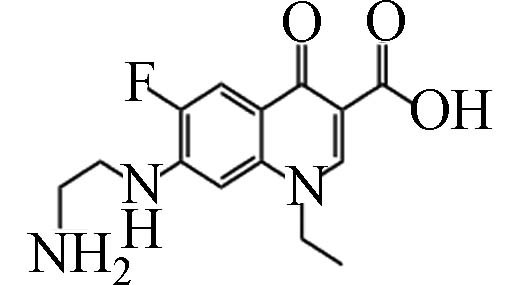
D7 5.34 279.08 6.21×105 C13H11FN2O4 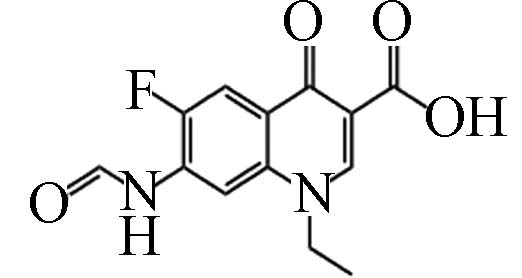
D8 7.06 251.18 1.46×105 C12H11FN2O3 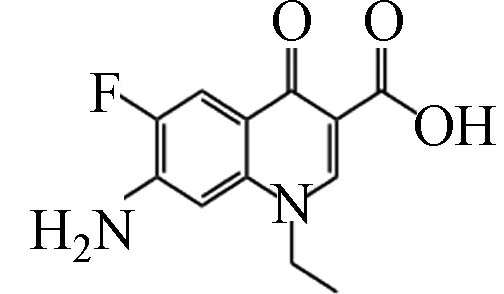
D9 0.62 190.12 8.47×104 C11H12N2O 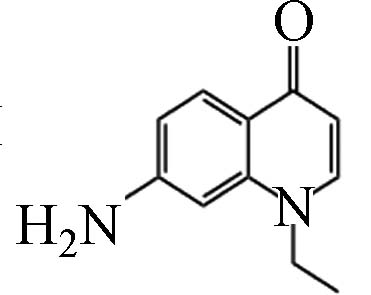
D10 4.06 336.14 1.19×106 C16H18FN3O4 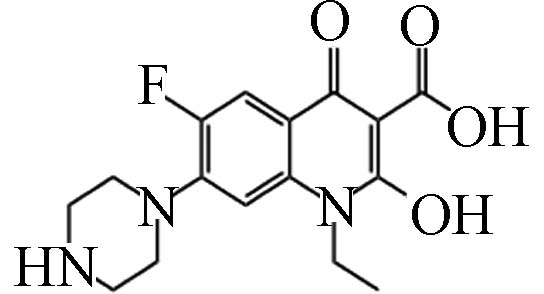
D11 10.64 338.34 5.33×106 C16H20FN3O4 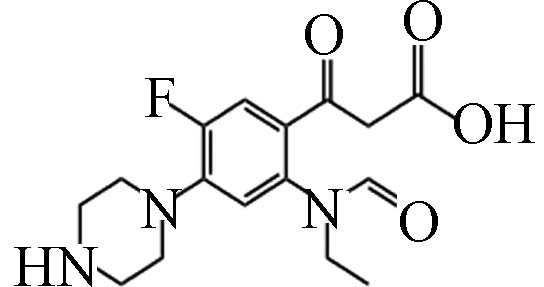
D12 3.25 296.14 3.73×106 C14H18FN3O3 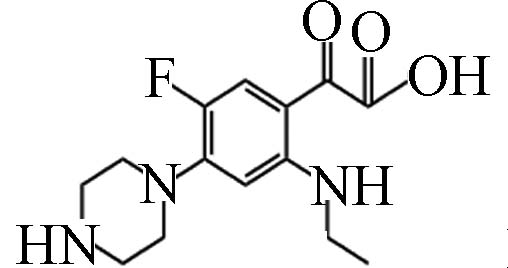
D13 3.25 268.15 3.59×105 C13H18FN3O2 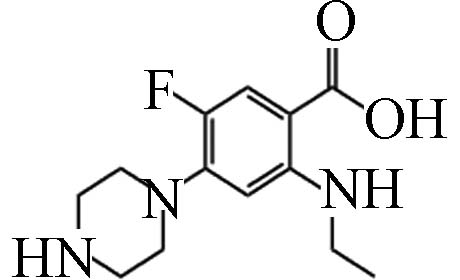
D14 2.98 240.05 1.25×105 C12H18FN3O 
D15 0.62 172.11 6.58×104 C8H10FNO2 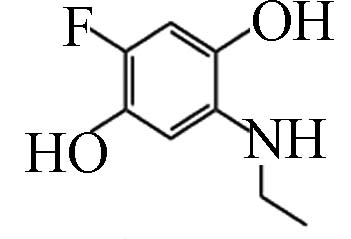
D16 3.72 305.16 1.55×105 C16H20FN3O2 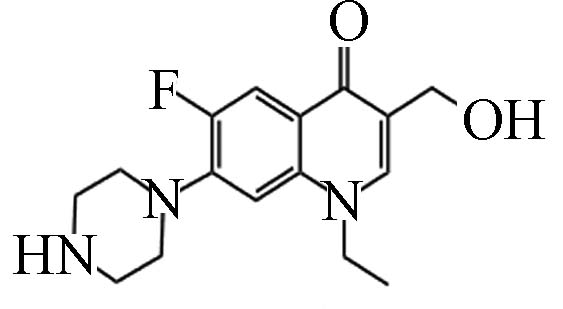
D17 3.25 296.14 3.73×106 C14H18FN3O3 
D18 2.98 269.15 6.64×104 C12H16FN3O3 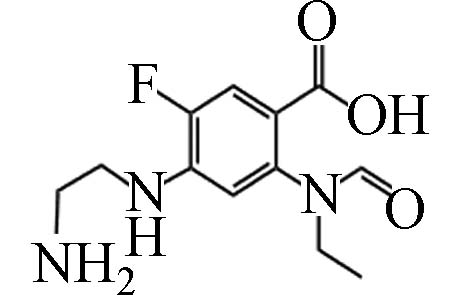
D19 4.93 227.18 1.90×105 C10H11FN2O3 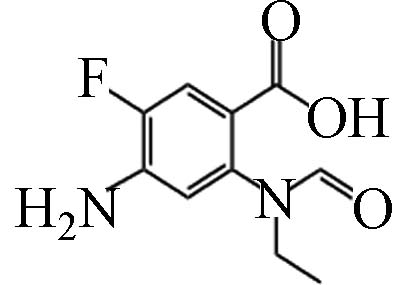
-
[1] KOVALAKOVA P, CIZMAS L, MCDONALD T J, et al. Occurrence and toxicity of antibiotics in the aquatic environment: A review[J]. Chemosphere, 2020, 251: 126351. doi: 10.1016/j.chemosphere.2020.126351 [2] LI S M, LI J, LI Z, et al. Toxic effects of norfloxacin in soil on fed and unfed Folsomia candida (Isotomidae: Collembola) and on gut and soil microbiota[J]. The Science of the Total Environment, 2021, 788: 147793. doi: 10.1016/j.scitotenv.2021.147793 [3] ZHANG Q F, ZHANG H, ZHANG Q X, et al. Degradation of norfloxacin in aqueous solution by atmospheric-pressure non-thermal plasma: Mechanism and degradation pathways[J]. Chemosphere, 2018, 210: 433-439. doi: 10.1016/j.chemosphere.2018.07.035 [4] ZHU F, WU Y Y, LIANG Y K, et al. Degradation mechanism of norfloxacin in water using persulfate activated by BC@nZVI/Ni[J]. Chemical Engineering Journal, 2020, 389: 124276. doi: 10.1016/j.cej.2020.124276 [5] GHOSH S, KAR S, PAL T, et al. Sunlight-driven photocatalytic degradation of Norfloxacin antibiotic in wastewater by ZnSe microsphere functionalized RGO composite[J]. Sustainable Chemistry for the Environment, 2023, 4: 100038. doi: 10.1016/j.scenv.2023.100038 [6] WANG X J, HU S S, MAO H T, et al. Facile fabrication of AgVO3/rGO/BiVO4 hetero junction for efficient degradation and detoxification of norfloxacin[J]. Environmental Research, 2023, 227: 115623. doi: 10.1016/j.envres.2023.115623 [7] FANG C, XU H B, WANG S H, et al. Simultaneous removal of norfloxacin and chloramphenicol using cold atmospheric plasma jet (CAPJ): Enhanced performance, synergistic effect, plasma-activated water (PAW) contribution, mechanism and toxicity evaluation[J]. Journal of Hazardous Materials, 2023, 452: 131306. doi: 10.1016/j.jhazmat.2023.131306 [8] KIM S H, PARK S Y, KIM G E, et al. Effect of pH and temperature on the biodegradation of oxytetracycline, streptomycin, and validamycin A in soil[J]. Applied Biological Chemistry, 2023, 66(1): 63. doi: 10.1186/s13765-023-00822-1 [9] SUMESH C K, PAREKH K. Nanocatalytic physicochemical adsorption and degradation of organic dyes[J]. Pramana, 2019, 92(6): 87. doi: 10.1007/s12043-019-1760-0 [10] WANG C K, LIN C Y, LIAO G Y. Degradation of antibiotic tetracycline by ultrafine-bubble ozonation process[J]. Journal of Water Process Engineering, 2020, 37: 101463. doi: 10.1016/j.jwpe.2020.101463 [11] WANG P, ZHANG H X, WU Z H, et al. A data-based review on norfloxacin degradation by persulfate-based advanced oxidation processes: Systematic evaluation and mechanisms[J]. Chinese Chemical Letters, 2023, 34(12): 108722. doi: 10.1016/j.cclet.2023.108722 [12] YUAN Q B, QU S Y, LI R, et al. Degradation of antibiotics by electrochemical advanced oxidation processes (EAOPs): Performance, mechanisms, and perspectives[J]. The Science of the Total Environment, 2023, 856(Pt 2): 159092. [13] ANJALI R, SHANTHAKUMAR S. Insights on the current status of occurrence and removal of antibiotics in wastewater by advanced oxidation processes[J]. Journal of Environmental Management, 2019, 246: 51-62. [14] LI S, WU Y N, ZHENG H S, et al. Antibiotics degradation by advanced oxidation process (AOPs): Recent advances in ecotoxicity and antibiotic-resistance genes induction of degradation products[J]. Chemosphere, 2023, 311(Pt 2): 136977. [15] ZHANG J, LV S Y, YU Q, et al. Degradation of sulfamethoxazole in microbubble ozonation process: Performance, reaction mechanism and toxicity assessment[J]. Separation and Purification Technology, 2023, 311: 123262 doi: 10.1016/j.seppur.2023.123262 [16] LIU T, ZHANG B, LI W Q, et al. The catalytic oxidation process of atrazine by ozone microbubbles: Bubble formation, ozone mass transfer and hydroxyl radical generation[J]. Chemosphere, 2023, 325: 138361. doi: 10.1016/j.chemosphere.2023.138361 [17] VERINDA S B, MUNIROH M, YULIANTO E, et al. Degradation of ciprofloxacin in aqueous solution using ozone microbubbles: Spectroscopic, kinetics, and antibacterial analysis[J]. Heliyon, 2022, 8(8): e10137. doi: 10.1016/j.heliyon.2022.e10137 [18] 杨旭. 微气泡催化臭氧化降解制药废水过程及机制研究[D]. 石家庄: 河北科技大学, 2022. YANG X. Study on the process and mechanism of catalytic ozonation of microbubbles in degradation of pharmaceutical wastewater[D]. Shijiazhuang: Hebei University of Science and Technology, 2022 (in Chinese).
[19] ZHANG J, LIU M, PANG B W, et al. Ciprofloxacin degradation in microbubble ozonation combined with electro-generated H2O2 process: Operational parameters and oxidation mechanism[J]. Separation and Purification Technology, 2023, 325: 124676 doi: 10.1016/j.seppur.2023.124676 [20] 胡英, 刘洪来. 密度泛函理论[M]. 北京: 科学出版社, 2016. HU Y, LIU H L. Density functional theory[M]. Beijing: Science Press, 2016(in Chinese).
[21] 卢志磊, 范勇杰, 陈洁洁, 等. 基于Gaussian、ECOSAR模型的紫外/次氯酸体系降解含卤阻燃剂的产物预测与毒性评估[J]. 环境化学, 2024, 43(1): 82-91. doi: 10.7524/j.issn.0254-6108.2022063002 LU Z L, FAN Y J, CHEN J J, et al. Product prediction and toxicity assessment of halogen-containing flame retardants degraded by UV/hypochlorous acid systems based on Gaussian and ECOSAR models[J]. Environmental Chemistry, 2024, 43(1): 82-91 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022063002
[22] GUTIÉRREZ-SÁNCHEZ P, ÁLVAREZ-TORRELLAS S, LARRIBA M, et al. Influence of transition metal-based activating agent on the properties and catalytic activity of sewage sludge-derived catalysts. Insights on mechanism, DFT calculation and degradation pathways[J]. Journal of Molecular Liquids, 2023, 381: 121840. doi: 10.1016/j.molliq.2023.121840 [23] YEOM Y, HAN J R, ZHANG X R, et al. A review on the degradation efficiency, DBP formation, and toxicity variation in the UV/chlorine treatment of micropollutants[J]. Chemical Engineering Journal, 2021, 424: 130053. doi: 10.1016/j.cej.2021.130053 [24] 陈洁洁, 范勇杰, 杨婧, 等. 基于Guassian、Multiwfn及ECOSAR的氮磷系阻燃剂在UV/PDS体系中的降解路径及产物毒性预测研究[J]. 环境科学学报, 2022, 42(12): 39-48. CHEN J J, FAN Y J, YANG J, et al. Degradation pathway and product toxicity prediction of nitrogen phosphorus flame retardants in UV/PDS system based on Guassian, Multiwfn and ECOSAR[J]. Acta Scientiae Circumstantiae, 2022, 42(12): 39-48 (in Chinese).
[25] MARENICH A V, CRAMER C J, TRUHLAR D G. Universal solvation model based on solute electron density and on a continuum model of the solvent defined by the bulk dielectric constant and atomic surface tensions[J]. The Journal of Physical Chemistry. B, 2009, 113(18): 6378-6396. doi: 10.1021/jp810292n [26] FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 16 Rev. C. 01[CP/OL]. [27] LU T, CHEN F W. Bond order analysis based on the Laplacian of electron density in fuzzy overlap space[J]. The Journal of Physical Chemistry. A, 2013, 117(14): 3100-3108. doi: 10.1021/jp4010345 [28] LU T, CHEN F W. Multiwfn: A multifunctional wavefunction analyzer[J]. Journal of Computational Chemistry, 2012, 33(5): 580-592. doi: 10.1002/jcc.22885 [29] ALAM M S, LEE D U. Molecular structure, spectral (FT-IR, FT-Raman, Uv-Vis, and fluorescent) properties and quantum chemical analyses of azomethine derivative of 4-aminoantipyrine[J]. Journal of Molecular Structure, 2021, 1227: 129512. doi: 10.1016/j.molstruc.2020.129512 [30] HUMPHREY W, DALKE A, SCHULTEN K. VMD: Visual molecular dynamics[J]. Journal of Molecular Graphics, 1996, 14(1): 33-38,27-28. doi: 10.1016/0263-7855(96)00018-5 [31] GEERLINGS P, de PROFT F, LANGENAEKER W. Conceptual density functional theory[J]. Chemical Reviews, 2003, 103(5): 1793-1873. doi: 10.1021/cr990029p [32] FENG X F, LONG R X, LIU C C, et al. Flexible Z-scheme heterojunction membrane reactors for visible-light-driven antibiotic degradation and oil-water separation[J]. Chemical Engineering Journal, 2023, 471: 144447. doi: 10.1016/j.cej.2023.144447 [33] LYKOS C, KOURKOUTA T, KONSTANTINOU I. Study on the photocatalytic degradation of metronidazole antibiotic in aqueous media with TiO2 under lab and pilot scale[J]. The Science of the Total Environment, 2023, 870: 161877. doi: 10.1016/j.scitotenv.2023.161877 [34] 王福生, 孙玮, 张渝, 等. 过渡金属离子促进煤自燃机理的量子化学计算[J]. 煤炭学报, 2024, 49(5) : 2347-2359. WANG F S, SUN W, ZHANG Y, et al. Quantum chemical calculation of transition metal ions promoting coal spontaneous combustion mechanism[J]. Journal of China Coal Society, 2024, 49(5) : 2347-2359 (in Chinese).
[35] PARLAK C, ALVER Ö. A density functional theory investigation on amantadine drug interaction with pristine and B, Al, Si, Ga, Ge doped C60 fullerenes[J]. Chemical Physics Letters, 2017, 678: 85-90. doi: 10.1016/j.cplett.2017.04.025 [36] KURBAN M, MUZ İ. Theoretical investigation of the adsorption behaviors of fluorouracil as an anticancer drug on pristine and B-, Al-, Ga-doped C36 nanotube[J]. Journal of Molecular Liquids, 2020, 309: 113209. doi: 10.1016/j.molliq.2020.113209 [37] 付蓉, 卢天, 陈飞武. 亲电取代反应中活性位点预测方法的比较[J]. 物理化学学报, 2014, 30(4): 628-639. doi: 10.3866/PKU.WHXB201401211 FU R, LU T, CHEN F W. Comparing methods for predicting the reactive site of electrophilic substitution[J]. Acta Physico-Chimica Sinica, 2014, 30(4): 628-639 (in Chinese). doi: 10.3866/PKU.WHXB201401211
[38] WU Y H, LI Y L, HE J Y, et al. Nano-hybrids of needle-like MnO2 on graphene oxide coupled with peroxymonosulfate for enhanced degradation of norfloxacin: A comparative study and probable degradation pathway[J]. Journal of Colloid and Interface Science, 2020, 562: 1-11. doi: 10.1016/j.jcis.2019.11.121 [39] DENG J, XU M Y, CHEN Y J, et al. Highly-efficient removal of norfloxacin with nanoscale zero-valent copper activated persulfate at mild temperature[J]. Chemical Engineering Journal, 2019, 366: 491-503. doi: 10.1016/j.cej.2019.02.073 [40] XUE L, ZHAO C X, LIU J M, et al. Microwave electrodeless UV light source combine ozone generation with photocatalytic simultaneous degradation of norfloxacin[J]. Chemical Engineering and Processing - Process Intensification, 2023, 186: 109325. doi: 10.1016/j.cep.2023.109325 [41] XU Z M, XUE X J, HU S H, et al. Degradation effect and mechanism of gas-liquid phase dielectric barrier discharge on norfloxacin combined with H2O2 or Fe2+[J]. Separation and Purification Technology, 2020, 230: 115862. doi: 10.1016/j.seppur.2019.115862 [42] ZHAO Y P, SUN Q, ZHANG J, et al. Construction of Fe/N/C nano-clusters anchored on porous diatomite for efficient removal of norfloxacin via the adsorption-PMS activation[J]. Separation and Purification Technology, 2023, 310: 123127. doi: 10.1016/j.seppur.2023.123127 [43] ZHOU Y, HE J, LU J, et al. Enhanced removal of bisphenol A by cyclodextrin in photocatalytic systems: Degradation intermediates and toxicity evaluation[J]. Chinese Chemical Letters, 2020, 31(10): 2623-2626. doi: 10.1016/j.cclet.2020.02.008 [44] LIU H Y, CHEN H J, ADDISON F, et al. Insights into electrocatalytic oxidation of aqueous ampicillin: Degradation mechanism and potential toxicity from intermediates[J]. Journal of Environmental Chemical Engineering, 2022, 10(6): 108673. doi: 10.1016/j.jece.2022.108673 [45] YANG J X, LV G C, LI T T, et al. Theoretical insight into the degradation of diclofenac by hydroxyl and sulfate radicals in aqueous-phase: Mechanisms, kinetics and eco-toxicity[J]. Journal of Environmental Chemical Engineering, 2022, 10(5): 108311. doi: 10.1016/j.jece.2022.108311 [46] HE B, SONG L X, ZHAO Z X, et al. CuFe2O4/CuO magnetic nano-composite activates PMS to remove ciprofloxacin: Ecotoxicity and DFT calculation[J]. Chemical Engineering Journal, 2022, 446: 137183. doi: 10.1016/j.cej.2022.137183 -



 下载:
下载: