-
塑料制品具有成本低、质量轻、强度大、防腐蚀等优良特性,被广泛应用于生产生活各个领域[1]. 以C—C键为骨架的聚烯烃类塑料和C—O键为骨架的聚酯类塑料是日常生活中常见的塑料类型[2]. 其中,典型的聚烯烃类塑料聚乙烯 (polyethylene, PE) 是全球生产量最高的塑料,全球年产量为1.5亿吨,市场占有率为30%[3]. 典型的聚酯类塑料聚氨酯 (polyurethane, PU) 年产量约为0.2亿t,占据了塑料市场的8.20%[3]. 塑料制品产量逐年增加,然而回收率只有9%[4],大量的塑料制品被随意弃置于自然环境中不易被分解,通过风化过程不断破碎形成粒径更小比表面积更大的微塑料(直径小于5 mm),甚至是纳米塑料(直径小于1 μm),难以从自然环境中回收处理,对生态系统和人类健康构成潜在严重威胁[5].
废弃塑料的传统处理方式如填埋和焚烧等,存在侵占土地、造成二次污染等问题,违背“碳中和”理念[6]. 近年来昆虫取食降解塑料的研究为废弃塑料的高效生物降解和资源化提供了新的研究方向和处理策略[7]. 在过去的十年中,鳞翅目昆虫和鞘翅目昆虫的幼虫,如黄粉虫、斜纹夜蛾、大麦虫、黑粉虫、大蜡螟虫等被发现能够降解多种塑料,包括PE、PU、PS (polystyrene)、PP (polypropylene)、 PET (polyethylene terephthalate)、PVC (polyvinyl chloride) 等等,其中研究最多的是黄粉虫、大麦虫[6, 8 − 17]. 然而,现实生活中产生、弃置于自然环境中的塑料废弃物复杂多样,要想将黄粉虫、大麦虫取食降解塑料应用到实际工艺中达到较好的降解效果,必须探究黄粉虫、大麦虫对不同类型塑料的喜食性、降解效率差异. 黄粉虫、大麦虫均可取食、降解聚烯烃塑料和聚酯类塑料,然而两种昆虫、两类塑料之间的降解效率和生长发育情况是否存在差异还未得到研究比较. 同时,昆虫肠道是丰富的微生物资源库,目前昆虫肠道微生物正成为塑料降解菌株的重要来源. 通过喂食各类塑料、塑造肠道微生物群落结构可影响昆虫的微生物组代谢功能,提高昆虫肠道中塑料降解功能菌的筛选效率[18 − 19]. 针对性地比较两种昆虫喂食两类塑料后的肠道差异塑料降解功能菌和酶有助于了解不同塑料生物降解所涉及的代谢通路和降解路径,更深入地解析微生物代谢之间的协同作用.
本文基于黄粉虫和大麦虫对聚烯烃类塑料PE和聚酯类塑料PU的取食降解能力、取食塑料后的生长发育特征差异、塑料降解程度差异进行了研究,并通过分析肠道微生物的响应挖掘昆虫降解塑料的代谢路径和潜在功能微生物和酶等,为将昆虫取食降解塑料应用到实际工艺、优化降解效率提供理论依据.
-
黄粉虫和大麦虫幼虫购自山东省滨州市无棣县农业养殖场. 麦麸购自浙江省金华市晨曦有机饲料公司. 聚乙烯 (PE)、聚氨酯 (PU) 泡沫塑料购自江苏苏州加奈尔包装材料厂. 在温度为26 ℃、湿度为60%的人工培养箱内暗条件下以麦麸为食物喂饲黄粉虫和大麦虫3 d并饥饿2 d后开始试验[7].
-
选取体长约2.0—2.2 cm的黄粉虫幼虫,体长为4.0—4.2 cm的大麦虫幼虫,选择典型聚烯烃类泡沫塑料PE和典型聚酯类泡沫塑料PU作为黄粉虫、大麦虫幼虫唯一的饲料来源,将泡沫塑料切成8 cm×5 cm×1 cm大小的小块,用蒸馏水清洗、干燥、紫外消毒后再进行试验. 设置喂食麦麸组为对照组. 每组放入10 g左右的幼虫,设置3个平行. 每7 d测定幼虫的生长发育情况包括体长、体宽、体重、存活率、化蛹率等,同时测量塑料的减重情况,清理死虫和蜕的虫皮,收集排泄物. 整个实验周期为42 d.
-
每隔7 d收集各组的排泄物样品并置于-20 ℃冰箱中以便进一步分析测定. 将将排泄物中的残留微塑料通过5% SDS(Sodium dodecyl sulfate, 十二烷基硫酸钠)溶液超声30 min后用灭菌超纯水反复清洗3次以去除生物分子污染,减少塑料添加剂可能产生的影响[20]. 将回收的残留塑料在60 ℃烘箱干燥48 h以待进一步分析测试. 用傅立叶红外光谱法 (FTIR,fourier transform infrared spectroscopy) 对塑料及大麦虫排泄物中残留塑料的物质组成成分进行鉴定,设定光谱范围为
4000 —500 cm−1. 用热重分析仪 (TGA, thermogravimetric analysis) 对原始塑料和排泄物中残留塑料的热稳定性进行表征. 实验升温温度为0—600 ℃, 升温速率20 ℃·min−1,保护气为Ar. 使用凝胶渗透色谱 (GPC, gel permeation chromatography) (Agilent1260 , Waters, USA) 分析PE、PU聚合物的分子量变化. 分别用1,2,4—三氯苯和N,N—二甲基甲酰胺溶液与PE、PU塑料样品混合,在60 ℃下缓慢加热,然后沉淀静置取上清液并通过0.22 μm PVDF (Polyvinylidene fluoride) 过滤器过滤. 以0.8 mL·min−1的速度注射20 μL进行GPC分析[7, 14, 21 − 23]. 采用配备HESI源的液相色谱-串联质谱法 (LC—MS/MS, liquid chromatography-tandem mass spectrometry) (Thermo Scientific Q Exactive, USA) 对塑料的生物降解产物进行分析[24]. 通过LC—MS/MS测得的降解产物的毒性分析根据美国环境署USEPA开发的T.E.S.T毒性预测工具进行. 将测得的降解产物的分子式或化学名称输入该软件,可自动根据发育毒性、畸变系数、生物浓缩系数等指标预测出相应毒性值. -
试验结束后提取黄粉虫、大麦虫幼虫的肠道进行后续分析:先把黄粉虫和大麦虫幼虫放入95%酒精浸泡5 min,再将幼虫在灭菌生理盐水中浸泡5 min[18]. 取出幼虫置于灭菌蜡盘上用解剖针挑出肠道置于1.5 mL离心管中. 加入200 μL PBS (Phosphate buffer saline) 磷酸盐缓冲液,使用电动搅拌器匀浆处理,于−80 ℃保存.
-
使用DNeasy Blood and Tissue Kit试剂盒(QIAGEN,德国)抽提肠道样本总DNA并寄送至上海美吉生物工程有限公司进行PCR (Polymerase chain reaction) 扩增和测序[25]. 使用引物对515F(5′-GTGYCAGCMGCCGCGGTAA-3′) 和806R (5′-GGACTACNVGGGTWTCTAAT-3′) 扩增16S rRNA的V4区[26]. 在Illumina HiSeq2500上使用对端测序策略 (PE250) 进行测序. 最后,使用在线Majorbio云平台(上海,中国)进行肠道微生物群落分析. 将各样品所测得的有效序列数据抽平(均一化) 处理后再进行后续分析. 通过PICRUSt2和FAPROTAX将ASVs序列与其内部的参考序列比对,获得每个样本中对应的功能信息和丰度信息, 丰度用lg (abundance+1) 表示.
-
所有的实验均进行了3次平行测试. 采用SPSS 25.0软件 (SPSS, Chicago, USA) 对数据进行统计学比较. 结果以平均值±标准差表示. 对多组间的差异进行单因素方差分析 (ANOVA),并进行事后Tukey检验. P < 0.05认为有统计学意义.
-
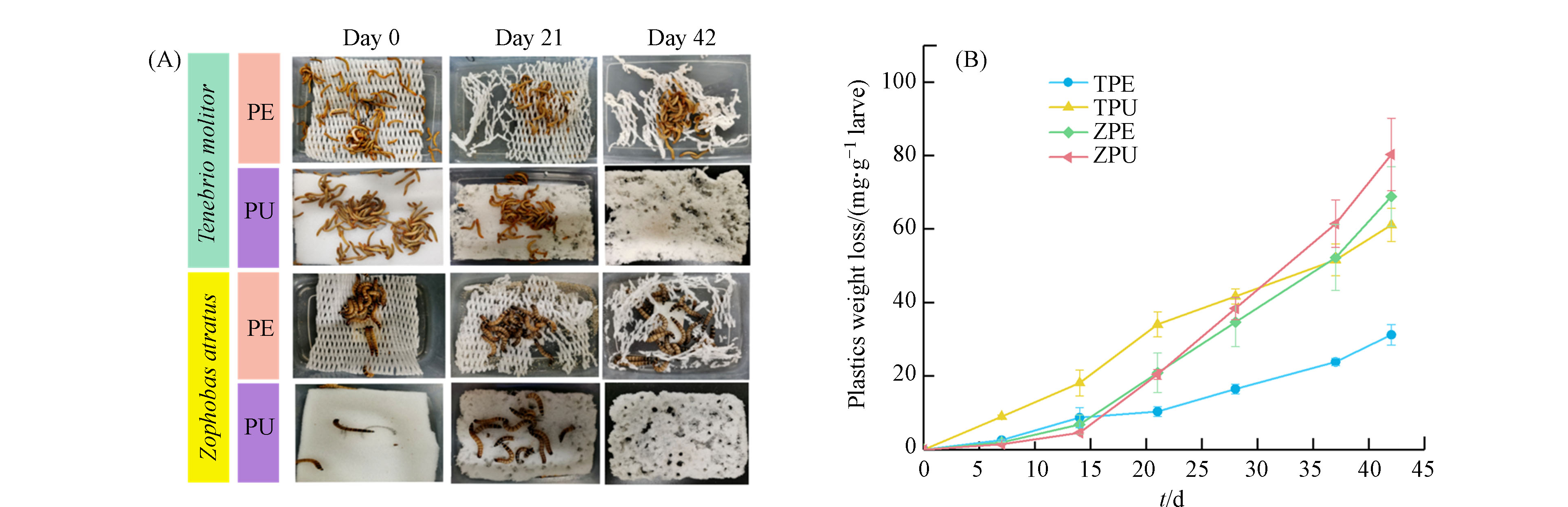
黄粉虫、大麦虫幼虫均对PE、PU泡沫塑料均表现出活跃的取食性,主要以蛀洞形式取食(图1A). 在实验42 d内对两类泡沫塑料的取食效率有一定差异. 平均每g黄粉虫取食31.29 mg的PE和61.20 mg的PU塑料;平均每克大麦虫取食68.90 mg的PE和80.38 mg的PU(图1B). 可以看出,相比于聚烯烃类塑料PE,大麦虫、黄粉虫均更倾向于取食聚酯类塑料PU,黄粉虫、大麦虫取食聚酯类塑料的效率是取食聚烯烃类塑料的1.17—1.96倍. 同时,在同等条件下,大麦虫幼虫的取食塑料效率显著高于黄粉虫幼虫 (ANOVA, P < 0.05),约为黄粉虫取食塑料效率的1.3—2.20倍. 大麦虫取食聚烯烃塑料PE的效率甚至略高于黄粉虫取食聚酯类塑料PU的效率. 考虑到工艺的生态可持续,还需探究昆虫取食塑料后的生长以及繁殖情况.
-
表1展示了黄粉虫、大麦虫幼虫取食两类塑料后生长发育指标的差异. 可以看出,吸食PE黄粉虫 (TPE)、吸食PU黄粉虫 (TPU)、吸食PE大麦虫 (ZPE)、吸食PU大麦虫 (ZPU) 虫体体重或体长有一定的增长,说明以PE、PU泡沫塑料为唯一食物可以为其提供维持正常生长所需的能量. 与麦麸对照组 (TBran、ZBran) 相比,生长情况较差,体重增长率低,存活率较低,且化蛹率几乎为0,说明仅仅取食塑料不能保证其正常生长和繁殖,对利用黄粉虫、大麦虫来长期降解塑料的实际工艺应用不利. 大麦虫组的存活率显著高于黄粉虫组 (ANOVA, P < 0.05),同时大麦虫对塑料的降解效率也高于黄粉虫组,由此可见大麦虫更适合用于实际昆虫降解塑料工艺中. 相关文献指出,通过添加麦麸或采取交替饲喂塑料和麦麸的方式不仅可以提高泡沫塑料降解能力,还能减少取食塑料对昆虫生长发育的影响[7, 13]. 因此,在实际的昆虫生物降解塑料工艺中,与麦麸共同饲喂将有可能是高效、生态可持续的方法.
-
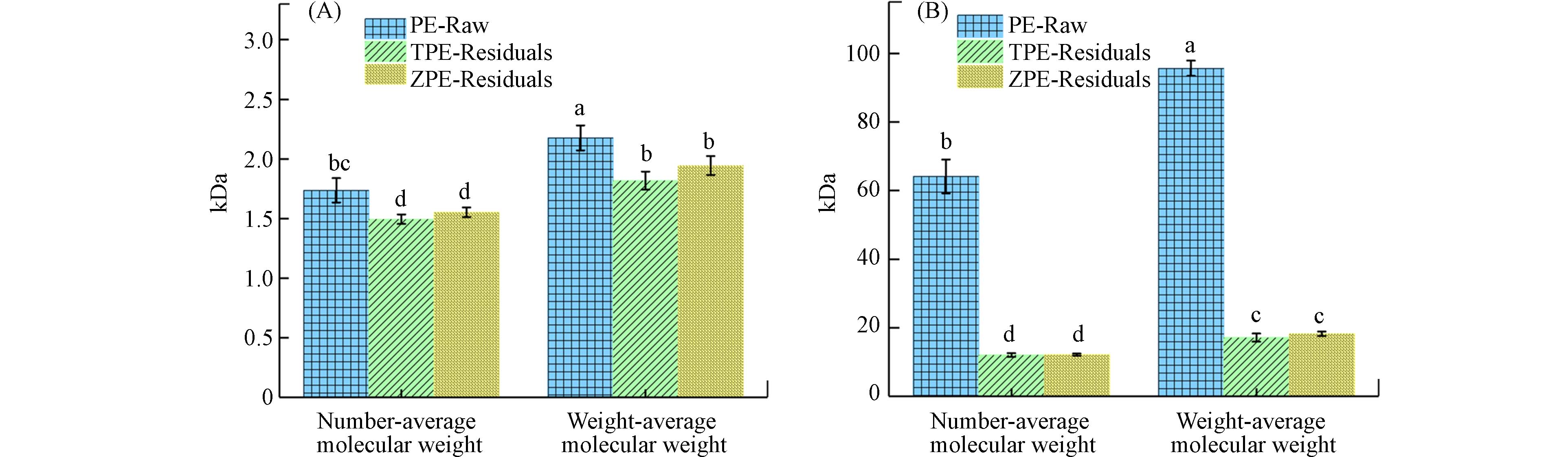
黄粉虫喂食泡沫塑料42 d后,从其幼虫排泄物中回收了残留的塑料碎片进行分子量变化的测试(图2). 通过GPC分析发现,经黄粉虫、大麦虫取食PE泡沫塑料后,残留的PE的分子量(数均分子量 (Mn, number-average molecular weight) 和重均分子量 (Mw, weight-average molecular weight))比原始PE塑料均显著下降 (ANOVA, P < 0.05),表明黄粉虫、大麦虫幼虫取食PE塑料过程后塑料发生了一定的解聚. 黄粉虫、大麦虫取食PU泡沫后,残留塑料的分子量同样也得到了显著降低 (ANOVA, P < 0.05). 数均分子量和重均分子量的同时下降说明昆虫降解塑料均较完全,塑料聚合物断裂成小分子并被完全分解[19]. 对比两种塑料的分子量下降程度可以看出,黄粉虫、大麦虫幼虫对聚酯类塑料PU降解程度最高,降解更完全,猜测这与塑料本身分子结构有关. PE为聚烯烃类塑料,主要含有C—C单键,不易于被微生物和酶水解,而PU为聚酯类塑料,含有酯键易于被水解酶水解[27]. 而两种昆虫对同种塑料的降解程度接近,塑料分子量的变化程度没有显著差异 (ANOVA, P > 0.05),在同等培养条件和相同时间内等生物量的黄粉虫降解PE后的Mn、Mw分子量变化程度略高于大麦虫,降解PU后的Mw分子量变化程度略高于大麦虫,可见从塑料降解程度上黄粉虫降解塑料略优于大麦虫.
-
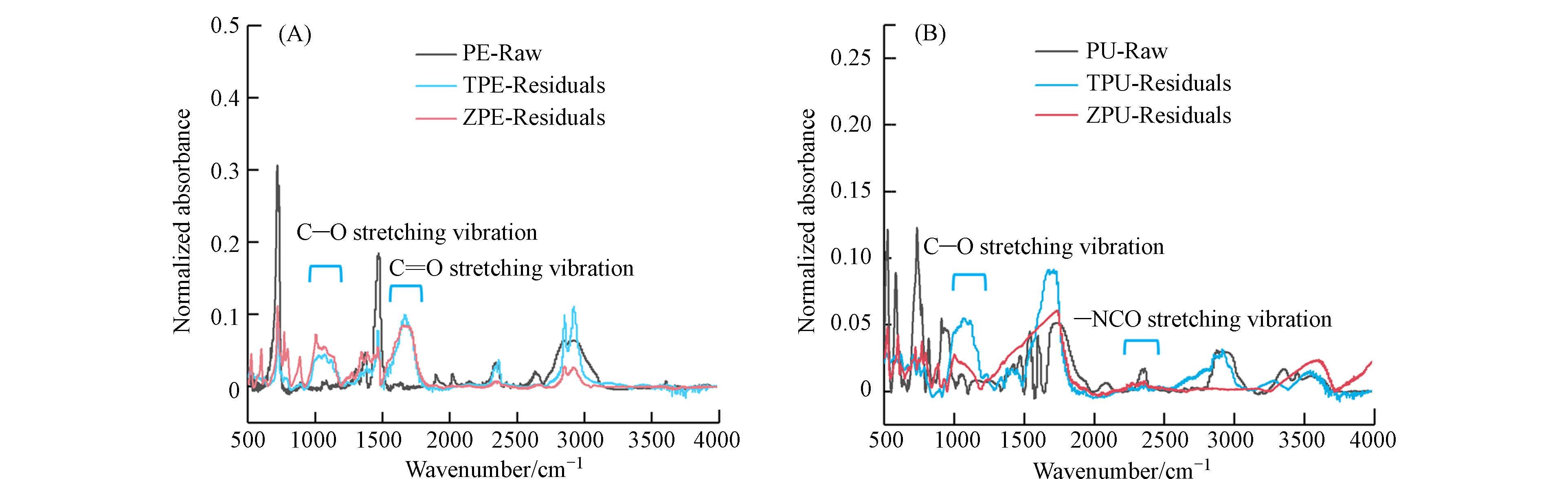
对比黄粉虫、大麦虫取食PE塑料前后的红外光谱图发现,原始PE具有的
2918 、2853 、1469 、730 cm−1等基本特征吸收峰减弱,并且新出现 1014(C—O伸缩振动)、1640 (C=O伸缩振动),可见PE塑料发生了氧化作用,PE塑料得到了降解(图3A)[28]. 对比原始PU谱图和昆虫啃食PU后残留微塑料的FTIR结果可以发现,原始PU具有的3289 、2273 、1715 cm−1(N—H伸缩振动、—NCO的不对称伸缩振动、C=O伸缩振动)等基本特征谱带减弱或消失,并且出现3426 、1386 cm−1 (O—H伸缩振动、C—O弯曲振动)等新谱带,可以看出塑料组分发生了很大的变化,PU得到了明显的降解(图3B). 从红外光谱结果可以看出,在昆虫取食降解聚烯烃、聚酯类塑料过程中,均对塑料产生氧化作用. 将氧官能团加入到聚合物链中,使其疏水性降低、分子量减少,是塑料生物降解过程中必不可少的关键步骤[15]. 可以推测,经过黄粉虫、大麦虫取食后,昆虫肠道内的微生物在塑料表面定殖,分泌了胞外酶等物质,使PE、PU残留塑料表面发生了氧化作用,塑料表面变粗糙,塑料结构被破坏,促进了塑料的进一步降解[27, 29]. 两种昆虫降解聚烯烃类塑料PE后的残留塑料红外光谱差异较小,说明黄粉虫、大麦虫对PE塑料的降解程度接近. 而从降解后的聚酯类塑料PU的红外光谱可以看出,黄粉虫取食后的PU塑料中C—O峰的强度相比大麦虫的更高,推测黄粉虫对PU塑料的氧化程度更高,所以取食前后PU的分子量变化更大(图2),降解程度更高. -
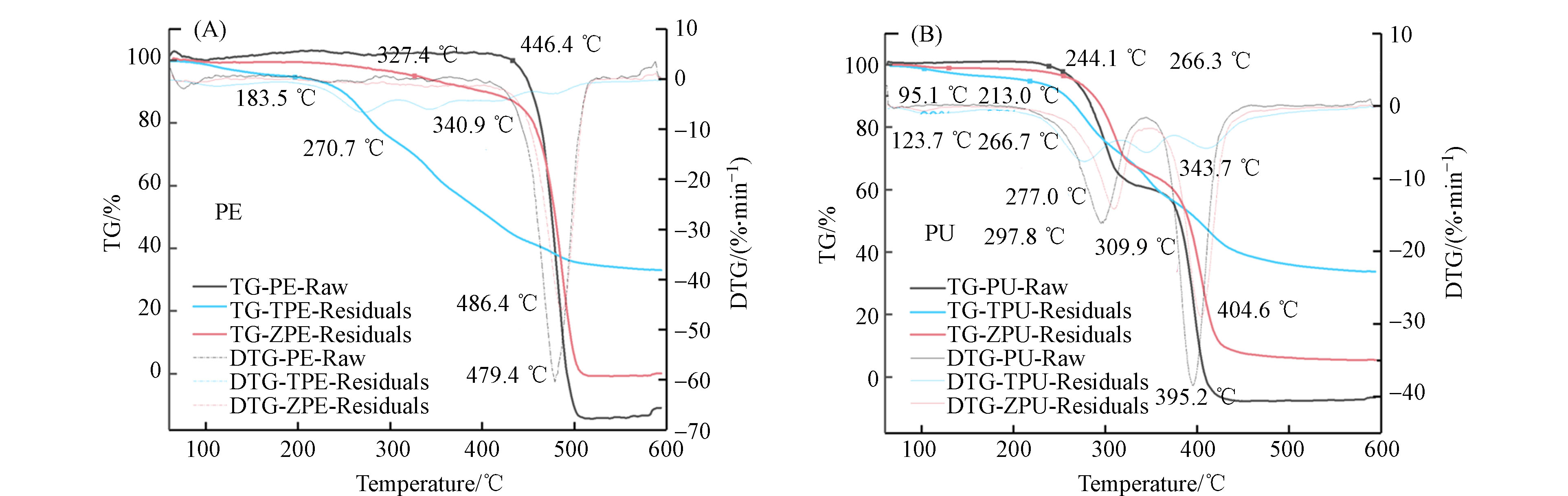
通过热重分析比较了昆虫取食塑料前后塑料热稳定性质的变化差异. 原始PE塑料在前400 ℃的温度条件下没有出现明显的失重,在446.4 ℃损失5%质量,整个过程只出现一个吸热峰(图4). 而经过黄粉虫肠道消化后残留的PE塑料5%质量损失温度为183.5 ℃,明显低于原始PE塑料,且整个失重过程出现4个吸热峰,说明残留的微塑料中存在新组分,热稳定性降低. 同样地,经过大麦虫取食后残留的PE塑料热稳定性也低于原始塑料,5%质量损失温度为327.4 ℃,吸热峰出现温度接近原始塑料,说明同原始PE塑料相比较有相同的组分,但物质成分组成并不是完全一样的,经大麦虫消化后有新物质生成. 由黄粉虫、大麦虫取食降解聚烯烃类塑料PE前后热稳定的变化程度可以看出,经黄粉虫取食后PE热稳定变化更大,由此可见黄粉虫对PE塑料的降解程度比大麦虫高. 原始PU塑料经历了两个失重过程,整个过程中出现两个吸热峰,分别为297.8℃和395.2℃,推测是由于分子链断裂所致(图4). 而黄粉虫取食降解PU后残留的微塑料热稳定性降低,失重速率加快. 大麦虫取食PU塑料后残留微塑料热稳定性也有了一定的降低. 通过对比发现,与原始PU热重曲线存在明显区别,可见昆虫消化PU后残留微塑料组分产生了变化,说明黄粉虫、大麦虫对PU具有明显的降解作用. 经过黄粉虫肠道消化后残留的PU塑料5%质量损失温度为213.0℃,低于经过大麦虫肠道消化后残留的PU塑料5%质量损失温度 (266.7℃),可见经黄粉虫取食后PU热稳定变化更大,黄粉虫对聚酯类塑料PU的降解程度比大麦虫高.
由黄粉虫、大麦虫取食烯烃类塑料PE、聚酯类塑料PU前后塑料的理化特征变化可以看出,黄粉虫、大麦虫均可取食并降解聚烯烃和聚酯类泡沫塑料,降解程度较完全. 同等条件下,昆虫对聚酯类塑料PU的降解程度高于聚烯烃类塑料PE,黄粉虫对聚烯烃和聚酯类泡沫塑料的降解程度高于大麦虫.
-
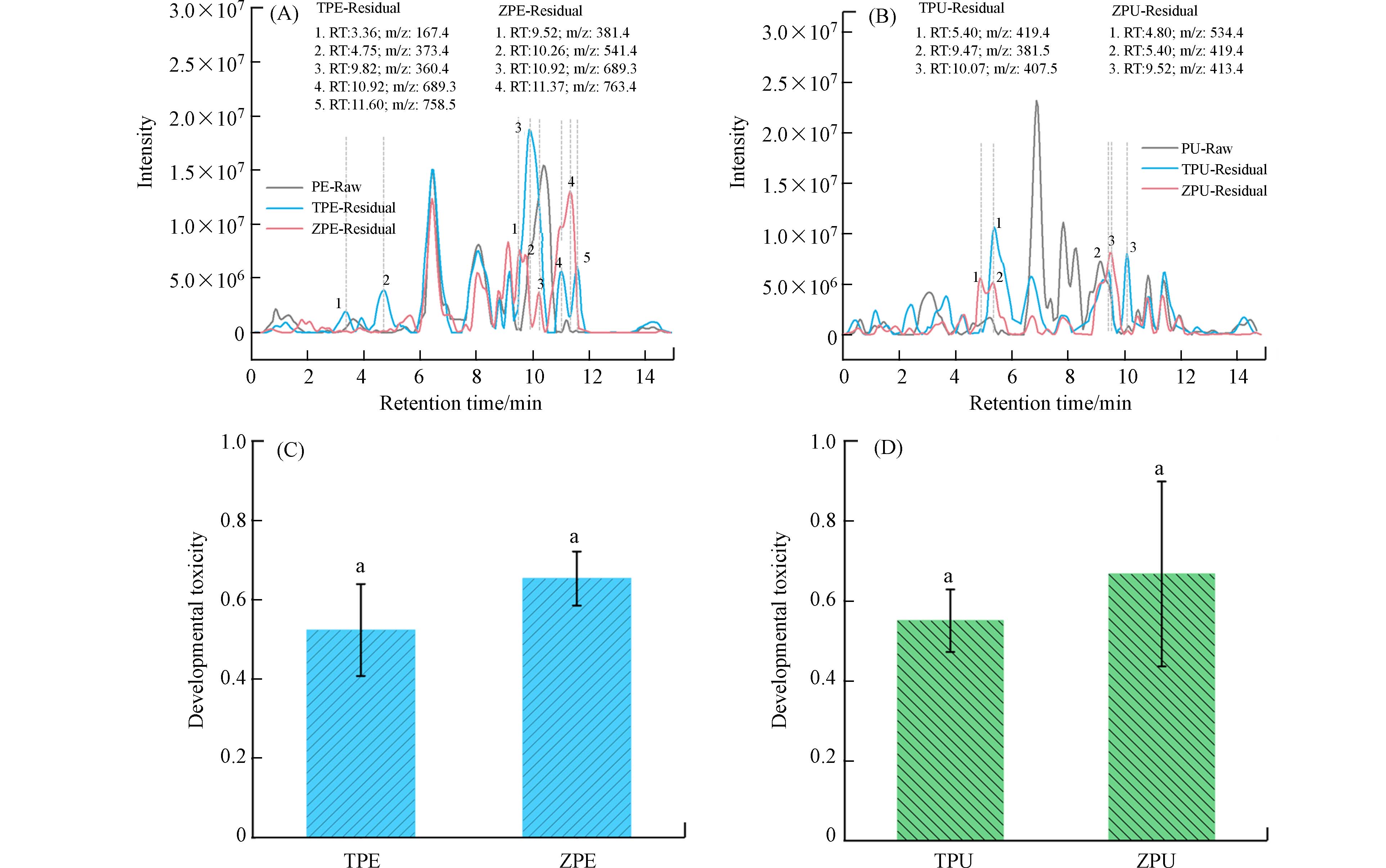
通过高效液相色谱-质谱联用进一步分析了黄粉虫、大麦虫取食降解PE、PU泡沫塑料后的塑料降解中间产物差异(图5). 扣除了原始PE塑料的色谱峰后,黄粉虫取食后的PE残余塑料在保留时间为3.36、4.75、9.82、10.92、11.60出现了新的峰,通过分析产物的二级质谱中碎片离子的结构推测可能的降解产物为C6H10O4、C15H27N5O6、C16H29N3O6等,大麦虫取食后PE残余塑料中存在的降解产物推测为C22H40O2、C31H50O6、C43H76O6等. 同样地,黄粉虫取食PU塑料后产生的中间小分子代谢产物可能为C20H40N2O3、C22H40O2、C21H34N4O4等,而大麦虫取食PU后产生的代谢产物可能为C28H49NO4、C24H39N3O3、C24H43NO3等. 可以看出主要的塑料降解产物为含有C、H、O、N等元素不饱和脂肪酸等物质. 由此可见,塑料的解聚、氧化、水解以及氮固定在塑料降解过程中起重要作用[16, 19, 30]. 黄粉虫、大麦虫对两类塑料的降解产生的小分子主要为不饱和脂肪酸等物质,可以看出脂肪酸的降解、代谢与合成在塑料降解过程中的关键作用. 在塑料降解过程中,塑料解聚、断链后产生的塑料单体和低聚物会进入脂肪酸合成代谢途径,最后进入β氧化机制生成乙酰基辅酶A进入TCA循环 (Tricarboxylic acid cycle),氧化有机物产生ATP (Adenosine triphosphate) 为细胞代谢、生长提供能量[27, 31]. 同时,通过比较昆虫取食塑料后的降解产物发育毒性可以看出,黄粉虫取食PE、PU后的降解产物毒性低于大麦虫取食后产生的降解产物的发育毒性,虽然差异不明显 (ANOVA, P > 0.05). 一般来说,分子量较大的降解产物可能在环境中不易被生物降解,导致其在生态系统中的积累,从而表现出更高的毒性[32]. 虽然由于其他降解产物的质量低或结构复杂,二级质谱中没有足够的片段离子信息,很难确定完整的降解产物列表,但可以看出黄粉虫取食两种塑料后产生的降解产物分子量比大麦虫取食塑料产生的降解产物的分子量小,其降解产物毒性也较低,黄粉虫对两种塑料的降解程度相对较高[24]. 因此,虽然大麦虫对塑料的取食效率较高,但降解程度低于黄粉虫,降解产物的发育毒性相对较高,故在实际的昆虫降解塑料工艺中追求降解效率的同时也需要考虑塑料降解产物的绿色控制与消减.
-
经16S rRNA高通量测序后共获得优化序列
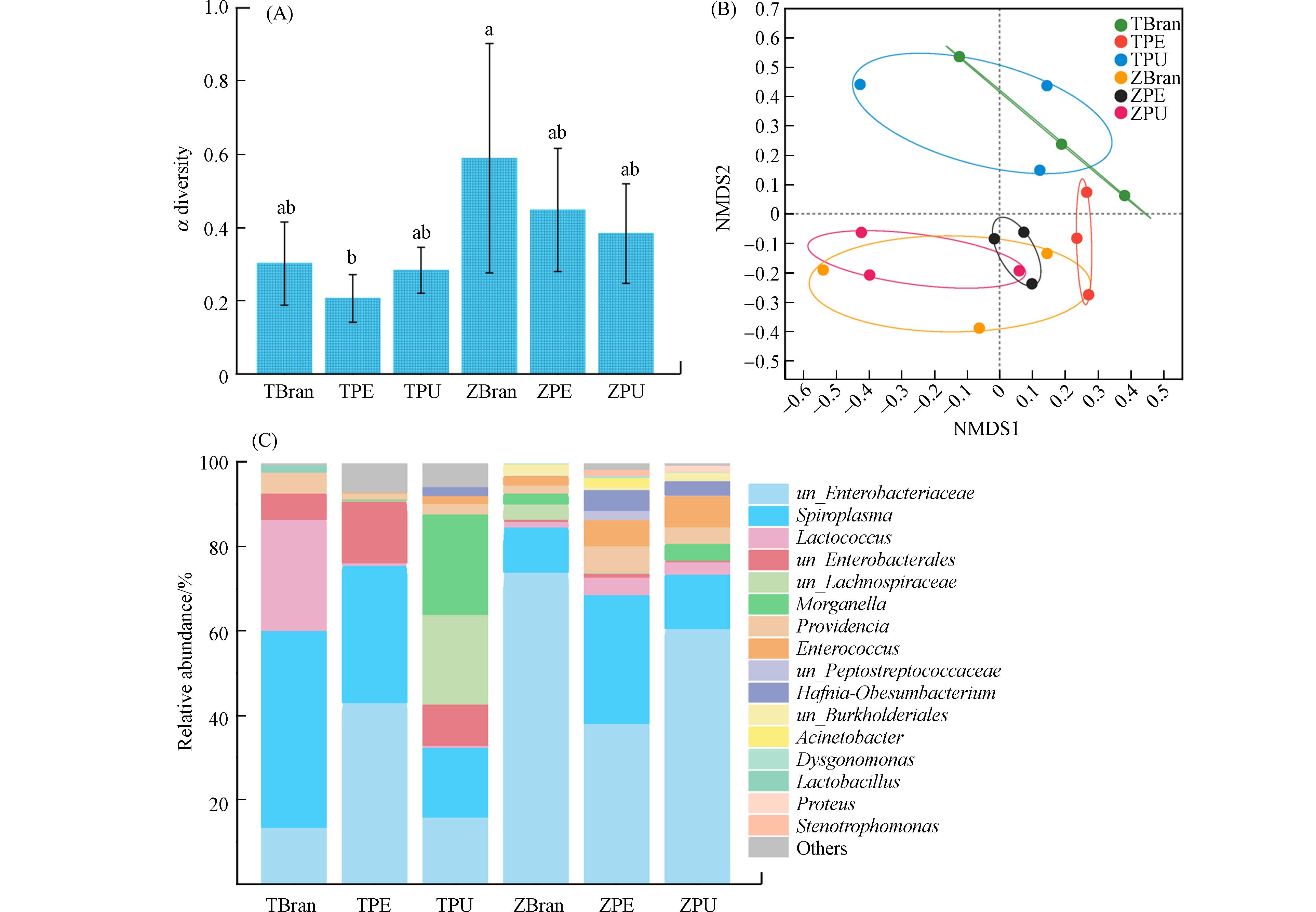
1015971 条,共256709445 bp,平均序列长度252.68 bp. 物种注释结果表明,从黄粉虫、大麦虫幼虫肠道样本共检测到细菌9门、12纲、32目、50科、71属. 从α多样性指数差异图可以看出,喂食两类塑料后大麦虫、黄粉虫肠道微生物多样性降低,但没有显著差异(图6A, ANOVA, P > 0.05). 基于Bray curtis距离的样本间β多样性指数差异结果可以看出,黄粉虫、大麦虫幼虫肠道微生物群落结构呈现显著性差异(图6B, P < 0.01, ADONIS, 置换999次). 黄粉虫、大麦虫取食降解PE、PU泡沫塑料后群落结构如图6C所示. 基于微生物群落的Kruskal-wallis秩和检验和多重检验校正FDR及Turkey-kramer检验与分析,揭示出黄粉虫、大麦虫幼虫取食聚烯烃塑料PE和聚酯类塑料PU后肠道中富集了相应的潜在塑料降解功能菌群. 取食PE塑料的黄粉虫肠道中的优势菌群主要是un_Enterobacteriaceae sp.,在取食PU塑料的黄粉虫肠道中富集了Morganella sp.和un_Lachnospiraceae sp. 属细菌. 而喂食PE塑料的大麦虫幼虫肠道中富集了un_Enterobacteriaceae sp.、 Hafnia-Obesumbacterium sp.和Acinetobacter sp.属细菌. 同时,在喂食PU塑料的大麦虫幼虫肠道中主要富集了Providencia sp.和Morganella sp.属细菌. 其中,Spiroplasma sp.、Hafnia-Obesumbacterium sp.和Acinetobacter sp.等属细菌被报道能够降解多种聚合物[13, 16, 33]. 由此可以看出,黄粉虫、大麦虫取食、降解PE、PU塑料过程中的肠道功能微生物组成存在明显差异,富集的潜在塑料降解功能菌组成不一致可能是导致两种昆虫对两类塑料降解效率、降解程度差异的关键因素. -
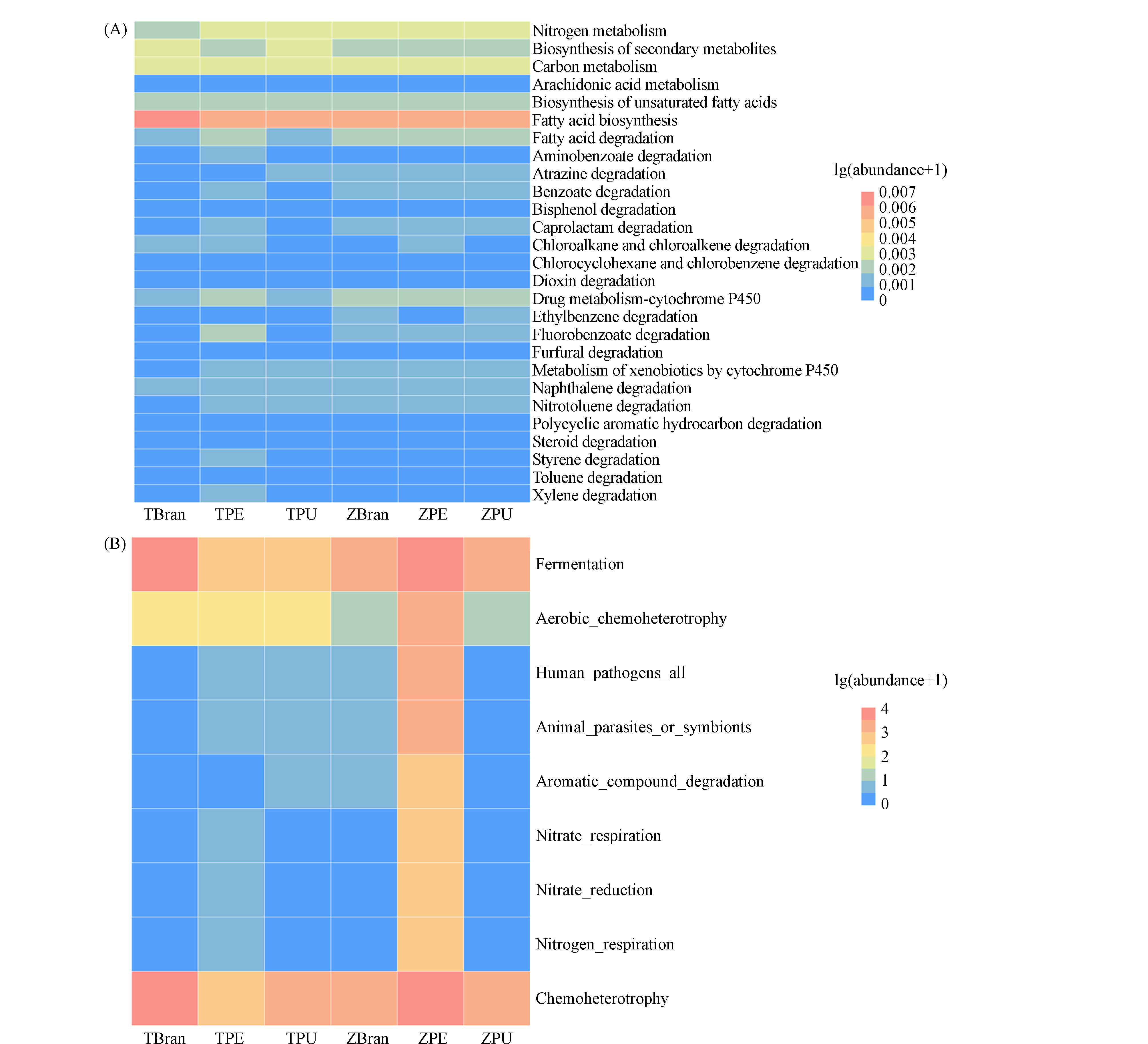
基于PICRUSt2的KEGG代谢通路功能预测发现,在黄粉虫、大麦虫取食降解各类塑料中苯甲酸盐降解、脂肪酸降解、脂肪酸合成、不饱和脂肪酸的生物合成、碳代谢、氮代谢等相关代谢路径的基因丰度提升(图7A). 说明昆虫取食消化塑料后,将塑料的高聚合结构中的分子链解聚,生成长链脂肪酸等中间产物并加以代谢利用产生能量,维持自身生长.
基于FAPROTAX的CNSP元素循环功能预测可以看出,有氧化学异养、发酵、芳香族化合物降解等代谢路径在昆虫取食各类塑料组中得到显著富集(图7B). 有氧化学异养是生物体利用有机化合物作为能量和碳的来源,并在此过程中需要氧气的代谢过程[34]. 这种类型的代谢在许多细菌、真菌和动物中很常见,包括通过有氧呼吸分解有机分子以产生ATP形式的能量. 在这个过程中,糖、脂肪和蛋白质等有机分子被氧化,产生二氧化碳、水和三磷酸腺苷. 这说明了昆虫取食塑料后,通过利用经过塑料化学异养作用,产生了维持其生长发育、新陈代谢对所需要的能量. 同时可以注意到,硝酸盐呼吸、硝酸盐还原、氮呼吸等氮循环过程对黄粉虫、大麦虫取食PE泡沫塑料十分重要[30]. 相关报道也证明了氮元素循环在昆虫取食降解塑料中起着协同促进的关键作用[19, 30].
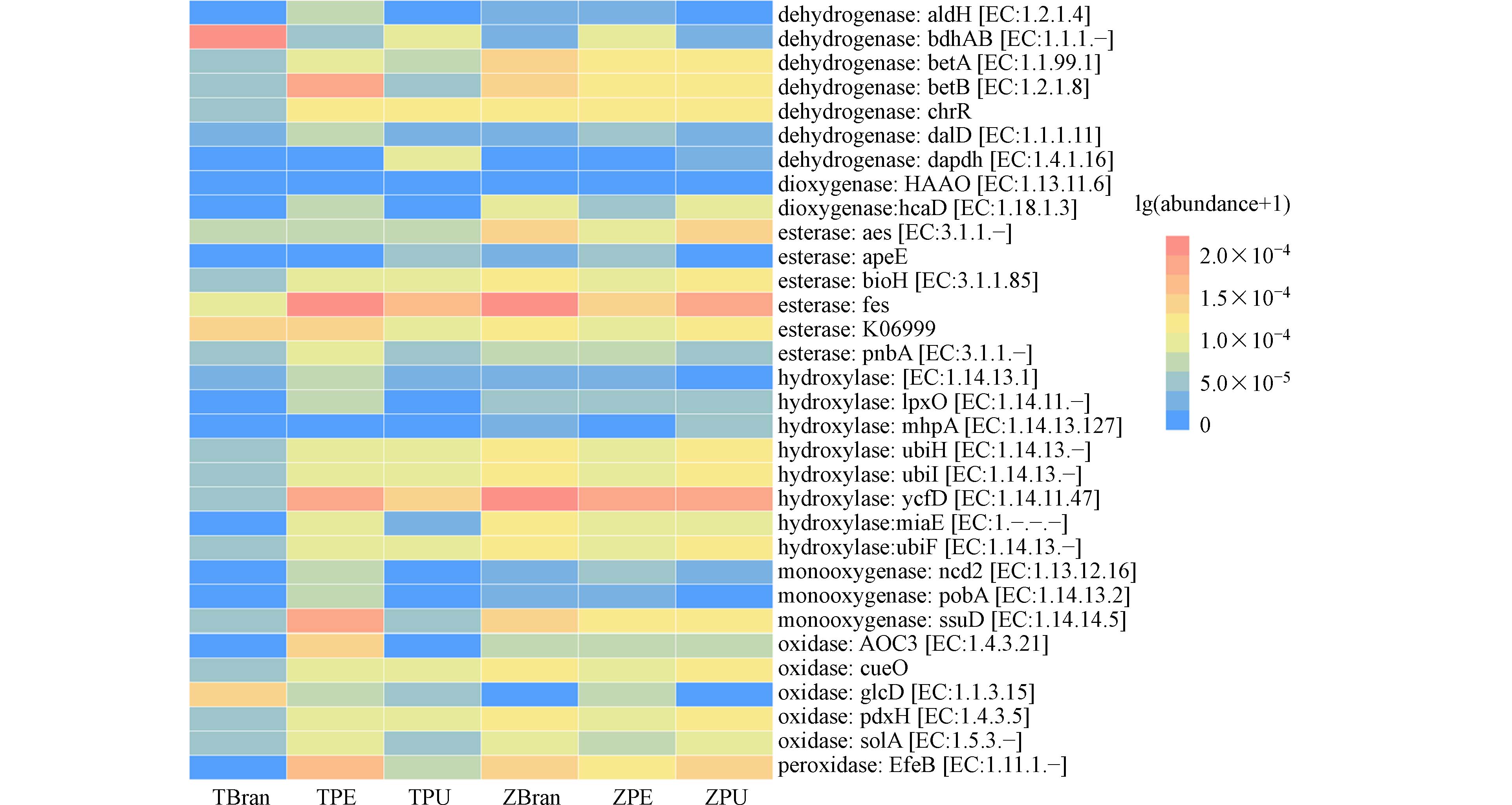
基于PICRUSt2的COG功能基因分析揭示了潜在塑料降解功能酶的差异(图8). 可以发现,大麦虫、黄粉虫取食、降解聚酯类和聚烯烃类塑料后肠道微生物中的脱氢酶、酯酶、羟化酶、单加氧酶、氧化酶、过氧化物酶的表达相比麦麸对照组得到了提升. 从图8中可以推测,脱氢酶betB、酯酶fes、羟化酶ycfD、单加氧酶ssuD、过氧化物酶EfeB等基因和酶在黄粉虫降解PE塑料中起主要的作用. 脱氢酶dalD、酯酶fes、羟化酶ycfD对于黄粉虫降解PU塑料有促进效果. 同样地,脱氢酶betA、betB,酯酶fes,羟化酶ycfD、ubiH、ubiF, 单加氧酶ssuD、pdxH, 过氧化物酶EfeB等基因和酶在大麦虫降解PE、PU塑料中扮演重要的角色. 氧化酶如加氧酶、单加氧酶、过氧化物酶等,通过氧化作用促使复杂的塑料分子氧化并分解为较小的分子或产生可溶解的化合物,促进微塑料的进一步降解[8, 16]. 羟化酶能催化羟基化反应,增加微塑料的亲水性,使底物更易溶于水,更容易被微生物进一步降解代谢[35]. 脱氢酶对于微塑料降解产生的分解产物的微生物代谢也是必不可少的,当微塑料被其他酶分解成更小的有机分子时,脱氢酶负责催化这些分子的氧化,产生还原性辅酶(NADH或NADPH),这些辅酶随后可用于电子传递链产生ATP[36]. 这个过程允许微生物从微塑料的分解产物中获得能量,促进它们的生长和微塑料降解过程. 酯酶可以分解聚合物链上的酯键,从而形成醇和羧酸部分,这些分解产物可以被微生物群落用作营养物,促进环境中塑料的生物降解[37].
从整体可以看出,黄粉虫取食PE、PU泡沫塑料过程中的代谢通路和功能基因如次生代谢物的生物合成、酯酶fes、羟化酶EC:1.14.13.1和ycfD、氧化酶gclD等的相对丰度高于大麦虫,这可能也是黄粉虫对两类塑料的降解程度高于大麦虫的原因. 这些结果说明昆虫取食塑料后大大激发了塑料降解相关的代谢通路并富集了大量塑料降解基因,促进了昆虫对塑料的生物降解.
-
(1) 昆虫对聚酯类塑料PU的降解效率和降解程度高于聚烯烃类塑料PE,大麦虫对塑料的取食效率高于黄粉虫,但黄粉虫对塑料的降解程度高于大麦虫,同时生成的降解产物毒性相对较低;
(2) 昆虫降解PE、PU塑料过程中肠道微生物群落结构产生显著变化,富集了潜在的塑料降解功能菌. Un_Enterobacteriaceae sp., Hafnia-Obesumbacterium sp.和Acinetobacter sp.细菌在PE降解中发挥关键作用,而Morganella sp., un_Lachnospiraceae sp.和Providencia sp.细菌参与了PU的生物降解. 这些潜在功能菌有望用来设计合成菌群协同降解各类塑料,提高塑料生物降解效果;
(3) 昆虫在取食、降解各类塑料过程中,脂肪酸降解、碳合成、氮代谢等外源化合物的生物降解与代谢相关的基因丰度升高,脱氢酶、酯酶、羟化酶、单加氧酶、氧化酶和过氧化物酶等基因和酶在塑料降解过程中起主要的作用. 特别地,脱氢酶betB、单加氧酶ssuD和过氧化物酶EfeB在PE降解中起重要作用,而脱氢酶dapdh、漆酶aes和羟化酶mhpA在PU降解中发挥关键的作用. 差异塑料降解功能菌和酶是造成两种昆虫取食聚烯烃类塑料PE和聚酯类塑料PU降解效率和降解程度差异的关键因子.
本研究为利用昆虫生物降解塑料提供了重要参考,未来可以更深入研究微生物代谢之间的协同作用,更好地了解不同塑料生物降解所涉及的酶系统,这将有助于发展基于合成菌群的废弃塑料绿色微生物修复方法.
昆虫降解聚烯烃和聚酯类塑料特征差异及肠道微生物响应
Differences in the properties of polyolefin and polyester plastics biodegradation by insects and gut microbiome responses
-
摘要: 塑料污染问题日趋严重,昆虫生物降解塑料的潜力为塑料无害化、资源化处理技术的发展提供了新的见解. 然而弃置于环境中的塑料废弃物复杂多样,不同昆虫对不同塑料类型的喜食性、降解效率及对其生长发育指标知之甚少,影响昆虫降解塑料实际工艺中的降解效果. 本研究比较了两种典型昆虫(黄粉虫、大麦虫)对两类典型泡沫塑料包括聚烯烃类塑料聚乙烯 (polyethylene,PE) 和聚酯类塑料聚氨酯 (polyurethane,PU) 的降解效果及生长发育特征差异,结果发现,昆虫对聚酯类塑料的取食效率和降解程度高于聚烯烃塑料,大麦虫的塑料取食效率高于黄粉虫,但黄粉虫对塑料的降解程度高于大麦虫,且其降解产物毒性低于大麦虫;昆虫取食、降解塑料过程中微生物群落发生显著变化,参与PE和PU生物降解的关键微生物种类不同,前者以un_Enterobacteriaceae sp.,Hafnia-Obesumbacterium sp.和Acinetobacter sp.为主,后者以Morganella sp.,un_Lachnospiraceae sp.和Providencia sp.为主; 潜在塑料降解酶得到了富集,脱氢酶betB、单加氧酶ssuD和过氧化物酶EfeB在PE降解中起重要作用,而脱氢酶dapdh、漆酶aes和羟化酶mhpA在PU降解中发挥关键作用. 这些结果为昆虫生物降解塑料工艺发展及废弃塑料的无害化处置提供了重要指导.Abstract: The issue of plastic pollution is becoming increasingly severe, and the potential of insects to biodegrade plastics offers new insights for the development of harmless and resource-efficient plastic waste treatment technologies. However, plastic wastes discarded in the environment are complex and diverse. There is limited knowledge regarding the feeding preferences, degradation efficiency, and impact on growth performance of different insects for various types of plastics, all of which would affect the plastics degradation effectiveness in practical applications involving insects. This study compared the degradation efficiency and growth index of two typical insects (mealworm Tenebrio molitor and superworm Zophobas atratus) on two types of typical foam plastics, i.e., a polyolefin plastic of polyethylene (PE), and a polyester plastic of polyurethane (PU). The results indicated that: (1) Insects exhibited higher feeding efficiency and degradation degree on polyester plastics than polyolefin plastics. Superworms showed higher plastic feeding efficiency than mealworms, while mealworms achieved a higher degradation degree, with their degradation products exhibiting lower toxicity than superworms; (2) Significant changes occurred in the microbial community of insects during the ingestion and degradation of plastics. Key microbial species involved in PE and PU biodegradation were distinct, with un_Enterobacteriaceae sp., Hafnia-Obesumbacterium sp. and Acinetobacter sp. predominating PE degradation, while Morganella sp., un_Lachnospiraceae sp. and Providencia sp. predominating PU degradation; (3) Potential plastic-degrading enzymes were enriched, with dehydrogenase (betB), monooxygenase (ssuD), and peroxidase (EfeB) playing significant roles in PE degradation, while dehydrogenase (dapdh), laccase (aes), and hydroxylase (mhpA) being crucial for PU degradation. These findings provided essential guidance for the development of insect-based plastic biodegradation processes and harmless treatment of plastic wastes.
-
Key words:
- T. molitor larvae /
- Z. atratus larvae /
- plastics degradation /
- gut microbiome /
- function prediction.
-

-
表 1 黄粉虫、大麦虫幼虫取食泡沫塑料后的生长发育情况
Table 1. Growth indexes of T. molitor larvae and Z.atratus larvae after feeding on foam plastics
TBran TPE TPU ZBran ZPE ZPU 化蛹率/% 8.69±2.35 a 0.91±1.01 bc 2.19±1.20 b 0±0 c 0±0 c 0±0 c 存活率/% 64.41±4.91 a 52.04±14.28 a 44.41±19.66 a 96.67±5.77 b 95±5 b 90±10 b 体重增加率/% 81.53±10.09 a 30.39±8.01 b 25.15±9.59 b 9.10±4.10 cd 0.87±11.70 d -2.83±6.98 d 体长增加率/% 15.90±6.67 a 10.58±8.77 ab 3.14±8.99 bc 6.48±4.84 bc 0±0 c 2.78±6.18 bc 体宽增加率/% 20.63±0.05 a 4.22±0.02 bc 1.76±0.02 c 7.87±0.03 b 3.78±0.024 bc 5.06±0.06 bc 注:表中用不同字母 (a, b, c, d) 表示各组间指标具有显著性差异 (ANOVA, P < 0.05) -
[1] CHEN B F, ZHANG Z Y, WANG T Z, et al. Global distribution of marine microplastics and potential for biodegradation[J]. Journal of Hazardous Materials, 2023, 451: 131198. doi: 10.1016/j.jhazmat.2023.131198 [2] ARON S K L L, SAMUEL E M, THOMAS S B, et al. Plastics in the Earth system[J]. Science, 2021, 373: 51-55. doi: 10.1126/science.abb0354 [3] 骆希, 詹佳慧, 张士成. 聚烯烃塑料的氧化降解回收研究进展[J]. 能源环境保护, 2023, 37(1): 194-206. LUO X, ZHAN J H, ZHANG S C. Progress in oxidative degradation and recovery of polyolefin plastics[J]. Energy Environmental Protection, 2023, 37(1): 194-206 (in Chinese).
[4] GEYER R, JAMBECK J R, LAW K L. Production, use, and fate of all plastics ever made[J]. Science Advances, 2017, 3(7): e1700782. doi: 10.1126/sciadv.1700782 [5] THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea: Where is all the plastic?[J]. Science, 2004, 304(5672): 838. doi: 10.1126/science.1094559 [6] 郭鸿钦, 罗丽萍, 杨宇航, 等. 利用昆虫取食降解塑料研究进展[J]. 应用与环境生物学报, 2020, 26(6): 1546-1553. GUO H Q, LUO L P, YANG Y H, et al. Research progress on plastic degradation by worms[J]. Chinese Journal of Applied and Environmental Biology, 2020, 26(6): 1546-1553 (in Chinese).
[7] YANG Y, YANG J, WU W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. chemical and physical characterization and isotopic tests[J]. Environmental Science & Technology, 2015, 49(20): 12080-12086. [8] ZHANG Z, PENG H R, YANG D C, et al. Polyvinyl chloride degradation by a bacterium isolated from the gut of insect larvae[J]. Nature Communications, 2022, 13(1): 5360. doi: 10.1038/s41467-022-32903-y [9] YANG Y, WANG J L, XIA M L. Biodegradation and mineralization of polystyrene by plastic-eating superworms Zophobas atratus[J]. Science of the Total Environment, 2020, 708: 135233. doi: 10.1016/j.scitotenv.2019.135233 [10] YANG S S, DING M Q, HE L, et al. Biodegradation of polypropylene by yellow mealworms (Tenebrio molitor) and superworms (Zophobas atratus) via gut-microbe-dependent depolymerization[J]. Science of the Total Environment, 2021, 756(1): 144087. [11] YANG L, GAO J, LIU Y, et al. Biodegradation of expanded polystyrene and low-density polyethylene foams in larvae of Tenebrio molitor Linnaeus (Coleoptera: Tenebrionidae): Broad versus limited extent depolymerization and microbe-dependence versus independence[J]. Chemosphere, 2021, 262: 127818. doi: 10.1016/j.chemosphere.2020.127818 [12] PENG B Y, CHEN Z B, CHEN J B, et al. Biodegradation of polyvinyl chloride (PVC) in Tenebrio Molitor (Coleoptera: Tenebrionidae) larvae[J]. Environment International, 2020, 145: 106106. doi: 10.1016/j.envint.2020.106106 [13] WANG Y M, LUO L P, LI X, et al. Different plastics ingestion preferences and efficiencies of superworm (Zophobas atratus Fab. ) and yellow mealworm (Tenebrio molitor Linn. ) associated with distinct gut microbiome changes[J]. Science of the Total Environment, 2022, 837: 155719. doi: 10.1016/j.scitotenv.2022.155719 [14] YANG J, YANG Y, WU W M, et al. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms[J]. Environmental Science & Technology, 2014, 48(23): 13776-13784. [15] LUO L P, WANG Y M, GUO H Q, et al. Biodegradation of foam plastics by Zophobas atratus larvae (Coleoptera: Tenebrionidae) associated with changes of gut digestive enzymes activities and microbiome[J]. Chemosphere, 2021, 282: 131006. doi: 10.1016/j.chemosphere.2021.131006 [16] MAMTIMIN T, HAN H W, KHAN A, et al. Gut microbiome of mealworms (Tenebrio molitor Larvae) show similar responses to polystyrene and corn straw diets[J]. Microbiome, 2023, 11(1): 98. doi: 10.1186/s40168-023-01550-w [17] BRANDON A M, GAO S H, TIAN R M, et al. Biodegradation of polyethylene and plastic mixtures in mealworms (larvae of Tenebrio molitor) and effects on the gut microbiome[J]. Environmental Science & Technology, 2018, 52(11): 6526-6533. [18] YANG Y, YANG J, WU W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 2. role of gut microorganisms[J]. Environmental Science & Technology, 2015, 49(20): 12087-12093. [19] HE L, DING J, YANG S S, et al. Molecular-weight-dependent degradation of plastics: Deciphering host-microbiome synergy biodegradation of high-purity polypropylene microplastics by mealworms[J]. Environmental Science & Technology, 2024, 58(15): 6647-6658. [20] MIRAVALLE E, BALBOA S, ZANETTI M, et al. New insights on the degradation of polystyrene and polypropylene by larvae of the superworm Zophobas atratus and gut bacterial consortium enrichments obtained under different culture conditions[J]. Journal of Hazardous Materials, 2024, 478: 135475. doi: 10.1016/j.jhazmat.2024.135475 [21] TAO X Y, OUYANG H R, ZHOU A F, et al. Polyethylene degradation by a Rhodococcous strain isolated from naturally weathered plastic waste enrichment[J]. Environmental Science & Technology, 2023, 57(37): 13901-13911. [22] SHAH Z, HASAN F, KRUMHOLZ L, et al. Degradation of polyester polyurethane by newly isolated Pseudomonas aeruginosa strain MZA-85 and analysis of degradation products by GC–MS[J]. International Biodeterioration & Biodegradation, 2013, 77: 114-122. [23] PFOHL P, BAHL D, RÜCKEL M, et al. Effect of polymer properties on the biodegradation of polyurethane microplastics[J]. Environmental Science & Technology, 2022, 56(23): 16873-16884. [24] LIU Z M, ZHAO J, LU K, et al. Biodegradation of graphene oxide by insects (Tenebrio molitor larvae): Role of the gut microbiome and enzymes[J]. Environmental Science & Technology, 2022, 56(23): 16737-16747. [25] JIN M K, ZHANG Q, ZHAO W L, et al. Fluoroquinolone antibiotics disturb the defense system, gut microbiome, and antibiotic resistance genes of Enchytraeus crypticus[J]. Journal of Hazardous Materials, 2022, 424: 127509. doi: 10.1016/j.jhazmat.2021.127509 [26] JIN M K, ZHANG Q, XU N H, et al. Lipid metabolites as potential regulators of the antibiotic resistome in Tetramorium caespitum[J]. Environmental Science & Technology, 2024, 58(10): 4476-4486. [27] 李昕玥, 刘卓苗, 薛润泽, 等. 典型塑料的生物降解及其降解机理[J]. 科学通报, 2021, 66(20): 2573-2589. doi: 10.1360/TB-2020-1347 LI X Y, LIU Z M, XUE R Z, et al. Biodegradation of typical plastics and its mechanisms[J]. Chinese Science Bulletin, 2021, 66(20): 2573-2589 (in Chinese). doi: 10.1360/TB-2020-1347
[28] LOU Y, LI Y R, LU B Y, et al. Response of the yellow mealworm (Tenebrio molitor) gut microbiome to diet shifts during polystyrene and polyethylene biodegradation[J]. Journal of Hazardous Materials, 2021, 416: 126222. doi: 10.1016/j.jhazmat.2021.126222 [29] ZEENAT, ELAHI A, BUKHARI D A, et al. Plastics degradation by microbes: A sustainable approach[J]. Journal of King Saud University – Science, 2021, 33(6): 101538. doi: 10.1016/j.jksus.2021.101538 [30] DING M Q, YANG S S, DING J, et al. Gut microbiome associating with carbon and nitrogen metabolism during biodegradation of polyethene in Tenebrio larvae with crop residues as co-diets[J]. Environmental Science & Technology, 2023, 57(8): 3031-3041. [31] 赵晶晶, 冯雅郡, 朱潇婷, 等. 石油基塑料的昆虫降解研究进展[J]. 应用化工, 2023, 52(7): 2207-2211,2217. doi: 10.3969/j.issn.1671-3206.2023.07.051 ZHAO J J, FENG Y J, ZHU X T, et al. Review progress of insects feeding and degrading plastics[J]. Applied Chemical Industry, 2023, 52(7): 2207-2211,2217 (in Chinese). doi: 10.3969/j.issn.1671-3206.2023.07.051
[32] LUO H W, LIU C Y, HE D Q, et al. Environmental behaviors of microplastics in aquatic systems: A systematic review on degradation, adsorption, toxicity and biofilm under aging conditions[J]. Journal of Hazardous Materials, 2022, 423: 126915. doi: 10.1016/j.jhazmat.2021.126915 [33] HOU L Y, MAJUMDER E L W. Potential for and distribution of enzymatic biodegradation of polystyrene by environmental microorganisms[J]. Materials(Basel), 2021, 14(3): 503. [34] MEGONIGAL J P, HINES M E, VISSCHER P T. Anaerobic metabolism: Linkages to trace gases and aerobic processes[M]. Biogeochemistry, 2004. [35] TYAGI P, AGATE S, VELEV O D, et al. A critical review of the performance and soil biodegradability profiles of biobased natural and chemically synthesized polymers in industrial applications[J]. Environmental Science & Technology, 2022, 56(4): 2071-2095. [36] RU J K, HUO Y X, YANG Y. Microbial degradation and valorization of plastic wastes[J]. Frontiers in Microbiology, 2020, 11(2020): 442. [37] EDWARDS S, LEÓN-ZAYAS R, DITTER R, et al. Microbial consortia and mixed plastic waste: Pangenomic analysis reveals potential for degradation of multiple plastic types via previously identified PET degrading bacteria[J]. International Journal of Molecular Sciences, 2022, 23(10): 5612. doi: 10.3390/ijms23105612 -



 下载:
下载: