分层式潜流人工湿地水力学特性数值模拟与分析
Numerical simulation and analysis of hydraulic characteristics of layered subsurface flow constructed wetland
-
摘要: 人工湿地水力学特征对其污染物去除过程有重要影响。采用计算流体力学软件FLUENT中的多孔介质模型对分层式潜流人工湿地内部的流场进行模拟,并分析了不同进出口位置对湿地水力学行为的影响。模拟结果表明,分层式潜流人工湿地基质层内部速度分布的差异较大,水流多从进口端的左半部汇入下部砾石层以大于3.69×10-4m/s的速度出流,形成快速出流通道,而出口端的右上部水流速度小于2.58×10-5m/s,出现滞留现象,整个湿地系统的水力效率未得到充分发挥;进水口位于基质层以下使得系统的水力效率进一步下降,而出水口位于基质层中上部则在一定程度上提高了右半部基质层的利用率,降低了下部快速流道的速度,整个系统的水力效率也有所提高。因此,建议将进水口置于湿地基质表层,而将出水口置于基质层的中上部。Abstract: Hydraulic characteristics of constructed wetland have a significant effect on the pollutant removal process. Flow field of a subsurface flow constructed wetland with layered medium was simulated by the model of porous media in FLUENT, a computational fluid dynamic software. Also the influence of inlet and outlet position on hydraulic behavior was analyzed. The results of simulation showed that: most of the fluid flowed into the gravel layer from the left part near the inlet and flow out with a velocity of larger than 3.69×10-4m/s forming a “fastspeed effluent path”. While fluid in the upper right area flowed with a velocity less than 2.58×10-5m/s causing stagnant. The hydraulic efficiency of the system was not used sufficiently. Putting the inlet below medium surface reduced the hydraulic efficiency of the system further. While putting the outlet at the middle-up of the medium improved utilization of medium in right part to a certain extent and reduced the flow rate in the “fast-speed effluent path” thus improved the hydraulic efficiency of the whole system. Consequently, putting inlet at the surface of medium and putting outlet at the middle-upper part of the medium is advised.
-
正渗透(FO)作为膜分离技术的一种,无需外加压力,水分子便能自发的从高水化学势区(原料液侧)通过选择性半透膜向低水化学势区(汲取液侧)传递,而溶质分子和离子被截留在原溶液中[1]。相对于反渗透(RO)、纳滤(NF)、超滤(UF)等其他膜分离技术,正渗透技术具有能耗较低、不易发生膜污染、对污染物截留能力强等特点[2-3],在工业、能源、医药、食品等领域引起了广泛关注,对解决我国水资源短缺问题,提高水质安全保障,具有十分重要的意义。
膜材料是正渗透系统的关键组成部分,在整个分离过程中起着决定性作用。聚酰胺(PA)复合膜(TFC)因具有高机械性、较高的选择性、抗热老化与化学稳定性等优点,近年来成为正渗透膜研究和应用的重点[4-5]。TFC膜是由水相(间苯二胺,MPD)的含胺基官能团与油相(均苯三酰氯,TMC)的含酰氯基团在多孔支撑层表面聚合而成的一种具有非对称特殊结构的正渗透膜[6]。但由于聚酰胺表面层的致密性,在应用中存在水通量低的问题[7]。目前多数的研究旨在提高TFC膜的水通量,然而在提高水通量的同时,也增加了反向盐通量或促进了汲取液中其它溶质渗透至原料液中,难以实现通量与反向盐通量之间的平衡[8]。同时,膜污染是正渗透技术在水处理应用中的另一主要瓶颈,主要包括无机污染、有机污染、生物污染。其中,生物污染主要是由于微生物附着、沉积,以及胞外聚合物(EPS)的分泌,最终在膜表面形成生物膜的过程[9]。生物污染形成过程中产生的EPS黏性基质难以通过传统的物理化学方法清洗,能够造成严重的不可逆污染;同时,生物污染是微生物的动态生长和代谢过程,即使预处理杀灭和消除了99.9%的细菌,残留的少量活性细菌细胞仍能再生形成生物膜,因此较其他污染(无机污染或有机污染)更加难以控制和清除[10-11]。生物污染在膜表面或膜孔内积累,导致跨膜压升高、水通量下降、化学清洗频率增大,从而缩短了膜的使用寿命,增大了运行成本。因此,制备高性能TFC膜,优化水盐渗透的平衡并有效控制生物污染,对于膜技术的发展及应用具有重要意义。
为解决上述问题,在膜表面引入亲水性及抑菌性材料制备改性膜成为近年研究的重要解决方案之一,亲水性及抑菌性材料可以增加水的渗透性、减少盐离子在膜表面的富集从而降低反向盐通量,并抑制微生物活性以控制生物污染[12-13]。纳米材料通常具有较小的尺寸,较大的比表面积,较强的表面与界面效应。另外,部分纳米材料具有较强的抗菌性,使其在信息产业、环境产业、能源环保、生物医药等领域发挥着巨大作用[14-15]。纳米氧化锌(ZnO-NPs)作为常见的纳米材料之一,具有无毒、稳定性好,较强的抗微生物污染性能,在与细菌接触时可破坏细菌细胞膜,阻碍细菌新陈代谢酶的合成,从而使细菌丧失生物活性[16-17]。ZnO-NPs在水和其他亲水性溶剂中易形成巨大的分散体,使其极性表面呈高度亲水状态[18-19]。与大多数纳米材料相比,ZnO-NPs来源广泛,廉价易得,在膜材料制备过程中,将ZnO-NPs作为添加剂,可增加膜的表面体积比、提高亲水性、抑制大孔腔结构的形成,进而增大孔隙率、缓解浓差极化等,使膜水通量明显增大,并且赋予膜抗菌功能,控制生物污染[20]。然而,在实际应用中纳米ZnO-NPs易发生颗粒团聚,造成膜合成过程中分布不均匀,成为其发挥作用的重要障碍[21]。另外,纳米氧化锌的光催化剂带隙较宽,只能在波长较短的紫外区(375 nm左右)被激发[22]。因此,在不符合激发波长或者光照条件不充分的条件下,会使ZnO-NPs的抑菌作用受到限制或无法发挥,不能实现抗生物污染的目的。纳米银(Ag-NPs)对微生物有强烈的抑制和杀灭作用,通过与微生物细胞接触,破坏细胞结构,达到杀菌作用,且不会产生耐药性[23]。但其价格昂贵,在以往的研究及应用中,通常作为掺杂金属,制备复合抗菌材料,用于提高改性材料的抑菌性。有研究[24]表明,将Ag-NPs与ZnO-NPs掺杂制备抑菌材料,不仅克服了Ag系抗菌剂易氧化变黑的缺点,而且Ag-NPs充当表面改性剂可以抑制ZnO-NPs抗菌过程中的电子与空穴的复合,使两者之间呈现协同抗菌效果从而实现更高的抑菌性能。因此,将ZnO-NPs与Ag-NPs相结合探索性应用于TFC-FO膜制备中,对于提高膜性能及抗菌作用具有潜在的效果与研究意义。
因此,针对目前存在的水通量与反向盐通量之间的不平衡问题,以及生物污染问题,本研究利用ZnO-NPs和Ag-NPs的亲水性、抗菌性等特点,将ZnO-NPs与Ag-NPs通过多巴胺多为中间载体负载至TFC膜表面,以提高膜的综合性能和抑菌性能。同时,对氧化锌进行分散性优化处理,提高其在膜上负载过程中的分散性。将纳米ZnO@Ag改性的聚酰胺复合膜进行了电镜分析、红外表征、亲水性和电位测定及水通量、反向盐通量测试,以揭示纳米ZnO-NPs与ZnO@Ag对正渗透膜的结构和性能的影响。同时,采用平板测定法进行改性膜的抗菌性能测试,探究了ZnO-NPs及Ag-NPs纳米材料抑菌性的影响。
1. 材料与方法
1.1 材料
聚砜(PSf, 99%)、NN-二甲基甲酰胺(DMF, 99%)、聚乙二醇600(PEG-600, 96%),纳米ZnO(98%)、硝酸银(AgNO3,98%)、间苯二胺(MPD,99%)、均苯三酰氯(TMC,98%)、正己烷(99%)、氯化钠(NaCl,98%)、琼脂(99.8%)、胰蛋白栋(99.7%),酵母提取物(99.7%),乙醇(C2H6O,99.5%)。
1.2 ZnO的改性
由于ZnO-NPs纳米颗粒分散性较差,因此,在本研究中,ZnO-NPs在负载至膜表面之前,先对其进行改性,以提高其分散性能。以1∶1比例配制200 mL乙醇/水溶液作为分散介质,称取8 g的ZnO-NPs加入到溶液中,加入体积分数为2% 的(3-巯基丙基)三甲氧基硅烷偶联剂[25],保持系统封闭,以避免溶剂挥发,恒温50 ℃条件下搅拌5 h,冷却后进行离心,使固液分离,并用乙醇洗涤3次,洗涤完成后在100 ℃条件下进行干燥、储存、备用。
1.3 ZnO改性的TFC膜材料制备
TFC膜包括聚砜支撑层及聚酰胺活性层,详细的操作步骤如我们以前的研究所示[26]。多巴胺利用自组装的方式,在TFC膜表面合成聚多巴胺层,即将TFC膜浸泡在2 g·L−1的盐酸多巴胺溶液中(pH=8.5),反应2 h后采用去离子水彻底清洗膜表面,此时形成的膜称为PDA/TFC膜。最后将PDA/TFC膜浸泡在ZnO溶液中,在此过程中,利用多巴胺的黏附作用,使纳米氧化锌沉积在膜表面[27],在该条件下制备的膜称ZnO改性的TFC膜(ZnO/TFC膜)。
1.4 ZnO@Ag改性膜制备
将ZnO/TFC膜在100 mL 50 mol·L−1 AgNO3溶液中浸泡24 h,在膜表面的生成Ag-NPs。在此过程中,AgNO3与多巴胺反应,Ag+发生还原反应转化成Ag-NPs,多巴胺上的O-,N-位点通过金属配位作用与Ag结合,从而使其稳定负载在膜表面[28]。反应完成后,用去离子水冲洗3次,在室温下晾干,在该条件下制备的膜称ZnO@Ag共同改性的TFC膜,简称ZnO@Ag/TFC膜。
1.5 膜性能的评价与表征方法
1)水通量及反向盐通量的测定方法。水通量及反向盐通量的测试均在FO错流系统中进行,有效过滤面积为32 cm2 FO系统的工艺流程如图1所示。汲取液和原料液分别为氯化钠溶液(NaCl,2.0 mol·L−1)和去离子水,流速为8 cm·s−1。水通量通过连续计数天平在线监测,计算方法如式(1)所示。反向盐通量为汲取液中的溶质到原料液中的量,计算方法[29]如式(2)所示。
JW=ΔmρAmt (1) Js=VtCt−V0C0Amt (2) 式中:Jw为水通量,L·(m2·h)−1;Am为膜的有效表面积;m2,t为时间间隔,h;Ct为时间t时的盐浓度,g·L−1;Js为反向盐通量,g·(m2·h)−1;Vt为时间t时的进料量,L;V0为初始原料液体积,L;C0为初始盐浓度,g·L−1。
2)多巴胺负载量的计算。ZnO-NPs及Ag-NPs在膜表面的负载是通过多巴胺作为载体,因此,多巴胺负载量对ZnO-NPs、Ag-NPs的负载以及膜整体性能均具有重要作用。多巴胺负载量(采用百万分之一天平进行称量),根据式(3)进行计算。
σ=Mt−M0S (3) 式中:σ为多巴胺负载量,μg·cm−2;M0为负载前膜的质量,μg;Mt为t时间后膜的质量,μg;S为膜面积,cm2。
3)膜的表征。Zeta电位仪(Anton Paar, GmbH,德国)、接触角仪(JC2000D2, 上海众辰数码科技设备有限公司)测定改性前后膜表面电位、亲疏水性的变化。扫描电镜仪(SEM,JEOL JSM-5600,日本)用于观察ZnO-NPs的团聚以及ZnO-NPs及Ag-NPs负载后膜表面的结构变化,在扫描分析之前,样品需涂上金层用以导电利于观察。为进行ZnO-NPs改性前后团聚性的表征,本研究分别将改性前后的ZnO-NPs分别加至去离子水中(5 g·L−1),然后利用超声仪进行超声分散1 h,获得均匀的氧化锌溶液,取等量氧化锌水溶液(30 μL),滴至锡箔纸上,然后进行SEM观察。此外,利用X射线光电子能谱(XPS,ESCSLAB250Xi,英国)对膜表面的化学组成进行表征,以验证ZnO-NPs和Ag-NPs在膜表面是否成功负载。
1.6 膜抗菌性测试
1)菌液的配制。首先配制LB液体培养基:氯化钠(10 g·L−1)、酵母提取物(5 g·L−1)、胰蛋白胨(10 g·L−1),将培养基置于灭菌锅内灭菌,灭菌后制备固体培养基备用。选取大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)2种菌作为模拟菌株(革兰氏阴性菌和阳性菌)用于对照评价改性膜抑菌性能,将适量菌株加入灭菌后的LB培养基中,置于37 ℃的恒温摇床中隔夜培养。利用紫外分光光度计在600 nm条件下测量吸光度,获得1×1012 CFU·L−1的细菌悬浮液,稀释至109 CFU·L−1待用。
2)抗菌实验。无菌条件下,将100 μL 109 CFU·L−1的菌液均匀分散于1 cm2的膜表面,将玻璃片盖在膜面上,确保菌液均匀分散且不易挥发。1 h后,用生理盐水(0.15 mol·L−1 NaCl,pH 7.0,20 mol·L−1 NaHCO3)充分冲洗膜片与玻璃片,收集冲洗液。将冲洗液稀释至103 CFU·L−1,取100 μL稀释的冲洗液涂于LB固体培养基,恒温37 ℃条件下培养24 h,统计培养基上的菌落数A。另需设置空白对照组,即将不与膜接触的稀释后细菌悬浮液涂于固体培养基上,在37 ℃条件下培养24 h后,统计空白实验的菌落数B,每组实验进行3次,取平均值,细菌死亡率利用式(4)计算,用以表征膜的抗菌性能。
R=B−AB×100% (4) 式中:R为细菌死亡率;A为对照实验的菌落数;B为空白实验的菌落数。
2. 结果与讨论
2.1 ZnO-NPs分散性的提高
ZnO-NPs改性前后的水溶液SEM图像如图2所示。ZnO-NPs具有较宽的尺寸分布,分散性较差,由于其表面吸引力强而趋于聚集并形成簇。硅烷偶联剂改性后的ZnO-NPs分散性明显提高,平均粒径为10~40 nm,是由于在水解体系中,硅烷偶联剂水解生成的硅氧负离子进攻极性纳米ZnO-NPs中带有正电荷的原子,发生接枝反应生成二聚体,使反应体系的能量降低、分散性提高。改性后纳米ZnO电位变化曲线(图3)显示ZnO-NPs在水溶液中呈正电性,且随着pH的增大,其正电性有减弱的趋势,主要是基于连续相与附着在ZnO-NPs纳米粒子上的流体稳定层之间的电势差发生变化所致。在pH为7的条件下,ZnO-NPs电位为31.1 mV。
2.2 ZnO及ZnO@Ag在膜表面负载的形态变化
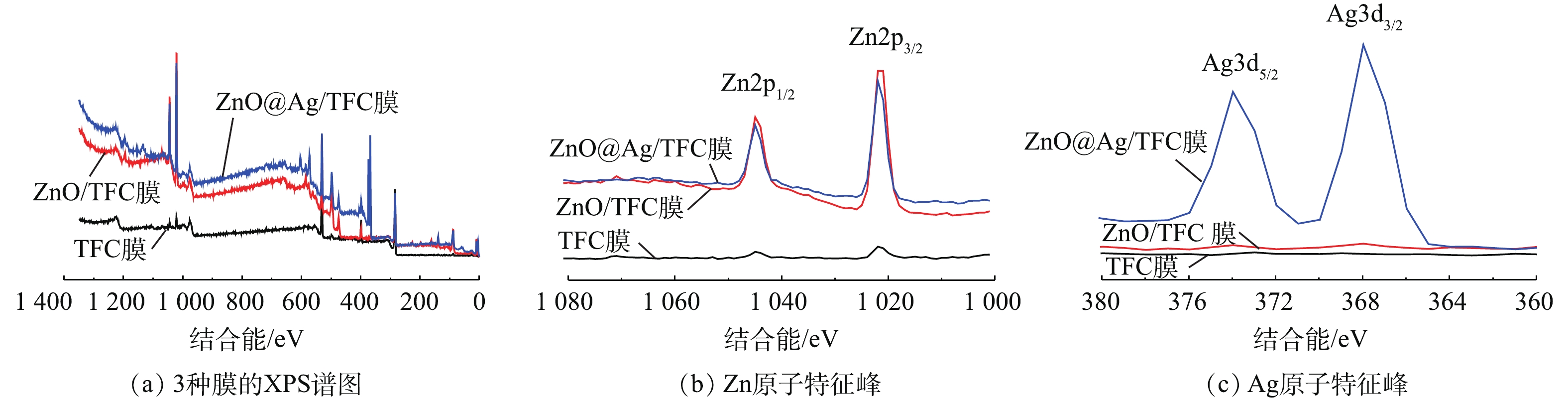
XPS是表征膜表面化学状态和成分的重要工具。ZnO-NPs及ZnO@Ag纳米颗粒改性TFC膜表面的XPS结果如图4所示。光谱显示在286.5、532.6、399.3和162.7 eV处有4个能峰,分别对应于碳(C1s)、氧(O1s)、氮(N1s)和硫(S2p)[16]。ZnO/TFC膜和ZnO@Ag/TFC膜在1 022.4 eV和1 045.6 eV处显示2个特征峰,分别为Zn2p3/2和Zn2p1/2,这一结果验证了ZnO-NPs的成功负载。另外,在ZnO@Ag/TFC膜上观察到结合能为368 eV和374 eV的Ag特征峰,这表明纳米Ag成功负载至膜表面[30-31]。由XPS图谱计算得出的原子含量如表1所示。ZnO/TFC膜中的Zn原子含量约为13.04%,ZnO@Ag/TFC膜中的Zn原子和Ag原子含量分别为10.36%和5.34%。对ZnO/TFC膜和ZnO@Ag/TFC膜2个样品的原子含量占比进行比较发现,在膜表面合成Ag-NPs之后,Zn原子含量有所降低,这是由于Zn原子被Ag原子覆盖,从而导致Zn原子的信号强度削弱。此外,XPS原子占比结果证实了各原子占比之和相加接近100%,这表明在该实验制备条件下,纳米材料改性的TFC膜表面是高纯度的。
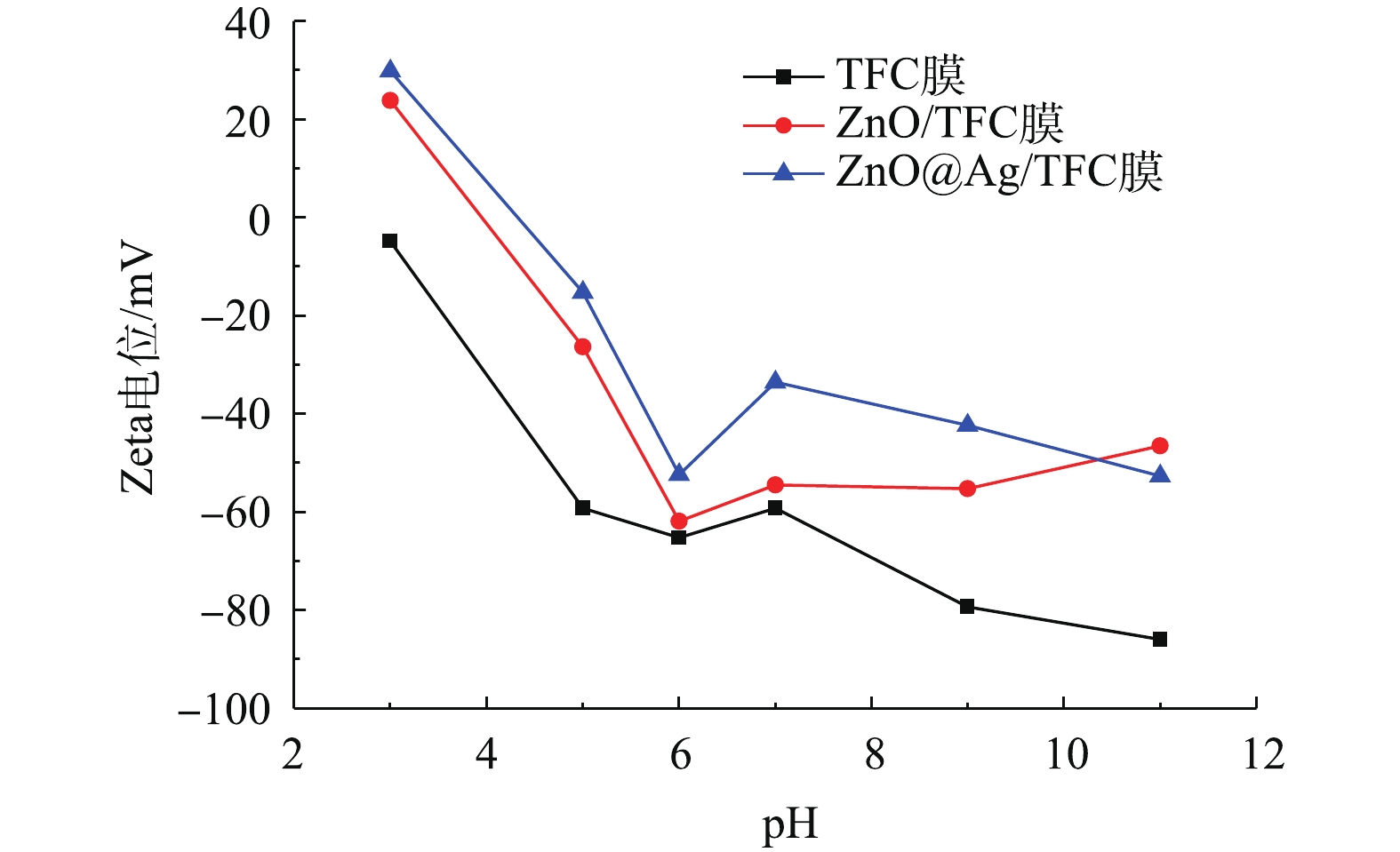
表 1 膜表面原子占比Table 1. Proportion of atoms on the membrane surface% 膜类型 C N O S Zn Ag TFC膜 66.04 10.86 22.78 0.31 — — ZnO/TFC膜 49.27 5.79 28.89 3 13.04 — ZnO@Ag/TFC膜 49.79 9.08 23.83 1.43 10.36 5.34 图5为TFC、ZnO/TFC和ZnO@Ag/TFC膜在不同pH条件下的的Zeta电位测定结果。结果表明,随着pH的增大,3种膜的电负性均呈现增强的趋势。具体来说,原始TFC膜在任意pH条件下均呈电负性,且在pH=7条件下,Zeta电位值为-59.25 mV。ZnO-NPs在膜表面的负载使膜的电负性减弱。这一结果主要是由于ZnO-NPs具有正电荷的性质,这一点由图3中的结果可被证实,在pH=7条件下,膜表面的Zeta电位值为-54.5 mV。当Ag-NPs在膜表面生成后,膜的负电性更低,在pH=7条件下,膜表面的Zeta电位值为-33.57 mV。
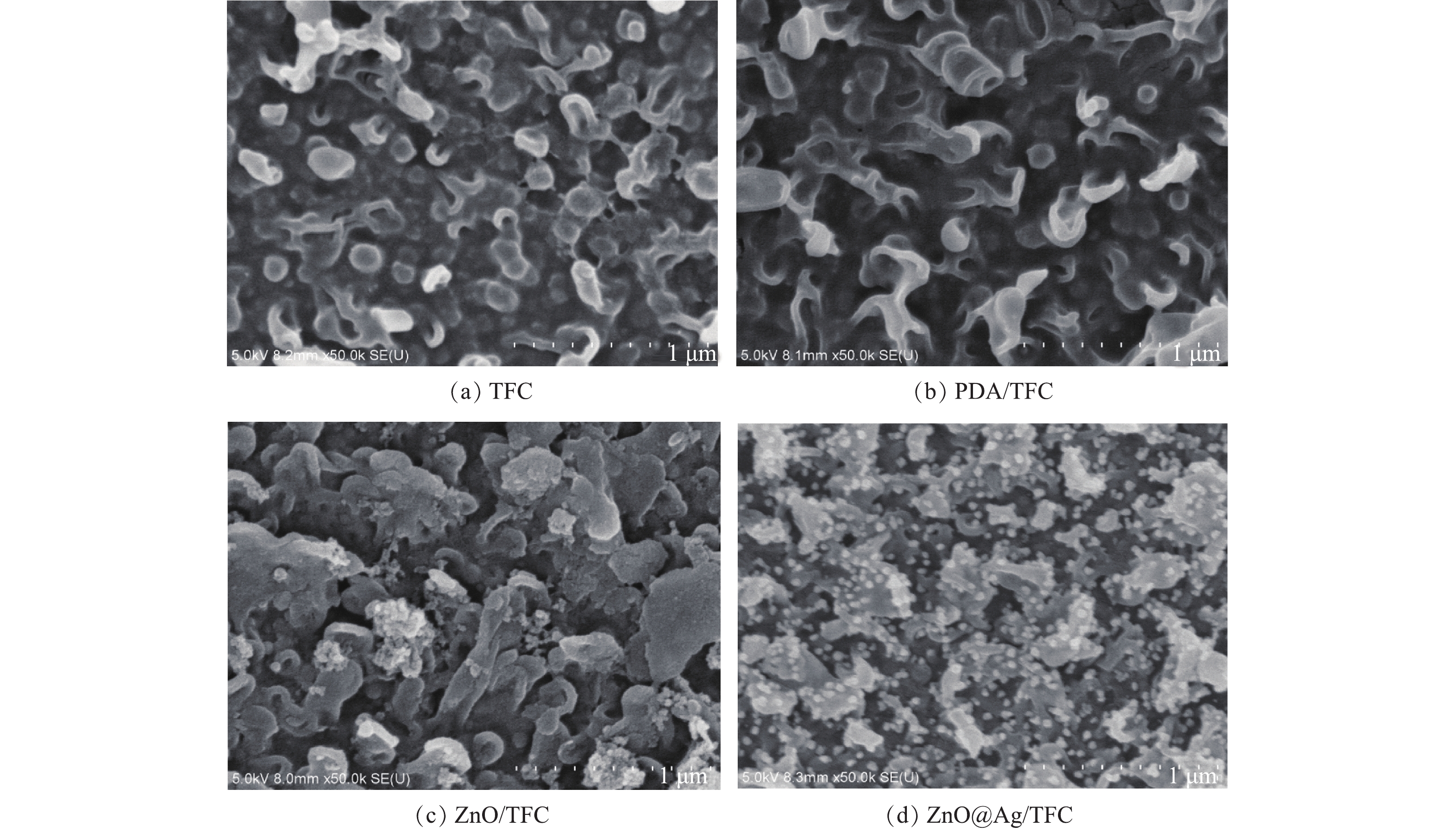
ZnO-NPs及ZnO@Ag在TFC膜上负载后,膜表面的SEM结果如图6所示。初始聚酰胺TFC膜表面呈现特征性的脊和谷结构[27](图6(a))。当多巴胺在膜表面自聚合之后,PDA/TFC膜呈典型的聚多巴胺形貌[32](图6(b))。由图6(c)可见,ZnO-NPs在膜表面的成功负载,主要利用的是多巴胺的黏附作用使ZnO-NPs沉积至PDA/TFC膜表面,从而得到ZnO /TFC膜。由图6(d)可见,在硝酸银在与多巴胺反应后,纳米Ag颗粒释放出来,在膜表面呈现点状结构。上述结果表明ZnO和Ag均已成功负载至膜表面。
与原始TFC膜相比,PDA/TFC膜亲水性显著提高,主要基于PDA较强的亲水性(图7)。纳米ZnO在膜表面的负载,使TFC膜的接触角从65°减小到34°,这说明将ZnO-NPs负载至膜表面能够改善膜的亲水性。这一方面由于高极性的ZnO-NPs在水溶液中与水分子之间形成氢键,在膜表面吸附水分子,亲水性增强;另一方面ZnO-NPs的负载增加了膜表面的表体积比,表面积增大,亲水性提高[33]。ZnO@Ag/TFC膜的接触角为31°,这说明Ag在膜表面的负载对接触角影响不大。
2.3 膜表面多巴胺的优化
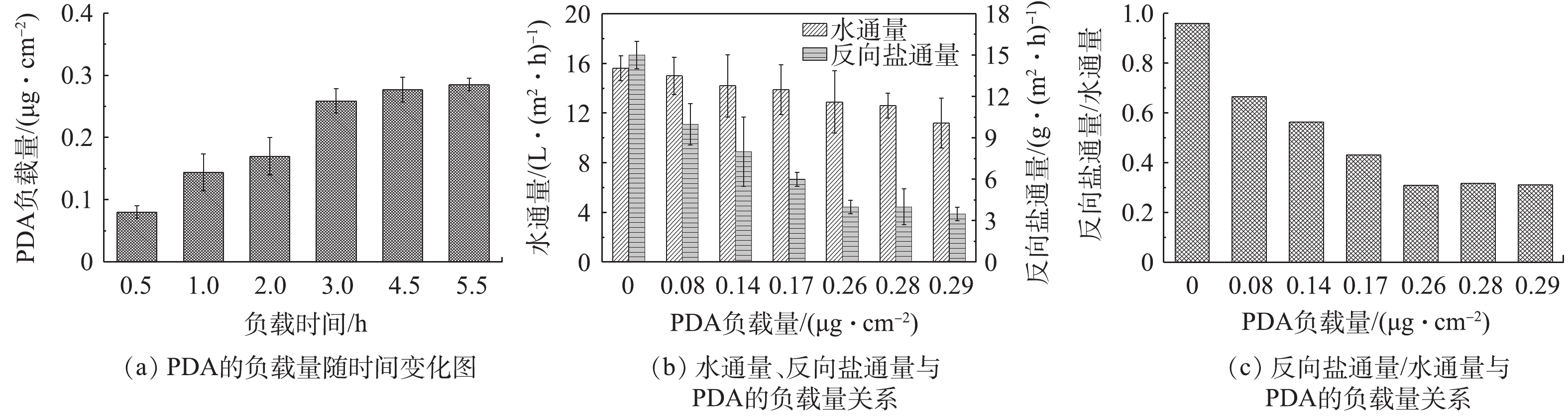
ZnO-NPs及Ag-NPs在TFC膜表面的负载是通过多巴胺作为中间媒介,因此,多巴胺在膜表面的含量对ZnO-NPs、Ag-NPs的负载以及膜性能均具有重要作用。图8显示了多巴胺对水通量及反向盐通量的影响。在最初的3 h中,随着浸泡时间的延长,多巴胺在膜表面的累积量逐渐增加且增速较快,在3 h多巴胺负载量达到0.26 μg·cm−2。而3 h后,多负载量则无显著变化(图8(a)),说明多巴胺负载趋于饱和状态。从多巴胺的负载量与水通量之间的关系图(图8(b))可以看出,随着膜表面多巴胺负载量的增加,水通量(Jw)降低且多巴胺自聚合时间越长,水通量下降的越明显,由初始时的15.6 L·(m2·h)−1降至11.2 L·(m2·h)−1。但总体来看,下降幅度不大,这主要是由于多巴胺可以提升膜表面亲水性,与多巴胺层在膜表面形成的阻碍作用相抵消,从而有利于缓解水通量降低。另外,由图8(c)可见,反向盐通量 Js与膜表面多巴胺的量成反比,主要是由于多巴胺在膜表面形成一层“屏障层”,阻碍了盐的渗透。Js/Jw是衡量FO膜综合性能的重要参数,Js/Jw的值越小,表明膜的性能越好[34-35]。由图8(c)可见,当膜在多巴胺溶液中浸泡3 h,Js/Jw最小,说明此时具有最佳的水盐渗透比,原始TFC膜水通量与反向盐通量之间的不平衡关系得以改善。综上所述,多巴胺的最佳负载量为0.26 μg·cm−2,此时水通量为12.9 L·(m2·h)−1,反向盐通量为4 g·(m2·h)−1。
2.4 ZnO浓度的优化
制备ZnO/TFC膜过程中,通过测定水通量及反向盐通量对ZnO-NPs的浓度进行了优化,以获得ZnO-NPs负载的最佳参数。图9反映了ZnO-NPs在膜表面负载后水通量及反向盐通量的变化。相对于PDA/TFC膜(氧化锌浓度为“0”时),水通量上升,表明ZnO-NPs通过影响膜性能提高了水通量(图9(a))。这一方面是由于ZnO-NPs增加了TFC膜的表面体积比,使水渗透面积增大,另一方面,ZnO-NPs在膜表面形成较强亲水性结构,提高了ZnO-NPs与水的亲和力,从而降低了水力阻力,使膜表面吸附了更多的水分子[36-37]。当ZnO-NPs量高于0.75 g·L−1后,水通量降低,由于过量的ZnO-NPs在膜表面负载堵塞膜孔,导致通透性降低。反向盐通量的结果与水通量变化趋势相似,这说明当水通量较高时,反向盐通量也随之升高,但整体变化幅度不大。通过反向盐通量与水通量的比值结果(图9(b))可以看出,纳米氧化锌在膜表面的负载进一步优化了膜的综合性能,并且当ZnO-NPs的浓度为0.75 g·L−1时,Js/Jw值最小,此时膜性能最佳。
2.5 ZnO@Ag/TFC的性能
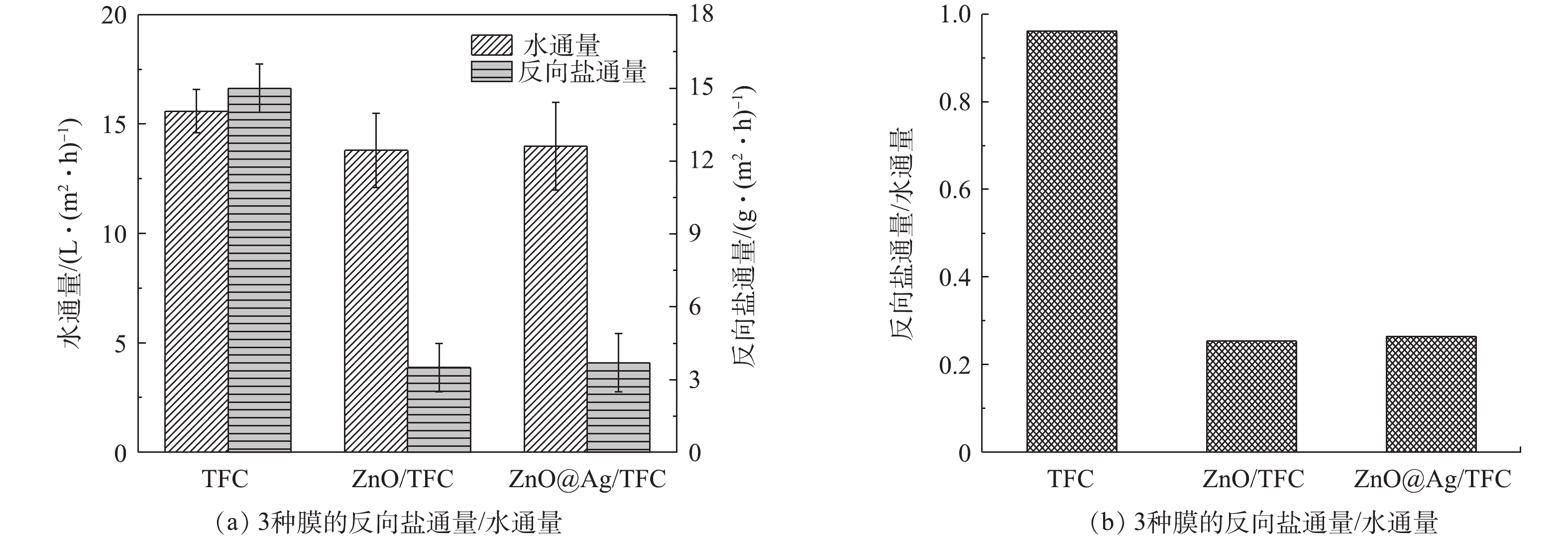
原始TFC膜、ZnO/TFC改性膜及ZnO@Ag/TFC改性膜的水通量及反向盐通量结果如图10所示。其中,初始TFC膜的水通量为15.6 L·(m2·h)−1,ZnO/TFC水通量为13.8 L·(m2·h)−1,说明ZnO-NPs在膜表面负载后通量略有降低,这主要是由于在氧化锌负载之前,多巴胺在膜表面的自聚合对水的渗透起到阻碍作用(图8)。TFC膜的反向盐通量为15 g·(m2·h)−1,ZnO/TFC膜为3.5 g·(m2·h)−1,这表明改性后膜的盐通量显著降低。这主要是由于膜表面亲水性增强,其对盐离子的渗透抵抗力变大。ZnO@Ag/TFC膜的通量和反向盐通量分别为14 L·(m2·h)−1和3.7 g·(m2·h)−1,与ZnO/TFC膜相比,Ag的负载对膜性能没有明显影响。ZnO/TFC膜和ZnO@Ag/TFC膜的Js/Jw分别为0.25和0.26(图10),比原始膜(0.96)大大降低,这说明改性后膜的综合性能明显增强,显著优化了水通量与反向盐通量之间的平衡。
2.6 膜的抑菌性测试
采用平板计数法测试了ZnO-NPs和ZnO@Ag-NPs修饰的TFC-FO膜对革兰氏阴性菌(大肠杆菌)和革兰氏阳性菌(金黄色葡萄球菌)的抗菌性能。图11为2种细菌在3种不同类型的膜上存活率的结果,结果表明,与具有较高存活率的空白TFC膜相比,ZnO-NPs改性膜上的大肠杆菌存活率减少了40%(图11),金黄色葡萄球菌的存活率降低了51%,证实了ZnO-NPs的抑菌作用。在此过程中,氧化锌的抗菌机制归因于ZnO-NPs表面原子缺少邻近的配位原子,从而具有很高的能量,使ZnO-NPs与细菌之间具有较强的亲和力,与细菌细胞壁直接接触时,导致细菌细胞完整性破坏。Zn²+与细菌体内蛋白的疏基结合,从而可以抑制其活性[17, 38]。同时,纳米氧化锌经过硅烷偶联剂的改性,有效减少了锌离子的溶出量,一定程度上促进了ZnO的抗菌作用[39]。与对照样品相比,ZnO@Ag改性膜上,大肠杆菌和金黄色葡萄球菌的存活率分别减少了84%和91%(图11),表明Ag-NPs的负载使FO膜对2种菌表现出显著的抑菌性能,除了Ag自身较强的抗菌作用外,2种纳米材料的协同作用也增强了表面抗菌效果:Ag可以充当改性剂,抑制ZnO-NPs电子与空穴的复合,而且Ag-NPs会与ZnO-NPs电子结合,进一步提高抑菌性能[23]。另外,由图6可知,细小的银在氧化锌改性的膜表面密集分布,增加了膜表面积,为细菌细胞与膜表面之间的直接接触提供了更大的概率,因此,可显著降低2种细菌的存活率。相对于大肠杆菌,2种改性膜对金黄色葡萄球菌的抑菌作用更强,这主要是由于革兰氏阳性菌和阴性菌细胞壁结构差异,导致革兰氏阳性菌对纳米氧化锌更为敏感,金黄色葡萄球菌的细胞壁较厚,主要由肽聚糖二磷壁酸和脂磷壁酸组成,而大肠杆菌的细胞壁不仅具有脂多糖和肽聚糖薄层,其表面还覆盖一层外膜,该膜作为阻渗层能够有效减轻活性氧自由基对细胞的破坏[40]。另外,纳米氧化锌对细菌毒性的强弱还可能与细菌菌膜的极性相关。有研究[41]证实,革兰氏阳性菌细胞膜较阴性菌带更多的正电荷,因此带负电荷的自由基更易穿透带更多正电荷的革兰阳性菌菌膜,从而对革兰阳性菌造成更大的损伤。
3. 结论
1)利用硅烷偶联剂改善了ZnO-NPs的分散性,改性后ZnO-NPs的平均粒径为10~40 nm,归因于硅烷偶联剂与ZnO-NPs发生接枝反应,使反应体系的能量降低、分散性提高。
2)通过多巴胺作为中间载体将ZnO-NPs及Ag-NPs成功负载至TFC正渗透膜上,最佳制膜条件为:多巴胺负载量为0.26 μg·cm−2,ZnO-NPs的浓度为0.75 g·L−1,在此条件下的Js/Jw为0.25,ZnO/TFC膜显著改善了传统膜水通量与反向盐通量的平衡关系。
3) Ag-NPs的负载显著提高了TFC膜的抑菌性,对大肠杆菌和金黄色葡萄球菌的的抑菌性分别达84%和91%。抗菌效果显著。
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2493
- HTML全文浏览数: 1096
- PDF下载数: 1079
- 施引文献: 0






 下载:
下载: