-
近年来,我国一些发达地区的村落建设了分散式农村污水处理设施,并取得了较好的环境效益,但这些村落污水的治理,仍以COD、氨氮、总磷等污染物的降解为考核目标,而农村居民生活水平和医疗条件在不断提高,村落水环境中EDCs浓度水平也相应增加,其对水环境生态和人类健康危害日益严重[1],尤其是农村地区,EDCs通过灌溉形式,直接被稻、麦、瓜果等农作物吸收,进而进入食物链。EDCs是一种能扰乱生物体新陈代谢平衡的化学物质,主要分为天然产生(E1、E2、E3)及人工合成(EE2)[2]。据报道,各种环境基质中均检测到不同浓度的EDCs,水体中其质量浓度可低至10−6(1 μg·L−1)量级和10−9(1 ng·L−1)量级,而EDCs在极低浓度下就可引起水生生物的生殖发育障碍[3-4]。主要原因在于,EDCs与生物体内的雌激素受体结合而干扰生物内分泌系统正常代谢[5]。Legler等[6]研究发现,当自然水体中E2浓度达到1.0 ng·L−1时,可引起生物体内分泌紊乱。Cappiello等[7]发现不少猝死婴儿体内残留的EDCs含量相对普通新生婴儿较高;Clarke等[8]研究表明,妊娠期女性若接触过量EE2,则将増加母女患乳腺癌的风险。由此可见,当EDCs进入动物食物链,再经过层层传递,最终在人类体内积累,对人体健康损害威胁相应不断增大。
国内外众多学者研究表明,耕作型稻田复合生态系统通过“微生物-稻田湿地”耦合的复合系统对村落污水中的有机污染物进行生物降解,其主要依靠水稻复杂的根系及其附着的生物膜协同净化作用,不但可以达到净化村落污水的效果,还可以产生水稻增肥的效益[9]。但存在类固醇类激素(EDCs)环境污染及生态危害问题。现阶段,人为去除环境中雌激素类污染物主要通过吸附[10]、光催化氧化[11]、生物降解[12]的3种途径使EDCs在环境中迁移、降解。阳春等[10]研究表明,污泥对雌激素的吸附主要来自于污泥中的活性成分,而被生物表面所吸附的雌激素才能被生物降解。光解与氧化作用是EDCs真正的分解过程,因为它不可逆的改变了分子结构,强烈影响其在环境中的归趋,但光降解类固醇雌激素极易受pH的影响,近期有一些研究表明类固醇雌激素光氧化降解后产生的代谢产物仍具有雌激素活性[11]。生物降解通过微生物新陈代谢和自身与周围环境进行物质交换,达到将污染物去除或转化为无害无毒的物质[12],日益受到人们的重视。
本文针对村落污水中的类固醇类激素(EDCs)环境污染及生态危害问题,构建耕作型稻田湿地[13],并以本课题组筛选的农药降解菌HD为EDCs生物强化降解菌[14],考察其对EDCs的降解效能,以期为村落水环境中的EDCs降解机制及环境生态影响评价提供参考。
-
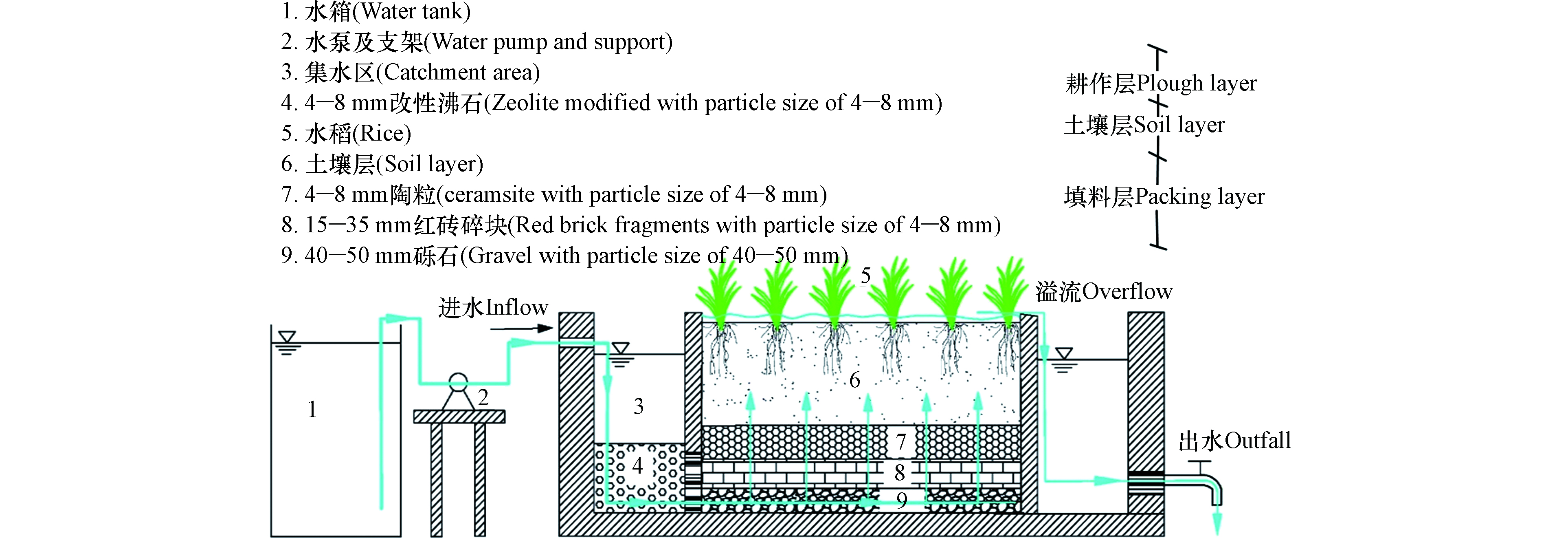
耕作型稻田湿地试验装置分2组,A组为空白对照组,B组为HD菌剂强化组。试验装置如图1所示,整个耕作型稻田湿地装置采用PP板(L×B×H=1 m×0.4 m×0.65 m),由集水区、湿地处理区和出水区3部分所组成,集水区沸石[15]层厚度200 mm,湿地填料层厚度300 mm,自下而上由40—50 mm砾石、15—35 mm红砖碎块、4—8 mm陶粒组成,孔隙率约30.8%;试验进水通过恒流水泵抽入集水区,经集水区的沸石层有效拦截后,再进入稻田湿地。装置内的土壤,取自常州洛阳镇薛家河周边稻田表层15—20 cm处土壤,所取土壤为该地区连年种植水稻土,装置内土壤层厚度为20 cm。耕作层厚度10 cm。水稻秧苗取自常州市洛阳镇薛家河周边水稻田中,种植密度为45株·m−2。
菌剂投加:A、B二组均采用自然进水法生物膜培养,当镜检可见填料上有褐色生物膜和原生动物及COD降解率超过60%时,认为生物挂膜成功。此时在B组中投加HD菌剂,配制100 mL的基础液体培养基(氯化钠:0.5 g,七水合硫酸镁:0.5 g,七水合硫酸亚铁:0.002 g,硫酸铵:1.5 g,氯化钙:0.04 g,磷酸氢二钾:1.5 g,磷酸二氢钾:1.5 g,蒸馏水:1 L,琼脂粉:20 g,pH:7.2—7.4),按照体积分数2.5%的比例接入菌种HD,培养48 h,将菌液混合后,再按照1%的投加比例混入进水中,随进水进入B组耕作型稻田湿地系统,连续投加2周,进行菌剂强化挂膜。A组不投菌,在正常条件下进行生物挂膜,为试验对照组。
农药降解菌HD筛选自南京某废弃农药厂的土壤中,是一株具有降解2,4-二氯苯酚能力的菌,现保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:CGMCC No. 15123。经理化特性和分子鉴定判断属于摩式假单胞菌属(Pseudomonas mosselii)。
试验进水水质如表1所示。在生活污水的基础上添加少量内分泌干扰物,模拟进水内分泌干扰物浓度波动,如表2所示。
-
-
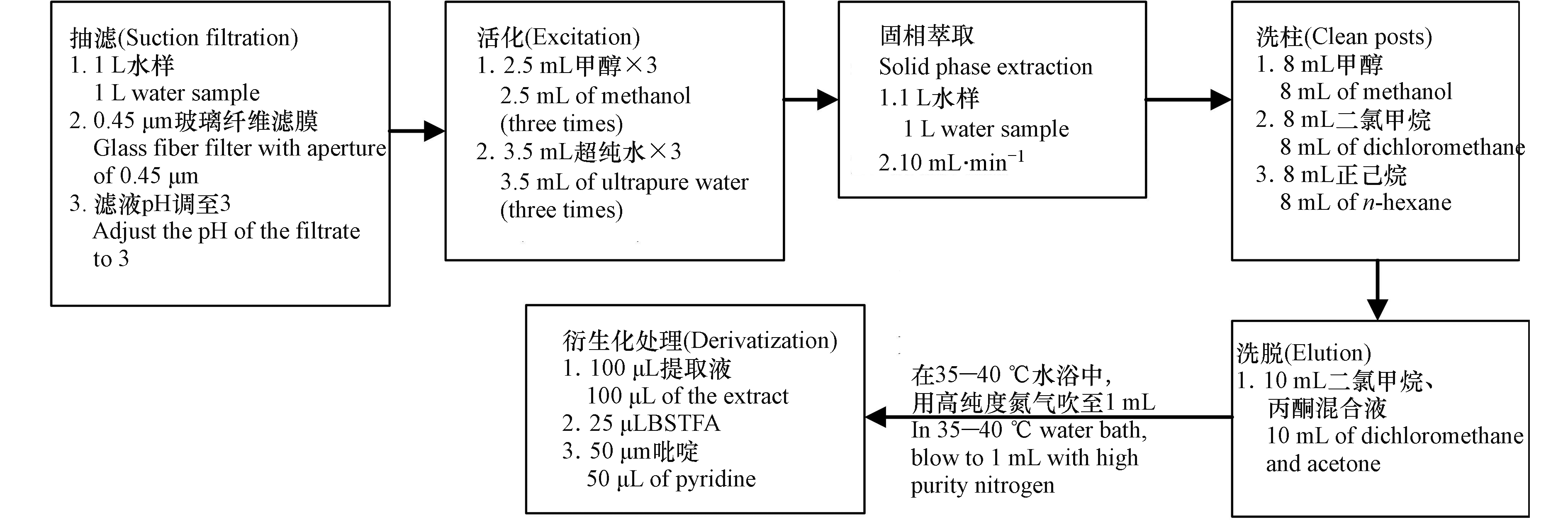
采集1 L水样,GF/F(0.45 μm)滤膜抽滤,滤液用99%的浓硫酸调节至pH3以下。
固相萃取:利用Simon Acti-Carb SPE柱进行固相萃取,首先活化SPE,分别加入2.5 mL甲醇3次,3.5 mL超纯水3次,控制流速在10 mL min−1,进行萃取,待水样萃取完,再分别加入8 mL甲醇、8 mL二氯甲烷、8 mL正己烷进行洗柱,最后用10 mL的二氯甲烷和丙酮的混合溶液淋洗,收集淋洗液,在35—40 ℃的水浴中,用高纯度氮气吹至1 mL,放入冰箱待用,具体步骤见图2。
-
稻田土壤采集后,自然风干,去除杂石杂草,用球磨机在400 r·min−1的条件下充分研磨,过20目筛网,混匀后放入冰箱待用。预处理时,称取1 g的样品,放入10 mL的离心管中,加入5 mL溶剂(甲醇∶丙酮=1∶1),超声波萃取10 min,随后以5000 r·min−1转速离心10 min,收集上清液至25 mL离心管中。重复以上步骤2次,合并上清液后,经高纯度氮气吹至1 mL后,定容至20 mL。最后按照图2水样预处理的方法,进行固相萃取。
-
环境中类固醇类EDCs的含量相对较低,且由于这类化学物质都含有—OH官能团,极性较强,若直接采用气质联用测定,在测定过程中容易被色谱柱所吸附,从而造成实测浓度小于实际浓度,因此为降低该类物质的极性,提高其热稳定性,增加了衍生化步骤,即在正常衍生化的步骤中,又增添了吡啶,可以有效降低EE2的衍生产物转变为E1的衍生产物。黄成等[16]对某制药厂污水样品中E1、E2、E3和EE2衍生化后使用气相色谱/质谱法(GC-MS)分析表明,4种目标化合物的加标回收率达到(94.0%±2.9%)—(101.0%±3.8%),说明GC-MS法可应用于污水中雌激素化合物定量检测。
衍生化方法是在1.5 mL色谱进样瓶中加入100 μL的混合标液,通入高纯度氮气将其缓慢吹干,接着在进样瓶中加入25 μL BSTFA和50 μL吡啶,待其反应一定时间后吹干,最后加入V(二氯甲烷)∶V(正己烷)=1∶4的进样溶剂和10 μL 0.01 g·L−1的内标,取1 μL注入GC-MS分析,在空白污水样品中添加100,300、500 ng·L−1 等3个浓度水平的目标物,测定回收率。衍生化的具体反映结构变化如下:

-
试验中E1、E2、EE2、E3选用气质联用进行测定,色谱柱为TG-5MS(30 m×0.25 mm×0.25 μm),气相条件如下:
GC:以氦气为载气,流速1 mL·min−1;不分流方式进样,进样口温度280 ℃,进样体积1 μL;柱初始温度为50 ℃,保持2 min,以12 ℃·min−1程序升温至260 ℃,保持8 min,再以3 ℃·min−1升温至280 ℃,保持5 min;
MS:接口温度280 ℃,传输线温度300 ℃,离子源为EI源,温度250 ℃,电子轰击能量70 eV,溶剂延迟时间12 min,以全扫描模式定性,扫描范围50—600 m/z,以选择离子扫描模式定量;
根据其衍生产物的特征碎片离子分布特征来确定目标产物的实际浓度,衍生产物实际参数如表5所示。
-
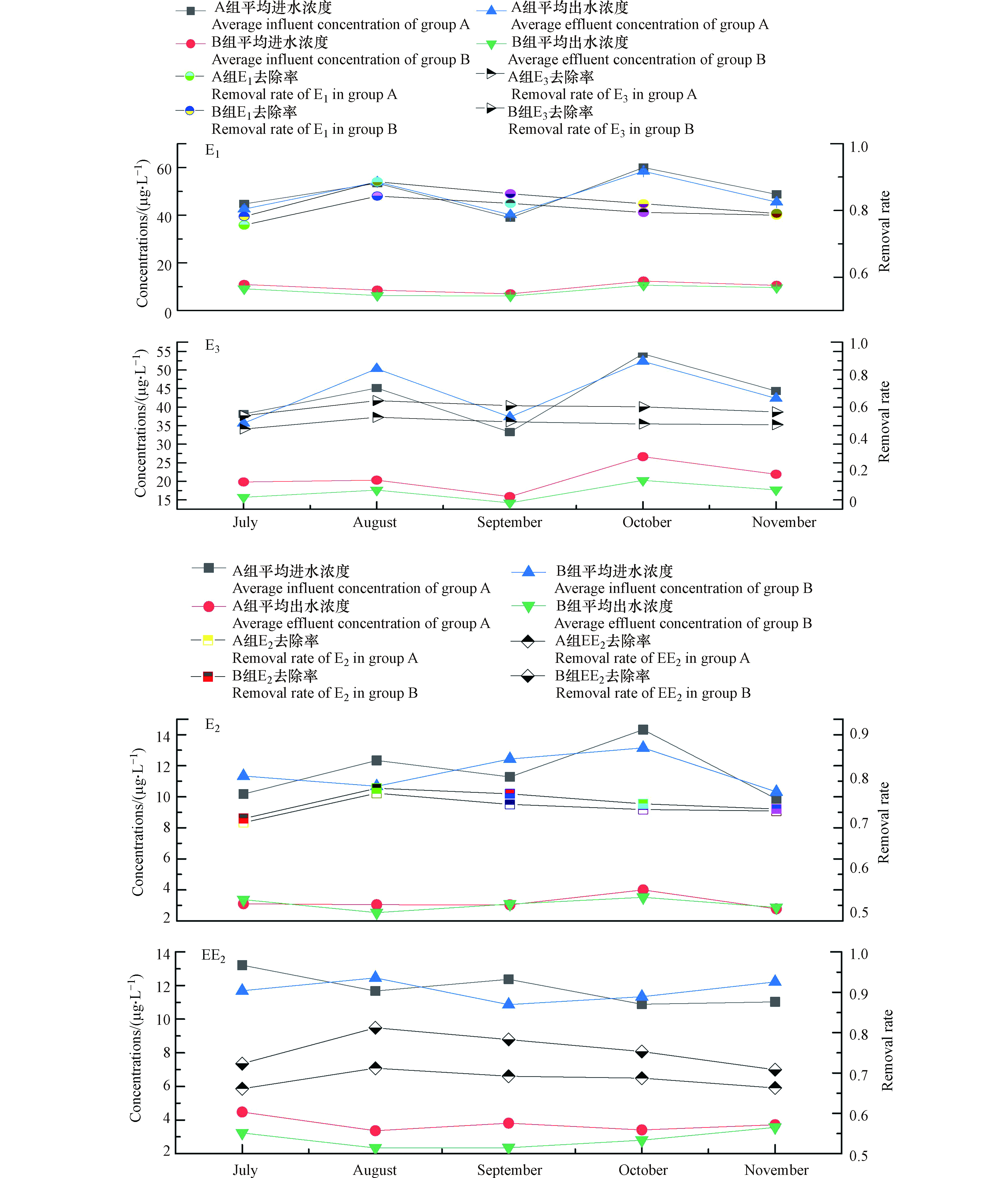
图3是2018年7月至11月,水稻生长过程中,耕作型稻田湿地对EDCs中E1、E2、EE2、E3的去除效果图。从图3可以看出,生活污水中EDCs通过耕作型稻田湿地吸附降解后,A组的E1、E2、EE2、E3的平均去除率为80.1%、72.4%、68.3%、51.4%,B组的平均去除率为82.6%、73.4%、75.6%、60.5%,除了E3外,其余各目标污染物的去除率均在65%以上,Baronti[17]在试验过程中发现E2在生物降解过程中,一部分的E2较易氧化转化成E1,遵循典型的醇氧化为酮原则,而E1通过水和作用又转化为E3,随着中间产物的不断产生,进而导致了出水E3浓度偏高。B组投加HD菌后,可能是假单胞菌HD诱导产生了羟基酶[18],相比A组E1、E2去除率未发生明显变化,EE2和E3去除率增高7%—9%,Huang等[19]发现,在BPA(双酚A)降解的河流底泥中,假单胞菌和鞘单胞菌占据了原有细菌群落的73%,由此可见,向湿地中投加假单胞菌HD有助于提高EDCs的去除率。
湿地经过5个月的连续运行后,投菌组B中的EDCs残留量明显低于未投菌组A。由图3中的实测数据,经计算B组湿地出水中E1、E2、E3和EE2含量相比A组分别降低约26.6%、17.1%、30.3%、13.3%。试验时间跨秋夏两季,夏季EDCs的去除效果要明显优于秋季,这主要是因为夏季正值水稻生长期,水稻根系对EDCs有一定吸收作用,夏季温度较高,微生物活性较强,微生物新陈代谢较为旺盛,运行至秋季时,温度降低,水稻收割,微生物活性逐渐降低,EDCs的降解率并未大幅下降,说明人工湿地中填料层及土壤层对EDCs的去除起到了一定作用。
-
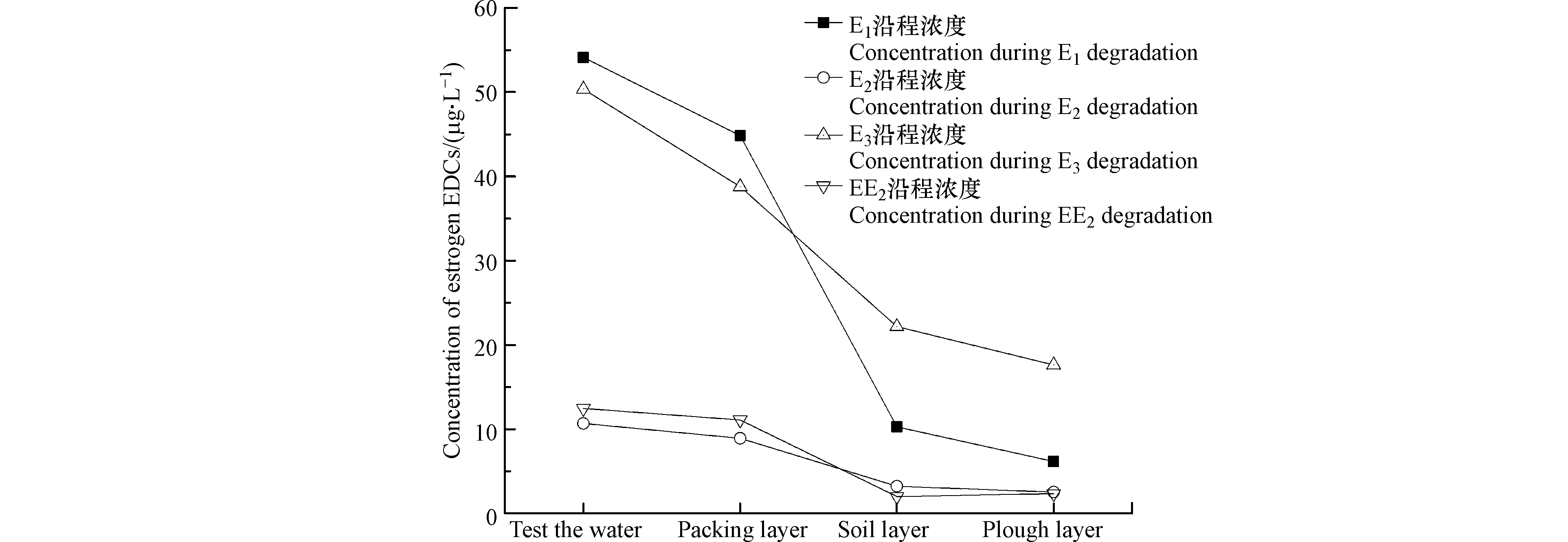
图4为耕作型稻田湿地经HD菌剂强化后EDCs浓度变化趋势图,沿程对E1、E2、E3和EE2的总去除率分别为88.6%、76.3%、64.8%和81.2%。3个生物单元填料层、土壤层、耕作层对E1去除率分别为16.2%、75.1%、28.2%,对E2去除率分别为14.5%、61.8%、18.7%,对E3去除率分别为20.6%、49.8%、10.4%,对EE2去除率分别为8.9%、43.4%、-8.1%,显然土壤层对EDCs的去除贡献占比相对最大,主要是因为土壤中微生物种群丰度要远高于填料层孔隙中生物膜上的微生物种群丰度,同时,土壤中还有分布广泛的水稻根系,通过其根系的泌氧作用,刺激微生物活性,促进微生物新陈代谢,进而加强了微生物降解能力,而填料层的填料作为微生物的代谢场所[20],其主要作用有二:一是直接吸附EDCs,二是作为微生物的载体,在其表面形成微生物集聚(生物膜),为生物膜微生物吸附、吸收、降解EDCs提供平台。其中E1、E2、E3的降解沿程越往后,目标污染物浓度越低,但EE2在经过土壤层的降解后,其浓度却略有提升,一方面,据Ascenzo等[21]研究显示,EE2的生物降解只发生在好氧段,因为EE2拥有乙炔基,从空间结构上来看,这对基团基质和受体的结合有阻碍作用,使得酶活性表达受阻,且在厌氧阶段,会使其由结合态变为游离态,导致EE2不易被降解,另一方面,Li等[22]研究发现,EE2在厌氧条件下更有利用吸附,耕作层分布有植物根系,植物根系的泌氧作用使得填料层吸附作用相比土壤层较弱。同时在降解过程中E3的含量在进水时略低于E1,但随着沿程越往后E3出水浓度高于E1,因为E2在生物降解过程中,一部分的E2较易氧化转化成E1,而E1通过水和作用又转化为E3,随着中间产物的不断产生,进而导致出水E3浓度偏高。
-
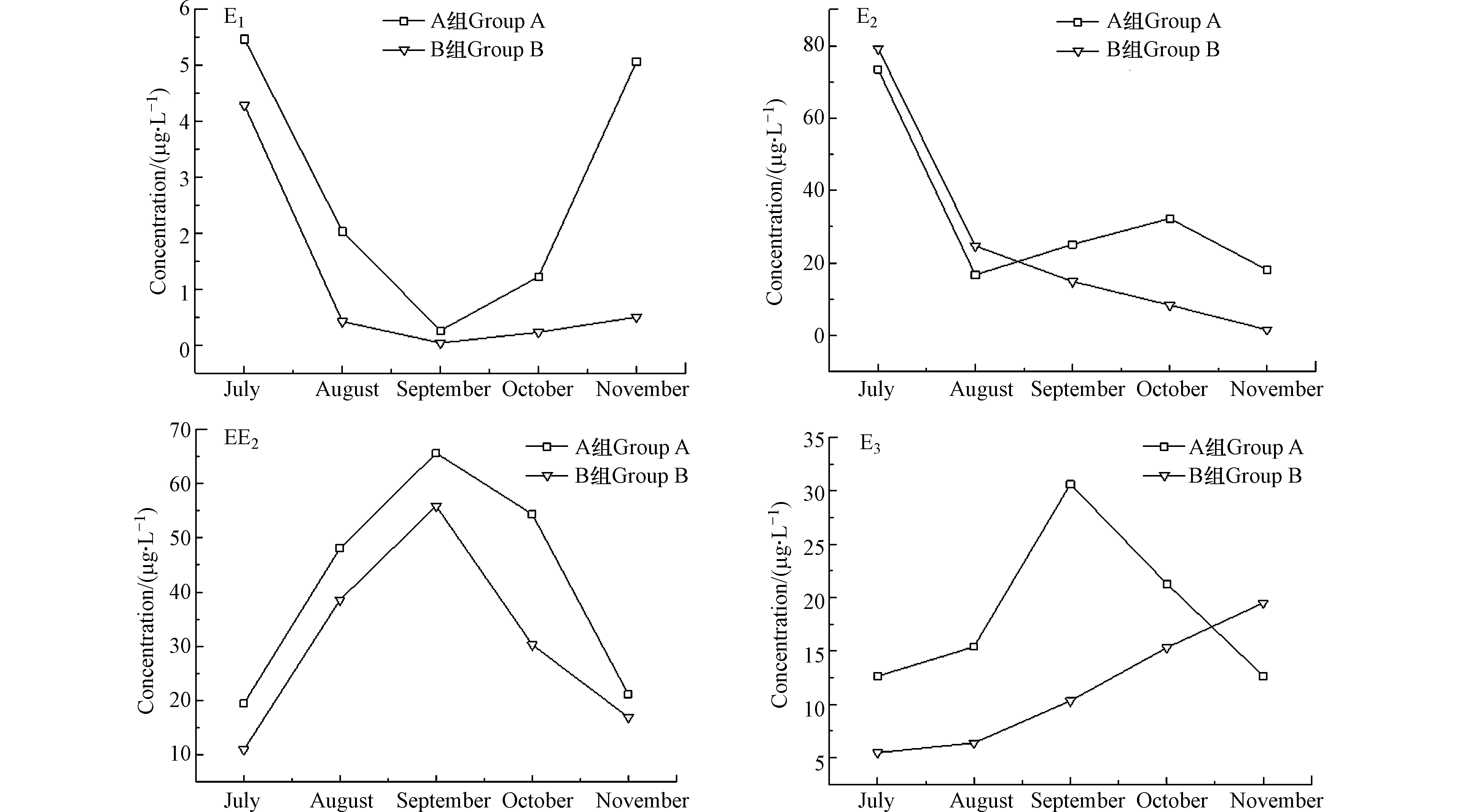
类固醇类EDCs多半有亲脂疏水的特性,易被土壤所吸附,一般类固醇类EDCs在环境中的半衰期为5—25 d不等,土壤中残留的EDCs会在一定时期,通过迁移、浸出到水体中,所以稻田湿地水体中EDCs含量通常偏高[23]。图5反应了耕作型稻田湿地净化过程中,土壤中残留EDCs含量的变化趋势,可看出投菌组B中E1、E2、EE2残留量明显小于A组,可见稻田湿地微生物对EDCs进行生物降解时,反硝化假单胞菌[24]使得反硝化细菌种群丰度提升,有利于E1的生物降解,说明HD菌促进了土壤层中羟基酶的产生,提高了其对EDCs的去除效率。从图5可看出,EE2浓度是先增后减,可能是由于EE2较为稳定不易降解。Ternes等[25]研究EE2的生物降解特性,发现1 mg·L−1的EE2经24 h后几乎无降解。10月水稻收割后,新种植了水芹,据Schroeder等[26]研究发现水芹在24 h内便能通过茎部富集近0.9 ng·L−1的EE2,所以后期EE2浓度又显下降趋势。B组中E3浓度一直呈上升趋势,任海燕等[27]研究发现,对EE2降解中间产物进行质谱分析推测,EE2在降解过程中首先被氧化为E1,后经过一系列生物催化作用生成2-羟基-2,4-二烯-戊酸和2-羟基-2,4-二烯-1,6-己二酸两种中间代谢产物,E1通过水合作转化为E3,又E2在生物降解过程中部分较易被氧化转化为E1,E1通过水合作用又转化为E3,故而导致土壤中E3浓度不断增高。湿地运行初期E1、E2浓度分别增加了85%、25%,EE2、E3浓度下降了60%、30%,这主要是因为生活污水中EDCs的构成主要以天然雌激素中的E1、E2为主,且其主要为结合态形式,极性更强,更易被土壤所吸收[28],且溶解性有机物的共轭物在经细菌酶分解时,亦会产生E1的衍生产物[29],进而导致E1浓度提高。虽然土壤层对于EDCs的降解效果较好,但初期由于土壤中生物种群尚未稳定,所以导致E1、E2的处理效果受限。
-
(1)未投菌的A组对雌酮(E1)、雌二醇(E2)、雌三醇(E3)及17α-乙炔基雌二醇(EE2)的平均去除率分别为80.1%、72.4%、51.4%、68.3%,投加HD菌剂强化的B组平均去除率分别为82.6%、73.4%、60.5%、75.6%,A、B两组耕作型稻田湿地对E3去除率相比E1、E2、EE2最低。E2在生物降解过程中较易氧化转化成E1,而E1通过水和作用又转化为E3,随着中间产物的不断产生,出水E3浓度增大。A、B两组耕作型稻田湿地中,除E3外E1、E2、EE2去除率均在65%以上,EE2的生物降解只发生在好氧段,EE2拥有乙炔基,从空间结构上来看,这对基团基质和受体的结合有阻碍作用,使得酶活性表达受阻,且在厌氧阶段,会使其由结合态变为游离态,致使EE2不易被降解。
(2)投加HD菌后,耕作型稻田湿地对E1、E2、E3和EE2的总去除率分别为88.6%、76.3%、64.8%和81.2%。耕作层、土壤层、填料层3个生物单元对EDCs(E1、E2、E3、EE2)去除效果均有提升,其中:对E1去除率分别为16.2%、75.1%、28.2%;对E2去除率分别为14.5%、61.8%、18.7%;对E3去除率分别为20.6%、49.8%、10.4%;对EE2去除率分别为8.9%、43.4%、−8.1%。HD菌对耕作型稻田湿地中微生物群落产生影响,诱导产生的羟基酶有利于降解EDCs,从而提高了EDCs的去除效率。耕作型稻田湿地经HD菌剂强化后,3个生物单元中明显土壤层对EDCs去除贡献相对较大,土壤层微生物种群丰度更大,且土壤层中还分布有广泛的水稻根系,不仅为微生物代谢提供营养物质和氧气,还进一步提高了其生物分解能力。
(3)湿地运行初期,耕作型稻田背景土壤中残留的EDCs含量相对较高,经过5个月的连续运行后,土壤中EDCs含量明显下降,投菌组B中的EDCs残留量要明显低于未投菌组A,B组湿地出水中E1、E2、E3和EE2含量相比A组可分别降低约26.6%、17.1%、30.3%、13.3%。表明HD菌剂能强化耕作型稻田湿地土壤中EDCs的降解。本研究对于村落水环境中的EDCs降解机制及环境生态影响评价有一定的参考价值。
村落耕作型稻田湿地中类固醇类激素HD菌强化降解试验
Study on enhancement degradation of steroid hormone HD bacteria in paddy field wetland cultivated in villages
-
摘要: 农村生活污水中的类固醇类激素(EDCs)通过灌溉形式直接被稻、麦、瓜果等农作物吸收,进而进入食物链,带来的环境污染及生态危害问题日益突出。本研究以水稻田为载体构建耕作型稻田湿地,并以本课题组筛选的农药降解菌HD为EDCs强化降解菌,考察耕作型稻田湿地对EDCs的去除效率。试验设A(空白对照)、B(投加HD菌剂强化)两组,结果表明,A组对雌酮(E1)、雌二醇(E2)、雌三醇(E3)及17α-乙炔基雌二醇(EE2)的平均去除率分别为80.1%、72.4%、51.4%、68.3%,B组平均去除率分别为82.6%、73.4%、60.5%、75.6%,除E3外E1、E2、EE2去除率均在65%以上。经HD菌剂强化后,耕作层、土壤层、填料层等3个生物单元对EDCs(E1、E2、E3、EE2)的去除效果均有提升,其中对E1去除率分别为16.2%、75.1%、28.2%;对E2去除率分别为14.5%、61.8%、18.7%;对E3去除率分别为20.6%、49.8%、10.4%;对EE2去除率分别为8.9%、43.4%、-8.1%。湿地经过5个月的连续运行后,EDCs含量下降明显,投菌组B中的EDCs残留量明显低于未投菌组A,B组湿地出水中E1、E2、E3和EE2含量相比A组可分别降低约26.6%、17.1%、30.3%、13.3%。HD菌剂能有效强化村落耕作型稻田湿地对EDCs的降解。Abstract: Steroid hormones (EDCs) in rural sewage are directly absorbed by crops such as rice, wheat, melon and fruit through irrigation, and then enter the food chain, causing growing serious environmental pollution and ecological hazard. In this study, cultivated paddy field wetlands were established to investigate the removal efficiency of EDCs in cultivated paddy field wetland, with rice field being as the carrier, and the pesticide degrading bacteria HD screened by our research group being used as EDCs strengthening degrading bacteria. Two test were set in this study, named with A and B, which were blank control and adding the HD bacterium agent improved respectively. Results showed that the average removal rates of estrone (E1), estradiol (E2) and estriol (E3) and 17-α-ethinylestradiol in group A were 80.1%, 72.4%, 51.4%, 68.3%, and 82.6%, 73.4%, 60.5%, 75.6% in group B. the removal rates of E1, E2 and EE2 were all above 65% except E3 in both of group A and B. The removal effect of EDCs (E1, E2, E3 and EE2) by three biological units (tillage layer, soil layer and packing layer et al) was improved after the addition of HD bacteria agent. The removal rates for E1 in these biological unites were 16.2%, 75.1% and 28.2%, respectively. The removal rates for E2 were 14.5%, 61.8% and 18.7%, respectively. The removal rates for E3 were 20.6%, 49.8% and 10.4%, respectively. The removal rates for EE2 were 8.9%, 43.4% and −8.1%, respectively. The content of EDCs decreased significantly after the wetland successive running for 5 months, the residual content of EDCs in the introduced group B was significantly lower than that in the non-introduced group A. the contents of E1, E2, E3 and EE2 in the out water from group B decreased by about 26.6%, 17.1%, 30.3% and 13.3%, respectively. All results showed HD could effectively improve the degradation of EDCs in rural paddy fields and wetlands cultivated.
-

-
表 1 试验进水水质
Table 1. Test water quality
指标
IndexCODcr/
(mg·L−1)总磷/(mg L−1)
TP氨氮/(mg·L−1) ${\rm{NH}}_4^{+} $ 总氮/(mg·L−1)
TNpH 范围 87—156 2.23—5.69 8.75—16.34 10.86—18.33 7.39—7.84 表 2 进水内分泌干扰物浓度(μg·L-1)
Table 2. Concentration of endocrine disruptors in water inlet(μg·L-1)
类固醇Steroid estrogen E1 Estrone E2 Estradiol EE2 17-α-ethinylestradiol E3 Estriol 原水浓度 10.13—15.25 0.79—1.1 0.88—1.82 6.31—9.58 模拟进水浓度 38.69—60.13 9.86—14.32 10.89—13.21 33.28—54.36 表 3 主要试验试剂
Table 3. Main experimental reagents
药品名称
Drug names分子式
Molecular formula规格
Specification生产单位
Production unitE1 C18H22O2 — 阿拉丁 E2 C18H24O2 — 阿拉丁 E3 C18H24O3 — 阿拉丁 EE2 C20H24O3 — 阿拉丁 BSTFA C8H18F3NOSi2 — 阿拉丁 吡啶 C5H5N AR 永华化学科技(江苏) 丙酮 CH3COCH3 AR 国药 正己烷 C6H14 AR 江苏强盛功能化学 二氯甲烷 CH2Cl2 AR 永华化学科技(江苏) 雄烷 C19H23 — 北京谱析科技有限公司 表 4 试验主要仪器
Table 4. Experimental main instruments
仪器设备
Instrument and equipment型号
Model number生产单位
Production unit多用途高速离心机 SORVALL Thermo electron corporation 行星式球磨机 QM-1SP2 南京大学仪器厂 超声波细胞粉碎机 JY96-Ⅱ 宁波新芝生物科技股份有限公司 气质联用 Trace ISQLT 美国赛默飞科技有限公司 表 5 衍生产物的相应参数
Table 5. corresponding parameters of derivative products
衍生产物
Derivative product保留时间/min
Retention time特征碎片离子(m/z)
Characteristic fragment ion线性回归方程
Equation of linear regressionTMS-E1 24.28 342、327、285 Y=(9.43×108)x+(1.02×109);R2=0.91 di-TMS-E2 25.43 416、401、285 Y=(1.08×107))x+(7.55×106);R2=0.91 di-TMS-EE2 27.03 440、425、285 Y=(1.90×107))x+(3.92×106);R2=0.92 Tri-TMS-E3 28.43 504、489、285 Y=(1.14×106)x+(2.38×106);R2=0.90 注:x为目标产物的实际浓度,单位mg·L−1,Y为色谱峰面积.
Note:x is the actual concentration of the target product, unit: mg·L−1, Y is the peak area. -
[1] 周开茹, 龚剑, 熊小萍, 等. 污水处理厂中典型内分泌干扰物的降解效果研究 [J]. 生态环境学报, 2018, 27(9): 1732-1740. ZHOU K R, GONG J, XIONG X P, et al. Study on removal effect of typical endocrine disruptors in sewage treatment plants [J]. Ecology and Environmental Sciences, 2018, 27(9): 1732-1740(in Chinese).
[2] MAO L, HUANG Q, LU J, et al. Ligninase-mediated removal of natural and synthetic estrogens from water: I. reaction behaviors [J]. Environmental Science & Technology, 2009, 43(2): 374-379. [3] TUAN FAUZAN TUAN OMAR, AZRILAWANIAHMAD, AHMAD ZAHARIN ARIS, et al. Endocrine disrupting compounds (EDCs) in environmental matrices: Review of analytical strategies for pharmaceuticals, estrogenic hormones, and alkylphenol compounds [J]. Trends in Analytical Chemistry, 2016, 85: 241-259. doi: 10.1016/j.trac.2016.08.004 [4] RICHARD HAMPL, JANA KUBÁTOVÁ, LUBOSLAV STÁRKA. et al Steroids and endocrine disruptors-History, recent state of art and open questions [J]. Journal of Steroid Biochemistry and Molecular Biology, 2016, 155: 217-223. doi: 10.1016/j.jsbmb.2014.04.013 [5] 陈栋, 王烁阳, 王玉玺, 等. 典型内分泌干扰物在城市污水处理过程中的降解研究进展 [J]. 青岛理工大学学报, 2018, 39(6): 1-9. doi: 10.3969/j.issn.1673-4602.2018.06.001 CHEN D, WANG S Y, WANG Y X, et al. Research progress on removal of typical endocrine disruptors in municipal wastewater treatment [J]. Journal of Qingdao University of Technology, 2018, 39(6): 1-9(in Chinese). doi: 10.3969/j.issn.1673-4602.2018.06.001
[6] LEGLER J, JONAS A, LAHR J, et al. Biological measurement of estrogenic activity in urine and bile conjugates with the in vitro ER-Calus reporter gene assay [J]. Environmental Toxicology & Chemistry, 2010, 21(3): 473-479. [7] CAPPIELLO A, FAMIGLINI G, PALMA P, et al. Determination of selected endocrine disrupting compounds in human fetal and newborn tissues by GC-MS [J]. Analytical and Bioanalytical Chemistry, 2014, 406(12): 2779-2788. doi: 10.1007/s00216-014-7692-0 [8] LEENA HILAKIVI-CLARKE, SONIA ASSIS, ANNI WARRI. et al Exposures to synthetic estrogens at different times during the life, and their effect on breast cancer risk [J]. Journal of Mammary Gland Biology and Neoplasia, 2013, 18(1): 25-42. doi: 10.1007/s10911-013-9274-8 [9] 谢宁宁. 武汉市稻田生态系统服务功能评价[D]. 哈尔滨: 东北林业大学, 2008. XIE N N. Evaluation of ecosystem service function of rice field in wuhan[D]. Harbin: Northeast Forestry University, 2008(in Chinese).
[10] 阳春, 胡碧波, 张智. 类固醇雌激素在生活污水处理中的去除过程 [J]. 中国给水排水, 2008, 24(10): 11-15. doi: 10.3321/j.issn:1000-4602.2008.10.003 YANG C, HU B B, ZHANG Z. Removal process of steroid estrogen in sewage treatment [J]. China Water Supply and Drainage, 2008, 24(10): 11-15(in Chinese). doi: 10.3321/j.issn:1000-4602.2008.10.003
[11] 黄诗蓓. 人工湿地根区微环境调控强化雌激素去除的研究[D]. 南京: 东南大学, 2015. HUANG S P. Study on estrogen removal enhanced by microenvironmental regulation in root area of constructed wetland[D]. Nanjing: Southeast University, 2015 (in Chinese).
[12] 林泳墨, 秦玉莹, 李明堂. 雌激素类污染物的微生物降解研究进展 [J]. 广州化工, 2016, 44(11): 3-4, 25. doi: 10.3969/j.issn.1001-9677.2016.11.002 LIN Y M, QIN Y Y, LI M T. Advances in microbial degradation of estrogenic pollutants [J]. Guangzhou Chemical Industry, 2016, 44(11): 3-4, 25(in Chinese). doi: 10.3969/j.issn.1001-9677.2016.11.002
[13] 胡林潮, 周新程, 邓文, 等. 潜流式人工湿地消纳城市污水厂尾水微生物特性及机制 [J]. 土木建筑与环境工程, 2016, 38(6): 135-141. HU L C, ZHOU X C, DENG W, et al. Microbiological characteristics and mechanism of subsurface flow constructed wetland in wastewater treatment plant [J]. Journal of Chongqing Jianzhu University, 2016, 38(6): 135-141(in Chinese).
[14] 张文艺, 黄彬, 郭惠娟, 等. 一株2, 4-二氯苯酚降解菌及降解方法[P]. 江苏: CN108823122A, 2018-11-16. ZHANG W Y, HUANG B, GUO H J, et al. A strain of 2, 4-dichlorophenol degrading bacteria and its degradation method[P]. JIANG SU: CN108823122A, 2018-11-16(in Chinese).
[15] 刘通, 闫刚, 姚立荣, 等. 沸石的改性及其对水源水中氨氮降解的研究 [J]. 水文地质工程地质, 2011, 38(2): 97-101. doi: 10.3969/j.issn.1000-3665.2011.02.017 LIU T, YAN G, YAO L R, et al. Modification of zeolite and removal of ammonia nitrogen from water source [J]. Hydrogeology Engineering Geology, 2011, 38(2): 97-101(in Chinese). doi: 10.3969/j.issn.1000-3665.2011.02.017
[16] 黄成, 姜理英, 陈建孟, 等. 固相萃取-衍生化气相色谱/质谱法测定制药厂污水中的环境雌激素 [J]. 色谱, 2008, 26(5): 618-621. doi: 10.3321/j.issn:1000-8713.2008.05.018 HUANG C, JIANG L Y, CHEN J M. et al Determination of environmental estrogens in pharmacy wastewater using solid-phase extraction-gas chromatography/mass spectrometry with derivatization [J]. Chinese Journal of Chromatography, 2008, 26(5): 618-621(in Chinese). doi: 10.3321/j.issn:1000-8713.2008.05.018
[17] BARONTI C. Monitoring natural and synthetic estrogens at activated sludge sewage treatment plants and in a receiving river water [J]. Environ Sci Technol, 2000, 34(24): 5059-5066. doi: 10.1021/es001359q [18] 钟文辉. 降解2,4-二氯酚微生物的分离及其2,4-二氯酚羟化酶基因的克隆和表达 [J]. 生物工程学报, 2004, 20(2): 209-214. doi: 10.3321/j.issn:1000-3061.2004.02.011 ZHONG W H. Isolation of microorganisms degrading 2,4-dichlorophenol and cloning and expression of 2,4-dichlorophenol hydroxylase gene [J]. Journal of Biological Engineering, 2004, 20(2): 209-214(in Chinese). doi: 10.3321/j.issn:1000-3061.2004.02.011
[19] HUANG C, XU P, ZENG G, et al. The rapid degradation of bisphenol A induced by the response of indigenous bacterial communities in sediment [J]. Applied Microbiology and Biotechnology, 2017, 101(9): 3919-3928. doi: 10.1007/s00253-017-8154-3 [20] 冀泽华, 冯冲凌, 吴晓芙, 等. 人工湿地污水处理系统填料及其净化机理研究进展 [J]. 生态学杂志, 2016, 35(8): 2234-2243. JI Z H, FENG Z L, WU X F, et al. Research progress on packing and purification mechanism of constructed wetland wastewater treatment system [J]. Journal of Ecology, 2016, 35(8): 2234-2243(in Chinese).
[21] G D’ASCENZO, A Di CORCIA, Alessandra GENTILI, et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities [J]. Science of the Total Environment, 2003, 302(1-3): 199-209. doi: 10.1016/S0048-9697(02)00342-X [22] LI Y M, ZENG S J. Removal and fate of estrogens in an anaerobic-anoxic-oxic activated sludge system [J]. Water Science and Technology, 2011, 63(1): 51-56. doi: 10.2166/wst.2011.008 [23] 王薇, 蔡祖聪, 钟文辉, 等. 好氧反硝化菌的研究进展 [J]. 应用生态学报, 2007, 18(11): 2618-2625. WANG W. CAI Z C. ZHONG W H. et al Advances in aerobic denitrifying bacteria [J]. Journal of Applied Ecology, 2007, 18(11): 2618-2625(in Chinese).
[24] LUCAS S D, JONES D L. Biodegradation of estrone and 17 β-estradiol in grassland soils amended with animal wastes [J]. Soil Biology and Biochemistry, 2006, 38(9): 2803-2815. doi: 10.1016/j.soilbio.2006.04.033 [25] TERNES T A, P KREKEL J MUELLER. Behaviour and occurrence of estrogens in municipal sewage treatment plants - I. Investigations in Germany, Canada and Brazil [J]. Science of the Total Environment, 1999, 225(1-2): 81-90. doi: 10.1016/S0048-9697(98)00334-9 [26] SCHROEDER L M, BLACKWELL B, KLEIN D, et al. Rate uptake of three common pharmaceuticals in Celery, Apium Graveolens [J]. Water Air & Soil Pollution, 2015, 226(4): 1-20. [27] 任海燕, 纪淑兰, 崔成武, 等. 鞘氨醇杆菌(Sphingobacterium sp.)JCR5降解17α-乙炔基雌二醇的代谢途径 [J]. 环境科学, 2006, 27(9): 1835-1840. doi: 10.3321/j.issn:0250-3301.2006.09.025 REN H Y, JI S L, CUI C W. et al Metabolic pathway of 17-α-ethinylestradiol degradation by sphingobacterium sp. JCR5 [J]. Environmental Science, 2006, 27(9): 1835-1840(in Chinese). doi: 10.3321/j.issn:0250-3301.2006.09.025
[28] ANDROLINI F, BORRA C, CACCAMO F, et al. Estrogen conjugates in late-pregnancy fluids: extraction and group separation by a graphitized carbon black cartridge and quantification by high-performance liquid chromatography [J]. Analytical Chemistry, 1987, 59(13): 1720-1725. doi: 10.1021/ac00140a029 [29] YOUNG K C, DOCHERTY K M, MAURIICE P A, et al. Degradation of surface-water dissolved organic matter: influences of DOM chemical characteristics and microbial populations [J]. Hydrobiologia, 2005, 539(1): 1-11. doi: 10.1007/s10750-004-3079-0 -



 下载:
下载: