-
随着水体富营养化问题日益突出,氮素污染的防治越来越受到人们的重视[1]。目前污水脱氮处理方法主要有化学法、生化法及生物物理-物化组合工艺。其中生物脱氮以其经济、高效、无残留污染的优点,成为污水脱氮的主要手段[2]。但是,传统的生物脱氮分硝化和反硝化等不同过程,要求在2个反应器中进行,故建设成本高,而且反硝化部分还需要投加大量碳源[3]。
近年来,随着具有异养硝化-好氧反硝化特性菌株的发现,利用异养硝化-好氧反硝化菌研发污水脱氮技术已成为研究热点[4]。与传统硝化微生物相比,异养硝化-好氧反硝化菌具有更高的细胞生长速率[5],并且实现了在同一个反应器中同步完成硝化和反硝化反应,同时将氨氮、硝态氮和亚硝态氮转化为含氮气体[6]。而且,在硝化和反硝化过程中分别产生的酸和碱能相互中和,从而相对维持水体酸碱平衡,减少pH调节成本[7]。此外,一些特殊异养硝化-好氧反硝化菌甚至还具备耐受高氨氮、高盐度、低温和低C/N的特性[8-11]。目前已发现的异养硝化-好氧反硝化菌主要有产碱菌属(Alcaligenes)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)等[12-15]。然而,由于异养硝化-好氧反硝化菌在养殖废水中存在脱氮效果稳定性差、环境适应力和竞争力弱等问题,故实际应用于畜禽养殖废水的异养硝化-好氧反硝化菌较少。为此,本研究从南昌县一中型养猪厂曝气池筛选出一株脱氮性能较好的异养硝化-好氧反硝化菌株YZ-12,经过16S rRNA基因序列分析鉴定菌株种属,分析了优化菌株脱氮条件,并将该菌株应用于养猪废水脱氮实验,以期为猪场养殖废水提供脱氮效果优良、环境适应力和竞争力强的微生物菌剂。
-
筛选样品采自南昌县一中型养猪厂曝气池;细菌DNA提取试剂盒购自美国Omega Bio-Tek公司,PCR聚合酶购自TOYOBO公司,27F/1492R引物购自生工生物工程(上海)股份有限公司,其他试剂均为国产分析纯。
-
富集培养基的成分为:1 g胰蛋白胨,0.5 g酵母膏,0.1 g KNO3,1 L蒸馏水,pH为7.2。BTB初筛培养基:8.5 g C4H4Na2O4∙6H2O,1 g KNO3,1 g MgSO4∙7H2O,1 g KH2PO4,0.05 g FeSO4∙7H2O,0.2 g CaCl2∙2H2O,20 g琼脂,1 mL 1%溴百里酚蓝,1 L蒸馏水,pH为7.0~7.3。硝化培养基的成分为:11 g C4H4Na2O4∙6H2O,6.7 g Na2HPO4∙12H2O,1.5 g NH4Cl,1 g KH2PO4,0.1 g MgSO4∙7H2O,2 mL微量元素溶液,1 L蒸馏水,pH为7.0~7.3。反硝化培养基的成分为:13 g C4H4Na2O4∙6H2O,7.9 g Na2HPO4∙12H2O,3 g KNO3,1.5 g KH2PO4,0.1 g MgSO4∙7H2O,2 mL微量元素溶液,1 L蒸馏水,pH为7.0~7.3。微量元素溶液的成分为:50 g EDTA,7.28 g CaCl2∙2H2O,5 g FeSO4∙7H2O,3.92 g ZnSO4∙7H2O,2.06 g MnCl2∙4H2O,1.61 g CoCl2∙6H2O,1.57 g CuSO4∙5H2O,1.1 g (NH4)6Mo7O24∙4H2O,1 L蒸馏水,pH为6.0[16]。
-
取10 mL养殖废水,加入到装有90 mL无菌富集培养基的250 mL三角瓶中,30 ℃、120 r∙min−1恒温培养24 h,取5 mL培养液转接,重复富集3次。将富集液进行梯度稀释(10−4~10−7),取0.2 mL涂布于BTB初筛培养基上,在30 ℃培养箱中培养至出现明显的单菌落。挑取变蓝单菌落,经多次划线纯化后于4 ℃冰箱中保存。
将保存的菌株分别接种于无菌富集培养基中,在30 ℃、120 r∙min−1下恒温培养24 h,按3%接种量分别加到硝化培养基和反硝化培养基中,在30 ℃、120 r∙min−1下恒温培养48 h,取培养液检测
$ {\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N浓度,从而筛选出具有较好脱氮性能的异养硝化-好氧反硝化菌。采用细菌DNA提取试剂盒提取菌株基因组的样品,利用27F/1492R引物对样品DNA进行扩增,用Sanger法对PCR产物进行测序,采用双向引物测序,测序结果采用DNAMAN软件进行拼接处理。
-
1)菌株生长曲线的测定。菌株于富集培养基中活化后,按3%接种量分别接种于硝化培养基和反硝化培养基中,在30 ℃、120 r∙min−1下恒温培养54 h,每3 h检测培养液OD600值,每6 h检测
$ {\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N的质量浓度。2)菌株的脱氮条件优化实验。考察了碳源、氮浓度、C/N、pH、盐度5种单因素对菌株脱氮效果的影响。其中,碳源分别为葡萄糖、蔗糖、乙酸钠、甲醇和丁二酸钠;
$ {\rm{NH}}_4^ + $ -N质量浓度分别为50、100、150、200和250 mg·L−1;${\rm{NO}}_3^ - $ -N质量浓度分别为400、450、500、550和600 mg·L−1;C/N分别为2.5、5、10、15和20;pH分别为5、6、7、8和9;盐度分别为10、20、30、40和50 g·L−1。30 ℃、120 r∙min−1恒温培养72 h,每24 h取样检测培养液OD600值及$ {\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N质量浓度。 -
供试样品为曝气池的水泡粪污水,采集自南昌县一中型养猪厂污水处理站好氧池。经检测,养殖废水样品中COD为2 031 mg·L−1,
$ {\rm{NH}}_4^ + $ -N质量浓度为362 mg·L−1,${\rm{NO}}_3^ - $ -N质量浓度为23.8 mg·L−1,pH为7.8。用蔗糖将养殖废水C/N调节为10,并进行以下3种处理:1)121 ℃灭菌30 min,按5%接种量接入菌株YZ-12悬液;2)不灭菌,按5%接种量接入菌株YZ-12悬液;3)不灭菌,按5%接种量接入无菌水。在30 ℃,120 r∙min−1恒温培养48 h,每24 h取样检测
$ {\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N质量浓度,每个处理3个重复。 -
$ {\rm{NH}}_4^ + $ -N使用纳氏试剂分光光度法测定;${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N使用离子色谱法测定;OD600使用光电比浊法测定;COD使用重铬酸盐法测定;pH使用上海雷磁PHSJ-3F pH计测定。 -
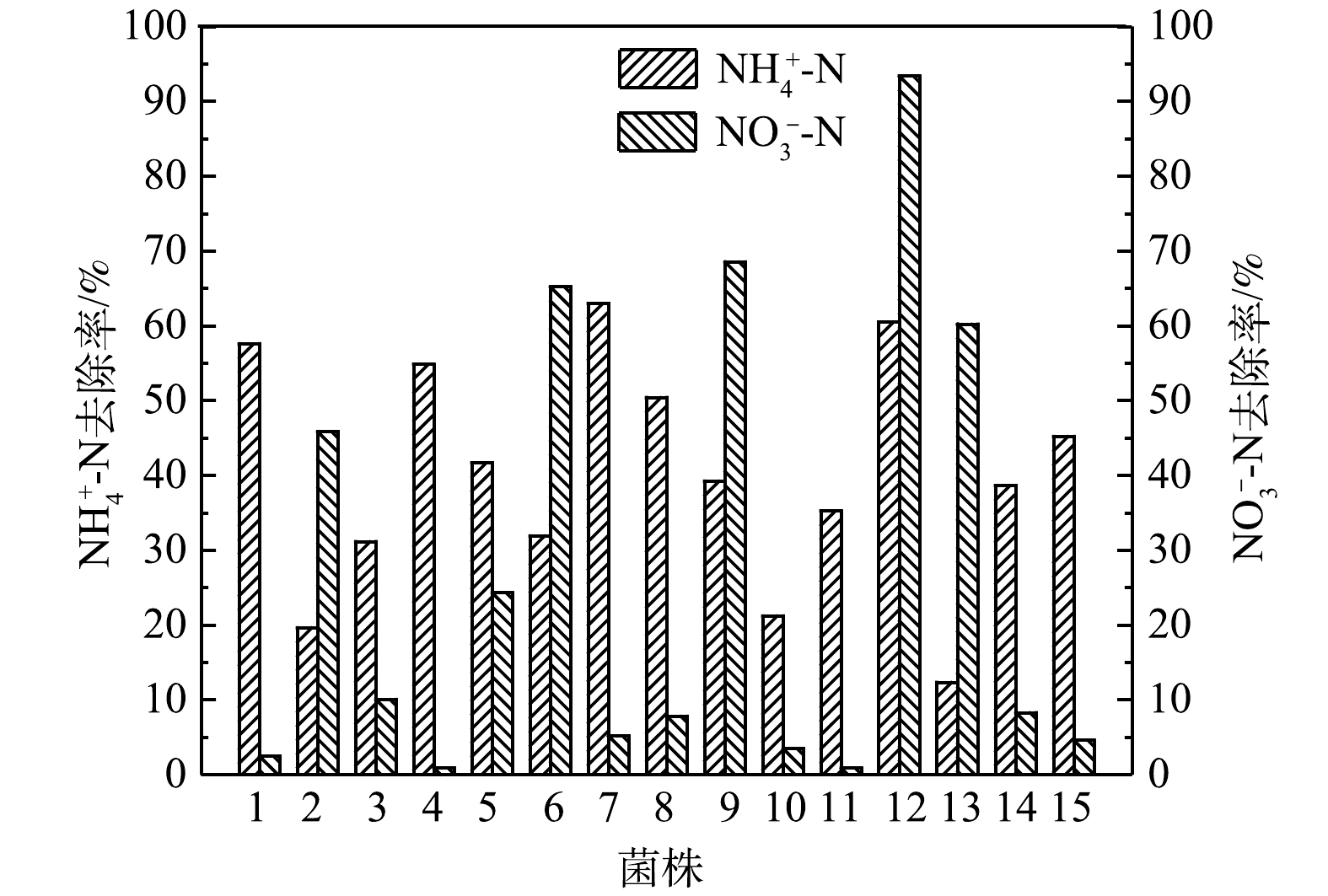
从养殖废水中共筛选出15株细菌,脱氮效果如图1所示。其中12号菌株(YZ-12)对氨氮去除率为60.52%,对硝态氮去除率为93.39%,其脱氮效果最佳,故将其用于后续的脱氮实验。
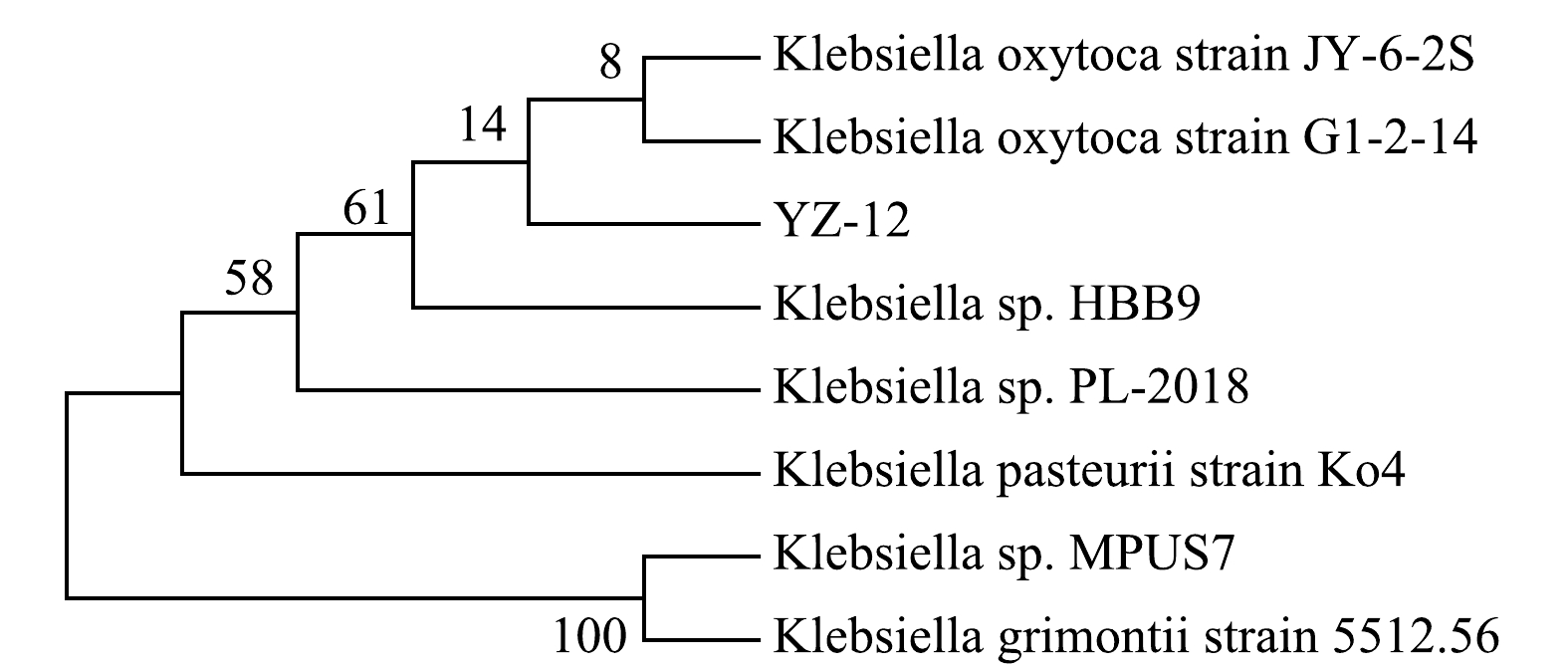
提取菌株YZ-12的DNA,使用细菌16S通用引物进行扩增测序,将测序结果得到的seq文件中的序列信息,输入NCBI数据中的Blast比对系统中,搜索数据库中相似的序列,得到序列比对结果。菌株YZ-12与Klebsiella oxytoca strain相似度最高,同源性为100%,采用Mega7.0软件构建菌株系统发育树(图2)。
-
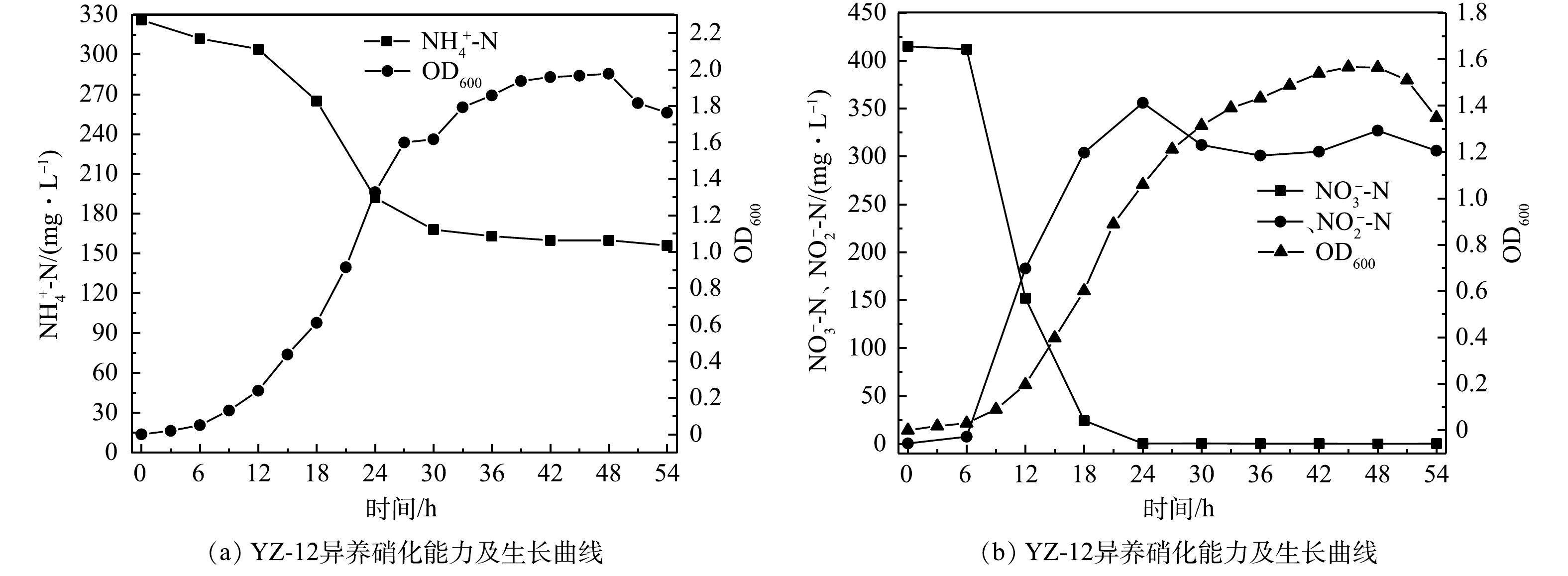
1)菌株YZ-12生长曲线的测定。由图3可以看出,菌株YZ-12的对数生长期为12~30 h,稳定期为30~48 h,48 h后进入衰亡期。在对数生长期,氨氮被快速去除,
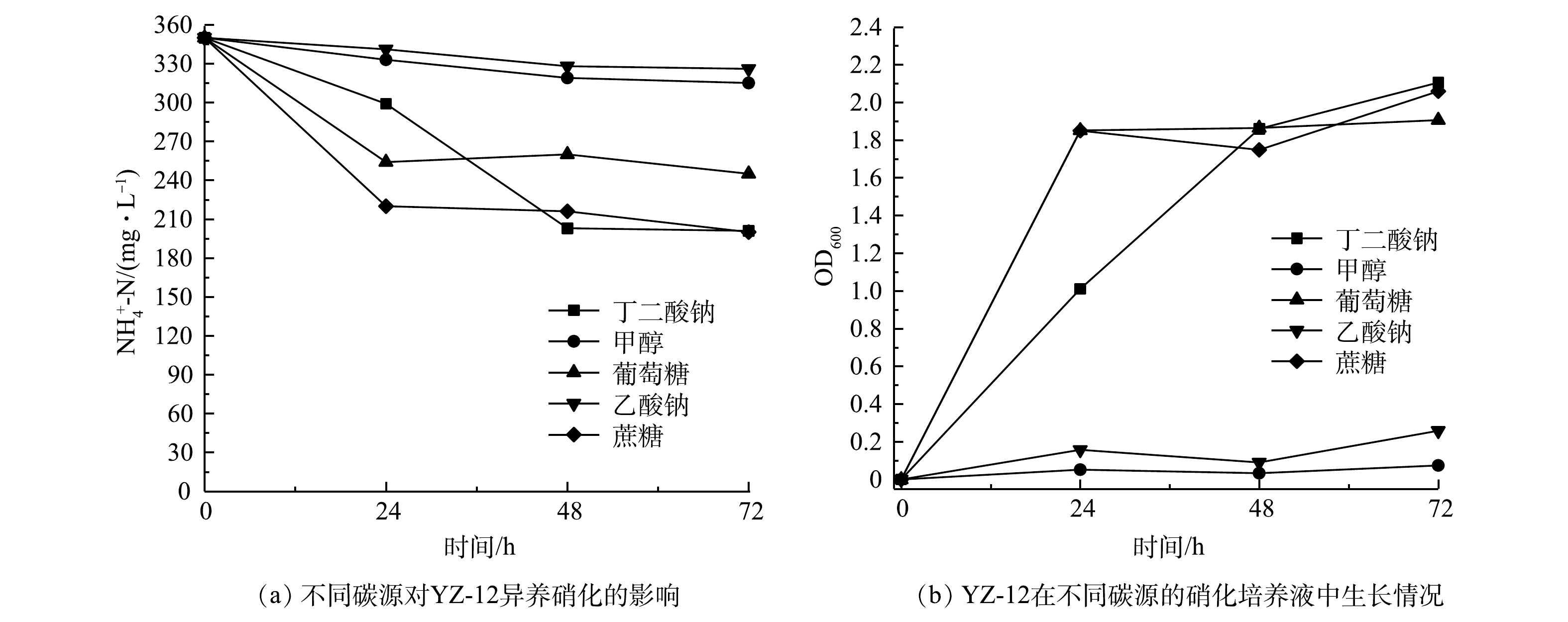
$ {\rm{NH}}_4^ + $ -N由326 mg·L−1下降至156 mg·L−1,氨氮去除率为52.15%。在此脱氨过程中,硝态氮有少量产生后又去除,亚硝态氮几乎未检出,这与AN等[17]、陈猛等[18]的研究结果类似。由于初始氨氮质量浓度较高,与邹艳艳等[19]的研究结果相比,氨氮去除率下降明显,但氨氮去除量明显增加。在0~24 h,${\rm{NO}}_3^ - $ -N由415 mg·L−1下降至0.215 mg·L−1,硝态氮去除率为99.95%,同时${\rm{NO}}_2^ - $ -N不断积累,最高达到356 mg·L−1。这与杨静丹等[16]的研究结果类似,碳源和碳氮比可能对${\rm{NO}}_2^ - $ -N积累均有影响。2)碳源对菌株YZ-12脱氮效果的影响。异养硝化-好氧反硝化是氧化还原反应,不同的碳源具有不同的氧化还原电位,所以会产生不同的脱氮效果[20]。由图4可以看出,以葡萄糖、蔗糖、丁二酸钠为碳源进行异养硝化时,菌株均能正常生长,OD600值达到1.9以上,氨氮去除率最大分别为30%、42.86%、42.57%。此时,菌株无法利用甲醇为碳源,几乎不生长,以乙酸钠为碳源进行异养硝化时,菌株生长也受到抑制。因此,与甲醇、乙酸钠、葡萄糖等碳源相比,蔗糖、丁二酸钠作为异养硝化的碳源更具优势。
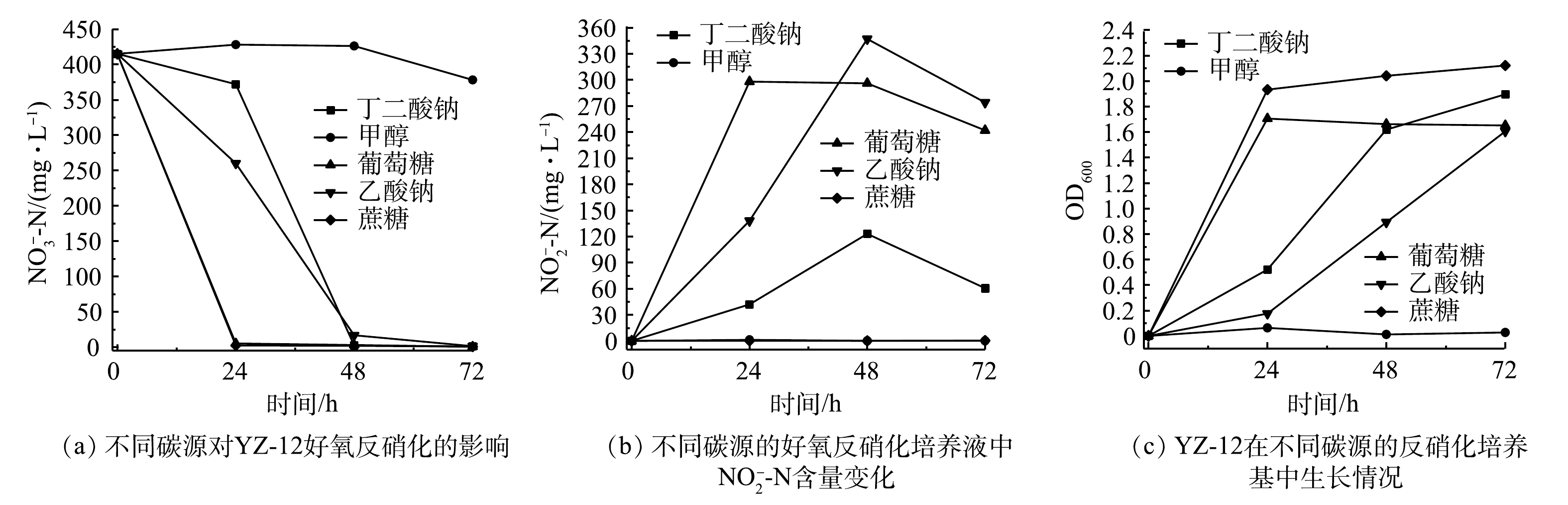
由图5可知,以葡萄糖、蔗糖、丁二酸钠、乙酸钠为碳源进行好氧反硝化时,菌株能正常生长,72 h时
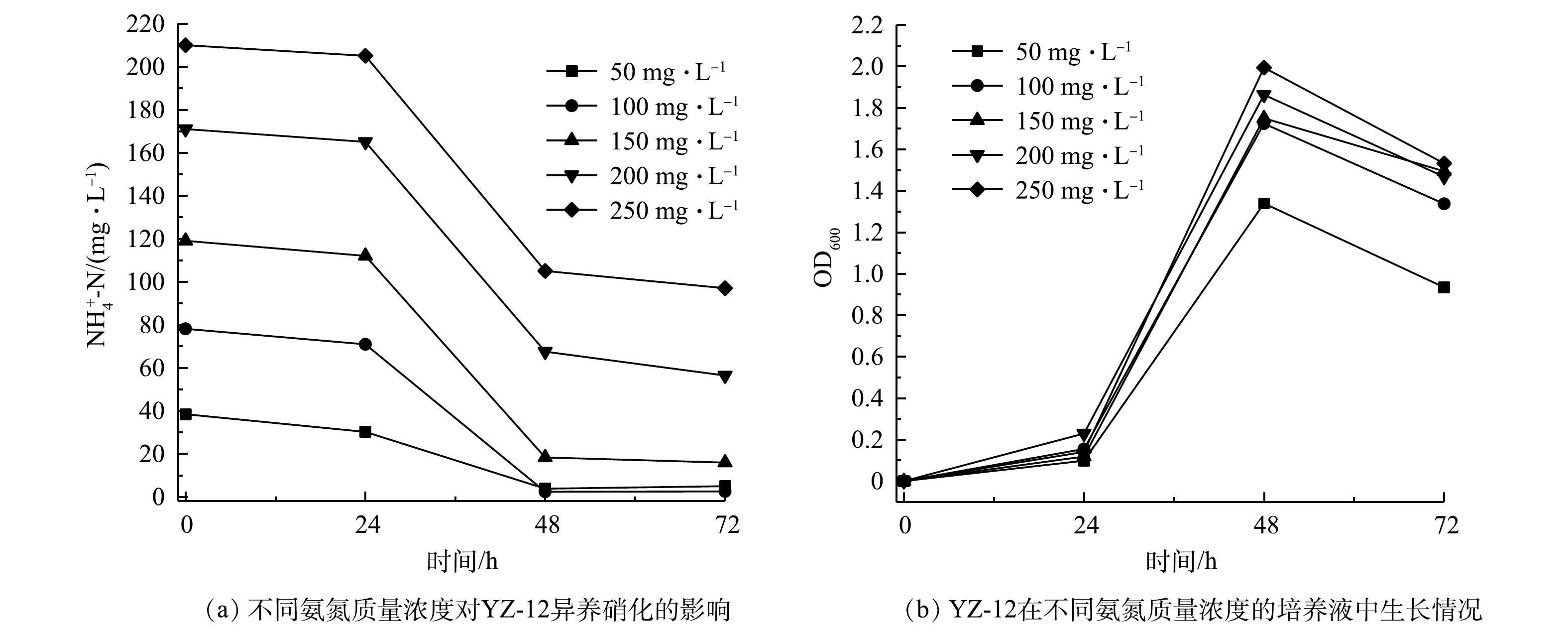
${\rm{NO}}_3^ - $ -N去除率均达到99%。其中,以葡萄糖、蔗糖为碳源时,24 h时${\rm{NO}}_3^ - $ -N去除率达到99%。但以葡萄糖、丁二酸钠、乙酸钠为碳源时,${\rm{NO}}_2^ - $ -N有明显累积,而以蔗糖为碳源时${\rm{NO}}_2^ - $ -N几乎未检出。综合选择,蔗糖作为好氧反硝化碳源更具优势。这与LIU等[21]的研究结果一致。3)初始氨氮质量浓度对菌株YZ-12脱氮效果的影响。不同废水含氮量不同,配置不同初始氮浓度培养液,研究菌株的脱氮效果。由图6可以看出,菌株YZ-12的异养硝化主要在24~48 h,这是菌株生长期和稳定期,这24 h内平均
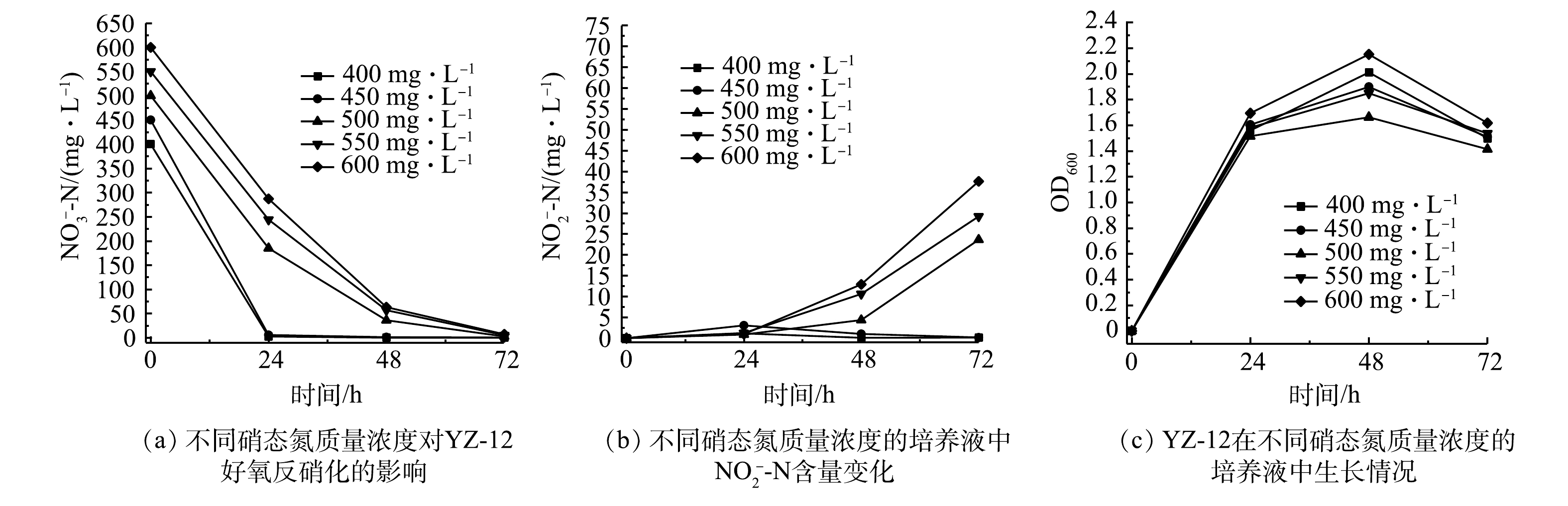
$ {\rm{NH}}_4^ + $ -N去除速率分别为1.10、2.86、3.90、4.06、4.17 mg·(L·h)−1。当初始氨氮质量浓度为150~250 mg·L−1时,其$ {\rm{NH}}_4^ + $ -N去除速率趋于稳定;当初始氨氮质量浓度为50 mg·L−1时,菌株YZ-12因为氮源不足,影响菌的生长,从而影响了$ {\rm{NH}}_4^ + $ -N去除速率。高游离氨浓度废水对异养硝化-好氧反硝化菌具有毒性[22],当$ {\rm{NH}}_4^ + $ -N为150、200、250 mg·L−1时,其氨氮去除率分别为86.64%、67.02%、53.81%,与$ {\rm{NH}}_4^ + $ -N为100 mg·L−1时96.81%的去除率相比,差异显著。硝态氮质量浓度对YZ-12好氧反硝化的影响如图7所示。菌株YZ-12的好氧反硝化主要发生在0~48 h,当初始硝态氮质量浓度为400~450 mg·L−1时,在0~24 h的
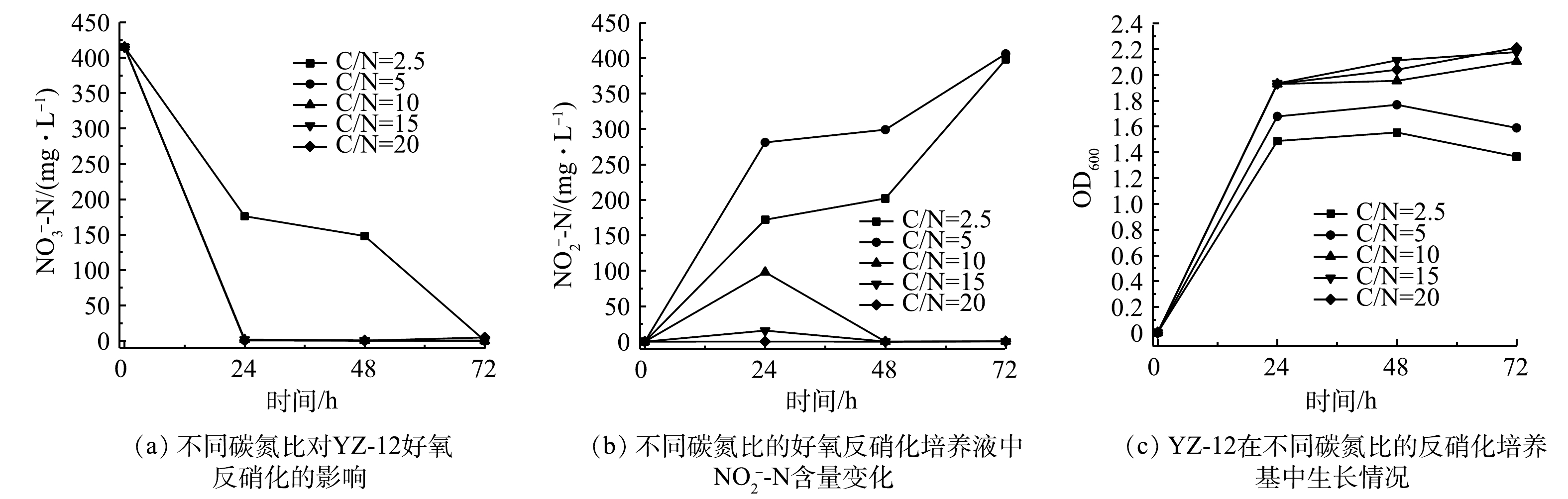
${\rm{NO}}_3^ - $ -N去除速率分别为16.56、16.43 mg·(L·h)−1;当初始硝态氮质量浓度升高至500~600 mg·L−1时,在0~24 h的${\rm{NO}}_3^ - $ -N去除速率分别下降至8.96、6.50、4.71 mg·(L·h)−1,同时还有部分亚硝态氮积累。这可能因高浓度硝态氮对菌株的好氧反硝化作用起到了抑制作用[23]。4)碳氮比对菌株YZ-12脱氮效果的影响。不同碳氮比对菌株YZ-12脱氮的影响如图8和图9所示。在C/N为2.5和5的硝化培养液中,菌株生长缓慢,
$ {\rm{NH}}_4^ + $ -N去除率不高,分别为40.00%和62.84%。这是因为低C/N影响微生物酶活性,从而影响脱氮率及菌株的生长[24]。当C/N为10、15、20时,$ {\rm{NH}}_4^ + $ -N均在48 h后降至10 mg·L−1以下,菌株生长良好。所以,菌株YZ-12异养硝化最佳C/N为10~20。对于菌株好氧反硝化而言,当C/N在2.5~20时,菌株均能良好生长,且C/N越高,菌株生长越好。当C/N为5~20时,培养24 h后其
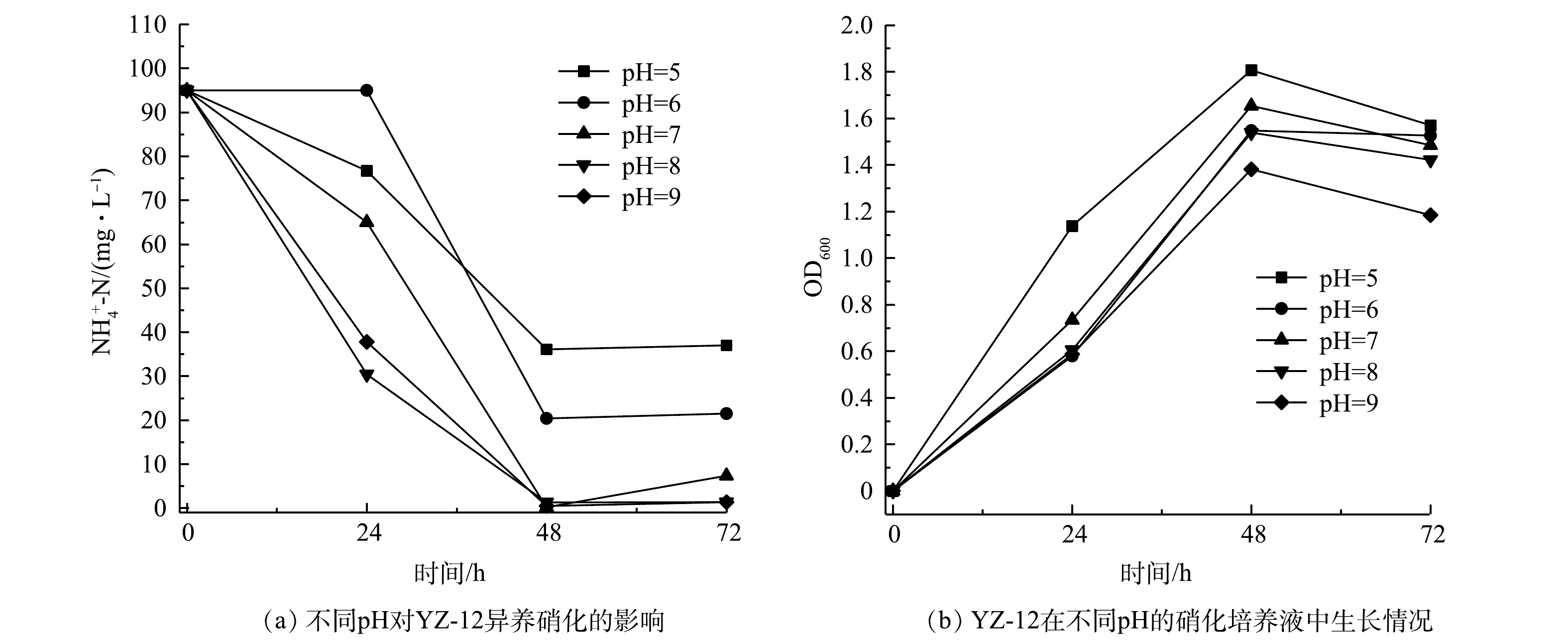
${\rm{NO}}_3^ - $ -N去除率为99.6%。在C/N=10时,${\rm{NO}}_2^ - $ -N有明显累积,后又去除;但当C/N=5时,${\rm{NO}}_3^ - $ -N均转化为NO2-N;当C/N=2.5时,${\rm{NO}}_3^ - $ -N也慢慢转化为${\rm{NO}}_2^ - $ -N,未能去除。综合考虑,菌株YZ-12最佳好养反硝化C/N为10~20。这符合大多数异养硝化-好氧反硝化菌最佳C/N范围(6~20)[25]。5)pH对菌株YZ-12脱氮效果的影响。不同pH对菌株YZ-12脱氮的影响如图10和图11所示。在pH为5~9的硝化培养液中,菌株均能正常生长。菌株在pH为7、8、9的培养液中培养48 h,
$ {\rm{NH}}_4^ + $ -N去除率均为98%以上。但在酸性条件下$ {\rm{NH}}_4^ + $ -N去除率有所下降,在pH为5和6时,$ {\rm{NH}}_4^ + $ -N最大去除率分别为62.00%和78.53%。这说明菌株YZ-12更适合处理中性及偏碱性废水,这与胡杰等[26]获得的结果相近。酸性环境不仅影响菌株YZ-12降解硝态氮效果,同时还会影响菌株生长。菌株在pH为7、8、9的培养液中培养24 h,
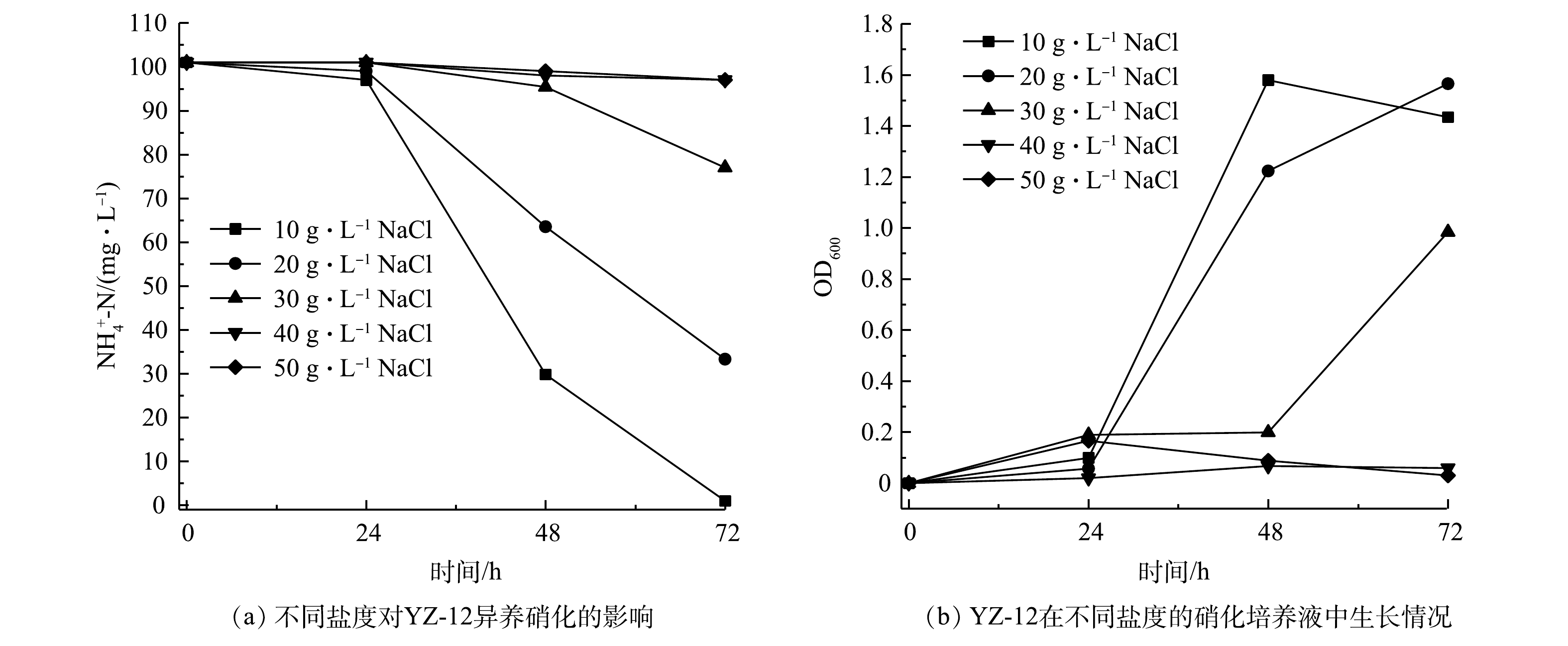
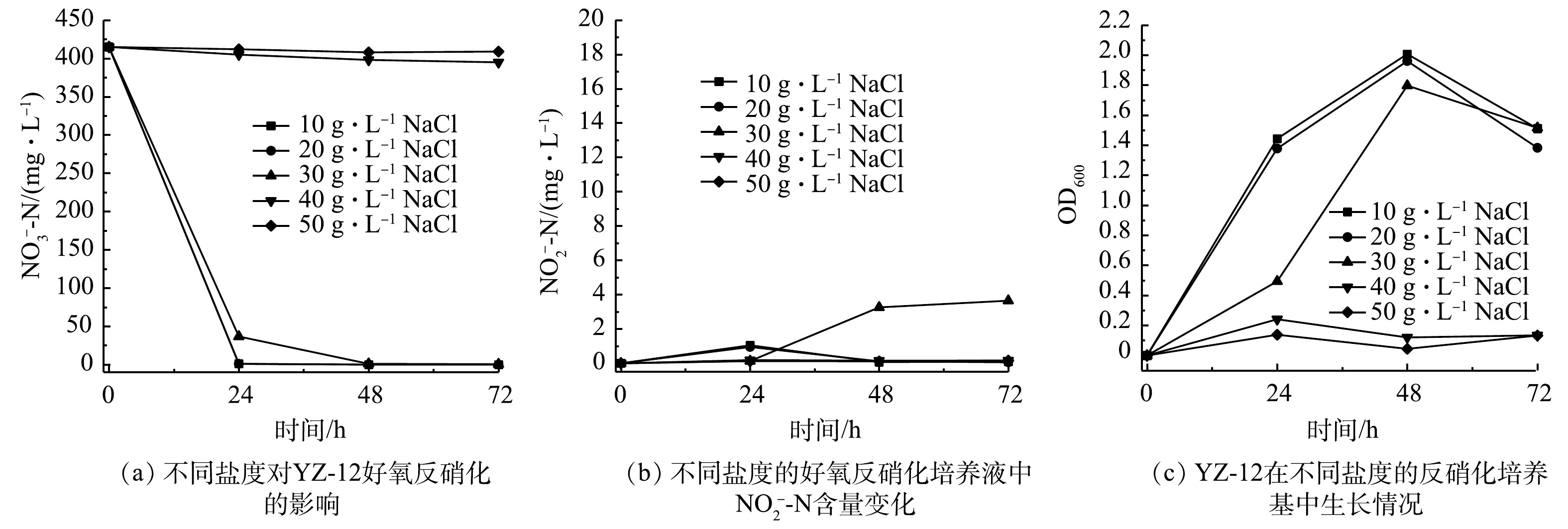
${\rm{NO}}_3^ - $ -N的去除率均在99%以上,且生长良好;但pH为7时,则有62.7 mg·L−1的${\rm{NO}}_2^ - $ -N积累。有研究表明,反硝化酶在中性或微碱性环境中活性更高[27],在偏酸性条件下其活性受到抑制,导致脱氮效果下降,这与本研究结果一致。6)盐度对菌株YZ-12脱氮效果的影响。部分异养硝化-好氧反硝化菌具有耐盐性[28]。由图12可以看出,盐度对硝化作用影响显著,在盐度为10 g·L−1和20 g·L−1的异养硝化培养基中,菌株YZ-12能够正常生长,
$ {\rm{NH}}_4^ + $ -N去除率最大分别为99.02%和66.70%;当盐度为30 g·L−1时,菌株在48 h适应高盐环境后开始生长,$ {\rm{NH}}_4^ + $ -N在72 h时去除率为23%。这说明菌株具有一定的耐盐性。当盐度≥40 g·L−1时,高盐环境会破坏细菌细胞,抑制细菌生长及代谢过程[29],导致菌株无法大量繁殖。盐度对YZ-12好氧反硝化的影响如图13所示。当盐度≥40 g·L−1时,菌株也无法在反硝化培养基中生长;盐度≤30 g·L−1时,菌株具有良好的反硝化能力,培养48 h后,
${\rm{NO}}_3^ - $ -N去除率均达到99%,同时仅有部分亚硝态氮积累。这说明菌株YZ-12属于耐盐菌[30],具有处理高盐硝态氮废水的能力。 -
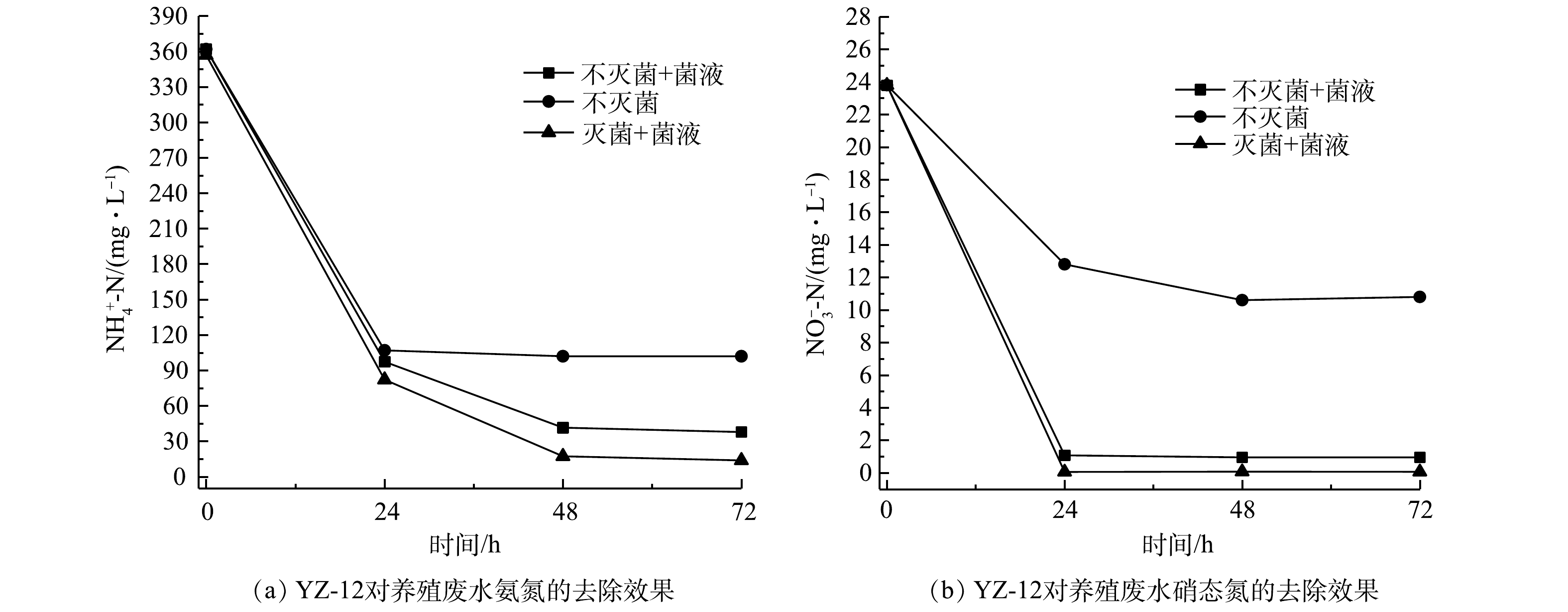
由图14可以看出,不同的处理方式下脱氮效果亦不同。不加菌液的养殖废水中的微生物在合适的C/N条件下,
$ {\rm{NH}}_4^ + $ -N和${\rm{NO}}_3^ - $ -N的去除率分别为71.82%和55.46%。这说明养殖废水中本身存在脱氮菌[31],在适宜生长条件下可以起到部分脱氮作用。不灭菌加5%菌液处理的养殖废水$ {\rm{NH}}_4^ + $ -N和${\rm{NO}}_3^ - $ -N的去除率分别为88.54%和96.0%。这说明加入5%的YZ-12菌液后,YZ-12在养殖废水中竞争力强,能够提升脱氮效果,但受到其他菌种的影响。灭菌加5%菌液处理的养殖废水$ {\rm{NH}}_4^ + $ -N和${\rm{NO}}_3^ - $ -N的去除率分别为95.15%和99.69%。该处理的$ {\rm{NH}}_4^ + $ -N去除率高于陈猛等[18]实验结果,与陈均利等[32]的实验结果相似,说明菌株YZ-12在不受其它菌株影响时,对养殖废水具有更好的脱氮效果。 -
1)从养猪厂污水处理站曝气池筛选出一株异养硝化-好氧反硝化菌株Klebsiella oxytoca YZ-12,该菌株具有较好的异养硝化-好氧反硝化能力,同时还具有一定的耐盐性,能够独立完成脱氮全部过程。
2)菌株YZ-12最适脱氮条件为C/N=10、pH=7、盐度≤10 g·L−1、
$ {\rm{NH}}_4^ + $ -N质量浓度≤150 mg·L−1、${\rm{NO}}_3^ - $ -N质量浓度≤450 mg·L−1、碳源为蔗糖。3)调节养殖废水C/N后加入5% YZ-12菌株对其进行脱氮处理,48 h后
$ {\rm{NH}}_4^ + $ -N去除率达95.15%,${\rm{NO}}_3^ - $ -N去除率达99.69%。这说明该菌株脱氮性能好且在养殖废水中具有较强的竞争力和适应力。
异养硝化-好氧反硝化菌YZ-12的脱氮性能及其对养殖废水的处理效果
Denitrification performance and aquaculture wastewater treating effects of heterotrophic nitrifying aerobic denitrifying bacteria YZ-12
-
摘要: 为获得高效脱氮菌,从南昌县一中型养猪厂曝气池筛选出一株异养硝化-好氧反硝化菌株YZ-12,经过16S rRNA基因序列分析,鉴定其为Klebsiella oxytoca;随后检测了该菌株的硝化和反硝化能力。结果表明,在
$ {\rm{NH}}_4^ + $ -N质量浓度为100 mg·L−1的硝化培养基和${\rm{NO}}_3^ - $ -N质量浓度为400 mg·L−1的反硝化培养基中,$ {\rm{NH}}_4^ + $ -N去除率在96%以上,${\rm{NO}}_3^ - $ -N去除率在99%以上,无${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N积累。同时,还考察了碳源、氮浓度、C/N、pH、盐度5种单因素对菌株脱氮效果的影响。结果表明,菌株最佳脱氮条件为C/N=10、pH=7、盐度≤10 mg·L−1、$ {\rm{NH}}_4^ + $ -N质量浓度≤150 mg·L−1、${\rm{NO}}_3^ - $ -N质量浓度≤450 mg·L−1、碳源为蔗糖;用蔗糖将养殖废水C/N调节为10,加入5%菌株进行脱氮处理,灭菌后的养殖废水$ {\rm{NH}}_4^ + $ -N和${\rm{NO}}_3^ - $ -N的去除率分别为95.15%和99.69%。-
关键词:
- 异养硝化-好养反硝化 /
- 养殖废水 /
- 生物脱氮
Abstract: To obtain highly efficient denitrification bacteria, a bacterium YZ-12 with heterotrophic nitrification-aerobic denitrification was isolated from an aeration tank of a medium-sized pig factory in Nanchang County. The strain YZ-12 was identified as Klebsiella oxytoca by 16S rRNA gene sequence analysis. And its nitrification and denitrification abilities were tested. The results showed that the ammonia nitrogen removal efficiency reached above 96% in the nitrification medium with the initial ammonia nitrogen concentration of 100 mg·L−1, and the nitrate nitrogen removal efficiency reached above 99% in the denitrification medium with the initial nitrate nitrogen concentration of 400 mg·L−1. Meanwhile, the accumulation of ammonia nitrogen and nitrate nitrogen did not occur. In addition, the effects of five factors (including carbon source, nitrogen concentration, carbon to nitrogen ratio, pH, and salinity) on denitrification efficiency of the strain YZ-12 were investigated, respectively. The optimum denitrification conditions were as follows: C/N ratio of 10, pH 7, salinity less than or equal to 10 g·L−1, ammonia nitrogen concentration less than or equal to 150 mg·L−1, nitrate nitrogen concentration less than or equal to 450 mg·L−1, sucrose as the optimal carbon resource. The carbon nitrogen ratio of aquaculture wastewater was adjusted to 10 with sucrose, and 5% strains was added for denitrification, the removal rates of ammonia nitrogen and nitrate nitrogen for sterilized aquaculture wastewater were 95.15% and 99.69%, respectively. -

-
-
[1] JUN K I, ABRAHAM A, CHOI O, et al. Aerobic denitrification by a novel Pseudomonas sp. JN5 in different bioreactor systems[J]. Water-Energy Nexus, 2019, 2(1): 37-45. doi: 10.1016/j.wen.2020.02.001 [2] MAN X T, LIN H, SUN J. Review on the development of new technology of biological nitrogen removal from sewage[J]. International Journal of Environmental Protection and Policy, 2017, 5(6): 99-99. doi: 10.11648/j.ijepp.20170506.13 [3] GUPTA R K, PODDAR B J, NAKHATE S P, et al. Role of heterotrophic nitrifiers and aerobic denitrifiers in simultaneous nitrification and denitrification process: A non-conventional nitrogen removal pathway in wastewater treatment[J]. Letters in Applied Microbiology, 2021, 8: 1-54. [4] SONG T, ZHANG X, LI J, et al. A review of research progress of heterotrophic nitrification and aerobic denitrification microorganisms (HNADMs)[J]. Science of the Total Environment, 2021, 801: 149319. doi: 10.1016/j.scitotenv.2021.149319 [5] 陈均利, 张树楠, 戴桂金, 等. 同步硝化反硝化菌(Alcaligenes faecalis WT14)养殖污水脱氮效果研究[J]. 农业环境科学学报, 2020, 39(8): 1811-1817. doi: 10.11654/jaes.2020-0325 [6] XIE F, THIRI M, WANG H. Simultaneous heterotrophic nitrification and aerobic denitrification by a novel isolated Pseudomonas mendocina X49[J]. Bioresource Technology, 2020, 319: 124198. [7] QIAO Z X, SUN R, WU Y G, et al. Characteristics and metabolic pathway of the bacteria for heterotrophic nitrification and aerobic denitrification in aquatic ecosystems[J]. Environmental Research, 2020, 191: 110069. doi: 10.1016/j.envres.2020.110069 [8] SHO D M, ISHIKAWA Y. Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge by Alcaligenes faecalis strain No. 4[J]. Journal of Bioscience & Bioengineering, 2014, 117(6): 737-741. [9] SILVA L, LIMA H S, SARTORATTO A, et al. Effect of salinity in heterotrophic nitrification/aerobic denitrification performed by acclimated microbiota from oil-produced water biological treatment system[J]. International Biodeterioration & Biodegradation, 2018, 130: 1-7. [10] ZHAO T T, CHEN P P, ZHANG L J, et al. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. TAC-1 at low temperature and high ammonia nitrogen[J]. Bioresource Technology, 2021, 339: 125620-125620. doi: 10.1016/j.biortech.2021.125620 [11] CHEN X, ZHANG Q, ZHU Y, et al. Response of wastewater treatment performance, microbial composition and functional genes to different C/N ratios and carrier types in MBBR inoculated with heterotrophic nitrification-aerobic denitrification bacteria[J]. Bioresource Technology, 2021, 336: 125339-125339. doi: 10.1016/j.biortech.2021.125339 [12] HUNG S J, MITSUYO H, MAKOTO S. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4[J]. Journal of Bioscience and Bioengineering, 2005, 100(2): 184-191. doi: 10.1263/jbb.100.184 [13] HUANG F, PAN L Q, LV N, et al. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2017, 124(5): 564-571. doi: 10.1016/j.jbiosc.2017.06.008 [14] CHEN L F, LIN J Q, PAN D, et al. Ammonium removal by a newly isolated heterotrophic nitrification-aerobic denitrification bacteria Pseudomonas Stutzeri SDU10 and its potential in treatment of piggery wastewater[J]. Current Microbiology, 2020, 77: 2792-2801. doi: 10.1007/s00284-020-02085-1 [15] CHEN H J, ZHOU W Z, ZHU S N, et al. Biological nitrogen and phosphorus removal by a phosphorus-accumulating bacteria Acinetobacter sp. strain C-13 with the ability of heterotrophic nitrification-aerobic denitrification[J]. Bioresource Technology, 2020, 322: 124507-124507. [16] 杨静丹, 祝铭韩, 刘琳, 等. 异养硝化-好氧反硝化菌HY3-2的分离及脱氮特性[J]. 中国环境科学, 2020, 40(1): 294-304. doi: 10.3969/j.issn.1000-6923.2020.01.033 [17] AN Q, ZHOU Y, ZHAO B, et al. Efficient ammonium removal through heterotrophic nitrification-aerobic denitrification by Acinetobacter baumannii strain AL-6 in the presence of Cr(VI)[J]. Journal of Bioscience and Bioengineering, 2020, 130(6): 622-629. doi: 10.1016/j.jbiosc.2020.07.010 [18] 陈猛, 李安章, 张明霞, 等. 一株异养硝化-好氧反硝化菌的分离鉴定及其对养殖废水中氮的去除特性[J]. 农业资源与环境学报, 2020, 37(2): 270-279. [19] 邹艳艳, 张宇, 李明智, 等. 一株异养硝化-好氧反硝化细菌的分离鉴定及脱氮活性研究[J]. 中国环境科学, 2016, 36(3): 887-893. doi: 10.3969/j.issn.1000-6923.2016.03.034 [20] 黄廷林, 张丽娜, 张海涵, 等. 一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性[J]. 生态环境学报, 2015, 24(1): 113-120. [21] LIU J F, ZHOU T, LIU Z H, et al. Screening and identification of a new heterotrophic nitrifying bacteria and characterization of nitrification[J]. Environmental Science & Technology, 2014, 37(8): 99-103. [22] 翁梓航, 吕红, 周集体. 异养硝化-好氧反硝化菌的脱氮性能研究进展[J]. 工业水处理, 2017, 37(3): 21-25. doi: 10.11894/1005-829x.2017.37(3).005 [23] 丁钰, 张婷月, 黄民生, 等. 好氧反硝化菌及其在污水处理和环境修复中的研究进展[J]. 华东师范大学学报(自然科学版), 2018(6): 7-17. [24] 郑冰冰, 吴怡伟, 李云辉, 等. 不同碳氮比对海水养殖废水脱氮效果的影响[J]. 环境科学研究, 2020, 33(8): 1848-1856. [25] 杨婷, 杨娅, 刘玉香. 异养硝化-好氧反硝化的研究进展[J]. 微生物学通报, 2017, 44(9): 2213-2222. [26] 胡杰, 颜家保, 霍晓琼, 等. 低C/N比异养硝化-好氧反硝化菌筛选及硝化特性[J]. 化工进展, 2019, 38(3): 427-432. [27] TIMMERMANS P, HAUTE A V. Denitrification with methanol-fundamental study of the growth and denitrification capacity of Hyphomicrobium sp[J]. Water Research, 1983, 17(10): 1249-1255. doi: 10.1016/0043-1354(83)90249-X [28] PAN Z L, ZHOU J, LIN Z Y, et al. Effects of COD/TN ratio on nitrogen removal efficiency, microbial community for high saline wastewater treatment based on heterotrophic nitrification-aerobic denitrification process[J]. Bioresource Technology, 2020, 301: 122726. doi: 10.1016/j.biortech.2019.122726 [29] 邹玉兰, 王莹, 陈虎, 等. 恶劣环境下异养硝化-好氧反硝化菌的研究进展[J]. 工业水处理, 2020, 40(12): 8-13. [30] SIVAPRAKASAM S, MAHADEVAN S, SEKARS, et al. Biological treatment of tannery wastewater by using salt-tolerant bacterial strains[J]. Microbiology and Immunology, 2008, 7(1): 15-15. [31] MENG L Q, LI W G, ZHAO Y, et al. Insights into influences of sucrose amendment on nitrification and denitrification in sewage sludge composting[J]. Chemosphere, 2021, 276: 130245. doi: 10.1016/j.chemosphere.2021.130245 [32] 陈均利, 彭英湘, 罗沛, 等. 异养硝化-好氧反硝化菌的脱氮特性及其对猪场废水处理的研究[J]. 环境污染与防治, 2021, 43(3): 295-299. -













 下载:
下载: