-
随着工农业的发展,重金属污染对环境造成了严重威胁,逐渐受到广泛关注。2014年发布的《全国土壤污染状况调查公报》[1]显示,土壤重金属污染区域遍布全国各地,工矿废弃地等土壤环境问题尤其突出,是造成土壤重金属含量超标的主要原因。其中镉(Cd)是土壤重金属污染的主要元素之一,造成的危害已非常严重,对土壤重金属Cd污染的治理和修复是当前环境污染治理的突出任务[2]。
目前,用于治理和修复重金属污染土壤的方法有很多,如物理、化学和生物技术,但均具有一定的局限性,如费用高、降低土壤活性及破坏土壤理化性质等[3]。植物修复(Phytoremediation)是指利用超富集植物有选择地去除并回收重金属,于1983年被CHANEY et al[4]首次提出,由于具有成本低、环保、可维持土壤活性和防止水土流失等优点而受到广泛关注。目前已发现对Cd具有超富集能力的植物多为草本植物(如东南景天、拟南芥等),这些草本植物由于个体矮小、生长缓慢、生物量少、根系单一等缺点,且对重金属迁移量不高,导致修复周期变长,无法高效解决土壤污染问题。树木修复(Dendroremediation)由美国密歇根州立大学的学者在植物修复的基础上于2001年首次提出,指利用木本植物对污染环境进行修复,树木主要通过提取(Extraction)、固定(Stabilization)和挥发(Volatilization)等方式对土壤和污水中的重金属、有机物等污染物进行净化[5]。其中,重金属的树木提取修复(Dendroextraction)是利用木本植物,特别是速生、具有较高累积性能的木本植物通过其根部从土壤和污水中吸收重金属并将它们转移、蓄积到树木其他部位,以减弱乃至消除重金属污染[6-7]。与草本植物相比,速生树木具有生长迅速、根系深、生物量大、寿命长和管理方便等优势,因而具有更大的吸收总量以及更高的综合效益[7]。树木提取修复被认为是低投资、可持续及生态安全的绿色高效治理技术,具有广阔的应用前景[8-9]。对于Cd的树木提取修复,国内外研究的树种主要集中在柳树、杨树、桦树、松树和槭树等[7,9]。从应用的角度来说,选出适合当地环境,又有较高富集能力的树木品种,是推广这项技术的一个重要环节,目前这方面的研究还比较缺乏[8,10]。
安徽省铜陵市位于长江中下游,是南方重要的矿业型城市之一,以采矿和有色金属冶炼而闻名,但也因矿区的开采、冶炼,不仅使矿区和冶炼场地土壤受到重金属严重污染,而且由于洪水泛滥、污灌和大气沉降等使更多的土壤受到不同程度的污染,严重影响土地耕作和植被生长,同时也对附近居民及生态系统安全造成很大的威胁,因此急需具有实用性的各类治理和修复技术。本文通过对铜陵某矿区及下游流域人工林杨树及土壤进行采样,测定土壤和杨树各部位的重金属含量,研究杨树提取修复实际污染土壤重金属Cd的性能,为该地及相似环境条件下土壤Cd污染的杨树提取修复设计提供科学依据。
-
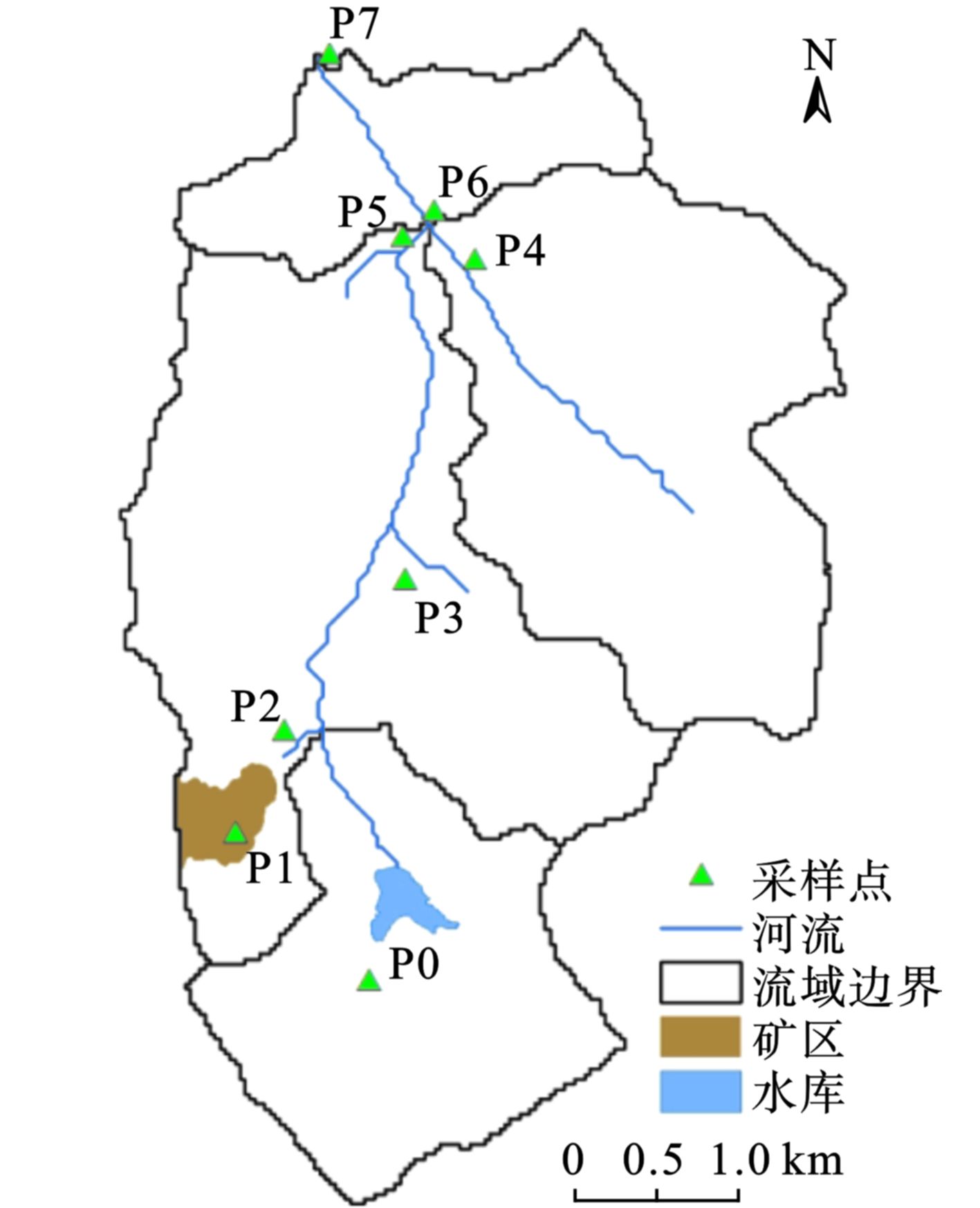
研究区位于安徽省铜陵市某硫铁矿及其所在的小流域,见图1,总面积为20 km2,平均海拔49.5 m,土壤类型为黄棕壤,气候为亚热带湿润季风气候,年均气温17 ℃,年均降水量1370 mm,目前生产活动以农业和林业为主。20世纪80年代中期开始开采,采矿、洗矿产生的废水通过支流汇入下游河流。30多年来,因洪水泛滥、污溉等导致沿河土壤重金属污染。另外,在矿区开采时期大气沉降也可能是土壤污染的原因。虽目前该矿已停产近6年,但矿区地面因长期洗矿活动,在降雨径流的冲刷下仍有污染输出。
本实验对流域内共8个采样点的人工林美洲黑杨(Populusdeltoides W. Bartram ex Marshall)和立地土壤进行了采样。在矿区设立采样点1个(P1),沿河往下游设立6个采样点(P2~P7),其中P2、P5、P6和P7点在矿区下河流干流附近,而P3和P4点位在河流东边2个主要支流的沿岸,其中P3点位所在的支流位于河流的中上游,而P4点位所在支流位于河流的下游。此外,在河流源头水库附近设一个采样点(P0)为对照。
-
在每个采样点,随机选取3~4颗杨树,分别采集杨树的树根、树干、树枝、树皮和树叶5个部位的植株样。其中树根样的获取是在土壤取样时同时获得;采用生长锥取大约在胸径部位的树干木材样;用高枝剪截取树的枝丫部分,获取枝样和叶样;树干和树枝的树皮混合为树皮样。样品分别用自来水和去离子水冲洗干净,去除杂物,将杨树各部位样品分别放入烘箱中于60 ℃烘干至恒重,用剪刀剪碎,研钵和球磨仪磨碎,过250 μm筛,装袋密封,注明样品编号。杨树各部位Cd含量采用TAS990 GF石墨炉原子吸收分光光度计(北京PERSEE通用仪器有限公司)测定,参照标准《饲料中镉的测定-石墨炉原子吸收光谱法:DB 34/T1037—2009》。
-
人工林杨树立地土壤采样参照《土壤环境检测技术规范:HJ 166—2004》,在杨树周围随机选取3~5处,用土钻获取表层土(0~50 cm)和深层土(50~100 cm)等量混合,按四分法获取约1 kg土样,装袋带回。样品在室内风干,去除杂物,磨碎过150 μm筛后装入样品袋,进行编号。采用常规方法测量土壤基本理化性质(pH、有机质、全氮、有效磷和速效钾)[11],土壤重金属Cd含量采用TAS990 GF石墨炉原子吸收分光光度计(北京PERSEE通用仪器有限公司)测定,参照标准《土壤质量 铅、镉的测定 石墨炉原子吸收分光光度法:GB/T 17141—1997》。
-
生物富集系数(BCF)是植物体内重金属含量与相应的土壤重金属含量之比,转运系数(TF)指植物地上部分重金属含量与地下树根部重金属含量之比,见式(1~2)[12]:
式中,C植株表示植株(地上或地下部分)中的Cd含量,mg/kg;C土壤表示土壤中的Cd含量,mg/kg;C地上部分表示植株地上部分的Cd含量,mg/kg;C地下部分表示植株地下部分的Cd含量,mg/kg。
利用Excel 2013和Origin 2017等进行数据计算、统计与绘图,数据分析采用SPSS软件进行双因素方差分析,比较杨树不同部位、不同土壤Cd浓度之间差异的显著性。
-
采样点土壤基本理化性质和Cd含量,见表1。各采样点土壤pH值介于4.84~6.66之间,均值为5.79,整体呈弱酸性,土壤营养成分可满足杨树生长的需要。采样点土壤Cd含量范围为0.32~33.87 mg/kg,平均含量为5.30 mg/kg,差异十分明显,参照《土壤环境质量农用地土壤污染风险管控标准:GB 15618—2018》可知,土壤Cd含量均超过农用地土壤污染风险筛选值(0.3 mg/kg),超标率达100%,土壤污染总体表现出较为严重。
表1可知,Cd含量最大值位于矿区P1点位,达33.87 mg/kg,显著高于其他点位,重金属Cd污染最为严重。从矿区至下游,即从P2到P5、P6和P7点位,土壤Cd含量逐渐增大。P2点位距离矿区最近,但由于位于上游,坡度较大且支流的汇水面积小,水患较少,从而对附近土壤的污染并不明显。但到了下游,随着地势变平缓,河流的水量增大,水患泛滥的频次和程度增加,矿区暴露土层和运行期间的洗矿废水Cd含量很高,且多以离子形态存在,易吸附在土壤颗粒上,随河水迁移、泛滥[13-14],导致下游附近土壤Cd含量逐渐增大。Cd含量最小值位于不受河水泛滥和灌溉影响的源头水库附近的P0点,其次为位于河流上游一小支流下游附近的P3点,这2处的Cd含量略高于农用地土壤污染风险筛选值(0.3 mg/kg,GB 15618—2018)。河流下游一较大支流的P4点,Cd含量为0.77 mg/kg,由于该点位于下游,距离干流很近,加上地势低,大洪水期间干流的水流会跨过子流域边界淹没东边子流域的下游地区,造成该地区的土壤污染。总体来说,8个采样点可分为Cd含量很高的矿区(P1)、受污染河水泛滥和灌溉影响的区域(P2、P4、P5、P6和P7)和可能受大气沉降和人类活动影响的区域(P0和P3)。
-
各采样点杨树不同部位Cd含量值介于0.99~42.10 mg/kg之间,相差较大,杨树各部位Cd含量的标准差范围在10%~118%之间,表明同一采样点不同杨树相同部位对Cd的吸收和富集有较大的个体差异,这可能与特定的立地条件,如光照或个体树木的生长情况有关,见表2。
表2可知,杨树各部位Cd含量在不同采样点差别也很大,其最大值是最小值的3.1(树枝)~27.5(树根)倍,各点均值和中位数值差别较大。这首先是因为不同点土壤Cd含量不同(见表1),土壤Cd含量比较高的P1和P7点位的杨树各部位Cd吸收和富集的量也相对较大,但最大值不在P1而在P7点位,这可能是因为在P1点位矿区土壤Cd浓度过高,一定程度上抑制了杨树的吸收作用[15]。P7点位杨树各部位对Cd的吸收量在所有点中均为最高,这一方面可能是由于Cd含量在该浓度范围的土壤更有利于Cd的吸收[16],另一方面也可能与下游P7点特定的立地条件有利于杨树的生长及Cd的吸收和富集有关。另外,P1点土壤污染非常严重,但杨树依然可以生长,且具有较高的Cd吸收和富集量,说明杨树不仅对Cd耐受性较强,同时也能较好地吸收和富集Cd。其他各点位土壤Cd含量相对较低,杨树各部位Cd含量和土壤Cd含量没有确定的关系。总体来说,杨树对Cd的吸收量和土壤Cd含量有关,但不完全成正比增加,这可能是野外条件下其他因素的影响所致,这和李金花等[17]对野外杨树林地的研究结果相似。
从杨树各部位Cd含量均值来看,杨树不同部位对Cd的吸收量总趋势为:树根>树叶>树皮>树干>树枝,根部对Cd的吸收能力最强,Cd含量最高,达到了12.37 mg/kg,其次是树叶,Cd含量为11.21 mg/kg;从杨树各部位Cd含量中值来看,杨树不同部位对Cd的吸收量总趋势为:树叶>树皮>树根>树干>树枝,树叶对Cd的吸收能力最强,达到了8.26 mg/kg,而树根为3.20 mg/kg。总体来看,树根对Cd吸收量差异大,而树叶表现出相对较稳定且很强的Cd吸收和富集量,因此中值更能反应杨树对Cd吸收富集的情况。Cd首先进入根部,并暂时累积在其中,进入到杨树体内的Cd,在其强大的蒸腾作用下,随着水分和所需的矿物质元素一起通过树木内部的导管、纹孔和薄壁细胞等构造分子运输到树木内部、树枝、树皮和树叶中[16-18]。树叶处在蒸腾流上移的终端位置,加上树叶中有较多的氨基酸等成分,这些化学物质与Cd离子能够结合,生成稳定的络合物,导致树叶中的Cd含量不断增加[18-19]。树皮组织中富含有助于与二价离子结合的萜类、软木脂、脂肪酸酯和氨基酸等物质,也能富集较多的Cd[16]。而树干和树枝中,主要为纤维素、半纤维素和木质素,其他物质的含量较少,相对不易与二价离子结合[17]。所以,树根、树皮和树叶总体表现出较高的Cd含量,而只有少部分累积在树枝和树干中。
-
BCF能够反映杨树从土壤中吸收、富集重金属Cd的能力,其值越大,则表明杨树对Cd的富集能力越强。不同采样点杨树不同部位BCF介于0.06~19.39之间,同一采样点杨树各部位BCF的标准差范围在10%~118%之间,虽然差异很大,但BCF>1的占比为75.83%,总体表现出较高的富集能力,见表3。
李金花等[17]在野外杨树林试验中发现,在Cd含量低于土壤背景值土壤上生长的杨树叶片对Cd的BCF在1.36~16.28之间,叶片中Cd吸收量与土壤中Cd含量没有显著相关性。RONG et al[16]计算了盆栽试验中在0~100 mg/kg Cd处理土壤中生长的一年直立杨树各部位的BCF在0.08~1.05之间,杨树不同个体、不同部位之间BCF也表现出较大差异性,通过与本试验结果做比较,表明在实际污染土壤中,杨树对Cd总体表现出更强的富集能力,这可能是由于野外实际的立地条件更有利于树木的生长。本试验较高的富集能力可能也与土壤偏酸性有关,许多研究表明酸性土壤有利于植物吸收Cd,而碱性土壤会限制植物对Cd的吸收[10,20]。在不同采样点,杨树各部位BCF的最大值是其最小值的34.6(树根)~84.7(树枝)倍,表现出比Cd含量更大的差异(表2和表3)。杨树各部位BCF的最高值分别出现在土壤Cd含量较低的3个采样点,即P0、P3和P4,而最低值都在P1点位,这是由于BCF是杨树不同部位Cd含量与土壤Cd含量的比值。虽然杨树对重金属Cd的吸收总体与土壤中Cd含量有关,但并不成比例增加。P7点位树干、树皮和树叶的BCF基本反映了在该流域实际污染土壤下杨树的吸收富集重金属的能力见表3,但树根的吸收累积能力更大,可能与杨树特定的生长时期有关,被吸收进入根部的Cd,有待进一步迁移至植物的不同部位累积。
表3可知,由于各部位BCF值差异较大,且受异常高值的影响,均值普遍略高于中值。但无论从均值还是中值来看,杨树不同部位对Cd的平均BCF大小均为:树叶>树皮>树根>树干>树枝,这与RONG et al[16]的研究结论一致。树叶总体表现出很高的富集能力,达到8.55,其次是树皮和树根,而树干和树枝最低,但中值也分别达到2.42和1.33,表明杨树各部位对Cd的富集能力总体较强。
-
TF用于评估植物从根部向地上部分迁移并积累重金属的能力,TF数值越高,表示重金属从地下部分向地上部分运输能力越强。不同采样点杨树不同部位TF介于0.09~12.27之间,TF>1的占比为53.6%。杨树各部位TF的标准差范围在38%~127%之间,也表现出同一采样点同一部位不同杨树TF值的个体差异,见表4。
在不同采样点,杨树各部位TF的最大值是其最小值的6.4(树干)~13.9(树叶)倍,不同采样点杨树各部位TF的差异均比BCF的小见表3和4。P7和P4点位树根Cd平均含量高,杨树各部位TF平均值﹤1。P1点位杨树树根Cd含量差异很大见表2,导致不同杨树各部位TF的巨大差异,特别是树皮和树叶TF见表4。不同采样点杨树TF随土壤中Cd浓度变化规律性不明显,这与WU et al[12]对杨树的研究中TF随土壤Cd浓度变化趋势类似。
表4可知,杨树地上部分各部位TF均值也普遍略高于中值,总体来看,杨树地上不同部位TF大小均为树叶>树皮>树干>树枝。树叶和树皮的TF>1,而树干和树枝的TF﹤1。其中树叶的转运能力远高于其他部位,最高值达到了12.27,这是由于进入根部的Cd在强大蒸腾作用下,往地上部分迁移,最终累积在叶片[6]。
-
通过结果分析可知,即使在受到严重污染的土壤条件下,杨树各部位对Cd也表现出较高的吸收富集能力,这表明杨树对重金属Cd具有强耐受性,在提取修复Cd污染土壤上具有较大潜力。
为进一步探讨利用杨树对污染土壤进行提取修复的可能性,根据本研究中杨树在实际污染土壤条件下对Cd的吸收富集能力,参照杨树生物量等信息计算通过杨树吸收富集土壤中的Cd,并将其移出土壤植物系统,使其土壤Cd含量达到土壤环境质量相应标准所需的年限。根据矿区流域土壤污染特征,选择2种污染程度的土壤,即以矿区为代表的高污染区,Cd含量为33.87 mg/kg和下游河岸带土壤,Cd含量为1.37 mg/kg,拟修复达到农用地土壤污染风险筛选值0.3 mg/kg。由于杨树生长受重金属影响不显著[16],参考相似环境条件下相同品系7年杨树成材时的总生物量1.32×105 kg/hm2,树根占14.3%、树干55.2%、树枝12.9%、树皮5.7%和树叶11.9%[21]。杨树落叶每年收集并移出系统,参考赵英铭[22]对杨树树叶每年生物量的计算,统计7年树叶累计生物量。假设杨树各部位吸收富集Cd能力不变,计算出杨树7年中可吸收并移出系统Cd总量,不断循环种植修复。修复年限[23]=[(土壤当前Cd含量−土壤目标Cd含量)×1 hm2土壤重量]/1 hm2土壤可移除的Cd含量。对上述2种污染程度的土壤,计算得出最终修复时间分别约为389年和16年。假如只需将矿区重污染土壤修复到建设第一类用地土壤污染筛选值标准(20 mg/kg)[24],则所需的修复时间约为161年。
土壤一旦被污染,通过植物提取修复达到标准的周期是相当漫长的[25]。虽然如此,利用杨树进行重金属污染土壤的提取修复具有很好的生态环境效益和经济效益。首先,在树木提取修复的过程中,不加任何化学药剂,没有二次污染和破坏土壤结构和质地的风险,在秋季落叶时只要及时对杨树叶进行收集和处理,就可避免Cd再次回到土壤。其次,杨树可增强杨树根系与土壤间的凝聚力,提高土壤涵养水源能力,防止水土流失,利于稳定土层的形成,杨树还有很好的绿化、固碳等功能。在经济效益方面,杨树是速生树种,生长快、成材早,属于木材产量较高的树种,可与林业木材生产相结合,将收获的杨树作为材料或能源资源,能带来很好的经济效益。另外,确定杨树最佳轮作周期对提升杨树富集和转运重金属效率也有重要参考作用。
在未来的研究中,可通过不同的技术措施提高杨树的提取修复能力,有效缩短修复年限。如利用不同杨树树种对重金属吸收富集能力不同,筛选出重金属富集能力强的杨树品种;利用基因工程和激素调控提高杨树提取修复重金属能力等。此外,还可以利用杨树和具有超累积能力的草本植物进行复合种植来提高提取修复效率。
-
(1) 矿区流域土壤Cd污染程度不同,总体比较严重,其中矿区土壤Cd含量最高,达到33.87 mg/kg,其下游各点主要受洪水泛滥或灌溉的影响,土壤Cd含量介于0.75~3.62 mg/kg之间,呈现出往下游加重的趋势。而河流源头和上游支流等不受矿区直接影响采样点土壤Cd含量最低,为0.32 mg/kg和0.34 mg/kg,说明矿区流域土壤Cd污染主要来源于矿区。
(2) 杨树在Cd含量很高的矿区和Cd含量相对较低的其他地区都能很好地生长,且总体表现出较高的Cd吸收量,位于最下游的采样点杨树各部位吸收量都最高,其中地上部分Cd最高含量在树叶,达35.34 mg/kg。
(3) 不同采样点杨树不同部位对重金属Cd的BCF介于0.06~19.39之间,差异较大,BCF>1的占比为75.8%,杨树各部位BCF介于1.33~8.55(以中值计)之间,总体表现出较高的富集能力。不同部位对Cd的吸收量和BCF均表现为树叶>树皮>树根>树干>树枝。对Cd吸收量和富集能力最大且相对稳定的是树叶,BCF为8.55,树枝对Cd的吸收最低,但BCF总体水平也达到了1.33。在Cd高污染的矿区,杨树各部位的BCF较低,但仍具有较大的吸收量。在土壤Cd含量相对较低的采样点,杨树总体表现出较好的吸收量和富集能力。不同采样点杨树不同部位TF范围介于0.09~12.27之间,表现为树叶>树皮>树干>树枝。美洲黑杨适合于当地生长且有较高的Cd富集能力,可作为该地或相似地区污染土壤的提取修复树种。
矿区流域杨树对污染土壤镉的吸收和富集研究
Absorption and enrichment of Cd with planted poplar growing on polluted soil in a small post-mining watershed
-
摘要: 为探究污染土壤里生长的杨树提取修复重金属镉(Cd)的特性,对安徽省铜陵市某矿区及所在小流域共8个点位的人工林美洲黑杨(Populusdeltoides W. Bartram ex Marshall)及土壤进行采样,测定了土壤和杨树不同部位Cd含量。结果表明:矿区及其下游不同采样点土壤Cd污染程度不同,均超过《土壤环境质量农用地土壤污染风险管控标准:GB 15618—2018》中的农用地土壤风险筛选值0.3 mg/kg;杨树在不同污染程度的土壤上都生长良好,且整体表现出较高的吸收量,其中树叶中Cd含量总体最高;不同采样点杨树不同部位对Cd的生物富集系数(BCF)介于0.06~19.39之间,BCF>1的占75.8%,杨树各部位平均BCF介于1.33~8.55之间,不同部位对Cd的吸收量和BCF表现为树叶>树皮>树根>树干>树枝,树叶对Cd的富集能力最强也相对稳定。由于其对重金属Cd有很强的耐受性和较高富集能力,美洲黑杨可作为该地污染土壤的提取修复树种。Abstract: In order to understand the extraction characteristics of Cd by poplar growing on the polluted soil, samples of soil and various parts of poplar trees (Populusdeltoides W. Bartram ex Marshall) were sampled and analyzed for Cd from 8 sites in a small watershed with a post-mining hill area, located in Tongling, Anhui province, China. The results showed that the contamination of Cd in the soil of the different sites was different, but all of them were beyond the soil risk screening value of agricultural land, which was 0.3 mg/kg from GB 15618—2018. Poplars grew well on the soil with different pollution levels and demonstrated relatively high absorption of Cd with the highest Cd content in the leaves. The Bio-Concentration factor (BCF) of Cd in different parts of poplar at different sampling sites ranged from 0.06 to 19.39, with 75.8% of the samples having a BCF greater than 1. The average BCFs of various parts were between 1.33 and 8.55, demonstrating a high enrichment capacity. Both Cd uptake and BCF of different parts were in the order of leaf > bark > root > trunk > branch. In general, the Cd enrichment capacity by leaves was the strongest and relatively stable. Due to its strong tolerance to heavy metal Cd and high enrichment ability, populusdeltoides could be used as an extraction and remediation tree for polluted soil in this area.
-
Key words:
- Populusdeltoides /
- Cd /
- absorption /
- enrichment /
- polluted soil /
- post-mining watershed
-

-
表 1 各采样点土壤基本理化性质和Cd含量
采样点 Cd/mg·kg−1 pH 有机质/g·kg−1 全氮/g·kg−1 有效磷/mg·kg−1 速效钾/mg·kg−1 P0 0.32 5.20 19.92 1.48 9.30 62.00 P1 33.87 6.38 13.82 0.92 4.60 111.50 P2 0.75 5.70 22.28 1.58 8.10 318.00 P3 0.34 5.70 7.32 0.68 9.40 82.00 P4 0.77 5.40 19.28 1.56 6.70 92.50 P5 1.07 4.80 15.08 1.05 5.90 71.00 P6 1.68 6.70 13.63 0.99 9.20 182.50 P7 3.62 6.50 10.65 0.86 4.90 105.00 均值 5.30 5.79 15.25 1.14 7.26 128.06 中值 0.92 5.70 14.45 1.02 9.37 98.75 最大值 33.87 6.70 22.28 1.58 9.40 318.00 最小值 0.32 4.80 7.32 0.68 4.60 62.00 表 2 各采样点杨树不同部位Cd含量
mg·kg−1 采样点 树根 树干 树枝 树皮 树叶 P0 / 2.2±1.27cd 1.63±0.46bc 5.81±2.81bc 2.35±2.08d P1 19.1±22.46ab 3.69±1.32bc 2.14±0.79ab 7.78±1.64b 15.16±2.26b P2 3.20±1.13b 1.12±0.47d 0.99±0.06c 1.28±0.57d 4.33±0.94d P3 3.11±3.34b 1.04±0.38d 1.38±0.55bc 2.56±0.4d 6.49±1.9cd P4 14.93±5.58b 4.24±1.02b 2.73±0.82a 13.28±1.95a 10.03±3.50bc P5 2.65±2.76b 2.65±1.08bcd 1.43±0.58bc 6.53±1.1bc 11.04±7.04bc P6 1.53±1.01b 1.77±0.53d 1.28±0.27bc 4.03±0.65cd 4.90±0.48d P7 42.1±26.67a 8.55±1.99a 3.03±1.07a 15.91±3.17a 35.34±4.84a 均值 12.37 3.16 1.83 4.15 11.21 中值 3.20 2.43 1.53 6.17 8.26 最大值 42.10 8.55 3.03 15.91 35.34 最小值 1.53 1.04 0.99 1.28 2.35 注:Cd的平均浓度以及标准偏差(n=3),根据最小显著性差异,同一列不同字母(a、b、c和d)之间差异显著(p<0.05)。 表 3 杨树各部位对Cd的BCF
位置 树根 树干 树枝 树皮 树叶 P0 / 6.89±3.96a 5.08±1.44a 18.16±8.79a 7.33±6.49bcd P1 0.56±0.66c 0.11±0.04d 0.06±0.02c 0.23±0.05c 0.45±0.07e P2 4.26±1.51bc 1.49±0.63cd 1.32±0.08c 1.70±0.76c 5.77±1.25cde P3 9.14±9.83abc 3.06±1.11bc 4.05±1.63ab 7.52±1.18b 19.10±5.58a P4 19.39±12.44a 5.51±1.33ab 3.55±1.07b 17.24±2.53a 13.03±4.55ab P5 2.48±2.60bc 2.48±1.02cd 1.34±0.54c 6.14±1.03bc 10.37±6.61bc P6 0.91±0.60c 1.05±0.32cd 0.76±0.16c 2.40±0.38bc 2.92±0.29de P7 11.64±7.38ab 2.36±0.55cd 0.84±0.29c 4.40±0.88bc 9.77±1.24bc 均值 6.91 2.87 2.13 7.22 8.59 中位数 4.26 2.42 1.33 5.27 8.55 最大值 19.39 6.89 5.08 18.16 19.10 最小值 0.56 0.11 0.06 0.23 0.45 注:各部位的平均BCF及标准偏差(n=3),根据最小显著性差异,同一列不同字母(a、b、c、d和e)之间差异显著(p<0.05)。 表 4 杨树地上部分对Cd的TF
位置 树干 树枝 树皮 树叶 P1 0.49+0.43ab 0.29±0.25b 1.30±1.37bc 2.69±3.32b P2 0.41±0.29ab 0.34±0.13ab 0.50±0.42c 1.58±0.99b P3 1.13±1.44ab 0.92±0.85ab 1.96±1.91abc 4.66±4.46ab P4 0.39±0.30ab 0.26±0.18b 1.18±0.79bc 0.88±0.67b P5 1.73±1.40a 0.94±0.76ab 4.97±4.78a 12.27±15.49a P6 1.45±0.67a 1.18±0.76a 3.38±1.53ab 4.18±2.16ab P7 0.27±0.15b 0.09±0.09b 0.47±0.44bc 1.17±0.72b 均值 0.84 0.57 1.97 3.92 中位数 0.49 0.34 1.30 2.69 最大值 1.73 1.18 4.97 12.27 最小值 0.27 0.09 0.47 0.88 注:杨树各部位平均TF及平均偏差(n=3),根据最小显著性差异,同一列不同字母(a、b和c)表示不同采样点间差异显著(p<0.05)。 -
[1] 环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17)[2021-06-02]. http://www.gov.cn/foot/2014-04/17/content_2661768.htm. [2] 顾继光, 周启星. 镉污染土壤的治理及植物修复[J]. 生态科学, 2002(4): 352 − 356. doi: 10.3969/j.issn.1008-8873.2002.04.017 [3] DERMONT G, BERGERON M, MERCIER G, et al. Soil washing for metal removal: a review of physical/chemical technologies and field applications[J]. Journal of Hazardous Materials, 2008, 152(1): 1 − 31. doi: 10.1016/j.jhazmat.2007.10.043 [4] CHANEY R L, MLI Y M, BROWN S L, et al. Phytoremediation of soil metals[J]. Current Opinion in Biotechnology, 1997, 8(3): 279 − 284. doi: 10.1016/S0958-1669(97)80004-3 [5] 张东为, 崔建国, 戈素芬, 等. 土壤镉污染对不同品种杨树生长状况的影响[J]. 水土保持通报, 2008(3): 59 − 64. [6] PULFORD I D, WATSON C. Phytoremediation of heavy metal-contaminated land by trees-a review[J]. Environment International, 2003, 29(4): 529 − 540. doi: 10.1016/S0160-4120(02)00152-6 [7] GONZALEZ-OREJA J A, ROZAS M A, ALKORTA I, et al. Dendroremediation of heavy metal polluted soils[J]. Reviews on Environmental Health, 2008, 23(3): 223 − 234. [8] ROCKWOOD D L, NAIDU C V, CARTER D R, et al. Short-rotation woody crops and phytoremediation: Opportunities for agroforestry?[J]. Agroforestry Systems, 2004, 61: 51 − 63. [9] HE J L, MA C F, MA Y L, et al. Cadmium tolerance in six poplar species[J]. Environmental Science and Pollution Research, 2013, 20(1): 163 − 174. doi: 10.1007/s11356-012-1008-8 [10] BUDZYŃSKA S, KUBIAK A, SZOSTEK M, et al. Trees and shrubs from a post-industrial area high in calcium and trace elements: the potential of dendroremediation[J]. International Journal of Phytoremediation, 2021, 24(1): 1 − 14. [11] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. [12] WU F Z, YANG W Q, ZHANG J, et al. Cadmium accumulation and growth responses of a poplar (Populus deltoids×Populus nigra) in cadmium contaminated purple soil and alluvial soil[J]. Journal of Hazardous Materials, 2010, 177(1-3): 268 − 273. doi: 10.1016/j.jhazmat.2009.12.028 [13] 柳影, 卢维盛, 赵扬, 等. 不同污染类型水稻土中镉的化学形态分布特征及其影响因素[J]. 农业环境科学学报, 2016, 35(9): 1703 − 1708. doi: 10.11654/jaes.2016-0103 [14] 窦韦强, 安毅, 秦莉, 等. 土壤pH对镉形态影响的研究进展[J]. 土壤, 2020, 52(3): 439 − 444. [15] HU Y H, NAN Z R, SU J Q, et al. Chelant-assisted uptake and accumulation of Cd by poplar from calcareous arable soils around baiyinnonferrous metal smelters, Northern China[J]. Arid Land Researchand Management, 2014, 28(3): 340 − 354. doi: 10.1080/15324982.2013.841305 [16] RONG G, CHU Y, LIU S Q, et al. Comparison of cadmium accumulation in upright and leaning poplar trees[J]. Bioresources, 2021, 16(2): 3422 − 3436. doi: 10.15376/biores.16.2.3422-3436 [17] 李金花, 何燕, 段建平, 等. 107杨对土壤重金属的吸收和富集[J]. 林业科学研究, 2012, 25(1): 65 − 70. doi: 10.3969/j.issn.1001-1498.2012.01.012 [18] LIU X Q, PENG K J, WANG A G, et al. Cadmium accumulation and distribution in populations of Phytolacca americana L. and the role of transpiration[J]. Chemosphere, 2010, 78(9): 1136 − 1141. doi: 10.1016/j.chemosphere.2009.12.030 [19] 王书翰, 王传槐, 丁少军, 等. 欧美杨和美洲黑杨树叶化学成分的研究[J]. 南京林业大学学报, 1999, 23(4): 72 − 74. [20] SJOSTROM E. Wood chemistry: Fundamentals and applications[M]. 2nd ed. New York: Academic Press, 1993. [21] 王彦, 乔玉玲, 王桂岩. 杨树[M]. 济南: 山东科学技术出版社, 2004. [22] 赵英铭. 内蒙古磴口县新疆杨农田防护林带生物量和碳储量研究[D]. 北京: 中国林业科学研究院, 2020. [23] XIN W, JIA Y. Study on adsorption and remediation of heavy metals by poplar and larch in contaminated soil[J]. Environmental Science and Pollution Research, 2010, 17(7): 1331 − 1338. doi: 10.1007/s11356-010-0313-3 [24] 中华人民共和国生态环境部. 土壤环境质量 建设用地土壤污染风险管控标准: GB 3660—2018[S]. 北京: 中国环境出版集团有限公司, 2018. [25] ALLOWAY B J. Heavy metals in soils[M]. London: Blackie Academic and Professional, 1995. -



 下载:
下载:

