-
抗生素是由微生物(包括细菌、真菌、放线菌属)或高等动植物产生的具有抗病原体,能干扰其他细胞发育功能的化学物质,或具有其它活性的一类次级代谢产物[1]. 自1928年青霉素被发现以来,抗生素的发展史已有将近一百年,其为人类的健康及生活做出了不可磨灭的贡献. 目前抗生素类药物大致可以分为七类:β-内酰胺类、磺胺类、喹诺酮类、氯霉素类、四环素类、氨基糖苷类及大环内酯类. β-内酰胺类主要有青霉素类(青霉素、阿莫西林等)和头孢菌素类(头孢氨苄、头孢唑啉等),是临床上最常用和品种最多的抗菌药物[2];磺胺类(磺胺嘧啶、磺胺甲基嘧啶等)可用于治疗链球菌、沙门氏菌、大肠杆菌、葡萄球菌、巴氏杆菌等细菌感染疾病[3],是类广谱抗生素;喹诺酮类(恩诺沙星、氧氟沙星等)与氯霉素类(氟苯尼考、甲砜霉素等)在水产养殖行业被广泛应用[4-5],如诺氟沙星用于治疗美洲鳗鲡气单胞菌属等引起的细菌性疾病[6];四环素类(四环素、土霉素等)不仅广泛应用于细菌感染,还作为生长促进剂投喂给动物;氨基糖苷类(链霉素、卡那霉素)与β-内酰胺等抗生素具有协同作用[7];大环内酯类(阿奇霉素、罗红霉素等)对抑制革兰氏阳性菌及支原体有较高活性[8-9].
据文献报道,在2000年至2015年间,全球抗生素消费量就已经增加了65%,预测2030年全球抗生素消费量比2015年高出200%[10]. 由于畜牧业近年向规模化、集约化快速发展,使其成为抗生素消耗量较大行业,2010年抗生素在畜牧业使用量占全球抗生素年产的2/3,保守估计为6.32万t,到2030年消耗量预计增加到10.56万t[11]. 大量抗生素的使用加之抗生素不能被生物体完全吸收,导致环境及农产品中抗生素相继被检出. 为遏制抗生素污染局势的继续发展,2022年我国新出台了《新污染物治理行动方案》,将抗生素列入重点环保管控对象之一,加强临床抗菌药物及兽用抗菌药监督管理. 并力求到2025年完成一批新污染物环境风险评估[12].
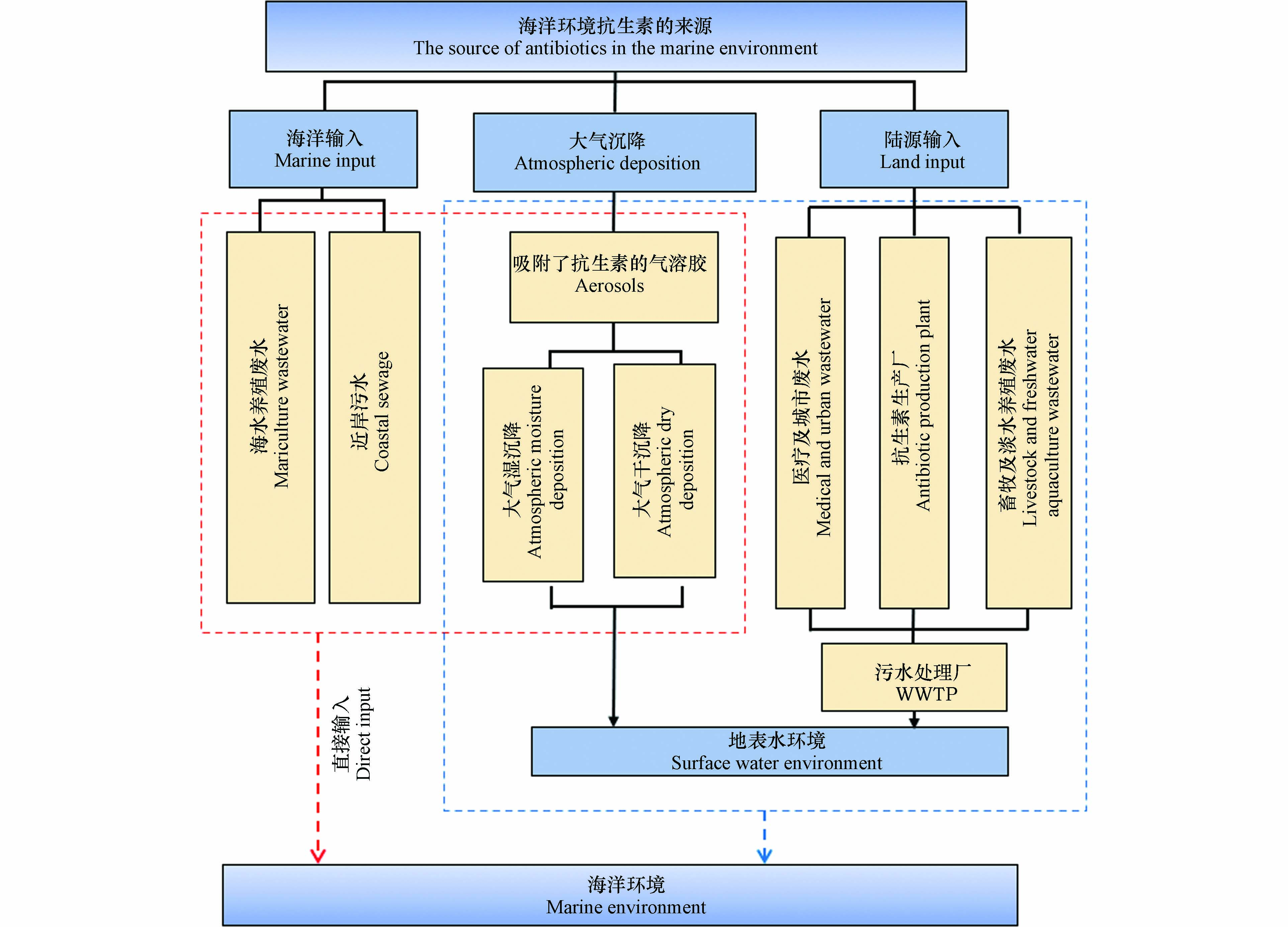
抗生素通过制药企业的工业废水、畜牧及水产养殖废水、医疗及城市污水等途径排放到环境中,经河流或城市内河道进行远距离迁移,最终汇聚于海洋,对生态环境及人类生活造成影响. 抗生素一方面可以抑制环境微生物的生长,甚至杀死微生物,改变环境微生物群落结构,破坏微生态平衡,影响海洋环境中碳、氮、硫等生源要素的地球化学循环;另一方面,海洋环境中持续存在的抗生素还可以诱导耐药菌群或抗生素抗性基因(antibiotic resistant genes,ARGs)产生,ARGs在海洋环境中的持久性残留,在菌群间的迁移、传播和扩增,对生态环境和人体健康都造成巨大威胁. 因此,本文对海洋环境中抗生素和ARGs的来源、赋存、迁移转化和生态风险进行全面综述,并对其发展趋势进行展望,以期为海洋环境中抗生素和ARGs的研究提供参考.
-
制药企业的排放是抗生素的主要来源之一,制药企业在生产抗生素的过程中会产生大量含有抗生素的废水. 某些抗生素制造企业排放的废水中抗生素的含量甚至可达mg·L−1[13-14]. 废水生化处理单元中的微生物对抗生素的降解具有一定的限度,如Guo等[15]发现,当阿莫西林浓度达到650 mg·L−1时,污水处理过程则完全不能去除该抗生素. 在抗生素生产过程中产生的废渣及过期药物处置过程中,有一些抗生素也不能被完全去除,且抗生素未被纳入现有的污水排放标准中,导致制药企业所产生的含有抗生素的废水排放到水环境中,据报道现有的污水处理工艺只能去除36%—79%的抗生素[15],抗生素随着污水处理厂出水口流入地表水环境,并最终通过河流输入和地表径流等途径进入海湾和近岸环境,给海洋生态环境带来巨大的压力.
-
海洋环境中抗生素污染的另一重要来源是人用抗生素排放. 据报道,发展中国家中对44%—97%的住院患者所开具的抗生素处方是不必要的[16],抗生素的滥用导致抗生素污染加剧. 抗生素在生物体内不能被完全代谢吸收,约有50%—80%的抗生素会以原药和代谢产物的形式通过粪便、尿液等排出体外[17]. 大部分含有抗生素的人类排泄物会进入污水处理厂,但由于污水处理工艺水平的限制,抗生素并不能被完全去除而进入水环境中. 另外,在部分地区,含有抗生素的排泄物会以有机肥的形式进入土壤环境中. 上述进入水环境的抗生素,可通过地表径流、地下水循环等途径进入海洋环境中,而土壤环境中的抗生素也可通过雨水冲刷、地下水等进入海洋环境,导致海洋环境成为了抗生素污染的“汇”.
-
在规模化养殖过程中,抗生素除了被用作治疗和预防细菌感染的药物外,还常被作为促生长剂添加到饲料中[18]. 因此,在禽畜养殖过程中会产生大量含有抗生素的废水和动物排泄物. 由于污水处理厂处理工艺和经济发展水平的限制,大量含有残留抗生素的污水会被排放到水环境中,最终通过河流输入或非点源排放汇入海洋环境中. 另外,淡水水产养殖被认为是海洋环境中抗生素污染的另一重要来源. 在淡水养殖中抗生素作为饲料添加剂被直接投加到水中,在一定范围内起到了杀菌抑菌的的效果. 但是,抗生素的过量投放造成了淡水养殖环境水体、沉积物和水生生物中抗生素的残留. 目前,已有多项研究表明,淡水养殖环境中抗生素的残留问题不容忽视. 如在天津近郊地区淡水养殖水体的表层水和沉积物中典型抗生素的残留分析研究表明,淡水养殖水体中磺胺类和喹诺酮类抗生素残留水平达μg·L−1[19]. 而对泰国的Tha Chin和Mu河水和沉积物中抗生素的检测结果表明,水体中土霉素和恩诺沙星的峰值分别达49 μg·L−1和1.6 μg·L−1,而沉积物中土霉素和恩诺沙星的峰值分别达6908 μg·L−1和2339 μg·L−1[20]. 淡水养殖厂一般位于河流、湖泊附近,淡水养殖过程中抗生素的使用不可避免的对地表水环境造成影响. 这些残留在地表水环境中的抗生素,可通过河流输入、地下水等方式进入海洋环境,成为海洋环境中抗生素的主要来源之一.
-
有机污染物进入环境后可吸附在气溶胶中,然后通过不同类型的大气沉降方式进入地表和水体环境中. 近岸海洋环境是生物圈、大气圈和水圈交汇、活动最剧烈的区域,因此大气沉降也是海洋环境中抗生素的一个重要来源[21]. 抗生素的大气沉降主要有两种方式,一种是通过雨、雪等形式的大气湿沉降,另一种则是气溶胶干沉降. 先前的研究通过计算水、沉积物和空气中抗生素到水环境的传输速率发现,大气颗粒相的干沉降通量在相同时间内高于引水和沉积物,这说明大气沉降是抗生素在环境中传输的重要方式. 陈畇岐等[22]在珠江口地区大气和雨水中均检测到了抗生素. 而彭全材等[23]通过对胶州湾地区降雪中的新型药物活性化合物进行检测发现,抗生素是最主要的类型,其中四环素的残留的最高浓度达到1500 ng·L−1,这表明抗生素更易残留在降雪中,通过大气湿沉降的方式进入海洋环境. 因此,抗生素的大气沉降可以被认为是海洋环境中抗生素的又一来源.
-
抗生素除了可以通过陆源输入、大气沉降等间接方式进入海洋环境外,还可以通过直接输入的方式进入海洋环境. 海水养殖业的发展缓解了人类对水产品的需求和天然渔业资源日益枯竭之间的矛盾,但集约化养殖密度大,水生生物疾病频发,死亡率不断升高. 为了预防和治疗养殖品的细菌性感染疾病并促进养殖品的生长,抗生素被广泛应用于海水水产养殖活动中. 但是,由于海水养殖水体和海水具有连通性,海水养殖给药后抗生素并不能被很好的利用. 抗生素最终被释放到周围的海水水体或养殖区的沉积物中,并持续迁移扩散,最终成为海洋环境中抗生素的主要来源之一. 海洋环境中抗生素的浓度水平受到水产养殖活动强弱的影响,如在北部湾地区海水养殖池的抗生素的浓度水平在43.2—885 ng·L−1之间[24],而对海陵岛海水养殖厂抗生素的污染水平调查发现[25],土霉素的浓度高达15163 ng·L−1. 可见,水产养殖活动强的地区,抗生素的残余浓度远超其他地区,对海洋区域的生态环境造成了巨大威胁. 另外,近岸水域受到人类活动的强烈影响. 在人类生产生活活动中使用的抗生素会随着污水等,直接排放到近岸海域,使得抗生素的浓度升高.
综上所述,海洋环境中的抗生素主要来源于陆源输入、大气沉降和海洋输入. 其中陆源输入是海洋环境中抗生素的主要来源,对海洋环境中抗生素的贡献最大. 其次是海洋输入,海水水产养殖和近岸输入对海洋环境中的抗生素有较大贡献. 无论是大气干沉降还是大气湿沉降都对抗生素的稳定性有较高要求,但是由于抗生素本身结构不稳定,大气沉降对海洋环境中抗生素的贡献相对较小(图1).
-
统计2007至2022年国内外报道四大洲(亚洲、欧洲、北美洲,南极洲)11个国家及部分公海海洋环境中检测的抗生素数据(表1),海洋环境中抗生素普遍存在,其中磺胺类和大环内酯类是最普遍检出的抗生素,浓度量级为ng·L−1—μg·L−1(0.040—73722 ng·L−1). 但各大洲检测到抗生素种类及浓度含量有所差异,且可检测到的抗生素种类及含量很大程度上取决于当地社会经济发展水平[46]. 欧洲海域除波罗的海南部海域外普遍抗生素含量较低,处于ng·L−1级别,抗生素检出类型多以磺胺类、大环内酯类及其他类的甲氧苄啶为主. 北美洲美国海域中抗生素含量较低,为ng·L−1级,主要为磺胺类、大环内酯类及少量喹诺酮类抗生素. 其中,哥斯达黎加检测到较高浓度抗生素,达到μg·L−1级别,最高为四环素类抗生素强力霉素,含量高达73722 ng·L−1,β-内酰胺类抗生素苯甲异噁唑青霉素达7571 ng·L−1. 除此之外,即使是人迹罕至的南极洲地区也不能幸免,在南极洲地区也检测到抗生素残留,喹诺酮类抗生素环丙沙星含量相对较高,为4—218 ng·L−1.
相较于其他国家,我国海洋环境中抗生素污染形式更加严峻. 2009年到2022年报道的抗生素数据显示,我国抗生素检出浓度达到μg·L−1级别,且我国有三分之二的海域检测到的抗生素浓度达μg·L−1级别. 我国海洋环境中抗生素总浓度在0.04—6800 ng·L−1之间,七大类抗生素(磺胺类、大环内酯类、β-内酰胺类、喹诺酮类、四环素类、氨基糖苷类及一些其他类抗生素)都有检出,不同海域检出抗生素的浓度和种类有所差异. 如渤海海域的喹诺酮类抗生素最高达到6800 ng·L−1,东海海域的林可酰胺类总含量最高达1688.4 ng·L−1,南海海域的大环内酯类和喹诺酮类抗生素最高达到了μg·L−1级别. 值得注意的是,在我国四大海域中磺胺类抗生素普遍检出,浓度范围在0—584.32 ng·L−1之间,这可能与其成本低、抗菌谱广以及化学性质稳定难降解的特性有关[47].
针对目前严峻的抗生素污染情况,已有大量研究对海洋环境中抗生素的生态风险进行评估,一些抗生素已被指出对海洋环境具有一定的风险. 如黄海近海检出的磺胺甲恶唑、头孢菌素、氧氟沙星、恩诺沙星和诺氟沙星等抗生素主要对藻类有生态风险,尤其磺胺甲恶唑和氧氟沙星的风险熵值最高分别达到1.78和23.70[28]. 而在南海海陵湾中,土霉素、诺氟沙星和红霉素被认为对水生生物具有一定的生态风险[48]. 磺胺类抗生素是海洋环境中生态风险最高的一类抗生素,研究发现东海中磺胺嘧啶、磺胺甲恶唑、磺胺氯达嗪、磺胺甲氧达嗪和磺胺二甲氧嘧啶具有明显的生态风险[49],同时磺胺甲恶唑在黄海和渤海水环境中个别对水生生物具有高和低风险[50],磺胺嘧啶在南海海洋环境中呈现中等风险而磺胺二甲嘧啶在海南东部养殖场呈现中低风险[51]. 总体来看,海洋环境中抗生素的生态风险等级并不高,一般呈现低风险或无风险. 但需注意的是,我国多个海域中的磺胺类抗生素均具有一定的生态风险,应对其进行进一步的监管.
-
抗生素进入到海洋环境中后,会发生包括:吸附、降解等一系列的迁移转化过程,而降解又具体分为水降解、光降解和微生物降解. 抗生素通过迁移转化过程,在环境介质间进行再分配,并对环境生态产生影响.
吸附是抗生素在环境中转化的重要过程,一般包括物理性吸附和化学性吸附,物理性吸附是指抗生素与水环境中的颗粒物表面的吸附位点通过范德华力、氢键等作用力吸附,而化学吸附是通过抗生素结构官能团与水环境中的物质发生络合或者螯合反应,研究表明四环素类抗生素可在中性条件下与多种金属形成不溶性螯合物[52]. 梁惜梅等[53]研究表明,珠江口水产养殖区沉积物中残留的抗生素较水中的抗生素稳定,且其检出率和种类均高于水中,表明在海洋环境中,吸附在沉积物中的抗生素既是海洋环境中抗生素的储存库又是水中抗生素潜在的污染源.
对于降解而言,水降解是抗生素在海洋环境中降解的极为重要的方式. pH和温度是影响抗生素在海洋环境中水解速率的重要环境因素. 比如对四环素而言,当pH值<2时,四环素分子结构C-6上的羟基与C-5上的氢形成反式构型,容易发生消除反应,所得的产物失去TCs的活性. 而当pH值>9水体呈碱性条件时,碳环发生破裂,生成内酯型结构的异构体[51]. 一般而言,抗生素水解的速率随着水体温度的上升而增加,而离子强度对其降解率并无显著影响[53]. 值得注意的是,抗生素的降解情况取决于各类抗生素自身的特性(如水溶性、挥发性和吸附性),不同类型的抗生素在海洋环境中的降解途径、速率以及起降解作用的微生物类型都有差异. 比如大环内酯类和磺胺类抗生素易发生水解[12],而四环素的水解过程却非常漫长. 再具体到每一种抗生素,降解速率也不尽相同,比如对于四环素而言一般遵循金霉素>土霉素>四环素的规律[52].
抗生素的光解是一种光化作用,可以通过改变反应因子,达到去除污染物的效果[49]. 通过研究抗生素在高压汞灯和紫外灯不同光源对光解速率的影响,发现紫外灯的光解速率是高压汞灯的2.6倍,且光解速率会随着初始浓度的增加而降低[54]. 海洋环境表层水环境无其他物体遮挡,紫外线的强度高于其他环境,且由于海水的稀释作用,抗生素的浓度较低,因此抗生素的光解速率加快. 海洋环境中抗生素的光降解反应主要发生在表层水中,而深层水和沉积物中的抗生素通过光降解的途径几乎可以忽略. 海洋环境中抗生素的光解主要有3种形式:直接光解、间接光解和自敏性光解[55].
相对于光解和水解,微生物降解是抗生素降解最普遍的一种方式,可发生于海洋环境的表层水、深层水和沉积物中. 微生物降解是指由于微生物的作用,使抗生素残留物结构发生改变,从而引起一系列物理化学反应,即通过微生物作用,将抗生素残留物从大分子化合物降解为小分子化合物,最后生成H2O和CO2,实现对环境中抗生素的无害化处理过程[56]. 据统计,具有抗生素降解作用的细菌有80%属于厚壁菌门和变形菌门,少部分属于栖热菌门、拟杆菌门、放线菌门和浮霉菌门等. 除细菌外,还有一些真菌也被证明具有降解抗生素的能力. 与细菌相比,真菌对抗生素有更强的耐受能力,并且可以同时降解多种污染物. 而海洋环境中具有丰富的变形菌门和厚壁菌门细菌和各类真菌,这为抗生素在海洋环境中的微生物降解提供了得天独厚的条件.
伴随着抗生素的迁移转化,抗生素或转化成无活性的小分子物质或转化成更具毒性的次级代谢物[57]. 抗生素活性易受多种环境因素的影响,其在海洋环境中极易失活. 但由于海洋、陆源和大气源抗生素不断的输入,抗生素在海洋环境中呈现“假持久性”[58],抗生素的持久性存在一方面会抑制微生物的生长,进而造成生态环境失衡,另一方面则会诱导环境微生物产生ARGs,进而造成更大的威胁.
-
目前环境中的ARGs以胞外ARGs(extracellular ARGs, iARGs)和胞内ARGs(extracellular ARGs, eARGs)的形式存在. iARGs主要存在抗生素抗性细菌体内,可以通过复制传给下一代,也可以通过接合和转导传递给其它物种[59]. eARGs是游离态的胞外DNA所携带ARGs,可由死细菌裂解或活细菌分泌释放,裸露于环境介质中,并具有很长的存在周期,可通过转化方式进入到细菌中,使细菌获得抗生素抗性[60]. 与iARGs相比,eARGs因为其特有的性质更容易在环境中传播,对人体健康和生态系统产生严重的威胁[61]. ARGs的两个主要来源是外源耐药基因输入ARGs和微生物体内的内源ARGs,一方面,外源输入使ARGs在各种环境介质中被广泛检出,例如在医疗、水产养殖和工业中过度使用抗生素导致耐药细菌出现[62];另一方面,微生物基因组中原始存在可产生抗生素抗性的基因,其在正常生长条件下并不能表达,而当外界给予污染压力,使ARGs能够表达. 海洋环境中抗生素的不断输入使耐药菌不断增值,耐药菌中的抗性基因通过水平转移的方式转移给其他细菌,导致ARGs的种类和丰度增加.
-
近年来已在多个近海海洋环境中检测出了ARGs,如在我国东海杭州湾、天津的渤海湾、山东江苏的黄海以及海南东寨港等,各海域检测出的ARGs如表2所示. 在中国北部的渤海地区,运用qPCR技术对天津渤海湾7个采样点采集海水和沉积物中11种ARGs进行检测,结果显示7个采样点均检测到sul1和sul2,海水样品中的tet类和erm类抗性基因的检出率为28%—57%和0—57%[63]. Lu等[64]的研究表明,不同的ARGs在黄海不同的采样点的绝对丰度波动比较大,但是占据主导地位的ARGs还是sul1和sul2,这两种基因的绝对丰度为2.13×103 copies·mL−1和6.23×103 copies·mL−1. 而在东海杭州湾,其沉积物样品中检测出11种ARGs,总绝对丰度在8.39×106—2.33×107 copies·g−1之间,其中绝对丰度最大的ARGs为甲氧苄胺嘧啶类抗性基因(dfrA13),其次是sul1、tetW和sul2[65]. 在广东沿岸,海水中ARGs总绝对丰度在1.82×105—5.9× 109 copies·mL−1之间,且在所有采样点中都有ARGs的检出[66]. 在海南东寨港的10个采样点中检测磺胺类、四环素类、氯霉素类、喹诺酮类等12种ARGs(sul1、sul2、dfrA1;tetA、tetC、tetG、tetM;cata1、cata2、cmle1、cmle3;qnrS),这12种ARGs在10个采样点的海水和沉积物样品中全被检测出,其中海水样品中sul2的绝对丰度最高,为5.13×108 copies·L−1,sul1的绝对丰度为1.21×108 copies·L−1,tetM的绝对丰度在10个采样点检测的12种ARGs中最低,为1.16×105 copies·L−1,沉积物样品中ARGs的绝对丰度为1.13×108—5.34×108 copies·g−1,sul2基因的绝对丰度高达5.05×107—2.17×108 copies·g−1 [67]. 总的来说,我国海洋环境海水中ARGs的丰度范围在105—1011 copies·mL−1之间,沉积物中ARGs的丰度范围在106—108 copies·g−1之间,磺胺类、四环素类和喹诺酮类ARGs的平均检出率和丰度最高,是我国近海海洋环境中主要的ARGs.
此外,在原始的极地海洋环境也发现了ARGs. 在北极海洋沉积物中检测到26种ARGs,磺胺类ARGs丰度最高[68];在南极海水样品中分离到携带广谱β-内酰胺酶型CTX-M基因的细菌,多位点序列分型技术结果表明此细菌已在人体中被分离出,这说明与人类相关的ARGs已传播扩散到全球[69].
-
抗生素抗性基因的产生及传播与抗生素的广泛使用有直接关系,抗生素自身在环境中的迁移、转化及归趋等环境行为理论上应与其所诱导的抗生素抗性基因具有一致性和相似性. ARGs在海洋环境中的扩散受到诸多因素的影响,其中人类活动被认为是影响ARGs扩散传播的主要因素. 然而,海洋环境中抗生素的残留浓度往往低于内陆环境两到三个数量级,更低的抗生素含量意味着更弱的选择压力. 在针对海洋及河口环境中典型抗生素抗性污染分布特征的研究中也发现,海洋环境中抗生素与其抗性基因之间的相关性明显减弱. 由此推测,ARGs在远距离迁移与传播的过程中,随着抗生素浓度的下降及环境变化程度的加剧,抗生素对其抗性污染丰度与分布的决定性作用将被分担或替代. 而ARGs的主要传播方式也可能由抗生素主导的“主动传播”向复合环境因素制约的“被动传播”切换,从而形成一个多机制、多维度的复杂传播方式.
抗生素抗性基因在海洋环境中进行迁移传播,意味着影响抗生素抗性基因发生扩散的因素很复杂. 如环境中的受体菌是否处于感受态,Ca2+或Mg2+浓度是否适宜、化学污染情况、环境温度以及菌体所处环境的pH值、营养盐是否满足要求等. 盐度的变化是淡水与海水之间最明显的特征,研究发现盐度梯度会影响ARGs的传播,抑制质粒的水平转移[70],这可能是海洋环境与淡水环境ARGs丰度不同的主要原因;关于pH与温度对ARGs水平转移的影响还不明确,一些研究发现土壤的温度、pH可以影响质粒的转移[71],JIA[72]的研究显示pH与ARGs呈显著负相关,但是其他环境介质中pH与温度对ARGs的传播造成的影响还需要更深入的研究;耐药质粒能够同时编码多种耐药基因,这些基因能够对抗其他对细菌生存不利的环境因子,从而协助细菌在恶劣的条件下更好的生存,有研究表明在杀虫剂、消毒剂、重金属和耐药基因都能够位于同一个质粒上,重金属等化学物质对抗生素耐药基因的共选择作用也在多篇文章中被证实[73-74]. 同时,大量非对应污染物(重金属、多环芳烃、pH、盐度、COD、DO等)与抗生素之间还存在协同或交叉筛选的作用机制,环境微生物也会在适应性调节的过程中存在推进多重抗性基因连锁传递. 随着污染物在环境中的迁移,稳定性更强更易在环境介质中富集的非对应污染物会随抗生素浓度的降低逐渐表现出更强的选择压力,这种情况在河口及海洋环境尤为突出.
-
随着抗生素使用量的逐年增大,海洋环境可能成为抗生素和ARGs重要储存库,其对人类健康和海洋生态环境构成威胁,海洋环境中抗生素和ARGs的治理面临着新的机遇与挑战:
(1) 抗生素在海洋环境中普遍存在,浓度量级为ng·L−1—μg·L−1(0.040—73722 ng·L−1),检出最多的是磺胺类和大环内酯类抗生素;陆源输入是海洋环境中抗生素的主要来源,同时,海洋直接输入和大气输入不容忽视.
(2) 抗生素在海洋环境中不断发生迁移转化而失活,由于陆源抗生素的不断输入,抗生素呈现假持久性存在,但研究显示海洋环境中抗生素的生态风险等级呈现低风险或无风险.
(3) 我国海洋环境中ARGs普遍检出,主要为磺胺类、四环素类以及大环内酯类抗性基因,其迁移转化的影响因素主要为人类源和环境因素(如盐度等).
(4) 鉴于海洋环境中抗生素和ARGs的监测数据有限,未来应重点河流入海口、重点城市海域及典型养殖区抗生素及其抗性污染的调查,全面评价海水环境中抗生素及抗性的环境风险,特别关注抗生素及其抗性污染的分布特征、环境归趋,以建立我国海洋抗生素及其抗性污染的基础数据库,为进一步研究建立我国抗生素环境风险评估和预警体系提供支撑.
(5) 考虑到抗生素及其抗性污染具全球迁移性和健康危害,加强海域中抗生素及其抗性污染的丰度、扩散规律等基础性研究,准确评估陆源排污、海水养殖、医疗垃圾等对海洋生态环境抗生素及其抗性污染的影响,具有重要意义.
海洋环境中抗生素存在与环境行为研究进展
Advances in research on the presence and environmental behavior of antibiotics in the marine environment
-
摘要: 由于抗生素的频繁使用和排放,抗生素不断排放进入水环境,表现为“持续存在”的状态,对生态环境系统造成长期、持续的环境风险,由此导致的环境污染和细菌耐药性是我国及全球都亟待解决的重大环境问题. 抗生素持久性的选择压力会产生抗生素抗性基因(antibiotic resistant genes,ARGs),其在环境中的持久性残留,在菌群间的迁移、传播和扩增,比抗生素残留本身对生态环境的危害更大. 随着海洋资源与环境的持续开发与利用,海洋正逐步成为抗生素和ARGs的重要储存库,海洋环境中的抗生素和ARGs对海洋生态环境和公众健康的威胁同样不容忽视. 本文对海洋环境中抗生素的来源、赋存、迁移转化和生态风险等研究进行分析梳理,对海洋环境中ARGs的环境行为进行综述,以期为海洋环境中抗生素和ARGs环境行为和风险评估研究提供参考,最后对相关研究的发展趋势进行了展望.Abstract: Frequent use and continued discharge of antibiotics lead to their persistence in aquatic environments and cause ecological risk More importantly, the selective stress from antibiotics may contribute to the development of antibiotic resistance. The potential ecological risks of widespread dissemination of antibiotic resistance genes (ARGs) are greater than the antibiotics themselves. With the continuous exploitation and utilization of marine resources, the marine environment is gradually becoming an important reservoir of antibiotics and ARGs. However, the threat of antibiotics and ARGs in the marine environment to the marine ecosystem and public health have not been clarified. The objectives of this paper are to analyze the sources, occurrence, transformation and ecological risks of antibiotics in the marine environment, and assess the environmental behavior of ARGs in marine environments. In addition, we provide an outlook for future studies.
-

-
表 1 国内外近海海域水体中抗生素浓度水平(单位:ng·L−1)
Table 1. Levels of antibiotic concentration in domestic and international offshore waters(ng·L−1)
洲
State国家
Country海域
Sea磺胺类
Sulfonamides大环内酯类
Macrolidesβ-内酰胺类
Beta-lactams喹诺酮类
Quinolones四环素类
Tetracyclines其他类
Others参考文献
References亚洲 中国 渤海 磺胺甲恶唑(3—140) 红霉素(4—150) — 氧氟沙星(3—5100)
诺氟沙星(3—6800)— — [26] 北黄海 总磺胺量(nd—584.32 )
磺胺甲恶唑(nd—167.40)— — — — — [27] 黄海南部 磺胺甲恶唑(nd—48) 红霉素(nd—48) — — — 氟苯尼考(nd—42) [28] 黄东海 磺胺甲恶唑(nd—1.363) — — — — 甲氧苄胺嘧啶(0.269—2.88) [29] 东海 总磺胺量2.0—156.5 总大环内酯(2.9—77.0)
克林霉素(1.2—1507.9)— 总喹诺酮量(8.6—185.2) 总四环素量(1.0—6.5) 林可酰胺类总含量(2.5—1688.4),
林可霉素(0.9—180.8)[30] 维多利亚海湾(南海) — 红霉素(4.7—1730)
头孢氨苄(6.1—493)阿莫西林
(0.64—76)氧氟沙星 (8.1—1140) — 甲氧苄啶(2.6—216) [31] 南海 磺胺甲恶唑(nd—0.53) 罗红霉素(0.16–0.18 )克拉霉素(nd—0.04);D3—红霉(0.06—0.10) — — — 氟苯尼考(nd—0.52 ) [32] 韩国 南海 甲氧苄氨嘧啶(nd—5.3) 红霉素 (nd—0.2) — 诺氟沙星(nd—0.5)
氧氟沙星(nd—12.4)— 林可霉素(nd—438) [33] 新加坡 沿海 — — — — — 三氯生(nd—10.5) [34] 伊朗 波斯湾 — 阿奇霉素(0.3—4.8) — 诺氟沙星(19—68) 四环素(4.0—71) — [35] 沙特阿拉伯 红海 磺胺甲恶唑(31.5—62.4 ) — — — — 甲硝唑(51.0—178.6), 甲氧苄啶(nd—45.6) [36] 欧洲 西班牙 加的斯湾 — 阿奇霉素(nd—1.2);红霉素(nd—0.3) — — — 氟甲喹(nd—0.1)
林可霉素(nd—0.4)
奥硝唑(nd—5.1)[37] 地中海海滩 磺胺甲恶唑(9) — — — — 甲氧苄啶(1) [38] 欧洲 比利时 大西洋东部北海海湾 磺胺甲恶唑(13—96) — — — — 甲氧苄啶(13—29) [39] 希腊 东地中海 — 克拉霉素(nd—1.5) 阿莫西林(nd—127.8) — — 甲氧苄啶(nd—3.4)
甲硝唑(nd—8.2)[40] 德国 波罗的海 磺胺甲恶唑(nd—42) 罗红霉素(nd—16)
克拉霉素(nd—14)— — — — [41] 公海 威尼斯沿海 磺胺甲恶唑(nd—7.2) 克拉霉素(nd—8.7) — — — — [41] 亚得里亚海北部 磺胺甲恶唑(nd—4.1) 红霉素 (nd—5.8) — — — — [41] 波罗的海南部 磺胺甲恶唑(nd—311) — — 恩诺沙星(nd—208) — 甲氧苄啶(nd—279) [42] 欧洲和亚洲 希腊和土耳其 爱琴海和达达尼尔海峡 磺胺甲恶唑(nd—11) 克拉霉素(nd—16) — — — — [41] 北美洲 美国 切萨皮克湾 磺胺甲基异恶唑(nd—14.8) 阿奇霉素(nd—2.7);罗红霉素(nd—5.9);克拉霉素(nd—9.7) — 诺氟沙星(nd—94.1)
恩诺沙星(nd—17.8)— — [43] 太平洋 磺胺甲恶唑(nd—6.4) 红霉素 (nd—86);
罗红霉素(nd—141);
克拉霉素(nd—130)— — — — [41] 旧金山湾 磺胺甲恶唑(13—61) 红霉素(nd—217) — — — — [41] 哥斯达黎加 哥斯达黎加沿海海域 — — 苯甲异噁唑青霉素 (70—7571) 诺氟沙星(38—1744) 强力霉素
(74—73722)— [44] 南极洲 南极海水 — 克林霉素(<0.1) — 环丙沙星(4—218) — 甲氧苄啶(<0.1) [45] 备注:“—”为未进行检测;“nd”为未检出 表 2 中国海洋环境中ARGs的分布
Table 2. Distribution of ARGs in coastal marine environment of China
海洋环境
Seas检测出的ARGs
The detected ARGs参考文献
References渤海 sul1、sul2、tetO、tetW、tetB、tetM、tetH、tetX、ermB [63] 黄海 sul1、sul2、tetG、tetX、ermF、ermT、qnrS、qnrA、qnrB [64] 东海 sul1、sul2、tetC、tetW、dfrA13,blaPSE-1 [65] 南海 sul1、sul2、tetG、tetC、cmle1、cmle3、qnrS [66] 海南东寨港 sul1、sul2、dfrA1;tetA、tetC、tetG、tetM;cata1、cata2、cmle1、cmle3;qnrS [67] -
[1] 徐永刚, 宇万太, 马强, 等. 环境中抗生素及其生态毒性效应研究进展 [J]. 生态毒理学报, 2015, 10(3): 11-27. XU Y G, YU W T, MA Q, et al. The antibiotic in environment and its ecotoxicity: A review [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 11-27(in Chinese).
[2] 李琳. β-内酰胺类抗生素的合理应用 [J]. 中国继续医学教育, 2015, 7(6): 220-221. doi: 10.3969/j.issn.1674-9308.2015.06.183 LI L. The reasonable application of β-lactam antibiotics [J]. China Continuing Medical Education, 2015, 7(6): 220-221(in Chinese). doi: 10.3969/j.issn.1674-9308.2015.06.183
[3] 姜宏, 徐丽华, 李照东. 抗生素及磺胺类药物的合理应用 [J]. 中国禽业导刊, 2002, 19(12): 35-36. JIANG H, XU L H, LI Z D. Rational application of antibiotics and sulfonamides [J]. Guiele to Chinese Poultry, 2002, 19(12): 35-36(in Chinese).
[4] 王勇, 王钊. 固相萃取-高效液相色谱三重四级杆质谱联用法在北方河流水体氯霉素类抗生素测定中的应用 [J]. 海河水利, 2016(6): 65-67. doi: 10.3969/j.issn.1004-7328.2016.06.021 WANG Y, WANG Z. Application of solid phase extraction-high performance liquid chromatography triple quadrupole mass spectrometry in the determination of chloramphenicol antibiotics in northern rivers [J]. Haihe Water Resources, 2016(6): 65-67(in Chinese). doi: 10.3969/j.issn.1004-7328.2016.06.021
[5] 张石云, 宋超, 陈家长. 喹诺酮类抗生素在水产养殖中应用的研究进展 [J]. 江苏农业科学, 2019, 47(3): 32-36. doi: 10.15889/j.issn.1002-1302.2019.03.007 ZHANG S Y, SONG C, CHEN J Z. Research progress of application of quinolones antibacterial drugs in aquaculture [J]. Jiangsu Agricultural Sciences, 2019, 47(3): 32-36(in Chinese). doi: 10.15889/j.issn.1002-1302.2019.03.007
[6] 吴小梅, 林茂, 鄢庆枇, 等. 美洲鳗鲡及其养殖水体分离耐药菌的多样性和耐药性分析 [J]. 水产学报, 2015, 39(7): 1043-1053. WU X M, LIN M, YAN Q P, et al. Diversity and antimicrobial susceptibility of drug-resistant bacteria isolated from Anguilla rostrata and the farming water [J]. Journal of Fisheries of China, 2015, 39(7): 1043-1053(in Chinese).
[7] 郑卫. 氨基糖苷类抗生素研究的新进展 [J]. 国外医药(抗生素分册), 2005, 26(3): 101-110. ZHENG W. New progress in the research of aminoglycoside antibiotics [J]. World Notes on Antibiotics, 2005, 26(3): 101-110(in Chinese).
[8] 马俊美, 孙磊, 曹梅荣, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定猪肉中9种大环内酯类抗生素 [J]. 食品科学, 2020, 41(4): 273-279. doi: 10.7506/spkx1002-6630-20181026-306 MA J M, SUN L, CAO M R, et al. Determination of nine macrolide antibiotics in pork samples by ultra-high performance liquid ChromatographyQuadrupole/orbitrap high resolution mass spectrometry [J]. Food Science, 2020, 41(4): 273-279(in Chinese). doi: 10.7506/spkx1002-6630-20181026-306
[9] 尹晖, 王亦琳, 叶妮, 等. UPLC-MS/MS法检测禽蛋中10种大环内酯类药物多残留的研究 [J]. 中国兽医杂志, 2020, 56(8): 77-83. YIN H, WANG Y L, YE N, et al. Determination of macrolides residue in poultry eggs by UPLC-MS/MS [J]. Chinese Journal of Veterinary Medicine, 2020, 56(8): 77-83(in Chinese).
[10] KLEIN E Y, van BOECKEL T P, MARTINEZ E M, et al. Global increase and geographic convergence in antibiotic consumption between 2000 and 2015 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(15): E3463-E3470. [11] 到2030年全球农业抗生素使用将持续增长[J]. 饲料与畜牧, 2016(4): 33. By 2030, the global use of agricultural antibiotics will continue to increase[J]. Animal Agriculture, 2016(4): 33 (in Chinese).
[12] 到2025年完成一批新污染物化学物质环境风险评估[J]. 氯碱工业, 2022, 58(6): 46. By 2025, the environmental risk assessment of a number of new pollutants and chemicals will be completed[J]. Chlor-Alkali Industry, 2022, 58(6): 46 (in Chinese).
[13] LI S, SHI W Z, LI H M, et al. Antibiotics in water and sediments of rivers and coastal area of Zhuhai City, Pearl River Estuary, South China [J]. Science of the Total Environment, 2018, 636: 1009-1019. doi: 10.1016/j.scitotenv.2018.04.358 [14] LI S, SHI W Z, LIU W, et al. A duodecennial national synthesis of antibiotics in China’s major rivers and seas (2005-2016) [J]. Science of the Total Environment, 2018, 615: 906-917. doi: 10.1016/j.scitotenv.2017.09.328 [15] GUO R X, XIE X D, CHEN J Q. The degradation of antibiotic amoxicillin in the Fenton-activated sludge combined system [J]. Environmental Technology, 2015, 36(7): 844-851. doi: 10.1080/09593330.2014.963696 [16] CHEN H Y, LI Y Z, SUN W C, et al. Characterization and source identification of antibiotic resistance genes in the sediments of an interconnected river-lake system [J]. Environment International, 2020, 137: 105538. doi: 10.1016/j.envint.2020.105538 [17] LI J, ZHOU L T, ZHANG X Y, et al. Bioaerosol emissions and detection of airborne antibiotic resistance genes from a wastewater treatment plant [J]. Atmospheric Environment, 2016, 124: 404-412. doi: 10.1016/j.atmosenv.2015.06.030 [18] 庄榆佳, 赵忆, 苏建强, 等. 抗生素抗性基因在养殖废水中的分布与去除 [J]. 环境化学, 2017, 36(11): 2311-2318. doi: 10.7524/j.issn.0254-6108.2017041801 ZHUANG Y J, ZHAO Y, SU J Q, et al. Distribution and removal of antibiotic resistance genes in swine wastewater [J]. Environmental Chemistry, 2017, 36(11): 2311-2318(in Chinese). doi: 10.7524/j.issn.0254-6108.2017041801
[19] 阮悦斐, 陈继淼, 郭昌胜, 等. 天津近郊地区淡水养殖水体的表层水及沉积物中典型抗生素的残留分析 [J]. 农业环境科学学报, 2011, 30(12): 2586-2593. RUAN Y F, CHEN J M, GUO C S, et al. Distribution characteristics of typical antibiotics in surface water and sediments from freshwater aquaculture water in Tianjin suburban areas, China [J]. Journal of Agro-Environment Science, 2011, 30(12): 2586-2593(in Chinese).
[20] RICO A, OLIVEIRA R, McDONOUGH S, et al. Use, fate and ecological risks of antibiotics applied in tilapia cage farming in Thailand [J]. Environmental Pollution, 2014, 191: 8-16. doi: 10.1016/j.envpol.2014.04.002 [21] McEACHRAN A D, BLACKWELL B R, HANSON J D, et al. Antibiotics, bacteria, and antibiotic resistance genes: Aerial transport from cattle feed yards via particulate matter [J]. Environmental Health Perspectives, 2015, 123(4): 337-343. doi: 10.1289/ehp.1408555 [22] 陈畇岐. 珠江口河岛养殖区抗生素和杀虫剂的污染特征、输入途径及潜在风险[D]. 广州: 暨南大学, 2020. CHEN Y Q. Occurrence, distribution, and potential risk of antibiotics and pesticides in freshwater aquaculture farms of an urbanized island, South China[D]. Guangzhou: Jinan University, 2020 (in Chinese).
[23] 彭全材. 胶州湾典型药物活性化合物(PhACs)的环境生物地球化学特征解析[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2020. PENG Q C. Environmental biogeochemical characteristics of typical pharmacologically active compounds (PhACs) in Jiaozhou Bay[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2020 (in Chinese).
[24] LENG Y F, XIAO H L, LI Z, et al. Tetracyclines, sulfonamides and quinolones and their corresponding resistance genes in coastal areas of Beibu Gulf, China [J]. The Science of the Total Environment, 2020, 714: 136899. doi: 10.1016/j.scitotenv.2020.136899 [25] CHEN H, LIU S, XU X R, et al. Antibiotics in typical marine aquaculture farms surrounding Hailing Island, South China: Occurrence, bioaccumulation and human dietary exposure [J]. Marine Pollution Bulletin, 2015, 90(1/2): 181-187. [26] ZOU S C, XU W H, ZHANG R J, et al. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay, China: Impacts of river discharge and aquaculture activities [J]. Environmental Pollution, 2011, 159(10): 2913-2920. doi: 10.1016/j.envpol.2011.04.037 [27] NA G S, ZHANG W R, ZHOU S Y, et al. Sulfonamide antibiotics in the Northern Yellow Sea are related to resistant bacteria: Implications for antibiotic resistance genes [J]. Marine Pollution Bulletin, 2014, 84(1/2): 70-75. [28] DU J, ZHAO H X, LIU S S, et al. Antibiotics in the coastal water of the South Yellow Sea in China: Occurrence, distribution and ecological risks [J]. Science of the Total Environment, 2017, 595: 521-527. doi: 10.1016/j.scitotenv.2017.03.281 [29] 陈贤, 张彩杰, 杨桂朋, 等. 典型药物及个人护理品在黄东海海域水体中的检测、分布规律及其风险评估 [J]. 环境科学, 2020, 41(1): 194-204. doi: 10.13227/j.hjkx.201907028 CHEN X, ZHANG C J, YANG G P, et al. Detection method, distribution, and risk assessment of pharmaceuticals and personal care products in the Yellow Sea and the East China Sea [J]. Environmental Science, 2020, 41(1): 194-204(in Chinese). doi: 10.13227/j.hjkx.201907028
[30] 李菲菲. 受污染近海中抗生素的分布、生态风险及优先控制策略[D]. 北京: 中国地质大学(北京), 2020. LI F F. Distribution, ecological risks and priority control strategies of antibiotics in polluted coastal environment[D]. Beijing: China University of Geosciences, 2020 (in Chinese).
[31] BINH MINH T, LEUNG H W, LOI I H, et al. Antibiotics in the Hong Kong metropolitan area: Ubiquitous distribution and fate in Victoria Harbour [J]. Marine Pollution Bulletin, 2009, 58(7): 1052-1062. doi: 10.1016/j.marpolbul.2009.02.004 [32] ZHANG R J, ZHANG R L, YU K F, et al. Occurrence, sources and transport of antibiotics in the surface water of coral reef regions in the South China Sea: Potential risk to coral growth [J]. Environmental Pollution, 2018, 232: 450-457. doi: 10.1016/j.envpol.2017.09.064 [33] KIM S C, CARLSON K. Temporal and spatial trends in the occurrence of human and veterinary antibiotics in aqueous and river sediment matrices [J]. Environmental Science & Technology, 2007, 41(1): 50-57. [34] BAYEN S, ZHANG H, DESAI M M, et al. Occurrence and distribution of pharmaceutically active and endocrine disrupting compounds in Singapore’s marine environment: Influence of hydrodynamics and physical-chemical properties [J]. Environmental Pollution, 2013, 182: 1-8. doi: 10.1016/j.envpol.2013.06.028 [35] KAFAEI R, PAPARI F, SEYEDABADI M, et al. Occurrence, distribution, and potential sources of antibiotics pollution in the water-sediment of the northern coastline of the Persian Gulf, Iran [J]. Science of the Total Environment, 2018, 627: 703-712. doi: 10.1016/j.scitotenv.2018.01.305 [36] ALI A M, RØNNING H T, ALARIF W, et al. Occurrence of pharmaceuticals and personal care products in effluent-dominated Saudi Arabian coastal waters of the Red Sea [J]. Chemosphere, 2017, 175: 505-513. doi: 10.1016/j.chemosphere.2017.02.095 [37] BIEL-MAESO M, BAENA-NOGUERAS R M, CORADA-FERNÁNDEZ C, et al. Occurrence, distribution and environmental risk of pharmaceutically active compounds (PhACs) in coastal and ocean waters from the Gulf of Cadiz (SW Spain) [J]. Science of the Total Environment, 2018, 612: 649-659. doi: 10.1016/j.scitotenv.2017.08.279 [38] GROS M, RODRÍGUEZ-MOZAZ S, BARCELÓ D. Fast and comprehensive multi-residue analysis of a broad range of human and veterinary pharmaceuticals and some of their metabolites in surface and treated waters by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry [J]. Journal of Chromatography A, 2012, 1248: 104-121. doi: 10.1016/j.chroma.2012.05.084 [39] WILLE K, NOPPE H, VERHEYDEN K, et al. Validation and application of an LC-MS/MS method for the simultaneous quantification of 13 pharmaceuticals in seawater [J]. Analytical and Bioanalytical Chemistry, 2010, 397(5): 1797-1808. doi: 10.1007/s00216-010-3702-z [40] ALYGIZAKIS N A, GAGO-FERRERO P, BOROVA V L, et al. Occurrence and spatial distribution of 158 pharmaceuticals, drugs of abuse and related metabolites in offshore seawater [J]. Science of the Total Environment, 2016, 541: 1097-1105. doi: 10.1016/j.scitotenv.2015.09.145 [41] NÖDLER K, VOUTSA D, LICHA T. Polar organic micropollutants in the coastal environment of different marine systems [J]. Marine Pollution Bulletin, 2014, 85(1): 50-59. doi: 10.1016/j.marpolbul.2014.06.024 [42] SIEDLEWICZ G, BIAŁK-BIELIŃSKA A, BORECKA M, et al. Presence, concentrations and risk assessment of selected antibiotic residues in sediments and near-bottom waters collected from the Polish coastal zone in the southern Baltic Sea—Summary of 3 years of studies [J]. Marine Pollution Bulletin, 2018, 129(2): 787-801. doi: 10.1016/j.marpolbul.2017.10.075 [43] HE K, HAIN E, TIMM A, et al. Occurrence of antibiotics, estrogenic hormones, and UV-filters in water, sediment, and oyster tissue from the Chesapeake Bay [J]. Science of the Total Environment, 2019, 650: 3101-3109. doi: 10.1016/j.scitotenv.2018.10.021 [44] SPONGBERG A L, WITTER J D, ACUÑA J, et al. Reconnaissance of selected PPCP compounds in Costa Rican surface waters [J]. Water Research, 2011, 45(20): 6709-6717. doi: 10.1016/j.watres.2011.10.004 [45] HERNÁNDEZ F, CALıSTO-ULLOA N, GÓMEZ-FUENTES C, et al. Occurrence of antibiotics and bacterial resistance in wastewater and sea water from the Antarctic [J]. Journal of Hazardous Materials, 2019, 363: 447-456. doi: 10.1016/j.jhazmat.2018.07.027 [46] LI S, LIU Y, WU Y, et al. Antibiotics in global rivers [J]. National Science Open, 2022, 1(2): 20220029. doi: 10.1360/nso/20220029 [47] 秦丽婷, 童蕾, 刘慧, 等. 环境中磺胺类抗生素的生物降解及其抗性基因污染现状 [J]. 环境化学, 2016, 35(5): 875-883. doi: 10.7524/j.issn.0254-6108.2016.05.2015113004 QIN L T, TONG L, LIU H, et al. Biodegradation of sulfonamides and the pollution characteristics of sulfonamide resistance genes in the environment [J]. Environmental Chemistry, 2016, 35(5): 875-883(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.05.2015113004
[48] CHEN H, LIU S, XU X R, et al. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea: Spatial distribution, source analysis and ecological risks [J]. Marine Pollution Bulletin, 2015, 95(1): 365-373. doi: 10.1016/j.marpolbul.2015.04.025 [49] LI F F, CHEN L J, CHEN W D, et al. Antibiotics in coastal water and sediments of the East China Sea: Distribution, ecological risk assessment and indicators screening [J]. Marine Pollution Bulletin, 2020, 151: 110810. doi: 10.1016/j.marpolbul.2019.110810 [50] ZHANG R J, TANG J H, LI J, et al. Antibiotics in the offshore waters of the Bohai Sea and the Yellow Sea in China: Occurrence, distribution and ecological risks [J]. Environmental Pollution, 2013, 174: 71-77. doi: 10.1016/j.envpol.2012.11.008 [51] LIN M G, ZHONG Y T, CHEN Z L, et al. High incidence of drug-resistant Mycobacterium tuberculosis in Hainan Island, China [J]. Tropical Medicine & International Health:TM & IH, 2019, 24(9): 1098-1103. [52] 王静松, 姚一凡. 四环素类抗生素在环境中的迁移转化 [J]. 山东化工, 2020, 49(15): 240-241,247. doi: 10.3969/j.issn.1008-021X.2020.15.105 WANG J S, YAO Y F. Migration and transformation of tetracycline antibiotics in environment [J]. Shandong Chemical Industry, 2020, 49(15): 240-241,247(in Chinese). doi: 10.3969/j.issn.1008-021X.2020.15.105
[53] 梁惜梅, 施震, 黄小平. 珠江口典型水产养殖区抗生素的污染特征 [J]. 生态环境学报, 2013, 22(2): 304-310. doi: 10.3969/j.issn.1674-5906.2013.02.022 LIANG X M, SHI Z, HUANG X P. Occurrence of antibiotics in typical aquaculture of the Pearl River Estuary [J]. Ecology and Environmental Sciences, 2013, 22(2): 304-310(in Chinese). doi: 10.3969/j.issn.1674-5906.2013.02.022
[54] 张爽. 冰中和水中典型抗生素光降解动力学及其影响因素的比较研究[D]. 大连: 大连海事大学, 2020. ZHANG S. Photodegradation of typical antibiotics in ice and in water: Kinetic comparison, and effects of main aqueous constituents[D]. Dalian: Dalian Maritime University, 2020 (in Chinese).
[55] 张志超. 典型兽药在水体中光降解研究: 以氟喹诺酮和苯胂酸类化合物为例[D]. 广州: 中国科学院大学(中国科学院广州地球化学研究所), 2018. ZHANG Z C. Study on photodegradation of typical veterinary drugs in water—Taking fluoroquinolones and benzarsonic acids as examples[D]. Guangzhou: Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, 2018 (in Chinese).
[56] 葛林科. 水中溶解性物质对氯霉素类和氟喹诺酮类抗生素光降解的影响[D]. 大连: 大连理工大学, 2009. GE L K. Effects of aqueous dissolved matter on photodegradation of phenicol and fluoroquinolone antibiotics[D]. Dalian: Dalian University of Technology, 2009 (in Chinese).
[57] 余子贤, 赵婧滢, 饶培源, 等. 静态水环境中抗生素赋存状态和迁移转化规律 [J]. 环境污染与防治, 2021, 43(7): 904-908. doi: 10.15985/j.cnki.1001-3865.2021.07.019 YU Z X, ZHAO J Y, RAO P Y, et al. Occurrence state and migration and transformation rule of antibiotics in static water environment [J]. Environmental Pollution & Control, 2021, 43(7): 904-908(in Chinese). doi: 10.15985/j.cnki.1001-3865.2021.07.019
[58] 赵富强, 高会, 李瑞婧, 等. 环渤海区域典型河流下游水体中抗生素赋存状况及风险评估 [J]. 中国环境科学, 2022, 42(1): 109-118. doi: 10.3969/j.issn.1000-6923.2022.01.013 ZHAO F Q, GAO H, LI R J, et al. Occurrences and risk assessment of antibiotics in water bodies of major rivers in Bohai Rim Basin [J]. China Environmental Science, 2022, 42(1): 109-118(in Chinese). doi: 10.3969/j.issn.1000-6923.2022.01.013
[59] 张永鹏. 渤海湾近岸海域抗生素及抗生素抗性基因的污染特征研究[D]. 天津: 天津大学, 2018. ZHANG Y P. Pollution characteristics of antibiotics and antibiotic resistance genes in the coastal area of Bohai Bay[D]. Tianjin: Tianjin University, 2018 (in Chinese).
[60] 郭行磐. 长江口滨岸水环境中抗生素抗性基因的赋存特征[D]. 上海: 华东师范大学, 2019. GUO X P. Occurrence and abundance of antibiotic resistance genes in aquatic environments along the Yangtze Estuary[D]. Shanghai: East China Normal University, 2019 (in Chinese).
[61] YUAN K, WANG X W, CHEN X, et al. Occurrence of antibiotic resistance genes in extracellular and intracellular DNA from sediments collected from two types of aquaculture farms [J]. Chemosphere, 2019, 234: 520-527. doi: 10.1016/j.chemosphere.2019.06.085 [62] MARTI E, VARIATZA E, BALCAZAR J L. The role of aquatic ecosystems as reservoirs of antibiotic resistance [J]. Trends in Microbiology, 2014, 22(1): 36-41. doi: 10.1016/j.tim.2013.11.001 [63] NIU Z G, ZHANG K, ZHANG Y. Occurrence and distribution of antibiotic resistance genes in the coastal area of the Bohai Bay, China [J]. Marine Pollution Bulletin, 2016, 107(1): 245-250. doi: 10.1016/j.marpolbul.2016.03.064 [64] LU J, ZHANG Y X, WU J, et al. Occurrence and spatial distribution of antibiotic resistance genes in the Bohai Sea and Yellow Sea areas, China [J]. Environmental Pollution, 2019, 252: 450-460. doi: 10.1016/j.envpol.2019.05.143 [65] CHEN J Y, SU Z G, DAI T J, et al. Occurrence and distribution of antibiotic resistance genes in the sediments of the East China Sea Bays [J]. Journal of Environmental Sciences, 2019, 81: 156-167. doi: 10.1016/j.jes.2019.01.016 [66] XU K H, WANG J, GONG H, et al. Occurrence of antibiotics and their associations with antibiotic resistance genes and bacterial communities in Guangdong coastal areas [J]. Ecotoxicology and Environmental Safety, 2019, 186: 109796. doi: 10.1016/j.ecoenv.2019.109796 [67] 姜春霞, 黎平, 李森楠, 等. 海南东寨港海水和沉积物中抗生素抗性基因污染特征研究 [J]. 生态环境学报, 2019, 28(1): 128-135. doi: 10.16258/j.cnki.1674-5906.2019.01.015 JIANG C X, LI P, LI S N, et al. Pollution characteristics of antibiotic resistance genes in seawater and sediment of Dongzhai Harbor, Hainan Province [J]. Ecology and Environmental Sciences, 2019, 28(1): 128-135(in Chinese). doi: 10.16258/j.cnki.1674-5906.2019.01.015
[68] TAN L, LI L Y, ASHBOLT N, et al. Arctic antibiotic resistance gene contamination, a result of anthropogenic activities and natural origin [J]. Science of the Total Environment, 2018, 621: 1176-1184. doi: 10.1016/j.scitotenv.2017.10.110 [69] CUADRAT R R C, SOROKINA M, ANDRADE B G, et al. Global ocean resistome revealed: Exploring antibiotic resistance gene abundance and distribution in TARA Oceans samples [J]. GigaScience, 2020, 9(5): giaa046. doi: 10.1093/gigascience/giaa046 [70] LU Z H, NA G S, GAO H, et al. Fate of sulfonamide resistance genes in estuary environment and effect of anthropogenic activities [J]. Science of the Total Environment, 2015, 527/528: 429-438. doi: 10.1016/j.scitotenv.2015.04.101 [71] RICHAUME A, SMIT E, FAURIE G, et al. Influence of soil type on the transfer of plasmid RP4p from Pseudomonas fluorescens to introduced recipient and to indigenous bacteria [J]. FEMS Microbiology Letters, 1992, 101(4): 281-291. [72] JIA J, GUAN Y J, CHENG M Q, et al. Occurrence and distribution of antibiotics and antibiotic resistance genes in Ba River, China [J]. Science of the Total Environment, 2018, 642: 1136-1144. doi: 10.1016/j.scitotenv.2018.06.149 [73] SIEBOR E, NEUWIRTH C. The new variant of Salmonella genomic island 1 (SGI1-V) from a Proteus mirabilis French clinical isolate harbours blaVEB-6 and qnrA1 in the multiple antibiotic resistance region [J]. Journal of Antimicrobial Chemotherapy, 2011, 66(11): 2513-2520. doi: 10.1093/jac/dkr335 [74] RANGASAMY K, ATHIAPPAN M, DEVARAJAN N, et al. Cloning and expression of the organophosphate pesticide-degrading α- β hydrolase gene in plasmid pMK-07 to confer cross-resistance to antibiotics [J]. BioMed Research International, 2018, 2018: 1535209. -



 下载:
下载:

