-
河网具有重要的环境、水文和社会功能[1]。平原河网地区是河流网状结构和城镇化特征显著的区域[2]。随着城市化水平的提高,平原河网地区河流生态状况水平普遍降低[3]。近年来,随着河湖环境污染综合整治工作的开展,尤其是环境基础设施建设、产业结构调整、水质提升等项目的实施,一些平原河网中小流域水系的水环境质量有所改善。然而,平原河网水系的水环境问题依然突出。如水体流速较慢且水流方向不定,水体自净能力差,污染物易累积[4];周边区域土地利用现状较复杂,面源污染严重[2];水体生物多样性低,水生态系统脆弱[5];水体污染负荷高且呈分散污染的特点,难管理;水系相互连通,相互影响,成效难以长久维持。平原河网水污染治理对于我国水环境治理至关重要。太湖流域位于长三角中心,为我国经济核心区之一[6],是典型的平原河网地区。该地区存在河网萎缩、水系连通受阻等问题[7],个别城区的河网污染亦很严重[8]。梁塘河位于中国民族工业和乡镇工业的摇篮江苏省无锡市,是太湖新城与老城的界河。该河西起五里湖穿过老城区、工业区,向东汇入京杭大运河。梁塘河两岸城市化水平高、人口密集。
潮汐式生态滤床已应用于生活污水治理、雨水回用及小范围河道生态治理中。通过选择最优人工湿地类型,选择适当进水方式、基质及植物,可组成特定生态滤床。该技术有如下优势:能适应较高污染负荷;能长久有效运行,维护管理方便;滤床进水、出水带动水体流动,可提高水体自净能力。因此,潮汐式生态滤床可应用于平原河网污染河流治理中。
本研究以梁塘河水系为例开展平原河网水环境生态治理工作,长期连续监测梁塘河NH4+-N质量浓度 ([NH4+-N]) 、TN、TP、高锰酸钾指数 (IMn) 等水质指标,并采集潮汐式生态滤床混合层基质样本进行微生物群落分析,为提升平原河网水体水质,特别是位于城区的平原河网水环境提供示范,同时也有助于推动其他类似水体的水污染治理,具有很好的参考和借鉴价值。
-
梁塘河西起五里湖,东至京杭运河,全长约5 390 m,是连通五里湖和京杭运河、蠡湖新城、太湖新城的一条天然纽带,也是无锡市城市总体规划确定的老城和新城之间的一条绿色开敞空间 (图1) 。梁塘河水质整体向Ⅴ类~劣Ⅴ类转变。TN、TP、[NH4+-N]和IMn分别为15.81 mg·L−1、1.65 mg·L−1、7.68 mg·L−1和20.62 mg·L−1。
近年来,针对梁塘河的治理已修建了生态湿地并开展支浜的环保疏浚[9],河畔许多工业企业也已搬迁,梁塘河的水质在短时间内有所改善。然而,由于其污染特点独特,两岸环境状况复杂,其水质改善效果难以长久维持。
梁塘河水流方向是从五里湖流向京杭运河,水质随流向逐渐变差。本研究于梁塘河治理前进行了为期一年的水质监测。以国考断面水质作为梁塘河总体水质,取样时间为每月中旬,监测结果见表1。梁塘河全年[NH4+-N]为Ⅴ类~劣Ⅴ类状态,最高可达4.63 mg·L−1,全年平均2.16 mg·L−1,已超过了Ⅴ类水质标准;TP仅个别月份较高,全年平均值为0.22 mg·L−1,达到了Ⅳ类水质标准;梁塘河IMn最高为18.34 mg·L−1,远超Ⅴ类水质标准,平均值为8.94 mg·L−1。
-
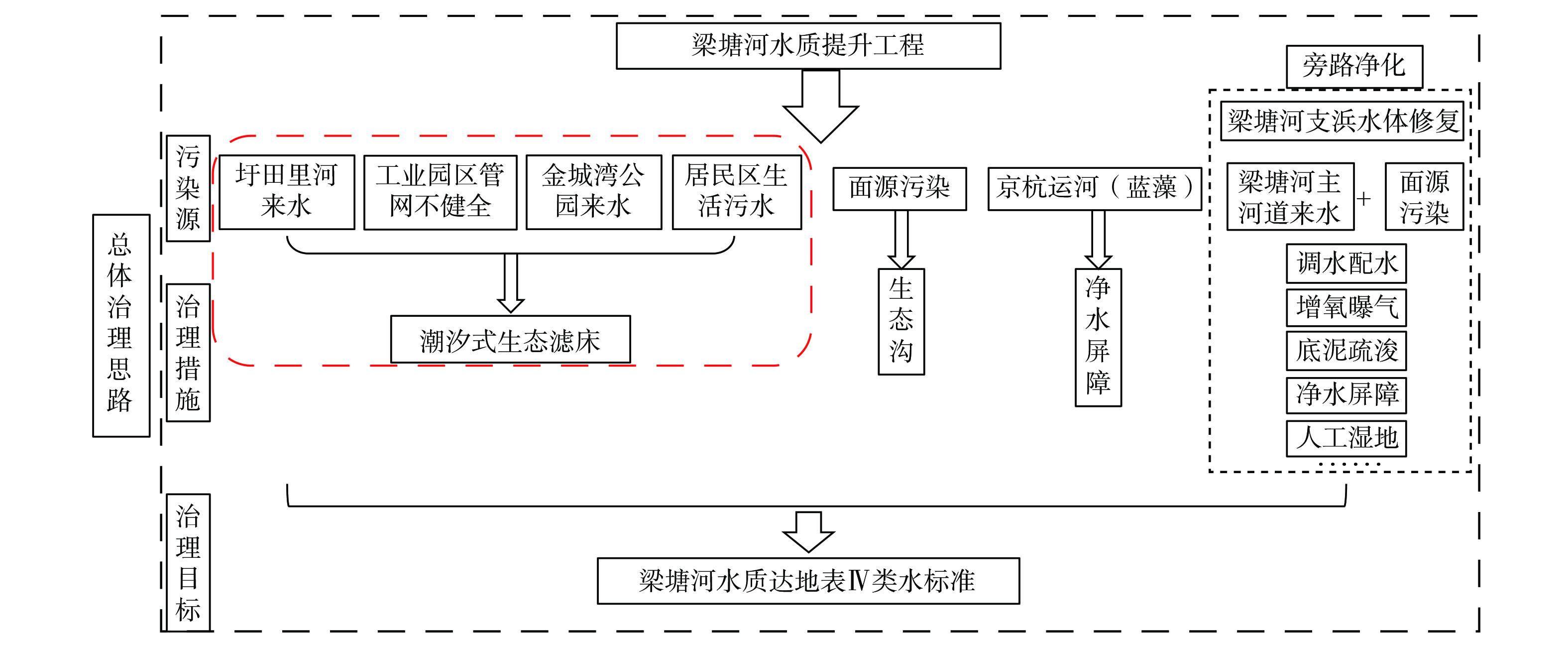
梁塘河水质提升工程总体设计思路 (图2) 包括主河道全段治理和支浜水系的水环境修复。梁塘河支浜水体修复区域位于周新东路与华清大道交界处,整治河段总长689 m,水面面积12 000 m2,河道水深1.9~2.8 m,水体总容量30 000 m3。支浜的治理方法有调水配水、曝气、底泥疏浚、底部生物载体、生态净水屏障、生物质炭阻隔墙、多级潜流人工湿地及阶梯湿地等。
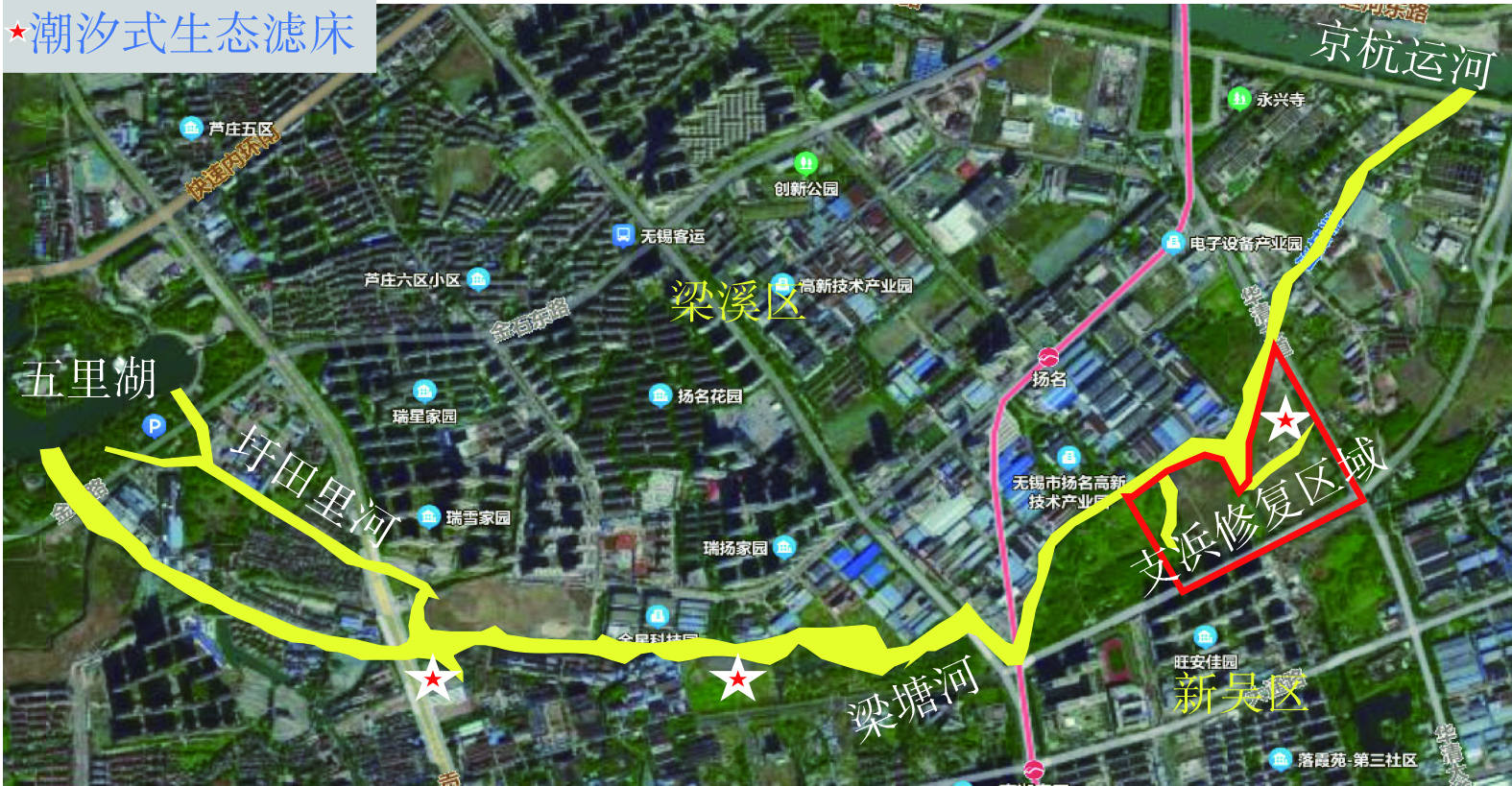
梁塘河主河道全长约长5 390 m,水面面积165 000 m2,河道水深2.6~5 m,水体总容量约577 500 m3。梁塘河主河道水体修复技术包括生态滤墙、生态沟、净水屏障和潮汐式生态滤床等。其中,潮汐式生态滤床是整个梁塘河水质提升项目中起最主要作用的工程,是贯穿梁塘河全河段的主体工程,其施工规模最大、耗时最长、耗资最多。图3是潮汐式生态滤床的布设位置。1号、2号滤床位于梁塘河与圩田里河交汇处,旨在处理两岸大量居民区的生活污水污染及圩田里河来水;3号滤床位于金星科技园下游,针对处理金星科技园及周围其他工业企业所引起的水体污染;4号滤床位于扬名工业园下游,针对处理扬名工业园管网不健全造成的水体污染。
-
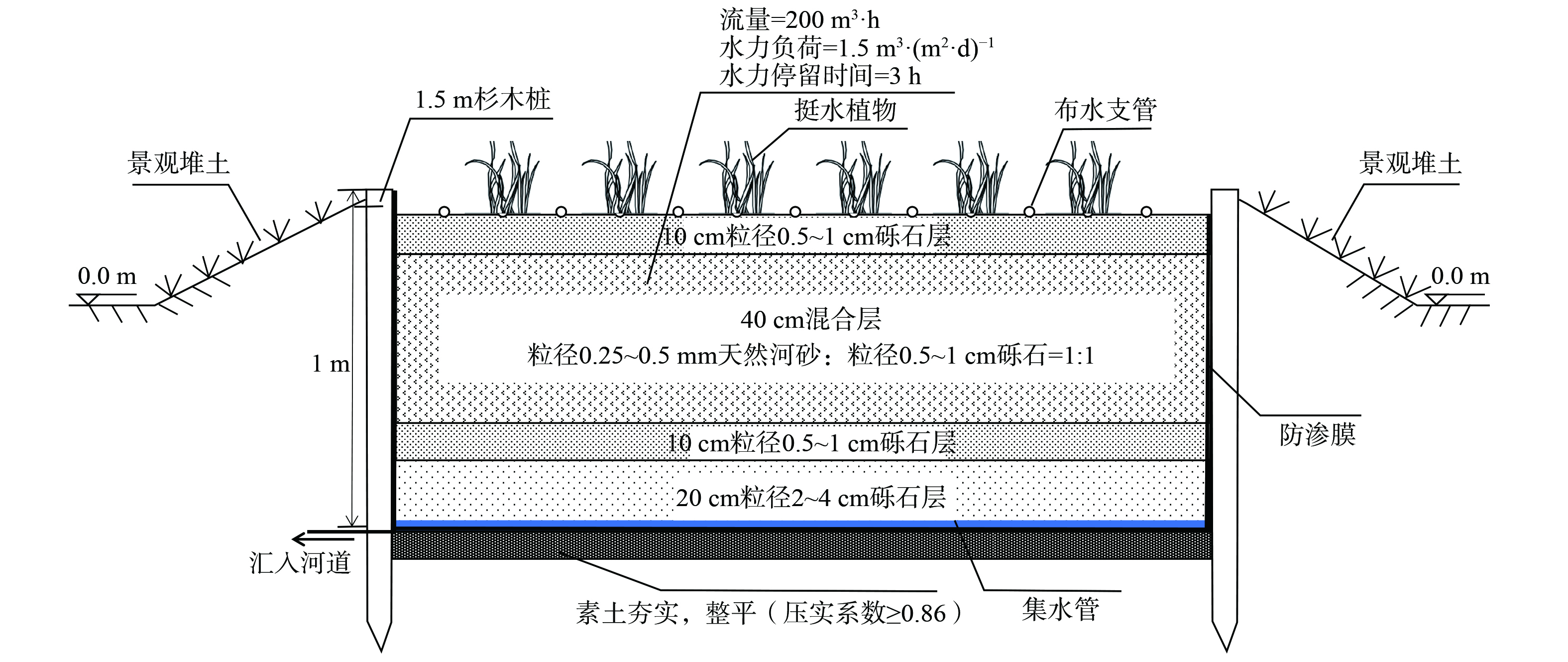
潮汐式生态滤床技术是基于人工湿地开发。通过确定最优人工湿地类型[10-12],选择适当的进水方式[13-16]、基质[17-18]及植物[19-21]最终设计形成以垂直潜流人工湿地为基础,采用间歇潮汐式进水的一种生态滤床技术。潮汐式生态滤床基质的设置从下至上分别为承托层、砾石层、混合层、砾石层。图4为潮汐式生态滤床剖面图。
-
检测项目包括潮汐式生态滤床进出水常规水质指标及潮汐式生态滤床内部微生物种群和群落分析。常规水质指标有NH4+-N、NO3−-N的质量浓度,TN、TP、高锰酸钾指数 (IMn) 。水样经过 0.45 μm滤膜过滤后根据《水和废水监测分析方法》测定各项水质指标。其中,采用纳氏试剂分光光度法测定NH4+-N的质量浓度 ([NH4+-N]) ,采用紫外分光光度法测定NO3−-N的质量浓度 ([NO3−-N]) ,采用碱性过硫酸钾消解紫外分光光度法测定总氮 (TN) ,采用钼酸铵分光光度法测定总磷 (TP) ,采用酸性高锰酸钾法测定IMn。
采用高通量测序技术对潮汐式生态滤床混合层填料进行分析,主要包括DNA提取,以及PCR扩增后的高通量测序。使用E.Z.N.A soil DNA kit试剂盒对样品微生物进行总DNA提取,完成基因组DNA抽提后,利用1% (质量分数) 琼脂糖凝胶电泳检测抽提的基因组DNA。按指定测序区域,合成带有barcode的特异引物。PCR 采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase;PCR仪:ABI GeneAmp® 9700型;每个样本3个平行,将同一样本的PCR产物混合后用2% (质量分数) 琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒 (AXYGEN公司) 切胶回收PCR产物,Tris_HCl洗脱;2% (质量分数) 琼脂糖电泳检测。由上海美吉生物科技有限公司利用Miseq PE300 (Illumina公司) 平台进行高通量测序。
-
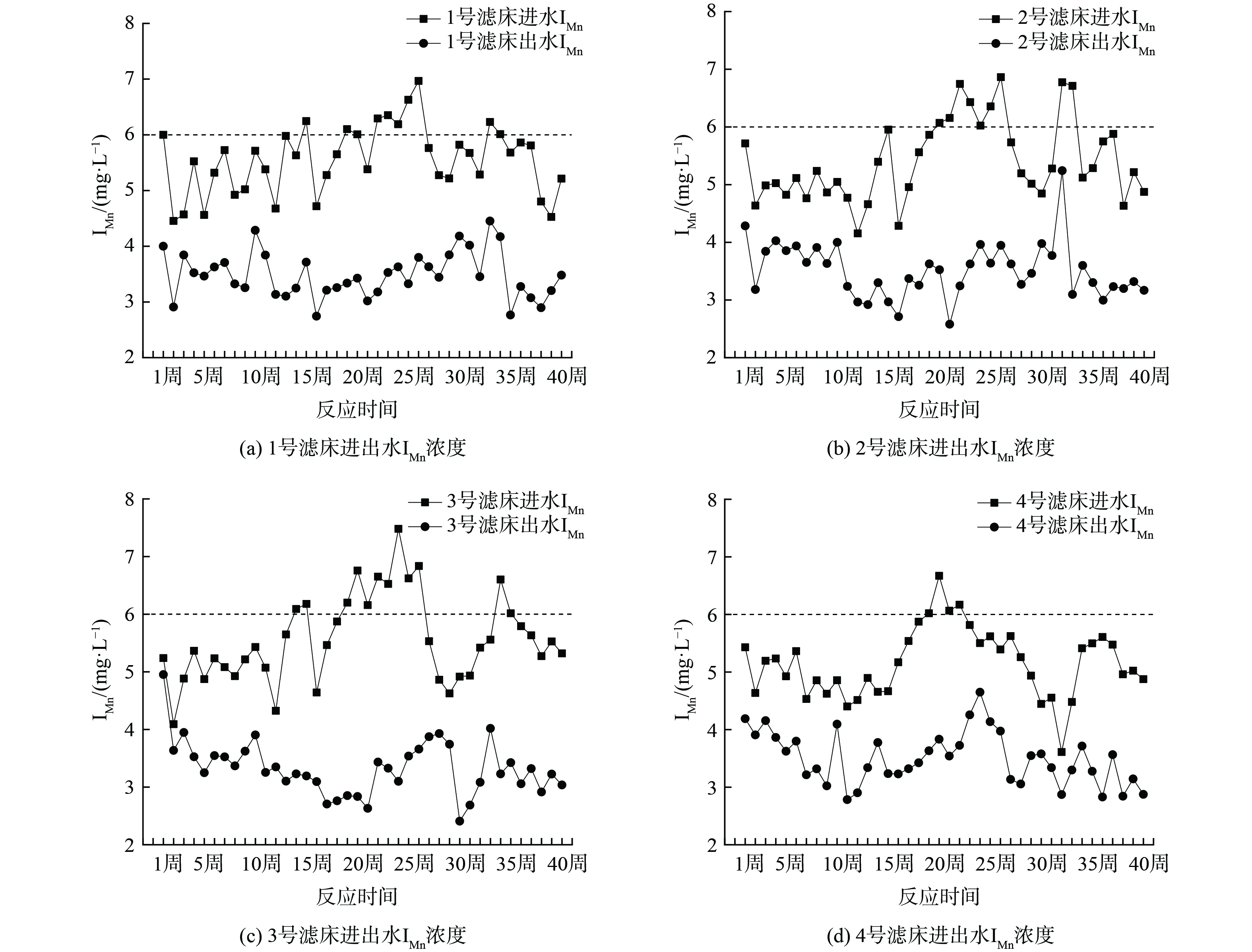
图5是潮汐式生态滤床进出水IMn的变化。4处滤床进水IMn分别为4.46~6.97 mg·L−1、4.15~6.86 mg·L−1、4.09~7.48 mg·L−1、3.61~6.67 mg·L−1;出水平均IMn为3.48 mg·L−1、3.51 mg·L−1、3.33 mg·L−1、3.50 mg·L−1,出水可达到Ⅱ类水质标准。IMn平均去除率为37.03%、34.56%、39.05%、32.00%。
-
图6为4处潮汐式生态滤床进出水[NH4+-N]的变化。4处滤床进水[NH4+-N]分别为0.17~3.11 mg·L−1、0.21~3.23 mg·L−1、0.13~3.56 mg·L−1、0.11~2.58 mg·L−1,为Ⅳ~Ⅴ类水质。随着滤床投入运行时间的延长,河道水体中的[NH4+-N]呈总体下降的趋势。由于期间经历2次持续降雨,雨水冲刷形成径流,将周边污染物汇入河流,造成了水体中[NH4+-N]升高,但之后水质能迅速恢复。在运行1周后,潮汐式生态滤床的NH4+-N去除能力即稳定高效。由于气候、季节原因,进水[NH4+-N]波动较大,滤床出水[NH4+-N]则稳定在一个较低范围,4块滤床平均出水[NH4+-N]分别为0.23、0.28 、0.34和0.15 mg·L−1,为Ⅱ类水质;NH4+-N平均去除率分别为84.20%、81.59%、78.01%、79.94%,最高去除率为99.42%,潮汐式生态滤床对NH4+-N的去除效果较好。
图7为4处滤床进出水[NO3−-N]的变化,进水平均[NO3−-N]分别为1.72、1.81、1.62、1.09 mg·L−1;出水平均[NO3−-N]为2.89、2.81、2.72、2.08 mg·L−1。进出水[NO3−-N]随时间推移均呈下降趋势,出水[NO3−-N]始终高于进水[NO3−-N]。这表明滤床内部发生了硝化反应,硝化细菌在好氧条件下经硝化作用将进水中NH4+-N转化为NO3−-N,而NO3−-N并未及时去除。分析其原因有两点,一是植物吸收NO3−-N的速率赶不上NH4+-N转化为NO3−-N的速率;另外滤床内部反硝化作用并不突出。
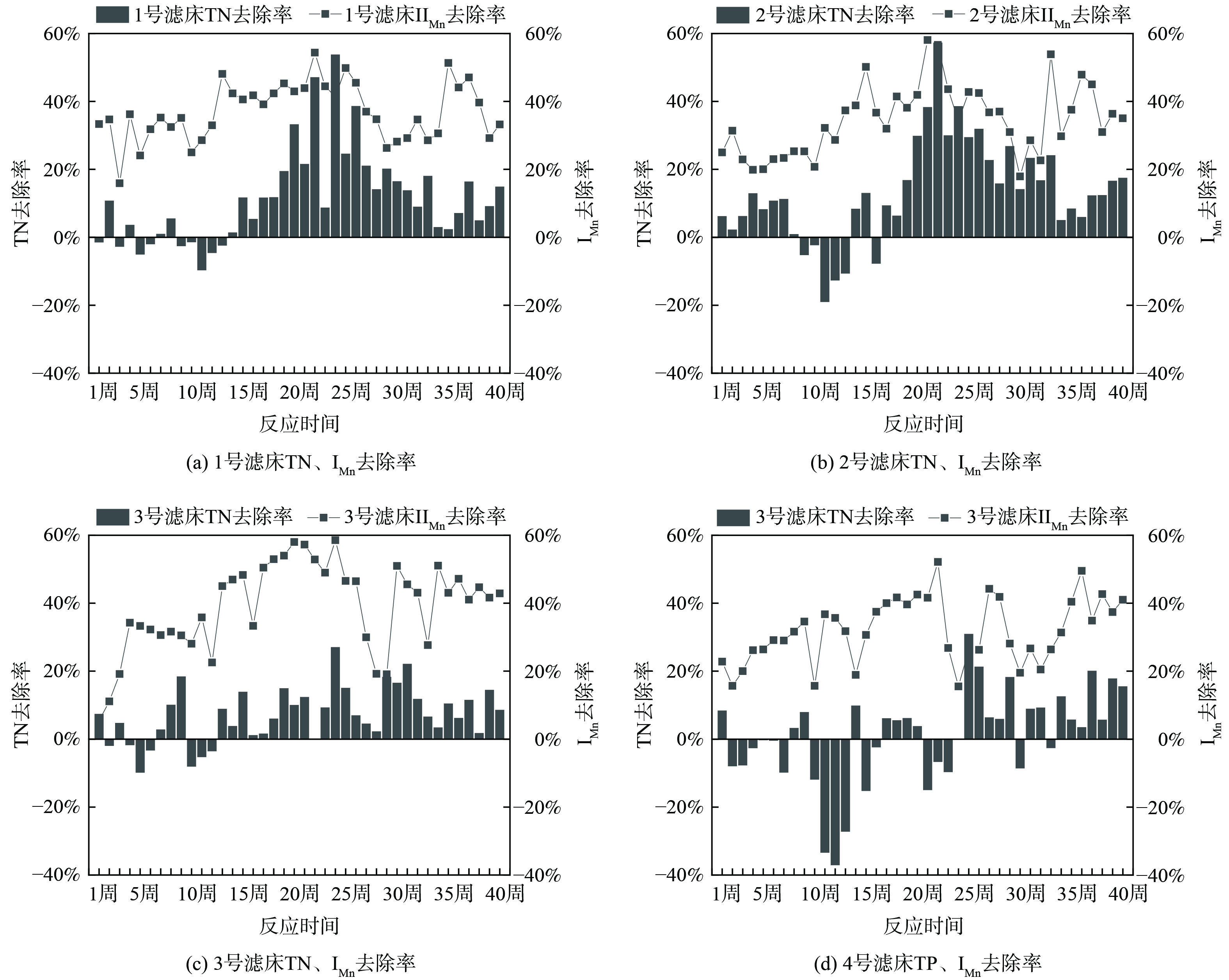
4处滤床进出水TN不大,进水平均TN分别为3.55、3.65、3.36、2.46 mg·L−1,出水平均TN分布为3.17、3.16、3.14、2.38 mg·L−1。图8展示了潮汐式生态滤床TN和IMn去除率的变化。TN去除率的变化大致可分为3个阶段:在前15周,大部分时间滤床出水TN高于进水TN,TN不降反增;第15至25周,TN去除率显著上升;第25周后,TN去除率逐渐下降。总体而言,在运行15周之后,各滤床的TN逐渐被去除,平均去除率分别为17.78%、20.01%、9.65%、6.31%。这是由于在前15周,滤床正处在运行初期,植物对NO3−-N的吸收作用不明显,且反硝化作用不突出;而在15周之后,滤床已运行了一定时间,滤床中植物的生长过程对NO3−-N的吸收起到关键性作用[22]。此外,IMn的去除率与TN去除率变化趋势基本相似,可见水中碳源消耗影响着TN的去除 (反硝化过程) 。
-
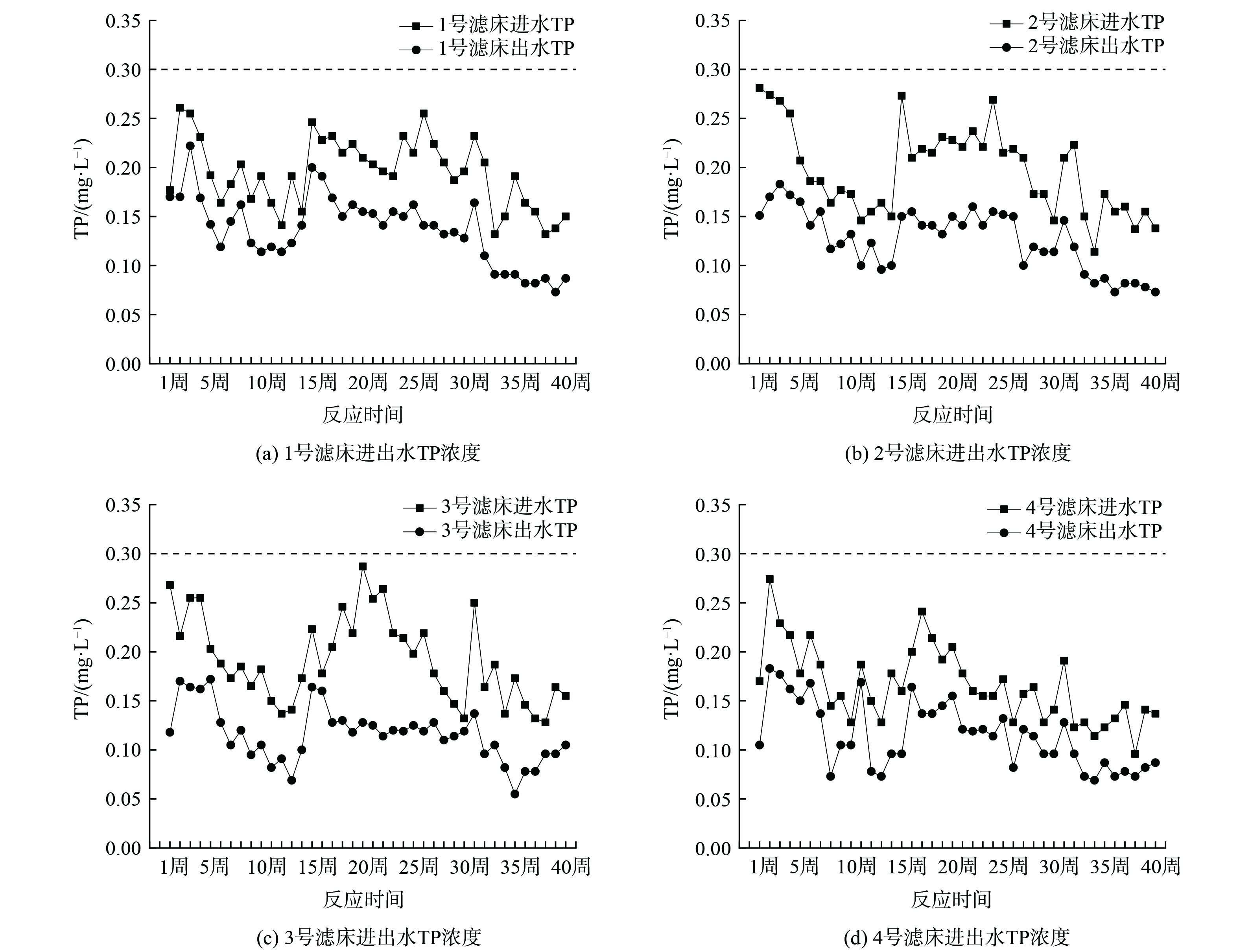
潮汐式生态滤床中磷的去除途径有植物吸收、微生物同化吸收及基质的截留吸附和化学沉淀,其中起主要作用的是基质的截留和吸附[23]。图9是潮汐式生态滤床进出水TP变化,4处滤床进水TP为0.13~0.26 mg·L−1、0.11~0.28 mg·L−1、0.13~0.29 mg·L−1、0.10~0.27 mg·L−1;出水TP有下降趋势,平均值分别为0.14、0.13、0.12、0.11 mg·L−1,达到Ⅲ类水质标准。潮汐式生态滤床对于TP的去除效果并不佳,平均去除率为30.17%、35.41%、38.71%、33.21%。
-
前文中对滤床进水水质监测结果表明,潮汐式生态滤床使得梁塘河水质随水流方向逐渐变好。以梁塘河国考断面处的水质代表梁塘河总体水质,梁塘河总体水质 (指标有[NH4+-N]、TN、TP、IMn) 情况如图10所示。治理后梁塘河的[NH4+-N]为0.05~3.39 mg·L−1,平均值为1.45 mg·L−1,相比于治理前的平均值2.16 mg·L−1有了大幅下降,基本达到Ⅳ类水质标准;治理后梁塘河的TN、TP、IMn平均值分别为3.21、0.16和5.28 mg·L−1,达到Ⅲ类水质标准。这表明治理后梁塘河总体水质稳定提高。滤床在运行期间经历了两次污染冲击,之后水质恢复迅速,[NH4+-N]、TN、TP均呈现下降趋势。特别是NH4+-N,其质量浓度下降趋势明显,IMn也始终稳定在一定范围内。
-
为比较运行时长及季节对潮汐式生态滤床微生物群落的影响,分别于运行3个月 (夏季,温度在32 ℃左右) 和9个月 (冬季,温度在10 ℃左右) 时采集4块滤床的混合层基质样本,取样深度为40 cm。样本采集编号分别为S1、S2、S3、S4,以及W1、W2、W3、W4。
-
通过微生物群落Alpha多样性分析可反映微生物群落的丰富度和多样性。对滤床运行过程中的样本进行高通量测序分析,其丰富度指数Sobs、Ace、Chao及多样性指数Shannon、Simpson如表2所示。8个样本微生物测序中Coverage均大于0.97,这说明测序结果很好的代表了样本的真实情况[24]。3号滤床运行3个月和运行9个月即S3和W3实际检测到的OTU数目 (Sobs) 分别为1 815、2 102,Ace为2 271.49、2 618.30,Chao为2 262.60、2 603.93,均小于其余3个滤床。这表明4块滤床中3号滤床丰富度最低。4号滤床运行3个月时的Shannon指数为6.46,高于其余3块滤床;运行9个月时的Shannon指数为6.63,仅略低于1号滤床;但4号滤床S4和W4的Simpson指数显著低于另外3个滤床。Simpson指数越低,多样性越高,因此,4块滤床中4号滤床微生物多样性最高。分析其原因是梁塘河水流方向是从五里湖流向京杭运河,4号滤床位于梁塘河下游,从上文水质监测数据可看出,水质随梁塘河流向逐渐好转,4号滤床进水水质相对最好,而水质较好的水体中微生物多样性和丰度都较高[25]。
-
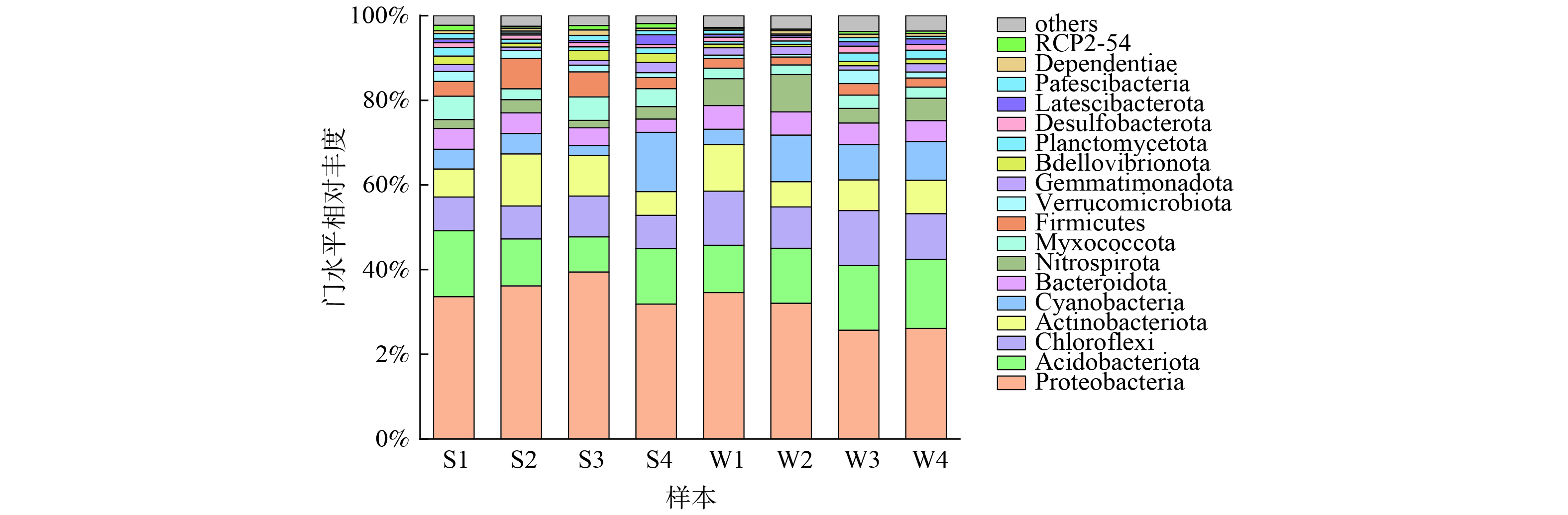
在运行3个月的基质样本中共检测出37个门、117个纲、285个目、418个科和690个属;在运行9个月的基质样本中检测出46个门、132个纲、285个目、415个科和666个属。随着滤床的运行,检测出微生物菌门有所增加。图11是运行3个月和运行9个月时潮汐式生态滤床在门水平上的群落组成,其中相对丰度排在前面的有:变形菌门 (Proteobacteria,25.68%~39.45%) 、酸杆菌门 (Acidobacteriota,8.29%~16.33%) 、放线菌门 (Actinobacteriota,5.58%~12.29%) 、绿弯菌门 (Chloroflexi,7.85%~13.03%) 、蓝细菌门 (Cyanobacteria,2.29%~14.0%) 等。变形菌门是土壤微生物中相对重要的一大门类,其丰富度高低可反映土壤养分含量高低,养分含量越高越有利于变细菌门生长[26]。变形菌门微生物通常具有多种代谢途径,生长较快,其在营养物质和有机物的去除中发挥着重要的作用,大多数反硝化菌就属于变细菌门[27]。酸杆菌门在潮汐式生态滤床中的相对丰度仅次于变形菌门。酸杆菌对于pH及土壤的C和N含量等环境因子的响应较为敏感[28]。放线菌门微生物是有机物的主要降解者,能降解复杂的有机物,在湿地净化方面起到重要作用[29]。绿弯菌形态多样,一般为多细胞丝状,通常出现在污水处理过程中[30],在C、N、S等元素的生物地球化学循环中绿弯菌门微生物起到十分重要的作用[31]。蓝细菌门微生物在富营养化较高的水域往往会成为优势种,形成蓝藻水华,对水环境造成重大威胁[32]。在潮汐式生态滤床中蓝细菌门有较大量的检出,主要是由于潮汐式生态滤床处理对象为位于太湖流域的梁塘河,夏季蓝藻水华问题较为严重。
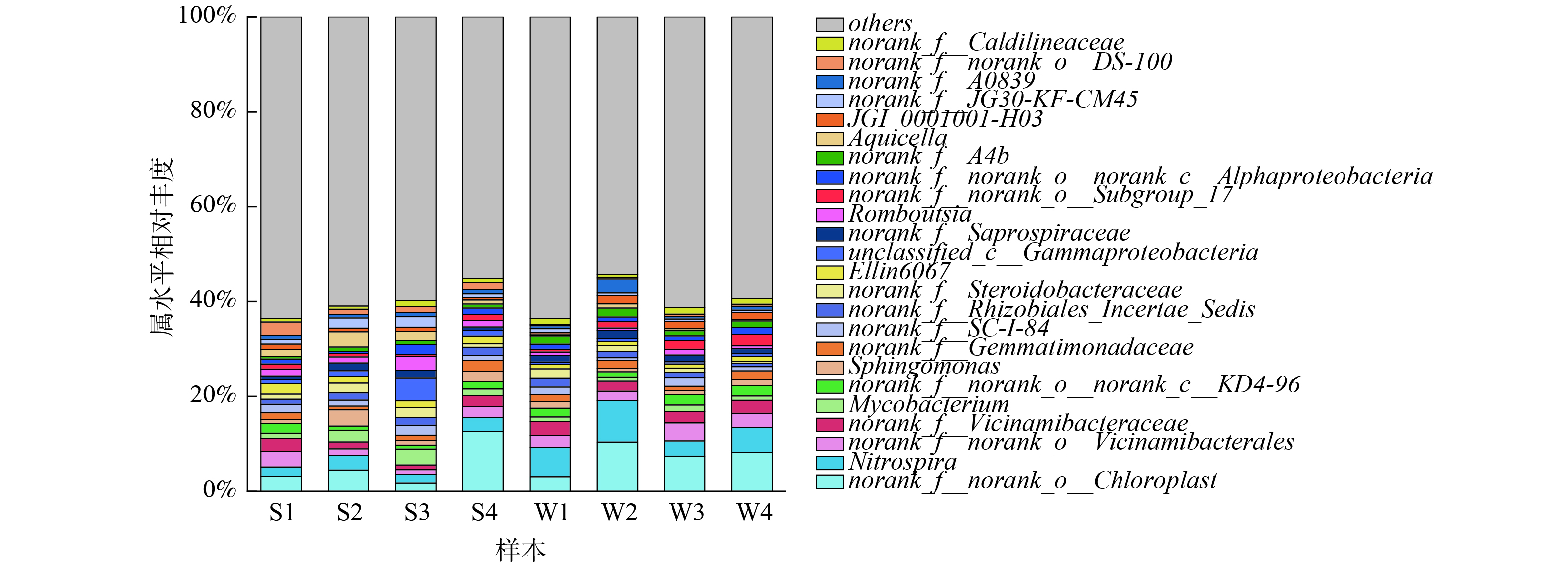
选择平均相对丰度大于1%的菌属绘制属水平群落结构图 (图12) 。其中,相对丰度排前列的有:蓝细菌纲 (Cyanobacteria) 下的norank_f_norank_o_Chloroplast (1.72%~12.61%) 、硝化螺旋菌属 (Nitrospiria,1.75%~8.75%) 、Vicinamibacteria纲下的norank_f_norank_o_Vicinamibacterales (1.15%~3.80%) 和norank_f_Vicinamibacteraceae (0.97%~2.94%) 、分枝杆菌属 (Mycobacterium,0.90%~3.36%) 等。其中,norank_f_norank_o_Chloroplast与硝化螺旋菌属的相对丰度远高于其他菌属。norank_f_norank_o_Chloroplast常常在人工湿地上覆水中作为第一优势菌属被检出[33],在潮汐式生态滤床中norank_f_norank_o_Chloroplast同样是作为第一优势菌属被检测出。值得注意的是,在运行3个月时硝化螺旋菌属相对丰度为1.75%~3.10%,在运行9个月时相对丰度为3.21%~8.75%,硝化螺旋菌属微生物相对丰度随滤床的持续运行增长显著。作为一类亚硝酸盐氧化细菌,硝化螺旋菌属微生物在硝化反应中发挥着重要作用[34]。这也就解释了为什么潮汐式生态滤床能有持续稳定的高NH4+-N去除率。norank_f_norank_o_Vicinamibacterales和norank_f_Vicinamibacteraceae都是Vicinamibacteria纲下的微生物。有研究表明Vicinamibacteria纲的微生物具有溶解P的作用,Vicinamibacterales目微生物的丰度与土壤中有效磷 (AP) 含量呈强相关性[35]。分枝杆菌属微生物是一类条件致病菌属微生物,可致人患结核病、麻风等,在自来水厂的水处理工艺过程中常常能检测出这类微生物[36]。潮汐式生态滤床中主要的反硝化菌属为变形菌门下的unclassified_p_Proteobacteria和unclassified_k_norank_d_Bacteria,分别占到检出反硝化菌属的48.77%~56.42%和15.98%~22.17%,与N2O的排放密切相关[37]。此外,unclassified_k_norank_d_Bacteria同样作为氨氧化菌被检测出,其相对丰度占检出氨氧化菌的1.91%~9.48%。主要的氨氧化菌为norank_f_Nitrosomonadaceae和亚硝化螺旋菌属 (Nitrosospira) ,分别占检出氨氧化菌的19.74%~61.38%和11.32%~52.83%。总体而言,由于受到潮汐式进水的影响,滤床复氧速度快,混合层取样点处长时间处于好氧或兼氧状态,这导致潮汐式生态滤床内部硝化反应强烈,而反硝化菌相对丰度较低,反硝化作用不突出。前文中NO3−-N的累积及TN去除率低便是由于这个原因造成的,TN的少量去除主要是由于植物生长需要吸收了大部分NO3−-N。此外,结合上文IMn浓度及去除率的变化,水中碳源的含量也影响着反硝化菌的生长。
-
图13显示的是运行3个月和运行9个月时潮汐式生态滤床样本独有和共有的OTU数。在运行3个月时,实际检测出的OTU数分别为1 994、2 048、1 815、2 235,其中共有的OTU数为930,占OTU 总数的45.97%,独有的OTU数分别为196、216、215、295,占各自检出OTU数的9.83%、10.55%、11.85%和13.20%。在运行9个月时,实际检出的OTU数分别为2 664、2 469、2 102、2 449,其中共有的OTU数为1 114,占OTU总数的46.01%,独有的OTU数分别为321、187、155、267,占各自检出OTU数的12.05%、7.57%、7.37%、10.90%。无论是运行3个月还是9个月都有近一半的OTU为共有的OTU,独有的OTU占比较小,这表明4块滤床微生物群落组成差异不大。
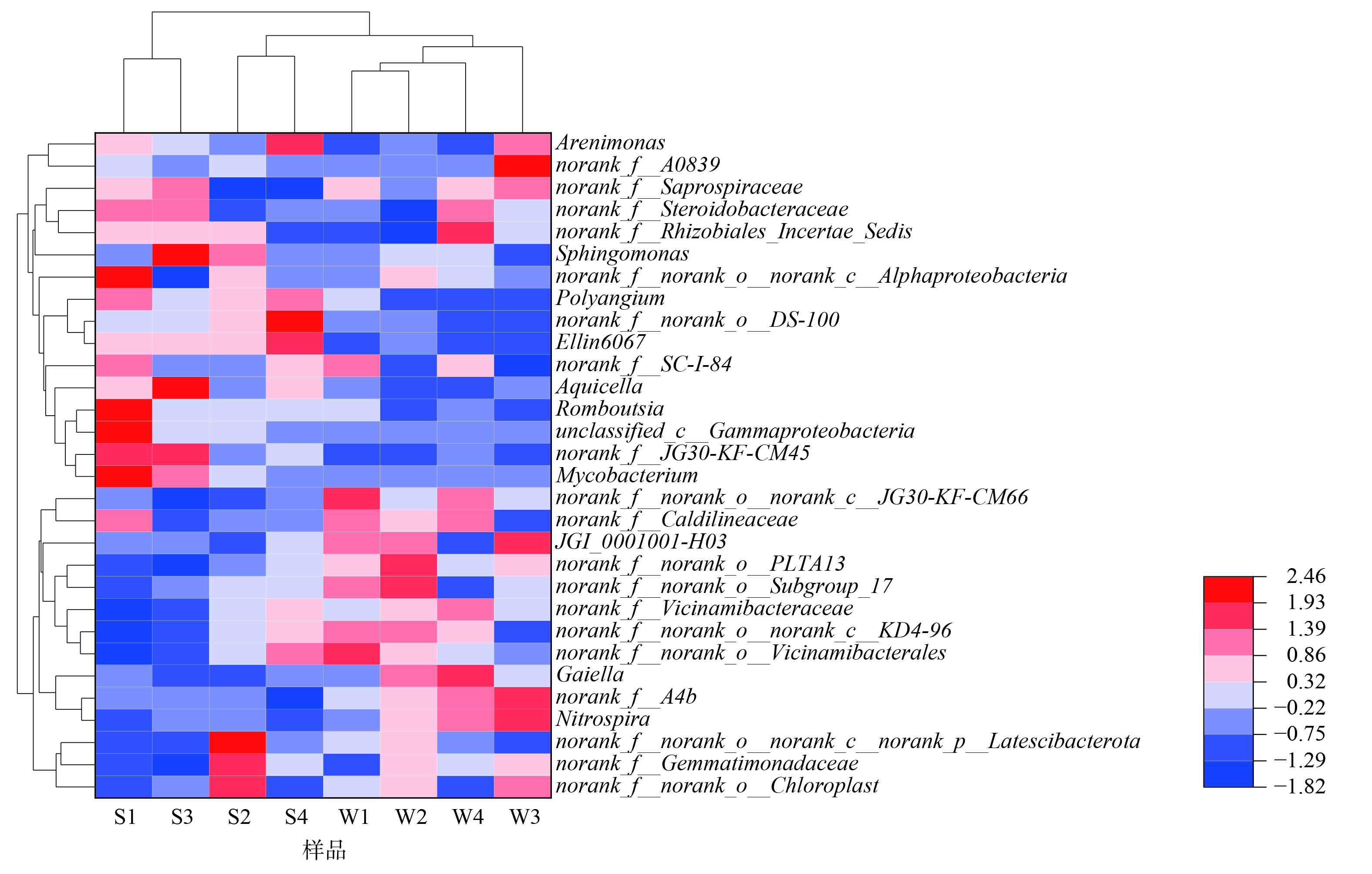
选择微生物属水平上前30的菌属绘制热图,并进行聚类分析 (图14) ,通过颜色梯度和相似程度可反映出样本在各分类水平上群落组成的相似性和差异性。W1、W2、W3、W4归为一支,而S1与S3构成一支,S2与S4构成一支。这表明运行时长会对滤床微生物组成造成一定差异,差异主要体现在相比于运行3个月、运行9个月时滤床内部有更多的norank_f_A4b (1.53%) 、norank_f_Caldilineaceae (1.13%) 、盖氏菌属 (Gaiella,1.28%) 、norank_f_norank_o_norank_c_JG30-KF-CM66 (1.25%) 和norank_f_norank_o_PLTA13 (1.23%) 。norank_f_A4b是一类潜在的亚硝酸盐还原菌,其对酸性条件表现出高度敏感性,在酸性条件下几乎检测不出[38]。norank_f_Caldilineaceae多为丝状菌,且能在低COD和高DO环境下生长,其部分菌属具有反硝化能力[39]。盖氏菌属是与金属相互作用最常见的类群[40],此外Gaiella occulta这类细菌的相对丰度与某些多环芳烃 (PAHs) 的质量浓度显著相关[41]。这表明盖氏菌属能参与某些PAHs的降解。有研究表明,norank_f_norank_o_PLTA13、norank_f_Caldilineaceae和norank_f_A4b是脱碳菌,其相对丰度仅与COD相关。相对丰度变低的有Ellin6067 (0.91%) 、unclassified_c_Gammaproteobacteria (0.56%) 、Aquicella (0.43%) 、norank_f_norank_o_DS-100 (0.38%) 和多囊菌属 (Polyangium,0.28%) 。γ-变形菌纲下的Ellin6067属噬酸,通常在酸性土壤中含量丰富,Ellin6067属在经生物炭改良的土壤中相对丰度会有所提高[42]。结合上文中对酸性条件呈现高敏感性的norank_f_A4b属相对丰度的增加,可判断潮汐式生态滤床内部为中性或碱性环境。unclassified_c_Gammaproteobacteria是一类反硝化菌,它对生物炭敏感[43],在废水处理过程中对氮去除具有重要作用[44]。Aquicella属同样归于γ-变形菌纲,是与土壤碳代谢最密切相关的微生物之一[45]。总结上文两组样本微生物相对丰度的变化,尽管存在一些差异,但其在OTU水平上的主成分分析 (PCA) (图15) 结果显示,两组样本间并不存在显著性差异 (P>0.05) 。而运行3个月时,正处夏季,温度约为32 ℃,运行9个月时则刚进入冬季,温度约为10 ℃。这也就表明夏季和冬季潮汐式生态滤床微生物群落组成无显著差异。
-
1) 潮汐式生态滤床对NH4+-N去除效果较好,去除率最高达到99.42%,平均去除率也高达80.94%;对TP和IMn的去除率分别为34.37%和35.65%。通过工程治理,梁塘河水质有所提高,以潮汐式生态滤床为主体的治理工程运行稳定。在受到污染冲击后,水质能迅速恢复,[NH4+-N]和TP下降明显,NH4+-N达到Ⅳ类水质标准,TP达到Ⅲ类水质标准。
2) 潮汐式生态滤床微生物群落分析结果表明,微生物在门水平上的群落组成不会随滤床的持续运行或季节的转变而变化,相对丰度排在前面的菌门有变形菌门 (Proteobacteria,25.68%~39.45%)、酸杆菌门 (Acidobacteriota,8.29%~16.33%) 、放线菌门 (Actinobacteriota,5.58%~12.29%) 、绿弯菌门 (Chloroflexi,7.85%~13.03%) 和蓝细菌门 (Cyanobacteria,2.29%~14.0%) 。属水平上的群落分析结果显示,norank_f_norank_o_Chloroplast与硝化螺旋菌属的相对丰度远高于其他菌属,分别占到1.72%~12.61%和1.75%~8.75%,而反硝化细菌菌属相对丰度极低,滤床内部硝化反应强烈,而反硝化并不突出。
3) 微生物群落相似性和差异性分析结果表明,相同运行时间,各滤床的群落组成差异不大;不同运行时长会对滤床微生物群落组成造成一定差异,但不存在显著性 (P>0.05) 。潮汐式生态滤床微生物群落组成不会因季节变化而发生大的改变。
潮汐式生态滤床在平原河网地区污染河流治理中的应用
Practice of tidal ecological filtering bed (TEF) to process in restoration polluted river in plain river network area
-
摘要: 以梁塘河治理措施中的主体工程潮汐式生态滤床为研究对象,考察其对平原河网地区污染河流中的N、P及有机污染物等的去除效果,并通过高通量测序技术分析潮汐式生态滤床混合层的微生物群落组成。结果表明,以潮汐式生态滤床为主体的治理工程运行稳定,河流水质趋好,且在受到污染冲击后,水质能迅速恢复。潮汐式生态滤床对[NH4+-N]有很好的去除效果,[NH4+-N]去除率最高为99.42%,平均去除率为80.94%。潮汐式生态滤床对TP和IMn也有一定的去除效果,平均去除率为34.37%和35.65%。潮汐式生态滤床内部硝化作用明显,微生物群落分析结果表明,滤床内主要的优势菌属是norank_f_norank_o_Chloroplast (1.72%~12.61%) 和硝化螺旋菌属 (Nitrospiria,1.75%~8.75%) 。norank_f_norank_o_Chloroplast作为第一优势菌属,其相对丰度远超其他菌属,且随着滤床的持续运行,具有硝化作用的硝化螺旋菌属相对丰度增长显著。微生物群落相似性和差异性分析结果表明,滤床微生物群落结构稳定,不受季节、温度的影响,尽管运行时长对滤床内部群落组成造成一定差异,但并不存在显著性。本研究以梁塘河水系为例开展水环境生态治理,一方面旨在提升梁塘河水环境质量,另一方面也为平原河网地区,尤其是位于城区的平原河网地区河流生态治理提供示范参考。Abstract: The tidal ecological filter bed (TEF), which is the main processt of Liangtang River restoration, was researched. The effect on the removal of nitrogen, phosphorus and organic pollutants in polluted rivers in plain river network area were investigated, and the microbial community composition of the TEF mixed layer was analyzed by high-throughput sequencing technology. The results showed that the operation of the TEF was stable, the water quality of the river tended to be better, and the water quality can recover quickly after being impacted by pollution. High NH4+-N removal efficiency of TEF was detected, the highest removal rate of NH4+-N was 99.45% and the average removal rate was 81.31%. The average removal rates of TP and IMn were 33.21% and 35.11%. Nitrification in the TEF was obvious, the microbial community analysis results showed that the dominant bacteria in the TEF were norank_f_norank_o_Chloroplast (1.72%-12.61%) and Nitrospiria, 1.75%~8.75%). As the first dominant bacteria, norank_f_norank_o_Chloroplas had a higher relative abundance than other bacteria. The relative abundance of Nitrospiria, which has nitrification, increased significantly with the continuous operation of the TEF. The results of similarity and difference analysis showed that the microbial community structure in the TEF was stable and was not affected by season and temperature. Although the running time had some difference on the community composition in the TEF, there was no significant difference. This study took Liangtang River as an example to carry out ecological management of water environment. On the one hand, it aimed to improve the water environment quality of Liangtang River; on the other hand, it also provided an example for ecological management of rivers in plain river network areas, especially those in urban plain river network areas, which had good reference significance.
-

-
表 1 治理前梁塘河水质监测数据
Table 1. The water quality of Liangtang River before treatment
月份 [NH4+-N]/(mg·L−1) TP/(mg·L−1) IMn/(mg·L−1) 1月 4.63 0.17 7.71 2月 2.45 0.17 7.14 3月 1.75 0.19 5.62 4月 1.28 0.30 11.28 5月 3.04 0.18 6.30 6月 2.57 0.16 9.54 7月 1.78 0.32 10.57 8月 1.87 0.22 6.85 9月 2.33 0.17 9.43 10月 1.76 0.38 10.21 11月 2.31 0.33 18.34 12月 0.14 0.06 4.26 平均 2.16 0.22 8.94 表 2 潮汐式生态滤床微生物多样性指数和丰富度指数
Table 2. Microbial diversity index and richness index of the TEF
Sample 测序数 丰富度指数 多样性指数 Coverage Sobs Ace Chao Shannon Simpson S1 54 080 1 994 2 598.71 2 599.58 6.14 0.006 6 0.975 9 S2 58 427 2 048 2 728.82 2 680.70 5.94 0.016 1 0.974 0 S3 53 723 1 815 2 271.49 2 262.60 5.99 0.007 6 0.979 8 S4 58 480 2 235 2 805.91 2 784.68 6.46 0.003 9 0.975 0 W1 45 425 2 664 3 244.29 3 140.47 6.67 0.006 2 0.972 7 W2 46 763 2 469 3 104.70 3 099.81 6.48 0.008 0 0.972 3 W3 47 309 2 102 2 618.30 2 603.93 6.04 0.015 6 0.977 0 W4 45 850 2 449 2 984.38 2 935.38 6.63 0.003 8 0.974 7 -
[1] WU Y Q, YU X, YAN Z, et al. Evolution of river network due to urbanization in the Southeast Yinzhou Plain of Yongjiang River Basin, China[J]. Journal of Cleaner Production, 2022, 379(P1): 134718. [2] 钟胜财, 胡婷, 郑小燕, 等. 生态文明背景下平原地区中小流域水系生态修复实践应用[J]. 环境生态学, 2021, 3(7): 49-55. [3] LI R, SONG S P, YUE Z. Evaluation of river ecological status in the plain river network area in the context of urbanization: A case study of 21 Rivers’ ecological status in Jiangsu Province, China[J]. Ecological Indicators, 2022, 142: 109172. doi: 10.1016/j.ecolind.2022.109172 [4] 马迎群, 曹伟, 赵艳民, 等. 典型平原河网区水体富营养化特征、成因分析及控制对策研究[J]. 环境科学学报, 2022, 42(2): 174-183. [5] 严以新, 蒋小欣, 阮晓红, 等. 平原河网区城市水污染特征及控制对策研究[J]. 水资源保护, 2008, 24(5): 1-3. doi: 10.3969/j.issn.1004-6933.2008.05.001 [6] 魏蓥蓥, 李一平, 翁晟琳, 等. 太湖流域城市化对平原河网水系结构与连通性影响[J]. 湖泊科学, 2020, 32(2): 553-563. [7] 林芷欣, 许有鹏, 代晓颖, 等. 城市化进程对长江下游平原河网水系格局演变的影响[J]. 长江流域资源与环境, 2019, 28(11): 2612-2620. [8] 罗国根, 何丽琼. 平原河网水污染特性及防治实践[J]. 环境与发展, 2019, 31(6): 47-48. doi: 10.16647/j.cnki.cn15-1369/X.2019.06.029 [9] 郭赟, 黄晓峰, 李海妮, 等. 城市河道环保疏浚与水利疏浚效果研究——以无锡市梁塘河薛家浜为例[J]. 环境工程技术学报, 2020, 10(3): 400-405. doi: 10.12153/j.issn.1674-991X.20190104 [10] 刘帅, 文韬, 马竞, 等. 基于多参数评价体系的三种人工湿地净化能力研究[J]. 中国给水排水, 2019, 35(12): 55-59. doi: 10.19853/j.zgjsps.1000-4602.2019.12.011 [11] ILYAS H, HULLEBUSCH E. A review on the occurrence, fate and removal of steroidal hormones during treatment with different types of constructed wetlands[J]. Journal of Environmental Chemical Engineering, 2020, 8(3): 103793. doi: 10.1016/j.jece.2020.103793 [12] SUN W J, ZHENG Z. Research on removal of fluoroquinolones in rural domestic wastewater by vertical flow constructed wetlands under different hydraulic loads[J]. Chemosphere, 2022: 135100. [13] 郭鹤方, 甄志磊, 赵林婷, 等. 潮汐流-潜流人工湿地对城市污染水体中氮的去除[J]. 环境化学, 2021, 40(12): 3887-3897. doi: 10.7524/j.issn.0254-6108.2021053002 [14] 程果, 杨永哲, 高壮, 等. 人工湿地-EAS系统在污泥厌氧消化液脱氮中的应用[J]. 工业水处理, 2017, 37(12): 34-37. doi: 10.11894/1005-829x.2017.37(12).034 [15] LIU Y, LIU X H, LI K, et al. Removal of nitrogen from low pollution water by long-term operation of an integrated vertical-flow constructed wetland: Performance and mechanism[J]. Science of the Total Environment, 2019, 652: 977-988. doi: 10.1016/j.scitotenv.2018.10.313 [16] 丁达江, 杨永哲, 吴雷, 等. 分段进水对深层床潮汐流人工湿地硝化-反硝化性能的影响[J]. 水处理技术, 2016, 42(11): 104-109. [17] 丁海静, 丁彦礼, 游俊杰, 等. 基质结构对人工湿地运行性能的影响分析[J]. 水处理技术, 2018, 44(12): 91-95. [18] 许光明. 基质配置对人工湿地性能及温室气体通量的影响研究[D]. 青岛: 青岛大学, 2020. [19] BEHARRELL M. Planting, selection and plant establishment in constructed wetlands in a tropical environment[J]. Wetlands Ecosystems in Asia, 2004: 311-329. [20] 王文垅. 低温季节西伯利亚鸢尾人工湿地对污染河水的净化研究[D]. 郑州: 郑州大学, 2014. [21] COSKUN D, BRITTO D, SHI W M, et al. How plant root exudates shape the nitrogen cycle[J]. Trends in Plant Science, 2017, 22(8): 661-673. doi: 10.1016/j.tplants.2017.05.004 [22] 彭宁彦. 抚河故道湿地植物水环境效应研究[D]. 南昌: 南昌大学, 2019. [23] FLORES L, GARCÍA J, PENA R, et al. Constructed wetlands for winery wastewater treatment: A comparative Life Cycle Assessment[J]. Science of the Total Environment, 2019, 659: 1567-1576. doi: 10.1016/j.scitotenv.2018.12.348 [24] 李玲丽. 复合人工湿地脱氮途径及微生物多样性研究[D]. 重庆: 重庆大学, 2015. [25] 孙寓姣, 陈程, 丁爱中, 等. 官厅水库水质特征及水体微生物多样性的响应[J]. 中国环境科学, 2015, 35(5): 1547-1553. doi: 10.3969/j.issn.1000-6923.2015.05.035 [26] LV X F, YU J B, FU Y Q, et al. A meta-analysis of the bacterial and archaeal diversity observed in wetland soils[J]. The Scientific World Journal, 2014, 2014: 437684. [27] WANG S Q, CUI Y B, LI A M, et al. Deciphering of organic matter and nutrient removal and bacterial community in three sludge treatment wetlands under different operating conditions[J]. Journal of Environmental Management, 2020, 260(C): 110159. [28] 刘彩霞, 董玉红, 焦如珍. 森林土壤中酸杆菌门多样性研究进展[J]. 世界林业研究, 2016, 29(6): 17-22. doi: 10.13348/j.cnki.sjlyyj.2016.0041.y [29] 李金业, 陈庆锋, 李青, 等. 黄河三角洲滨海湿地微生物多样性及其驱动因子[J]. 生态学报, 2021, 41(15): 6103-6114. [30] 房昀昊. 人工湿地和自然湿地细菌群落结构特征比较[D]. 长沙: 湖南大学, 2018. [31] 鲜文东, 张潇橦, 李文均. 绿弯菌的研究现状及展望[J]. 微生物学报, 2020, 60(9): 1801-1820. doi: 10.13343/j.cnki.wsxb.20200463 [32] 周磊, 李育森, 黄仙德, 等. 洪潮江水库浮游细菌群落空间分布及其与环境因子的关系[J]. 微生物学报, 2020, 60(10): 2253-2264. doi: 10.13343/j.cnki.wsxb.20190597 [33] 马香菊. 天津滨海人工湿地细菌种群特征及氮降解菌筛选[D]. 北京: 中国环境科学研究院, 2021. [34] 洪义国, 焦黎静, 吴佳鹏, 等. 海洋亚硝酸盐氧化细菌的多样性分布及其生态功能研究进展[J]. 热带海洋学报, 2021, 40(2): 139-146. doi: 10.11978/2020043 [35] WU X J, PENG J J, LIU P F, et al. Metagenomic insights into nitrogen and phosphorus cycling at the soil aggregate scale driven by organic material amendments[J]. Science of the Total Environment, 2021, 785: 147329. doi: 10.1016/j.scitotenv.2021.147329 [36] 蔡广强, 张金松, 刘彤宙, 等. 活性炭-超滤深度处理工艺中细菌群落时空分布及动态变化规律[J]. 环境工程学报, 2021, 15(4): 1465-1472. doi: 10.12030/j.cjee.202008166 [37] GUO H H, GU J, WANG X J, et al. Microbial driven reduction of N2O and NH3 emissions during composting: Effects of bamboo charcoal and bamboo vinegar[J]. Journal of Hazardous Materials, 2020, 390: 121292. doi: 10.1016/j.jhazmat.2019.121292 [38] SHI S H, HE L, ZHOU Y, et al. Response of nitrogen removal performance and microbial community to a wide range of pH in thermophilic denitrification system[J]. Bioresource Technology, 2022, 352: 127061. doi: 10.1016/j.biortech.2022.127061 [39] 陈祥瑞, 杜强强, 韩文杰, 等. 基于纯膜MBBR的紧凑型污水处理BFM中试基质转化特性[J]. 环境工程学报, 2021, 15(11): 3741-3756. doi: 10.12030/j.cjee.202107149 [40] LIU B, YAO J, MA B, et al. Metal(loid)s diffusion pathway triggers distinct microbiota responses in key regions of typical karst non-ferrous smelting assembly[J]. Journal of Hazardous Materials, 2022, 423(PB): 127164. [41] ZHANG Q Y, GAO M, SUN X H, et al. Nationwide distribution of polycyclic aromatic hydrocarbons in soil of China and the association with bacterial community[J]. Journal of Environmental Sciences, 2023, 128: 1-11. doi: 10.1016/j.jes.2022.07.026 [42] YANG C D, LIU J J, YING H C, et al. Soil pore structure changes induced by biochar affect microbial diversity and community structure in an Ultisol[J]. Soil & Tillage Research, 2022, 224: 105505. [43] DENG L T, LIU W Y, CHANG N, et al. Disentangling the coupling relationships between functional denitrifiers and nitrogen transformation during cattle-manure and biochar composting: A novel perspective[J]. Bioresource Technology, 2022, 367: 128235. [44] YU J, GU J, WANG X J, et al. Effects of inoculation with lignocellulose-degrading microorganisms on nitrogen conversion and denitrifying bacterial community during aerobic composting[J]. Bioresource Technology, 2020, 313: 123664. doi: 10.1016/j.biortech.2020.123664 [45] ZHOU W J, QIN X, DEGUO L, et al. Effect of glucose on the soil bacterial diversity and function in the rhizosphere of Cerasus sachalinensis[J]. Horticultural Plant Journal, 2021, 7(4): 307-317. doi: 10.1016/j.hpj.2021.02.002 -



 下载:
下载: