-
氟是自然界中广泛存在的元素之一,也是人体生长必须的微量元素[1]。我国在《生活饮用水卫生标准》(GB 5749-2022)中规定了氟离子的最大允许浓度为1.0 mg·L−1,超过这一范围可能会导致骨骼变形,甚至引起机体慢性中毒[2-3]。由于饮用高氟地下水而导致的氟中毒在我国十分普遍[4]。我国的高氟地下水主要分布于北方的干旱、半干旱地区[5]。其中,关中盆地地热水中氟含量可达1.2~6.9 mg·L−1[6]。因此,开发高效的除氟方法具有重要意义。
氟化物的去除方法主要有沉淀法、离子交换法、膜分离法和吸附法等[7-8]。吸附法因具有成本效益高、操作简单、去除率高、吸附剂可重复使用等优点,在除氟方面具有很大潜力[9-10]。目前,常用的吸附剂主要有活性氧化铝、骨炭、羟基磷灰石等[11],但常规吸附剂普遍存在吸附容量低的缺点[12]。
粉煤灰是燃煤电厂排放的最主要固体废弃物,也是当前我国排放量较大的工业固体废渣之一。粉煤灰与沸石分子筛(zeolite molecular sieve, ZMS)组成相似[13],可用于合成沸石分子筛,在某些情况下可以降低40%左右的成本,是一种有前途的固体废物再利用技术[14]。废弃贝壳是贝类养殖的副产物,由于难自然分解,已成为世界性的环境问题。而贝壳中碳酸钙含量高达95%,因此,可作为很好的绿色钙源用于制备羟基磷灰石[15]。羟基磷灰石(hydroxyapatite, HAP)是钙磷灰石(Ca10(PO4)6(OH)2)的自然矿化物,由于有较强的离子交换和生物相容性,被认为是一种潜在的吸附剂[16]。但常规HAP比表面积和活性位点少,导致其除氟容量较低[17]。表面改性技术已被证明可以有效提高HAP的吸附能力[18],而表面活性剂因具有可以降低溶液表面张力的特性,使粒子更加具有亲水性,成为羟基磷灰石表面改性的绝佳选择[19]。PRABHU等[20]采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide, CTAB)等阳离子表面活性剂改性HAP,使改性后HAP的除氟容量由2.6 mg·g−1提高到9.4 mg·g−1。但HAP存在着合成成本高、自身力学性能较差、抗剪切、弯曲强度低等问题,极大地限制了其实际应用潜力,而合成HAP复合材料可以改善力学性能上的缺陷,提高其性能和实用性[21]。沸石由于其独特的特点,能够和HAP合成性能更好的吸附材料。目前国内外将复合材料应用于含F−地下水的处理已成研究热点,但依然不完全具备经济、环保又适合大规模推广应用的条件[22]。所以寻求低成本的除氟吸附剂显得尤为重要。
综上所述,本研究利用废弃贝壳和粉煤灰为原料合成CTAB-HAP@ZMS复合吸附剂,探究了其对水溶液中氟的去除行为,并用于解决关中盆地地热水氟污染的问题。该研究不仅可以解决废弃物资源浪费的难题,还能降低复合材料的制备成本,可为低成本的复合吸附剂除氟提供一种新的思路。
-
实验用到的试剂有扇贝壳、粉煤灰、NaOH、 (NH4)2HPO4 、NH4H2PO4、尿素、盐酸、柠檬酸钠、NaF、十六烷基三甲基溴化铵、溴化钾。其中,盐酸来自天津市天力化学试剂有限公司,柠檬酸钠来自天津市致远化学试剂有限公司,扇贝壳产自青岛,其余试剂均来自天津市大茂化学试剂厂。此外,实验所用粉煤灰规格为F级,其余试剂规格均为分析纯。
-
1)HAP制备。以扇贝壳为原料,尿素为沉淀剂,通过水浴反应将碳酸钙转化为羟基磷灰石(HAP)[23]。将扇贝壳洗净、烘干、研磨、筛分后置于干燥环境中储存备用。称取2.5 g扇贝粉、0.860 9 g (NH4)2HPO4、0.988 1 g NH4H2PO4,加入30 mL蒸馏水混合均匀,将尿素按照1%浓度加入混合物中,pH调至6~7。将混匀后的混合液置于水浴锅中进行蒸馏,温度设施为80 ℃。蒸馏30 min后离心,取悬浊液继续蒸馏30 min,最后得到絮状沉淀物,将该絮状沉淀物抽滤、烘干、研磨后即可得到纳米带状羟基磷灰石[15]。
2) ZMS制备。以粉煤灰为原料,采用碱熔融-水热法合成粉煤灰基沸石分子筛(ZMS)[24]。将粉煤灰原粉与氢氧化钠按1∶1.2比例混合均匀,置于马弗炉中650 ℃煅烧1 h,将冷却后的样品研磨并按照液固比20 mL:1 g−1加水搅拌,即可得到硅铝凝胶,将硅铝凝胶放置24 h自然老化。向老化后的凝胶中补加一定碱液使氢氧化钠与硅铝凝胶进行充分反应,置于恒温干燥箱中120 ℃水热晶化12 h,将所得样品洗涤、过滤后80 ℃烘干2 h,得到粉煤灰基沸石分子筛。
3) CTAB-HAP@ZMS制备。采用PRABHU[20]的方法制备CTAB-HAP@ZMS复合材料。配制浓度为1 mmol·L−1的十六烷基三甲基溴化铵(CTAB)溶液,称取10 g HAP加入50 mL CTAB中混合均匀,将所制得的混合溶液置于磁力搅拌器上连续搅拌5 h,洗涤、过滤,70 ℃烘干5 h,即可得到CTAB改性后的羟基磷灰石(CTAB-HAP)。
将改性后的羟基磷灰石和沸石分子筛按比例进行混合,置于马弗炉中80 ℃条件下水热反应10 h,将所得样品洗涤、过滤、烘干后即可得到CTAB-HAP@沸石分子筛复合材料(CTAB-HAP@ZMS)。
-
用X射线衍射仪(D8 Advance,德国布鲁克公司)在扫描角度为10°~80°和扫描速度为5 °·min−1下对样品进行晶相分析;用扫描电镜(Quanta 650型,美国FEI公司)对样品进行表面形貌分析;用傅里叶变换红外光谱仪(Spectrum two,珀金埃尔默有限公司)在500~4 000 cm−1扫描范围及4 cm−1·s−1的分辨率下,分析样品表面官能团。
-
1) 物料比对除氟效果的影响。按照ZMS:CTAB-HAP为1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7的比例制备CTAB-HAP@ZMS复合材料,并按4 g·L−1的投加量分别将不同比例的ZMS:CTAB-HAP复合吸附剂投加到10 mg·L−1的氟化钠溶液中进行吸附实验,在200 r·min−1、室温条件下振荡吸附12 h后过滤,测定水样中剩余F−的浓度。采用氟离子选择性电极法测定其电位值,代入标准曲线后计算水样中剩余F−的浓度。复合材料的吸附容量和去除率根据式(1)和式(2)进行计算。
式中:qt为t时刻的吸附容量,mg·g−1;C0、Ct分别是初始时刻和t时刻的F−质量浓度,mg·L−1;V为溶液的体积,L;m为复合吸附剂的投加量,g;R为去除率,%。
2)吸附剂投加量对除氟效果的影响。将物料比为1∶6的CTAB-HAP@ZMS复合材料按照1、2、4、6、8、10、12 g·L−1的投加量分别加入10 mg·L−1的氟化钠溶液中,在200 r·min−1、室温条件下振荡吸附12 h后过滤,测定水样中剩余F−的浓度。
3)氟化钠初始浓度对除氟效果的影响。配制5、10、20、30、40、50、60、70、80、90、100 mg·L−1的氟化钠溶液,按8 g·L−1的投加量分别将物料比为1:6的CTAB-HAP@ZMS复合吸附剂投加到不同浓度的氟化钠溶液中进行吸附实验,在200 r·min−1、室温条件下振荡吸附12 h,过滤,测定水样中剩余F−的浓度。
4)反应温度对除氟效果的影响。在含有10 mg·L−1氟化钠溶液的50 mL聚乙烯锥形瓶中加入物料比为1∶6,投加量为8 g·L−1的CTAB-HAP@ZMS复合吸附剂,并分别在温度为30、35、40、45、50、55 ℃时进行吸附实验,在200 r·min−1条件下振荡吸附12 h后过滤,测定水样中剩余F−浓度。
5) pH对除氟效果的影响。配制10 mg·L−1的氟化钠溶液,在pH为1、3、5、7、9、11、13的条件下进行吸附实验,将氟化钠溶液置于50 mL聚乙烯锥形瓶中,加入物料比为1∶6,投加量为8 g·L−1的CTAB-HAP@ZMS 复合吸附剂,在200 r·min−1、室温条件下振荡吸附12 h后过滤,测定水样中剩余F−的浓度。
6) 探究Cl−、SO42−、CO32−和NO3− 4种阴离子对吸附性能的影响。按照比例称取一定量的含有上述阴离子的钠盐(100、200、300 和 400 mg·L−1)溶于氟化钠中,在 200 r·min−1、室温下振荡 12 h,过滤后测定氟离子浓度。
7)模拟地热水除氟实验。据资料显示,关中盆地地热水中中污染元素主要为F−、Cu2+、Cr3+、Cd2+和Pb2+。以北大东大渔场地热水为例[6,25],按照其含量用氟化钠、硝酸铜、硝酸铬、硝酸镉和硝酸铅分别配制成8.0 mg·L−1 F−、2.6 mg·L−1 Cu2+、2.0 mg·L−1 Cr3+、0.1 mg·L−1 Cd2+和3.0 mg·L−1 Pb2+的溶液,将上述溶液等比例混合后得模拟水样。将投加量为8.0 g·L−1的CTAB-HAP@ZMS复合吸附剂加入模拟废水中进行震荡吸附,过滤后测定氟离子浓度。
8)吸附动力学实验。将物料比为1∶6的CTAB-HAP@ZMS复合吸附剂按照8 g·L−1的投加量加入10 mg·L−1的氟化钠溶液中,在200 r·min−1、室温条件下振荡吸附,分别在0.5、1、1.5、2、2.5、3、4、5、6、7 h时取水样进行过滤,测定F−浓度。分别使用准一级动力学方程和准二级动力学方程对实验数据进行线性拟合计算。准一级动力学方程和准二动力学方程分别如式(3)和式(4)所示。
式中:qe和qt分别为平衡时刻和t时刻的吸附容量,mg·g−1;t为吸附时间,min;k1为准一级动力学速率常数,min−1、k2为准二级动力学速率常数,mg·(g·min)−1。
9)吸附等温线实验。制备10、20、30、40、50、60、70、80 mg·L−1的氟化钠溶液,分别在298、308、318 K温度条件下加入CTAB-HAP@ZMS复合吸附剂进行震荡吸附,过滤后测量水样中F−浓度。根据Langmuir(式(5))和Freundlich(式(6))等温吸附模型对实验数据进行拟合。
式中:Ce为吸附平衡时的F−质量浓度,mg·L−1;qm为最大吸附容量,mg·g−1;KL为Langmuir吸附常数;KF为Freundlich吸附常数;n为吸附强度指数。
此外,通过计算不同温度下的热力学参数,以判断吸附过程是否自发进行,计算公式如(式(7))和(式(8))所示。
式中:∆G为吉布斯自由能,kJ·moL−1;∆H为焓变,kJ·moL−1;∆S为熵变,kJ·(mol·K)−1;R是理想气体常数,为8.314 J·(mol·K)−1;T为温度,K。
-
采用NaOH作为解吸剂[26]对充分吸附氟离子后的CTAB-HAP@ZMS进行解吸。称取 0.5 g吸附后的吸附剂,分别加入0.5、1.0、2.0、3.0 mol·L−1的NaOH溶液中超声处理2 h。另外称取4份0.5 g反应后的吸附剂加入0.5 mol·L−1 NaOH溶液中进行超声处理,分别超声0.5、1、1.5、2 h确定最佳再生条件。将处理后的吸附剂抽滤、洗涤、烘干,得到一次再生吸附剂。按照8 g·L−1的投加量将一次再生吸附剂加入10 mg·L−1氟化钠溶液中震荡吸附,过滤后测定氟离子浓度。此外,将复合吸附剂在NaOH浓度为0.5 mol·L−1和2 h的超声时间下4次循环再生,并对10 mg·L−1的氟化钠溶液进行吸附实验,以评估吸附剂的再生性能。
-
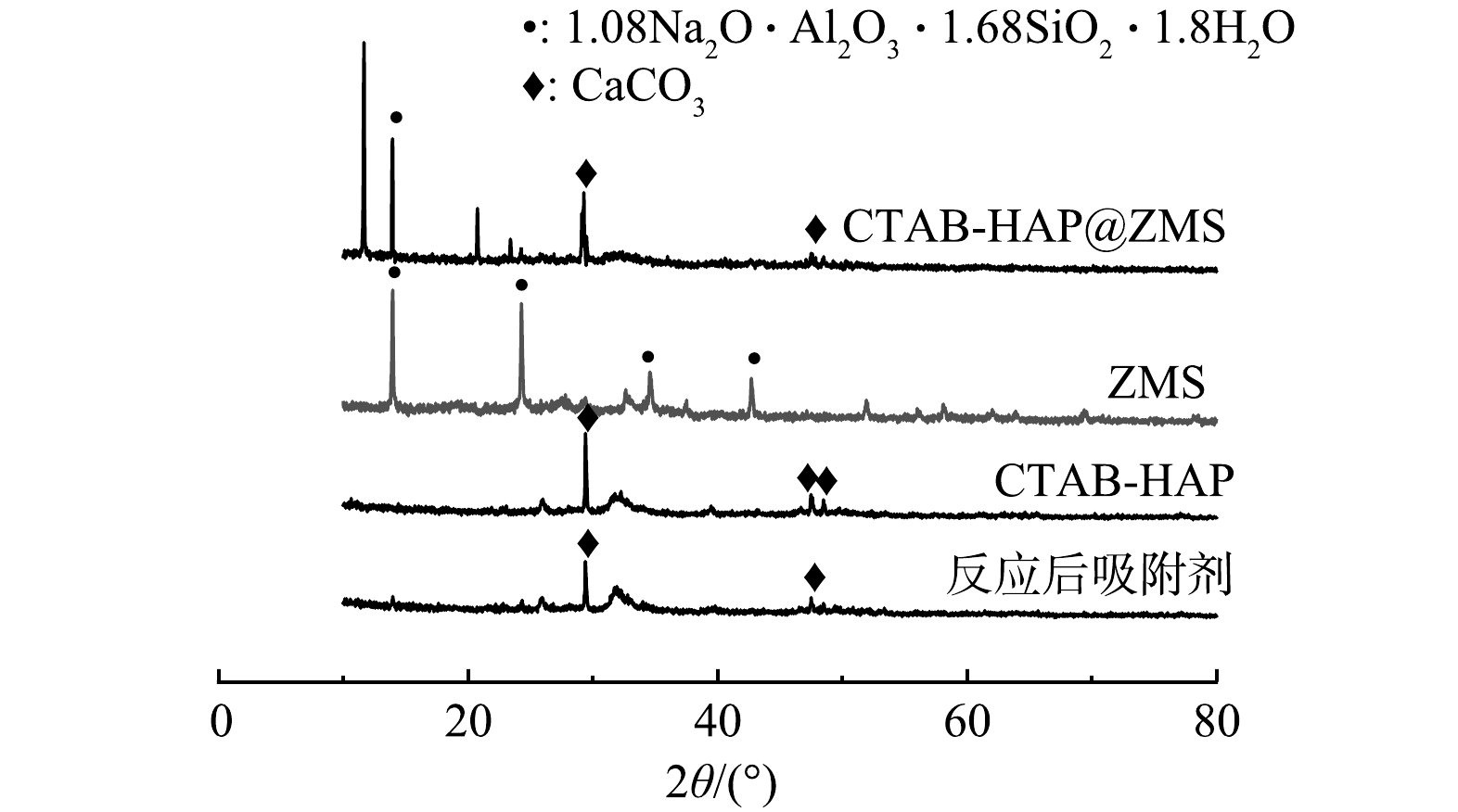
1) XRD分析。ZMS 、CTAB-HAP、CTAB-HAP@ZMS和反应后吸附剂的XRD分析结果如图1所示。可见,ZMS谱图中出现明显的衍射峰,其中特征衍射峰为2θ=13.96° (110)、24.31° (211)、34.604° (222)、42.738° (411)为沸石分子筛(PDF#31-1 271)的特征衍射峰;CTAB-HAP谱图中在2θ=29.405° (104)、47.489° (018)、48.512° (116)处出现了明显的衍射峰,与标准卡片PDF#05-0 584相对应。CTAB-HAP@ZMS 出现了以上2种物质的特征衍射峰,表明沸石分子筛表面负载上了CTAB-HAP,从而形成新复合材料;而吸附后吸附剂表面的特征衍射峰强度消失或降低,晶体性变差。这表明吸附过程中吸附剂表面的物质参与了吸附过程,进而弱化了吸附剂本身的晶体特征。
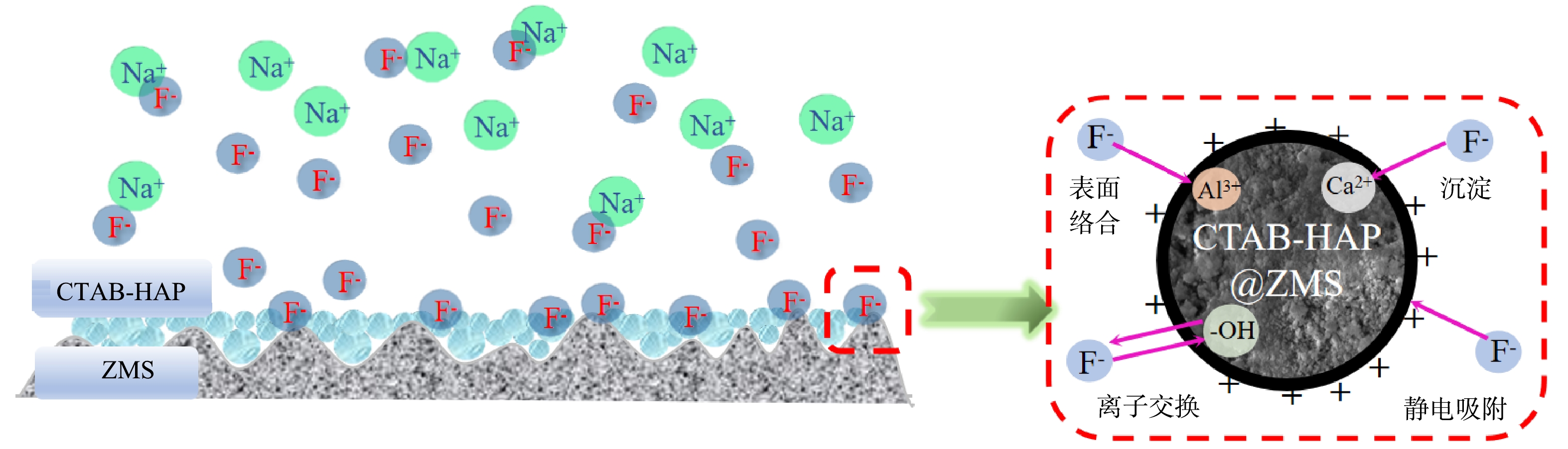
2) SEM分析。使用扫描电子显微镜对ZMS、反应前后的CTAB-HAP@ZMS进行表面形貌表征,结果如图2所示。图2(a)为沸石分子筛的SEM图像。可以看出,沸石分子筛表面凹凸不平,呈现颗粒状,且颗粒粒径较大。图2(b)反映了了负载CTAB-HAP以后的复合材料表面结构,由图中看出材料表面颗粒感消失,变得光滑、均匀,有绵密感和层次感。这说明沸石分子筛表面负载上了粒径更小的改性羟基磷灰石[27];由图2(c)可以看出,反应后吸附剂表面出现了明显的絮状物,形态更加蓬松并且紧密的附着在吸附剂表面。推测可能是沸石分子筛中的铝元素和F−发生络合反应生成了络合物,而络合物以絮状体的形式存在[28]。
-
1)物料比对除氟效果的影响分析。如图3(a)所示,随着物料比的不断增加,复合材料对氟的去除率和吸附容量均逐渐增加,当物料比为1∶6时吸附容量达到峰值,继续增加吸附容量反倒略微降低。分析原因可能是因为随着物料比的增加,CTAB-HAP在复合材料中的含量有所提高,而结果证明,改性羟基磷灰石的吸附性能优于沸石分子筛,因此,增加羟基磷灰石的比例可以提高吸附能力。但达到一定比例后,复合吸附剂的吸附机理以改性羟基磷灰石为主,吸附位点饱和,因此,继续增加CTAB-HAP比例对吸附效果影响不大。此时,复合吸附剂对氟的吸附容量由纯沸石分子筛的0.74 mg·g−1上升至2.19 mg·g−1,吸附容量增加了2倍。因此,在考虑材料本身的经济效益和制作成本的前提下,选择物料比为1∶6的复合吸附剂进行后续实验。
2)投加量对除氟效果的影响。吸附效果如图3(b)所示。随着投加量的不断增加,复合材料对F−的去除率明显增加,而吸附容量却呈现下降趋势。当投加量大于8 g·L−1时,去除率不再明显增加,而吸附容量持续降低。可能是由于相同体系中污染物的去除率会达到平衡,当投加量达到一定程度后,溶液中的F−不再被释放出来从而被吸附剂所吸附[29],所以加入过量的吸附剂不但不能提高其去除率,还会使吸附容量降低。因此,考虑到去除率和吸附容量,选择8 g·L−1的投加量作为复合吸附剂的最佳投加量。
3)初始浓度对除氟效果的影响。结果见图3(c)。随着初始浓度的升高,CTAB-HAP@ZMS复合吸附剂对F−的吸附容量逐渐上升,但去除率不断下降,吸附容量由5 mg·L−1时的0.5 mg·g−1上升至100 mg·L−1时的10.4 mg·g−1,增加了22倍。分析可能是在低浓度条件下,吸附剂没有达到饱和状态,仍有部分吸附位点未被F−占据,并且在一定的浓度下,污染物质所释放的可以被吸附的F−是有限的,所以吸附容量较低[30]。然而随着浓度的不断升高,F−在复合材料上的吸附量逐渐增多,导致表面吸附位点逐渐趋于饱和,从而增加其吸附容量。但由于溶液中剩余F−浓度增加,所以相应的去除率降低。
4)温度对除氟效果的影响分析。吸附结果见图3(d)。在25~55 ℃内,随着温度的不断升高,F−的去除率和吸附容量逐渐增加,当温度由55 ℃升高到60 ℃时,吸附容量不在发生变化,吸附过程达到饱和。因此,55 ℃为该复合材料的最佳吸附温度,CTAB-HAP@ZMS复合材料有良好的耐热性,在较高温度下可以保持良好的吸附效果。
5) pH对除氟效果的影响分析。结果如图3(e)所示。随着pH增加,吸附容量和去除率均呈现下降趋势,在酸性条件下(pH<5) ,吸附效果最好,pH为5~13时,吸附容量的变化趋势不大。分析可能是十六烷基三甲基溴化铵在酸性条件下具有较好的稳定性,添加十六烷基三甲基溴化铵会使羟基磷灰石晶格表面呈正电,通过静电吸附作用将F−吸附在复合吸附剂表面,从而增加吸附位点[20],此外,由于阳离子表面活性剂和阴离子之间有良好的配位性,可以通过络合反应生成络合物达到去除F−的目的,所以吸附效果较好。但是随着碱性的增加,十六烷基三甲基溴化铵的化学性质发生一定的变化,晶格表面不再呈现正电性,吸附剂表面—OH与F−之间通过离子交换作用进行吸附,从而使其吸附容量有所增加[31]。
6)共存离子对除氟效果的影响分析。如图4所示,4种阴离子对氟的吸附均存在抑制作用,并且随着阴离子浓度的增加,抑制强度逐渐增加,其中CO32−和SO42−的抑制效果较Cl−和NO3−更明显,当CO32−和SO42−的浓度上升至400 mg·L−1时,吸附容量分别降低了6.8%和4.0%。分析原因可能为二价阴离子和—OH的交换能力高于一价阴离子,因此,限制了F−和—OH的交换作用,导致吸附容量降低[32]。而CO32−可以与HAP中的Ca2+反应生成不溶于水的CaCO3沉淀,从而被吸附在材料表面,抢占了F−吸附位点,从而使得吸附效果变差。
7)模拟地热水除氟实验。结果表明,CTAB-HAP@ZMS复合吸附剂在50 ℃条件下震荡吸附6 h后,所测得的F−的剩余浓度为0.9 mg·L−1,去除率为89%,证明该复合吸附剂可以有效的将关中盆地地热水中的污染物质降低到国家标准规定的1.0 mg·L−1以下,是一种良好的吸附材料。
-
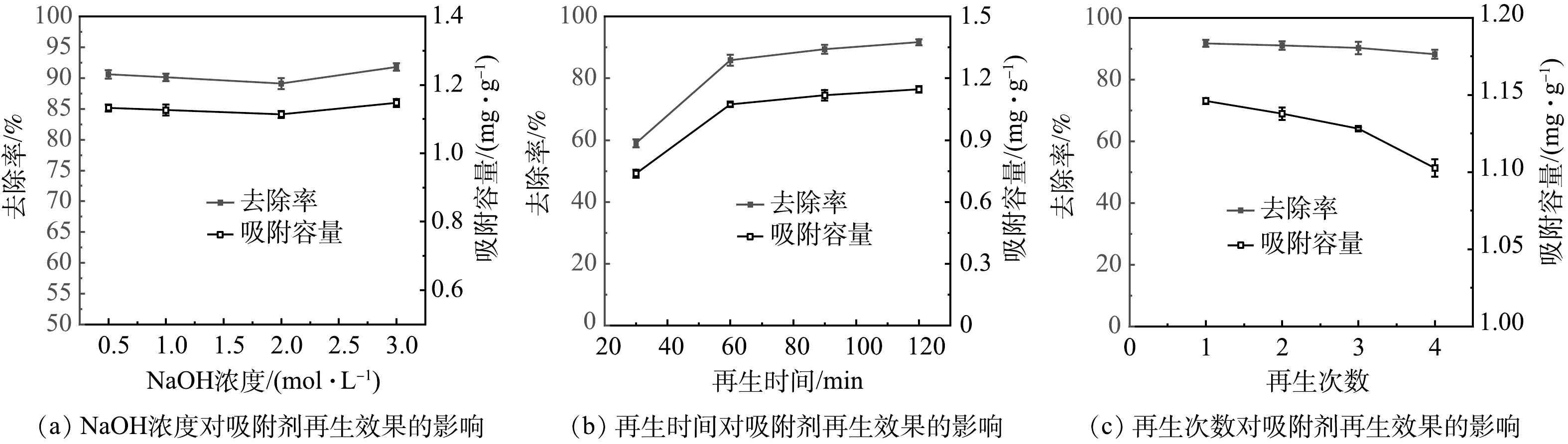
1) NaOH浓度对吸附剂再生效果的影响。如图5(a)所示,当NaOH浓度在0.5~3.0 mol·L−1之间时,再生吸附剂对氟的去除率在91%左右,达到了原始CTAB-HAP@ZMS复合材料的吸附效果。从图5(a)中看出,NaOH浓度对吸附剂再生性能影响不大,因此考虑选择0.5 mol·L−1作为吸附剂的NaOH再生浓度以减少材料费用。
2)再生时间对吸附剂再生效果的影响。如图5(b)所示,随着超声时间的加长,再生吸附剂的吸附容量逐渐增加,当超声时间延长至2 h时,再生吸附剂的吸附容量达到了原始吸附剂的吸附容量,说明吸附剂上的F−全部被解吸下来,吸附位点恢复到原来的数量。因此,选择2 h作为再生吸附剂的最佳超声时间。
3)再生次数对吸附剂再生效果的影响。如图5(c)所示,随着再生次数的增加,CTAB-HAP@ZMS复合材料的吸附性能逐渐降低。原因可能是多次重复使用NaOH解吸吸附剂表面的F−会改变复合材料表面性质,使得材料表面吸附位点减少,吸附性能降低[33]。经过4次再生循环后,吸附剂的去除率降至88%左右,但是该去除率仍然可以将关中盆地地热水中的氟含量降至标准水平之下。
-
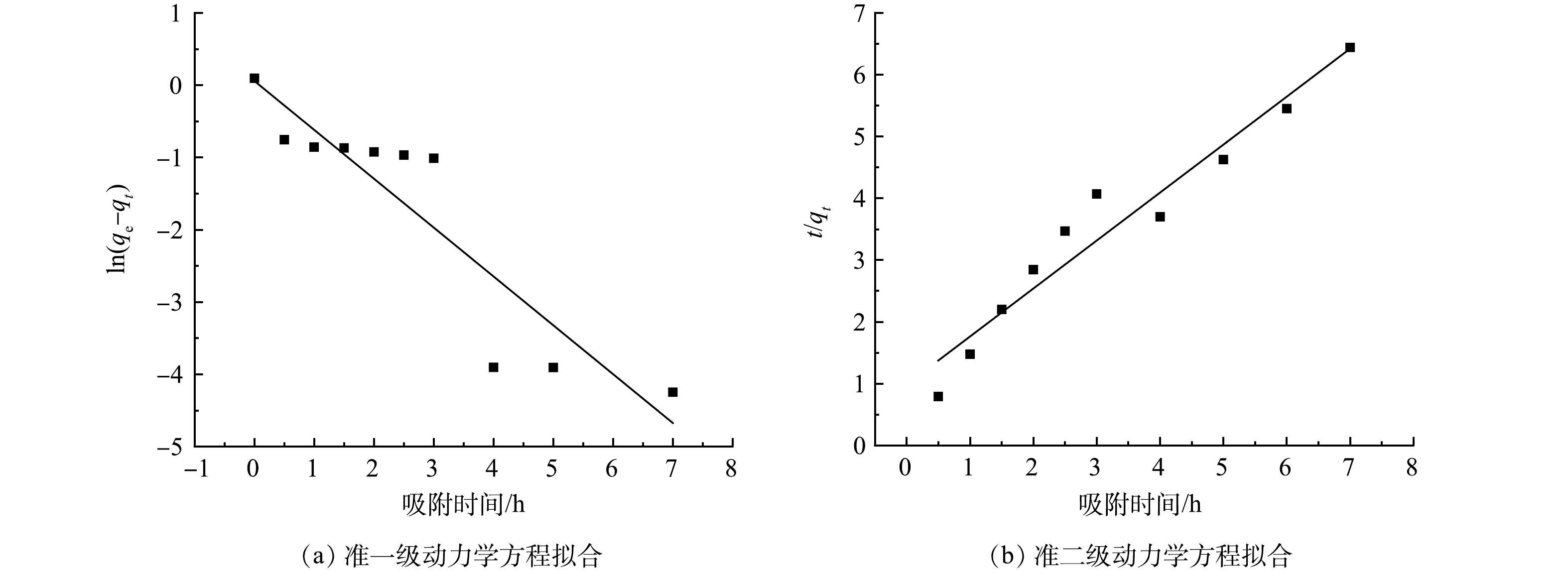
1)吸附动力学。由图6和表1可以看出,准一级动力学和准二级动力学均可以拟合 CTAB-HAP@ZMS 对F−的吸附过程,但准二级动力学模型的拟合参数更好,R2值更接近1,且Q2的值更接近于实验所得的吸附容量。这可能是由于准一级动力学模型具有局限性,一般仅适用于吸附初始阶段的动力学描述[34]。因此,吸附过程既有物理吸附又有化学吸附,但以化学吸附为主。由于F−与吸附剂上的吸附位点结合时需要的时间较长,速率常数k2小于k1,使结合更完全,从而导致吸附速率降低。
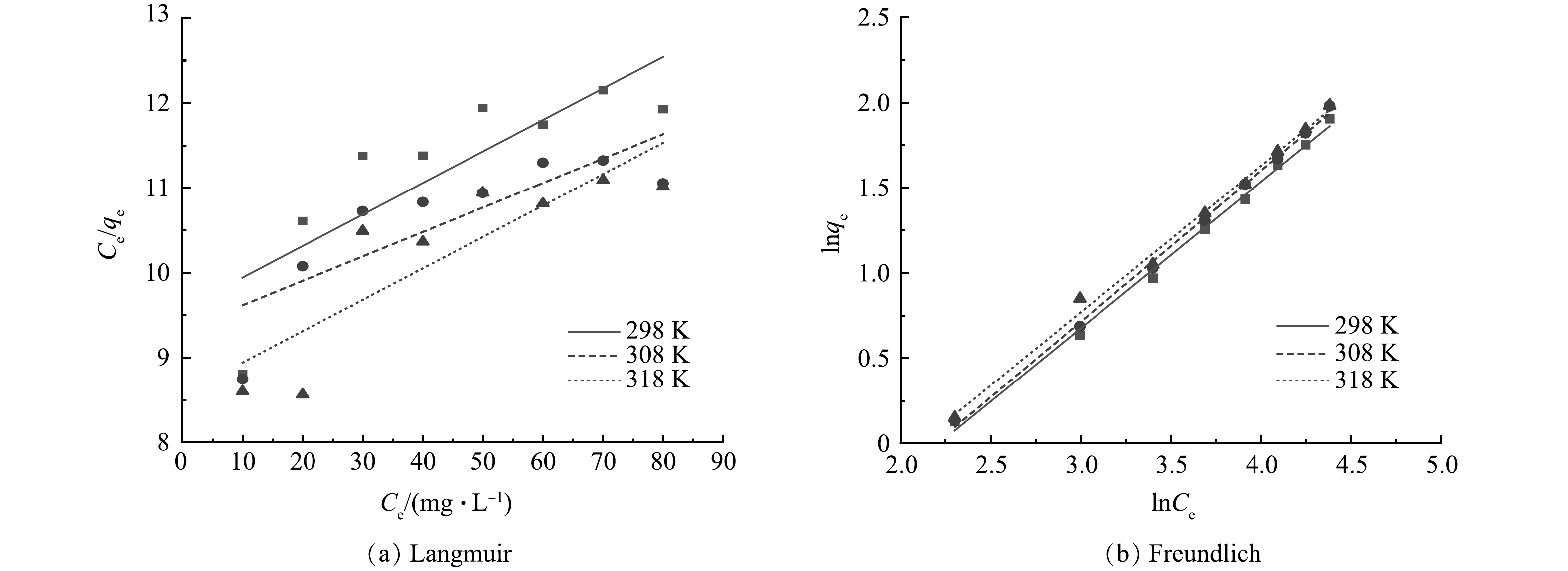
2)吸附等温线。由图7及表2可以看出,Langmuir吸附等温模型的R2值小于Freundlich吸附等温模型。因此,Freundlich吸附等温模型可以更好地拟合热力学吸附过程,表明吸附过程属于多分子层吸附。KF值随着温度的升高而增加,表明反应体系温度上升使得反应速率增加,因此,升高体系的温度有利于反应的正向进行,该结论也符合吸附等温线的实验结果。
热力学参数见表3。ΔH的值为21.906 kJ·moL−1,表明该CTAB-HAP@ZMS复合材料对F−的吸附为吸热过程;ΔS值为0.065 6 kJ·moL−1·K−1,表明吸附过程中混乱度增加,这可能是由于与F−发生离子交换作用的—OH更活泼;ΔG为负值,表明该反应可以自发进行。
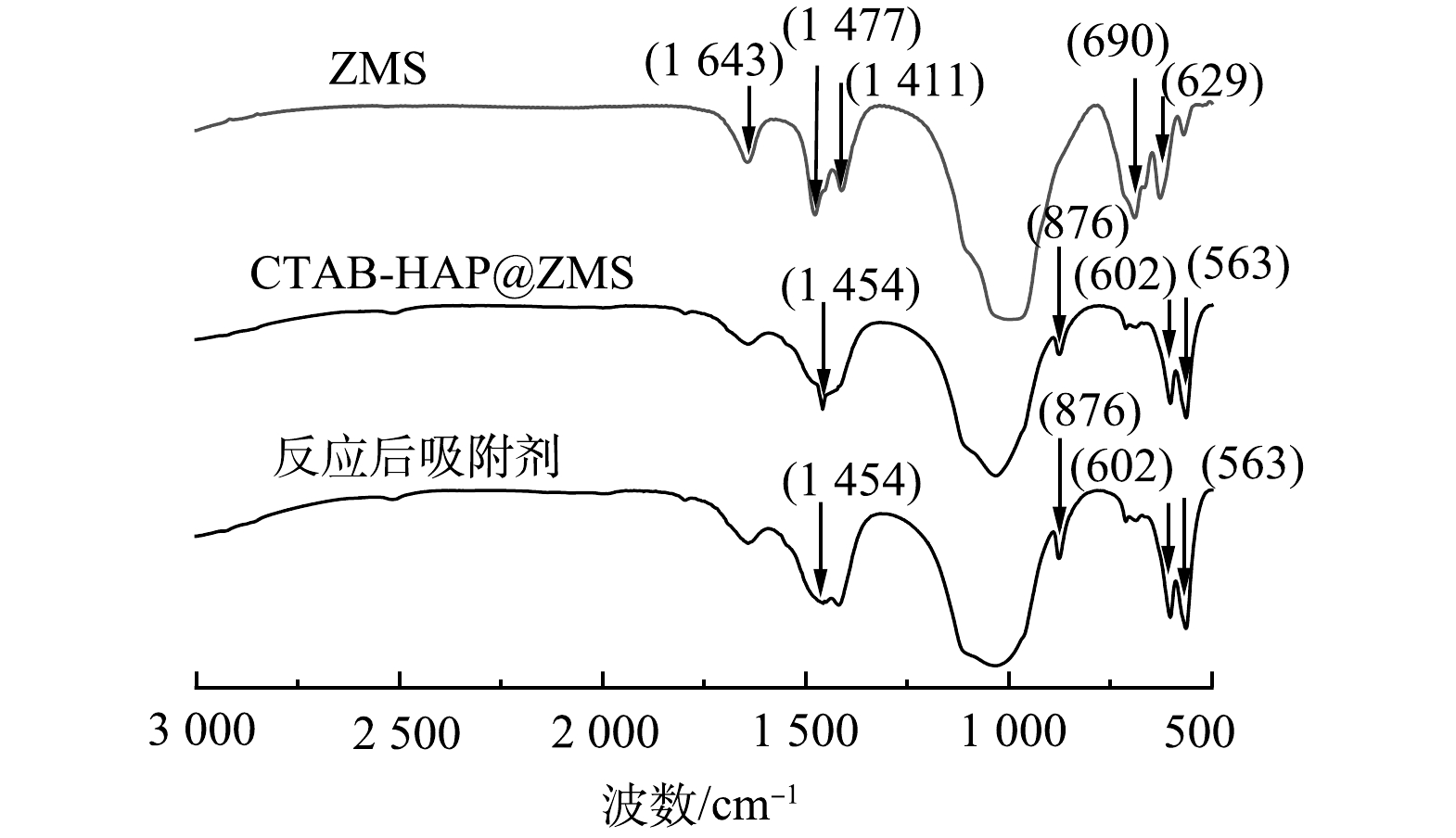
3) FT-IR分析。通过FT-IR对吸附前后的复合吸附剂CTAB-HAP@ZMS和沸石分子筛进行红外光谱测定,分析样品表面官能团变化情况,结果如图8所示。可以看出,沸石分子筛在629 cm−1处出现了内四面体C—H键弯曲振动强吸收峰,在690 cm−1处出现了外四面体羟基弯曲振动强吸收峰,在1 411 cm−1和1 477 cm−1处分别出现了内四面体羟基弯曲强吸收峰,在1 643 cm−1处出现了C=C双键伸缩吸收峰。这说明制备的沸石分子筛中含有羟基和烯烃类官能团。CTAB-HAP@ZMS复合吸附剂在563 cm−1处出现了C—CO—C内四面体弯曲振动吸收峰,在602 cm−1和876 cm−1处出现了外四面体C—H键弯曲振动强吸收峰,在1 454 cm−1处出现了内四面体羟基弯曲振动强吸收峰,在1 641 cm−1处出现了C=C双键伸缩强吸收峰,除羟基和烯烃类官能团还出现了间双取代官能团,表明复合材料合成过程中物质发生了相应的变化,但仍具有合成材料的典型官能团[35]。反应后的吸附剂在1 454 cm−1处吸收峰变弱,相比于复合吸附剂而言,羟基明显减少,表明CTAB-HAP@ZMS复合吸附剂对于F−的吸附主要是—OH和F−之间的离子交换作用[36]。
4)吸附机理分析。表征结果表明,CTAB-HAP@ZMS对氟的吸附机理为—OH和F−之间的离子交换作用、表面电荷的静电吸附、材料表面化合物与F−之间的络合反应生成络合物以及HAP本身的Ca2+与F−之间的化学反应4种形式。如图9所示,对F−的吸附过程包括物理吸附和化学吸附,化学吸附主要表现为离子交换和表面络合。在酸性条件下,CTAB使羟基磷灰石晶格表面呈正电,对带负电的F−产生静电作用[20,37]。此外,HAP的羟基基团与F−发生离子交换,形成Ca10(PO4)6F2或Ca10(PO4)6FOH[36,38-40],使得饱和吸附剂的—OH明显减少;同时,ZMS中的Al3+和F−发生络合反应生成络合物[41-42],可从SEM图像上蓬松絮状物的形态观察到。除此以外,HAP晶格表面的Ca2+与溶液中F−反应生成不溶于水的CaF2沉淀[36,43],进一步去除了水体中的F−。
-
为体现CTAB-HAP@ZMS复合吸附剂的优势,从吸附容量、材料来源及成本等方面对该材料和之前所研究的除氟吸附剂进行了比较,结果如表4所示。结果表明,CTAB-HAP@ZMS的吸附性能优于单体HAP和ZMS吸附剂,低于部分改性和商用材料。但在成本上,CTAB-HAP@ZMS复合吸附剂相较于高吸附容量的吸附剂有明显的优势。CTAB-HAP@ZMS复合吸附剂以废弃粉煤灰和贝壳为原料制备而成,不仅降低了材料成本,还能降低固体废弃物对环境的危害,达到废物资源化的目的。因此,CTAB-HAP@ZMS材料可作为一种低成本的新型复合吸附剂用于地下水除氟。
-
1)通过单因素实验分析,当CTAB-HAP:ZMS的物料比为1∶6,复合材料投加量为8 g·L−1、pH=3、温度为55 ℃时,对F−的去除率可以达到95%。当F−的初始浓度为100 mg·L−1时,吸附容量达到10.4 mg·g−1。共存离子中CO32−和SO42−对吸附效果的抑制作用最明显,当2种离子浓度上升至400 mg·L−1时,氟的吸附容量分别降低了6.8%和4.0%。
2)复合材料吸附过程更符合准二级动力学模型和Freundlich吸附等温模型,该过程属于多分子层的化学吸附,反应过程为自发的吸热反应,体系温度升高有利于反应正向进行。
3)经模拟关中盆地地热水除氟实验,可实现将高氟地热水浓度降低至国家规定的饮用水标准限值内。经过4次循环再生后的吸附剂对F−的去除率仍然高达88%。
4)通过与其他常见吸附材料进行比较,CTAB-HAP@ZMS复合吸附剂在低成本上具有明显优势,可以认为该吸附剂是一种环保、低成本的高吸附量除氟材料。
CTAB-HAP@ZMS复合材料的制备及其对氟离子的吸附性能
Preparation of CTAB-HAP@ZMS composites and their adsorption properties towards fluoride ions
-
摘要: 使用贝壳和粉煤灰等固体废弃物为原材料,采用水热合成法将十六烷基三甲基溴化铵(CTAB)改性后的羟基磷灰石(HAP)负载到粉煤灰基沸石分子筛(ZMS)上,得到一种高效的吸附剂(CTAB-HAP@ZMS)用于去除氟离子。当投加量为8.0 g·L−1、pH为3、温度为55 ℃时,CTAB-HAP@ZMS复合材料的最高吸附容量达到了10.4 mg·g−1,对10.0 mg·L−1氟化钠溶液中F−的去除率可以达到95%。动力学和热力学拟合参数表明吸附过程主要为多分子层式、自发、吸热的化学吸附。将此吸附剂用于处理模拟地热水(F−初始浓度为8.0 mg·L−1),去除率达到89%,残留浓度低于我国饮用水质量标准中F−的浓度限值(1.0 mg·L−1)。此外,经4次循环再生吸附后,CTAB-HAP@ZMS复合材料仍然表现出较高的氟离子去除效率。该复合材料的制备不仅能使固体废物资源化,还在氟离子去除方面有广阔应用前景。Abstract: In this study, solid wastes such as shell and fly ash were used as raw materials. Hydroxyapatite (HAP) modified by cetyltrimethyl ammonium bromide (CTAB) was loaded onto flyash-based zeolite molecular sieve (ZMS) by hydrothermal synthesis method. A highly efficient adsorbent (CTAB-HAP@ZMS) was obtained for fluoride removal. At the dosage of 8.0 g·L−1, pH 3, and 55 ℃, the highest adsorption capacity of CTAB-HAP@ZMS composite could reach 10.4 mg·g−1, and the removal rate of F− in 10.0 mg·L−1 sodium fluoride solution could reach 95%. The kinetic and thermodynamic fitting parameters showed that the adsorption process was mainly a type of multi-molecular layer, spontaneous and endothermic chemisorption. When the adsorbent was used to treat the simulated geothermal water with F− initial concentration of 8.0 mg·L−1, the removal rate reached 89%, and the F−residual content was lower than the concentration limit of F− in China's drinking water quality standard (1.0 mg·L−1). In addition, CTAB-HAP@ZMS composite still showed a high fluoride removal efficiency after 4 cycles of regeneration and adsorption. The preparation of the composite material can not only make solid waste resources, but also have broad application prospects in fluoride ion removal.
-
Key words:
- modified hydroxyapatite /
- zeolite molecular sieve /
- fluoride removal /
- adsorption
-

-
表 1 CTAB-HAP@ZMS 复合材料的准一级动力学和准二级动力学参数
Table 1. Quasi-first-order and quasi-second-order dynamics parameters of CTAB-HAP@ZMS composites
复合材料 准一级动力学 准二级动力学 k1/min−1 Q1/(mg·g−1) R2 k2/(g·(mg·min)−1) Q1/(mg·g−1) R2 CTAB-HAP@ZMS 0.676 2 1.059 7 0.833 0.612 2 1.288 0.941 2 表 2 CTAB-HAP@ZMS复合材料吸附等温模型参数
Table 2. Parameters of adsorption isothermal model for CTAB-HAP@ZMS composite materials
复合材料 T/K Langmuir Freundlich Qm/(mg·g−1) KL/(L·mg−1) R2 1/n KF/[mg·g−1(L·mg−1)1/n ] R2 CTAB-HAP@ZMS 298 26.881 7 0.003 1 0.690 2 0.858 9 0.143 1 0.996 4 308 34.722 2 0.003 9 0.682 1 0.885 4 0.149 1 0.997 8 318 27.027 0 0.004 3 0.744 2 0.859 0 0.163 8 0.994 9 表 3 热力学参数
Table 3. Thermodynamic parameters
T/K ∆H/(kJ·moL−1) ∆S/(kJ·(moL·K)−1) ∆G/(kJ·moL−1) $ \mathrm{l}\mathrm{n}\dfrac{{q}_{\mathrm{e}}}{{C}_{\mathrm{e}}} $ 298 21.906 0.065 6 −2.246 7 0.353 3 308 21.906 0.065 6 −1.893 9 0.739 6 318 21.906 0.065 6 −0.934 1 0.906 8 表 4 本研究和其他吸附剂的除氟性能和成本的比较
Table 4. Comparison of the fluoride removal capacity and cost of adsorbents in this study and other studies
-
[1] 张启闲, 张成, 徐瑶, 等. 高氟水处理技术发展现状[J]. 绿色科技, 2021, 23(12): 46-49. doi: 10.3969/j.issn.1674-9944.2021.12.018 [2] 许乃才, 黄国勇, 史丹丹, 等. 氧化铝基吸附材料制备及除氟研究进展[J]. 材料导报, 2023, 37(15): 57-66. [3] YADAV K K, KUMAR S, PHAM Q B, et al. Fluoride contamination, health problems and remediation methods in Asian groundwater: A comprehensive review[J]. Ecotoxicology and Environmental Safety, 2019, 182: 109362. doi: 10.1016/j.ecoenv.2019.06.045 [4] ADIMALLA N, QIAN H, NANDAN M J. Groundwater chemistry integrating the pollution index of groundwater and evaluation of potential human health risk: A case study from hard rock terrain of south India[J]. Ecotoxicology and Environmental Safety, 2020, 206(1/2): 111217. [5] 孙一博, 王文科, 张春潮, 等. 关中盆地浅层高氟水形成演化机制[J]. 水文地质工程地质, 2013, 40(6): 117-122. [6] CHEN Y Y, YANG S K. Levels of toxic elements in fish from fishing ground using geothermal water in Guanzhong Basin, China[J]. Advanced Materials Research, 2012, 573-574: 654-658. doi: 10.4028/www.scientific.net/AMR.573-574.654 [7] 于波, 任桐, 都兴红, 等. 含氟废水处理工艺研究[J]. 中国资源综合利, 2020, 38(11): 4. [8] OWUSU-AGYEMAN I, SHEN J J, SCHAFER A I. Renewable energy powered membrane technology: impact of pH and ionic strength on fluoride and natural organic matter removal[J]. Science of the Total Environment, 2018, 621: 138-147. doi: 10.1016/j.scitotenv.2017.11.111 [9] RAJKUMAR S, MURUGESH S, SIVASANKAR V, et al. Low-cost fluoride adsorbents prepared from a renewable biowaste: Syntheses, characterization and modeling studies[J]. Arabian Journal of Chemistry, 2019, 12(8): 3004-3017. doi: 10.1016/j.arabjc.2015.06.028 [10] YADAV K K, GUPTA N, KUMAR V, et al. A review of emerging adsorbents and current demand for defluoridation of water: Bright future in water sustainability[J]. Environment international, 2018, 111: 80-108. doi: 10.1016/j.envint.2017.11.014 [11] 魏永, 李贤建, 罗政博, 等. 氧化铝改性活性炭纤维电吸附除氟效能及机理分析[J/OL]. 中国环境科学: 2023, 42: 1-10. [12] HUANG S, HU M, LI D, et al. Fluoride sorption from aqueous solution using Al (OH)3-modified hydroxyapatite nanosheet[J]. Fuel, 2020, 279(1-241): 118486. [13] WEN B. Comparison of several processes for removing fluoride from coal chemical wastewater[J]. Environment, Resource and Ecology Journal, 2021, 5(4): 7-10. [14] AQUINO T, ESTEVAM S T, VIOLA V O, et al. CO2 adsorption capacity of zeolites synthesized from coal fly ashes[J]. Fuel, 2020, 276: 118143. doi: 10.1016/j.fuel.2020.118143 [15] 王润南, 张丹丹, 王璇, 等. 贝壳粉制备球形羟基磷灰石[J]. 化工时刊, 2015, 29(4): 7-9. doi: 10.3969/j.issn.1002-154X.2015.04.002 [16] 章萍, 杨陈凯, 马若男, 等. 碳纳米管/羟基磷灰石复合材料对水体F−的去除研究[J]. 中国环境科学, 2019, 39(1): 179-187. doi: 10.3969/j.issn.1000-6923.2019.01.020 [17] 郑搏英, 张亮亮, 张襄, 等. 我国吸附法处理含氟废水研究进展[J]. 广东化工, 2022, 49(3): 140-142. doi: 10.3969/j.issn.1007-1865.2022.03.043 [18] DING H, JIANG L, TANG C, et al. Study on the surface-modification of nano-hydroxyapatite with lignin and the corresponding nanocomposite with poly (lactide-co-glycolide) [J]. Frontiers of Chemical Science and Engineering, 2021, 15: 630-642. doi: 10.1007/s11705-020-1970-5 [19] 付琳. 铁铝改性羟基磷灰石的制备及其在含氟水体除氟中的应用研究[D]. 北京: 北京化工大学, 2022. [20] PRABHU S M, MEENAKSHI S. Synthesis of surface coated hydroxyapatite powders for fluoride removal from aqueous solution[J]. Powder Technology, 2014, 268: 306-315. doi: 10.1016/j.powtec.2014.08.041 [21] 田键, 汤钒, 胡攀, 等. 羟基磷灰石复合及掺杂改性研究进展[J]. 有色金属材料与工程, 2021, 42(4): 55-60. [22] 陈东. 饮用水除氟技术研究综述[J]. 山东化工, 2021, 50(2): 261-262. doi: 10.3969/j.issn.1008-021X.2021.02.104 [23] 赵宏, 陈瑶, 李正明, 等. 废弃贝壳制备纳米带状羟基磷灰石的研究[J]. 甘肃科技, 2016, 32(17): 50-52. doi: 10.3969/j.issn.1000-0952.2016.17.018 [24] 邓慧, 张启凯, 白英芝. 碱性活化法合成粉煤灰沸石的研究进展[J]. 硅酸盐通报, 2014, 33(7): 1706-1714. [25] 邓晓铌. 关中盆地地热水开发利用对环境影响研究[D]. 西安: 长安大学, 2008. [26] 左清青, 王烁康, 赵陈晨, 等. 纳米羟基磷灰石对镉的吸附解吸及对镉污染土壤修复研究[J]. 环境工程, 2017, 35(3): 179-184. doi: 10.13205/j.hjgc.201703037 [27] IQBAL N, KADIR M A, MAHMOOD N, et al. Microwave synthesis, characterization, bioactivity and in vitro biocompatibility of zeolite–hydroxyapatite (Zeo–HA) composite for bone tissue engineering applications[J]. Ceramics International, 2014, 40(10): 16091-16097. doi: 10.1016/j.ceramint.2014.07.038 [28] 程伟强. 铝溶胶改性粉煤灰沸石吸附氟离子及其动力学研究[D]. 南昌: 东华理工大学, 2016. [29] 赵云, 刘瑞来, 徐婕, 等. 原位合成羟基磷灰石/壳聚糖复合吸附剂及除氟特性研究[J]. 高分子通报, 2021, (2): 54-62. doi: 10.14028/j.cnki.1003-3726.2021.02.007 [30] NGUYEN V C, PHO Q H. Preparation of chitosan coated magnetic hydroxyapatite nanoparticles and application for adsorption of reactive blue 19 and Ni2+ ions[J]. The Scientific World Journal, 2014, 2: 273082. [31] ZHAN Y, LIN J, JIA L. Preparation and characterization of surfactant-modified hydroxyapatite/zeolite composite and its adsorption behavior toward humic acid and copper (II) [J]. Environmental Science & Pollution Research, 2013, 20(4): 2512-2526. [32] 唐芳, 陈玲, 项朋志, 等. 壳聚糖/羟基磷灰石复合材料对氟离子吸附研究[J]. 广州化工, 2020, 48(2): 54-58. doi: 10.3969/j.issn.1001-9677.2020.02.022 [33] STERNITZKE V, KAEGI R, AUDINOT J N, et al. Uptake of fluoride from aqueous solution on nano-sized hydroxyapatite: Examination of a fluoridated surface layer[J]. Environmental Science & Technology, 2012, 46(2): 802. [34] LI X, YU X, LIU L, et al. Preparation, characterization serpentine-loaded hydroxyapatite and its simultaneous removal performance for fluoride, iron and manganese[J]. RSC advances, 2021, 11(27): 16201-16215. doi: 10.1039/D1RA02028E [35] WEI Y F, WANG L, LI H B, et al. Synergistic fluoride adsorption by composite adsorbents synthesized from different types of materials: A review[J]. Frontiers in Chemistry, 2022, 10(5): 1-23. [36] SAIRAM S C, VISWANATHAN N, MEENAKSHI S. Fluoride sorption by nano-hydroxyapatite/chitin composite[J]. Journal of hazardous materials, 2009, 172(1): 147-151. doi: 10.1016/j.jhazmat.2009.06.152 [37] 陈强. 城市污水厂氟化物超标的除氟试验研究[D]. 成都: 西华大学, 2022. [38] 肖琴. 不同前处理-超滤组合工艺处理高氟水源水技术研究[D]. 重庆: 重庆交通大学, 2022. [39] 王娟, 郭亚丹, 曾华, 等. 羟基磷灰石复合材料对地下水中铀吸附去除研究进展[J]. 有色金属 (冶炼部分) , 2021(8): 37-45. [40] GAO M, WANG W, CAO M, et al. Hierarchical hollow manganese-magnesium-aluminum ternary metal oxide for fluoride elimination[J]. Environmental Research, 2020, 188: 109735. doi: 10.1016/j.envres.2020.109735 [41] 宋淑敏, 刘伟, 徐晓军, 等. 氯化铝改性复合生物絮凝剂去除饮用水中的氟[J]. 有色金属 (冶炼部分) , 2019(10): 80-85. [42] KANG D, YU X, GE M, et al. Insights into adsorption mechanism for fluoride on cactus-like amorphous alumina oxide microspheres[J]. Chemical Engineering Journal, 2018, 345: 252-259. doi: 10.1016/j.cej.2018.03.174 [43] 杨丽云. 羟基磷灰石纳米棒/壳聚糖复合材料的制备与性能研究[D]. 天津: 天津工业大学, 2017. [44] 李焕娣. 流化床粉煤灰合成分子筛及处理含氟废水的研究[D]. 太原: 太原理工大学, 2009. [45] SHAN G, RONG S, WEI Z, et al. Size-dependent defluoridation properties of synthetic hydroxyapatite[J]. Journal of Fluorine Chemistry, 2009, 130(6): 550-556. doi: 10.1016/j.jfluchem.2009.03.007 [46] SAMANT A, NAYAK B, MISRA P K. Kinetics and mechanistic interpretation of fluoride removal by nanocrystalline hydroxyapatite derived from Limacine artica shells[J]. Journal of Environmental Chemical Engineering, 2017, 5(6): 5429-5438. doi: 10.1016/j.jece.2017.09.058 [47] XU F, JIANG C, LI D. Defluoridation of wastewaters using HAP-coated-limestone[J]. Separation Science and Technology, 2019, 54(14): 2304-2313. doi: 10.1080/01496395.2018.1541470 [48] MEENAKSHI S, VISWANATHAN N. Identification of selective ion-exchange resin for fluoride sorption[J]. Journal of Colloid and Interface Science, 2007, 308(2): 438-450. doi: 10.1016/j.jcis.2006.12.032 [49] FAN X, PARKER D J, SMITH M D. Adsorption kinetics of fluoride on low cost materials[J]. Water Research, 2003, 37(20): 4929-4937. doi: 10.1016/j.watres.2003.08.014 -



 下载:
下载: