-
随着我国社会和经济发展,农业生产过程中过量使用磷肥及城市大量排放含磷污水导致我国水体富营养化问题突显. 近年来,我国的滇池、太湖和巢湖等内陆湖泊不断发生水华现象[1]. 根据2019年中国海洋灾害公报显示,我国赤潮暴发频率自70年代开始每10年增长3倍,截止2018年我国有明确暴发时间及地点等基本信息的赤潮次数为1780次. 大量未经处理的含磷污水的直接排入是造成水体总磷超标的主要原因,包括城市、工业和农业中大量含磷水的排放. 控制磷污染,保障生态系统安全已刻不容缓.
吸附法除磷因具有操作简便、适用范围广、效果好、运行费用低等优点而得到高度关注[2]. 稀土元素镧(La)对磷酸盐具有强亲和力,可与磷酸根形成稳定不可溶的LaPO4,展现出优异的除磷性能[3]. 然而镧的氧化物通常以粉末形式存在,易流失、堵塞,且流体力学性能差,吸附磷后会沉入水体难以回收,造成了资源的浪费和污泥污染,从而限制了镧氧化物在水体除磷中的应用. 将La固定在多孔颗粒材料的表面或孔道中是减少La组分流失和提高除磷性能的有效方式. 目前常采用多孔的天然黏土材料(如沸石、蛭石、硅藻土等)、碳基材料(如活性炭、黑炭、碳纳米管等)、离子交换树脂高分子材料负载La,得到La改性的多孔无机或有机复合吸附材料,如La-负载多孔沸石、La-负载碳纳米管、La-离子交换树脂等含La吸附剂[4 − 6].
不同于以上载体硬模板方式固定La,钛(Ti)基多孔材料可通过原位自生模板法原位转化为介孔毫米球同步固载La[7],得到具有丰富的孔道(孔径2—50 nm)、高比表面积的球形颗粒,具有优异的流体力学与传质性能,有望实现高选择性除磷性能[8 − 9]. 而且,Ti载体本身也可通过静电吸附、配体交换、Ti—P化学键等作用吸附磷[10 − 11],起到协同La除磷作用. 故以Ti为载体通过溶胶-凝胶法制备镧钛双金属氧化物介孔毫米球,提高对磷的吸附能力,减少吸附过程中La的流失,同时大大增强吸附剂流体力学性能,实现吸附材料的分离与回收利用.
为此,本文以镧和钛金属盐为原料,海藻酸钠为交联剂,采用沉淀凝胶法制备了镧钛双金属氧化物介孔毫米球LaxTi1-xO2,利用N2吸附-脱附、XRD、SEM、TEM等对制备的LaxTi1-xO2进行了表征,根据镧钛物质的量比、煅烧温度对LaxTi1-xO2除磷性能的影响,优选出400 ℃煅烧制得的La0.5Ti0.5O2. 考察了La0.5Ti0.5O2投加量、溶液pH等因素对吸附的影响,并利用准一级和二级动力学模型及Langmuir和Freundlich模型对La0.5Ti0.5O2除磷过程进行了动力学与热力学研究. 通过除磷性能测定并结合零电荷点、FT-IR、XPS等表征手段提出了La0.5Ti0.5O2除磷机制.
-
实验过程中使用的试剂主要包括:LaN3O9·6H2O(AR,99%,麦克林)、TiOSO4·xH2SO4·xH2O(synthesis grade,阿拉丁)、尿素(AR,99%,阿拉丁)、海藻酸钠(AR,阿达丁)、磷酸二氢钾(AR,广东光华科技)、抗坏血酸(AR,西陇科学)、钼酸铵(AR,西陇科学)、酒石酸锑钾(AR,西陇科学)、硫酸(AR,中星化工),所有实验用水均为超纯水(Millipore,18.2 MΩ·cm).
-
镧钛金属氧化物制备是基于海藻酸钙凝胶球模板法和尿素沉淀法为基础并进行了改进和开发[12 − 13]. 制备具体步骤如下:将TiOSO4·xH2SO4·xH2O和LaN3O9·6H2O共15 mmol按照La占双金属元素物质的量比分别为0、2.5、5.0、7.5 mmol溶于80 mL去离子水中;将120 mL含有14.0 g尿素的水溶液加入到上述所得溶液中,500 r·min−1磁力搅拌并于90—95 ℃水浴锅中加热8 h;搅拌加热后,用去离子水将悬浊液离心清洗3次,得到高浓度金属氧化物前驱体悬浊液40 g,将0.4 g的海藻酸钠粉末加入到悬浊液中,在55 ℃水浴中高速磁力搅拌30 min预混合,静置30 min;利用蠕动泵将所得到的悬浊液滴入0.1 mol·L−1的LaN3O9·6H2O溶液中形成凝胶球,静置24 h后在60 ℃烘箱中烘干12 h;然后将烘干材料放入管式炉进行两段煅烧,先经氮气气氛下200 ℃预处理2 h后在空气气氛400 ℃下煅烧2 h,升温速度为5 ℃·min−1.
经过预实验后, LaN3O9·6H2O和TiOSO4·xH2SO4·xH2O共15 mmol分别按照La/Ti物质的量比1:1、2:1、3:1、1:3制备,其中La:Ti=2:1形成的球形形状不规范,故排除该物质的量比; La:Ti=3:1因过于黏稠无法成球,故也排除该物质的量比. 最终,制得3种不同物质的量比的小球材料,分别为:TiO2球、La:Ti=1:1(La0.5Ti0.5O2)、La:Ti=1:3(La0.25Ti0.75O2). 另外,为了探究煅烧温度的影响,在400 ℃和600 ℃两个不同的煅烧温度下制备了介孔毫米球.
-
通过测定ASAP2020HD88型比表面孔径测定仪(BET,中国,麦克默瑞提克)得到材料的比表面积和孔径. 通过JSM-6700F型扫描电子显微镜(SEM,日本,JEOL)分析介孔毫米球的表观形貌. 材料的微观结构通过JEM-2100F型透射电子显微镜/选区电子衍射(TEM/SAED,日本,JEOL)和D8ADVANCE型X射线衍射仪(XRD,美国,BRUKER)表征. 吸附剂中La含量采用6 mol·L−1硝酸消解后通过电感耦合等离子谱仪(ICP-OES, PerkinElmer,USA)测定.
-
用超纯水配制30 mg·L−1的KH2PO4溶液为初始磷溶液,取100 mL于150 mL三角烧瓶中. 用0.1 mol·L−1的NaOH溶液和0.1 mol·L−1的HCl溶液调节pH至7,温度为25 ℃,加入0.1 g吸附材料,振荡速率为150 r·min−1,在0、3、6、12、24、36、48、60、72 h分别取样测定,并用0.22 μm滤膜过滤,测定不同时间间隔下的磷浓度,水样中磷含量采用钼酸铵分光光度法(GB11893—89),并计算磷吸附量.
设置磷浓度为30 mg·L−1,溶液体积为100 mL,温度为25 ℃,振荡速率为150 r·min−1,通过改变溶液初始pH值(pH=3、5、7、9),介孔毫米球的投加量(投量为0.05、0.075、0.1、0.15、0.2 g)来探究对磷吸附效果的影响,同时选取水中常见阴离子Cl−、SO42−、NO3−和HCO3−(以钠盐形式存在)考察了共存离子的影响.
-
吸附剂投量为1 g·L−1,设置初始磷酸盐浓度为1—70 mg·L−1,pH为3,在25 ℃条件下以150 r·min−1速度振荡72 h.采用Langmuir和Freundlich模型进行拟合.
Langmuir等温吸附方程:
Freundlich等温吸附方程:
式中,qm为最大吸附量(mg·g−1);qe为吸附平衡时的磷酸盐吸附量(mg·g−1);Ce为吸附平衡时的磷酸盐浓度(mg·L−1);1/n为经验常数;KL和KF分别为Langmuir吸附模型和Freundlich吸附模型的吸附常数,代表吸附能力的强弱.
-
吸附动力学参数决定了磷酸盐回收时间,在水处理过程中至关重要. 吸附剂投加量为1 g·L−1,初始磷酸盐浓度为30 mg·L−1,pH为7,温度为25 ℃,置于恒温振荡器内以150 r·min−1速度振荡72 h,设置时间段测定磷酸盐浓度. 实验数据由准一级动力学模型和准二级动力学模型进行拟合.
准一级动力学模型:
准二级动力学模型:
式中,k1为准一级动力学速率常数(min−1);k2为准二级动力学速率常数(g·(mg·min)−1);t为反应时间(min);qe为反应平衡时的吸附量(mg·g−1);qt为反应时间t时的吸附量(mg·g−1).
-
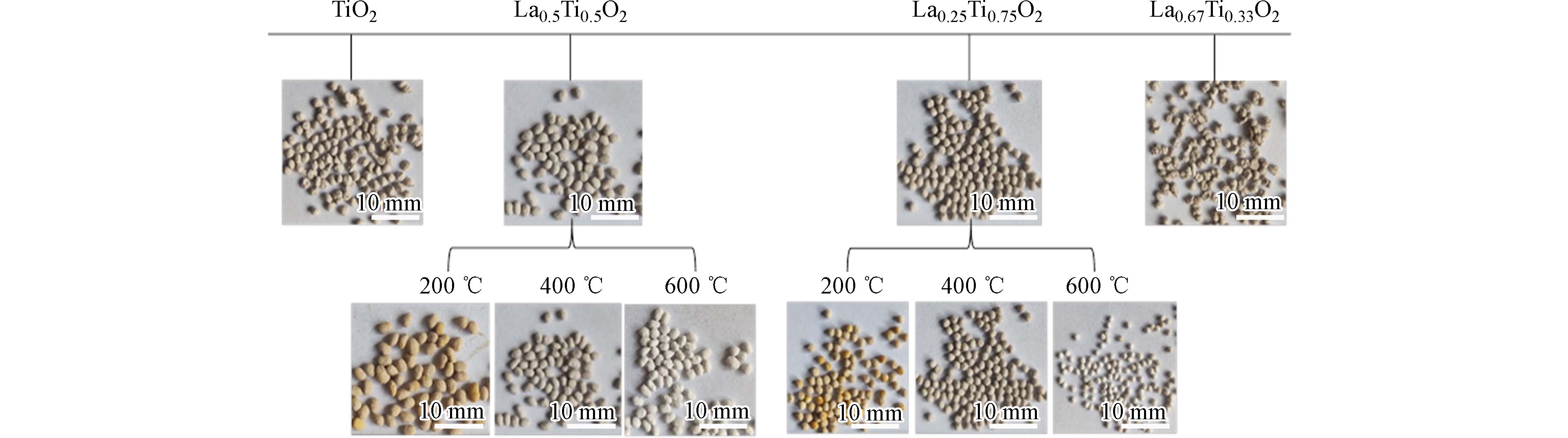
采用溶胶-凝胶模板法在不同煅烧温度下制备了不同La/Ti物质的量比的镧钛双金属氧化物介孔毫米球LaxTi1-xO2. 由图1可知,从宏观形貌上来看,随着煅烧温度的增加,LaxTi1-xO2的颜色由黄色逐渐变为灰白色,且通过吸附实验发现在200 ℃下煅烧制作的小球硬度不够,易碎成粉末,机械强度低,故舍弃该煅烧温度下制备的材料. 对比不同La/Ti物质的量比下制得的介孔毫米球发现,随着Ti含量增加,得到的毫米球球形变得更加规则,LaxTi1-xO2平均粒径为2—3 mm.
LaxTi1-xO2介孔毫米球的SEM图像如图2(a)所示,TiO2和La:Ti=1:3的LaxTi1-xO2颗粒外形均呈现球状且表面光滑,而La:Ti=1:1的LaxTi1-xO2颗粒外形均呈现棒状且互相黏集在一起,即随着La量的增加,介孔毫米球表面会形成褶皱而变得粗糙,这种形貌可有效增加吸附剂活性吸附位点,增强除磷性能. 类似的在负载La之后使得吸附剂表面呈条状褶皱的粗糙形态在其他研究中也有发现[14]. 为进一步探究材料的微观结构,对不同La/Ti物质的量比的LaxTi1-xO2介孔毫米球研磨制样进行了TEM和选区电子衍射(SAED)表征,结果如图2(b)所示. LaxTi1-xO2以纳米颗粒或纳米簇形式存在,且分散均匀,400 ℃和600 ℃下煅烧的Ti0.5La0.5O2球存在明显的晶格条纹,而400 ℃下煅烧的TiO2球与Ti0.75La0.25O2球未观测到晶格条纹. 400 ℃下煅烧的Ti0.5La0.5O2球和600 ℃下煅烧Ti0.75La0.25O2球存在明显的环状多晶衍射图样,而400 ℃下煅烧的Ti0.75La0.25O2球和600 ℃下煅烧Ti0.5La0.5O2球未观测到衍射图样,表明这两种金属氧化物球在微观尺度上依然保持无定形结构,这可能是因为La、Ti两种元素相互渗入对方氧化物晶格达到一定比例后造成明显的畸变和扭曲后,导致各自的周期性被破坏,形成了La—O—Ti键[15]. 以上结果说明, 控制La/Ti物质的量比和煅烧温度可以调控LaxTi1-xO2晶型和无定形两类结构的产生.
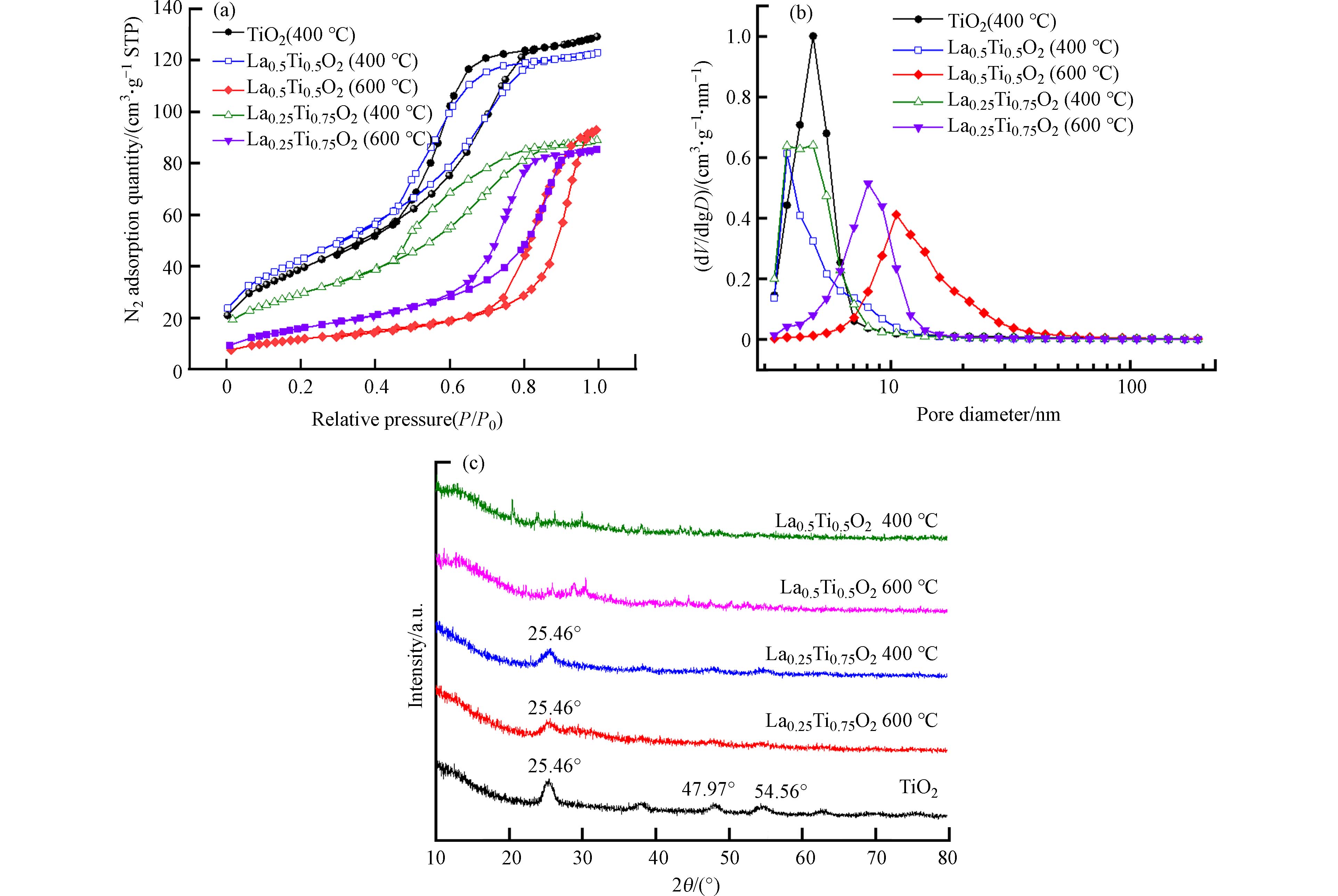
通过比表面积分析仪进一步测定了LaxTi1-xO2的孔结构. 根据国际纯粹与应用化学联合会(IUPAC)分类,LaxTi1-xO2的氮吸附-脱附等温线显示出“Ⅳ”型等温线(图3a),表明其孔结构主要是介孔,1—40 nm的孔径分布进一步证实了其介孔结构(图3b). 介孔毫米球LaxTi1-xO2的平均孔径和平均比表面积如表1所示,在不同的煅烧温度和La/Ti物质的量比下制备的材料的平均孔径和比表面积差别较大. 在400 ℃下煅烧LaxTi1-xO2平均孔径主要集中在3—5 nm;在600 ℃下煅烧LaxTi1-xO2平均孔径主要集中在8—10 nm. 由此可见,随着煅烧温度的增加,LaxTi1-xO2平均孔径有了明显的增加. 而在不同的煅烧温度下, LaxTi1-xO2介孔毫米球的比表面积也有不同程度的变化,其中在La:Ti=1:3时,400 ℃下煅烧的材料拥有最大的比表面积,为151 m2·g−1. 总体而言,在400 ℃下煅烧的材料的比表面积大于600 ℃下煅烧材料的比表面积. 综上,煅烧温度对LaxTi1-xO2比表面积影响较为显著,而La/Ti物质的量比对平均孔径和平均比表面积影响较小.
利用XRD谱图对LaxTi1-xO2的晶体结构特征进行了进一步分析,结果如图3(c)所示. TiO2的XRD谱图与锐钛矿标准谱图(PDF #21-1272)相符;对于La:Ti=1:3的两种LaxTi1-xO2,均在2θ=25.46°时出现了TiO2衍射峰,但是在特征峰处的衍射强度均有所减小,且经过改性后的LaxTi1-xO2的杂峰相较于TiO2有所减少,说明掺杂La之后的介孔材料和TiO2具有相似的结构特性[16]. 但是随着La量从La:Ti=1:3增加到La:Ti=1:1,TiO2特征峰逐渐消失,这表明LaxTi1-xO2中La含量增加会改变其晶形结构,使材料转变为无定形态[17 − 18]. 此外, LaxTi1-xO2的 XRD谱图中并没有出现明显的La相关衍射峰,谱图均表现为无定形特征,与SEAD和TEM结果一致,说明晶格周期性被完全破坏,形成了La—O—Ti键. 这与Ce—O—Ti破坏晶格周期性结构,形成无定型铈钛氧化物的结果一致[15 − 19].
-
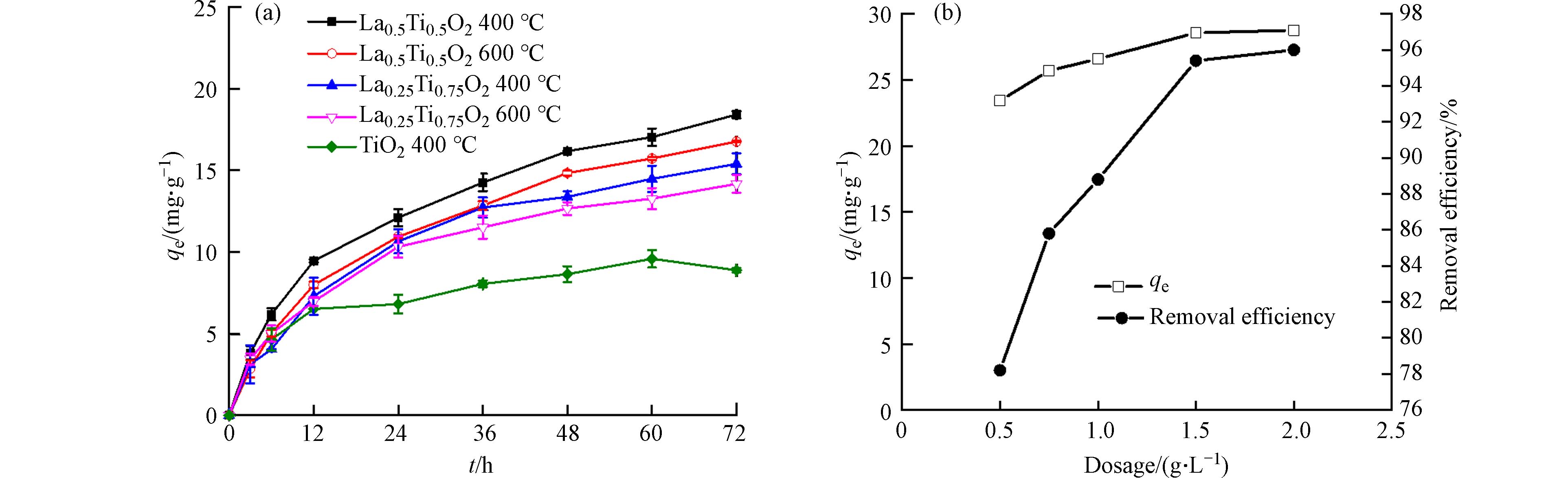
通过实验发现当La所占物质的量比过多时制备的吸附材料形状不规范甚至无法成球,因此选取了La:Ti=1:1、1:3的物质的量比条件下制备的LaxTi1-xO2介孔毫米球并探究其对磷酸盐的吸附性能. 如图4(a)所示,不管是La:Ti=1:1还是La:Ti=1:3的介孔毫米球,其对磷酸盐的吸附效果相较于TiO2球都有显著提高,TiO2对磷的吸附量仅为9 mg·g−1,而LaxTi1-xO2对磷的吸附量高达13—18 mg·g−1. 对比4种不同条件下制备的LaxTi1-xO2的吸附效果可知,煅烧温度由400 ℃升高至600 ℃,LaxTi1-xO2对磷的吸附量有一定下降. 400 ℃煅烧温度下La:Ti=1:1(La0.5Ti0.5O2)的介孔毫米球对磷的吸附量最大,为18.4 mg·g−1,是TiO2介孔毫米球的2倍. 故优选400 ℃下煅烧的La0.5Ti0.5O2介孔毫米球进行后续实验探究.
由图4(b)可以看出,在0.5 g·L−1到1.5 g·L−1范围内增加La0.5Ti0.5O2介孔毫米球的投加量,会提高对磷的吸附量和去除率,继续增加吸附剂投加量至2.0 g·L−1时对磷的吸附量和去除率趋于平缓. 尽管La0.5Ti0.5O2投加量为2.0 g·L−1时吸附量达到最大值28.76 mg·g−1,此时对磷的去除率达到96%,但当其投加量减少为1.0 g·L−1时其对磷的吸附量为26.59 mg·g−1,除磷率依然能够达到88.8%,因此本实验以磷的排放标准为基础,综合考虑吸附剂的吸附效果和经济成本,选用1.0 g·L−1 作为La0.5Ti0.5O2介孔毫米球最佳投加量.
-
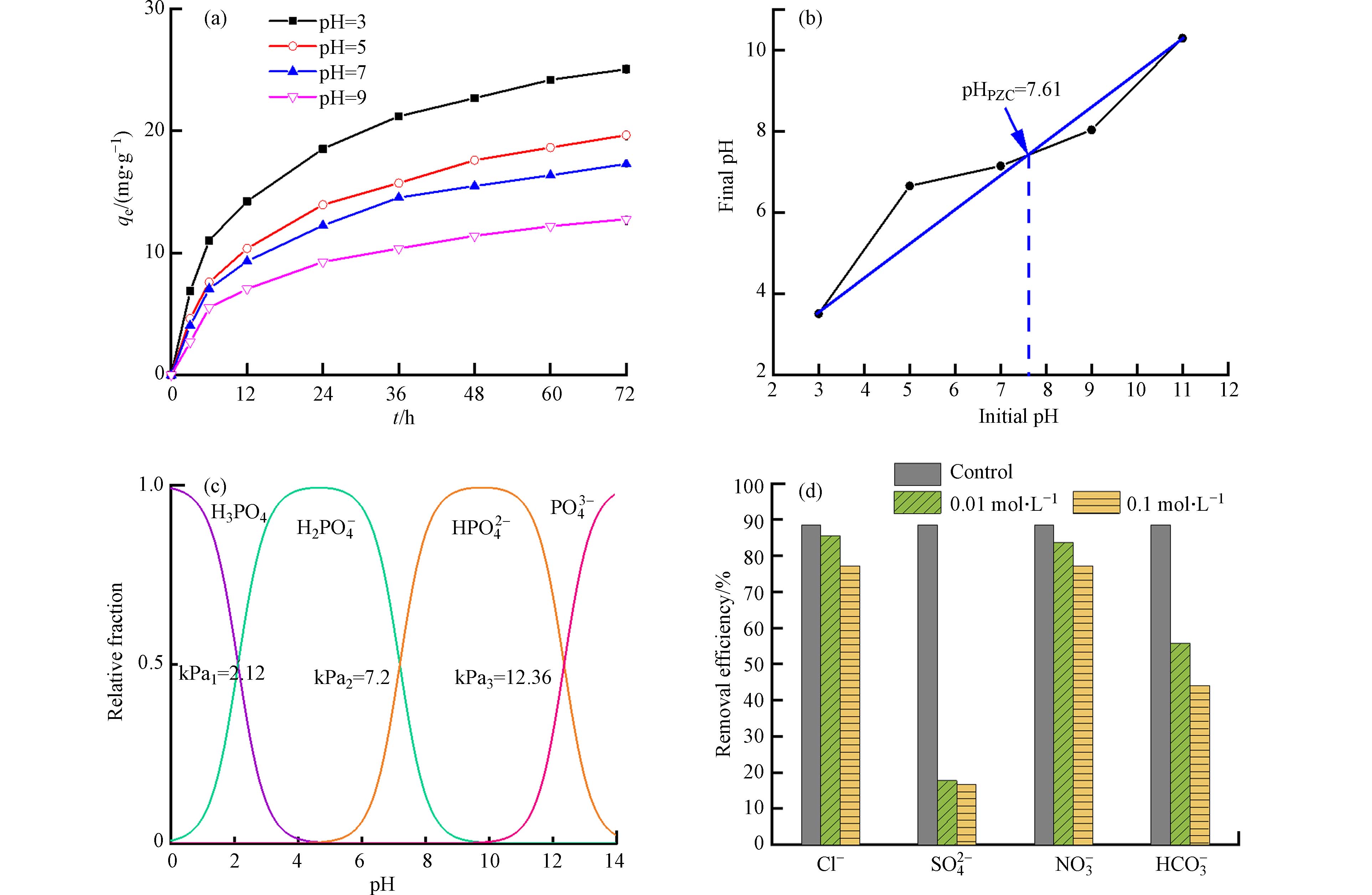
水体pH值是影响La0.5Ti0.5O2介孔毫米球吸附磷酸盐的重要影响因素,pH值既影响磷酸根在水体中的分布形态,又影响La0.5Ti0.5O2介孔毫米球的表面电荷[16]. 因此,实验通过改变溶液初始pH值,研究了其对La0.5Ti0.5O2介孔毫米球吸附磷酸盐的影响. 如图5(a)所示,La0.5Ti0.5O2介孔毫米球对磷酸盐的吸附效果随着溶液初始pH的增加而削弱,当pH值为3时,吸附量达到最大值26.15 mg·g−1. 这主要归因于La是原子半径较大的带正电荷原子,主要吸附阴离子,当溶液中的OH−逐渐增多时,会与磷酸根产生竞争吸附作用从而不利于La0.5Ti0.5O2吸附磷的进行[20 − 22]. 如图5(b)所示,通过pH漂移法获得La0.5Ti0.5O2的零电荷点(pHpzc)为7.61,表明La0.5Ti0.5O2在pH<7.61时容易携带正电荷(H+),导致La0.5Ti0.5O2和磷酸盐之间产生静电吸引,有利于对磷的吸附. 相反,La0.5Ti0.5O2在pH>7.61时倾向于携带负电荷(OH−),导致其与磷酸盐之间产生静电排斥,不利于对磷的吸附. 此外,pH值的增加也导致H2PO4−转化为HPO42−和PO43−(图5c),并且它们的吸附亲和力弱于H2PO4−,从而进一步削弱La0.5Ti0.5O2对磷的吸附. 综上,La0.5Ti0.5O2在酸性水质条件下对磷的去除性能表现更好.
如图5(d)所示,考察了湖泊或河流中常见的阴离子(Cl−、NO3−、SO42−和HCO3−)对La0.5Ti0.5O2去除磷的影响. 所有阴离子对磷的去除都表现出一定的抑制作用. 其中,Cl−和NO3−对磷去除的抑制作用不大,而SO42−和HCO3−对磷去除的抑制作用较强. 与空白组相比,当添加0.01—0.1 mol·L−1 Cl−和NO3−时,磷的去除率仅下降了3%—10%,表明La0.5Ti0.5O2主要以化学吸附的形式去除磷,因此其对磷的去除几乎不受Cl−和NO3−离子强度的影响[23]. SO42−和HCO3−对磷去除的强烈抑制作用可能是由于这些阴离子会与La3+反应形成La2(SO4)3和La2(CO3)3[24 − 25],从而减少了对磷的有效吸附位点. 此外,SO42−和HCO3−还可以提高水环境的pH值,从而增强磷酸盐与La0.5Ti0.5O2之间的静电排斥,抑制La0.5Ti0.5O2对磷的吸附.
-
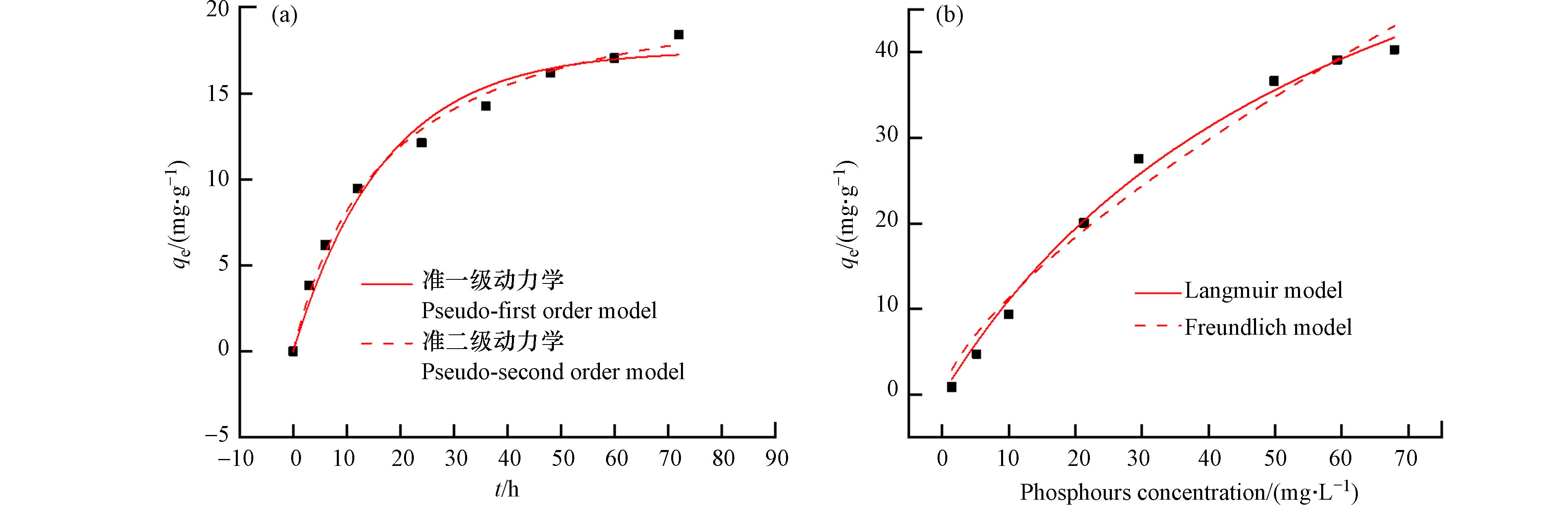
为了评估La0.5Ti0.5O2介孔毫米球对磷吸附的快慢程度,考察了该材料对磷的吸附动力学,结果如图6(a)和表2所示. 由表2可知,准二级动力学模型的R2=0.994,高于准一级动力学模型的R2=0.978,说明La0.5Ti0.5O2介孔毫米球对磷的吸附过程是以化学吸附为主的物理化学吸附过程. 图6(b)是La0.5Ti0.5O2介孔毫米球对磷酸盐的吸附等温线,得到的拟合参数见表3. La0.5Ti0.5O2介孔毫米球对磷的吸附量随着磷酸盐浓度的增加而逐渐增加,但增加速率逐渐变缓. 在低浓度磷酸盐溶液范围内的磷几乎被La0.5Ti0.5O2介孔毫米球完全吸附去除,这是因为在处理低浓度磷时,La0.5Ti0.5O2介孔毫米球吸附位点相对充足,可以足够吸附溶液中的磷. 但随着磷浓度的增加,吸附位点保持不变,La0.5Ti0.5O2介孔毫米球不能够完全吸附溶液中的磷,吸附量增加幅度随之变小,当吸附位点被占满后,吸附量几乎保持不变,从而吸附趋于饱和. 从拟合结果来看,两种模型均能较好地描述吸附过程,Freundlich模型的R2=0.974,Langmuir模型的R2=0.992,更接近于1. Langmuir模型更符合La0.5Ti0.5O2介孔毫米球对磷的吸附过程,说明La0.5Ti0.5O2介孔毫米球对于磷酸盐的吸附是单分子层吸附,这与已有报道的镧改性吸附剂一致[26 − 27]. La0.5Ti0.5O2介孔毫米球的理论最大磷吸附量为75.8 mg·g−1. 式(4)中的n值表示与吸附强度有关的常数,Freundlich模型得到的1/n小于1,表明磷易于吸附在La0.5Ti0.5O2介孔毫米球上[28]. 与其它含La吸附剂相比(表4), La0.5Ti0.5O2 表现出较好的磷吸附性能,磷的吸附量和P/La比(1.24)高于大多数含La吸附剂. 此外,La0.5Ti0.5O2对低浓度磷(<30 mg·L−1)的吸附能力明显强于其它含La吸附剂,这使其有望用于处理河流和湖泊的实际含磷水体治理.
-
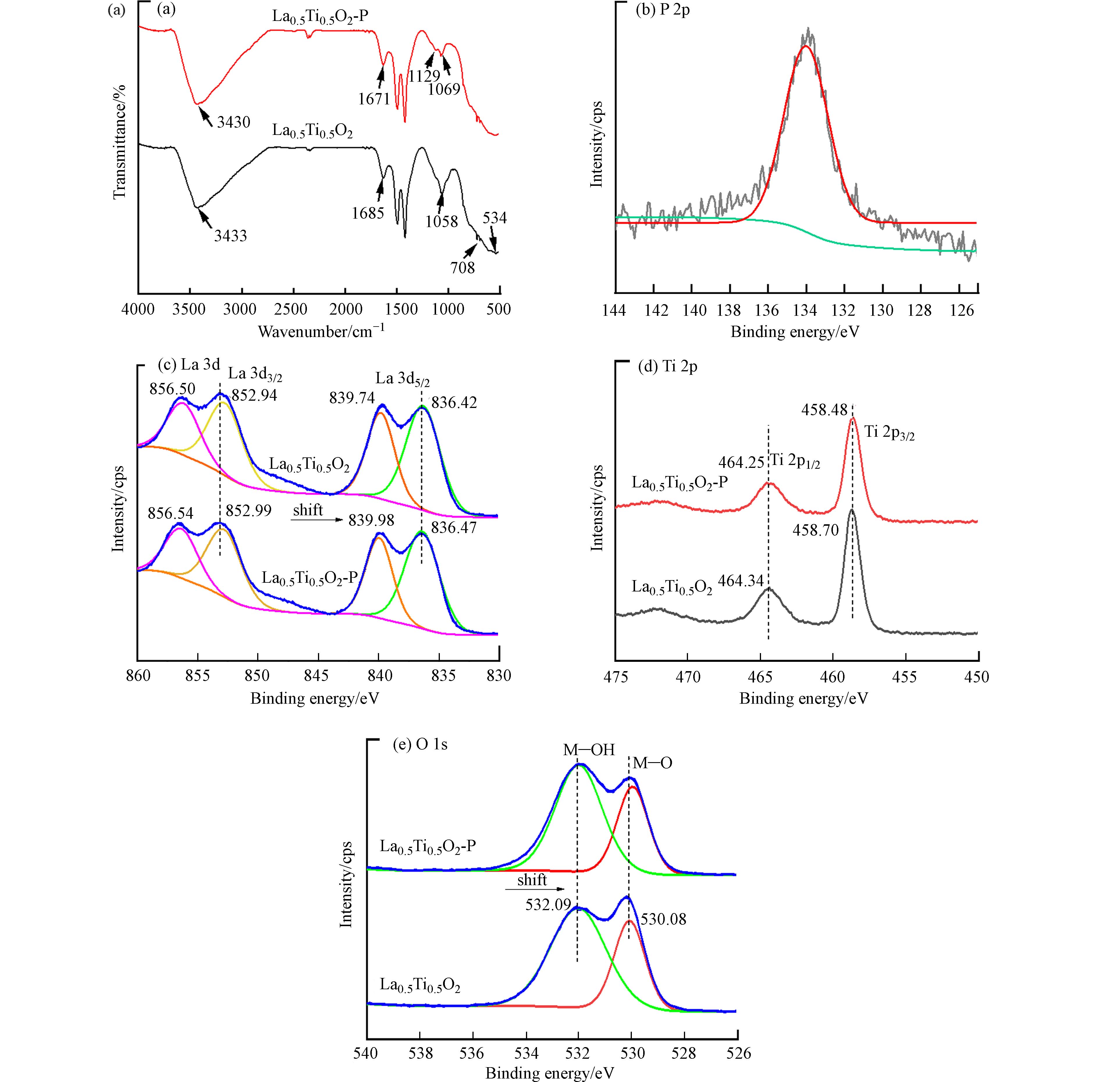
通过FR-IR谱图分析发现(图7a),在吸附磷的样品中检测到位于1129 cm−1处的P—O不对称拉伸振动[27]. La0.5Ti0.5O2吸附磷后,其位于534 cm−1处的特征峰消失,这是因为受到O—P—O的不对称拉伸振动影响. 此外,La0.5Ti0.5O2光谱中位于3433 cm−1和1685 cm−1处的O—H的拉伸和弯曲振动峰分别红移到3430 cm−1和1671 cm−1,表明La0.5Ti0.5O2表面的—OH参与了吸附磷过程,可能是由于La—OH中的—OH与部分磷酸盐发生了配体交换[29]. 为进一步探究La0.5Ti0.5O2与磷酸盐之间的相互作用,用XPS分析材料吸附磷酸盐前后结构变化,结果见图7(b)—(e). 吸附磷的La0.5Ti0.5O2样品的XPS光谱中检测到位于133.8 eV处的特征性P 2p峰(图7b),表明La0.5Ti0.5O2成功吸附了磷酸盐. 在吸附磷之前,在La 3d谱图中出现两特征峰(图7c),这两组峰分别是La 3d 3/2=856.50 eV、852.94 eV和La 3d 5/2=839.74 eV、83.42 eV. 在吸附磷之后,La 3d 3/2和La 3d 5/2的结合能移到较高的数值,分别为La 3d 3/2=856.54 eV、852.99 eV和La 3d 5/2=839.98 eV、836.47 eV,表明La价带上可能发生了电子转移且形成了La—O—P的内球络合物LaPO4[30]. 有研究表明P—O键具有强吸电子效应,其与镧(氢)氧化物结合后,导致镧电子密度降低,La 3d电子的结合能升高[38],这与本研究的现象一致. 此外,吸附后的La0.5Ti0.5O2的Ti 2p 2/3和Ti 2p 1/2也向较低的数值移动,在Ti 2p 2/3处的特征峰由458.70 eV移动到458.48 eV,在Ti 2p 1/2的特征峰由464.34 eV移动至464.25 eV(图7d),这可能是由于吸附剂表面的—OH键与磷酸盐之间发生了交换反应引起[31]. 由图5b可知,初始pH在零电荷点pHpzc=7.61以下,吸附稳定后的pH值均有一定程度的升高,进一步表明吸附过程表面-OH与磷酸盐发生配体交换反应. 吸附前,La0.5Ti0.5O2在532.09 eV和530.08 eV处出现了O 1s的两个特征峰(图7e),分别归属于La—OH和La—O[27]. 吸附后,532.09 eV处的特征峰强度增强,而530.08 eV处的特征峰强度减弱,进一步说明吸附的磷酸根形成了新的化学键La—O—P,改变了La—O键的化学环境. 结合文献报道和以上分析结果,La0.5Ti0.5O2通过配体交换吸附磷的过程可以表示如下[7, 29]:
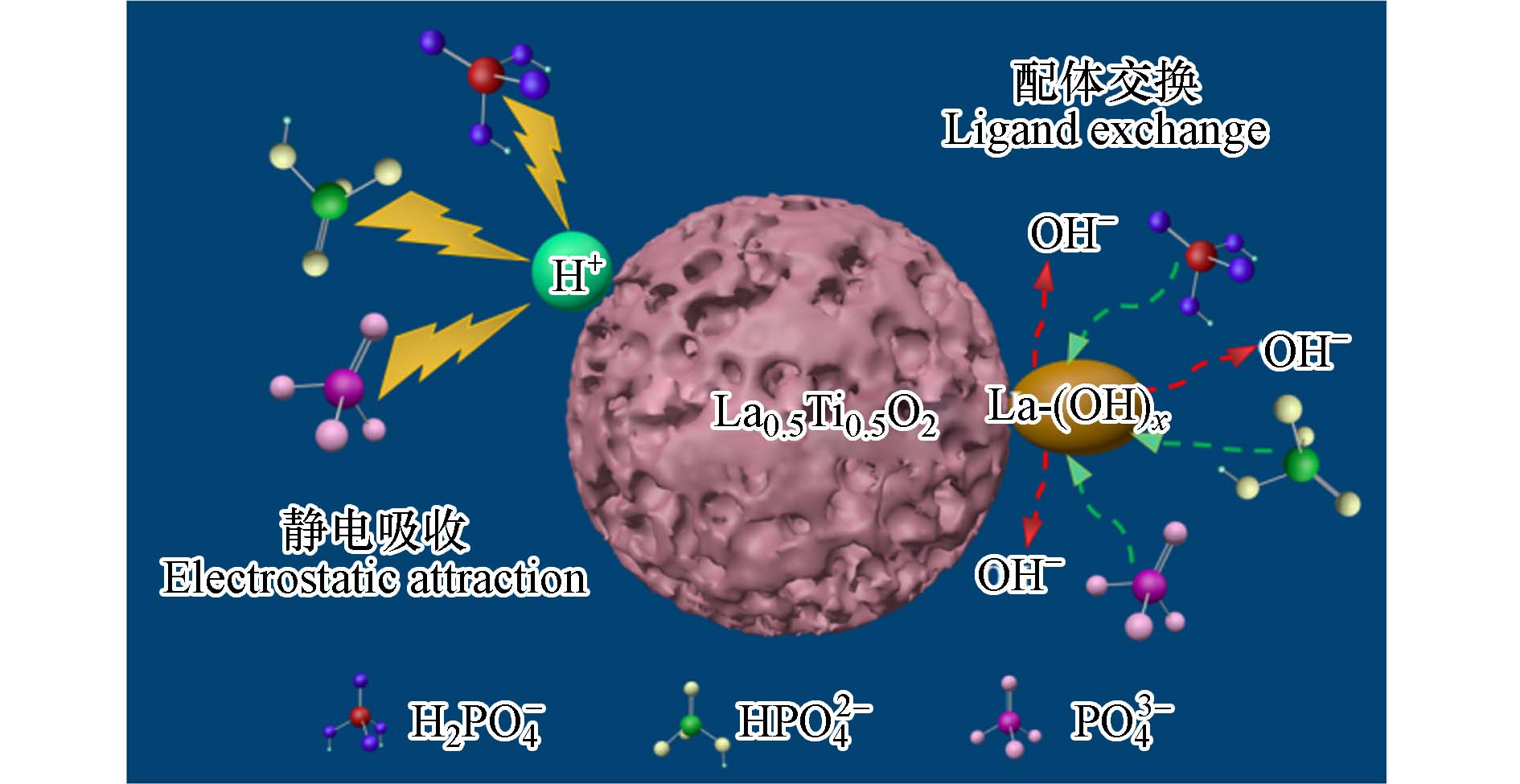
La0.5Ti0.5O2介孔毫米球对磷酸盐的吸附过程如图8所示. 在吸附过程中,静电吸引(物理吸附)和配体交换(化学吸附)都起着重要作用. 静电吸引受到溶液pH值的显著影响. 当pH<pHpzc时,La0.5Ti0.5O2表面发生质子化,H+浓度增加,吸附位点与磷酸盐之间的吸附力增强. 当pH>pHpzc时,La0.5Ti0.5O2表面脱质子化,OH−浓度增加,吸附位点与磷酸盐之间的排斥力增强. 配体交换过程[式(5)—(7)]也受到水溶液pH的极大影响. 提高pH值会大幅提高OH−的浓度,这不利于吸附剂与磷酸盐的配体交换过程. 配体交换机制也可以解释La0.5Ti0.5O2对磷酸盐的高选择性,与常见的阴离子Cl−、NO3−、SO42−和HCO3−等相比,配体交换反应为磷酸盐与La0.5Ti0.5O2结合提供了非常强的驱动力.
-
(1) 本研究制备合成的介孔钛镧双金属氧化物毫米球,在La:Ti=1:1,煅烧温度为400 ℃时具有良好的吸附性能,其平均孔径为3.71 nm,具有丰富的孔结构、高比表面积,对磷酸根的吸附容量可以达到75.8 mg·g−1.
(2) 溶液pH的升高会抑制La0.5Ti0.5O2介孔毫米球的对磷的吸附性能;吸附除磷效果随着吸附剂投量的增加而增加,但投量为1.5 g·L−1之后,对磷去除效果提升较小;水体中常见的共存离子Cl−、NO3−对吸附除磷效果干扰不大,而SO42−和HCO3−对La0.5Ti0.5O2吸附除磷的抑制作用明显.
(3) La0.5Ti0.5O2介孔毫米球对磷的吸附过程符合Langmuir模型和准一、准二级动力学模型,说明La0.5Ti0.5O2介孔毫米球对磷酸盐的吸附是单分子层吸附,对磷酸盐吸附过程是物理化学吸附.
4) 静电吸附和配体交换反应共同决定了La0.5Ti0.5O2介孔毫米球对磷的吸附,两种作用机制均受pH值影响,pH值越低,吸附性能越好.
镧钛氧化物介孔毫米球除磷性能与机理
Performance and mechanism of mesoporous La-Ti oxide millispheres for efficient removal of phosphorus
-
摘要: 利用溶胶-凝胶模板法制备了镧钛双金属氧化物介孔毫米球LaxTi1-xO2,通过BET、XRD、SEM、TEM等方法对LaxTi1-xO2进行了系统表征,同时考察了镧钛物质的量比、煅烧温度、初始溶液pH等因素对LaxTi1-xO2除磷效果的影响. 结果表明,经400 ℃煅烧制得的La0.5Ti0.5O2介孔毫米球具有高比表面积(105 m2·g−1)、适宜的介孔结构(平均孔径3.71 nm)、优异的吸附磷酸盐能力,吸附容量达75.8 mg·g−1. La0.5Ti0.5O2除磷性能随La/Ti物质的量比和投量的增加而升高,随pH增加而下降. 共存Cl−和NO3−对La0.5Ti0.5O2吸附磷酸盐的影响较小,而SO42−和HCO3−对吸附过程有较大影响. 吸附等温线与Langmuir模型高度吻合(R2=0.992),表明La0.5Ti0.5O2对磷酸盐的吸附是单分子层吸附. La0.5Ti0.5O2对磷酸盐的吸附过程遵循准一级(R2=0.978)、准二级动力学模型(R2=0.994),表明其对磷酸盐吸附过程是以化学吸附为主的物理化学吸附. 零电荷点、FT-IR、XPS等表征结果表明,La0.5Ti0.5O2通过静电吸引与配体交换反应吸附去除磷.Abstract: A series of mesoporous LaxTi1-xO2 millispheres were prepared by sol-gel template method. The resultant adsorbents were systematically characterized by means of BET, XRD, SEM and TEM. Effects of La/Ti molar ratio, calcination temperature, initial solution pH on the performance of phosphorus removal by LaxTi1-xO2 millispheres were investigated. The results showed the optimized La0.5Ti0.5O2 prepared at 400 ℃ possessed high specific surface area (105 m2·g−1), suitable mesoporous structure (average pore size of 3.71 nm) and excellent adsorption capacity of 75.8 mg P·g−1. The removal of phosphorus by La0.5Ti0.5O2 increased with the increase of La/Ti molar ratio and La0.5Ti0.5O2 dosage, but decreased with the increase of pH. The coexisting Cl− and NO3− exhibited a little influence on the adsorption of phosphorus, while SO42− and HCO3− showed great effects on adsorption process. The adsorption isotherm was well in agreement with Langmuir model (R2=0.992), indicating that the adsorption of phosphorus by La0.5Ti0.5O2 obeyed monolayer adsorption. The adsorption kinetic of phosphorus followed pseudo-first-order (R2=0.978) and pseudo-second-order kinetic model (R2=0.994), suggesting that the removal of phosphorus by La0.5Ti0.5O2 belonged to a chemical adsorption-dominated physicochemical adsorption. The results of zero charge point measurement, FT-IR and XPS demonstrated the adsorption of phosphorus by La0.5Ti0.5O2 through electrostatic attraction and ligand exchange reaction.
-
Key words:
- mesoporous millisphere /
- La-Ti oxide /
- adsorption /
- phosphorus removal /
- ligand exchange.
-

-
表 1 不同煅烧温度下LaxTi1-xO2介孔毫米球的基本性质
Table 1. Basic properties of LaxTi1-xO2 mesoporous millispheres
LaxTi1-xO2介孔毫米球 TiO2(400 ℃) La0.5Ti0.5O2 (400 ℃) La0.5Ti0.5O2 (600 ℃) La0.25Ti0.75O2 (400 ℃) La0.25Ti0.75O2 (600 ℃) 平均孔径/nm
平均比表面积/(m2·g−1)4.76
1403.71
10510.6
41.34.76
1518.06
56.9表 2 La0.5Ti0.5O2介孔毫米球吸附磷的动力学参数
Table 2. Kinetic parameters of phosphorus adsorption by LaxTi1-xO2 mesoporous millispheres
温度/℃
Temperature准一级动力学
Pseudo-first order model准二级动力学
Pseudo-second order modelqe/(mg·g−1) k1 R2 qe/(mg·g−1) k2 R2 25 ℃ 17.5 6.25×10−2 0.978 22.1 2.74×10−3 0.994 表 3 Langmuir和Freundlich模型拟合参数
Table 3. Fitting related parameters of Langmuir and Freundlich
温度/℃
TemperatureLangmuir模型
Langmuir modelFreundlich模型
Freundlich modelqm/(mg·g−1) R2 KL/(L·mg−1) KF/(mg·g−1) 1/n R2 25 75.8 0.992 0.0176 2.49 0.671 0.974 表 4 吸附剂吸附性能对比
Table 4. Comparation of adsorption capacity of adsorbents
吸附剂
Adsorbents初始浓度/(mg ·L−1P)
Initial concentrationpH 投加量/
(g·L−1)
Dosage比表面积/(m2·g−1)
Specific surface area吸附容量/(mg ·g−1P)
Adsorption capacity磷镧比
P/La参考文献
ReferencesLa-多孔沸石 5—60 7.02 2.0 52.75 14.8 0.95 [29] La(OH)3 5—500 11.3 12.5 153 107.5 0.84 [30] Fe3O4/50%-La(OH)3 1—10 7.0 0.1 190 52.7 0.68 [31] FeOOH/La-磁铁矿 2—120 6.8 1.0 85.8 44.8 1.30 [32] La-功能化SiO2气凝胶 10—120 5.0 1.0 192 69.4 0.85 [33] La(OH)3-改性蛭石 1—100 7.0 1.0 39.1 79.6 0.85 [27] La-介孔硅小球 5—80 6.0 0.5 67.4 44.8 0.67 [34] La(OH)3-改性硅藻石 10—100 6.8 0.5 74.1 58.7 2.39 [35] 沸石-氢氧化镧复合吸附剂 10—500 7.74 0.1 55.7 71.9 1.48 [6] 碳酸镧-阴离子交换树脂 5—60 7.0 0.5 — 77.4 0.73 [5] La-碳纳米管 0—100 12.0 0.2 — 96.3 — [4] LaOH-活性炭纤维 10—70 2.0 0.25 — 15.3 1.30 [36] LaFe-活性炭纤维 5—60 4.0 1.0 — 29.4 — [37] La0.5Ti0.5O2 1—70 3.0 1.0 105 75.8 1.24 本研究 -
[1] 杨桂山, 徐昔保. 长江经济带“共抓大保护、不搞大开发” 的基础与策略[J]. 中国科学院院刊, 2020, 35(8): 940-950. YANG G S, XU X B. Foundation and strategy of well-coordinated environmental conservation and avoiding excessive development in the Yangtze River economic belt[J]. Bulletin of Chinese Academy of Sciences, 2020, 35(8): 940-950 (in Chinese).
[2] 张亦南, 丁佳锋, 张小芳, 等. 镧负载沸石壳聚糖复合吸附剂高效除磷性能研究[J]. 环境科学学报, 2021, 41(2): 557-565. ZHANG Y N, DING J F, ZHANG X F, et al. Adsorption properties of high efficient lanthanum-loaded zeolite-chitosan composite absorbent for phosphorus removal[J]. Acta Scientiae Circumstantiae, 2021, 41(2): 557-565 (in Chinese).
[3] ZHANG Y Y, KONG B, SHEN Z Y, et al. Phosphorus binding by lanthanum modified pyroaurite-like clay: Performance and mechanisms[J]. ACS ES& T Engineering, 2021, 1(11): 1565-1575. [4] LIU B H, DAI S Y, ZHANG X T, et al. Highly efficient and reusable lanthanum-carbon nanotube films for enhanced phosphate removal[J]. Separation and Purification Technology, 2022, 299: 121710. doi: 10.1016/j.seppur.2022.121710 [5] TEE K A, BADSHA M A H, KHAN M, et al. Lanthanum carbonate nanoparticles confined within anion exchange resin for phosphate removal from river water: Batch and fixed-bed column study[J]. Process Safety and Environmental Protection, 2022, 159: 640-651. doi: 10.1016/j.psep.2022.01.008 [6] XIE J, WANG Z, FANG D, et al. Green synthesis of a novel hybrid sorbent of zeolite/lanthanum hydroxide and its application in the removal and recovery of phosphate from water[J]. Journal of Colloid and Interface Science, 2014, 423: 13-19. doi: 10.1016/j.jcis.2014.02.020 [7] 魏小兰, 赵靖华, 丁静, 等. 介孔吸附剂SiO2-TiO2的合成及其水蒸气吸附性能[J]. 华南理工大学学报(自然科学版), 2012, 40(9): 14-19. WEI X L, ZHAO J H, DING J, et al. Synthesis and water vapor adsorption property of meso-porous adsorbent SiO2-TiO2[J]. Journal of South China University of Technology (Natural Science Edition), 2012, 40(9): 14-19 (in Chinese).
[8] YIN X J, LI X, PETROPOULOS E, et al. Phosphate removal from actual wastewater via La(OH)3-C3N4 adsorption: Performance, mechanisms and applicability[J]. Science of the Total Environment, 2022, 814: 152791. doi: 10.1016/j.scitotenv.2021.152791 [9] FENG Y Y, LUO Y, HE Q P, et al. Performance and mechanism of a biochar-based Ca-La composite for the adsorption of phosphate from water[J]. Journal of Environmental Chemical Engineering, 2021, 9(3): 105267. doi: 10.1016/j.jece.2021.105267 [10] LI X C, YAN L, ZHONG W, et al. Competitive arsenate and phosphate adsorption on α-FeOOH, LaOOH, and nano-TiO2: Two-dimensional correlation spectroscopy study[J]. Journal of Hazardous Materials, 2021, 414: 125512. doi: 10.1016/j.jhazmat.2021.125512 [11] CONNOR P A, McQUILLAN A J. Phosphate adsorption onto TiO2 from aqueous solutions: an in situ internal reflection infrared spectroscopic study[J]. Langmuir, 1999, 15(8): 2916-2921 doi: 10.1021/la980894p [12] KIMLING M C, CARUSO R A. Sol–gel synthesis of hierarchically porous TiO2 beads using calcium alginate beads as sacrificial templates[J]. Journal of Materials Chemistry, 2012, 22(9): 4073-4082. doi: 10.1039/c2jm15720a [13] WATANABE S, MA X L, SONG C S. Characterization of structural and surface properties of nanocrystalline TiO2–CeO2 mixed oxides by XRD, XPS, TPR, and TPD[J]. The Journal of Physical Chemistry C, 2009, 113(32): 14249-14257. doi: 10.1021/jp8110309 [14] 许润, 石程好, 唐倩, 等. 氢氧化镧改性介孔稻壳生物炭除磷性能[J]. 环境科学, 2019, 40(4): 1834-1841. XU R, SHI C H, TANG Q, et al. Phosphate removal using rice husk biochars modified with lanthanum hydroxide[J]. Environmental Science, 2019, 40(4): 1834-1841 (in Chinese).
[15] FEI Z Y, YANG Y R, WANG M H, et al. Precisely fabricating Ce-O-Ti structure to enhance performance of Ce-Ti based catalysts for selective catalytic reduction of NO with NH3[J]. Chemical Engineering Journal, 2018, 353: 930-939. doi: 10.1016/j.cej.2018.07.198 [16] 王羽. 镧改性除磷剂的制备及其性能研究[D]. 北京: 北京化工大学, 2021. WANG Y. Preparation and properties of lantanum-modified adsorbents for phosphorus removal[D]. Beijing: Beijing University of Chemical Technology, 2021 (in Chinese).
[17] ZHAN W C, LU G Z, GUO Y L, et al. Synthesis of Ln-doped MCM-41 mesoporous materials and their catalytic performance in oxidation of styrene[J]. Journal of Rare Earths, 2008, 26(1): 59-65. doi: 10.1016/S1002-0721(08)60038-1 [18] YANG J P, CHEN W Y, SHEN D K, et al. Controllable fabrication of dendritic mesoporous silica–carbon nanospheres for anthracene removal[J]. Journal of Materials Chemistry A, 2014, 2(29): 11045-11048. doi: 10.1039/c4ta01516a [19] 周冬, 单超, 高冠道, 等. 铈钛氧化物介孔毫米球的制备及其催化臭氧氧化特性与机理[J]. 中国科学:技术科学, 2019, 49(5): 565-578. doi: 10.1360/N092018-00418 ZHOU D, SHAN C, GAO G D, et al. Preparation of mesoporous Ce-Ti oxide millispheres for efficient catalytic ozonation: Performance and mechanism[J]. Scientia Sinica (Technologica), 2019, 49(5): 565-578 (in Chinese). doi: 10.1360/N092018-00418
[20] ZAMPARAS M, GIANNI A, STATHI P, et al. Removal of phosphate from natural waters using innovative modified bentonites[J]. Applied Clay Science, 2012, 62/63: 101-106. doi: 10.1016/j.clay.2012.04.020 [21] LIU S J, LI J, YANG Y K, et al. Influence of environmental factors on the phosphorus adsorption of lanthanum-modified bentonite in eutrophic water and sediment[J]. Environmental Science and Pollution Research, 2016, 23(3): 2487-2494. doi: 10.1007/s11356-015-5453-z [22] 司静, 卢少勇, 金相灿, 等. pH值和光照对镧改性膨润土吸附水中氮和磷的影响[J]. 中国环境科学, 2009, 29(9): 946-950. SI J, LU S Y, JIN X C, et al. Effect of pH value and light on La-modified bentonite adsorption of phosphorus and nitrogen in water[J]. China Environmental Science, 2009, 29(9): 946-950 (in Chinese).
[23] 林建伟, 王虹, 詹艳慧, 等. 氢氧化镧-天然沸石复合材料对水中低浓度磷酸盐的吸附作用[J]. 环境科学, 2016, 37(1): 208-219. LIN J W, WANG H, ZHAN Y H, et al. Adsorption of phosphate by lanthanum hydroxide/natural zeolite composites from low concentration phosphate solution[J]. Environmental Science, 2016, 37(1): 208-219 (in Chinese).
[24] 戴敏, 王建国, 巢军委, 等. 镧生物质炭对磷酸根离子的吸附特性[J]. 生态与农村环境学报, 2015, 31(3): 372-379. doi: 10.11934/j.issn.1673-4831.2015.03.016 DAI M, WANG J G, CHAO J W, et al. Phosphate adsorption characteristics of La-containing biochar[J]. Journal of Ecology and Rural Environment, 2015, 31(3): 372-379 (in Chinese). doi: 10.11934/j.issn.1673-4831.2015.03.016
[25] WANG D, CHEN N, YU Y, et al. Investigation on the adsorption of phosphorus by Fe-loaded ceramic adsorbent[J]. Journal of Colloid and Interface Science, 2016, 464: 277-284. doi: 10.1016/j.jcis.2015.11.039 [26] WANG Z H, SHEN D K, SHEN F, et al. Phosphate adsorption on lanthanum loaded biochar[J]. Chemosphere, 2016, 150: 1-7. doi: 10.1016/j.chemosphere.2016.02.004 [27] HUANG W Y, LI D, LIU Z Q, et al. Kinetics, isotherm, thermodynamic, and adsorption mechanism studies of La(OH)3-modified exfoliated vermiculites as highly efficient phosphate adsorbents[J]. Chemical Engineering Journal, 2014, 236: 191-201. doi: 10.1016/j.cej.2013.09.077 [28] ISMAIL Z Z, AbdelKAREEM H N. Sustainable approach for recycling waste lamb and chicken bones for fluoride removal from water followed by reusing fluoride-bearing waste in concrete[J]. Waste Management, 2015, 45: 66-75. doi: 10.1016/j.wasman.2015.06.039 [29] HE Y H, LIN H, DONG Y B, et al. Preferable adsorption of phosphate using lanthanum-incorporated porous zeolite: Characteristics and mechanism[J]. Applied Surface Science, 2017, 426: 995-1004. doi: 10.1016/j.apsusc.2017.07.272 [30] XIE J, WANG Z, LU S Y, et al. Removal and recovery of phosphate from water by lanthanum hydroxide materials[J]. Chemical Engineering Journal, 2014, 254: 163-170. doi: 10.1016/j.cej.2014.05.113 [31] FANG L P, LIU R, LI J, et al. Magnetite/Lanthanum hydroxide for phosphate sequestration and recovery from lake and the attenuation effects of sediment particles[J]. Water Research, 2018, 130: 243-254. doi: 10.1016/j.watres.2017.12.008 [32] FU H Y, YANG Y X, ZHU R L, et al. Superior adsorption of phosphate by ferrihydrite-coated and lanthanum-decorated magnetite[J]. Journal of Colloid and Interface Science, 2018, 530: 704-713. doi: 10.1016/j.jcis.2018.07.025 [33] EMMANUELAWATI I, YANG J, ZHANG J, et al. Low-cost and large-scale synthesis of functional porous materials for phosphate removal with high performance[J]. Nanoscale, 2013, 5(13): 6173-6180. doi: 10.1039/c3nr01574b [34] HUANG W Y, YU X, TANG J P, et al. Enhanced adsorption of phosphate by flower-like mesoporous silica spheres loaded with lanthanum[J]. Microporous and Mesoporous Materials, 2015, 217: 225-232. doi: 10.1016/j.micromeso.2015.06.031 [35] WU Y, LI X M, YANG Q, et al. Hydrated lanthanum oxide-modified diatomite as highly efficient adsorbent for low-concentration phosphate removal from secondary effluents[J]. Journal of Environmental Management, 2019, 231: 370-379. [36] ZHANG L, ZHOU Q, LIU J Y, et al. Phosphate adsorption on lanthanum hydroxide-doped activated carbon fiber[J]. Chemical Engineering Journal, 2012, 185/186: 160-167. doi: 10.1016/j.cej.2012.01.066 [37] LIU J Y, ZHOU Q, CHEN J H, et al. Phosphate adsorption on hydroxyl–iron–lanthanum doped activated carbon fiber[J]. Chemical Engineering Journal, 2013, 215/216: 859-867. doi: 10.1016/j.cej.2012.11.067 [38] YANG J, DAI Y, ZHU X Y, et al. Metal-organic frameworks with inherent recognition sites for selective phosphate sensing through their coordination-induced fluorescence enhancement effect[J]. Journal of Materials Chemistry A, 2015, 3(14): 7445-7452. doi: 10.1039/C5TA00077G -



 下载:
下载: