-
餐厨垃圾全球范围产生量已达到13亿t[1]. 其有机物含量高(VS含量达85%—95%),含水率高(约75%—85%)[2]. 如果不妥当处理会对环境产生负面影响,甚至直接或间接影响人类的健康. 但另一方面,餐厨垃圾由于富含有机质及营养元素,是理想的厌氧消化基质;通过厌氧消化可产生中间产物,如氢气(H2)和挥发酸(VFAs)以及末端产物甲烷(CH4)等,较好地实现资源化利用. 其中,H2单位重量的热值最大,为142.35
$ \mathrm{k}\mathrm{J}\cdot {\mathrm{g}}^{-1} $ ,被视为最清洁和最理想的能源载体[3 − 4]. 因此,餐厨垃圾厌氧发酵产氢具有良好的发展前景.餐厨垃圾组分复杂,主要由淀粉、蛋白质、油脂和纤维素组成[5]. 不同组分的理化性质不同,产氢性能也不同. 关于餐厨垃圾不同组分厌氧发酵产氢已进行较多研究,淀粉类,如米饭[6 − 7]、土豆[6 − 7]、谷类食品[8]以及意大利面、面条和面包[9]等;纤维素类如胡萝卜、卷心菜[10]、莴苣[6]、水果果皮[11]等;蛋白质类如鸡蛋[8,10,12]、瘦肉[6]、牛奶[13]等;油脂类如食用油、肥肉[6]、鸡皮[10]等. 餐厨垃圾的组分含量变化是影响产氢效率的重要因素[14 − 15]. 研究发现,餐厨垃圾挥发性固体中碳水化合物含量达到35.5%、脂质24.1%、蛋白质14.4%[16],因此餐厨垃圾中主要成分为碳水化合物,对餐厨垃圾产氢起到重要影响作用. 同时,许多研究表明,H2的产量在很大程度上取决于碳水化合物含量[17]. Alibardi等[18]研究了有机物中碳水化合物、蛋白质、脂质对H2产量、VFAs产量和碳转移途径影响,结果表明,H2产量与碳水化合物含量呈线性相关,而蛋白及脂质对其影响较小. 餐厨垃圾中,米饭等淀粉类以及果蔬等纤维素类是构成碳水化合物的主要组分. 其中大米是五大主食之一,且是中国南方地区主要主食,因此大米为南方餐厨垃圾中主要淀粉类物质. Kobayashi等[8]研究发现产氢量与淀粉类浓度呈显著正相关,与纤维素浓度呈负相关. 许多研究表明,对比其他组分(葱[19]、苹果[19]、猪肉[19]、白菜[20]、鸡蛋[20]和肥肉[20]),发现以米饭为基质产氢效果最好[6,10,19 − 22].
虽然以米饭为基质进行厌氧发酵产氢已进行一定研究,却主要以已加工煮熟的米饭为主. 而在餐厨垃圾组分中,除了熟米饭(CR)外,其实还有因发霉、受潮等原因而丢弃的生米(RR). 关于以RR为基质进行发酵产氢目前较少见到相关报道,而对比RR、CR产氢效能则更少见到相关报道. 本文以大米作为餐厨垃圾中淀粉类组分的代表,研究了淀粉类代表性组分生、熟性质的产氢潜能和发酵过程中副产物的释放规律. 主要研究内容如下:(1)探究了代表组分的厌氧发酵产氢潜能,对比了大米在生、熟条件下的产氢情况,并确定最佳接种量;(2)对代表组分厌氧发酵产氢过程进行追踪,分析副产物的释放规律和底物的变化情况,确定主要代谢途径和发酵产氢类型.
-
底物:本实验中以大米作为餐厨垃圾淀粉类组分的代表,直接从福州某大型生鲜超市采购. 将RR样品用粉碎机粉碎,然后于4 ℃冰箱保存备用. CR的制备同日常烹饪一样,即在RR中加水,用电饭锅煮熟,获得CR. RR样品:总固体(TS)90.36
$ \mathrm{\%}\pm $ 5.15%,挥发性固体/总固体(VS/TS) 97.10%$ \pm $ 2.49%,C/N 29.30,总蛋白质9.63%(按TS算),总糖62.56%(按TS算). CR样品:TS 40.81$ \mathrm{\%}\pm $ 0.61%,VS/TS 99.13$ \mathrm{\%}\pm $ 0.43%,C/N 27.07,总蛋白质10.22%(按TS算),总糖为69.57 %(按TS算).接种物:来自福州某污水处理厂的浓缩泥,该厂采用的是A2/O工艺. 本次研究种泥的预处理条件为:先将污泥的含水率调整到92 %,然后加热75 ℃保持10 min. 预处理后污泥产气量较低,已在数据处理时抵扣. 种泥的C/N 为7.05,VS/TS 为0.36
$ \mathrm{\%}\pm $ 0.04%,pH 值6.235$ \pm $ 0.001. -
以RR、CR作为基质,热处理后的浓缩泥为种泥,按基质与种泥比(S/I)(VS比)为0.5:1及1:1混合均匀,用蒸馏水调节含水率至92%. 其中以RR为基质,S/I=0.5、1的实验组分别命名为RR-F1、RR-F2;以CR为基质,S/I=0.5、1的实验组分别命名为CR-F1、CR-F2. 每个实验组设8—10个平行样. 取180 g混合物装入330 mL血清瓶中,通氮气3 min后以丁胶塞密封并用铝盖加固,连接实验装置,于(35±1)℃的恒温水浴锅中进行厌氧发酵产氢(试验装置见图1). 测定发酵过程中气体成分、排水体积及发酵前后底物指标变化. 依据产氢情况选择时间出样,测定发酵底物各指标随时间的变化.
-
气体成分和含量用GC-TCD气相色谱(岛津,日本)测定,手动进样. 污泥TS测定采用烘干法(CJ/T 221-2005),VS测定为重量法(CJ/T 221-2005),pH用雷磁pH计(PHS-3C)测定. 基质样品冷冻干燥24 h,固定在导电胶上,喷金后进行扫描电子显微镜(SEM)测试. 测定发酵底物可溶性化学需氧量(SCOD)、可溶碳水化合物、可溶蛋白和NH4+-N等溶解性指标时,将样品在8000 r·min−1离心10 min后的上清液经0.45 μm滤膜过滤,SCOD采用COD快速测定仪(5B-3C型,连华科技);含水率用烘干法测定;NH4+-N用纳氏试剂分光光度法测定;可溶性蛋白质用Folin-酚试剂法测定;可溶性糖及消解后的总糖用苯酚-硫酸法测定. 挥发酸(VFAs)样品测试前加3%的磷酸酸化,用气相色谱法(安捷伦公司,GC7890B)确定组分及含量,VFAs总量(TVFA)为各组分浓度的总和.
-
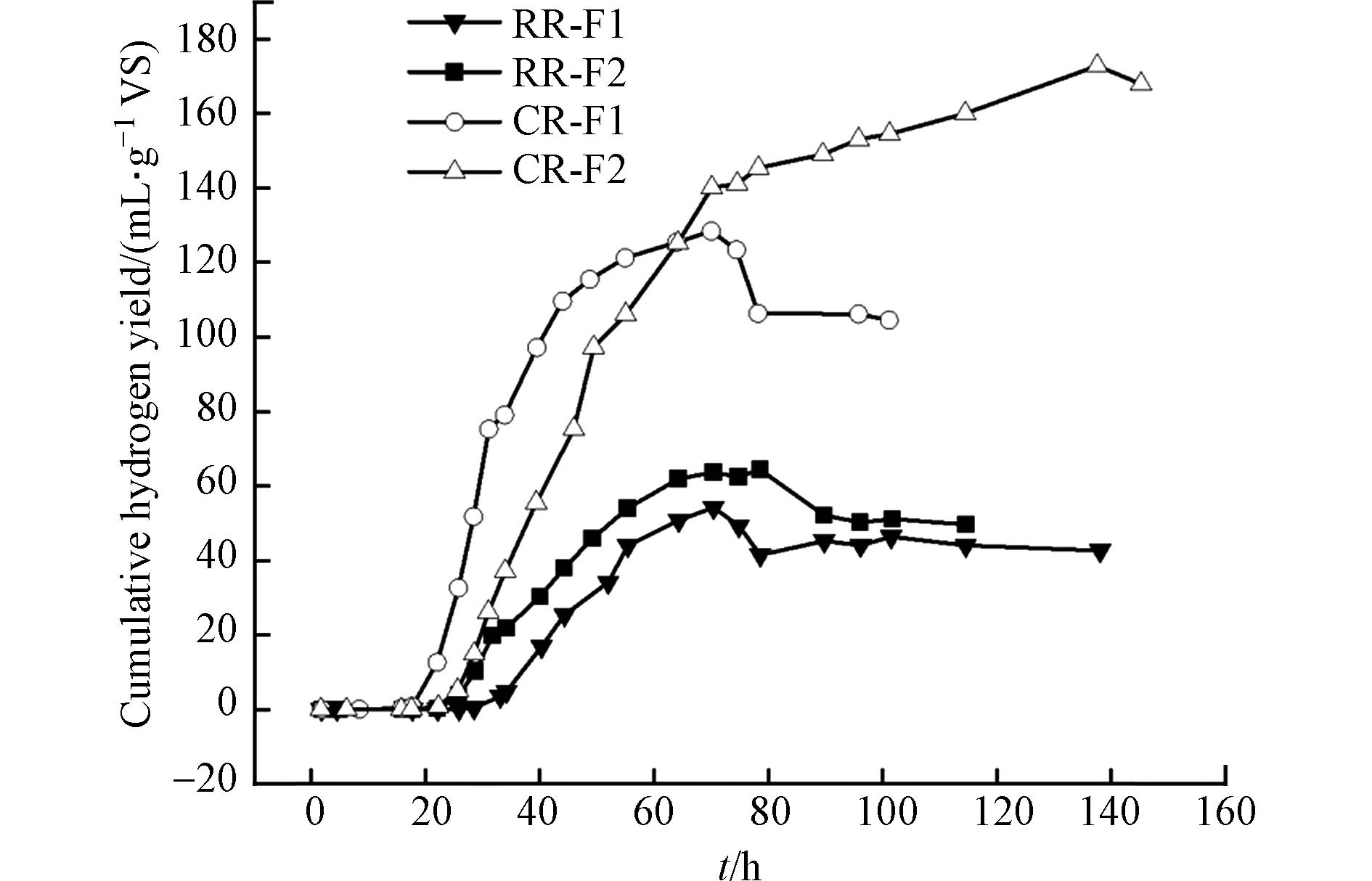
图2表示不同S/I对RR-F和CR-F厌氧发酵产氢的影响. 可以看到,CR-F累积产氢量明显比RR-F高,相同S/I下,CR-F累积产氢量是RR-F的2.4倍(CR-F1)、3.4倍(CR-F2). 同一基质条件下,S/I比越小累积产氢量越小,与Kanchanasuta等[25]的研究结果类似,高负荷基质会导致产酸微生物迅速地将餐厨垃圾转化为挥发性脂肪酸,从而造成反应器为酸性条件,对产氢微生物产生抑制作用. 此外,除了CR-F2组的累积产氢曲线在发酵140 h左右才开始下降,其余各组累积产氢曲线在达到峰值后(基本在75 h左右)迅速下降,说明底物存在耗氢物质.
表1是改进Gompertz模型对各组厌氧发酵产氢动力学曲线拟合的结果,所有实验组的R2均大于0.900,说明拟合效果较好. 相同基质下产氢潜势随S/I增大而增大,S/I为1:1最佳. 其中最佳条件下相对应的RR-F组和CR-F组产氢潜势分别为59.62
$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS和$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS. 说明基质的生熟明显影响产氢潜势,CR-F的产氢潜势是RR-F的2.8倍(S/I=1)、3.6倍(S/I=0.5). Okamoto等[10]和Dong等[6]使用预处理后的厌氧消化污泥与CR进行产氢发酵实验,产氢势能分别为96$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS和134$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS,小于本研究CR-F最佳实验组的产氢势能(166.97$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS).国内外利用发酵法生物制氢技术虽然已取得突破性研究进展,但是转化效率仍然很低. 从生物化学角度,理论上1 mol葡萄糖可以产生12 mol H2. 以乙酸为末端产物,1 mol葡萄糖理论上可以产生4 mol H2;以丁酸为末端产物,1 mol葡萄糖理论上则可得到2 mol H2. 目前通过厌氧发酵法制氢,若统一折合为以乙酸为末端产物,1 mol葡萄糖可以获得的H2产量实际上仅有2—3 mol[26],远低于12 mol H2的产量. 本研究中,将RR-F1、RR-F2、CR-F1、CR-F2折算为每摩尔葡萄糖,其产氢率为0.21
$ {\mathrm{m}\mathrm{o}\mathrm{l}\cdot \mathrm{m}\mathrm{o}\mathrm{l}}^{-1} $ 葡萄糖、0.12$ {\mathrm{m}\mathrm{o}\mathrm{l}\cdot \mathrm{m}\mathrm{o}\mathrm{l}}^{-1} $ 葡萄糖、0.48$ {\mathrm{m}\mathrm{o}\mathrm{l}\cdot \mathrm{m}\mathrm{o}\mathrm{l}}^{-1} $ 葡萄糖、0.40$ {\mathrm{m}\mathrm{o}\mathrm{l}\cdot \mathrm{m}\mathrm{o}\mathrm{l}}^{-1} $ 葡萄糖,与理论产氢量相差较多,这是因为本次实验探究自然发酵时产氢效果,并没有调节最佳实验条件. -
淀粉是发酵产氢的重要能源物质,在厌氧发酵过程中先水解生成可溶性糖类物质. 从可溶糖初始浓度观察,RR-F及CR-F的初始浓度相差10倍以上(见图3(a)). 从RR、CR表面(图3(b)、(c))与横切面((d)、(e))的形态结构,可以看出RR的表面颗粒结构更加致密,这种致密的结构是由RR自身的直链淀粉和支链淀粉的相互链接作用、直链淀粉-脂质复合物以及蛋白质与淀粉的相互作用引起[27]. CR表面有多个核状凸起,横截面中形成多个直径大于40 μm的“裂缝通道”. Thuengtung等[28]研究也发现经过高温蒸煮,米粒表面被分解,导致出现了核状突起. 这种核状突起是由于在高温烹饪时,水分从大米表面渗透到粒核,导致米粒膨胀与细胞壁破坏[28]. 米粒会先产生裂缝,成为水分进入米粒的通道;随着温度的升高,米粒中出现更宽的裂纹,水分穿透淀粉体或蛋白质片(protein sheet),与其交换质子,使得亲水基团和水之间的相互作用增加[29],导致大米内部中可溶糖含量大量溶出,并且可溶性蛋白质增加.
混合体系中,RR-F及CR-F初始可溶蛋白含量相差不大. 虽然如前所述,CR可溶蛋白含量在蒸煮过程中有一定的溶出,相应初始可溶蛋白有一定量的增加,但大米自身的蛋白质成分很少,因此发酵混合体系中蛋白质主要来自种泥. 同比例S/I下 RR-F和CR-F组溶解性蛋白质初始浓度相差不大,且无论RR-F、CR-F,其初始溶解性蛋白质均随着S/I比例的增大而减小,呈显著负相关(P<0.05). 进一步验证RR-F和CR-F蛋白质初始浓度主要来自种泥.
-
RR-F和CR-F厌氧发酵产氢过程中可溶糖浓度变化情况见图4(a). 可以看到,以大米为基质进行发酵,不论是否进行蒸煮,发酵前期的可溶糖浓度均快速下降,主要用于前期产氢菌的复苏和增殖. 随着厌氧发酵的进行,可溶糖不断溶出,但溶出速率小于消耗速率;接近发酵末期,可溶糖消耗的速率变小,产氢速率逐渐减小,产氢逐渐结束,可溶糖浓度有些许回升. 由于CR经过蒸煮,水解产生足量的可溶糖,发酵过程中继续溶出的量很少,因此整个产氢过程呈持续降低的趋势,最终趋于稳定;而RR在发酵过程中可溶糖则不断溶出,因此后期相应有回升的趋势.
另外还发现,随S/I增大,RR-F和CR-F的可溶糖降解率均相应增大,其中RR-F随S/I增大降解率分别为51.64%和60.16%;CR-F随S/I增大分别为90.50%和97.32%;CR-F可溶糖的降解率远高于RR-F的降解率. 对照产氢效能,随S/I增大RR-F和CR-F的产氢效能也增大,可以认为,基质同为RR-F或CR-F的情况下,可溶糖降解率越大,产氢效能越高;比较同比例S/I下RR-F和CR-F产氢效能,CR-F的产氢效能也均远高于RR-F,同样可溶糖降解率越大,产氢效能越高. 相关性分析表明,可溶糖的降解量和累积产氢量呈极显著正相关(P<0.01). Ozmihci等[30]用制糖工业废弃物制氢,也发现可溶性的糖类物质更易被细菌利用,降解率越大,更易产生较好的产氢效果. Pagliaccia等[31]也认为在中温条件下,高溶解糖含量有利于氢的初始回收,提高氢的回收效率,缩短延迟时间.
-
同可溶糖一样,可溶蛋白也是厌氧微生物的主要能源物质. 图4(b)和(c)表示RR-F和CR-F厌氧发酵产氢过程中底物可溶蛋白及氨氮浓度的变化情况. 另外,对比同比例S/I的RR-F、CR-F可溶蛋白发酵过程中的变化情况,发现RR-F可溶蛋白浓度均是在厌氧发酵初期(即系统开始产氢前)开始快速下降,这部分蛋白质消耗主要用于产氢菌的复苏和增殖;开始产氢后可溶蛋白的浓度有少量上升,说明产氢菌在产氢过程中对可溶蛋白的利用很少,由于种泥在发酵过程中部分微生物会发生自溶,并作为基质的一部分参与厌氧发酵,因此可溶蛋白的浓度有少量上升. 而对于CR-F,发现可溶蛋白厌氧发酵初期至开始产氢均未有明显变化,只是在发酵后期略微升高,这是因为CR-F在厌氧发酵过程中主要利用的是可溶糖,后期略微升高的溶解性蛋白同样可能来自部分种泥的自溶.
蛋白质生成氨氮过程主要有三个途径[6],即(1)成对氨基酸的脱氨基作用(Stichland反应)生成氨和脂肪酸;(2)单个氨基酸的氧化脱氨作用;(3)单个氨基酸的还原脱氨作用. 蛋白质形成氨氮的过程主要以途径(1)为主(约90%);途径(2)中H2作为产物之一,在热力学上是不利的,需要极低的氢分压值才能反应;途径(3)在有H2存在下也会发生,这也是蛋白质分解会一定程度消耗H2的原因;此外,在以Stichland途径为主时,蛋白质的降解也不会有H2的生成. 因此蛋白质降解越多,某种程度上越不利于H2的积累. 这也是CR-F产氢量高于RR-F的原因之一.
厌氧发酵体系中氨氮主要来自基质及种泥自身的带入及厌氧发酵过程中蛋白质的分解转化;而对于氨氮的减少,大部分认为由于挥发造成的,随着发酵过程中产生的气体的逸出而带走,另外体系中部分自养型微生物也会以氨氮为营养元素而加以利用. 发酵过程中所有实验组的氨氮浓度在发酵过程中均降低. 对比同比例S/I RR-F和CR-F的氨氮变化,发现CR-F氨氮减少程度均较RR-F大. 由蛋白质降解可知,RR-F蛋白质降解程度高于CR-F,因此RR-F在厌氧发酵过程中生成的氨氮较CR-F多,这也是总体RR-F氨氮减少的幅度少于CR-F的原因. 产氢效率越高,降低量越大.
-
(1) TVFA
VFA是厌氧发酵过程中有机质水解酸化的重要产物,同时也是产氢菌的底物,影响着厌氧发酵产氢过程. 图5(a)表示RR-F和CR-F厌氧发酵产氢过程中,底物中TVFA及VFAs浓度的变化. 可以发现,无论RR-F还是CR-F初始的氨氮浓度都是随着S/I比例的增大而减少,这是因为本研究中,氨氮主要来自种泥中蛋白质的水解,种泥量的减少导致氨氮含量减少. 发酵前各实验组的TVFA无明显差别(RR-F1:2660.28
$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ 、RR-F2:2338.27$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ 、CR-F1:2858.39$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ 、CR-F2:2362.09$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ ). 由于CR-F厌氧发酵过程中可溶蛋白几乎未发生降解,因此TVFA浓度的增加主要是来自可溶糖降解. 而RR-F各组TVFA浓度在厌氧发酵开始至产氢前这个阶段的增加主要是可溶糖和可溶蛋白的降解;产氢后可溶蛋白的变化较小,TVFA浓度的增加主要来源于可溶糖的降解。随S/I增加,TVFA浓度增加(RR-F1:7418.24$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ 、RR-F2:8051.61$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ 、CR-F1:7160.31$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ 、CR-F2:10034.75$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ ). 由“2.3.1”分析还可知,产氢后的可溶糖降解速率比产氢前快,因此TVFA浓度的增加速率加快. 可溶糖降解速率越大,TVFA浓度增加速率越快,其中CR-F增加的比RR-F快. VFA的增加可能会抑制H2的进一步生产. 随着可溶糖降解速率的减少,TVFA浓度逐渐趋于稳定.(2) VFAs
富含碳水化合物的废物是暗发酵产氢的理想底物,大多是丁酸型发酵. Dong等[6]实验结果表明, 乙酸和丁酸是米饭、马铃薯和生菜的主要中间代谢产物. Fang等[32]以米饭为基质进行厌氧发酵产氢,同样发现乙酸和丁酸的产生量在TVFA中占比较高. 本次实验也发现同样结论(RR-F1:62.4%和27.8%、RR-F2:58.8%和35.6%、CR-F1:51.2%和41.3%、CR-F2:32.1%和55.4%). 可以看出,反应后RR-F组乙酸占比相对较高,而CR-F组丁酸占比相对较高. 尽管由于餐厨垃圾中碳水化合物含量的增加,H2的产率增加,但只有易生物降解的化合物,如单糖和淀粉,通过乙酸和丁酸途径被消化并转化为H2[11]. 由图可知,不论RR-F或CR-F,乙酸和丁酸是最主要的两种中间代谢产物,其次是丙酸. 产氢过程中只有乙酸和正丁酸的浓度不断增加,丙酸、异丁酸和异戊酸的浓度最终有不同程度的减少,属于丁酸型发酵. 丁酸型发酵制氢的菌类主要是一些厌氧菌和兼性厌氧菌,主要优势种群是梭菌属(Clostridium),如丁酸梭状芽孢杆菌(C.butyricum)等. 丁酸型发酵产氢过程的末端产物主要是丁酸、乙酸、H2、CO2和少量丙酸. 在严格的厌氧细菌或兼性厌氧菌的作用下,经过三羧酸循环生成丙酮酸,丙酮酸在丙酮酸铁氧还蛋白氧化还原酶的催化作用下脱酸,羟乙基结合到酶的TPP上,生成乙酞辅酶A,脱下的氢使铁氧还蛋白还原,而还原型铁氧还蛋白在氢化酶的作用下被还原同时释放出H2[11].
对于乙酸,产氢前无论RR-F、CR-F,乙酸的浓度快速增加;随着产氢进行,RR-F实验组的乙酸浓度持续增加,而CR-F实验组的乙酸浓度逐渐趋于稳定,尤其CR-F2实验组乙酸浓度基本不变;随着产氢结束,所有实验组的乙酸浓度逐渐趋于稳定. 对于正丁酸,产氢前正丁酸浓度基本没有变化. 随着产氢进行,正丁酸浓度逐渐增加,其中CR-F1实验组最早开始产氢(在15.9 h开始产氢),相应在发酵20 h左右可以检测到正丁酸浓度增大;产氢效能越大,正丁酸浓度增加越快,最终随着产氢速率的减小,增加速率逐渐变小,其浓度逐渐趋于稳定;产氢效能越大,正丁酸浓度越高. 这一结果也表明,较高的正丁酸浓度有利于产氢细菌的生长,从而导致优秀的产氢效果. 丙酸和异丁酸变化基本一致,开始产氢前RR-F实验组的丙酸和异丁酸浓度有少量减少,而CR-F实验组的丙酸和异丁酸浓度呈增大趋势. 产氢后,丙酸和异丁酸浓度有明显的波动. 随着产氢结束,基本呈减小趋势. 异戊酸的浓度随着H2的产生开始下降,产氢效能越大异戊酸的降解量越大.
(3) 正丁酸/乙酸的比值
研究表明,发酵类型为丁酸型时,丁酸/乙酸的比值与产氢量呈正相关,可以作为衡量产氢效率的指标,其比值越大,说明产氢效率高[33],是一种较直观反映产氢效果的指标. 本次实验中各实验组厌氧发酵产生的丁酸以正丁酸为主,因此以正丁酸/乙酸的比值表征产氢效率.
图5(b)(c)表示RR-F、CR-F厌氧发酵过程中正丁酸/乙酸比值的变化情况及与最大累积产氢量的关系. 由图可知,正丁酸/乙酸比值的变化情况与累积产氢量的变化基本一致. 这与Fang等[32]的研究结果一致. Alibardi等[18]的研究结果表明,富含碳水化合物的底物产氢时正丁酸/乙酸的比值较高且产氢效果较好. 在产氢前,各实验组的正丁酸/乙酸比值大小差不多(RR-F1:0.19、RR-F2:0.19、CR-F1:0.20、CR-F2:0.18);产氢后,随着H2产生,比值开始逐渐变大(RR-F1:0.46、RR-F2:0.67、CR-F1:0.81、CR-F2:1.77),产氢效率越好,比值增加得越快. 随产氢速率的变小,比值的增加速率变小;随产氢结束,最后逐渐趋于稳定. 可见此次实验正丁酸/乙酸的比值能很好的指示RR-F、CR-F的产氢效能.
-
图5(d)表示RR-F、CR-F厌氧发酵产氢过程中底物pH的变化情况. 由2.3.2和2.3.3分析可知,氨氮浓度有少量减少,但TVFA浓度快速增大,因此导致pH降低. 产氢后,pH的下降速率逐渐变慢. TVFA浓度在开始产氢后增加速率增大,同时可溶蛋白在产氢后有少量增加,可溶蛋白的增加可以提高系统的缓冲性,减缓pH降低,因此pH的下降速率逐渐变慢. 最终随着TVFA浓度和可溶蛋白浓度的逐渐稳定,pH值逐渐稳定.
每种微生物都可以在不同的条件下有效地发挥作用. 在最佳pH范围内,维持微生物细胞膜上的表面电荷,促进营养物质在细胞和周围流体之间的运输. 通常,在H2的生产中,微生物在pH为5—8下活性最强,可以有效发挥作用[11]. 为了限制耗氢菌,特别是pH在6.3至7.8的窄范围内具有活性的产甲烷菌等耗氢细菌[34],pH的控制非常重要. 一般来说,产氢细菌的适宜pH值在5.0—6.0的范围内[34]. Fang等2]的研究发现在37 ℃时,用蒸煮后的米饭制成的米浆发酵制氢,pH为4.5时,有最大累积产氢量. 本研究在20h左右,各实验组的pH下降至5.32—4.99,并且累积产氢量开始增加;随着反应继续,pH继续下降,当pH达到4.83—4.50分别达到最大累积产氢量,其中CR-F2的累积产氢量最大,产氢速率最大时pH为4.63—4.50直至产氢结束. 由此说明,以大米为基质的发酵产氢实验中,pH为4.5—5.0为最佳产氢范围. Kovalev等[35]利用富含碳水化合物的废水进行厌氧发酵制氢,在反应器长期运行过程中也发现系统器pH低于4.5时可保持稳定运行且没有观察到产氢抑制现象. 较低的适宜产氢pH范围,可能是VFAs的产生过多导致,使产氢菌适宜此pH范围. 同时观察到,S/I越高,pH越低. 基质增多导致有机酸在产氢阶段积累,进一步系统pH值降低[36]. 总体上,对于丁酸型发酵而言,RR-F、CR-F厌氧发酵产氢过程中的pH值偏低,可以适当添加碱剂或联合其他含氮量高的物质提高体系的pH值和缓冲能力,进而提高产氢效率.
-
利用Pearson相关系数构建相关性热图(图6),以揭示不同理化指标(可溶糖降解量、可溶蛋白降解量、氨氮浓度变化量、pH、正丁酸/乙酸和总VFAs及各VFAs浓度)与最大累积产氢量的关系. 相关性分析表明,最大累积产氢量与可溶糖降解量呈极显著正相关(P<0.01),与乙酸浓度呈显著负相关(P<0.05);可溶糖降解量与乙酸浓度呈显著负相关(P<0.05),与丙酸浓度呈显著正相关(P<0.05). 正丁酸/乙酸与丙酸浓度呈极显著正相关(P<0.05),与正丁酸浓度呈极显著正相关(P<0.01). 乙酸和丁酸是在产氢过程中形成的,对于丁酸型发酵,总VFAs浓度与正丁酸浓度呈显著正相关(P<0.05). 发酵产氢主要来自糖的降解[6],而CR-F中可溶糖含量较高,其消耗途径则是进一步被降解为短链脂肪酸,如乙酸等[37]. 这正是累积产氢量与可溶糖降解量呈正相关,与乙酸浓度呈负相关的原因. 以丁酸型发酵产氢的反应末端产物会有少量丙酸. 因此,丙酸浓度与可溶糖降解量呈显著正相关. 以上结果及前文分析表明,累积产氢量受可溶糖降解量、乙酸浓度影响很大. CR-F组的可溶糖降解量与正丁酸/乙酸较大,乙酸浓度较小,并与RR-F组形成明显差异,这正是导致CR-F组的累积产氢量大于RR-F组的主要原因.
-
(1)RR-F、CR-F的产氢效能均随S/I比例的增大而增大,1:1是最佳S/I比,最大累积产氢量分别达 59.62
$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS和 166.97$ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $ VS,CR-F的产氢效能较好.(2)经湿热蒸煮后,淀粉间的相互作用减弱,CR中可溶糖会大量析出. 产氢前,可溶糖、可溶蛋白浓度和pH快速降低,TVFA浓度快速增加. 随着产氢的结束,各项指标均逐渐趋于稳定. 发酵过程中,部分氨氮作为氮源被微生物利用. RR-F、CR-F产氢过程中的pH值偏低,当S/I过大时会出现抑制的现象.
(3)RR-F、CR-F发酵产氢过程的副产物VFAs以乙酸和正丁酸为主,属于丁酸型发酵. 产氢过程中,乙酸浓度快速增加,正丁酸浓度和比例逐渐增加. 随正丁酸比例逐渐趋于稳定,产氢速率逐渐变小,产氢逐渐结束. 整个发酵过程中,丙酸、异丁酸和异戊酸的浓度最终有不同程度的减少. 正丁酸/乙酸比值可以衡量产氢效能的大小.
(4)Pearson相关性分析表明,最大累积产氢量与可溶糖降解量呈极显著正相关(P<0.01),与乙酸浓度呈显著负相关(P<0.05). 经过蒸煮后CR的可溶糖析出较多,发酵导致正丁酸/乙酸较大,乙酸浓度较小,并与RR-F组形成明显差异,进一步导致CR-F组的累积产氢量大于RR-F组.
餐厨垃圾淀粉类代表组分生熟大米中温厌氧发酵产氢性能
Mesophilic anaerobic fermentative hydrogen production from raw and cooked rice represented starch components of food waste
-
摘要: 餐厨垃圾中淀粉类组分的性质是影响产氢效率的重要因素. 为探究淀粉类代表组分——大米在生、熟性状下(RR、CR)的产氢效能,本文通过中温批式小瓶试验,研究不同接种比条件下生、熟大米的厌氧发酵混合体系(RR-F、CR-F)产氢及底物变化情况. 结果表明,无论RR-F或CR-F产氢效能均随基质与种泥比(S/I)比的增大而增大,最佳S/I比为1∶1;CR产氢效能更佳,RR-F和CR-F的最大累积产氢量分别为59.62 mL·g−1VS和166.97 mL·g−1VS. 发酵副产物以乙酸和正丁酸为主,属于丁酸型发酵;正丁酸/乙酸比值越大,累积产氢量越大. 发酵过程中,可溶糖、可溶蛋白浓度和pH快速降低,总挥发酸(TVFA)浓度快速增加并逐趋于稳定. Pearson相关性分析表明,累积产氢量主要受可溶糖降解量、乙酸浓度的影响. 蒸煮使CR的可溶糖析出更多,导致CR-F产氢效能明显高于RR-F.Abstract: The composition and chemical properties of starch in food waste are important factors affecting its hydrogen productivity during the anaerobic fermentation. In this study, the rice, as a representative component of starch in food waste, was used as substrate before and after being cooked (raw rice, RR vs. cooked rice, CR), and a series of mesophilic batch tests were carried out at different substrate/inoculation (S/I) ratios to investigate the effects of chemical properties of starch on hydrogen production potential. The results showed that the hydrogen production efficiency of both raw and cooked rice increased with S/I ratio, and the optimal S/I ratio was 1:1. Under the optimal condition, the cooked rice gained the highest cumulative hydrogen yield of 166.97 mL·g−1 VS whereas it was only 59.62 mL·g−1 VS for raw rice. The main fermentation by-products were determined to be acetic acid and n-butyric acid, indicating the occurrence of butyric acid-type fermentation; moreover, the higher n-butyrate/acetate ratios, the better hydrogen productivity was observed. Additionally, soluble sugar, soluble protein, and pH level showed a rapid drop tendency during the whole process, while TVFA were accumulated rapidly and became stabilized gradually at the end of operation. Pearson correlation analysis further showed that the cumulative hydrogen yield was mainly governed by the degradation of soluble sugar and the production of acetic acid. It could be concluded that significantly higher hydrogen production from CR than RR was due to the liberation of more soluble sugar in virtue of cooking or steaming process.
-
Key words:
- food waste /
- rice /
- raw and cooked components /
- anaerobic fermentation /
- H2 production /
- carbohydrates /
- mesophilic
-

-
图 5 厌氧发酵产氢过程中(a)RR-F1、RR-F2、CR-F1、CR-F2中的VFAs变化,(b)正丁酸/乙酸比值的变化,(c)最大累积产氢量和正丁酸/乙酸比值的关系,以及(d)pH 的变化
Figure 5. Variation of VFAs (a) RR-F1, RR-F2, CR-F1, and CR-F2 and n-butyric acid/acetic acid ratio (b) in different operational conditions, (f) the relationship between maximum cumulative hydrogen yield and n-butyric acid/acetic acid ratio, and (g) variation of pH during anaerobic fermentation
表 1 大米厌氧发酵产氢的修正Gompertz模型的动力学常数
Table 1. Estimated parameters of modified Gompertz equation for RR-F and CR-F
实验组
Reactor最大累积产氢量/ $ (\mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $
Maximum cumulative hydrogen volume最大产氢速率/( $ \mathrm{m}\mathrm{L}\cdot {\mathrm{g}}^{-1} $
Maximum Hydrogen yield产氢延迟时间/(h)
Hydrogen production delay拟合系数(R2)
Fit coefficientRR-F1 46.540 2.470 33.540 0.979 RR-F2 59.615 2.210 24.690 0.968 CR-F1 116.610 6.890 20.840 0.985 CR-F2 166.970 3.590 24.774 0.997 -
[1] LIPINSKI B. Why Does Animal-Based Food Loss and Waste Matter?[J]. Animal Frontiers, 2020, 10(4): 48-52 doi: 10.1093/af/vfaa039 [2] JIN C X, SUN S Q, YANG D H, et al. Anaerobic digestion: An alternative resource treatment option for food waste in China[J]. The Science of the Total Environment, 2021, 779: 146397. doi: 10.1016/j.scitotenv.2021.146397 [3] XU Z F, ZHOU Y R, YIN K X, et al. Exergy, techno-economic and environment analysis of food waste plasma gasification and syngas chemical looping processes[J]. Journal of Cleaner Production, 2023, 386: 135835. doi: 10.1016/j.jclepro.2022.135835 [4] NAM J Y. Optimum conditions for enhanced biohydrogen production from a mixture of food waste and sewage sludge with alkali pretreatment[J]. Energies, 2023, 16(7): 3281-3294. doi: 10.3390/en16073281 [5] CHENG D L, NGO H H, GUO W S, et al. Advanced strategies for enhancing dark fermentative biohydrogen production from biowaste towards sustainable environment[J]. Bioresource Technology, 2022, 351: 127045. doi: 10.1016/j.biortech.2022.127045 [6] DONG L, ZHENHONG Y, YONGMING S, et al. Hydrogen production characteristics of the organic fraction of municipal solid wastes by anaerobic mixed culture fermentation[J]. International Journal of Hydrogen Energy, 2009, 34(2): 812-820. doi: 10.1016/j.ijhydene.2008.11.031 [7] XIE B F, CHENG J, ZHOU J H, et al. Production of hydrogen and methane from potatoes by two-phase anaerobic fermentation[J]. Bioresource Technology, 2008, 99(13): 5942-5946. doi: 10.1016/j.biortech.2007.10.048 [8] KOBAYASHI T, XU K Q, LI Y Y, et al. Evaluation of hydrogen and methane production from municipal solid wastes with different compositions of fat, protein, cellulosic materials and the other carbohydrates[J]. International Journal of Hydrogen Energy, 2012, 37(20): 15711-15718. doi: 10.1016/j.ijhydene.2012.05.044 [9] GÓMEZ X, MORÁN A, CUETOS M J, et al. The production of hydrogen by dark fermentation of municipal solid wastes and slaughterhouse waste: A two-phase process[J]. Journal of Power Sources, 2006, 157(2): 727-732. doi: 10.1016/j.jpowsour.2006.01.006 [10] OKAMOTO M, MIYAHARA T, MIZUNO O, et al. Biological hydrogen potential of materials characteristic of the organic fraction of municipal solid wastes[J]. Water Science and Technology: a Journal of the International Association on Water Pollution Research, 2000, 41(3): 25-32. doi: 10.2166/wst.2000.0052 [11] JARUNGLUMLERT T, PROMMUAK C, PUTMAI N, et al. Scaling-up bio-hydrogen production from food waste: Feasibilities and challenges[J]. International Journal of Hydrogen Energy, 2018, 43(2): 634-648. doi: 10.1016/j.ijhydene.2017.10.013 [12] CHEN W, CHEN S, KUMARKHANAL S, et al. Kinetic study of biological hydrogen production by anaerobic fermentation[J]. International Journal of Hydrogen Energy, 2006, 31(15): 2170-2178. doi: 10.1016/j.ijhydene.2006.02.020 [13] STILES M E, HOLZAPFEL W H. Lactic acid bacteria of foods and their current taxonomy[J]. International Journal of Food Microbiology, 1997, 36(1): 1-29. doi: 10.1016/S0168-1605(96)01233-0 [14] GUO X, TRABLY E, LATRILLE E, et al. Predictive and explicative models of fermentative hydrogen production from solid organic waste: Role of butyrate and lactate pathways[J]. International Journal of Hydrogen Energy, 2014, 39(14): 7476-7485. doi: 10.1016/j.ijhydene.2013.08.079 [15] CHOI J, AHN Y. Characteristics of biohydrogen fermentation from various substrates[J]. International Journal of Hydrogen Energy, 2014, 39(7): 3152-3159. doi: 10.1016/j.ijhydene.2013.12.050 [16] YADAV S, SINGH D, MOHANTY P, et al. Biochemical and thermochemical routes of H2 production from food waste: A Comparative review[J]. Chemical Engineering & Technology, 2023, 46(2): 191-203. [17] SHANMUGAM S, MATHIMANI T, RAJENDRAN K, et al. Perspective on the strategies and challenges in hydrogen production from food and food processing wastes[J]. Fuel, 2023, 338: 127376. doi: 10.1016/j.fuel.2022.127376 [18] ALIBARDI L, COSSU R. Effects of carbohydrate, protein and lipid content of organic waste on hydrogen production and fermentation products[J]. Waste Management, 2016, 47(Pt A): 69-77. [19] 한선기. Energy production from organic waste by anaerobic treatment (Ⅰ) : Hydrogen production from food waste[J]. Jornal of Korea Organic Resource Recycling Association, 2011, 19(1): 102-108. [20] 袁玉玉. 餐厨垃圾厌氧发酵制氢添加剂作用研究[D]. 上海: 同济大学, 2007. YUAN Y Y. Additives enhancement of bio-hydrogen production from food wastes[D]. Shanghai: Tongji University, 2007 (in Chinese).
[21] REDDY M V, CHANDRASEKHAR K, MOHAN S V. Influence of carbohydrates and proteins concentration on fermentative hydrogen production using canteen based waste under acidophilic microenvironment[J]. Journal of Biotechnology, 2011, 155(4): 387-395. doi: 10.1016/j.jbiotec.2011.07.030 [22] FAVARO L, ALIBARDI L, LAVAGNOLO M C, et al. Effects of inoculum and indigenous microflora on hydrogen production from the organic fraction of municipal solid waste[J]. International Journal of Hydrogen Energy, 2013, 38(27): 11774-11779. doi: 10.1016/j.ijhydene.2013.06.137 [23] 曹麒, 何雨恒, 卓桂华, 等. 高温条件下初始pH值对污泥-餐厨垃圾联合厌氧发酵产氢余物产CH4的影响[J]. 环境工程, 2022, 40(9): 150-157. CAO Q, HE Y H, ZHUO G H, et al. Effect of initial ph value on methane production from residue after anaerobic co-fermentative hydrogen production of sewage sludge and food waste under thermophilic operation[J]. Environmental Engineering, 2022, 40(9): 150-157 (in Chinese).
[24] 王永萍, 方皓珏, 华若婷, 等. 多因素共同作用对中温条件下污泥与餐厨垃圾联合厌氧发酵产H2的影响[J]. 环境工程, 2023, 41(3): 103-110. WANG Y P, FANG H J, HUA R T, et al. Comprehensive influence of multiple factors on hydrogen production from combined anaerobic fermentation of sludge and kitchen waste under medium temperature condition[J]. Environmental Engineering, 2023, 41(3): 103-110 (in Chinese).
[25] KANCHANASUTA S, SILLAPARASSAMEE O. Enhancement of hydrogen and methane production from co-digestion of palm oil decanter cake and crude glycerol using two stage thermophilic and mesophilic fermentation[J]. International Journal of Hydrogen Energy, 2017, 42(5): 3440-3446. doi: 10.1016/j.ijhydene.2017.01.032 [26] 刘文宗. 乙酸盐为底物电化学辅助生物产氢初步研究[D]. 哈尔滨: 哈尔滨工业大学, 2007. LIU W Z. Primary research on bio-hydrogen production by eletrochemically assisted microbial process from acetate[D]. Harbin: Harbin Institute of Technology, 2007 (in Chinese).
[27] TIEN N N T, PHI N T L, THU N N A, et al. Cooking quality, textural characteristics and sensory evaluation of heat-moisture treated unpolished red rice under different cooking conditions[J]. International Journal of Food Science & Technology, 2024: ijfs. 16913. [28] THUENGTUNG S, MATSUSHITA Y, OGAWA Y. Comparison between microwave-cooking and steam-cooking on starch properties and in vitro starch digestibility of cooked pigmented rice[J]. Journal of Food Process Engineering, 2019, 42(6): jfpe. 13150. [29] YIN X T, CHEN X Y, HU J L, et al. Effects of distribution, structure and interactions of starch, protein and cell walls on textural formation of cooked rice: A review[J]. International Journal of Biological Macromolecules, 2023, 253(Pt 6): 127403. [30] OZMIHCI S. Performance of batch solid state fermentation for hydrogen production using ground wheat residue[J]. International Journal of Hydrogen Energy, 2017, 42(37): 23494-23499. doi: 10.1016/j.ijhydene.2017.03.225 [31] PAGLIACCIA P, GALLIPOLI A, GIANICO A, et al. Variability of food waste chemical composition: Impact of thermal pre-treatment on lignocellulosic matrix and anaerobic biodegradability[J]. Journal of Environmental Management, 2019, 236: 100-107. doi: 10.1016/j.jenvman.2019.01.084 [32] FANG H, LI C, ZHANG T. Acidophilic biohydrogen production from rice slurry[J]. International Journal of Hydrogen Energy, 2006, 31(6): 683-692. doi: 10.1016/j.ijhydene.2005.07.005 [33] 袁雨珍, 肖利平, 刘传平, 等. pH对餐厨垃圾厌氧发酵产氢过程的影响[J]. 生态环境学报, 2017, 26(4): 687-692. YUAN Y Z, XIAO L P, LIU C P, et al. Effect of pH on hydrogen production during anaerobic fermentation of kitchen waste[J]. Ecology and Environmental Sciences, 2017, 26(4): 687-692 (in Chinese).
[34] LI B, DONG Z Y, YUE Y, et al. Hydrogen and methane production in a two-stage thermophilic anaerobic digestion system by co-digestion of kitchen waste and municipal sewage sludge with a high solid content[J]. Environmental Engineering Science, 2023, 40(6): 253-261. doi: 10.1089/ees.2022.0344 [35] KOVALEV A A, KOVALEV D A, LITTI Y V, et al. Biohydrogen production in the two-stage process of anaerobic bioconversion of organic matter of liquid organic waste with recirculation of digister effluent[J]. International Journal of Hydrogen Energy, 2020, 45(51): 26831-26839. doi: 10.1016/j.ijhydene.2020.07.124 [36] WANG Y, WEI W, DAI X H, et al. Corncob ash boosts fermentative hydrogen production from waste activated sludge[J]. The Science of the Total Environment, 2022, 807(Pt 3): 151064. [37] MONLAU F, SAMBUSITI C, BARAKAT A, et al. Do furanic and phenolic compounds of lignocellulosic and algae biomass hydrolyzate inhibit anaerobic mixed cultures?A comprehensive review[J]. Biotechnology Advances, 2014, 32(5): 934-951. doi: 10.1016/j.biotechadv.2014.04.007 -




 下载:
下载: