-
双酚A(BPA)是一种应用非常广泛的化学品,主要用于婴儿奶瓶、食品包装等塑料产品的生产. 伴随着这些产品的使用,BPA不断溶出释放到环境中,通过呼吸、饮食摄入和皮肤接触等途径进入人体[1]. 研究表明BPA已经广泛存在于人类血清、尿液、胎盘组织和母乳中[2 − 4]. 例如,一项来自韩国普通人群研究显示成年人尿液中BPA浓度为9.54 μg·L−1(42 nmol·L−1)[5]. 一项来自非洲普通人群BPA的研究结果显示,非洲人群尿液中BPA含量约为208.55 ng·mL−1(917 nmol·L−1)[6]. 针对中国上海地区学生的调查研究显示人体尿液中BPA浓度为79.52 ng·mL−1(350 nmol·L−1)[7]. 此外,研究证实职业工人血液中BPA浓度较普通人群高,平均为397.72 μg·L−1(
1742 nmol·L−1),最高达732.44 μg·L−1(3208 nmol·L−1)[8].先前有大量的研究证实BPA对人体健康具有潜在的危害作用[2]. 例如,研究证实BPA具有内分泌干扰效应,可以影响机体生殖功能[9]. 另外,研究发现婴幼儿时期接触BPA可能会对其生长发育存在影响[10]. 考虑到BPA的潜在危害性,多个国家和地区都出台相应的政策限制BPA的使用. 这使得一些化学结构类似的其他双酚类化合物(BPs)作为BPA的替代品被大量地生产和使用,其环境和人体浓度水平快速上升,成为一类新型的环境污染物[11]. 双酚AF(BPAF)是其中一种重要的BPA替代品,被用于氟橡胶、电子、光纤等领域[12 − 14]. 目前,BPAF也已经在人体内被检测到. 例如,一项来自中国普通人群的调查研究显示BPAF人体尿液浓度为0.173 μg·L−1(0.5 nmol·L−1)[15]. 在中国杭州地区对孕妇母乳的研究结果显示BPAF浓度为0.58 μg·L−1(1.7 nmol·L−1)[16].
近年来,BPs暴露与机体糖代谢紊乱的关联性已被证实. 例如,Lang等通过对美国普通人群的分析发现BPA与糖尿病存在正相关性[17]. 另外一些基于NHANES的研究数据和多项Meta分析研究也证明BPA水平与患二型糖尿病(T2DM)风险之间存在正相关关系[18 − 21]. Duan等分析了251名2型糖尿病患者和251名对照者尿液中BPs浓度,发现BPA和BPAF浓度与T2DM显著正相关[22]. 此外,多篇动物实验研究也证明BPs暴露可以导致糖代谢紊乱. 例如Angle等发现5 μg·kg−1·d−1的BPA暴露可以导致子代小鼠糖耐受能力下降[23]. Magdalena等发现10 μg·kg−1·d−1的BPA暴露4 d就会导致小鼠出现胰岛素抵抗[24]. Gyimah等采用斑马鱼实验发现1 μmol·L−1的BPA可以影响其血糖和胰岛素水平[25].
虽然研究证实BPs可以导致机体糖代谢紊乱,但其毒性机制目前尚不明确. 胰腺中的胰岛β细胞是机体合成和分泌胰岛素的唯一细胞,其功能异常可导致机体胰岛素水平异常进而引发糖代谢紊乱[26]. 因此,影响胰岛β细胞的胰岛素分泌功能可能是BPs导致糖代谢紊乱的作用机制之一. 目前已经有多篇动物实验证实了该作用机制. 例如,Alonso-Magdalena等对小鼠采用10 μg·kg−1·d−1的BPA暴露,发现其血清胰岛素水平显著上升[24, 27]. Fang等也同样发现低剂量BPA(100 μg·kg−1·d−1)暴露可显著提高小鼠血清中的胰岛素水平[28]. 另外,Soriano等采用分离出的小鼠和人类胰岛进行实验,发现采用BPA处理胰岛1 h就可以刺激其分泌胰岛素[29]. Song等[30]和Adachi等[31]也利用分离的小鼠胰岛进行实验,同样发现低浓度的BPA可以快速地刺激其分泌胰岛素.
前期有研究表明BPs具有类雌激素效应,BPs可能会通过与雌激素受体作用产生毒性效应[32]. 目前,有研究表明雌激素受体信号通路在BPA影响胰岛β细胞功能时发挥介导作用[33]. 例如,Nadal等发现BPA暴露可以导致胰岛β细胞内钙离子浓度上升,提示可能是由于BPA激活了雌激素膜受体信号通路[34]. BPAF是BPA的结构类似物,是否具有与BPA类似的毒性效应尚不清楚. 因此,本研究通过研究BPs与E2对胰岛β细胞的影响,有助于探讨BPAF的毒性效应. 此外,通过转录组学法有助于揭示导致机体糖尿病的环境成因,也可以为污染物导致糖代谢干扰效应提供毒理机制解释.
为了探究BPs导致糖代谢紊乱的毒理机制,本工作选取BPA和BPAF开展研究,以小鼠胰岛素瘤β-TC-6作为模型细胞,基于转录组学方法分析了BPs对该细胞基因表达的影响,通过与雌二醇(E2)进行对比分析,探讨了BPs对β细胞的潜在影响和可能的分子毒理机制. 本文首先采用CCK8实验测定了不同浓度BPA和BPAF对β-TC-6细胞活性的影响. 进一步选取了人体相关浓度水平(1 µmol·L−1)的BPA和BPAF,通过转录组学的方法分析BPA和BPAF暴露对胰岛β细胞基因表达的影响. 为了探究BPA和BPAF是否通过其类雌激素效应产生影响,选取雌激素E2作为对照进行了对比研究.
-
本研究使用的BPA购自罗恩试剂(CAS:80-05-7;纯度≥99%,中国),BPAF购自Sigma-Aldrich公司(CAS:
1478 -61-1;纯度≥97%,美国),雌二醇E2购自Sigma-Aldrich公司(CAS:50-28-2;美国). 所有的化学药品溶解在二甲基亚砜(DMSO)中,储存于-20 ℃. 活性检测Cell-Counting Kit-8(CCK-8)试剂盒购自Proteintech公司(美国). TRIzol试剂购自Thermo Fisher Scientific公司(美国). -
β-TC-6细胞购自武汉普诺赛生命科技有限公司(中国). 培养细胞的完全培养基为高糖Dulbecco’s modified Eagle’s培养基(DMEM,英潍捷基贸易有限公司,美国),添加15%(V/V)灭活胎牛血清(FBS,Gibco,美国),100 U·mL−1青霉素和100 μg·mL−1链霉素(Gibco,美国). 无血清培养基不含FBS,其余成分不变. 细胞在含5% CO2,温度为37 ℃条件下的培养箱中培养.
-
为了排除FBS中激素的影响,在无血清培养基条件下开展了BPA和BPAF对β-TC-6细胞活性影响的研究. 将β-TC-6细胞在完全培养基中以每孔3×104个的密度接种于96孔板中,培养48 h后去除培养基,每孔加入100 μL BPA或BPAF暴露溶液(暴露溶液采用无血清培养基配制). 药物暴露48 h后,每孔加入10 μL CCK8试剂继续孵育1.5 h,孵育结束后采用多功能酶标仪(Molecular Devices,美国)检测对照组及不同浓度药物暴露组在450 nm及630 nm处的吸光度值,其中630 nm处的吸光度值用于背景扣除. 所有实验组数据以对照组为基准进行归一化处理,计算细胞的相对活性值. 在本次细胞活性检测实验中,不同浓度药物暴露组使用3个重复孔.
-
为了排除FBS中激素的影响,在无血清培养基条件下进行了BPA和BPAF对β-TC-6细胞的暴露用于转录组学分析. 将β-TC-6细胞在完全培养基中以每皿5×106个的密度接种于10 cm培养皿中. 贴壁培养48 h后去除培养基,分别加入BPA、BPAF和E2暴露溶液(暴露溶液采用无血清培养基配制). 本实验一共15例样本,分为5组不同药物暴露组样本,每组3份生物学重复样本. 暴露48 h后,去除培养基,使用磷酸盐缓冲液润洗细胞3次,按照每5×106个细胞加入1 mL的比例加入TRIzol试剂裂解细胞提取总RNA. 使用Illumina对样品总RNA进行高通量测序. 使用Trimmomatic软件对测序结果进行数据分析. 使用T. test函数检验P value值(样本间差异显著性),并计算组间差异倍数(Fold change, FC). 以P < 0.05、|log2(FC)|>1作为差异基因筛选标准. 通过GO数据库分析实验样本的差异基因在细胞功能上的影响,使用KEGG数据库对差异基因进行通路富集分析.
-
在细胞活性检测中,采用Microsoft Excel和GraphPad Prism软件对实验结果进行分析. 数据以均数±标准差(n=3)表示. 组间统计学差异采用单因素方差分析(One-way ANOVA)检验进行统计学分析,两组以上统计学差异比较采用双因素方差分析(Two-way ANOVA). 以P< 0.05为差异有统计学意义.
-
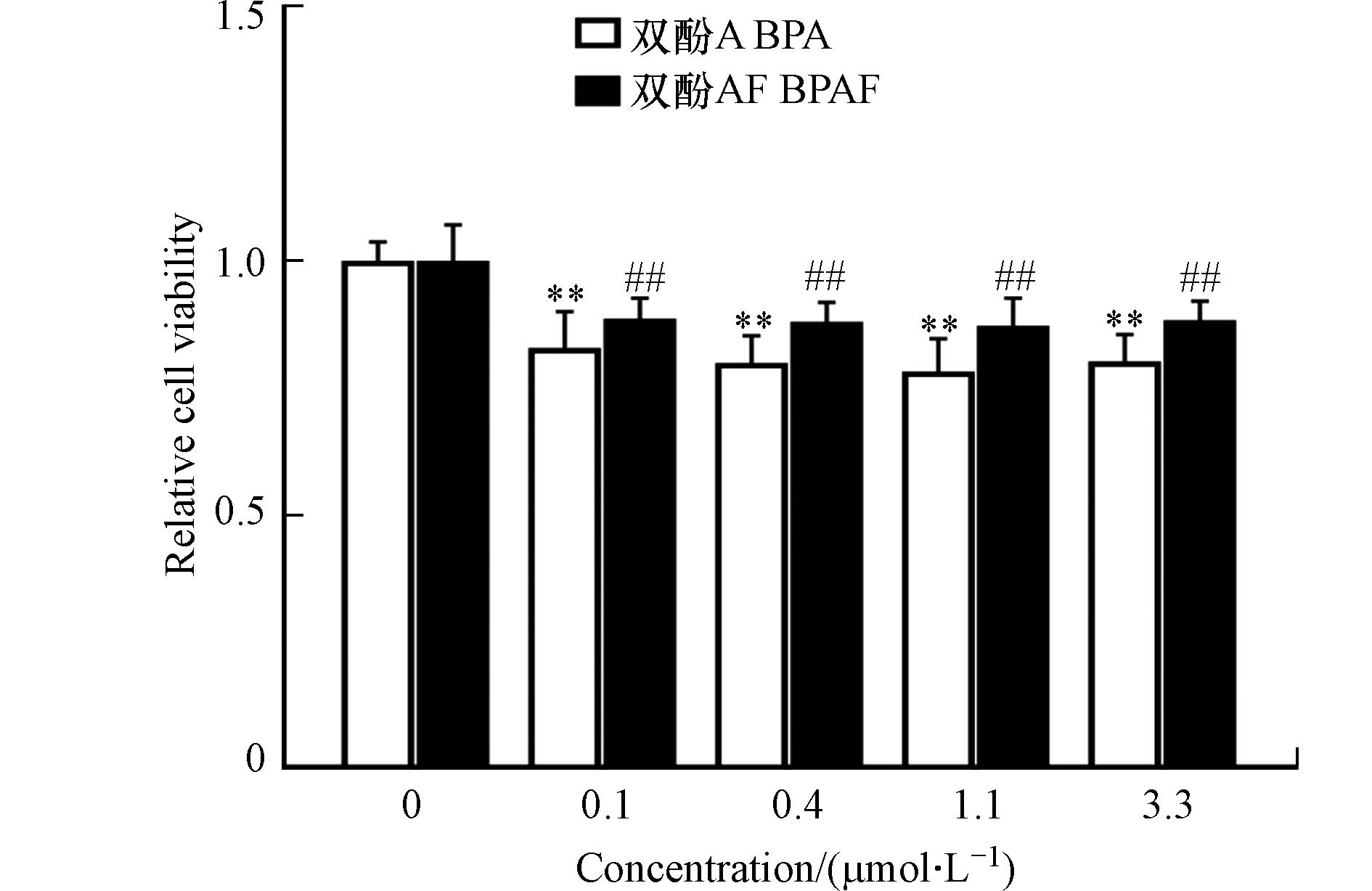
在开展转录组学研究前,首先利用CCK8法测定了BPA和BPAF对β-TC-6细胞活性的影响. 前期人体暴露研究显示BPA在人体内的浓度范围在nmol·L−1—µmol·L−1之间. 因此首先考察了多个人体相关浓度(0.1—3.3 µmol·L−1)BPA和BPAF对β-TC-6细胞活性的影响. 如图1所示,0.1—3.3 µmol·L−1 BPA和BPAF暴露都导致细胞活性下降了10%左右,但没有出现随剂量增加毒性效应变强的趋势.
前期有研究人员考察了在人体相关浓度下BPA对小鼠胰岛β细胞的毒性作用,发现1 μmol·L−1 BPA会导致小鼠胰岛细胞线粒体功能障碍和活性氧产生最终导致β细胞凋亡,使得细胞相对活率降低[35]. Nadal等也发现,BPA会通过导致β细胞凋亡降低细胞活率[32]. 基于前人的研究结果,推测BPA和BPAF可能是通过导致β-TC-6细胞凋亡进而降低细胞活性.
-
为了研究BPA和BPAF对β-TC-6细胞的潜在影响,本研究选择了1 µmol·L−1 BPA或1 µmol·L−1 BPAF进行暴露,并采用转录组学探讨其对细胞基因表达的影响. 同时也考察了100 nmol·L−1E2对β细胞转录组的影响,通过比较BPA和BPAF与E2的相似之处,探讨BPA和BPAF是否可能是通过与E2相似的作用机制对β细胞产生影响.
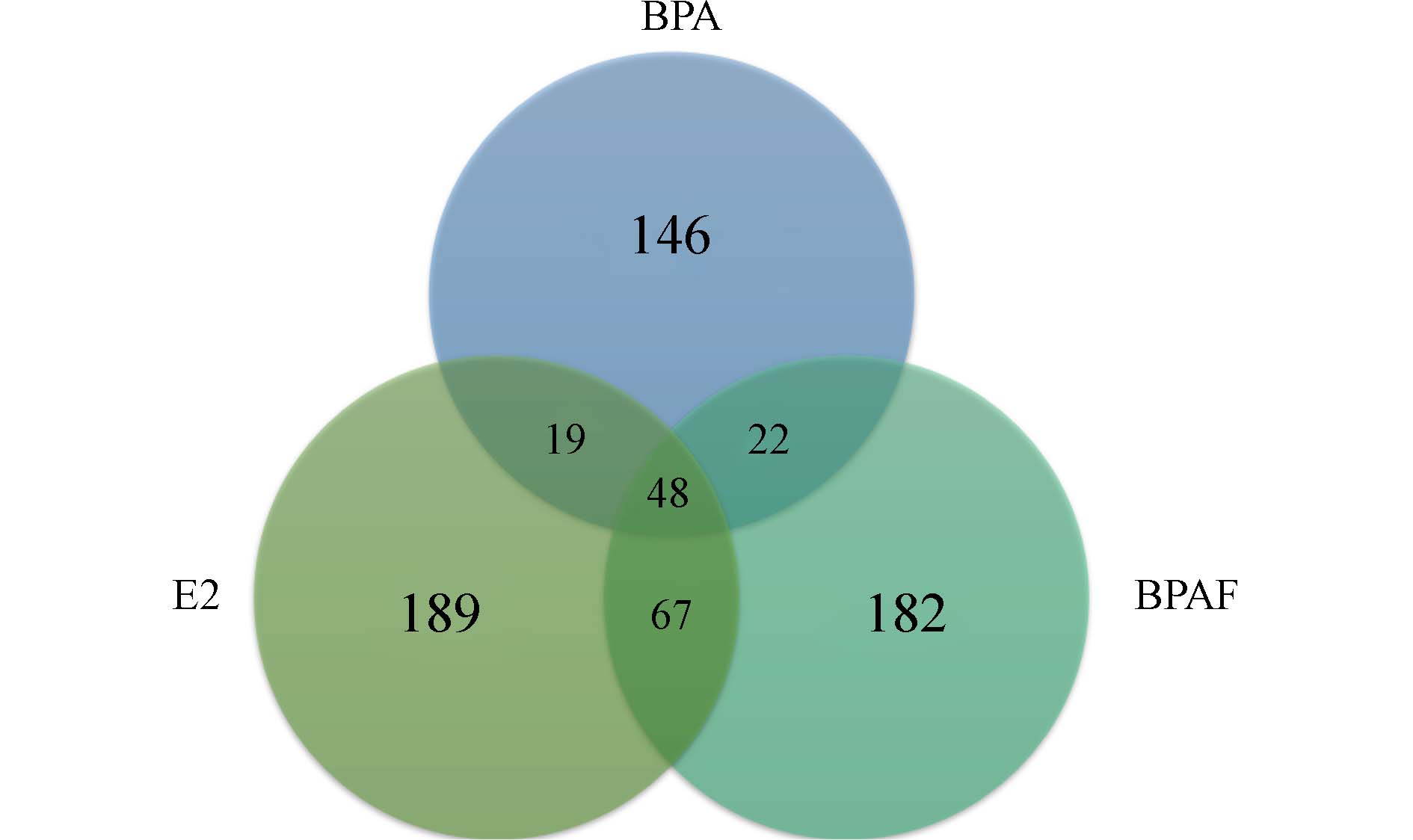
研究结果显示,BPA、BPAF和E2暴露组的差异表达基因数量分别为252、343和343个(表1). BPAF导致β细胞差异基因数量较BPA更多,说明BPAF对β细胞可能具有比BPA更大的影响. 由图2所示,通过对比不同暴露组差异基因的相似性,发现BPA、BPAF与E2组有很多相同的差异基因,且BPAF与E2组相同差异基因数量较BPA更多. 这表明BPAF较BPA具有与E2更高的相似度,这提示BPAF可能具有更强的类雌激素效应.
前期有研究证实BPAF具有比BPA更高的类雌激素效应. 例如,Kitamura等利用人乳腺癌MCF-7细胞检测了包括BPA和BPAF等几种BPs的雌激素活性,发现BPAF具有最高的雌激素活性[36]. Song等研究也得到类似的结果,BPAF在体内及体外研究中都显示出比BPA更强的雌激素受体激活效应[37]. BPAF更强的类雌激素效应可能与其CF3基团比BPA的CH3基团具有更高的疏水性有关[14]. 由于BPAF具有更强的类雌激素效应,可能会通过作用于雌激素受体对β细胞产生比BPA更大的影响.
-
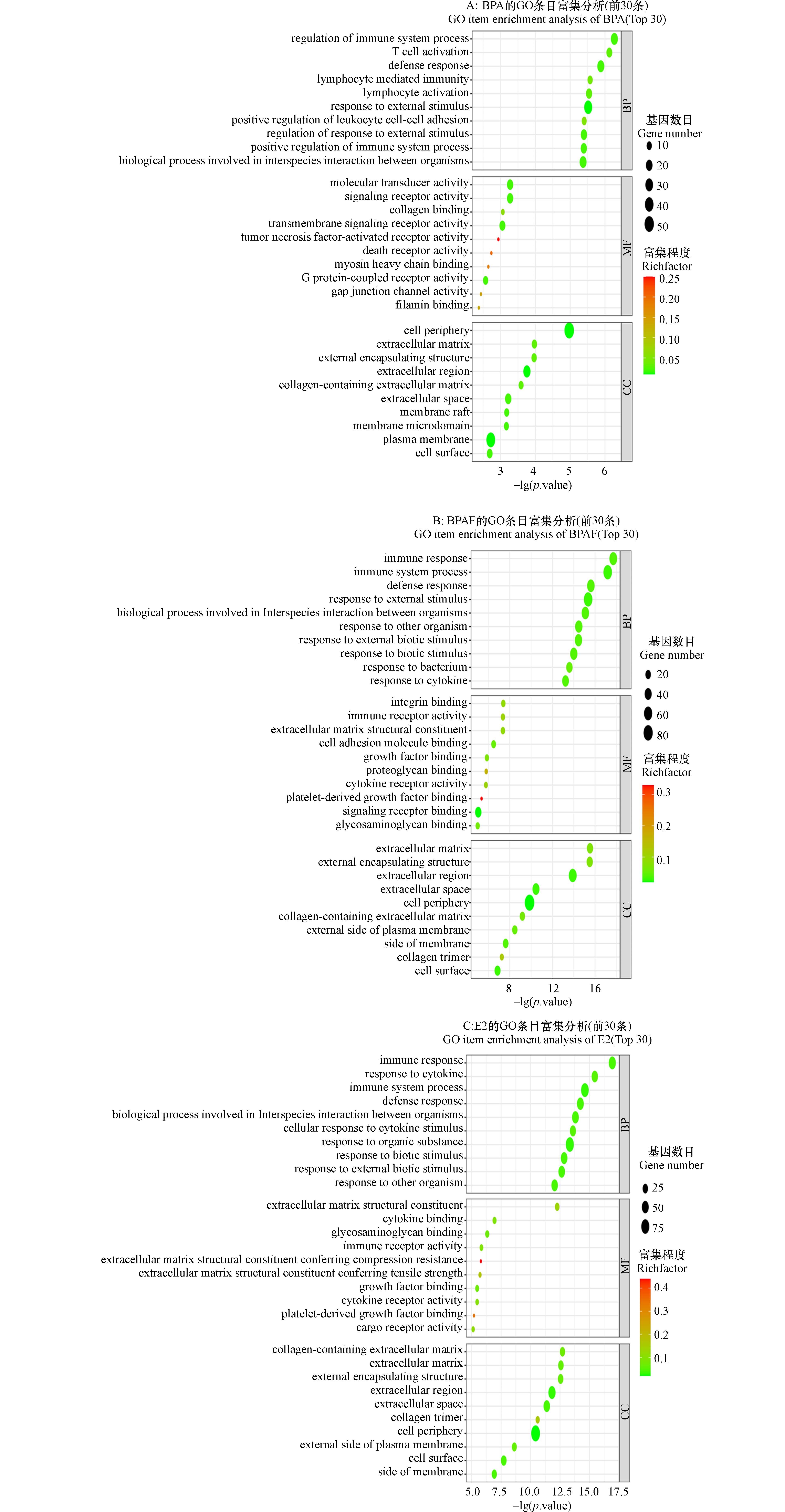
为了分析BPA和BPAF对β细胞生物学功能的潜在影响,对BPA、BPAF和E2暴露组的差异基因进行了GO功能注释和富集分析. 如图3所示,本实验筛选出了BPA(图3A)、BPAF(图3B)和E2(图3C)导致差异表达基因参与的最显著的前30个生物学功能. 图中BP代表生物过程,MF代表分子功能,CC代表细胞组分. 结果发现BPA暴露组主要影响了免疫系统过程、T细胞活化和防御反应等生物过程;分子传感器活性、信号受体活性等分子功能;细胞外围、细胞外基质和胞外区域等细胞组分. BPAF暴露组主要影响了免疫反应、免疫系统过程、防御反应和对外界刺激的反应等生物过程;整合素结合、免疫受体活性和细胞外基质结构成分等分子功能;细胞外基质、外部封装结构和细胞外区域等细胞组分. E2暴露组主要影响了免疫反应、对细胞因子的反应和免疫系统过程等生物过程;细胞外基质结构成分、细胞因子结合等分子功能;含胶原的细胞外基质、细胞外基质和外部封装结构等细胞组分.
-
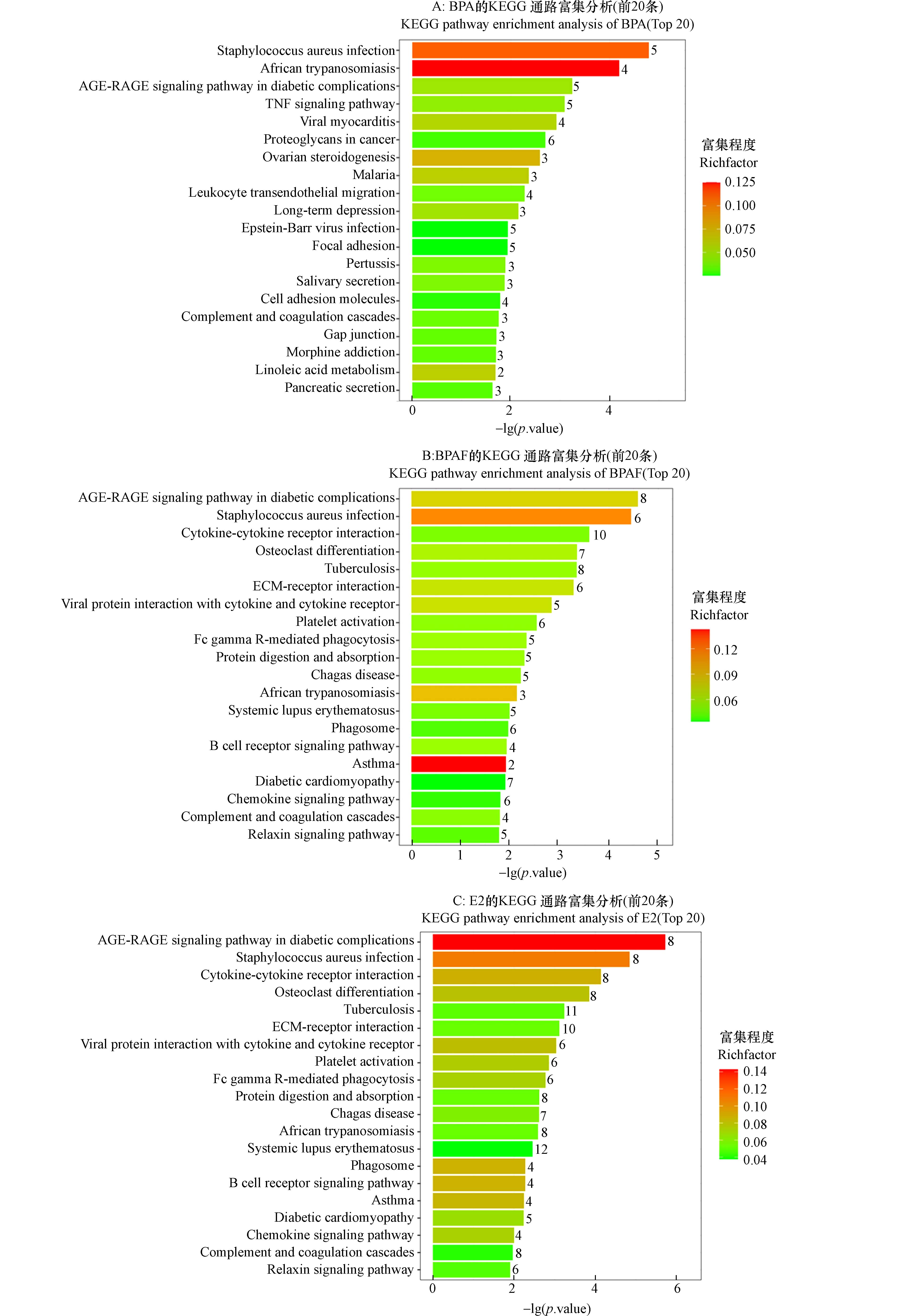
为了揭示BPA和BPAF影响β细胞的可能分子作用机制,本研究进一步对差异表达基因进行KEGG通路注释和富集分析,筛选出了BPA、BPAF和E2导致变化最显著的前20条信号通路. 如图4所示,BPA(图4A)影响的通路包括糖尿病并发症相关的高级糖基化终末产物-受体(AGE-RAGE)信号通路、TNF信号通路等.
BPAF(图4B)影响的通路主要包括糖尿病并发症相关的AGE-RAGE信号通路、B细胞受体信号通路、糖尿病性心肌病相关信号通路等. E2(图4C)影响的通路包括糖尿病并发症相关的AGE-RAGE信号通路、PI3K-Akt信号通路、I型糖尿病相关信号通路等. 值得注意的是,糖尿病并发症相关的AGE-RAGE信号通路在BPA、BPAF和E2暴露组都出现了富集.
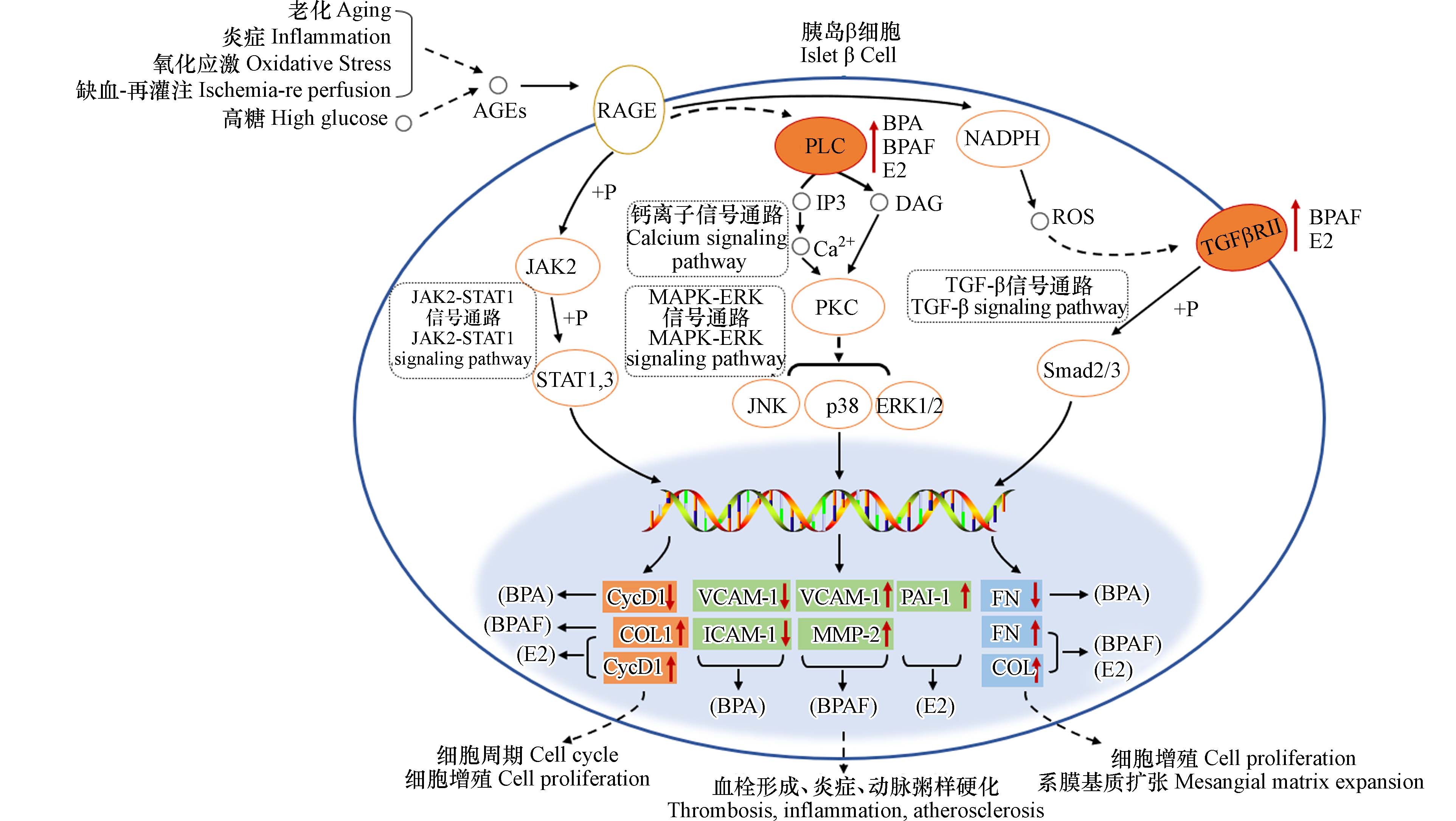
糖尿病并发症相关的AGE-RAGE信号通路是指由高血糖引起的蛋白质糖基化产物(AGEs)与其受体(RAGE)结合,进而引发一系列反应的信号传导通路[38 − 40]. AGE-RAGE信号通路在糖尿病并发症的发生和发展中发挥了重要作用[41 − 43]. 通过分析化合物对这条通路具体基因的影响(图5),发现BPA是通过影响Plce1、Vcam1、Icam1等基因表达对AGE-RAGE信号通路产生影响,BPAF则是通过影响Plce1、Tgfbr2、Col1a1、Vcam1、Mmp2等基因表达对此通路产生影响,E2通过影响Plce1、Tgfbr2、Col1a1、Fn1等基因表达对此通路产生影响.
糖尿病并发症相关的AGE-RAGE通路主要涉及4个下游转导信号通路,包括PI3K-AKT-钙离子,MAPK-ERK,NADPH-ROS和JAK2-STAT1信号通路. 本实验发现BPA、BPAF和E2均可以上调PI3K-AKT-钙离子通路中的Plce1基因. Plce1的高表达可促进磷脂酶C(PLC)激活,PLC激活后可以导致细胞生成IP3(1,4,5-三磷酸肌醇)和DAG(二酰基甘油),进一步激活下游钙离子信号通路,这可能是BPs影响β细胞功能的分子作用机制之一.
此外,本实验发现BPA、BPAF和E2会影响AGE-RAGE下游的MAPK-ERK信号通路的基因表达. BPA可以影响Vcam1、Icam1等基因表达对MAPK-ERK信号通路产生影响从而导致细胞功能紊乱. BPAF可能通过上调Vcam1、Mmp2等基因表达进而影响细胞炎症反应过程. E2则可能是影响了Serpine1基因表达对此通路产生影响进而影响凝血功能,这可能与糖尿病血管并发症有关.
BPA、BPAF和E2也影响了NADPH-ROS下游的TGF-β信号通路相关基因的表达. BPA影响了Fn1基因进而影响FN的表达对TGF-β信号通路产生影响. BPAF可能上调TGF-β通路中的Tgfbr2、Col1a1、Col3a1和Fn1等基因表达影响此通路. Tgfbr2的高表达可促进转化生长因子-β受体Ⅱ(TGFβR-Ⅱ受体)激活,该受体激活后可诱导一系列磷酸化级联反应,进一步激活下游信号转导子R-Smads(受体介导型Smads),影响细胞迁移与增殖过程. 有研究报道,转录因子Smad3激活会促进细胞凋亡,而β细胞数量的减少与β细胞功能障碍、葡萄糖的不良耐受及糖尿病密切相关[44]. E2通过影响Tgfbr2、Col1a1、Col3a1和Fn1等基因表达也对此通路产生影响.
此外,BPA、BPAF和E2对JAK2-STAT1信号通路中的基因表达也存在影响. BPA影响了Ccnd1基因表达进而影响JAK2-STAT1通路. BPAF影响Col1a1基因表达对此通路产生影响. E2影响了Ccnd1、Col1a1基因表达对此通路产生影响. 根据上述结果,推测BPA、BPAF和E2可能会通过影响AGE-RAGE通路中的基因表达,引起信号级联反应,从而影响细胞生物过程,进而导致糖尿病并发症发生.
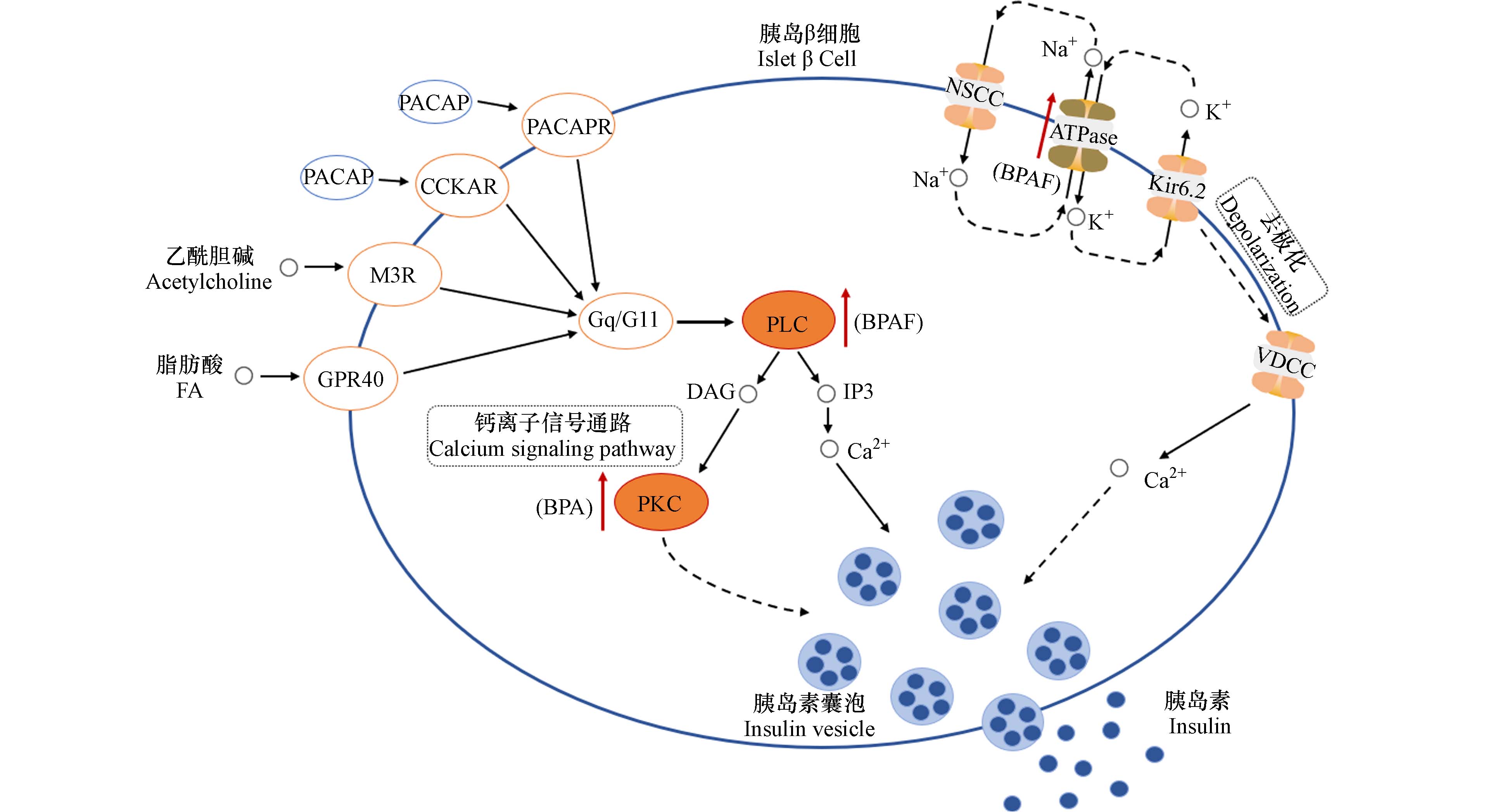
除了以上糖尿病并发症相关的AGE-RAGE通路外,胰岛素分泌通路是值得关注的另外一个重要通路. 虽然该通路不在前20条最显著变化通路中,但是实验发现BPA和BPAF对此通路也存在干扰作用(图6). 胰岛素分泌通路涉及钙离子信号通路和膜电位极化过程. 发现BPA可能会通过影响蛋白激酶C(PKC)的基因表达影响钙离子信号通路,进而影响胰岛素分泌. 有研究表明,PKC被激活后会导致膜去极化增加动作电位放电,进而刺激胰岛素分泌[45]. 而BPAF可能会通过影响Plce1基因的表达促进磷脂酶C(PLC)激活,导致细胞生成IP3和DAG,进一步激活钙离子通路,这可能导致胞内钙离子浓度升高进而间接调控胰岛素分泌过程. 已有研究证实胰岛素分泌情况可通过测定胞内钙离子信号来反应,细胞内钙离子浓度的升高会促进含胰岛素囊泡与血浆的融合,最终导致胰岛素的分泌[46]. 一般来说,细胞内钙离子浓度增加是钙离子跨膜内流或内质网(ER)释放钙离子所引起[47]. 实验还发现BPAF可能会通过影响ATP合酶(ATPase)基因的表达影响细胞膜电位去极化过程,间接影响电压依赖性钙通道VDCC,进而可能会刺激钙离子内流影响胰岛素分泌. 有研究表明ATP含量和ATP/ADP比值是钙离子浓度升高和胰岛素分泌的重要因素,ATP的产生会导致ATP敏感的钾通道(KATP)关闭,引起膜去极化和电压依赖性钙通道的开放,促进钙内流,进而刺激胰岛素的分泌[48].
-
本研究基于转录组学方法分析了BPs对β-TC-6细胞基因表达的影响,并通过与雌二醇(E2)进行对比分析,探讨了BPs对β细胞的潜在影响和可能的分子机制. 通过对不同暴露组差异基因数量的分析发现BPs与E2具有很多相同的差异基因,其中BPAF与E2含有的相同差异基因较BPA更多,这说明BPAF可能具有更强的类雌激素效应. 通过对不同暴露组差异基因进行GO分析发现BPs和E2都对细胞免疫反应、免疫系统过程和细胞外基质等产生了影响. 此外,通过对不同暴露组差异基因进行KEGG通路注释和富集分析,发现BPs与E2类似都参与了高级糖基化终末产物-受体(AGE-RAGE)信号通路相关基因的调控,进而可能影响β细胞功能. 此外,BPs可能通过影响蛋白激酶(PKC)和ATP合酶(ATPase)的基因表达干扰胰岛素分泌信号通路影响β细胞功能. 以上研究结果表明BPs可能会通过其类雌激素效应对β细胞功能产生影响,本研究有助于阐明BPs导致机体糖代谢紊乱的毒理机制. 同时,本研究发现BPAF可能具有比BPA更强的危害效应,BPAF可能不是BPA的安全替代品,但关于BPs的糖代谢干扰及作用机理还有待更加深入的研究. 因此,未来我们还需要开展更多的毒性研究,为人类健康风险做出更加可靠的评估.
基于转录组学分析双酚A及其替代品双酚AF对胰岛β细胞的潜在影响
Analysis of the potential effects of bisphenol A and its substitute bisphenol AF on islet β cells based on transcriptomics
-
摘要: 目前,双酚类化合物(BPs)暴露与机体糖代谢紊乱的关联性已被证实,然而其毒理机制目前尚不明确. 胰岛β细胞是机体分泌胰岛素的唯一细胞,其在调节机体糖代谢功能方面发挥着非常重要的作用. 本文选取双酚A(BPA)及其替代品双酚AF(BPAF)开展研究,以小鼠胰岛素瘤β-TC-6作为模型细胞,通过细胞计数试剂盒-8(CCK-8)法比较BPs对细胞活性影响的差异;基于转录组学方法分析了BPs对该细胞基因表达的影响,通过与雌二醇(E2)进行对比分析,探讨了BPs对β细胞的潜在影响和可能的分子毒理机制. 本文的研究结果表明,BPs在一定程度会降低β-TC-6细胞活性,同时BPs暴露组与E2暴露组有很多相同的差异基因,且BPAF与E2相同的差异基因数量较BPA更多,提示BPAF具有更强的类雌激素效应. 通过KEGG分析差异基因富集的通路,发现BPs可能会通过影响糖尿病并发症相关的高级糖基化终末产物-受体(AGE-RAGE)信号通路和胰岛素分泌信号通路相关基因的表达影响β细胞的功能. 综上所述,BPs暴露可能会通过其类雌激素效应影响β细胞功能,且BPAF可能具有比BPA更强的危害效应. 以上研究为BPs导致机体糖代谢紊乱提供了可能的毒理机制解释.Abstract: Currently, the correlation between bisphenols (BPs) exposure and glucose metabolism disorders has been established, but the underlying toxicological mechanisms remain unclear. Islet β cells, which are solely responsible for insulin secretion, play a critical role in regulating glucose metabolism. This study focuses on bisphenol A (BPA) and its substitute bisphenol AF (BPAF). Using mouse insulinoma β-TC-6 cells as a model, the study compared the effects of BPs on cell viability through the Cell Counting Kit-8 (CCK-8) assay and analyzed their impact on gene expression through transcriptomics. By comparing BPs with estradiol (E2), we explore their potential impact on β cells and possible molecular toxicological mechanisms. The results revealed that BPs can reduce the viability of β-TC-6 cells to some extent, while both the BPs exposure group and the E2 exposure group share many differential genes, with BPAF and E2 having more identical differential genes than BPA, indicating a stronger estrogen-like effect of BPAF. KEGG analysis suggests that BPs may impact β cell function by altering the expression of genes related to the advanced glycation end products-receptor (AGE-RAGE) signaling pathway and the insulin secretion signaling pathway, both associated with diabetes. In conclusion, BPs exposure may disrupt β cell function through estrogen-like effects, with BPAF potentially having a more detrimental impact than BPA. This research provides a possible explanation for the toxicological mechanisms behind the glucose metabolism disorders caused by BPs.
-
Key words:
- BPA /
- BPAF /
- islet β cell /
- disorder of glucose metabolism /
- transcriptomics.
-

-
表 1 不同比较组差异基因数量统计
Table 1. 1The number of differential genes in different groups
化合物
Compounds上调基因
Up-regulated gene下调基因
Down-regulated genes总差异基因数
Total differential gene numberBPA 141 111 252 BPAF 264 79 343 E2 281 62 343 -
[1] BJÖRNSDOTTER M K, de BOER J, BALLESTEROS-GÓMEZ A. Bisphenol A and replacements in thermal paper: A review[J]. Chemosphere, 2017, 182: 691-706. doi: 10.1016/j.chemosphere.2017.05.070 [2] ROCHESTER J R. Bisphenol A and human health: A review of the literature[J]. Reproductive Toxicology, 2013, 42: 132-155. doi: 10.1016/j.reprotox.2013.08.008 [3] GEENS T, AERTS D, BERTHOT C, et al. A review of dietary and non-dietary exposure to bisphenol-A[J]. Food and Chemical Toxicology, 2012, 50(10): 3725-3740. doi: 10.1016/j.fct.2012.07.059 [4] VANDENBERG L N, HAUSER R, MARCUS M, et al. Human exposure to bisphenol A (BPA)[J]. Reproductive Toxicology, 2007, 24(2): 139-177. doi: 10.1016/j.reprotox.2007.07.010 [5] YANG M, KIM S Y, LEE S M, et al. Biological monitoring of bisphenol A in a Korean population[J]. Archives of Environmental Contamination and Toxicology, 2003, 44(4): 546-551. doi: 10.1007/s00244-002-2124-0 [6] ROTIMI O A, OLAWOLE T D, de CAMPOS O C, et al. Bisphenol A in Africa: A review of environmental and biological levels[J]. Science of the Total Environment, 2021, 764: 142854. doi: 10.1016/j.scitotenv.2020.142854 [7] 王盈灿, 沈理笑, 陈瑶, 等. 上海市学龄儿童双酚A暴露现状及与肥胖关系的初步研究[J]. 中国儿童保健杂志, 2015, 23(4): 344-347. doi: 10.11852/zgetbjzz2015-23-04-03 WANG Y C, SHEN L X, CHEN Y, et al. Preliminary study of school-age children exposure to bisphenol-A and its relationship with obesity in Shanghai[J]. Chinese Journal of Child Health Care, 2015, 23(4): 344-347 (in Chinese). doi: 10.11852/zgetbjzz2015-23-04-03
[8] VANDENBERG L N, CHAHOUD I, HEINDEL J J, et al. Urinary, circulating, and tissue biomonitoring studies indicate widespread exposure to bisphenol A[J]. Environmental Health Perspectives, 2010, 118(8): 1055-1070. doi: 10.1289/ehp.0901716 [9] LI D K, ZHOU Z J, MIAO M H, et al. Urine bisphenol-A (BPA) level in relation to Semen quality[J]. Fertility and Sterility, 2011, 95(2): 625-630. e4. [10] PERERA F, VISHNEVETSKY J, HERBSTMAN J B, et al. Prenatal bisphenol a exposure and child behavior in an inner-city cohort[J]. Environmental Health Perspectives, 2012, 120(8): 1190-1194. doi: 10.1289/ehp.1104492 [11] PELCH K, WIGNALL J A, GOLDSTONE A E, et al. A scoping review of the health and toxicological activity of bisphenol A (BPA) structural analogues and functional alternatives[J]. Toxicology, 2019, 424: 152235. doi: 10.1016/j.tox.2019.06.006 [12] KONNO Y, SUZUKI H, KUDO H, et al. Synthesis and properties of fluorine-containing poly(ether)s with pendant hydroxyl groups by the polyaddition of Bis(oxetane)s and bisphenol AF[J]. Polymer Journal, 2004, 36(2): 114-122. doi: 10.1295/polymj.36.114 [13] BARADIE B, SHOICHET M S. Novel fluoro-terpolymers for coatings applications[J]. Macromolecules, 2005, 38(13): 5560-5568. doi: 10.1021/ma047792s [14] MATSUSHIMA A, LIU X H, OKADA H, et al. Bisphenol AF is a full agonist for the estrogen receptor ERα but a highly specific antagonist for ERβ[J]. Environmental Health Perspectives, 2010, 118(9): 1267-1272. doi: 10.1289/ehp.0901819 [15] YANG Y J, GUAN J, YIN J, et al. Urinary levels of bisphenol analogues in residents living near a manufacturing plant in South China[J]. Chemosphere, 2014, 112: 481-486. doi: 10.1016/j.chemosphere.2014.05.004 [16] JIN H B, XIE J H, MAO L L, et al. Bisphenol analogue concentrations in human breast milk and their associations with postnatal infant growth[J]. Environmental Pollution, 2020, 259: 113779. doi: 10.1016/j.envpol.2019.113779 [17] LANG I A, GALLOWAY T S, SCARLETT A, et al. Association of urinary bisphenol A concentration with medical disorders and laboratory abnormalities in adults[J]. JAMA, 2008, 300(11): 1303-1310. doi: 10.1001/jama.300.11.1303 [18] SHANKAR A, TEPPALA S. Relationship between urinary bisphenol A levels and diabetes mellitus[J]. The Journal of Clinical Endocrinology and Metabolism, 2011, 96(12): 3822-3826. doi: 10.1210/jc.2011-1682 [19] SILVER M K, O’NEILL M S, SOWERS M R, et al. Urinary bisphenol A and type-2 diabetes in U. S. adults: Data from NHANES 2003-2008[J]. PLoS One, 2011, 6(10): e26868. doi: 10.1371/journal.pone.0026868 [20] HWANG S, LIM J E, CHOI Y, et al. Bisphenol A exposure and type 2 diabetes mellitus risk: A meta-analysis[J]. BMC Endocrine Disorders, 2018, 18(1): 81. doi: 10.1186/s12902-018-0310-y [21] SONG Y, CHOU E L, BAECKER A, et al. Endocrine-disrupting chemicals, risk of type 2 diabetes, and diabetes-related metabolic traits: A systematic review and meta-analysis[J]. Journal of Diabetes, 2016, 8(4): 516-532. doi: 10.1111/1753-0407.12325 [22] DUAN Y S, YAO Y M, WANG B, et al. Association of urinary concentrations of bisphenols with type 2 diabetes mellitus: A case-control study[J]. Environmental Pollution, 2018, 243: 1719-1726. doi: 10.1016/j.envpol.2018.09.093 [23] ANGLE B M, DO R P, PONZI D, et al. Metabolic disruption in male mice due to fetal exposure to low but not high doses of bisphenol A (BPA): Evidence for effects on body weight, food intake, adipocytes, leptin, adiponectin, insulin and glucose regulation[J]. Reproductive Toxicology, 2013, 42: 256-268. doi: 10.1016/j.reprotox.2013.07.017 [24] ALONSO-MAGDALENA P, MORIMOTO S, RIPOLL C, et al. The estrogenic effect of bisphenol A disrupts pancreatic β-cell function in vivo and induces insulin resistance[J]. Environmental Health Perspectives, 2006, 114(1): 106-112. doi: 10.1289/ehp.8451 [25] GYIMAH E, DONG X, XU H, et al. Embryonic exposure to low concentrations of bisphenol A and S altered genes related to pancreatic β-cell development and DNA methyltransferase in zebrafish[J]. Archives of Environmental Contamination and Toxicology, 2021, 80(2): 450-460. doi: 10.1007/s00244-021-00812-8 [26] NADAL A, ALONSO-MAGDALENA P, SORIANO S, et al. The pancreatic β-cell as a target of estrogens and xenoestrogens: Implications for blood glucose homeostasis and diabetes[J]. Molecular and Cellular Endocrinology, 2009, 304(1/2): 63-68. [27] ALONSO-MAGDALENA P, VIEIRA E, SORIANO S, et al. Bisphenol A exposure during pregnancy disrupts glucose homeostasis in mothers and adult male offspring[J]. Environmental Health Perspectives, 2010, 118(9): 1243-1250. doi: 10.1289/ehp.1001993 [28] FANG F F, CHEN D L, YU P, et al. Effects of bisphenol A on glucose homeostasis and brain insulin signaling pathways in male mice[J]. General and Comparative Endocrinology, 2015, 212: 44-50. doi: 10.1016/j.ygcen.2015.01.017 [29] SORIANO S, ALONSO-MAGDALENA P, GARCÍA-ARÉVALO M, et al. Rapid insulinotropic action of low doses of bisphenol-A on mouse and human islets of Langerhans: Role of estrogen receptor Β[J]. PLoS One, 2012, 7(2): e31109. doi: 10.1371/journal.pone.0031109 [30] SONG L Q, XIA W, ZHOU Z, et al. Low-level phenolic estrogen pollutants impair islet morphology and β-cell function in isolated rat islets[J]. Journal of Endocrinology, 2012, 215(2): 303-311. doi: 10.1530/JOE-12-0219 [31] ADACHI T, YASUDA K, MORI C, et al. Promoting insulin secretion in pancreatic islets by means of bisphenol A and nonylphenol via intracellular estrogen receptors[J]. Food and Chemical Toxicology, 2005, 43(5): 713-719. doi: 10.1016/j.fct.2005.01.009 [32] BABILONI-CHUST I, dos SANTOS R S, MEDINA-GALI R M, et al. G protein-coupled estrogen receptor activation by bisphenol-a disrupts the protection from apoptosis conferred by the estrogen receptors ERα and ERβ in pancreatic beta cells[J]. Environment International, 2022, 164: 107250. doi: 10.1016/j.envint.2022.107250 [33] BORONAT-BELDA T, FERRERO H, AL-ABDULLA R, et al. Bisphenol-A exposure during pregnancy alters pancreatic β-cell division and mass in male mice offspring: A role for ERβ[J]. Food and Chemical Toxicology, 2020, 145: 111681. doi: 10.1016/j.fct.2020.111681 [34] NADAL A, ROPERO A B, LARIBI O, et al. Nongenomic actions of estrogens and xenoestrogens by binding at a plasma membrane receptor unrelated to estrogen receptor α and estrogen receptor β[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(21): 11603-11608. [35] CARCHIA E, PORRECA I, ALMEIDA P J, et al. Evaluation of low doses BPA-induced perturbation of glycemia by toxicogenomics points to a primary role of pancreatic islets and to the mechanism of toxicity[J]. Cell Death & Disease, 2015, 6(10): e1959. [36] KITAMURA S, SUZUKI T, SANOH S, et al. Comparative study of the endocrine-disrupting activity of bisphenol A and 19 related compounds[J]. Toxicological Sciences, 2005, 84(2): 249-259. doi: 10.1093/toxsci/kfi074 [37] SONG M Y, LIANG D, LIANG Y, et al. Assessing developmental toxicity and estrogenic activity of halogenated bisphenol A on zebrafish (Danio rerio)[J]. Chemosphere, 2014, 112: 275-281. doi: 10.1016/j.chemosphere.2014.04.084 [38] PINTO-JUNIOR D C, SILVA K S, MICHALANI M L, et al. Advanced glycation end products-induced insulin resistance involves repression of skeletal muscle GLUT4 expression[J]. Scientific Reports, 2018, 8(1): 8109. doi: 10.1038/s41598-018-26482-6 [39] COUGHLAN M T, THORBURN D R, PENFOLD S A, et al. RAGE-induced cytosolic ROS promote mitochondrial superoxide generation in diabetes[J]. Journal of the American Society of Nephrology, 2009, 20(4): 742-752. doi: 10.1681/ASN.2008050514 [40] WALKE P B, BANSODE S B, MORE N P, et al. Molecular investigation of glycated insulin-induced insulin resistance via insulin signaling and AGE-RAGE axis[J]. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, 2021, 1867(2): 166029. doi: 10.1016/j.bbadis.2020.166029 [41] YAN S F, RAMASAMY R, NAKA Y, et al. Glycation, inflammation, and RAGE: A scaffold for the macrovascular complications of diabetes and beyond[J]. Circulation Research, 2003, 93(12): 1159-1169. doi: 10.1161/01.RES.0000103862.26506.3D [42] RAMASAMY R, YAN S F, SCHMIDT A M. Receptor for AGE (RAGE): Signaling mechanisms in the pathogenesis of diabetes and its complications[J]. Annals of the New York Academy of Sciences, 2011, 1243: 88-102. doi: 10.1111/j.1749-6632.2011.06320.x [43] BHATTACHARYA R, ALAM M R, KAMAL M A, et al. AGE-RAGE axis culminates into multiple pathogenic processes: A central road to neurodegeneration[J]. Frontiers in Molecular Neuroscience, 2023, 16: 1155175. doi: 10.3389/fnmol.2023.1155175 [44] LEE J H, MELLADO-GIL J M, BAHN Y J, et al. Protection from β-cell apoptosis by inhibition of TGF-β/Smad3 signaling[J]. Cell Death & Disease, 2020, 11(3): 184. [45] SHIGETO M, RAMRACHEYA R, TARASOV A I, et al. GLP-1 stimulates insulin secretion by PKC-dependent TRPM4 and TRPM5 activation[J]. The Journal of Clinical Investigation, 2015, 125(12): 4714-4728. doi: 10.1172/JCI81975 [46] ASHCROFT F M, PROKS P, SMITH P A, et al. Stimulus-secretion coupling in pancreatic β cells[J]. Journal of Cellular Biochemistry, 1994, 55(S1994A): 54-65. doi: 10.1002/jcb.240550007 [47] KAWANO S, SHOJI S, ICHINOSE S, et al. Characterization of Ca2+ signaling pathways in human mesenchymal stem cells[J]. Cell Calcium, 2002, 32(4): 165-174. doi: 10.1016/S0143416002001240 [48] KAHN S E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes[J]. Diabetologia, 2003, 46(1): 3-19. doi: 10.1007/s00125-002-1009-0 -



 下载:
下载: