随着对大气颗粒物的深入研究和人们健康意识的增强,关于细颗粒物(fine particular matter,PM2.5)对运动人体健康风险评价的研究也日趋增多。流行病学研究发现,作为一类主要的污染物,PM2.5可以通过多种途径进入生物体内,在体内产生含氧自由基等活性氧物质[1],并通过多种信号通路及酶反应引起氧化应激,造成生物体内的脂质过氧化[2]、蛋白质损伤和酶失活等[3],引起机体发生氧化应激。尤其是在运动的状态下,由于呼吸加深加快,会使机体吸入更多的PM2.5,并且随着血液循环进入到身体各组织中,诱导产生心肺功能障碍,造成机体的系统性损伤。目前,我国国内从多器官水平上研究不同浓度PM2.5对运动状态下机体氧化-抗氧化网络的影响尚处在探索阶段。因此,本研究通过收集体育场馆内PM2.5,研究其对运动状态大鼠肺和心脏抗氧化系统的影响,以期为评价体育场馆内细颗粒物浓度和机体氧化损伤之间的关系提供理论依据,同时也为PM2.5暴露剂量-运动反应之间的关系机制提供一定的实验依据,研究结果亦可以为雾霾天气下健身锻炼者提供防护参考。
1 材料与方法(Materials and methods)
1.1 PM2.5的采样及悬液制备
利用TH-150C型颗粒物智能采样器(武汉天虹)采集某校体育馆内PM2.5,采样前清理采样点周围的运动器械及其他物品,同时确定采样点为非污染源。为了最大程度模拟PM2.5对运动机体的影响,将仪器放置在人体呼吸带高度(1.5 m),同时采用同心圆方式选取5个点,每2个采样点之间相距5 m左右,使采样仪器离墙>1 m、离门窗>3 m,空气流量为1.13 m3·min-1。采样时将已经真空干燥、称量质量的滤膜放入采样夹的滤网上,滤膜毛面朝进气方向,将滤膜压紧至不漏气。采样结束后将滤膜真空干燥,根据采样前、后滤膜质量差和采样体积得出颗粒物的质量浓度。将收集了PM2.5的玻璃纤维滤膜裁剪为小块后浸入去离子水中,经超声振荡4次,每次30 min后用去离子水洗脱颗粒物,然后将滤液在4 ℃离心20 min(1 000 r·min-1,离心半径59 mm),真空干燥后称量质量,-20 ℃保存。为保证颗粒物实际毒性效果,实验并未对颗粒物进行消毒灭菌处理,滴注前用0.9%生理盐水配制成需要的浓度,超声振荡15 min使染毒悬液均匀,并灭菌备用。
1.2 实验动物染毒剂量与染毒方式
运动大鼠采用非暴露式PM2.5气管滴注染毒,滴注时保持室内温度在20~26 ℃之间,室内相对湿度为44%~70%。滴注前先将染毒悬液预温至37 ℃,在大鼠乙醚麻醉后,分别按低(7.5 mg·kg-1)、中(15 mg·kg-1)和高(30 mg·kg-1)3种剂量经气管注入PM2.5颗粒物悬液,对照组滴注同等容量的生理盐水,实验大鼠染毒后进行运动。
1.3 实验动物分组与运动方案
实验动物选用32只7周龄健康雄性SPF级Wistar大鼠,体质量180~220 g。动物购回后在温度为20~26 ℃、湿度为44%~70%的常规饲养笼内适应性喂养7 d,自由进食和饮水,照明随同光照自然变化。所有动物处置均依照《关于善待实验动物的指导性意见》的相关要求进行[4]。适应性喂养7 d后将大鼠随机分为对照组(control group,CG)、高剂量染毒组(high-dose group,30 mg·kg-1,HG)、中剂量染毒组(middle-dose group,15 mg·kg-1,MG)和低剂量染毒组(low-dose group,7.5 mg·kg-1,LG)4组,每组8只,根据大鼠体质量/摄氧量回归方程建立递增负荷运动模型,正式训练前将所有大鼠以10 m·min-1、5 min·d-1的方案先进行2 d的适应性训练,具体运动方案如表1所示。
表1 实验大鼠运动方案
Table 1 Training program of experimental rats

阶段Step速度/(m·min-1)Speed of motion/(m·min-1)运动时间/minDuration of motion/min坡度/(°)Slope/(°)最大摄氧量Max volume of O2一阶段 Step 1 1515045%VO2max二阶段 Step 2 1820050%VO2max三阶段 Step 32130065%VO2max四阶段 Step 42440070% VO2max五阶段 Step 52750076% VO2max
1.4 肺泡灌洗液(BALF)和心脏组织匀浆的制备与指标测试
1.4.1 BALF制备
运动结束后用乙醚麻醉处死大鼠,切开颈部皮肤,暴露气管,结扎左肺,在主气管处剪一“V”形小切口,插人灌洗针头,结扎固定。注射器抽取37 ℃生理盐水缓慢注入肺内,同时轻轻按摩胸壁,待右肺变得膨隆后缓慢抽出灌洗液。灌洗2次,第1次注入6 mL,第2次注入3 mL,混匀抽吸2次,至灌洗液总量为6 mL。然后以4 000 r·min-1、4 ℃下离心20 min,取上清液于-20 ℃保存待测。
1.4.2 心脏组织匀浆液制备
大鼠宰杀后即刻称取适量心脏组织,加入0.9%的生理盐水,按体质量(g)∶体积(mL)=1∶9的比例加预冷的匀浆介质(pH 7.4,0.01 mol·L-1 Tris-HCl,0.0001 mol·L-1 EDTA-2Na,0.01 mol·L-1蔗糖,0.8%的NaCl溶液)于烧杯中,用眼科小剪尽快剪碎组织块,然后倒入研钵中按照顺时针方向进行研磨至糊状。匀浆液通过二层纱布过滤后按试剂盒要求分别于低温冷冻离心机4 000 r·min-1离心10 min,分离上清液,4 ℃冰箱保存备用或冷藏或-20 ℃冰箱冰冻备用,使用前按照试剂盒要求作相应的稀释。
1.4.3 指标测试
采用5,5’-二硫代硝基苯甲酸(DTNB)比色法测定谷胱甘肽过氧化物酶(glutathione peroxide,GSH-Px)活性和丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)含量;采用羟胺氧化法测定总抗氧化酶(total superoxide dismutase,T-SOD)活性;过氧化氢酶(catalase,CAT)、谷胱甘肽(glutathione,GSH)采用分光光度方法测定。
1.5 统计学分析
实验结果采用SPSS 18.0统计软件处理,采用单因素方差分析进行统计学分析,计算均值±标准差![]() 组间平均值的显著性差异以t检验表示,确定差异的显著性。
组间平均值的显著性差异以t检验表示,确定差异的显著性。
2 结果(Results)
2.1 不同剂量PM2.5暴露对运动大鼠BALF抗氧化酶活性的影响
如表2所示,和CG组相比,除CAT之外,LG组中GSH-Px、T-SOD活性和GSH含量均高于CG组,其中GSH-Px活性有极显著性差异(P<0.01);除GSH含量外,MG组、HG组GSH-Px、T-SOD和CAT活性呈剂量相关性下降,其中,GSH-Px、T-SOD活性与CG组相比差异有统计学意义(P<0.05,P<0.01),而GSH含量虽呈剂量相关性下降,但仍高于CG组,且有统计学意义(P<0.05,P<0.01)。
表2 PM2.5暴露对大鼠BALF抗氧化酶活性的影响(n=8)
Table 2 Effects of PM2.5 exposure on antioxidant enzymes activity of BALF in rats (n=8)

组别 GroupGSH-Px/(U·mL-1)T-SOD/(U·mL-1)CAT/(U·mL-1)GSH/(mg·L-1)CG6.78±1.5781.56±8.800.21±0.13 38.94±10.03LG 7.20±0.32**87.33±25.720.18±0.1152.84±8.17MG 6.62±0.29**80.34±23.660.17±0.10 48.62±7.51*HG 6.09±0.27**73.91±21.77*0.15±0.0944.73±6.91**
注:CG表示对照组,LG表示低剂量染毒组,MG表示中剂量染毒组,HG表示高剂量染毒组;GSH-Px表示谷胱甘肽过氧化物酶,T-SOD表示总抗氧化酶,CAT表示过氧化氢酶,GSH表示谷胱甘肽;与CG比较,*P<0.05、**P<0.01。
Note:CG means control group,LG means low-dose exposure group,MG means middle-dose exposure group,and HG means high-dose exposure group;GSH-Px means glutathione peroxidase,T-SOD means total antioxidant enzymes,CAT means catalase,and GSH means glutathione;compared with CG,*P<0.05,**P<0.01.
2.2 PM2.5 暴露对运动大鼠心脏抗氧化酶活性的影响
如表3所示,和CG组相比,在3个剂量组中,随着PM2.5剂量的增加T-SOD活性逐渐下降,差异具有统计学意义(P<0.05,P<0.01);而LG组GSH-Px活性与CG组相比略有上升,但MG组和HG组呈下降趋势,且HG组与CG组相比有显著性差异(P<0.05)。
表3 PM2.5暴露对运动大鼠心脏抗氧化酶活性影响(n=8)
Table 3 Effects of PM2.5 exposure on antioxidant enzymes activity of heart in rats (n=8) (U·mL-1)

组别 GroupGSH-PxT-SODCATCG310.05±55.7066.62±5.1635.09±2.82LG329.90±41.7458.63±4.54*30.88±2.48MG303.50±38.4053.94±4.1828.40±2.28HG 279.22±35.33* 49.62±3.84** 26.13±2.10*HG 279.22±35.33* 49.62±3.84** 26.13±2.10*
注:与CG比较,*P<0.05、**P<0.01。
Note:Compared with the CG,*represents P<0.05,**represents P<0.01.
2.3 PM2.5 暴露对运动大鼠BALF自由基含量的影响
运动及不同浓度PM2.5染毒对大鼠BALF自由基含量的影响如表4所示,由表4可知,和CG组相比,在3个不同剂量的PM2.5暴露组中,BALF中自由基含量随着PM2.5暴露剂量的增加呈剂量相关性上升,差异有统计学意义。
表4 PM2.5对训练大鼠BALF中丙二醛(MDA)、活性氧(ROS)含量的影响(n=8)
Table 4 The influence on malondialdehyde (MDA) and reactive oxygen species (ROS) content of BALF of training rats after PM2.5 exposure (n=8) (U·mL-1)

组别GroupMDA/(nmol·mg-1)ROS/(U·mg-1)CG2.05±0.573.24±6.79LG2.53±0.63*87.01±8.07MG 2.71±0.67 103.72±9.62**HG2.91±0.72**123.63±11.47**
注:与CG比较,*P<0.05、**P<0.01。
Note:Compared with the CG,*represents P<0.05,**represents P<0.01.
2.4 PM2.5暴露对运动大鼠心脏自由基含量的影响
由表5可知,和CG组相比,在3个不同剂量的PM2.5暴露组中,随着PM2.5暴露剂量的增加,MDA和ROS含量也成剂量相关性上升,差异有统计学意义。
表5 PM2.5对训练大鼠心脏MDA、ROS含量的影响(n=8)
Table 5 The influence on (MDA) and (ROS) content of heart of training rats after PM2.5 exposure (n=8) (U·mL-1)
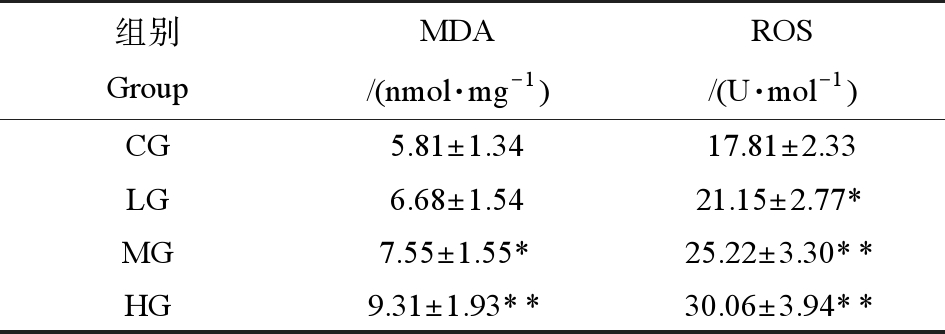
组别GroupMDA/(nmol·mg-1)ROS/(U·mol-1)CG 5.81±1.3417.81±2.33LG6.68±1.5421.15±2.77*MG 7.55±1.55*25.22±3.30**HG9.31±1.93**30.06±3.94**
注:与CG比较,*P<0.05、**P<0.01。
Note:Compared with the CG,*represents P<0.05,**represents P<0.01.
3 讨论(Discussion)
3.1 PM2.5暴露对运动大鼠BALF抗氧化酶活性的影响
抗氧化系统作为内稳态平衡的调节因素之一,可以通过非酶类物质和酶类如抗氧化酶构成抗氧化防御的屏障,从而消解自由基对机体内稳态的破坏。PM2.5的机械损伤和生物化学损伤,会加重呼吸系统的炎症及氧化应激反应。因此,BALF中抗氧化酶活性的改变是衡量PM2.5致肺组织氧化应激反应重要参考指标。心脏作为机体的动力器官,在运动过程中易受到外界应激,引起结构与功能改变[5]。以往研究表明,吸入空气污染物会影响心率变异性、血管张力和动脉粥样硬化的进展[6]。
由本实验结果可知,不同剂量的PM2.5暴露对运动大鼠BALF内的GSH-Px、T-SOD、GSH和CAT产生不同的影响。其中和CG组相比,LG组中GSH-Px、T-SOD活性和GSH含量均出现上升趋势,而CAT活性下降。而随着PM2.5暴露剂量的增加,4个指标均呈现剂量相关性下降。分析其原因可能是由于大鼠在运动过程中受到神经和体液的调节,促进抗氧化酶活性的暂时性升高,以对抗运动过程中产生的自由基及PM2.5暴露带来的负面影响,但是由于低剂量的PM2.5暴露对GSH-Px和T-SOD的负面影响不足以破坏机体的抗氧化防御系统,因此在LG组中呈现出GSH-Px和T-SOD活性升高的现象。
由于不同抗氧化酶的底物特异性、亲合性以及在细胞中的位置不同,而且机体内决定抗氧化酶活性变化的一些因素很大程度上取决于不同的外界应激源及干扰因素,所以LG组CAT的降低,可能是低浓度的PM2.5暴露作为一种触发因素,使CAT在PM2.5的刺激下出现防御性下降;但是随着PM2.5暴露剂量的增加,MG和HG组中各酶活性出现显著性下降,主要机制可能是PM2.5中的重金属有机成分可以诱导自由基的产生,或通过GSH、还原型辅酶Ⅱ(NADPH)的电子转移产生自由基[7]。当氧化应激增强时,细胞内ROS水平的升高导致溶酶体膜损伤,刺激肺组织与系统炎性因子和氧自由基的释放,继而促使氧化损伤[8]。染毒组GSH含量下降但仍高于CG组,推测随着PM2.5剂量的增加,大鼠运动过程中H2O2生成增多,这些自由基与GSH中的—SH结合,大量消耗了组织中的—SH,加深了抗氧化酶的流失。染毒组GSH含量高于CG组,说明PM2.5染毒和力竭运动中自由基的增加反过来促进了氧化型GSH(GSSG)向还原型GSH的转变,拮抗自由基的损伤。
3.2 PM2.5暴露对运动大鼠心脏抗氧化酶活性的影响
研究结果显示,和CG组相比,LG组除GSH-Px外,心肌组织T-SOD和GSH在PM2.5染毒后下降,且T-SOD具有显著性差异,在MG组和HG组中各酶活性下降。这说明心肌组织在抵抗由于运动和PM2.5染毒带来的氧化损伤中处于劣势。推测主要机制是:(1)运动或者PM2.5染毒造成了包括心肌结构改变、心肌间质胶原改建和心脏生物化学及心脏功能改变等方面的变化,从而使心脏包括抗氧化在内的一系列功能受损;(2)进入呼吸系统的PM2.5可通过血液循环引起心脏的氧化应激,削弱心脏的抗氧化功能,最终引发心血管系统损伤[9];(3)PM2.5作用于心脏后,其本身所吸附的有害物质会产生自由基,引起膜脂质过氧化、蛋白质氧化或水解,进而引起其抗氧化能力的下降;(4)由于本实验大鼠的运动方案为一次性急性递增负荷实验,因此大鼠在运动过程中的肺通气量会在短时间的内大幅度增加,同时中、高剂量的PM2.5由于携带更多的有害物质,会通过肺部进入血液循环,从而引起心脏的氧化应激反应[10];有研究表明,PM2.5对大鼠心脏氧化损伤程度随PM2.5浓度的增加而增加,说明其抵抗自由基能力变弱[11];由于抗氧化酶活性的下降,诱导或抑制蛋白酶活性、引起心血管系统一系列病理和抗氧化能力的下降[12]。
3.3 PM2.5暴露对运动大鼠BALF和心脏ROS和MDA的影响
正常情况下,体内存在抑制自由基反应和清除自由基的抗氧化体系,从而维持体内自由基代谢的动态平衡[13]。但是当由于外界的强应激导致机体的内稳态发生紊乱时,可以造成机体自由基代谢的紊乱,使氧化与抗氧化失衡,造成对各组织系统的损伤[14]。本实验数据显示,PM2.5暴露可以升高BALF及心肌MDA和ROS的含量,表明当机体处于运动和PM2.5暴露应激状态时,自由基的生成速度大于抗氧化系统的清除速度,造成ROS在体内的累积,对组织和细胞产生危害。尤其是PM2.5刺激组织诱导细胞产生的内源性ROS可以作为第二信使,通过改变氧化还原状态调节与细胞增殖、分化及凋亡相关的信号转导通路中多种靶分子的活性,最终决定细胞的命运[15]。在运动和PM2.5暴露组,各抗氧化酶活性总体呈下降趋势,而组织中自由基的升高也对应了抗氧化酶的降低。
氧自由基的增加可以通过分子机制诱导氧化酶发生适应性变化,大强度训练时机体处于脉冲式的氧化应激态中[16],同时运动过程中酸性代谢产物的堆积也产生较多的自由基。在低、中、高剂量浓度的PM2.5暴露后,MDA和ROS均呈剂量相关性升高,因此结合抗氧化酶的结果推测,PM2.5所含的炭核、氮、硫、多环芳烃、内毒素、细胞片段和过渡金属等多种有害的化学成分,可以随血液循环通过与各组织细胞接触,并相互作用释放出大量的ROS,穿过气血屏障和血脑屏障,造成组织内氧化与抗氧化系统的失衡。
[1] 袁圣武,黄超,季晓亚,等.环境污染物导致氧化应激的关键信号通路及其检测方法[J].生态毒理学报,2017,12(1):25-37
Yuan S W,Huang C,Ji X Y,et al.Main signaling pathways and detection methods of oxidative stress caused by environmental pollutants [J].Asian Journal of Ecotoxicology,2017,12(1):25-37 (in Chinese)
[2] 张学军.大气PM2.5对户外体育健身人群健康影响的研究[J].中国公共卫生管理,2017,33(6):781-784
Zhang X J.Study on health effects of atmosphere PM2.5 on outdoor sports fitness crowd [J].Chinese Journal of Public Health Management,2017,33(6):781-784 (in Chinese)
[3] 江龙,王清叶,崔文娟.金纳米颗粒的细胞毒性和促细胞生长作用[J].化学进展,2013,25(10):1631-1641
Jiang L,Wang Q Y,Cui W J.Influence of gold nanoparticles on thecytotoxity and cell growth [J].Progress in Chemistry,2013,25(10):1631-1641 (in Chinese)
[4] 中华人民共和国科学技术部.关于善待实验动物的指导性意见[S].北京:中华人民共和国科学技术部,2006
[5] Madrigano J,Kloog I,Goldberg R,et al.Long-term exposure to PM2.5 and incidence of acute myocardial infarction [J].Environmental Health Perspectives,2013,121(2):192-196
[6] Simkhovich B Z,Kleinman M T,Kloner R A.Air pollution and cardiovascular injury:Epidemiology,toxicology,and mechanisms [J].Journal of the American College of Cardiology,2008,52(9):719-726
[7] Faiola C,Johansen A M,Rybka S,et al.Ultrafine particulate ferrous iron and anthracene associations with mitochondrial dysfunction [J].Aerosol Science and Technology,2011,45(9):1109-1122
[8] Wang D B,Pakbin P,Shafer M M,et al.Macrophage reactive oxygen species activity of water-soluble and water-insoluble fractions of ambient coarse,PM2.5 and ultrafine particulate matter (PM) in Los Angeles [J].Atmospheric Environment,2013,77:301-310
[9] Polichetti G,Cocco S,Spinali A,et al.Effects of particulate matter (PM10,PM2.5 and PM1) on the cardiovascular system [J].Toxicology,2009,261(1-2):1-8
[10] 乔玉成,张琦.吸入PM2.5对运动人体致伤机制研究进展[J].中国运动医学杂志,2015,34(10):998-1007
[11] 孙志豪,崔燕平.PM2.5对人体健康影响研究概述[J].环境科技,2013,26(4):75-78
Sun Z H,Cui Y P.An overview of PM2.5 impacts on human health [J].Environmental Science and Technology,2013,26(4):75-78 (in Chinese)
[12] 臧文秀,陈宇,陈鹏,等.PM2.5引起氧化应激反应及对心血管疾病的影响[J].吉林医学,2018,39(4):751-754
[13] 崔建梅,苏晓云,王昕,等.自愿转轮运动对抑郁模型大鼠行为学、脑组织神经Y肽及中央杏仁核一氧化氮合酶表达的影响[J].体育科学,2014,34(5):15-22
Cui J M,Su X Y,Wang X,et al.Effects of voluntary wheeling on behavior changes,brain neuropeptide Y and nNOS expression within central amygdala in the depressive model rats [J].China Sport Science,2014,34(5):15-22 (in Chinese)
[14] 胡柏平,汪晓瑞,夏敏慧.游泳对攻击行为大鼠肾脏形态及HSP70表达的影响[J].陕西师范大学学报:自然科学版,2015,43(3):104-108
Hu B P,Wang X R,Xia M H.Effect of swimming on kidney morphology and expression of HSP70 in rats with aggressive behavior [J].Journal of Shaanxi Normal University:Natural Science Edition,2015,43(3):104-108 (in Chinese)
[15] Brown D I,Griendling K K.Regulation of signal transduction by reactive oxygen species in the cardiovascular system [J].Circulation Research,2015,116(3):531-549
[16] 潘同斌,王雅一,左伟,等.大负荷运动及恢复期大鼠心肌超微结构及心肌营养素-1的变化[J].北京体育大学学报,2012,35(12):53-56,61
Pan T B,Wang Y Y,Zuo W,et al.The changes of cardiac muscle ultrastructure and cardiotrophin-1 during heavy load exercise and recovery in rats [J].Journal of Beijing Sport University,2012,35(12):53-56,61 (in Chinese)