氰氟虫腙(metaflumizone,C24H16F6N4O2)是由德国巴斯夫公司开发的一种缩氨基脲类杀虫剂[1],它通过阻断昆虫中的钠离子通道,抑制昆虫的神经活动,从而使昆虫出现麻痹、瘫痪等症状[2]。截至2017年1月底,8个氰氟虫腙产品在我国获得批准登记,其中包含2个原药,6个农药制剂,主要用于十字花科蔬菜和水稻等作物的病虫害防治[3]。
氰氟虫腙对哺乳动物的急性毒性较低(口服LD50>5 000 mg·kg-1·d-1)[4-5],在长期慢性毒性研究中,氰氟虫腙对哺乳动物大鼠、小鼠和狗也都表现出较低的毒性,且没有发现其对哺乳动物具有致癌性[6]。此外,多代生殖毒性研究表明氰氟虫腙对哺乳动物的后代没有毒性。然而,氰氟虫腙对包括鱼类和水生无脊椎动物在内的水生物种却有一定的毒性影响[4-5]。氰氟虫腙对虹鳟鱼(Oncorhynchus mykiss)和鲈鲤(Cyprinodon variegates)的96 h半致死浓度分别为>0.228 mg·L-1和>0.257 mg·L-1[4-5]。同时,氰氟虫腙对糠虾(Americamysis bahia)和东部牡蛎(Crassostrea virginica)的96 h半数效应浓度分别为>0.289 mg·L-1和>0.136 mg·L-1[4-5]。目前尚没有其他较深入的关于氰氟虫腙对水生生物毒性及致毒机理等的研究报道。有研究表明,同为缩氨基脲类杀虫剂的茚虫威暴露能够引起斑马鱼出现心包水肿、心率下降及细胞凋亡等现象[7-8]。目前,对氰氟虫腙的研究主要集中在药效和药物残留等方面,而关于其对水生生物(例如鱼类)的毒理学信息仍是有限的。
与此同时,氰氟虫腙在土壤和水体沉积物系统等生态环境中具有较高环境持久性。欧洲食品安全局曾报道氰氟虫腙在土壤中的半衰期为141 d,在水体沉积物系统中的半衰期为451 d[4-5]。农药施用后往往会导致其在土壤和农作物中残留,同时也会随着雨水冲刷进入水生态系统[9]。因此,氰氟虫腙对水生态系统造成的危害不容忽视,而数量庞大的有鳔鱼类是水生态系统中的重要生物。鱼鳔作为重要的功能器官,其发育及充气过程极易受到环境污染物的干扰[10]。
斑马鱼作为一种常见的模式生物,目前已被广泛用于杀虫剂等农药的毒性评估[11-12]。在本研究中,将斑马鱼胚胎暴露于氰氟虫腙(0.1、1和10 μmol·L-1)中,记录并分析了不同发育时期胚胎的存活率、孵化率和畸形率,同时对斑马鱼幼鱼的鱼鳔组织进行病理学分析,并对鱼鳔发育相关的关键标记基因的表达进行深入研究。总体而言,本研究结果将为氰氟虫腙广泛使用所带来生态风险的评估提供更多的毒理学证据。
1 材料与方法(Materials and methods)
1.1 化学品和试剂
氰氟虫腙,分子式为C24H16F6N4O2,CAS No.139968-49-3,纯度≥97%,购自加拿大多伦多研究化学品公司;麻醉剂MS-222购自中国上海拜德医药科技有限公司。多聚甲醛购自Sigma公司;苏木素伊红(H&E)染色试剂盒购自中国碧云天生物技术有限公司;地高辛RNA标记试剂盒(SP6/T7)和抗-digoxigenin-AP Fab fragments购自德国Roche公司;BCIP/NBT显色试剂盒购自中国碧云天生物技术有限公司;助溶剂二甲基亚砜(dimethyl sulfoxide,DMSO)为分析纯,购自Biosharp公司。
1.2 斑马鱼和氰氟虫腙暴露
野生型成体斑马鱼(AB品系)饲养于上海海圣公司生产的独立养殖循环水系统中,水温保持在(28±0.5) ℃,成鱼饲喂新鲜孵化的丰年虾,每天3次。将成年雌雄斑马鱼(1只雌性和4只雄性)分隔开放在同一产卵箱中过夜,并在第2天灯亮时将隔离板移开让其追逐产卵。
氰氟虫腙粉末溶解于DMSO中配制成10 g·L-1的母液,然后避光存放。根据预实验的结果,设置了3个浓度梯度,分别为0.1 μmol·L-1(低浓度暴露组)、1 μmol·L-1(中浓度暴露组)和10 μmol·L-1(高浓度暴露组)。按照OECD准则[13],在体视显微镜(德国Leica公司,M205FA)下随机挑选处在囊胚期(受精后3 h)的健康胚胎用于药物暴露。在90 mm培养皿中,每组随机放置70个胚胎。每个暴露浓度设置3个平行,空白对照组加入0.05%的DMSO。在整个暴露期间,每天更换一次暴露溶液。
所有实验方案均得到华侨大学动物保护委员会与福利委员会的批准与支持。
1.3 氰氟虫腙实际浓度的测定
利用高效液相色谱(德国Agilent公司,Agilent Technologies 1260 Infinity)对培养皿中氰氟虫腙的暴露浓度进行检测,每次进样体积为15 μL。在检测过程中使用C18柱(4.6 mm×150 mm,5 μm),流动相为甲醇和水(V∶V=75∶25),流速为1.0 mL·min-1,检测波长为285 nm。
1.4 表型分析
在受精后24、48、72和96 h分别记录斑马鱼胚胎存活率、畸形率,在受精后48、72和96 h记录胚胎孵化率。同时,在受精后96 h,将斑马鱼幼鱼用0.03% MS-222进行麻醉和拍照,使用显微镜Leica Application Suite X软件计算鱼鳔的垂直长度和体长(德国Leica公司,LAS X)。
1.5 组织病理学分析
在幼鱼麻醉后,取受精后96 h的幼鱼(n=12)放置于4%的多聚甲醛溶液中进行固定,然后包埋于石蜡中进行切片。切片的厚度为3~5 μm。伊红和苏木素染色(hematoxylin and eosin staining,HE)按照试剂盒内的操作手册进行。染色完成后使用倒置显微镜(德国Zeiss公司,Axio Observer)观察并拍照。
1.6 胚胎整体原位杂交
设计基因pbx1a[14](GenBank:AJ245962.1)、anxa5b[15-16](GenBank:BC046873.1)、elovl1a[16](GenBank:NM_001005989.3)和hprt1l[17](GenBank:NM_001002056.1)含有T7启动子的探针引物,引物序列如表1所示。使用地高辛标记的RNA标记试剂盒合成上述基因的RNA探针,具体操作方法见说明书。胚胎整体原位杂交的操作过程按照Thisse和Thisse[18]建立的方法进行。
表1 探针引物序列
Table 1 The primers used for probe amplification

基因Gene引物序列Primer sequences探针长度/bpProduct length/bp基因库IDGenBank IDpbx1aF: 5’-GAGTTACGCGGCAGAGTCGCAGATT-3’digR: 5’-AATACGACTCACTATAGGGAGAGTCGAGGAAGCGGGAGCGCAGGATC-3’1 014AJ245962.1anxa5bF: 5’-ACTCCTCATTTCTGCTGCTTGCTCG-3’digR: 5’-AATACGACTCACTATAGGGAGAAACGCTTGCGGAATTCAGCACGAA-3’972BC046873.1elovl1aF: 5’-ACGATCACATTTACCTCATCAAGGT-3’digR: 5’-AATACGACTCACTATAGGGAGACAGAAGGCTGTGTTTTGACTGGTTC-3’1 242NM_001005989.3hprt1lF: 5’-AGAAGCAGCACAGAATCAGGCGGAA-3’digR: 5’-AATACGACTCACTATAGGGAGACCTCCATAAAGTACACAATTCTCAG-3’1 025NM_001002056.1
注:粗体代表T7启动子序列。
Note:Bold font represents T7 promoter sequence.
简而言之,将预杂交后的胚胎(每一个探针中的对照组与暴露组各包含10~15个胚胎)与上述反义RNA探针在60 ℃杂交过夜。第2天,使用预热的梯度杂交缓冲液清洗胚胎并进行封闭,然后,将胚胎孵育在抗体溶液中4 ℃孵育过夜。第3天,使用缓冲液进行洗涤,然后用BCIP/NBT显色试剂盒进行避光染色。在显色过程中,注意观察显色情况。当显色完成后使用甲醇进行梯度脱色,脱色完成后将胚胎置于甘油中透化过夜。
1.7 统计分析
本实验使用Statistic Package for Social Science (SPSS)25.0软件进行数据统计处理。数据表示为平均值±标准差(Mean±SEM)。氰氟虫腙处理组和对照组之间斑马鱼胚胎的存活率、孵化率、畸形率以及幼鱼鱼鳔大小和体长采用单因素方差分析法(one-way analysis of variance,ANOVA)选择最小显著性差异法进行统计分析。P<0.05表示具有显著性差异。
2 结果(Results)
2.1 暴露水体中氰氟虫腙实际浓度测定
采用高效液相色谱仪检测了0.1、1和10 μmol·L-1受试组中氰氟虫腙药物的实际浓度。氰氟虫腙0.1、1和10 μmol·L-1处理组对应的水体中氰氟虫腙药物的实际浓度分别为(0.091±0.003)、(0.982±0.005)和(10.020±0.034) μmol·L-1。同时,对照组中的氰氟虫腙实际浓度低于检测限。
2.2 氰氟虫腙影响斑马鱼早期发育
为了评估氰氟虫腙对斑马鱼早期胚胎发育的影响,首先将斑马鱼胚胎暴露于0.1、1和10 μmol·L-1氰氟虫腙中,暴露周期为4 d。从受精后24 h至受精后96 h,与对照组相比,3个浓度的氰氟虫腙处理(0.1、1和10 μmol·L-1)都不会影响斑马鱼胚胎的存活率(图1(a))。然而,最高浓度的氰氟虫腙(10 μmol·L-1)处理会显著降低斑马鱼胚胎在受精后48 h和72 h的孵化率(P<0.01,图1(b)),同时这种高浓度诱导的孵化延迟现象在受精后96 h恢复正常。此外,3个浓度的氰氟虫腙处理(0.1、1和10 μmol·L-1)在受精后24、48和72 h,都没有观察到明显的畸形现象(例如心包水肿、卵黄囊肿和脊柱弯曲)。然而,在受精后96 h高浓度(10 μmol·L-1)氰氟虫腙处理后,观察到幼鱼鱼鳔充气不全这一明显的畸形现象(图1(c)和图2(a)~(d))。
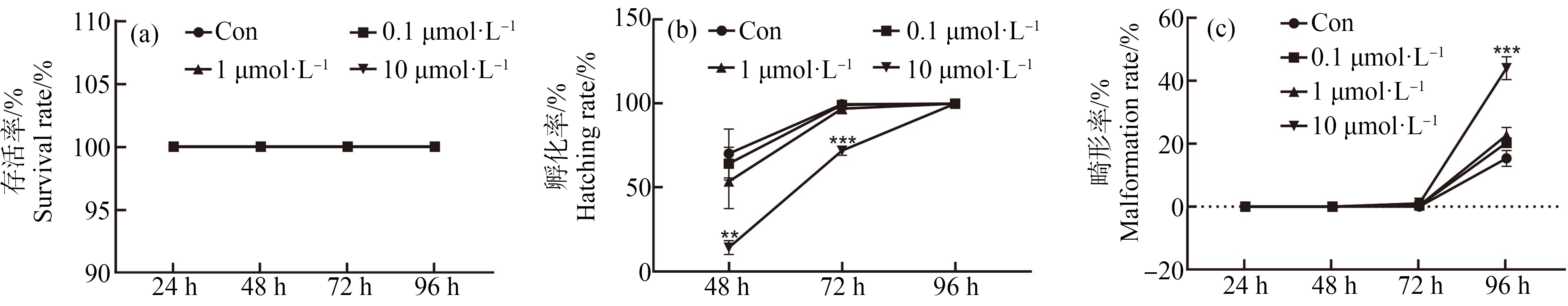
图1 氰氟虫腙对斑马鱼早期发育的毒性作用
注:(a)存活率,(b)孵化率,(c)畸形率;Con代表二甲基亚砜(DMSO)处理的对照组,误差线表示为至少3次重复的平均值(Mean±SEM)的平均标准误差;与对照组相比,***P<0.001、**P<0.01。
Fig.1 The toxic effects of metaflumizone on zebrafish embryos
Note:(a) Survival rate,(b) Hatching rate,(c) Malformation rate;Con represents control,treated with dimethyl sulfoxide (DMSO) only;error bars represent mean standard error of the mean (Mean±SEM) of at least three replicates;compared with the control,***P<0.001,**P<0.01.

图2 氰氟虫腙影响斑马鱼幼鱼鱼鳔发育
注:(a)~(d) 对照组、0.1 μmol·L-1、1 μmol·L-1和10 μmol·L-1氰氟虫腙处理组在受精后96 h幼鱼的侧面图,(e) 受精后96 h幼鱼鱼鳔的垂直长度,(f) 受精后96 h幼鱼的体长,(g)~(j) 对照组、0.1 μmol·L-1、1 μmol·L-1、10 μmol·L-1氰氟虫腙处理组在受精后96 h进行HE染色的幼鱼鱼鳔矢状切面;Con表示DMSO处理的对照组;黄圈指示鱼鳔位置;(a)~(d) 比例尺=500 μm;(g)~(j) 比例尺=200 μm;与对照组相比,***P<0.001,**P<0.01。
Fig.2 Effects of metaflumizone on the swim bladder development in zebrafish larvae
Note:(a)~(d) Lateral views of control,0.1 μmol·L-1,1 μmol·L-1,10 μmol·L-1 metaflumizone-treated larvae at 96 hpf,(e) Swim bladder vertical lengths of larvae at 96 hpf,(f) Body length of larvae at 96 hpf,(g)~(j) Sagittal section of the swim bladders in H&E stained control,0.1 μmol·L-1,1 μmol·L-1,10 μmol·L-1 metaflumizone-treated larvae at 96 hpf;Con represents DMSO treated groups;yellow circle indicates the position of swim bladder;(a)~(d) Scale bar=500 μm;(g)~(j) Scale bar=200 μm;compared with the control,***P<0.001,**P<0.01.
2.3 氰氟虫腙干扰斑马鱼胚胎的鱼鳔发育
利用Leica Application Suite X软件测量了各组间鱼鳔的大小和体长。对照组、低浓度(0.1 μmol·L-1)、中浓度(1 μmol·L-1)和高浓度(10 μmol·L-1)氰氟虫腙处理组中幼鱼的鱼鳔平均垂直大小分别为(0.243±0.023) mm (n=31)、(0.243±0.026) mm (n=23)、(0.247±0.033) mm (n=27)和(0.175±0.039) mm (n=41)(图2(e))。同时,对照组、低浓度、中浓度和高浓度处理组幼鱼的体长分别为(4.436±0.086) mm (n=36)、(4.438±0.101) mm (n=28)、(4.418±0.108) mm (n=34)和(4.353±0.127) mm (n=41) (图2(f))。经过统计学分析,检测到无论是鱼鳔大小还是体长,高浓度(10 μmol·L-1)氰氟虫腙处理组中都出现了显著性减少的现象(图2(e)和图2(f))。然后,在组织病理学水平上对幼鱼鱼鳔的变化进行深入探究,HE染色结果显示高浓度(10 μmol·L-1)氰氟虫腙暴露改变了鱼鳔的整体结构(图2(g)~(j))。在对照组和低中浓度氰氟虫腙处理组(0.1 μmol·L-1和1 μmol·L-1)中,观察到有明显充气的鱼鳔结构(图2(g)~(i),黄圈),而在高浓度(10 μmol·L-1)氰氟虫腙处理的幼鱼中,鱼鳔未充气且不规则的鱼鳔内部填充有大量细胞(图2(j))。
2.4 氰氟虫腙影响鱼鳔标记基因的表达
为了深入探究氰氟虫腙对斑马鱼鱼鳔发育和充气的影响,合成了地高辛标记的鱼鳔标记基因的探针,采用胚胎整体原位杂交实验,检测了氰氟虫腙处理后鱼鳔标记基因的表达水平(图3)。基因pbx1a在发育早期表达于鱼鳔原基[14],与对照组相比,在受精后36 h中浓度、高浓度氰氟虫腙处理组(1 μmol·L-1和10 μmol·L-1)的pbx1a表达的蓝紫色信号强度明显减弱(图3(a)~(d))。
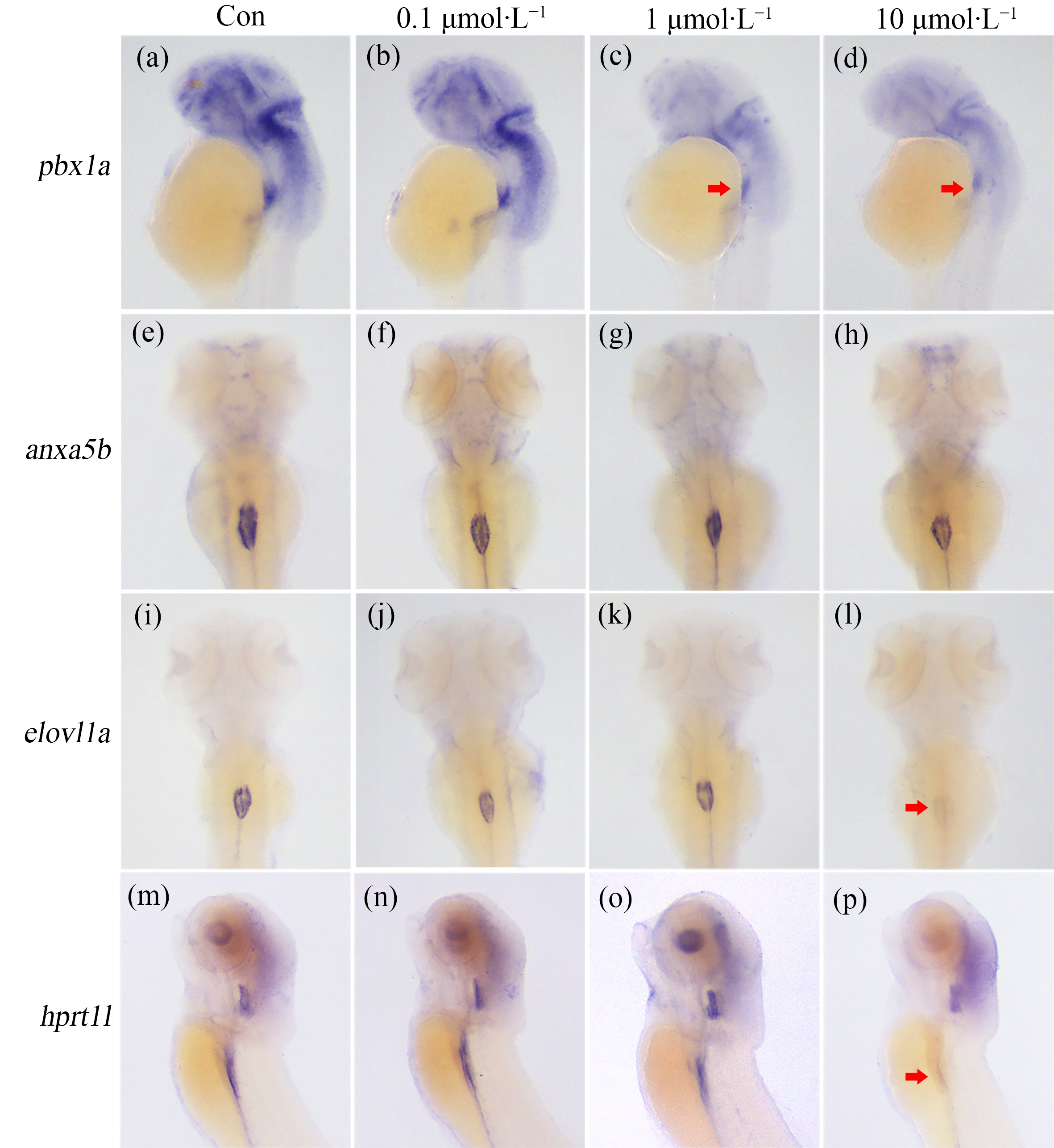
图3 氰氟虫腙影响鱼鳔发育标记基因的表达图式
注:(a)~(d)基因pbx1a在受精后36 h的表达图式,(e)~(h)基因anxa5b在受精后72 h的表达图式,(i)~(l)基因elov1a在受精后72 h的表达图式,(m)~(p)基因hprt1l在受精后72 h的表达图式,(a)~(d)和(m)~(p)是侧视图,(e)~(h)和(i)~(l)是背视图;Con代表DMSO处理的对照组;红色箭头指示信号减弱的位置。
Fig.3 Metaflumizone impairs the expressions of swim bladder markers
Note:(a)~(d) Expression of the pbx1a gene at 36 hpf,(e)~(h) Expression of the anxa5b gene at 72 hpf,(i)~(l) Expression of the elov1a gene at 72 hpf,(m)~(p) Expression of the hprt1l gene at 72 hpf,(a)~(d) and (m)~(p) were lateral views,(e)~(h) and (i)~(l) were dorsal views;Con represents DMSO treated groups;the red arrows indicate the positions where the signals decreased.
基因anxa5b、elovl1a和hprt1l参与鱼鳔的间皮层分化[17,19]。胚胎整体原位杂交实验结果显示在对照组中基因anxa5b、elovl1a和hprt1l均表达于鱼鳔位置(图3(e)~(h)、图3(i)~(l)和图3(m)~(p))。在各个浓度氰氟虫腙处理组中,anxa5b的表达图式都没有发生变化(图3(e)~(h));对于基因elovl1a和hprt1l,高浓度(10 μmol·L-1)处理组中这2个基因的表达量显著下调(图3(i)~(l)和图3(m)~(p))。
3 讨论(Discussion)
杀虫剂在使用过程中可能会通过地表径流或淋洗进入水体,对包括鱼类在内的水生生物构成威胁[9,20]。氰氟虫腙作为缩氨基脲类杀虫剂,它通过阻断神经元钠离子通道来抵御虫害[1,21],近来氰氟虫腙已在多个国家获得批准登记,并开始广泛用于农作物病虫害的防治[22]。目前尚没有关于氰氟虫腙对水生生物毒性的相关研究报道。冯青等[7]和俞瑞鲜等[23]报道了与氰氟虫腙作用机理相同的农药茚虫威对模式生物斑马鱼的发育毒性研究,暗示该类药物流入水环境势必会对水生生物造成严重危害。在本研究中,以斑马鱼为研究对象,将斑马鱼胚胎暴露于氰氟虫腙中,初步评估了氰氟虫腙的发育毒性效应,该研究结果将为氰氟虫腙对鱼类的毒性评估提供重要依据。
在本研究中,使用的氰氟虫腙药物浓度(0.1、1和10 μmol·L-1)不会引起斑马鱼胚胎或幼鱼死亡,但会延迟孵化(图1(a)和图1(b)),在畸形方面除在受精后96 h观察到鱼鳔发育畸形之外,在整个暴露过程中均未观察到常见的心包水肿、卵黄囊肿和脊椎弯曲等现象(图1(c)和图2(a)~(e))。鱼鳔的发育是受到机体严格调控的一个复杂过程,作为有鳔鱼类的重要器官,其主要功能是保持浮力、感知声音和辅助呼吸等[24-25]。鱼鳔的发育对化学污染物极其敏感,近年来,越来越多的研究报道称环境污染物(如重金属、磺胺嘧啶、双酚AF和四溴双酚A等)的暴露会影响鱼鳔正常发育并最终引起鱼鳔充气异常等现象[26-30]。幼鱼组织病理切片染色结果显示高浓度(10 μmol·L-1)氰氟虫腙暴露后有大量细胞填充于未成形的鱼鳔结构中,这一现象与环境污染物如重金属铜或杀虫剂溴氰菊酯暴露所引起的鱼鳔充气异常现象类似[31-32]。因此,这些结果暗示氰氟虫腙可能与铜或溴氰菊酯一样,能特异性干扰斑马鱼鱼鳔的发育过程,然而具体影响仍有待进一步探究。
斑马鱼的鱼鳔发育过程主要包括3个阶段,即出芽阶段(受精后36~65 h)、伸长阶段(受精后65~96 h)和充气阶段(受精后96~120 h)[19]。基因pbx1a最早于受精后28 h表达于鱼鳔原基,是鱼鳔早期出芽阶段发育调控的关键基因之一[14]。经氰氟虫腙暴露后,中浓度、高浓度氰氟虫腙(1 μmol·L-1和10 μmol·L-1)暴露组在受精后36 h时pbx1a的表达量都明显减少(图3(a)~(d)),暗示氰氟虫腙暴露后可能在发育早期(受精后36 h)就开始靶向干扰鱼鳔发育。同时,虽然中浓度(1 μmol·L-1)氰氟虫腙暴露在受精后96 h未观察鱼鳔充气异常,但中浓度(1 μmol·L-1)氰氟虫腙暴露却会在发育早期出芽阶段影响pbx1a的表达(图3(c))。基因anxa5b、hprt1l和elovl1a是鱼鳔组织间皮层发育过程中必不可少的基因[17,19]。原位杂交结果显示这些基因在受精后72 h都表达于鱼鳔上,并且经高浓度(10 μmol·L-1)氰氟虫腙处理后上述基因elovl1a和hprt1l的表达量均明显减少(图3(i)~(p))。综上所述,这些结果暗示氰氟虫腙对鱼鳔的影响可能是起始于出芽阶段,随后影响到鱼鳔的伸长阶段,最后影响鱼鳔的充气过程。根据已有研究报道,在发育过程中出现鱼鳔发育受损或充气不全现象将影响有鳔鱼类的游泳性能和沉浮能力,乃至影响后期的生长发育和繁殖等能力[25,33]。因此,氰氟虫腙对非靶标生物斑马鱼的影响不容忽视。
此外,在本研究中还观察到氰氟虫腙暴露后体长略有减少现象(图2(f))。研究报道氧化锌暴露同样会引起斑马鱼鱼鳔面积减少或者充气功能受损,与此同时伴随着一定程度的由于脊椎弯曲引起的斑马鱼幼鱼体长减少现象[34]。因此,推测氰氟虫腙暴露在干扰斑马鱼鱼鳔发育的同时,可能也造成了不同程度的脊椎弯曲从而引起体长改变,然而相关变化的具体原因仍有待进一步分析。
本研究揭示了氰氟虫腙对斑马鱼鱼鳔发育和鱼鳔充气的影响,为水生态环境中氰氟虫腙的风险评估提供了相关的理论数据支撑。有关氰氟虫腙暴露干扰斑马鱼鱼鳔发育和鱼鳔充气的具体分子机制仍需要进一步的研究。
[1] 李鑫.新型杀虫剂氰氟虫腙[J].农药,2007,46(11):774-776
Li X.A new insecticide metaflumizone [J].Agrochemicals,2007,46(11):774-776 (in Chinese)
[2] Salgado V L,Hayashi J H.Metaflumizone is a novel sodium channel blocker insecticide [J].Veterinary Parasitology,2007,150(3):182-189
[3] 刘刚.目前登记的氰氟虫腙产品[J].农药市场信息,2017,6:39
[4] Lewis K A,Tzilivakis J,Warner D J,et al.An international database for pesticide risk assessments and management [J].Human and Ecological Risk Assessment:An International Journal,2016,22(4):1050-1064
[5] Authority E F S.Conclusion on the peer review of the pesticide risk assessment of the active substance metaflumizone [J].EFSA Journal,2013,11(10):3373
[6] Hempel K,Hess F G,Bögi C,et al.Toxicological properties of metaflumizone [J].Veterinary Parasitology,2007,150(3):190-195
[7] 冯青,赖柯华,黄伟康,等.茚虫威对斑马鱼的急性毒性及遗传毒性[J].生态毒理学报,2015,10(4):226-234
Feng Q,Lai K H,Huang W K,et al.Acute and genetic toxicity of indoxacarb to zebrafish(Brachydanio rerio) [J].Asian Journal of Ecotoxicology,2015,10(4):226-234 (in Chinese)
[8] Fan Y M,Feng Q,Lai K H,et al.Toxic effects of indoxacarb enantiomers on the embryonic development and induction of apoptosis in zebrafish larvae (Danio rerio) [J].Environmental Toxicology,2017,32(1):7-16
[9] Schriever C A,Liess M.Mapping ecological risk of agricultural pesticide runoff [J].Science of the Total Environment,2007,384(1-3):264-279
[10] 韩建,何秋霞,韩利文,等.化学污染物对鱼鳔的毒理学研究进展[J].生态毒理学报,2016,11(6):37-43
Han J,He Q X,Han L W,et al.Review on toxicology of chemical pollutants on fish swim bladder [J].Asian Journal of Ecotoxicology,2016,11(6):37-43 (in Chinese)
[11] Lee O,Green J M,Tyler C R.Transgenic fish systems and their application in ecotoxicology [J].Critical Reviews in Toxicology,2015,45(2):124-141
[12] Horzmann K A,Freeman J L.Making waves:New developments in toxicology with the zebrafish [J].Toxicological Sciences,2018,163(1):5-12
[13] Organization for Economic Co-operation and Development (OECD).Test No.212:Fish,short-term toxicity test on embryo and sac-fry stages [R].Paris:OECD,1998
[14] Teoh P H,Shu-Chien A C,Chan W K.Pbx1 is essential for growth of zebrafish swim bladder [J].Developmental Dynamics,2010,239(3):865-874
[15] Yin A,Korzh V,Gong Z Y.Perturbation of zebrafish swim bladder development by enhancing Wnt signaling in Wif1 morphants [J].Biochimica et Biophysica Acta,2012,1823(2):236-244
[16] Bhandari S,Lee J N,Kim Y I,et al.The fatty acid chain elongase,Elovl1,is required for kidney and swim bladder development during zebrafish embryogenesis [J].Organogenesis,2016,12(2):78-93
[17] Yin A,Korzh S,Winata C L,et al.Wnt signaling is required for early development of zebrafish swim bladder [J].PLoS One,2011,6(3):e18431
[18] Thisse C,Thisse B.High-resolution in situ hybridization to whole-mount zebrafish embryos [J].Nature Protocols,2008,3(1):59-69
[19] Winata C L,Korzh S,Kondrychyn I,et al.Development of zebrafish swim bladder:The requirement of Hedgehog signaling in specification and organization of the three tissue layers [J].Developmental Biology,2009,331(2):222-236
[20] Schriever C A,von der Ohe P C,Liess M.Estimating pesticide runoff in small streams [J].Chemosphere,2007,68(11):2161-2171
[21] 杨吉春,吴峤,范玉杰,等.具有杀虫活性的缩氨基脲类化合物的研究进展[J].农药,2010,49(11):781-786,797
Yang J C,Wu Q,Fan Y J,et al.Recent advances on the development of the semicarbazone class insecticides [J].Agrochemicals,2010,49(11):781-786,797 (in Chinese)
[22] 刘广雷,韩文素,姚志刚,等.新型杀虫剂氰氟虫腙作用机理及应用现状[J].河北农业科学,2010,14(8):61-63
Liu G L,Han W S,Yao Z G,et al.Mechanism and application status of new insecticide metaflumizone [J].Journal of Hebei Agricultural Sciences,2010,14(8):61-63 (in Chinese)
[23] 俞瑞鲜,赵学平,吴长兴,等.茚虫威对环境生物的安全性评价[J].农药,2009,48(1):47-49
Yu R X,Zhao X P,Wu C X,et al.Evaluation of indoxacarb to environmental organisms [J].Agrochemicals,2009,48(1):47-49 (in Chinese)
[24] Fänge R.Gas exchange in fish swim bladder [J].Reviews of Physiology,Biochemistry and Pharmacology,1983,97:111-158
[25] Lindsey B W,Smith F M,Croll R P.From inflation to flotation:Contribution of the swim bladder to whole-body density and swimming depth during development of the zebrafish (Danio rerio) [J].Zebrafish,2010,7(1):85-96
[26] Powers C M,Yen J,Linney E A,et al.Silver exposure in developing zebrafish (Danio rerio):Persistent effects on larval behavior and survival [J].Neurotoxicology and Teratology,2010,32(3):391-397
[27] Witeska M,Sarnowski P, ugowska K,et al.The effects of cadmium and copper on embryonic and larval development of ide Leuciscus idus L.[J].Fish Physiology and Biochemistry,2014,40(1):151-163
ugowska K,et al.The effects of cadmium and copper on embryonic and larval development of ide Leuciscus idus L.[J].Fish Physiology and Biochemistry,2014,40(1):151-163
[28] 杨洋,陈亚文,唐天乐,等.双酚AF暴露对胚胎期和幼鱼期斑马鱼的毒性效应[J].环境科学研究,2015,28(8):1219-1226
Yang Y,Chen Y W,Tang T L,et al.Toxic effects of bisphenol AF on zebrafish embryos and larvae [J].Research of Environmental Sciences,2015,28(8):1219-1226 (in Chinese)
[29] 林涛,陈燕秋,陈卫.水体中磺胺嘧啶对斑马鱼的生态毒性效应[J].安全与环境学报,2014,14(3):324-327
Lin T,Chen Y Q,Chen W.Toxic effect of sulfadiazine on the growth of zebrafish embryos in the water body [J].Journal of Safety and Environment,2014,14(3):324-327 (in Chinese)
[30] 白承连,郑易,李星驰,等.四溴双酚A对斑马鱼胚胎发育毒性和神经毒性研究[J].中国药事,2013,27(3):292-297
Bai C L,Zheng Y,Li X C,et al.Developmental and neurobehavioral toxicity of TBBPA in zebrafish embryos [J].Chinese Pharmaceutical Affairs,2013,27(3):292-297 (in Chinese)
[31] Wu Y Q,Li W H,Yuan M R,et al.The synthetic pyrethroid deltamethrin impairs zebrafish (Danio rerio) swim bladder development [J].The Science of the Total Environment,2020,701:134870
[32] Xu J P,Zhang R T,Zhang T,et al.Copper impairs zebrafish swim bladder development by down-regulating Wnt signaling [J].Aquatic Toxicology,2017,192:155-164
[33] Smith F M,Croll R P.Autonomic control of the swim bladder [J].Autonomic Neuroscience,2011,165(1):140-148
[34] 刘涛.纳米氧化锌对斑马鱼鱼鳔发育毒性效应及其机理研究[D].广州:广东工业大学,2020:69-71
Liu T.Toxicities and mechanism of nano-ZnO on swin bladder of zebrafish embryos [D].Guangzhou:Guangdong University of Technology,2020:69-71 (in Chinese)