5-氮杂-2’-脱氧胞嘧啶核苷,又称地西他滨(decitabine,DAC),属于脱氧胞苷类似物,是一种DNA甲基转移酶抑制剂,可通过抑制DNA甲基化转移酶,逆转甲基化过程。作为一种人类用药,其常用于治疗骨髓增生异常综合征和急性髓系白血病[1],且有研究证实,DAC高浓度时具有细胞毒性,低浓度时具有去甲基化作用[2]。近年来作为一种DNA甲基化抑制剂,DAC已开始应用于农业生产、园艺[3]等领域,随着它们使用范围的扩大、使用频率的增加,其进入水体的机会也越来越大,若处理不当,其极有可能传播至水体中,在食物链中积累,危害生物,破坏水生态系统的平衡。
DNA甲基化是一种常见的生物表观遗传修饰现象,植物可通过基因甲基化和去甲基化对基因表达进行调控[4],从而调节植物生长及其对环境的适应能力。DNA甲基化常用于研究高等植物,如拟南芥(Arabidopsis thaliana)[5]、水稻(Oryza sativa)[6]、小麦(Triticum aestivum)[7]和花椰菜(Brassica oleracea)[8]等,其对高等植物的生长与发育有着重要的影响,如株高、开花和结果等[9],且已有多项研究结果表明DNA甲基化能提高植物对于不利条件的耐受能力,如水稻的耐盐能力[6]、马铃薯(Solanum tuberosum)的耐旱能力[10-11]等。藻类作为水生态系统的初级生产者,其种类多样性和初级生产量会直接影响水生态系统的结构与功能,而目前DNA甲基化对水生态系统影响特别是对藻类的毒性研究报道较少[12-14]。
塔玛亚历山大藻(Alexandrium tamarense)和血红哈卡藻(Akashiwo sanguinea)是2种常见的海洋赤潮甲藻,广布于温带和亚热带海域,其大量增殖引发的赤潮会导致多种海洋生物的死亡,其中塔玛亚历山大藻能产生麻痹性贝类毒素(paralytic shellfish poisoning,PSP)[15],且它产生的PSP毒素在已知赤潮毒素中毒性最强、分布最广、威胁性最大。本研究以2种典型赤潮甲藻为研究对象,研究不同浓度DAC对藻细胞生长的影响,并进一步揭示藻细胞内抗氧化系统对不同DAC浓度的响应;通过考察DAC对2种海洋甲藻的毒性和致毒机理,进而评估DAC对海洋初级生产力的潜在影响,为海洋生态系统保护提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
研究所用的塔玛亚历山大藻和血红哈卡藻均取自于暨南大学生态学系藻种室;所用的DAC为分析纯,CAS号为320-67-2,纯度99%,购自江苏艾康生物医药研发有限公司。使用由“HEKA CORAL”天然海盐配制的f/2去硅培养基培养,调节培养液盐度(30±1)‰,pH 7.6±0.1;培养条件为:温度(20±1) ℃,光照强度150 μE·m-2·s-1,光暗比为L∶D=12 h∶12 h。
1.2 实验方法
根据预备实验结果,得到对藻细胞生长具有梯度抑制作用的浓度组。设置了5个实验组和1个对照组,每组设3个重复,DAC浓度依次为0(对照组)、0.01、0.05、0.1、0.5和1 mmol·L-1。
实验在规格为150 mL的三角瓶中进行,先加入100 mL培养基,再加入已到达对数生长期的初始密度分别为0.33×104cells·mL-1和1.34×104 cells·mL-1的血红哈卡藻和塔玛亚历山大藻藻液。添加DAC母液配制成设定浓度的试验液,实验条件与甲藻的培养条件一致。实验周期为96 h,在实验进行前(0 h)及培养的24、48和96 h取样,对藻细胞进行计数,并制备藻细胞匀浆用于抗氧化指标的测定。
1.3 可溶性蛋白的测定
可溶性蛋白的测定用南京建成生物工程研究所试剂盒进行测定,具体操作依照试剂盒说明书步骤进行。在96孔细胞培养板中分别加入待测细胞匀浆(测定管)和蒸馏水(对照管)各10 μL,然后按顺序加入测试盒相关的反应试剂,旋涡混合器(Vortex-5,上海达姆实业有限公司,中国)充分混匀后于恒温箱37℃孵育40 min,于波长562 nm处,用酶标仪(MK3,Thermo,美国)测定各孔吸光度值。可溶性蛋白浓度以mg·10-6 cells表示。
1.4 超氧化物歧化酶(SOD)的测定
SOD活性的测定用南京建成生物工程研究所试剂盒进行测定,具体操作依照试剂盒说明书步骤进行。在15 mL测定管中分别加入待测细胞匀浆(测定管)和蒸馏水(对照管)各50 μL,然后按顺序加入测试盒相关的反应试剂,旋涡混合器充分混匀后于生化培养箱(SHH-250,上海予卓仪器有限公司,中国)37℃孵育40 min,然后加入按测试盒要求配好的显色剂2 mL,混匀后室温放置10 min,最后取200 μL至96孔细胞培养板,于波长550 nm处,用酶标仪测定各孔吸光度值。
SOD活性单位定义:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活性单位(U),SOD活性以单位细胞酶活性U·10-6 cells来表示。
1.5 谷胱甘肽(GSH)的测定
GSH含量的测定利用南京建成生物工程研究所试剂盒进行测定,具体操作依照试剂盒说明书步骤进行。取100 μL细胞匀浆与100 μL测试盒试剂(沉淀剂)混匀,用高速离心机(5804R,Eppendorf,德国)以转速3 500 r·min-1离心10 min,取上清液待测,向96孔细胞培养板加入待测上清液(测定孔)、沉淀剂(空白孔)和20 μmol·L-1标准品(标准孔)各100 μL,然后按顺序加入测试盒相关的反应试剂,充分混匀后室温静置5 min,于波长405 nm处,用酶标仪测定各孔吸光度值。藻细胞内GSH含量以nmol·10-6 cells表示。
1.6 丙二醛(MDA)的测定
MDA含量的测定用南京建成生物工程研究所试剂盒进行测定,具体操作依照试剂盒说明书步骤进行。在15 mL测定管中分别加入待测细胞匀浆(测定管和对照管)、无水乙醇(空白管)和10 nmol·mL-1标准品(标准管)各100 μL,然后按顺序加入测试盒相关的反应试剂,旋涡混合器混匀,保鲜膜扎紧管口并用刺针刺一小口,95℃水浴40 min,取出后流水冷却,用高速离心机以转速4 000 r·min-1离心10 min,取200 μL上清液至96孔细胞培养板,于波长532 nm处,用酶标仪测定各孔吸光度值。MDA活性以nmol·10-6 cells来表示。
1.7 数据处理
1.7.1 特定生长率
μ(d-1)=(ln(N2/N1))/(t2-t1)
式中:N2和N1分别为t2和t1时的藻细胞数量。
1.7.2 抑制率
IR=(1-Nt/N0)×100%
式中:IR为抑制率(%),Nt为培养96 h后实验组的藻细胞密度(cells·mL-1),N0为同样时间对照组的藻细胞密度(cells·mL-1)。
1.7.3 96 h半效应浓度(EC50)
生长抑制百分率(EC)是指对藻细胞特定生长率的抑制百分率,其计算公式为:
EC=(μc-μt)/μc×100%
式中:μc是对照组96 h内的特定生长率,μt是各实验组96 h内的特定生长率。EC50值采用抑制生长百分率的概率单位-浓度对数直线回归法进行计算。
1.8 统计与分析
利用Microsoft Excel 2013对实验结果进行统计,结果均为平均值±标准差。利用SPSS 20.0软件中的单因素方差分析(One-way ANOVA)的多重比较(LSD法)对不同培养条件下藻细胞内各抗氧化指标进行差异显著性分析。
2 结果与分析(Results and analysis)
2.1 DAC对2种甲藻生长的影响
经过96 h培养后,2种甲藻细胞密度虽有不同程度的增长,但均受到了DAC的抑制,其中对血红哈卡藻的抑制效果更明显。DAC浓度在0~0.5 mmol·L-1浓度范围内塔玛亚历山大藻呈现出一定的浓度-效应关系。暴露96 h后,当DAC浓度位于0~0.5 mmol·L-1区间时,DAC浓度越高,其对塔玛亚历山大藻的抑制效果越强,而浓度范围在0.5~1 mmol·L-1时,DAC对塔玛亚历山大藻的抑制效果有所减弱(图1(a))。在DAC暴露下,血红哈卡藻的生长受到明显抑制,各实验组在96 h时的藻细胞密度显著低于对照组(P<0.05),且DAC浓度越高,其对血红哈卡藻的抑制作用越强(图1(b))。

图1 不同浓度地西他滨(DAC)对2种甲藻生长的影响
注:(a)塔玛亚历山大藻;(b)血红哈卡藻。
Fig.1 The growth of two algae under the exposure of decitabine (DAC) with different concentrations
Note:(a) Al. tamarense;(b) Ak. sanguinea.
通过概率单位-浓度对数直线回归法进行计算,得出DAC对血红哈卡藻生长的96 h-EC50为0.0016 mmol·L-1 (0.37 mg·L-1),对塔玛亚历山大藻的96 h-EC50为0.116 mmol·L-1 (26.47 mg·L-1)。根据《新化学物质危害评估导则》(HJ/T154—2004)[16]中的评判标准(表1),DAC对血红哈卡藻的急性毒性属于极高毒性等级,对塔玛亚历山大藻的急性毒性属于中毒性等级。
表1 生态毒理学危害性分级[16]
Table 1 Classification of ecotoxicology hazard[16]

数据项目Data items危害性分级(赋分值) Hazard classification (scoring value)极高(3)Extremely high (3)高(2)High (2)中(1) Secondary (1)低(0)Low (0)急性毒性LC50/EC50/(mg·L-1)Acute toxicity LC50/EC50/(mg·L-1)≤11~1010~100>100
2.2 DAC对2种甲藻细胞各抗氧化指标的影响
2.2.1 可溶性蛋白
2种甲藻细胞可溶性蛋白含量随DAC处理浓度和处理时间的差异而不同,整体上DAC对2种甲藻细胞可溶性蛋白含量有较明显的促进作用,其中对血红哈卡藻的促进效果更明显(图2)。实验期间塔玛亚历山大藻对照组的可溶性蛋白含量基本无变化;DAC处理组中的0.01 mmol·L-1和0.1 mmol·L-1组呈现出先升后降的趋势,分别在24 h和48 h达到峰值;而0.05 mmol·L-1组是波状上升,0.5 mmol·L-1和1.0 mmol·L-1这2个高浓度组的可溶性蛋白含量则呈稳步上升趋势,均在96 h时达到最大值;96 h时,各中、高浓度处理组(>0.1 mmol·L-1)的可溶性蛋白含量均显著高于对照组(P<0.01,图2(a))。随时间延长,血红哈卡藻细胞对照组的可溶性蛋白含量略有波动,DAC处理组中的0.01 mmol·L-1和0.05 mmol·L-1这2个低浓度组整体上呈现出先下降(0~24 h)后上升(24~96 h)的趋势,而其余3个中、高浓度实验组则呈现稳步上升的趋势;96 h时对照组血红哈卡藻细胞的可溶性蛋白含量显著低于1 mmol·L-1组(P<0.01),显著低于其他处理组(P<0.05,图2(b))。
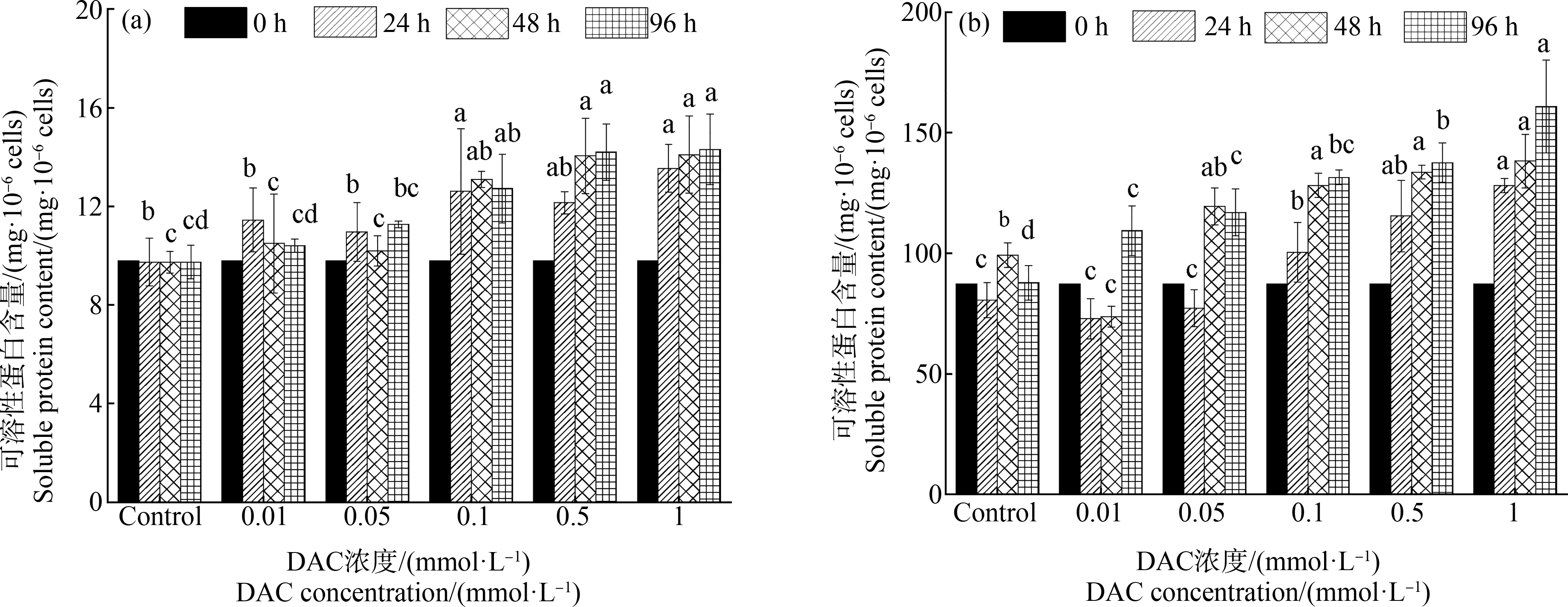
图2 不同浓度DAC对2种甲藻可溶性蛋白含量的影响
注:(a)塔玛亚历山大藻,(b)血红哈卡藻;同一时间不同DAC浓度条柱上的不同字母表示同一时间不同浓度处理组间差异显著,P<0.05。
Fig.2 The content of soluble protein in two algae under the exposure of DAC with different concentrations
Note:(a) Al. tamarense,(b) Ak. sanguinea;different letters at different DAC concentrations in the same time indicate significant differences,P<0.05.
2.2.2 超氧化物歧化酶(SOD)活性
随着实验的进行,塔玛亚历山大藻对照组的SOD活性逐渐下降,而各DAC处理组则呈现出先升后降的趋势:均在24 h时达到各组相对峰值,然后逐渐下降且都在96 h时达到最小值;96 h时对照组的SOD活性显著高于各中、低DAC浓度组(<0.1 mmol·L-1,P<0.05),而与中、高浓度组无显著差异(图3(a))。与塔玛亚历山大藻不同,DAC对血红哈卡藻细胞的SOD活性有一定的促进作用,实验过程中血红哈卡藻对照组的SOD活性略有升高,但变化不显著(P>0.05),而各处理组则均呈现先升后降且在24 h时达到顶点的趋势;96 h时血红哈卡藻对照组的SOD活性显著低于0.05 mmol·L-1和1 mmol·L-1组(P<0.05),而略低于其他实验组(图3(b))。
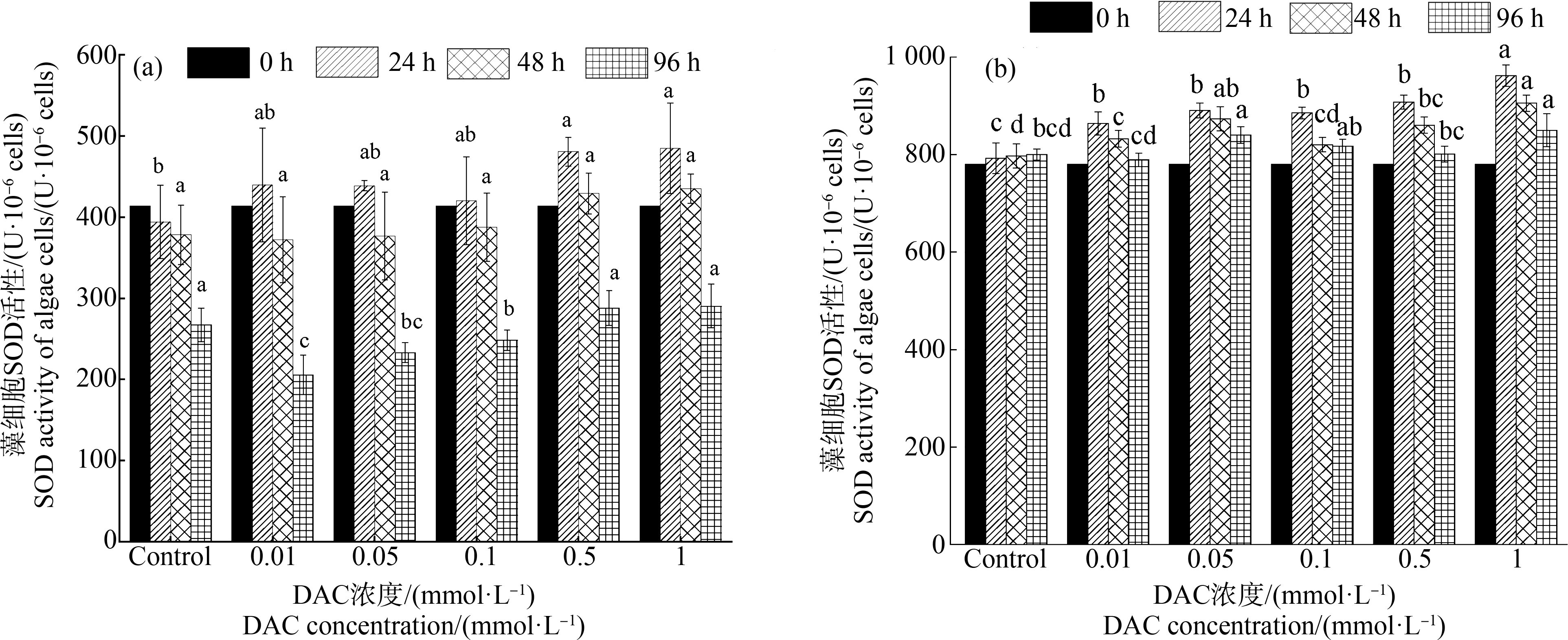
图3 不同浓度DAC对2种甲藻细胞超氧化物歧化酶(SOD)活性的影响
注:(a)塔玛亚历山大藻,(b)血红哈卡藻;同一时间不同DAC浓度条柱上的不同字母表示同一时间不同浓度处理组间差异显著,P<0.05。
Fig.3 Superoxide dismutase (SOD) activity in two algae under the exposure of DAC with different concentrations
Note:(a) Al. tamarense,(b) Ak. sanguinea;different letters at different DAC concentrations in the same time indicate significant differences,P<0.05.
2.2.3 谷胱甘肽(GSH)含量
DAC对藻细胞GSH生成具有促进作用,且对血红哈卡藻细胞GSH的促进作用更为明显(图4)。整体上塔玛亚历山大藻各组藻细胞GSH含量呈现先升后降、在24 h时达到最大值的趋势,其中对照组与0.01 mmol·L-1和0.05 mmol·L-1这2个低浓度组的变化规律一致,而0.5 mmol·L-1和1 mmol·L-1这2个高浓度组的变化规律相似;96 h时对照组的GSH含量显著低于3个中、高浓度实验组(P<0.05)(图4(a))。DAC显著促进了血红哈卡藻细胞GSH含量的生成,整体上各处理组与对照组的GSH含量变化一致,呈现出稳步升高、且均在96 h时达到最大值的趋势,96 h时血红哈卡藻对照组的GSH含量显著低于除0.01 mmol·L-1组之外的其他各浓度组(P<0.01,图4(b))。

图4 不同浓度DAC对2种甲藻细胞谷胱甘肽(GSH)含量的影响
注:(a)塔玛亚历山大藻,(b)血红哈卡藻;同一时间不同DAC浓度条柱上的不同字母表示同一时间不同浓度处理组间差异显著,P<0.05。
Fig.4 Variation of glutathione (GSH) content in two algae under the exposure of DAC with different concentrations
Note:(a) Al. tamarense,(b) Ak. sanguinea;different letters at different DAC concentrations in the same time indicate significant differences,P<0.05.
2.2.4 丙二醛(MDA)含量
藻细胞MDA含量是指示细胞内膜脂氧化程度的重要指标,所有实验组在DAC暴露初期藻细胞MDA含量就出现明显上升,并且随浓度增加而增大,血红哈卡藻则呈现出明显的浓度-效应关系(图5)。塔玛亚历山大藻各处理组与对照组整体变化一致,呈现出先升后降、24 h达到峰值,其后逐渐下降且均在96 h时出现最低值的趋势;96 h时对照组藻细胞MDA含量显著低于1 mmol·L-1浓度组(P<0.05,图5(a))。血红哈卡藻各DAC浓度组藻细胞MDA含量整体上先升后降,对照组和高DAC浓度组藻细胞MDA含量在24 h达到最大值,而0.01 mmol·L-1和0.1 mmol·L-1浓度组的最大值出现于48 h;96 h时对照组的MDA含量显著低于各中、高DAC浓度组(>0.5 mmol·L-1,P<0.05,图5(b))。

图5 不同浓度DAC对2种甲藻细胞丙二醛(MDA)含量的影响
注:(a)塔玛亚历山大藻,(b)血红哈卡藻;同一时间不同DAC浓度条柱上的不同字母表示同一时间不同浓度处理组间差异显著,P<0.05。
Fig.5 Variation of malondialdehyde (MDA) content in two algae under the exposure of DAC with different concentrations
Note:(a) Al. tamarense,(b) Ak. sanguinea;different letters at different DAC concentrations in the same time indicate significant differences,P<0.05.
3 讨论(Discussion)
不同藻类对DAC暴露的耐受能力不同,莱茵衣藻(Chlamydomonas reinhardtii)暴露在浓度为10 μmol·L-1的DAC下,虽然生物量浓度在第1天下降,但随着时间延长而持续增大,在第5天接近对照组;而四尾栅藻(Scenedesmus quadricauda)对DAC的耐受能力较差,生物量在第1天下降,1~3 d内有所增加,但第3天后大幅度下降,最终降至暴露前的初始生物量水平[14]。本研究中,不同浓度DAC对2种赤潮甲藻的生长均有较强的抑制作用,且呈现出明显的剂量-效应和时间-效应关系,因此需要防范其对海洋环境特别是海洋初级生产力的影响。
DAC是甲基转移酶抑制剂,分子结构上有一个醌基,具有诱导产生活性氧物质(reactive oxygen species,ROS)的可能,而活性氧中的![]() 作为活性最强、毒性最高的ROS组分,是醌类物质细胞致毒的重要途径[17],在细胞中有很强的毒害作用[18],其毒性会引起细胞产生氧化损伤和膜损伤,导致藻细胞的抗氧化系统被激活,以保持膜的完整性,适应不利的环境条件[19]。因此DAC能影响藻细胞的抗氧化酶活性以及非酶性抗氧化物质的含量。可溶性蛋白是存在于细胞中的非膜结合蛋白体系,在植物体内有贮存营养、抵抗极端环境等作用,蛋白质是生物体内一种重要的结构物质和营养物质,生物体内的可溶性蛋白多为各种酶,参与细胞代谢等活动,其含量变化直接反映了细胞代谢水平的变化[20]。在逆境条件下,植物体内正常蛋白合成代谢等受到影响,但也会有新的蛋白生成以应对逆境条件。本研究中,2种甲藻在DAC暴露下可溶性蛋白含量迅速上升,其中高浓度组在暴露初期就显著上升,而低浓度组响应时间略长。这都表明,在DAC暴露下,藻细胞启动体内机制,合成更多酶或者其他物质,以抵御DAC胁迫,调节藻细胞的代谢,适应外界变化。
作为活性最强、毒性最高的ROS组分,是醌类物质细胞致毒的重要途径[17],在细胞中有很强的毒害作用[18],其毒性会引起细胞产生氧化损伤和膜损伤,导致藻细胞的抗氧化系统被激活,以保持膜的完整性,适应不利的环境条件[19]。因此DAC能影响藻细胞的抗氧化酶活性以及非酶性抗氧化物质的含量。可溶性蛋白是存在于细胞中的非膜结合蛋白体系,在植物体内有贮存营养、抵抗极端环境等作用,蛋白质是生物体内一种重要的结构物质和营养物质,生物体内的可溶性蛋白多为各种酶,参与细胞代谢等活动,其含量变化直接反映了细胞代谢水平的变化[20]。在逆境条件下,植物体内正常蛋白合成代谢等受到影响,但也会有新的蛋白生成以应对逆境条件。本研究中,2种甲藻在DAC暴露下可溶性蛋白含量迅速上升,其中高浓度组在暴露初期就显著上升,而低浓度组响应时间略长。这都表明,在DAC暴露下,藻细胞启动体内机制,合成更多酶或者其他物质,以抵御DAC胁迫,调节藻细胞的代谢,适应外界变化。
在逆境胁迫下,植物体内也能产生大量的ROS[21],其往往能够导致细胞膜系统的损害及生物大分子结构的破坏等,因此生物形成了抗氧化系统来抵抗这类危害,而SOD就是第一道防线,其能够通过歧化反应控制![]() 量,维持生物体内的正常代谢活动[22]。本研究中,在DAC暴露下,2种甲藻细胞SOD活性在24 h内就迅速上升并达到最高值,其后塔玛亚历山大藻迅速下降,而血红哈卡藻轻微下降,并随暴露时间的延长仍保持在一个相对高位。这表明,在DAC暴露下,2种甲藻细胞能迅速启动SOD,以清除DAC胁迫下产生的过量
量,维持生物体内的正常代谢活动[22]。本研究中,在DAC暴露下,2种甲藻细胞SOD活性在24 h内就迅速上升并达到最高值,其后塔玛亚历山大藻迅速下降,而血红哈卡藻轻微下降,并随暴露时间的延长仍保持在一个相对高位。这表明,在DAC暴露下,2种甲藻细胞能迅速启动SOD,以清除DAC胁迫下产生的过量![]() 防止细胞遭受严重损害,维持细胞正常生命活动。而塔玛亚历山大藻的SOD变化对DAC更为敏感,在长时间DAC暴露下,DAC的危害作用已经超过了藻细胞的调节能力,细胞内的酶系统受到损害,SOD活性降低,这可能也是本研究中48 h暴露后塔玛亚历山大藻细胞SOD活性显著降低的主要原因。
防止细胞遭受严重损害,维持细胞正常生命活动。而塔玛亚历山大藻的SOD变化对DAC更为敏感,在长时间DAC暴露下,DAC的危害作用已经超过了藻细胞的调节能力,细胞内的酶系统受到损害,SOD活性降低,这可能也是本研究中48 h暴露后塔玛亚历山大藻细胞SOD活性显著降低的主要原因。
GSH与SOD一样,也是生物体内的一种重要的抗氧化物,能够有效清除![]() 和脂质过氧化物(LOOH)等物质,其含量在抗氧化过程中往往是下降的趋势[23],而GSH含量的降低是一种潜在的凋亡早期激活信号,随后产生的氧自由基能促使细胞发生凋亡[24-25]。另有研究表明,GSH含量在细胞内处于动态平衡,一方面作为反应底物被氧化而减少,另一方面由于谷胱甘肽还原酶(GR)的作用而重新产生[26]。本研究中,塔玛亚历山大藻GSH对DAC暴露的响应迅速而敏感,暴露24 h即可达到最高值,然后逐渐下降,但中、高浓度处理组(>0.1 mmol·L-1)的GSH含量一直都高于对照组;在低浓度DAC暴露初期,血红哈卡藻GSH含量未明显增加,随着暴露时间的延长及DAC浓度的升高,则呈现出明显的剂量-效应与时间-效应关系,表明血红哈卡藻GSH对中高浓度DAC的响应更为敏感。因此,DAC对2种海洋甲藻特别是对血红哈卡藻的GSH主要起诱导促生成作用,即在SOD等抗氧化酶受到抑制时,仍能发挥其抗氧化作用。2种甲藻比较而言,塔玛亚历山大藻对DAC胁迫更为耐受,受到一定程度的DAC胁迫时机体抗氧化方面主要启动SOD,无需诱导生成太多GSH发挥作用;而血红哈卡藻则相反,主要依靠GSH,需要GSH不断被诱导产生以发挥其抗氧化作用,也有可能是藻细胞所受到的氧化胁迫已经超过了SOD的调节能力,导致SOD活性下降[27]。这一点还需要后续进行更深入研究以佐证。
和脂质过氧化物(LOOH)等物质,其含量在抗氧化过程中往往是下降的趋势[23],而GSH含量的降低是一种潜在的凋亡早期激活信号,随后产生的氧自由基能促使细胞发生凋亡[24-25]。另有研究表明,GSH含量在细胞内处于动态平衡,一方面作为反应底物被氧化而减少,另一方面由于谷胱甘肽还原酶(GR)的作用而重新产生[26]。本研究中,塔玛亚历山大藻GSH对DAC暴露的响应迅速而敏感,暴露24 h即可达到最高值,然后逐渐下降,但中、高浓度处理组(>0.1 mmol·L-1)的GSH含量一直都高于对照组;在低浓度DAC暴露初期,血红哈卡藻GSH含量未明显增加,随着暴露时间的延长及DAC浓度的升高,则呈现出明显的剂量-效应与时间-效应关系,表明血红哈卡藻GSH对中高浓度DAC的响应更为敏感。因此,DAC对2种海洋甲藻特别是对血红哈卡藻的GSH主要起诱导促生成作用,即在SOD等抗氧化酶受到抑制时,仍能发挥其抗氧化作用。2种甲藻比较而言,塔玛亚历山大藻对DAC胁迫更为耐受,受到一定程度的DAC胁迫时机体抗氧化方面主要启动SOD,无需诱导生成太多GSH发挥作用;而血红哈卡藻则相反,主要依靠GSH,需要GSH不断被诱导产生以发挥其抗氧化作用,也有可能是藻细胞所受到的氧化胁迫已经超过了SOD的调节能力,导致SOD活性下降[27]。这一点还需要后续进行更深入研究以佐证。
MDA是细胞膜脂质过氧化的产物,也是衡量膜脂质过氧化程度的一个重要指标[28],其含量的高低能反映细胞的损害程度以及细胞在逆境条件下耐受能力的强弱。本研究中在DAC暴露下,血红哈卡藻和塔玛亚历山大藻MDA含量均出现明显上升趋势,而且呈现出一定的剂量-效应关系,其中血红哈卡藻MDA含量对DAC的响应更为敏感。但2种藻细胞MDA含量均在暴露后的24 h达到最大值,随后逐渐下降,这可能是由于随着暴露时间的延长,藻类细胞逐渐适应了毒害环境,加之SOD活性的增大及GSH诱导作用的加强,及时清除了一部分ROS,对细胞膜起到了一定的保护作用[29-30],使生物膜所受损害有所降低;此外,随着时间延长,DAC会有一定程度的降解和吸附,实验液中DAC浓度下降,毒性也随之降低[31],因此,MDA含量在暴露短时间内达到峰值后会逐渐回落。
2种实验甲藻中,塔玛亚历山大藻属于甲藻门膝沟藻目亚历山大藻属,其细胞表层覆有坚硬厚实的细胞壁,可有效阻止或减少DAC等胁迫因子进入细胞内而破坏细胞器,同时也有效减少了DAC的醌基诱导藻细胞产生大量ROS毒害的可能;而血红哈卡藻属于甲藻门多甲藻目裸甲藻属,细胞体表没有坚实的细胞壁,对DAC胁迫的保护能力较弱,这可能是本研究中血红哈卡藻对DAC胁迫更为敏感的主要原因。本研究中随着DAC浓度增加、暴露时间延长,2种甲藻细胞生长均受到明显抑制,DAC分子结构上的醌基能诱导大量ROS生成,同时在逆境胁迫下藻细胞SOD活性的抑制、GSH诱导作用的增强及膜脂过氧化可能是DAC抑制2种实验甲藻特别是血红哈卡藻的生长并对其产生一定致毒作用的重要原因。相较而言,血红哈卡藻对DAC胁迫更为敏感,其GSH和MDA含量变化敏感,呈现出明显的剂量-效应和时间-效应关系,可以作为监测DAC环境污染的生物标记指标之一。
[1] 王娜.地西他滨治疗骨髓增生异常综合征和急性髓系白血病的临床观察[J].临床医药文献电子杂志,2019,6(67):162-163
[2] Issa J P J,Gharibyan V,Cortes J,et al.Phase Ⅱ study of low-dose decitabine in patients with chronic myelogenous leukemia resistant to imatinibmesylate [J].Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,2005,23(17):3948-3956
[3] 赵文淇.姜黄素和地西他滨对菊花DNA甲基化和生长发育的影响[D].开封:河南大学,2015:28-31
Zhao W Q.Effects of curcumin anddecitabine on the DNA methylation and development of Chrysanthemum [D].Kaifeng:Henan University,2015:28-31 (in Chinese)
[4] Sheldon C C,Burn J E,Perez P P,et al.The FLF MADS box gene:A repressor of flowering in Arabidopsis regulated by vernalization and methylation [J].The Plant Cell,1999,11(3):445-458
[5] 王子成,马洪霞,何艳霞.重金属镉对拟南芥DNA甲基化的影响[J].植物生理学通讯,2009,45(2):115-118
Wang Z C,Ma H X,He Y X.Effects of cadmium on Arabidopsis thaliana DNA methylation [J].Plant Physiology Communications,2009,45(2):115-118 (in Chinese)
[6] Akimoto K,Katakami H,Kim H J,et al.Epigenetic inheritance in rice plants [J].Annals of Botany,2007,100(2):205-217
[7] 陈芳,王子成.5-氮杂胞苷对小麦生长发育及DNA甲基化的影响[J].河南大学学报:自然科学版,2011,41(1):61-66
Chen F,Wang Z C.Effects of 5-azaC on development and DNA methylation in wheat [J].Journal of Henan University:Natural Science,2011,41(1):61-66 (in Chinese)
[8] 袁建民,木万福,麻继仙,等.DNA甲基化抑制剂5-azaC对花椰菜生长发育的影响[J].江西农业学报,2018,30(2):42-45
Yuan J M,Mu W F,Ma J X,et al.Effects of DNA methylation inhibitor 5-azaC on growth and development of cauliflower [J].Acta Agriculturae Jiangxi,2018,30(2):42-45 (in Chinese)
[9] Kondo H,Miura T,Wada K C,et al.Induction of flowering by 5-azacytidine in some plant species:Relationship between the stability of photoperiodically induced flowering and flower-inducing effect of DNA demethylation [J].Physiologia Plantarum,2007,131(3):462-469
[10] 李鹏程,毕真真,梁文君,等.DNA甲基化参与调控马铃薯干旱胁迫响应[J].作物学报,2019,45(10):1595-1603
Li P C,Bi Z Z,Liang W J,et al.DNA methylation involved in regulating drought stress response of potato [J].Acta Agronomica Sinica,2019,45(10):1595-1603(in Chinese)
[11] 李鹏程,毕真真,孙超,等.DNA甲基化参与调控马铃薯响应干旱胁迫的关键基因挖掘[J].作物学报,2021,47(4):599-612
Li P C,Bi Z Z,Sun C,et al.Key genes mining of DNA methylation involved in regulating drought stress response in potato [J].Acta Agronomica Sinica,2021,47(4):599-612 (in Chinese)
[12] 孙琰晴,陈亚男,郝明梅,等.无机砷As(Ⅲ、Ⅴ)对牟氏角毛藻生长、叶绿素荧光特性及基因组DNA甲基化水平的影响[J].海洋湖沼通报,2021(1):85-90
Sun Y Q,Chen Y N,Hao M M,et al.Effects of inorganic arsenic As (Ⅲ,Ⅴ) exposure on the growth,chlorophyll fluorescence parameters and genomic DNA methylation of Chaetocerosmulleri [J].Transactions of Oceanology and Limnology,2021(1):85-90 (in Chinese)
[13] 陶虎春,阳赛,丁凌云,等.两种赤潮藻对汞富集和甲基化影响的研究[J].北京大学学报:自然科学版,2019,55(4):709-716
Tao H C,Yang S,Ding L Y,et al.Study on the effect of two red-tide algae on mercury biocondensation and methylation [J].Acta Scientiarum Naturalium Universitatis Pekinensis,2019,55(4):709-716 (in Chinese)
[14] Bacova R,Klejdus B,Ryant P,et al.The effects of 5-azacytidine and cadmium on global 5-methylcytosine content and secondary metabolites in the freshwater microalgae Chlamydomonas reinhardtii and Scenedesmusquadricauda [J].Journal of Phycology,2019,55(2):329-342
[15] 梁忠秀,李健,谭志军,等.塔玛亚历山大藻对中国明对虾肝胰腺及鳃SOD、GST和MDA的影响[J].水产学报,2013,37(8):1192-1197
Liang Z X,Li J,Tan Z J,et al.Effects of the toxic dinoflagellate Alexandrium tamarense on MDA,SOD and GST in hepatopancreas and gill of Fenneropenaeuschinensis [J].Journal of Fisheries of China,2013,37(8):1192-1197 (in Chinese)
[16] 国家环境保护总局.新化学物质危害评估导则:HJ/T 154—2004[S].北京:国家环境保护总局,2014
[17] 张文晓,尚静,郜鑫,等.1,4-萘醌老化黑碳对人支气管上皮细胞活性氧和DNA链断裂的影响[J].北京大学学报:医学版,2015,47(4):690-696
Zhang W X,Shang J,Gao X,et al.Effect of 1,4-naphthoquinone aged black carbon on reactive oxygen species and DNA strand breaks in human bronchial epithelial cells [J].Journal of Peking University:Health Sciences,2015,47(4):690-696 (in Chinese)
[18] Farber J L.Mechanisms of cell injury by activated oxygen species [J].Environmental Health Perspectives,1994,102(Suppl.10):17-24
[19] 胡智泉,肖波,刘永定.微囊藻毒素对束丝藻细胞生长和抗氧化系统的影响[J].生态毒理学报,2008,3(4):377-382
Hu Z Q,Xiao B,Liu Y D.Effects of microcystin-LR on the growth and antioxidant systems in Aphanizomenon sp.DC01 cells [J].Asian Journal of Ecotoxicology,2008,3(4):377-382(in Chinese)
[20] Kumar S,Habib K,Fatma T.Endosulfan induced biochemical changes in nitrogen-fixing cyanobacteria [J].Science of the Total Environment,2008,403(1-3):130-138
[21] Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation [J].The New Phytologist,1993,125(1):27-58
[22] Beyer W,Imlay J,Fridovich I.Superoxide dismutases [J].Progress in Nucleic Acid Research and Molecular Biology,1991,40:221-253
[23] 李燕,朱琳,刘硕.铅、汞单一及联合胁迫对栅藻的生长、GSH含量及相关酶活性的影响[J].环境科学,2009,30(1):248-253
Li Y,Zhu L,Liu S.Individual and joint stress of lead and mercury on growth,glutathione and glutathione-related enzymes of Scenedesmusquadricauda [J].Environmental Science,2009,30(1):248-253 (in Chinese)
[24] Armstrong J S,Steinauer K K,Hornung B,et al.Role of glutathione depletion and reactive oxygen species generation in apoptotic signaling in a human B lymphoma cell line [J].Cell Death and Differentiation,2002,9(3):252-263
[25] Li X Y,Liu Y D,Song L R,et al.Responses of antioxidant systems in the hepatocytes of common carp (Cyprinus carpio L.) to the toxicity of microcystin-LR [J].Toxicon:Official Journal of the International Society on Toxinology,2003,42(1):85-89
[26] 王辅明,朱祥伟,马永鹏,等.低浓度五氯酚暴露对稀有鮈鲫体内SOD活性、GSH和HSP70含量的影响[J].生态毒理学报,2009,4(3):415-421
Wang F M,Zhu X W,Ma Y P,et al.Effects of low concentration of pentachlorophenol exposure on SOD activity,GSH and HSP70 content in rare minnow(Gobiocyprisrarus) [J].Asian Journal of Ecotoxicology,2009,4(3):415-421 (in Chinese)
[27] 王执伟.水中溴酸盐的急性生物毒性及致毒机理[D].哈尔滨:哈尔滨工业大学,2016:73-79
Wang Z W.The acute biological toxicity and toxic mechanism of bromate inwater[D].Harbin:Harbin Institute of Technology,2016:73-79 (in Chinese)
[28] Li M,Hu C W,Zhu Q,et al.Copper and zinc induction of lipid peroxidation and effects on antioxidant enzyme activities in the microalga Pavlova viridis (Prymnesiophyceae) [J].Chemosphere,2006,62(4):565-572
[29] 王朝晖,谢骏,姜珊,等.商品氯氰菊酯对斜生栅藻生长的影响及其生理生化效应[J].中国环境科学,2012,32(4):659-665
Wang Z H,Xie J,Jiang S,et al.Effects of commercial cypermethrin on the growth of Scenedesmus obliquus and its physiochemical responses [J].China Environmental Science,2012,32(4):659-665 (in Chinese)
[30] 王朝晖,谢骏,姜珊,等.商品氯氰菊酯农药对蛋白核小球藻的毒性效应研究[J].环境科学学报,2012,32(5):1192-1198
Wang Z H,Xie J,Jiang S,et al.Toxicological effects of commercial cypermethrin on Chlorella pyrenoidosa [J].Acta Scientiae Circumstantiae,2012,32(5):1192-1198 (in Chinese)
[31] Wang Z H,Yang Y F,Yue W J,et al.The growth behavior of three marine phytoplankton species in the presence of commercial cypermethrin [J].Ecotoxicology and Environmental Safety,2010,73(6):1408-1414