纳米塑料(nanoplastics,NPs)是指尺寸<1 μm的塑料碎片或颗粒[1],根据其来源NPs可分为由人工合成的添加于个人护理用品中或用于载药、生物成像、生物传感等领域的初级NPs[2],以及塑料制品在自然环境中经风化降解而形成的次级NPs。尽管受到检测手段的限制,环境与食品中NPs的含量尚不清楚,但Lambert和Wagner[3]在实验室观测到了一次性咖啡杯盖可以降解成NPs,Hernandez等[4]则在塑料茶包中检测到了约31亿个NPs,上述研究均证实了人类接触NPs的机会和风险正在增加,因此,探究NPs的潜在毒性效应具有重要意义。
目前对于NPs的毒性研究多集中于细胞和水生模式生物[5-8],现有研究表明,消化道是生物体暴露于NPs的主要途径,摄入体内的NPs会在肠道蓄积并穿过肠道组织进入循环系统,诱导氧化应激、炎症反应、免疫损伤和脂质代谢紊乱等不良影响[9-10]。然而,对于与人类生理机能接近的哺乳动物的毒性研究,迄今鲜有报道。基于此,本研究以小鼠为受试对象,观察了聚苯乙烯纳米塑料(PS NPs)连续经口暴露对小鼠肠道免疫的影响,以期为NPs的潜在毒性效应和生态风险评估提供理论基础。
1 材料与方法(Materials and methods)
1.1 实验动物与试剂
SPF级雌性BALB/c小鼠40只,6周龄,购自斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2019-0010,小鼠饲养及相关实验操作均符合首都医科大学伦理委员会的相关要求(伦理审查号:2018-0003)。饲养温度为20~26 ℃,湿度为40%~70%,昼夜明暗交替时间为12 h/12 h,期间正常通风换气,小鼠自由饮水、摄食。染毒前小鼠适应性饲养一周。
PS NPs(100 nm)悬液购自中科雷鸣(北京)科技有限公司,浓度为50 mg⋅mL-1,使用Milli-Q超纯水将纯化后的PS NPs配成浓度分别为0.05、0.5和5 mg⋅mL-1的悬液,超声振荡30 min后制成PS NPs染毒悬液,备用;生理盐水购自石家庄四药有限公司;多聚甲醛固定液(4% PFA)购自武汉赛维尔生物科技有限公司。
1.2 主要仪器设备
透射电子显微镜(JEM-2100,JEOL,日本);马尔文激光粒度(ZS90,Malvern,英国);超纯水机(Millipore,Milli-Q,法国);超声波清洗器(KQ3200E型,江苏昆山市淀山仪器,中国);低温高速离心机(Eppendorf,5424R,德国);全自动生化仪(AU480,贝克曼,美国);石蜡切片机(RM2235,Leica,德国);全自动切片扫描仪(Pannoramic scan,3DHistech,匈牙利)。
1.3 PS NPs的表征
将PS NPs用Milli-Q超纯水稀释至50 μg⋅mL-1,超声振荡30 min,移取10 μL滴于碳支持膜上使其分散均匀,置于干燥器中待完全干燥后,使用透射电子显微镜观察PS NPs的粒径和形态;移取1 mL于粒径样品池和电位样品池中,使用马尔文激光粒度仪检测PS NPs的粒径分布和Zeta电位。
1.4 小鼠染毒与处理
适应性饲养结束后将小鼠随机分为4组,每组10只,分别为对照组、低剂量组、中剂量组和高剂量组。对照组小鼠每天灌胃纯水,染毒组剂量参考此前以微塑料染毒小鼠的剂量[11-13],3个染毒组分别按0.5、5和50 mg·kg-1灌胃PS NPs悬液,连续灌胃7 d。整个染毒期间观察小鼠的饮水、摄食、外观和活动状况,并做详细记录;在染毒的第1、3、5和7天记录小鼠体质量,并绘制连续染毒7 d小鼠的体质量变化趋势图。分别于染毒3 d后和7 d后将小鼠摘眼球取血并保存于EDTA抗凝管中,3 000 r·min-1离心10 min分离血浆,使用全自动生化仪通过免疫比浊法检测补体C3(C3)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)的含量,通过双缩脲法和溴甲酚绿法分别检测总蛋白和白蛋白的含量,并计算白球比(A/G)。染毒7 d后经麻醉取小肠和结肠各1~2 cm,生理盐水冲洗净肠道内容物,分别置于4%的多聚甲醛溶液中固定,经组织脱水、包埋、切片后,小肠进行HE染色,观察小肠的组织形态;结肠进行AB-PAS染色,Image J软件计算分析结肠的黏液分泌情况。
1.5 统计学分析
实验数据应用IBM SPSS Statistics 21.0软件进行统计分析,实验结果以平均值±标准差(Mean±SD)表示,各组间的显著性差异检验采用单因素方差分析(One-way ANOVA),P<0.05表示差异具有统计学意义。
2 结果(Results)
2.1 PS NPs的表征
PS NPs的透射电子显微镜图像如图1所示,显示PS NPs尺寸均一,且分散性良好。马尔文激光粒度仪的结果显示PS NPs水合粒径为(157.07±0.71) nm (多分散性指数=0.02±0.03),Zeta电位为(-23.73±0.15) mV,说明PS NPs粒径分布均匀,且在超纯水中稳定性良好。

图1 聚苯乙烯纳米塑料(PS NPs)的透射电子显微镜图
Fig. 1 The transmission electron microscope image of polystyrene nanoplastics (PS NPs)
2.2 小鼠一般状况
PS NPs染毒期间各组小鼠全部存活。各剂量组小鼠的饮食和活动未见异常,毛色外观和粪便与对照组相比基本无差异。染毒期间不同剂量PS NPs对小鼠体质量的增量变化影响如图2所示。对照组(图2(a))和低剂量组(图2(b))小鼠在染毒期间体质量逐渐增加,而中剂量组(图2(c))和高剂量组(图2(d))小鼠体质量增长缓慢,甚至呈停滞或下降趋势。
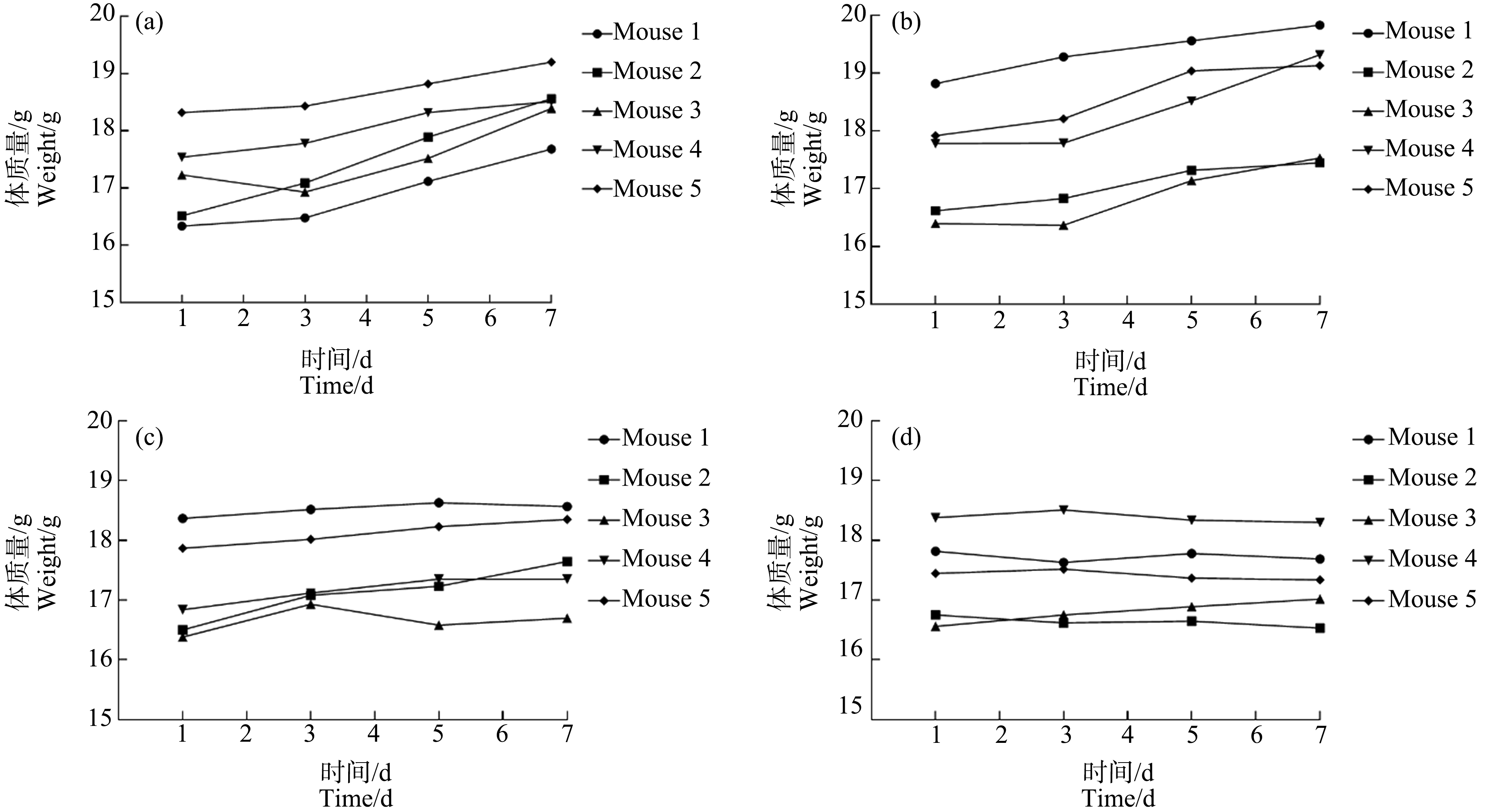
图2 PS NPs暴露对小鼠体质量变化趋势的影响
注:(a) 对照组;(b) 0.5 mg·kg-1;(c) 5 mg·kg-1;(d) 50 mg·kg-1。
Fig.2 The effects of PS NPs exposure on the weight change trends in mice
Note:(a) Control group;(b) 0.5 mg·kg-1;(c) 5 mg·kg-1;(d) 50 mg·kg-1.
2.3 小鼠免疫相关血生化指标
经PS NPs连续染毒后小鼠免疫相关血生化指标情况如图3所示。连续染毒3 d后,与对照组相比,随着染毒剂量的增加,C3含量逐渐下降(高剂量组,P<0.05);A/G变化不明显;IgG含量在中剂量组时达到峰值,而后随着染毒剂量的增加而降低;IgM含量呈逐渐下降的趋势。连续染毒7 d后,中剂量组和高剂量组小鼠的C3含量有所恢复;A/G变化不明显;IgG含量在中剂量组时最高;IgM含量在低剂量组时低于其余各组的含量且差异具有统计学意义(P<0.01)。
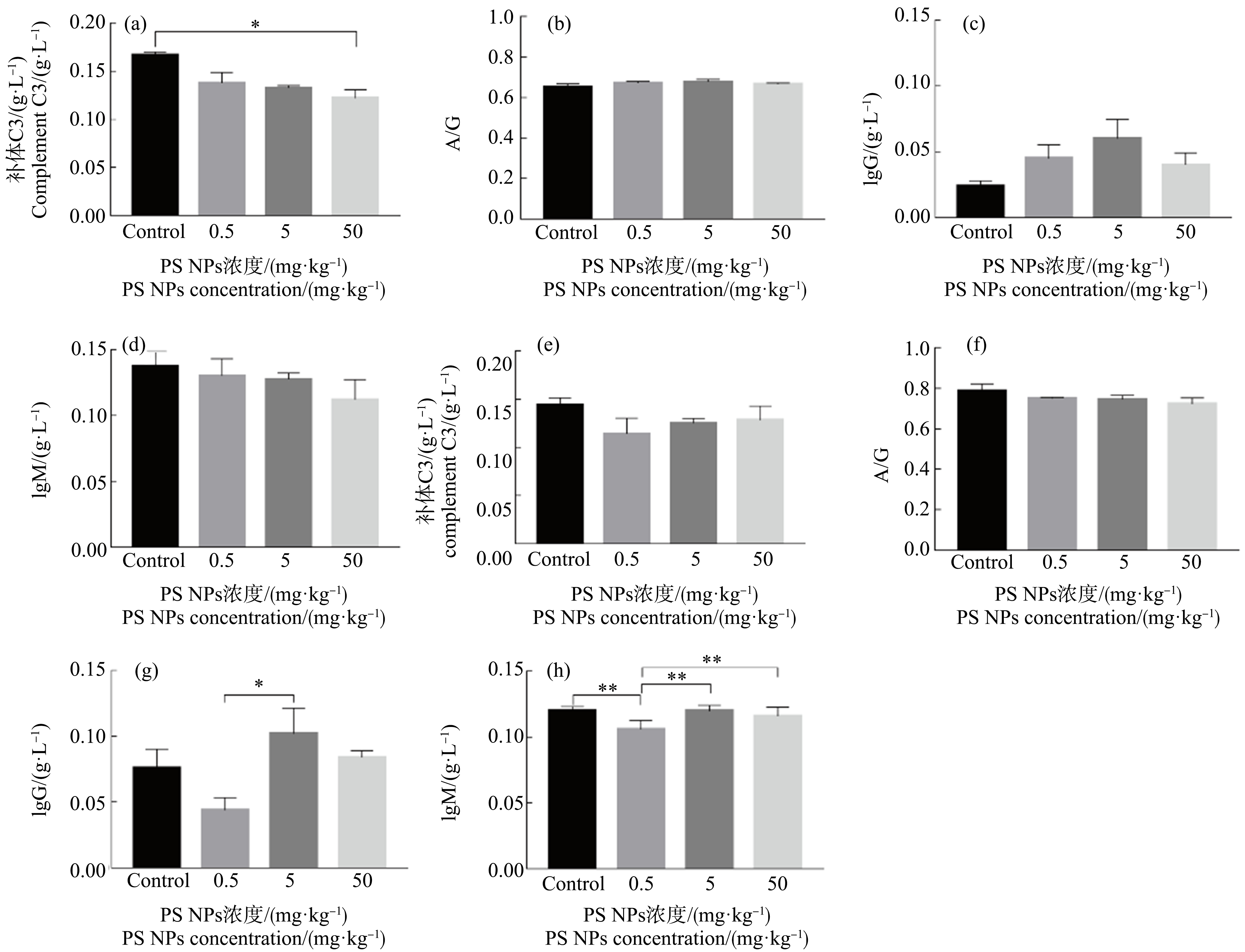
图3 PS NPs暴露对小鼠免疫相关血生化指标的影响
注:(a)~(d)连续暴露3 d后,(e)~(h)连续暴露7 d后;A/G表示白球比,IgG表示免疫球蛋白G,IgM表示免疫球蛋白M;*表示P<0.05,**表示P<0.01。
Fig.3 The effects of PS NPs exposure on immune-related blood biochemical indices in mice
Note:(a)~(d) Continuous exposure for 3 d,and (e)~(h) Continuous exposure for 7 d;A/G represents globulin ratio,IgG represents immunoglobulin G,and IgM represents immunoglobulin M;*represents P<0.05,and **represents P<0.01.
2.4 小鼠小肠组织形态观察
小鼠经剖检,各组别小鼠各肠段均无肉眼可见的异常。HE染色结果如图4所示,对照组小鼠小肠可见黏膜、黏膜下层、肌层和外膜4层结构,黏膜组织结构完整,小肠绒毛呈舌状且排列规则、密集,纹状缘清晰,上皮细胞结构完整,杯状细胞分布均匀,隐窝形态结构清晰;低剂量组小鼠小肠结构基本正常;中剂量组和高剂量组小鼠小肠黏膜结构破坏,出现小肠绒毛排列紊乱、松散,绒毛变短、肿胀、断裂破损,纹状缘不清晰,上皮细胞间质正常结构消失呈自溶性改变,黏膜固有层增宽,隐窝变浅,且高剂量组小鼠小肠结构损伤程度加重。
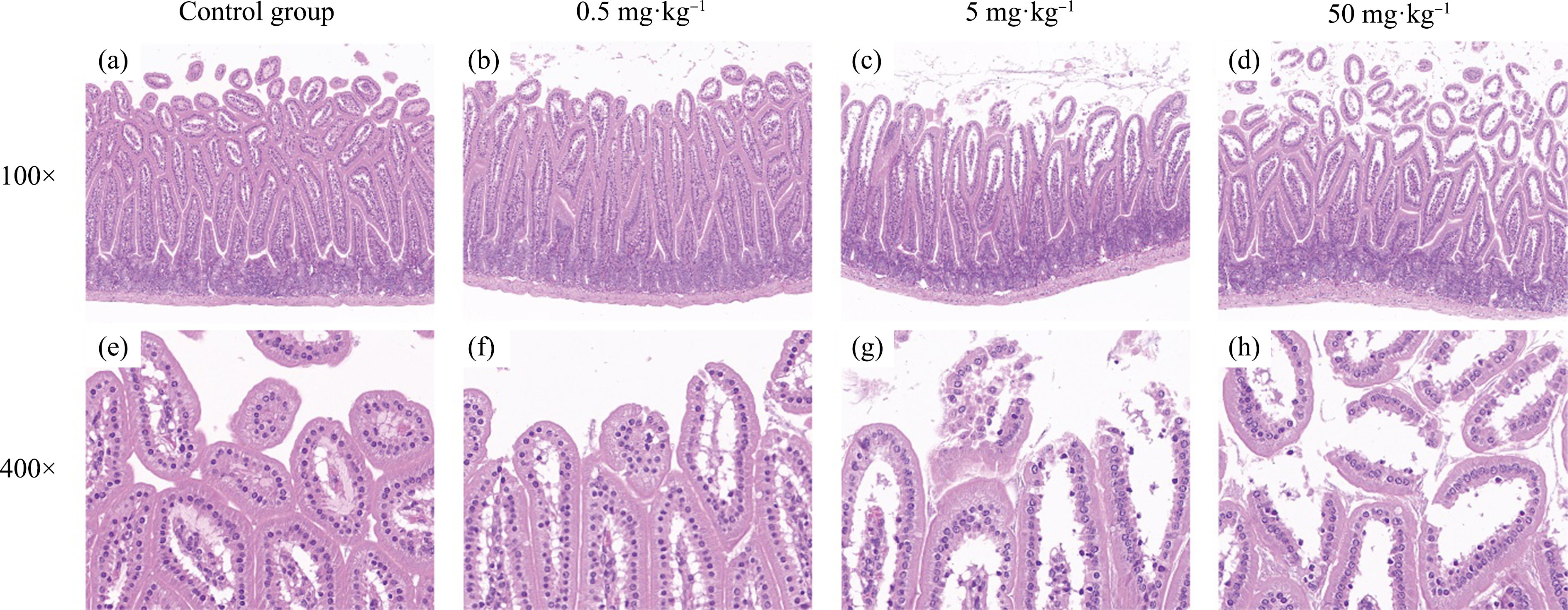
图4 PS NPs暴露对小鼠小肠结构的影响(HE)
注:(a),(e) 对照组;(b),(f) 0.5 mg·kg-1;(c),(g) 5 mg·kg-1;(d),(h) 50 mg·kg-1。
Fig.4 The effects of PS NPs exposure on small intestinal structure in mice (HE)
Note:(a),(e) Control group;(b),(f) 0.5 mg·kg-1;(c),(g) 5 mg·kg-1;(d),(h) 50 mg·kg-1.
2.5 小鼠结肠黏液分泌观察
PS NPs连续暴露7 d后小鼠结肠黏液的分泌情况如图5所示。与对照组相比,随着染毒剂量的增加,结肠分泌的黏液逐渐减少(中剂量组,P<0.05;高剂量组,P<0.0001)。高剂量组结肠分泌的黏液低于中剂量组(P<0.01)、低剂量组(P<0.001)和对照组(P<0.0001)。
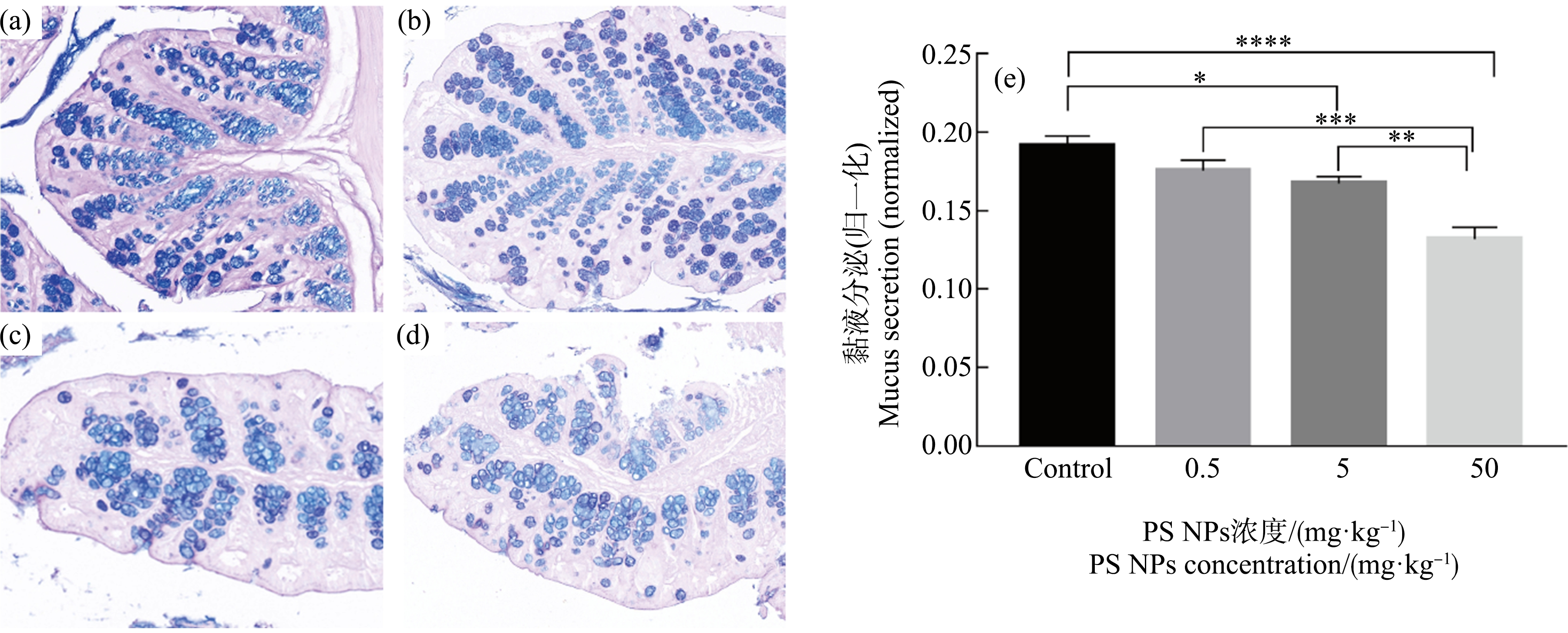
图5 PS NPs暴露对小鼠结肠黏液分泌的影响(AB-PAS,200×)
注:(a) 对照组;(b) 0.5 mg·kg-1;(c) 5 mg·kg-1;(d) 50 mg·kg-1;(e)黏液分泌面积与结肠面积之比;*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.0001。
Fig.5 The effects of PS NPs exposure on colonic mucus secretion in mice (AB-PAS,200×)
Note:(a) Control group;(b) 0.5 mg·kg-1;(c) 5 mg·kg-1;(d) 50 mg·kg-1;(e) the ratio of the mucus secretion area to the entire colon area; *represents P<0.05,**represents P<0.01,***represents P<0.001,and ****represents P<0.0001.
3 讨论(Discussion)
塑料是重要的有机合成高分子材料。目前全球塑料的年产量约3亿t[14],并仍在呈指数增长趋势不断增加。塑料的大规模生产和使用造成大量塑料废弃物的堆积。近年来,全球面临的塑料垃圾污染日益严重。据估计,全球每年有超过800万t塑料垃圾进入海洋,并随水力、风力扩散至各处。PS是应用最广泛的塑料之一,也是海洋垃圾中最丰富的塑料之一[15]。塑料具有持久性,难以回收、降解的塑料垃圾可在环境中存在数百年甚至数千年,在此期间经机械磨损、紫外线辐射和微生物降解等作用被分解形成微塑料(MPs)[16]。近年来,研究发现,MPs会进一步降解形成NPs[17]。据估计,直径为5 mm的MPs球形颗粒完全破碎可以降解成1014个直径为100 nm的NPs球形碎片[18]。研究证实颗粒物的尺寸是影响其毒性的重要因素之一[19],大多数情况下颗粒物的毒性会随颗粒尺寸的减小而增大,由于NPs的纳米尺寸,很容易被摄取而后跨越各种生物屏障,作用于组织和细胞产生细胞和分子层面上的毒性效应[20],并且排出较为缓慢,由此可能会导致更强的生物毒性和生物积累效应。因此,NPs的潜在毒性效应亟待进一步探究。
NPs对免疫功能的影响是评估其潜在风险的重要项目之一。肠道是机体最大的免疫器官,在维持机体免疫稳态中起着重要作用[18]。肠道黏膜上皮是肠道的机械屏障,紧密连接的肠道黏膜上皮结构可以有效阻止有害物质穿透;由杯状细胞分泌的黏液是肠道化学屏障的重要构成之一,具有调节免疫、保护肠壁黏膜细胞和维持黏膜稳态的作用[21-23]。小肠是机体对营养物质进行消化、吸收的主要部位。因此,肠道结构的完整性是维持正常肠道免疫屏障功能的重要因素,也是机体生长发育的重要保障。研究发现,胃肠道是NPs摄入后的主要富集部位[9,24]。Yang等[9]研究发现粒径为70 nm的NPs经金鱼幼苗的口咽腔摄入并在消化道蓄积,并抑制其体长增长,且导致肠道结构受损,肠腔变大,肠壁外膜与肌层分离,黏膜下层结构疏松,肠黏膜层结构破坏。
为模拟现实中生物体对于NPs的摄入途径,本研究采用灌胃的方式探究了PS NPs对小鼠肠道免疫的影响及其剂量-效应关系。结果表明,NPs暴露导致小鼠体质量增长缓慢甚至停滞,小肠绒毛变短、破损、紊乱,结肠黏液分泌减少,且具有剂量依赖效应,说明PS NPs暴露会破坏肠道免疫屏障功能,破坏绒毛完整性从而降低肠道的消化吸收营养物质的能力,这与现有的文献报道结果一致[9,25]。此外,由于肠道的损伤可能会影响黏膜免疫细胞的发育以及内环境的稳态,进而导致免疫球蛋白的含量改变,因此本研究检测了PS NPs暴露对小鼠免疫相关血生化指标的时间-效应关系和剂量-效应关系,结果显示,PS NPs暴露导致小鼠血浆中C3含量下降,IgG呈增高趋势,IgM呈下降趋势随后有所恢复,说明PS NPs暴露可导致补体系统活化并引起机体免疫功能受损。综上所述,PS NPs摄入可损伤小鼠肠道组织结构,影响其生长发育,通过干扰肠道免疫屏障稳态,引起免疫功能紊乱。关于NPs免疫毒性机制的深入研究仍需要进一步探讨。
[1] Gigault J,Halle A T,Baudrimont M,et al.Current opinion:What is a nanoplastic?[J].Environmental Pollution,2018,235:1030-1034
[2] Hernandez L M,Yousefi N,Tufenkji N.Are there nanoplastics in your personal care products?[J].Environmental Science &Technology Letters,2017,4(7):280-285
[3] Lambert S,Wagner M.Characterisation of nanoplastics during the degradation of polystyrene [J].Chemosphere,2016,145:265-268
[4] Hernandez L M,Xu E G,Larsson H C E,et al.Plastic teabags release billions of microparticles and nanoparticles into tea [J].Environmental Science &Technology,2019,53(21):12300-12310
[5] Thubagere A,Reinhard B M.Nanoparticle-induced apoptosis propagates through hydrogen-peroxide-mediated bystander killing:Insights from a human intestinal epithelium in vitro model [J].ACS Nano,2010,4(7):3611-3622
[6] Paget V,Dekali S,Kortulewski T,et al.Specific uptake and genotoxicity induced by polystyrene nanobeads with distinct surface chemistry on human lung epithelial cells and macrophages [J].PLoS One,2015,10(4):e0123297
[7] Veneman W J,Spaink H P,Brun N R,et al.Pathway analysis of systemic transcriptome responses to injected polystyrene particles in zebrafish larvae [J].Aquatic Toxicology,2017,190:112-120
[8] Marques-Santos L F,Grassi G,Bergami E,et al.Cationic polystyrene nanoparticle and the sea urchin immune system:Biocorona formation,cell toxicity,and multixenobiotic resistance phenotype [J].Nanotoxicology,2018,12(8):847-867
[9] Yang H,Xiong H R,Mi K H,et al.Toxicity comparison of nano-sized and micron-sized microplastics to goldfish Carassius auratus larvae [J].Journal of Hazardous Materials,2020,388:122058
[10] Lu Y F,Zhang Y,Deng Y F,et al.Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver [J].Environmental Science &Technology,2016,50(7):4054-4060
[11] Deng Y,Zhang Y,Lemos B,et al.Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure [J].Scientific Reports,2017,7:46687
[12] Stock V,Böhmert L,Lisicki E,et al.Uptake and effects of orally ingested polystyrene microplastic particles in vitro and in vivo [J].Archives of Toxicology,2019,93(7):1817-1833
[13] Park E J,Han J S,Park E J,et al.Repeated-oral dose toxicity of polyethylene microplastics and the possible implications on reproduction and development of the next generation [J].Toxicology Letters,2020,324:75-85
[14] Xia X H,Sun M H,Zhou M,et al.Polyvinyl chloride microplastics induce growth inhibition and oxidative stress in Cyprinus carpio var.larvae [J].The Science of the Total Environment,2020,716:136479
[15] Lithner D,Larsson A,Dave G.Environmental and health hazard ranking and assessment of plastic polymers based on chemical composition [J].The Science of the Total Environment,2011,409(18):3309-3324
[16] Moore C J.Synthetic polymers in the marine environment:A rapidly increasing,long-term threat [J].Environmental Research,2008,108(2):131-139
[17] Gigault J,Pedrono B,Maxit B,et al.Marine plastic litter:The unanalyzed nano-fraction [J].Environmental Science:Nano,2016,3(2):346-350
[18] Wagner S,Reemtsma T.Things we know and don’t know about nanoplastic in the environment [J].Nature Nanotechnology,2019,14(4):300-301
[19] Kögel T,Bjorøy Ø,Toto B,et al.Micro- and nanoplastic toxicity on aquatic life:Determining factors [J].The Science of the Total Environment,2020,709:136050
[20] 杨婧婧,徐笠,陆安祥,等.环境中微(纳米)塑料的来源及毒理学研究进展[J].环境化学,2018,37(3):383-396
Yang J J,Xu L,Lu A X,et al.Research progress on the sources and toxicology of micro (nano) plastics in environment [J].Environmental Chemistry,2018,37(3):383-396 (in Chinese)
[21] 杨涛,杨大平,钱友存.肠道菌群对机体免疫反应的调节和影响[J].中华炎性肠病杂志(中英文),2019,3(3):198-202
[22] 杨文娟,来利华,王青青.肠道杯状细胞在肠道免疫调控中作用的研究进展[J].细胞与分子免疫学杂志,2018,34(11):1046-1050
Yang W J,Lai L H,Wang Q Q.Progress in the role of intestinal goblet cells in intestinal immune regulation [J].Chinese Journal of Cellular and Molecular Immunology,2018,34(11):1046-1050 (in Chinese)
[23] Linden S K,Sutton P,Karlsson N G,et al.Mucins in the mucosal barrier to infection [J].Mucosal Immunology,2008,1(3):183-197
[24] Elizalde-Velázquez A,Crago J,Zhao X F,et al.In vivo effects on the immune function of fathead minnow (Pimephales promelas) following ingestion and intraperitoneal injection of polystyrene nanoplastics [J].The Science of the Total Environment,2020,735:139461
[25] Pedà C,Caccamo L,Fossi M C,et al.Intestinal alterations in European Sea bass Dicentrarchus labrax (Linnaeus,1758) exposed to microplastics:Preliminary results [J].Environmental Pollution,2016,212:251-256