随着农药、阻燃剂、增塑剂和内分泌干扰物等污染物在水体中频繁检出,新污染物的危害越来越受到人们的关注,这些污染物中很多没有被纳入常态监测体系,缺少标准测定方法,并且有些在环境中含量极低,不易检出,但是具有一定的生物毒性。新污染物的这些特性给传统监测方法带来了挑战。主动采样技术是目前应用最为广泛的监测方法,前处理方法相对简单,应用方法成熟,但是主动采样在监测某些痕量污染物时,需要进行大体积采样以降低检出限,导致成本高昂,可行性较低,此外主动采样提供的是瞬时样本,无法准确反映水体的真实浓度情况。水体痕量新污染物的监测意义重大,迫切需要新的监测方法。被动采样技术是20世纪70年代兴起的方法,随着几十年的发展,该技术已经成功应用在水体监测中。被动采样技术检出限低,可以简易高效地完成痕量污染物的定量,还可以模拟生物采样,提供污染物的生态健康风险信息。此外,被动采样技术具有时间累积采样的特性,提供时间加权平均浓度,能更好地应对污染物浓度波动情况。
1 水体被动采样技术(Aquatic passive sampling techniques)
1.1 被动采样技术的原理
被动采样技术与传统的主动采样不同,采样过程不需要外力,目标物质在化学势差的推动下,由水相以被动扩散的方式迁移至被动采样器(passive sampling device, PSD)中[1]。这个过程涉及污染物在多相间的转移,通常认为,目标物质从水相主体扩散至PSD附近,需要穿过水边界层、可能存在的生物膜层和扩散限制膜,才能进入采样器中被接收相富集。Huckins等[2]于1993年提出的一级动力学模型可以描述上述富集过程。该模型认为水相与采样器间的交换动力学满足公式:
(1)
式中:t为PSD的采样时间,Cs是目标物质t时刻在PSD中的浓度,Cw表示目标物质在水体中的浓度;ku和ke分别为吸收速率常数和消除速率常数。根据采样进程的特性,可以将目标物质在采样器中的积累过程划分为表1所示的3个阶段:线性富集阶段、曲线富集阶段和平衡富集阶段。
描述传质过程的模型除了公式(1)所示的动力学法,还可以使用传质系数法[5]。最简单的传质速率模型认为化合物穿过水边界层(water boundary layer, WBL)进入PSD内,即仅存在水边界层和采样器膜两步传质过程。可以用下面的方程描述:
(2)
表1 被动采样对目标物质的积累阶段
Table 1 Sampling stages in passive sampling process

采样阶段Sampling stages描述模型Models采样时间Sampling duration平衡度(DEQ)Degree of equilibrium (DEQ)线性阶段 Linear stageCs=Cwkut
注:半衰期(t1/2)[3]为PSD中物质浓度达到最大浓度一半的采样时间;平衡度(degree of equilibrium, DEQ)[4],DEQ=1-e-ket。
Note: The half-time (t1/2)[3] means sampling duration when the concentration in PSD reaches half of the maximum concentration; degree of equilibrium (DEQ)[4], DEQ=1-e-ket.
式中:kw和kp分别为化合物为在水边界层和在采样器膜中的传质系数,Ksw为化合物的采样器-水分配系数,ko为传质过程中的总传质系数。
如果考虑存在生物污染,则可将式(2)进一步表示为
(3)
式中:kb为化合物为在生物膜中的传质系数,Kbw则为化合物的生物膜-水分配系数。
Booij等[6]引入参数Bi用于判断传质过程的控速步骤,其定义为水边界层阻力与采样器膜阻力的比值,即
(4)
式中:Dp为化合物在采样器膜中的扩散系数,δp为膜的厚度。当Bi<0.05时,传质完全由水边界层控制,当Bi>300时,完全由采样器膜控制。
PSD富集污染物的过程除了会由水边界层或者采样器膜控制,也可能由化合物在多孔吸附剂材料(如POCIS和HECAM中使用的HLB)内的扩散(intra-particulate diffusion)控制[7]。当完全由吸附剂控制传质可以看作是化合物在一个半无限(semi-infinite)介质中的扩散,需要使用下述扩散方程(而非一级动力学方程)描述[8]:
(5)
式中:D为目标物质在采样器膜中的扩散系数,ρ为接收相材料的密度,t为采样时间,MPS为目标物质在采样器中的富集质量。
但实际的传质过程可能并不是由某一过程单独控制的,这种情况下可以使用一个半经验模型——混合速率控制模型来描述[9]。
MPS=KmCwtn
(6)
式中:K是速率常数(L·kg-1·h-n),m为接收相的质量(kg),n用来判断控速步骤[10]:如果n接近于0.5,说明由吸附剂控制;接近于1,说明由水边界层或采样器膜控制,介于0.5~1之间,说明由两者共同控制。但是混合速率模型仅适用于较短采样时间,因为随着采样逐渐趋近平衡,n会减小至0(平衡)。
传质过程会受到温度、流速和盐度等环境因素的影响,还会受到化合物性质和PSD配置的影响。化合物的性质决定了是否可以在被动采样中积累、富集的程度和采样速率等。疏水性、分子量(体积)、官能团种类等性质已经被证实会不同程度影响采样速率[11]。采样器的接收相种类影响着与化合物的亲和能力,膜材料的选择也会影响传质速率[12]。后续内容中会更详细讨论传质过程的影响因素。
1.2 PSD类型
根据目标物质与采样器接收相之间作用力的不同,可以将PSD大致划分为2种类型:分配型PSD和吸附型PSD[3]。分配型采样器的原理是化学物质的分配作用,主要靠范德华力,而吸附型采样器的原理主要是采样器内吸附剂对污染物的吸附作用,作用力包括氢键、配位键和偶极键等。对于分配型采样器,只要暴露时间够长,污染物往往能在采样器中达到平衡,但其非平衡状态也可以应用。对于吸附型采样器,污染物与吸附剂之间以强效方式结合,其往往不需要达到平衡状态。常用的分配型采样器有SPMD、Chemcatcher-C18和TECAM等,目标物质一般为疏水性有机物。吸附型采样器有POCIS、Chemcatcher-SDB和HECAM等,常针对极性化合物进行采样。分配型采样器一般使用单一接收相,适用目标物质范围较广,富集的物质形态为单一形态——自由溶解态。吸附型采样器可以根据目标物质的不同选择多种吸附相作为接收相,可以富集以自由溶解态为主的多种形态的目标物质。分配型采样器对目标物质的吸收和解吸符合各向同性交换动力学(isotropic exchange kinetics, IEK),可以使用效能参考化合物(performance reference compound, PRC)法进行原位采样校正[13]。但是吸附型采样器的富集过程更为复杂,不一定满足IEK,PRC法的应用也需要进一步研究[14]。
在应用被动式采样器测定水体浓度时,采样器类型又可以划分为2种[15]:平衡采样器和时间累积采样器,分别基于平衡富集阶段和线性富集阶段。平衡采样器一般要求吸附容量小,快速达到平衡,在已知分配系数的条件下,就可以根据采样器中的浓度算得水中浓度。而时间累积采样器吸附容量大,平衡所需时间较长,在采样速率(sampling rate, Rs)已知的情况下,可以计算出水体中的浓度[16]。因为采样器连续采样,所以计算浓度为时间加权平均浓度。时间累积采样器假设采样期内Rs不随水体浓度变化,但是Rs会受到温度、水流速度和生物污染等环境因素的影响[12]。
2 被动采样技术的采样速率校正方法(Calibration methods of sampling rates for passive samplers)
对于时间累积PSD而言,Rs的校正至关重要。常用的校正方法分为2类:实验室校正方法和现场校正方法。实验室校正方法主要包括3种[12]:静态耗损实验、静态更新实验和连续水流校正实验。由于实验室的模拟环境很难与实际采样环境完全一致,一些情况下,现场校正方法能有效提高被动采样的准确度。
现场校正方法最常用PRC法,基于PRC有2种方法可以得到目标物质的吸收速率常数[13],这2种方法都需要在已知平衡常数(KPSD)的前提下,通过测得释放速率常数(ke),然后根据下面的公式获得吸收速率常数。
(7)
第1种方法是暴露校正因子法(exposure adjustment factor, EAF),假设当PSD吸收目标化合物的传质过程由水边界层控制时,环境因素对采样速率的影响可以用相同条件下PRC受到的影响来近似。第2种方法是类比法,假设采样器对目标物质的释放速率常数与Kow之间存在一个恒定的关系,该方法适用的logKow范围比第1种方法更大。由于PRC法要求PSD对污染物的吸收释放满足IEK,分配型PSD的PRC法较为成熟,应用案例较多,而吸附型采样器PRC法的应用仍极为有限,仅少数化合物可以作为吸附型采样器的PRC。
流速被认为是影响采样速率最为显著的环境因子[5]。一些研究使用被动流速检测器(passive flow monitor,PFM)来校正现场采样速率[17-19],PFM法是基于石膏溶解建立的方法,在布设PSD的同时,布设被动流量检测器,通过确定石膏溶解速率与水体流速的关系来分析采样环境的流速情况,适用于水边界层控制传质的采样过程。由于石膏的溶解与水体的温度、钙离子和硫酸盐离子的浓度水平有关,因此在应用时需要考虑这些因素的影响。除了PFM法,也有学者提出可以直接控制采样流速,例如在PSD前端放置转子或者蠕动泵[20],使得采样器始终暴露在一个相对稳定的、可控的水流条件下,这样就可以达到用实验室的校正数据来计算采样结果的目的。
无论是实验室校正还是现场校正方法,都需要使用实验手段来确定采样速率,如果能够建立合适模型就可以通过使用数学手段免去实验操作带来的大量时间和资源消耗。如Vrana等[21]研究了适合logKow范围在3.7~6.8的化合物的经验公式,O’Brien等[17]提出的阿特拉津采样速率与流速之间的经验公式。除了建立经验公式的方法,利用定量结构-性质关系(quantitative structure-property relationship, QSPR)模型预测采样速率的方法也日益受到关注,QSPR是利用数学算法构建分子结构与目标性质之间的定量数学函数关系[22],常用的建模方法包括随机森林、多元线性回归和支持向量机等[23]。如Miller等[24]借助人工神经网络(artificial neural networks, ANNs),构建了RTD-model和GSD-model这2个模型,通过73种目标化合物的结构预测其在POCIS的采样速率,预测误差为(0.03±0.02) L·d-1(RTD-model)和(0.03±0.03) L·d-1(GSD-model)。
3 水体被动采样技术的应用(Applications of passive sampling)
自20世纪80年代起,PSD首次应用在水环境监测领域以来,被动采样领域发展迅速。各种新型PSD应用在河流、湖泊、海洋和下水道等大部分水体环境,应用案例的日益丰富显示出被动采样技术的巨大应用潜力。
3.1 水污染物的环境暴露浓度与归趋分析
3.1.1 筛查监测
被动采样技术用于污染物监测时,具有比主动采样技术更加灵敏的污染物识别能力,可以监测ng·L-1浓度水平的污染物,有研究表明被动采样大约可以满足75%以上的污染物监测需求[25]。借助被动采样技术的低检出限优势,将其作为筛查工具与预警工具,与生物监测、化学分析方法组成分级监测体系[26]。被动采样技术用于评估污染物的存在与否,在低浓度水平识别污染源,或者用于污染源间歇性排放场景。当被动采样检测值超过一定范围时,再使用生物测试,进一步确认污染物对生物体的危害。
3.1.2 时间累积采样
在大多数水体环境中,污染物的浓度都会发生一定程度的波动,被动采样技术具有时间累积采样的特性,可以提供污染物的时间加权平均浓度,相比于低频次的瞬时采样,可以更为准确地反映水体的真实浓度。现有的研究通常以自动采样器或者高频次手动采样结果作为参考值,评估被动采样的结果。很多研究[14, 27-28]都将被动采样监测获得时间加权平均(TWA)浓度与高频瞬时采样的监测结果进行对比,发现2种采样技术测定的TWA浓度具有较好的吻合度,被动采样所得浓度是瞬时采样的0.3倍~3倍,但是瞬时采样的浓度具有更大的变异性。
3.1.3 污染源识别
被动采样可以长时间布设在水环境中,并且布设灵活,适用于多点位同时监测,因此可以用于判断污染物的时空变化趋势以及识别污染源。Poulier等[29]使用POCIS在干流Auvézère河和其支流Amac河上下游分别进行采样,得到了支流对干流的污染物贡献通量,并推测了污染物的来源、迁移及转化过程。Monteyne等[30]于2007—2010年在比利时3个沿海港口的采样结果证明了多氯联苯(PCBs)的浓度主要受河流输入的影响,并且不同港口的污染源存在一定的差异。Gao等[31]应用被动采样分别在南极、北极不同类型水体(淡水、冰川融水和海水)采样识别不同类型的新污染物,并分析了有机磷酸酯等典型污染物的来源和归趋,例如近海海水中的新污染物既源自当地船舶污染,也包括海洋运输的影响[32]。
一般认为,被动采样技术提供的是自由溶解态组分,但是现行的标准体系针对的是污染物的“全量浓度”,因此被动采样的结果很难直接与之比较[11]。当被动采样用于评估中等极性到极性有机化合物(logKow<5)时,这些污染物与水体中的有机物亲和性较差,自由溶解态浓度与全量浓度差距较小,而对于疏水性强的化合物,一般是将自由溶解态浓度转换为“全量浓度”进行比较[33]。
3.2 水污染物的生物有效性与毒理学有效性评价
生物监测技术环境监测领域常应用的技术之一,通过研究实验生物对污染物的反应可以直接反映污染物的生物毒性,但是生物监测的结果往往会受到实验生物的种类、生长阶段和健康状况,代谢等生理因素的影响,并且可能缺少合适的生物,繁琐的前处理和较差的可重复性限制了生物监测技术的应用[23]。
3.2.1 生物有效性
过往的研究表明,被动采样过程与生物富集过程相似,可以用来评估污染物的生物有效性。研究表明被动采样浓度与水生生物体内的浓度有一定的相关关系[11]。但是,相关性的强弱与化合物的种类、PSD的种类和生物种类有关,如Friedman等[34]的研究表明一些多毛纲生物体内的脂质归一化PCBs浓度也与低密度聚乙烯(LDPE)中的平衡浓度存在强相关性关系,而多毛类生物的脂质归一化多环芳烃(PAHs)浓度与LDPE的平衡浓度相关性较差。生物体对污染物的富集过程涉及生长稀释、新陈代谢等生理过程,而PSD仅涉及了物理化学过程,因此使用被动采样测定生物有效态浓度时,结果与生物体内的浓度可能存在一定的偏差。研究中常使用贻贝等低营养级的生物作为参照,并且证明了SPMD、silicon rubber等PSD和贻贝生物富集浓度有较好的相关性[11],而将PSD与较高营养级联系起来时,可能需要引入生物积累模型来使研究结果更为合理。
3.2.2 毒理学有效性
相比于固相萃取等传统的前处理方法,被动采样能够长时间在水体中进行连续采样,可以获得不同浓度的生物活性物质,此外被动采样提供的自由溶解态浓度相比于污染物总浓度更符合生物测试的要求。因此许多研究使用被动采样技术提供样本,进行内分泌干扰效应、遗传毒性等体外生物毒性测试。如Liscio等[35]使用POCIS在污水处理厂中采集内分泌干扰物(EDCs)样品,用于酵母菌雌激素筛检(yeast estrogen screen, YES)测试,并与贝类生物实验进行对比,证明了被动采样技术与生物测试结合的可靠性与便捷性。被动采样技术与生物毒性测试结合时,提供的样本中含有多种未知污染物,生物测试的结果反映了水样的综合毒性。由于PSD对不同污染物的采样速率不同,并且污染物间存在毒性差异,因此可能会出现由于采样速率较低而低估某一污染物毒性的情况[12]。因此将被动采样技术与生物测试结合时,需要考虑PSD对不同目标化合物的采样速率差异。
4 监测水污染物时间加权平均浓度的挑战(The challenges of monitoring time-weighted average concentrations of water pollutants)
4.1 时间加权平均浓度的测定方法
水体中污染物的浓度并非恒定值,而是会发生一定的波动,尤其是当排污、降雨和洪水等事件发生时,污染物的浓度可能会发生剧烈变化。降雨或者洪水事件会增加地表径流,从而促进了农药、药物及个人护理品等污染物进入水体的进程,造成污染物浓度短时间内能骤增几倍到几十倍[36-38]。这些污染事件发生时间、持续时间和浓度波动程度通常无法预知,给污染物监测造成了较大的困难。此外,短时间多次脉冲污染还可能对水生生物产生更严重不利影响,因此明晰这些污染事件的生态环境影响对保护水环境有重要意义。这些浓度波动事件的发生时间、持续时间通常无法预知,浓度波动程度未知。常规水质监测多使用瞬时主动采样,但是每月1~2次的采样频率很容易遗漏波动信息。为了准确地反映水体浓度情况,需要获得一段时间内的平均浓度,即时间加权平均浓度。
TWA浓度可以使用高频瞬时采样获得,当采样间隔足够短时将可能监测到污染物浓度的动态变化。而高频瞬时采样通常有人工与自动采样器2种实现形式。使用人工采样不仅人力物力成本高昂,还会受到恶劣天气条件的制约;使用自动采样器则可能会受限于布设环境、能源供应等因素[39]。另外一种获得TWA浓度的方法即为被动采样技术,被动采样具有时间累积采样的特性,因为PSD综合了采样期内的浓度动态变化情况,更加有代表性,并且避免了大量重复采样,进而减少运输、储存和分析成本。
4.2 影响时间加权平均浓度不确定性的主要因素
不论是高频主动采样还是时间累积被动采样,TWA浓度获取过程的各个环节都会影响其结果的不确定性。TWA浓度的总不确定性包括主要不确定性(primary uncertainty)和次要不确定性(secondary uncertainty)[40]。主要不确定性与采样频率、采样位点空间分布和采样方法有关。被动采样方法相比于主动采样更具有时间和空间分布的代表性,因此可有效减少这部分不确定性[41]。次要不确定性与样品储存运输、前处理过程和分析测试方法有关。由于被动采样采集物质保存在采样器中[42],不会像主动采样那样可能出现物质在样品瓶中的吸附或转化等变化,因此这部分不确定性也可能会因被动采样而降低。
但是,由于被动采样的采样过程、分析过程会仍然受到一些因素的影响(图1),采样结果往往与真实值之间存在一定的偏差,正确认识这些因素的影响有助于被动采样技术更为准确地反映水体真实情况。

图1 水污染物时间加权平均(TWA)浓度的获得方法及其影响因素
Fig. 1 Methods for monitoring time-weighted average (TWA) concentrations in water and the major influencing factors
4.2.1 环境因素
(1)温度。PSD的采样速率通常会随着温度升高而增加。Rantalainen等[43]对SPMD的研究表明,温度每升高10 ℃,采样速率增加2倍。Li等[44]使用POCIS采集药物和个人护理品(PPCPs)和内分泌干扰物(EDCs)时发现了相近的结论,温度从5 ℃升至25 ℃,采样速率增加了不到2倍。但由于实际水体环境的温度一般不会有过大变化,因此温度对TWA浓度结果的影响较小。
(2)流速。PSD的采样速率通常随流速增加而增加。流速增加能够减小水边界层的厚度,如果传质过程由水边界层控制,则采样速率会增加。一般认为疏水性有机物受到水边界层的影响比亲水性有机物更大,logKow>4.5的化合物主要受水边界层控制,例如SPMD对疏水性有机物的采样速率对流速的改变非常敏感[45]。但极性PSD的传质限速步骤可能并非水边界层,目前众多的研究结果并未得到统一结论,有研究表明流速增加10倍以上水体中POCIS对某些极性化合物的吸附动力学变化却小于2倍[46]。洪水等事件发生时,径流增加可能显著提升流速,从而影响TWA浓度监测结果。Novic等[47]在监测一次洪水事件时发现高流量时段与低流量时段的采样速率有显著不同,当采样期内存在流量高低2种情况时,将2种暴露场景分别考虑能够提高PSD获取TWA浓度的准确性。
(3)溶解性有机物。溶解性有机物(dissolved organic matter, DOM)对PSD的采样速率有负面影响[48],原因有2个方面:①DOM(例如溶解性腐殖酸)与目标分子结合导致目标化合物的自由溶解态浓度降低,并且形成的络合物难以扩散到采样器中;②DOM可能占据接收相上的吸附位点并抑制对某些目标化合物的吸附能力。由于极性化合物与DOM的亲和力较弱,因此DOM对疏水性PSD影响大,而对极性PSD的影响可能较小,例如有研究报道在不同总有机物(TOC)浓度下POCIS对PPCPs的采样速率并没有显著差异[49]。
(4)pH。水体pH变化可能影响化合物在水相中的结构和形态,而PSD通常采集自由溶解态,即电中性的分子,因此pH的改变会影响PSD的采样结果,特别是对可解离目标物质。例如,Bernal-González 和Durán-Domínguez-de-Bazúa等[50]发现不同pH(4~7)下,C18 disk对氨基甲酸脂和均三嗪中性分子(pH=7)的采样速率高于其离子形态(pH=4)。
(5)盐度。水体盐度变化可能会影响盐析效应,盐析效应随分子大小增加而增加,随分子极性增加而降低。但是实际水体采样结果表明,盐度对疏水性和极性PSD的采样速率均无显著影响,各种PSDs都已经多次应用在海水环境中[30, 51-53]。
(6)生物污染。生物污染一般会降低采样速率。生物污染的形成与水体环境、采样器材料和采样时长等有关。一般认为亲水性膜材料(例如PES)不易受到生物污染。Schreiner等[54]使用2种构型的Chemcatcher采样器对极性化合物进行为期10 d采样,未使用扩散限制膜的“裸”采样器生物污染严重,在不破坏采样器的前提下很难完全去除生物膜,进而可能影响对采样器中目标物的提取;而使用PES扩散限制膜的Chemcatcher虽然暴露在同样环境中,但是几乎没有生物污染。此外,PSD表面的生物膜中含有大量有机物,因此疏水性化合物更容易受到生物污染的影响,造成采样速率的降低。
4.2.2 浓度波动特征
水体污染物的浓度波动给被动采样带来了挑战。为了探究浓度波动的影响,科研人员开展了从模型模拟、控制实验,到下水道、河流、海洋等现实水体污染事件的应用研究,不同波动情况下PSD的采样效果受到高度关注。
数学模型可以一定程度上用来简化模拟水体浓度波动和相应PSD富集浓度的变化。Hawker[55]将水体浓度波动变化划分为线性变化、指数变化和周期性振荡等数学模型,并且推导了各种波动变化形式相应的PSD浓度变化模型,以期从PSD采样结果直接预测水体浓度变化细节。但真实水体污染物浓度的变化情况更为复杂,很难使用某个单一模型进行描述,并且多数情况下不规则的浓度波动可能无法使用模型拟合。
研究者常用波动幅度、持续时间和波峰位置(采样前、中、后期)等来描述某一次波动的特征,而当采样期内包含多次浓度波动时,还可以使用其他参数来表征总体波动特征,如变异系数(coefficient of variation, CV)和半数时间比率(half-time ratio, htr)[56]。变异系数的大小可以衡量浓度波动的剧烈程度。htr用来表示浓度峰值分布在采样期的前半段还是后半段,若htr为正值,则表示浓度峰值在采样后半段。由于各种水体有各自的特点,如下水道中污水的流量、污染物的种类与人为活动、雨水等有关,这些参数对被动采样的影响也不尽相同,在控制实验和不同水体中的应用研究为PSD监测TWA浓度的校正提供了丰富的数据。Shaw和Mueller[57]在实验室条件下研究了波动幅度、波动持续时间等参数对Chemcatcher被动采样的影响,发现污染物浓度波动的时间越长,波动幅度越大,与理论真实值的差距越大,采样期末期发生的污染事件比部署后不久发生的事件可以更好地由PSD表示。Mutzner等[56]则发现水体浓度CV越大,由浓度波动导致的结果误差越大,当浓度峰值主要分布在后半段会高估实际浓度,分布在前半段会低估实际浓度。
4.2.3 PSD构型参数
(1)扩散限制膜的影响。PSD的吸收过程最重要的是水边界层和采样器膜提供传质的阻力,如果化合物穿过这些层的稳态条件没有迅速建立,就会存在采样滞后时间,因此扩散限制膜覆盖的PSD对脉冲污染事件的响应缓慢,适合较为长期的监测[33]。如果将膜和接收相一起提取,这样化合物在整个采样器内的分布就不会影响分析结果,一定程度上可以减少对环境浓度波动响应缓慢的影响。相反,没有扩散限制膜的PSD(例如某些Chemcatcher[57])对浓度波动响应迅速,但是由于富集速度过快,当采样时间较长时容易不满足线性假设,使TWA浓度误差增加,因此适用于短期监测。
(2)采样器面积的影响。采样器暴露面积增加一定程度上可以提高采样速率,但是会增加水流速对采样的影响[3]。
(3)膜材料的影响。膜材料的性质会影响膜转移动力学。一般认为带电与极性化合物在膜上无累积,迅速富集至接收相;而疏水性化合物可吸附在膜上,表现为吸附迟滞效应[48]。
(4)接收相的影响。接收相与目标物质的亲和力差异会导致采样速率不同,采集不同的目标物质可以选择最为合适的接收相材料。例如可以使用triolein、C18吸附剂等富集疏水性物质,SDB-RPS、HLB等吸附剂用于富集可电离和极性分析物[48]。
4.2.4 采样参数
当使用时间累积PSD计算TWA浓度时,需要假设采样器对化合物的富集过程处于线性阶段,如前所述,t1/2可被认为是PSD线性阶段与曲线阶段的分割点,Mutzner等[56]的研究表明PSD采样时间超过化合物对应t1/2时,TWA浓度监测结果的误差将会增大。
4.2.5 质量控制和质量保证
一些实验室间研究的结果表明对于某些新污染物的TWA浓度分析,不同实验室的分析结果存在很大的差异。但该误差来源与被动采样方法无关,主要来源于化合物的提取分析过程[58]。除此之外,仪器分析操作过程、数据分析过程的人为因素影响也值得关注。
4.3 被动采样获取TWA浓度不确定性的评估
被动采样监测TWA浓度的不确定性范围通常受到采样速率的制约,可以采用如下公式计算[26]:
Accuracylow-k×RSD≤UPSD≤Accuracyup+k×RSD
(8)
式中:UPSD为总不确定度;RSD反映被动采样数据的重现性;k为覆盖因子(coverage factor);accuracy为被动采样精度,通常由Rs精度决定。Morin等[59]回顾了关于环境条件对被动采样Rs影响的研究后得出结论,无论所考虑环境参数(温度、水流速或生物污染)如何变化,Rs的增加(或减少)通常<2倍。
5 研究展望(Prospect)
尽管被动采样技术相比于主动采样拥有时间累积、低检出限、富集自由溶解态浓度的优势,尤其适合应用在水体浓度存在复杂变化的场合,但仍然面临一定挑战需要克服,以便在水环境监测与暴露评估的应用中发挥更大潜力。
5.1 深入研究极性PSD水边界层与聚合物控制的传质过程机制
与疏水性PSD相比,对极性PSD的富集机制的认识还很少。污染物在极性PSD中主要传质阻力来源于哪个环节,以及环境因素对传质过程的影响需要进一步量化,这阻碍了极性被动采样结果的准确定量。一些研究表明极性PSD的富集过程可能不符合一级动力学过程或者与之存在一定的偏差[60-61]。疏水性化合物倾向于受到水边界层控制,而极性PSD的传质更有可能受到其他传质环节的限制。富集机制的不明确也阻碍对采样过程实际遇到问题的有效解决,例如:接收相与某些化合物强烈结合可能导致回收率低;采样器膜材料与接收相孔隙中存在水边界层对传质阻力的贡献;复杂环境基质中多种化合物之间可能存在竞争吸附等。因此有必要进一步研究极性PSD的传质过程和富集机制,建立合理的理论模型,以减少采样器的结果不确定性。另一方面也许可以尝试开发新的机制更为简单和可控的极性PSD。
5.2 提升对浓度波动污染事件的精准监测
监测污染事件中污染物的种类及浓度水平对保护水生态环境有重要意义,被动采样技术在污染事件中的应用如图2所示。但是,污染事件复杂多变,其变化特征难以识别。使用统计学的手段也许可以帮助提取变化特征,总结发现更多的变化规律,这将有利于考察被动采样在相应变化时的采样性能。此外,尽管被动采样在监测浓度波动事件中已经有大量应用,但仍然存在影响TWA浓度不确定性的技术挑战,例如频繁浓度波动时的准确性问题、短期被动采样的灵敏度问题等。
一些研究还发现浓度波动事件中PSD富集过程可能会出现时滞效应(lag effect)或瞬时浓集效应(burst effect)。这2种现象通常出现在采样初期,表现为比预期要慢或更快的富集,可能与化合物的疏水性等性质有关[62]。Lag effect可能导致PSD无法捕捉到微小的污染事件。Lag effect与burst effect的出现会导致PSD对化合物的富集与一级动力学过程产生偏差,进而导致对水体浓度的错误估计。但是还没有完全明晰这2种现象出现的原因,研究初步表明长期采样受其影响较小[7],但短期采样影响程度未知。因此,有必要对从化合物性质、环境因素和采样器参数等多角度对lag effect和burst effect进一步研究,确认其对TWA浓度监测结果的影响。

图2 被动采样在污染事件监测中的应用展望
Fig. 2 Application prospect of passive sampling in pollution event monitoring
5.3 完善水体被动采样的质量控制方法
虽然被动采样在水环境暴露监测和水质评价中的应用潜力巨大,但不完善的质量控制方法是其弱项之一[11],这使得不同研究间存在较大的变异性,从而很难直接为水质管理提供高质量数据。研究间的差异可能来源于采样至样品测试、数据分析的各个环节。为了减少被动采样结果的不确定性,有必要进一步完善质量控制,如完善采样速率校正方法,完善平衡分配系数(Ksw)等关键采样参数的确定方法等。
对于平衡采样器来说,Ksw的准确性直接关系着污染物浓度测量的准确性。但是实验测量某种材料Ksw是十分困难的,尤其是对于强疏水性化合物来说,往往需要极长时间才能达到平衡。DiFilippo和Eganhouse[63]综述了一些疏水性有机化合物在聚二甲基硅氧烷(PDMS)和水的平衡分配系数,不同研究间的Ksw变异性较高,导致浓度结果存在大约3倍的误差。有研究者提出可以使用某些Ksw值易于测量并且数据较为准确的物质作为参照物,在后续的Ksw测量实验中作为质量控制手段[64]。
对于时间累积采样器,采样速率(Rs)的确定至关重要。如上所述,Rs可能会受到流速、温度和生物污染等因素的影响,而实验室校正的参数与实际应用场景可能存在一定的差距。效能参考化合物(PRCs)法作为最常用的现场校正方法,在疏水性采样器中的应用十分成熟,但是对于极性采样器,仅有DIA-5、[2H3]-E2和[2H4]-EQ等极少数的化合物被证明可以作为PRCs[65],远不能满足极性采样器的实际需求,因此需要进一步寻找合适的PRCs或者开发新的现场校正方法,QSPR等模型方法可能是解决极性采样器校正采样速率难题的有效手段,但也有待进一步的研究确认。
5.4 发展被动采样技术与其他方法联用的新技术
进入21世纪以来,被动采样与非靶向分析、废水流行病学等方法的联合应用(图3),进一步发挥了其采样优势,并且促进了其他技术的发展,受到研究者的青睐。
靶向分析缺乏对未知污染物的关注,随着质谱分析方法的进步,非靶向分析(non-target analysis, NTA)利用对精确质量数、同位素分布和二级碎片信息的解读,实现了样品检测到化合物数量的显著增加,识别潜在未知污染物的能力大大提高。常规采样方法仅提供采样时刻的瞬时样本,容易造成对实际水体的估计出现偏差。被动采样灵敏的检出能力以及整合污染物浓度波动的能力,使其与非靶向分析的结合分别从采样和样品分析环节提高了污染物生态风险评估的可靠性。Beckers等[66]等使用液相色谱与高分辨质谱法对河流样品进行测试分析,应用针对纵向数据集设计的聚类分析,识别了污染物的3种空间分布模式,更为精准地完成了污染物的源解析。Gao等[31]将TECAM的提取物用于二维气相色谱和飞行时间质谱(GC×GC-TOFMS),对持久性、生物累积性和毒性(PBT)污染物进行非靶向筛查,逐级筛选出建议优先关注的PBT类新污染物,并进行了准确定量。
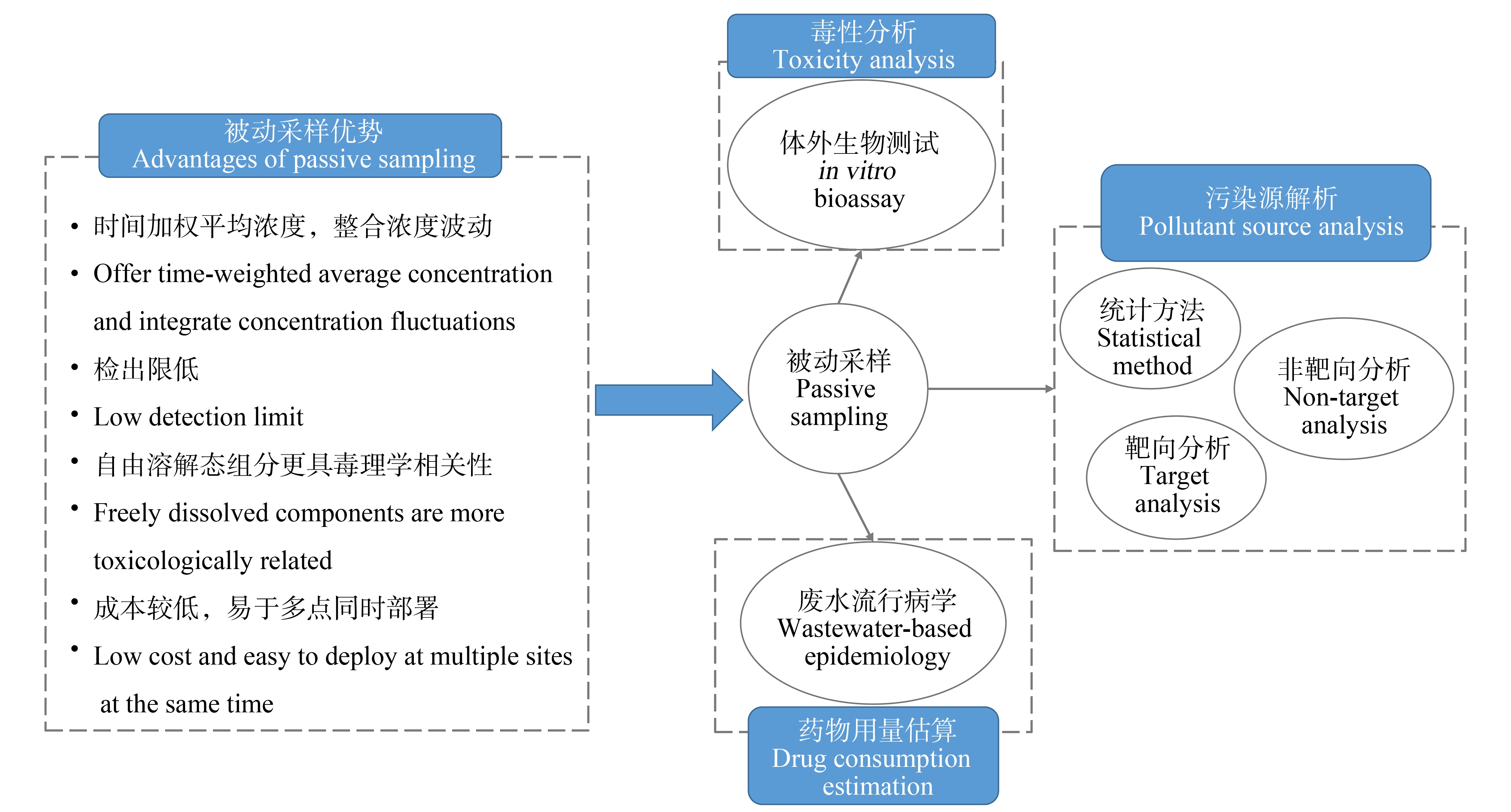
图3 水体被动采样联用技术的应用展望
Fig. 3 Application prospect of combined technology with passive sampling in water
基于废水流行病学(wastewater-based epidemiology, WBE)是实时检测人群药物使用量的有效工具[67]。WBE结果不确定性来源之一为收集样品的代表性。被动采样是针对污水处理厂废水中生物标志物采样的可行且低成本的方案。目前在WBE中应用被动采样技术的案例尚为有限,例如通过不同社区污水厂的长期被动采样,结合WBE估算比较不同人群之间的药物消耗量[28,39]。但污水厂进水流速波动,污水中高浓度溶解/悬浮固体和微生物的存在,以及生物膜形成可能性较高等因素都可能制约PSD监测结果的准确性,有待进一步改善[18,40]。
[1] Kot-Wasik A, Zabiega a B, Urbanowicz M, et al. Advances in passive sampling in environmental studies [J]. Analytica Chimica Acta, 2007, 602(2): 141-163
a B, Urbanowicz M, et al. Advances in passive sampling in environmental studies [J]. Analytica Chimica Acta, 2007, 602(2): 141-163
[2] Huckins J N, Manuweera G K, Petty J D, et al. Lipid-containing semipermeable membrane devices for monitoring organic contaminants in water [J]. Environmental Science & Technology, 1993, 27(12): 2489-2496
[3] Vrana B, Allan I J, Greenwood R, et al. Passive sampling techniques for monitoring pollutants in water [J]. TrAC Trends in Analytical Chemistry, 2005, 24(10): 845-868
[4] Booij K, Vrana B, Huckins J N. Chapter 7 Theory, modelling and calibration of passive samplers used in water monitoring [J]. Comprehensive Analytical Chemistry, 2007, 48: 141-169
[5] Alvarez D A, Petty J D, Huckins J N, et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments [J]. Environmental Toxicology and Chemistry, 2004, 23(7): 1640-1648
[6] Booij K. Passive sampler exchange kinetics in large and small water volumes under mixed rate control by sorbent and water boundary layer [J]. Environmental Toxicology and Chemistry, 2021, 40(5): 1241-1254
[7] Belles A, Pardon P, Budzinski H. Development of an adapted version of polar organic chemical integrative samplers (POCIS-Nylon) [J]. Analytical and Bioanalytical Chemistry, 2014, 406(4): 1099-1110
[8] Park G. The mathematics of diffusion: J. Crank Clarendon Press, Oxford, 1975.2nd edn. 414 pp.  £12.50 [J]. Polymer, 1975, 16(11): 855
£12.50 [J]. Polymer, 1975, 16(11): 855
[9] Mutzner L, Vermeirssen E L M, Mangold S, et al. Passive samplers to quantify micropollutants in sewer overflows: Accumulation behaviour and field validation for short pollution events [J]. Water Research, 2019, 160: 350-360
[10] Tran H N, You S J, Hosseini-Bandegharaei A, et al. Mistakes and inconsistencies regarding adsorption of contaminants from aqueous solutions: A critical review [J]. Water Research, 2017, 120: 88-116
[11] Booij K, Robinson C D, Burgess R M, et al. Passive sampling in regulatory chemical monitoring of nonpolar organic compounds in the aquatic environment [J]. Environmental Science & Technology, 2016, 50(1): 3-17
[12] Harman C, Allan I J, Vermeirssen E L M. Calibration and use of the polar organic chemical integrative sampler-a critical review [J]. Environmental Toxicology and Chemistry, 2012, 31(12): 2724-2738
[13] Huckins J N, Petty J D, Lebo J A, et al. Development of the permeability/performance reference compound approach for in situ calibration of semipermeable membrane devices [J]. Environmental Science & Technology, 2002, 36(1): 85-91
[14] Mazzella N, Lissalde S, Moreira S, et al. Evaluation of the use of performance reference compounds in an Oasis-HLB adsorbent based passive sampler for improving water concentration estimates of polar herbicides in freshwater [J]. Environmental Science & Technology, 2010, 44(5): 1713-1719
[15] Taylor A C, Fones G R, Vrana B, et al. Applications for passive sampling of hydrophobic organic contaminants in water-a review [J]. Critical Reviews in Analytical Chemistry, 2021, 51(1): 20-54
[16] Jeong Y, Schäffer A, Smith K. A comparison of equilibrium and kinetic passive sampling for the monitoring of aquatic organic contaminants in German Rivers [J]. Water Research, 2018, 145: 248-258
[17] O’Brien D, Lewis S, Davis A, et al. Spatial and temporal variability in pesticide exposure downstream of a heavily irrigated cropping area: Application of different monitoring techniques [J]. Journal of Agricultural and Food Chemistry, 2016, 64(20): 3975-3989
[18] McKay S, Tscharke B, Hawker D, et al. Calibration and validation of a microporous polyethylene passive sampler for quantitative estimation of illicit drug and pharmaceutical and personal care product (PPCP) concentrations in wastewater influent [J]. Science of the Total Environment, 2020, 704: 135891
[19] Kaserzon S L, Hawker D W, Booij K, et al. Passive sampling of perfluorinated chemicals in water: In-situ calibration [J]. Environmental Pollution, 2014, 186: 98-103
[20] Llorca J, Gutiérrez C, Capilla E, et al. Constantly stirred sorbent and continuous flow integrative sampler: New integrative samplers for the time weighted average water monitoring [J]. Journal of Chromatography A, 2009, 1216(31): 5783-5792
[21] Vrana B, Mills G A, Kotterman M, et al. Modelling and field application of the Chemcatcher passive sampler calibration data for the monitoring of hydrophobic organic pollutants in water [J]. Environmental Pollution, 2007, 145(3): 895-904
[22] Katritzky A R, Lobanov V S, Karelson M. QSPR: The correlation and quantitative prediction of chemical and physical properties from structure [J]. Chemical Society Reviews, 1995, 24(4): 279-287
[23] Hu J W, Zhang X Y, Wang Z W. A review on progress in QSPR studies for surfactants [J]. International Journal of Molecular Sciences, 2010, 11(3): 1020-1047
[24] Miller T H, Baz-Lomba J A, Harman C, et al. The first attempt at non-linear in silico prediction of sampling rates for polar organic chemical integrative samplers (POCIS) [J]. Environmental Science & Technology, 2016, 50(15): 7973-7981
[25] Miège C, Mazzella N, Allan I, et al. Position paper on passive sampling techniques for the monitoring of contaminants in the aquatic environment - Achievements to date and perspectives [J]. Trends in Environmental Analytical Chemistry, 2015, 8: 20-26
[26] Poulier G, Lissalde S, Charriau A, et al. Can POCIS be used in Water Framework Directive (2000/60/EC) monitoring networks? A study focusing on pesticides in a French agricultural watershed [J]. The Science of the Total Environment, 2014, 497-498: 282-292
[27] Tang J F, Chen S, Xu Y P, et al. Calibration and field performance of triolein embedded acetate membranes for passive sampling persistent organic pollutants in water [J]. Environmental Pollution, 2012, 164: 158-163
[28] Bishop N, Jones-Lepp T, Margetts M, et al. Wastewater-based epidemiology pilot study to examine drug use in the Western United States [J]. The Science of the Total Environment, 2020, 745: 140697
[29] Poulier G, Lissalde S, Charriau A, et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: Application of the passive sampling strategy [J]. Environmental Science and Pollution Research, 2015, 22(11): 8044-8057
[30] Monteyne E, Roose P, Janssen C R. Application of a silicone rubber passive sampling technique for monitoring PAHs and PCBs at three Belgian coastal harbours [J]. Chemosphere, 2013, 91(3): 390-398
[31] Gao X Z, Huang P, Huang Q H, et al. Organophosphorus flame retardants and persistent, bioaccumulative, and toxic contaminants in Arctic seawaters: On-board passive sampling coupled with target and non-target analysis [J]. Environmental Pollution, 2019, 253: 1-10
[32] Gao X Z, Xu Y P, Ma M, et al. Distribution, sources and transport of organophosphorus flame retardants in the water and sediment of Ny-Ålesund, Svalbard, the Arctic [J]. Environmental Pollution, 2020, 264: 114792
[33] Allan I J, Booij K, Paschke A, et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances [J]. Environmental Science & Technology, 2009, 43(14): 5383-5390
[34] Friedman C L, Burgess R M, Perron M M, et al. Comparing polychaete and polyethylene uptake to assess sediment resuspension effects on PCB bioavailability [J]. Environmental Science & Technology, 2009, 43(8): 2865-2870
[35] Liscio C, Magi E, Di Carro M, et al. Combining passive samplers and biomonitors to evaluate endocrine disrupting compounds in a wastewater treatment plant by LC/MS/MS and bioassay analyses [J]. Environmental Pollution, 2009, 157(10): 2716-2721
[36] Williams R J, Johnson A C, Smith J J, et al. Steroid estrogens profiles along river stretches arising from sewage treatment works discharges [J]. Environmental Science & Technology, 2003, 37(9): 1744-1750
[37] Mitchell C, Brodie J, White I. Sediments, nutrients and pesticide residues in event flow conditions in streams of the Mackay Whitsunday Region, Australia [J]. Marine Pollution Bulletin, 2005, 51(1-4): 23-36
[38] Rabiet M, Margoum C, Gouy V, et al. Assessing pesticide concentrations and fluxes in the stream of a small vineyard catchment—Effect of sampling frequency [J]. Environmental Pollution, 2010, 158(3): 737-748
[39] Baz-Lomba J A, Harman C, Reid M, et al. Passive sampling of wastewater as a tool for the long-term monitoring of community exposure: Illicit and prescription drug trends as a proof of concept [J]. Water Research, 2017, 121: 221-230
[40] Allan I J, Vrana B, Greenwood R, et al. A “toolbox” for biological and chemical monitoring requirements for the European Union’s Water Framework Directive [J]. Talanta, 2006, 69(2): 302-322
[41] Ort C, Lawrence M G, Reungoat J, et al. Sampling for PPCPs in wastewater systems: Comparison of different sampling modes and optimization strategies [J]. Environmental Science & Technology, 2010, 44(16): 6289-6296
[42] Carlson J C, Challis J K, Hanson M L, et al. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges [J]. Environmental Toxicology and Chemistry, 2013, 32(2): 337-344
[43] Rantalainen A L, Cretney W J, Ikonomou M G. Uptake rates of semipermeable membrane devices (SPMDs) for PCDDs, PCDFs and PCBs in water and sediment [J]. Chemosphere, 2000, 40(2): 147-158
[44] Li H X, Helm P A, Metcalfe C D. Sampling in the Great Lakes for pharmaceuticals, personal care products, and endocrine-disrupting substances using the passive polar organic chemical integrative sampler [J]. Environmental Toxicology and Chemistry, 2010, 29(4): 751-762
[45] Vrana B, Schüürmann G. Calibrating the uptake kinetics of semipermeable membrane devices in water: Impact of hydrodynamics [J]. Environmental Science & Technology, 2002, 36(2): 290-296
[46] Li H X, Vermeirssen E L, Helm P A, et al. Controlled field evaluation of water flow rate effects on sampling polar organic compounds using polar organic chemical integrative samplers [J]. Environmental Toxicology and Chemistry, 2010, 29(11): 2461-2469
[47] Novic A J, O’Brien D S, Kaserzon S L, et al. Monitoring herbicide concentrations and loads during a flood event: A comparison of grab sampling with passive sampling [J]. Environmental Science & Technology, 2017, 51(7): 3880-3891
[48] Gong X Y, Li K, Wu C L, et al. Passive sampling for monitoring polar organic pollutants in water by three typical samplers [J]. Trends in Environmental Analytical Chemistry, 2018, 17: 23-33
[49] Charlestra L, Amirbahman A, Courtemanch D L, et al. Estimating pesticide sampling rates by the polar organic chemical integrative sampler (POCIS) in the presence of natural organic matter and varying hydrodynamic conditions [J]. Environmental Pollution, 2012, 169: 98-104
[50] Bernal-González M, Durán-Domínguez-de-Bazúa C. Development of a passive sampler for monitoring of carbamate and s-triazine pesticides in surface waters [J]. Water, Air, & Soil Pollution, 2012, 223(8): 5071-5085
[51] Sobotka J, Lammel G, Slobodník J, et al. Dynamic passive sampling of hydrophobic organic compounds in surface seawater along the South Atlantic Ocean east-to-west transect and across the Black Sea [J]. Marine Pollution Bulletin, 2021, 168: 112375
[52] Moeris S, Vanryckeghem F, Demeestere K, et al. A margin of safety approach for the assessment of environmentally realistic chemical mixtures in the marine environment based on combined passive sampling and ecotoxicity testing [J]. The Science of the Total Environment, 2021, 765: 142748
[53] Vincent-Hubert F, Wacrenier C, Morga B, et al. Passive samplers, a powerful tool to detect viruses and bacteria in marine coastal areas [J]. Frontiers in Microbiology, 2021, 12: 631174
[54] Schreiner V C, Bakanov N, Kattwinkel M, et al. Sampling rates for passive samplers exposed to a field-relevant peak of 42 organic pesticides [J]. The Science of the Total Environment, 2020, 740: 140376
[55] Hawker D W. Modeling the response of passive samplers to varying ambient fluid concentrations of organic contaminants [J]. Environmental Toxicology and Chemistry, 2010, 29(3): 591-596
[56] Mutzner L, Vermeirssen E L M, Ort C. Passive samplers in sewers and rivers with highly fluctuating micropollutant concentrations - Better than we thought [J]. Journal of Hazardous Materials, 2019, 361: 312-320
[57] Shaw M, Mueller J F. Time integrative passive sampling: How well do chemcatchers integrate fluctuating pollutant concentrations? [J]. Environmental Science & Technology, 2009, 43(5): 1443-1448
[58] Jones L, Ronan J, McHugh B, et al. Emerging priority substances in the aquatic environment: A role for passive sampling in supporting WFD monitoring and compliance [J]. Analytical Methods, 2015, 7(19): 7976-7984
[59] Morin N, Miège C, Coquery M, et al. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments [J]. TrAC Trends in Analytical Chemistry, 2012, 36: 144-175
[60] Endo S, Matsuura Y. Characterizing sorption and permeation properties of membrane filters used for aquatic integrative passive samplers [J]. Environmental Science & Technology, 2018, 52(4): 2118-2125
[61] Endo S, Matsuura Y, Vermeirssen E L M. Mechanistic model describing the uptake of chemicals by aquatic integrative samplers: Comparison to data and implications for improved sampler configurations [J]. Environmental Science & Technology, 2019, 53(3): 1482-1489
[62] Bernard M, Boutry S, Tapie N, et al. Lab-scale investigation of the ability of polar organic chemical integrative sampler to catch short pesticide contamination peaks [J]. Environmental Science and Pollution Research International, 2022, 29(1): 40-50
[63] DiFilippo E L, Eganhouse R P. Assessment of PDMS-water partition coefficients: Implications for passive environmental sampling of hydrophobic organic compounds [J]. Environmental Science & Technology, 2010, 44(18): 6917-6925
[64] Jahnke A, Mayer P, Adolfsson-Erici M, et al. Equilibrium sampling of environmental pollutants in fish: Comparison with lipid-normalized concentrations and homogenization effects on chemical activity [J]. Environmental Toxicology and Chemistry, 2011, 30(7): 1515-1521
[65] Vallejo A, Prieto A, Moeder M, et al. Calibration and field test of the polar organic chemical integrative samplers for the determination of 15 endocrine disrupting compounds in wastewater and river water with special focus on performance reference compounds (PRC) [J]. Water Research, 2013, 47(8): 2851-2862
[66] Beckers L M, Brack W, Dann J P, et al. Unraveling longitudinal pollution patterns of organic micropollutants in a river by non-target screening and cluster analysis [J]. The Science of the Total Environment, 2020, 727: 138388
[67] Hahn R Z, Augusto do Nascimento C, Linden R. Evaluation of illicit drug consumption by wastewater analysis using polar organic chemical integrative sampler as a monitoring tool [J]. Frontiers in Chemistry, 2021, 9: 596875