以水体富营养化为重要诱因的水华污染是水体中藻类大量繁殖的一种自然现象。铜绿微囊藻(Microcystis aeruginosa)因其特殊的年生长周期、高效的氮吸收以及浮力调控等特性,普遍存在于全球温暖地区的湖泊、河流和水库等淡水系统,是众多水华污染的优势种[1-3]。铜绿微囊藻正常生理代谢可以产生剧毒的微囊藻毒素,在藻细胞衰老或破裂时释放至周围环境,对周围生物乃至人类健康产生严重威胁[4-6]。由铜绿微囊藻导致的水华污染防控已成为世界性难题。
大型植物能够抑制微囊藻的生长,相关机制包括光照遮阴、营养物质竞争和化感作用等[7-8]。其中,化感作用(allelopathy)是指部分植物(也包括部分微生物)释放某些化学物质至外部环境,从而对邻近个体的生长发育产生影响[9-11]。与人工合成的化学物质相比,化感物质属于植物正常生理代谢产生的天然物质,一般在环境中有其自然的降解途径,因此施用后对环境污染小[12],在调控水华藻的生长繁殖领域被寄予厚望。
化感物质发挥作用具有显著的种属特性[9-10],其中一个表现为不同化感物质对同一种藻具有不同的化感作用强度。酚酸广泛存在于水生植物体内[13-16],已有研究发现包括没食子酸、水杨酸、肉桂酸、阿魏酸和咖啡酸等众多酚酸具有抑制铜绿微囊藻的作用,但抑制作用的半数效应浓度(50% effective concentration, EC50)差异显著[17-18]。就分子结构而言,一个苯环和一个活性羧基是酚酸类化合物的共有基团,苯环上羟基或甲氧基等取代基的位置和数目构成了分子结构的多样性,该类化合物对铜绿微囊藻的化感抑制作用强度和其分子结构之间的内在关联尚不清楚;全面考察常见酚酸对铜绿微囊藻抑制作用的剂量效应关系、筛查出高效抑藻化合物十分必要。定量构效关系(quantitative structure-activity relationship, QSAR)研究方法以数理统计原理为基础,能够在生物受体未知的前提下,揭示化合物分子结构描述符与其生物活性之间的定量变化规律,并析出具有预测作用的数学模型,广泛应用于生命科学和环境科学等领域[19-21]。其中,比较分子相似性指数分析方法(comparative molecular similarity index analysis, CoMSIA)从立体场、静电场、疏水场、H键供体场和H键受体场5个方面描述分子立体结构特征,有助于全面揭示分子结构与其生物学活性之间的关系。因此,本文以常见酚酸为研究对象,在全面考察其对铜绿微囊藻的化感抑制剂量效应的基础上,采用CoMSIA方法阐明该类化合物分子结构特征与其化感抑藻强度之间的关系,为利用酚酸调控铜绿微囊藻生长与繁殖提供理论支撑。
1 材料与方法(Materials and methods)
1.1 实验材料
铜绿微囊藻购自中国科学院武汉水生生物研究所淡水藻种库,编号FACHB-315。酚酸购自阿拉丁试剂(上海,中国),种类如表1所示,纯度均为分析纯。
表1 酚酸抑制铜绿微囊藻的实验值与模型分析值
Table 1 The experimental and model predicted values of phenolic acids to Microcystis aeruginosa
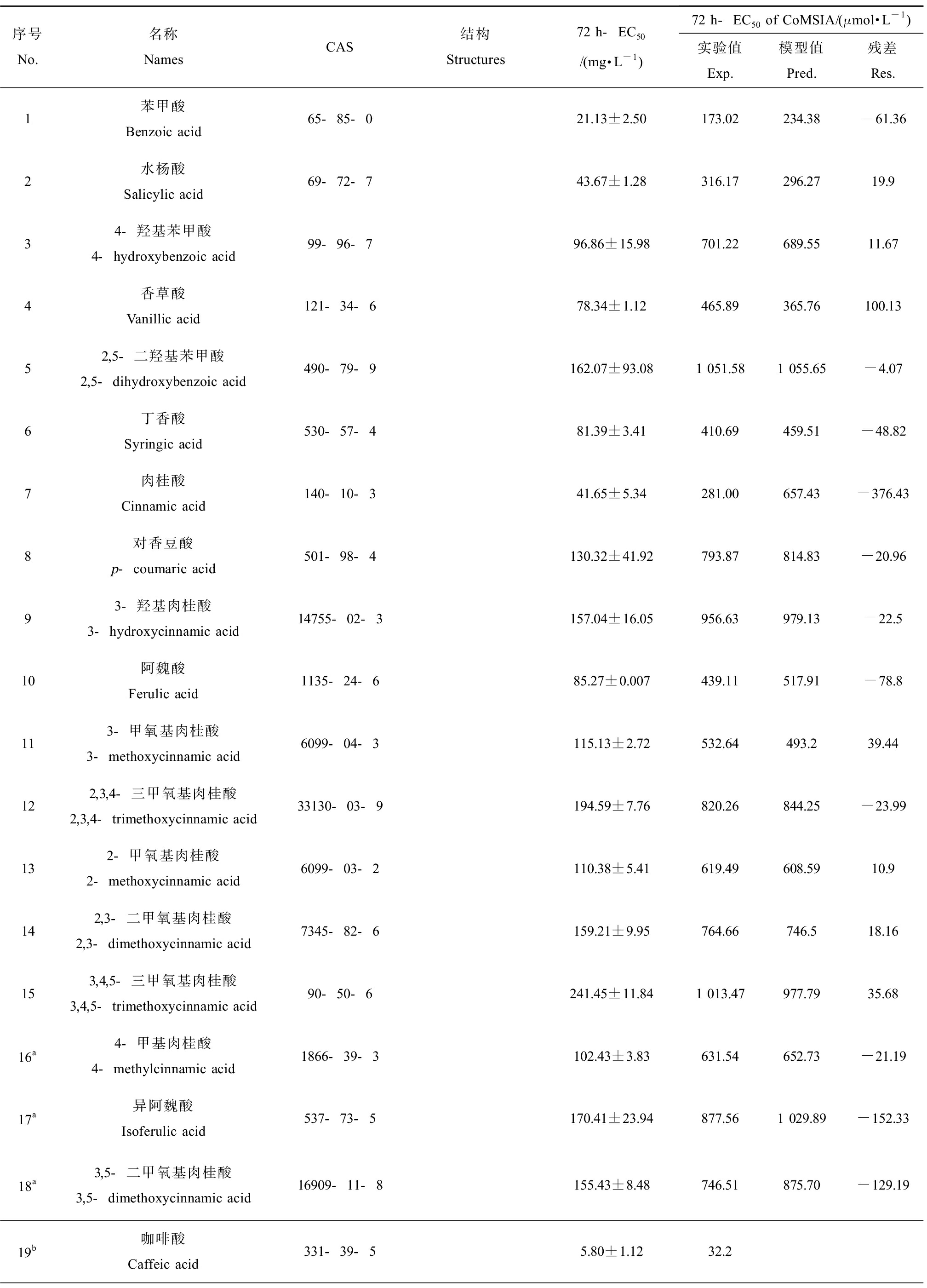
序号No.名称NamesCAS结构Structures72 h-EC50/(mg·L-1)72 h-EC50 of CoMSIA/(μmol·L-1)实验值Exp.模型值Pred.残差Res.1苯甲酸Benzoic acid65-85-021.13±2.50173.02234.38-61.362水杨酸Salicylic acid69-72-743.67±1.28316.17296.2719.934-羟基苯甲酸4-hydroxybenzoic acid99-96-796.86±15.98701.22689.5511.674香草酸Vanillic acid121-34-678.34±1.12465.89365.76100.1352,5-二羟基苯甲酸2,5-dihydroxybenzoic acid490-79-9162.07±93.081 051.581 055.65-4.076丁香酸Syringic acid530-57-481.39±3.41410.69459.51-48.827肉桂酸Cinnamic acid140-10-341.65±5.34281.00657.43-376.438对香豆酸p-coumaric acid501-98-4130.32±41.92793.87814.83-20.9693-羟基肉桂酸3-hydroxycinnamic acid14755-02-3157.04±16.05956.63979.13-22.510阿魏酸Ferulic acid1135-24-685.27±0.007439.11517.91-78.8113-甲氧基肉桂酸3-methoxycinnamic acid6099-04-3115.13±2.72532.64493.239.44122,3,4-三甲氧基肉桂酸2,3,4-trimethoxycinnamic acid33130-03-9194.59±7.76820.26844.25-23.99132-甲氧基肉桂酸2-methoxycinnamic acid6099-03-2110.38±5.41619.49608.5910.9142,3-二甲氧基肉桂酸2,3-dimethoxycinnamic acid7345-82-6159.21±9.95764.66746.518.16153,4,5-三甲氧基肉桂酸3,4,5-trimethoxycinnamic acid90-50-6241.45±11.841 013.47977.7935.6816a4-甲基肉桂酸4-methylcinnamic acid1866-39-3102.43±3.83631.54652.73-21.1917a异阿魏酸Isoferulic acid537-73-5170.41±23.94877.561 029.89-152.3318a3,5-二甲氧基肉桂酸3,5-dimethoxycinnamic acid16909-11-8155.43±8.48746.51875.70-129.1919b咖啡酸Caffeic acid331-39-55.80±1.1232.2

续表1序号No.名称NamesCAS结构Structures72 h-EC50/(mg·L-1)72 h-EC50 of CoMSIA/(μmol·L-1)实验值Exp.模型值Pred.残差Res.20b芥子酸Sinapic acid530-59-64.90±0.5821.85
注:a预测集化合物;b化合物未参与建模。
Note: a Test set compounds; b Compounds were not involved in model.
1.2 藻细胞培养和酚酸化合物抑藻活性测试
采用BG11(Blue-Green Medium)培养基进行藻细胞的人工培养,主要培养条件为:温度(25±1) ℃、光强4 000 lx、光暗比12 h∶12 h、摇床转速150 r·min-1;每间隔96 h进行一次转接,反复3~5次,采用基本达到同步生长的藻液作为实验藻种。
准确称取酚酸化合物,用二甲基亚砜(DMSO)溶解并定容,获得高浓度母液;采用培养基稀释对数生长期的藻种,获得藻密度为~104 个·mL-1的试验藻液;在试验藻液中加入一定体积的酚酸高浓度母液,获得具有5~7个浓度梯度的酚酸暴露液,控制暴露液中DMSO体积分数≤1%,并设置DMSO溶剂对照组。每个处理3个平行,每个化合物至少进行3次生物学重复。采用血球计数板计数方法获得藻细胞密度(个·mL-1),并建立其与藻液光密度OD680之间的相关关系。分别于酚酸暴露后0、24、48和72 h测定各样品OD680值,换算成藻细胞密度后,计算每个处理对藻细胞生长与繁殖的抑制率。采用概率单位回归法计算各化合物对铜绿微囊藻的72 h-EC50值。
1.3 三维定量构效关系建模
定量构效关系模型采用CoMSIA构建,所有计算机操作均采用SYBYL7.0软件各模块完成。建模主要参数为:酚酸分子结构优化使用Tripos力场,Gasteiger-Huckel电荷;能量最小化计算时,Gradient阈值为0.005,最大迭代次数为1 000;采用Align Database进行分子叠合,苯甲酸作为叠合模板,叠合效果如图1所示;未进一步说明的参数均采用SYBYL软件默认设定值。生物活性数据采用以物质的量浓度单位计的72 h-EC50(μmol·L-1)。统计学分析中,采用偏最小二乘(partial least squares analysis, PLS)方法建立模型,获得交叉验证相关系数(Q2);采用抽一法(leave-one-out, LOO)进行交叉验证,获得模型的相关系数(R2)等参数。
图1 酚酸类化合物分子叠合图
Fig. 1 Overlay chart of the phenolic acids
2 结果与分析(Results and analysis)
2.1 酚酸类化合物抑制铜绿微囊藻的剂量效应
20种酚酸对铜绿微囊藻生长与繁殖的化感抑制作用结果如表1所示,72 h-EC50数值范围为4.90~194.59 mg·L-1,其中咖啡酸的化感抑藻活性最强,72 h-EC50为(4.90±0.58) mg·L-1和(5.80±1.12) mg·L-1,2,3,4-三甲氧基肉桂酸和3,4,5-三甲氧基肉桂酸的化感抑藻活性最低,72 h-EC50接近200 mg·L-1。剂量效应关系显示,虽然酚酸类化合物分子结构具有较大共性,但苯环上取代基类型和数量、取代位点等特征对化合物抑制铜绿微囊藻的活性影响显著。
2.2 酚酸类化合物抑制铜绿微囊藻生长与繁殖的构效关系
2.2.1 CoMSIA建模统计学分析
采用CoMSIA方法定量研究酚酸类化合物结构特征与其抑制铜绿微囊藻生长与繁殖72 h-EC50之间的关系,构建最优的CoMSIA模型,统计学参数如表2所示,Q2和R2分别为0.694和0.97,表明获得的模型具有一定的可靠性;由于立体场、疏水场和H键受体场的贡献值非常小,因此剔除以上3个场构建CoMSIA Ⅱ模型,Q2上升至0.728。酚酸类化合物抑制铜绿微囊藻EC50实验值与CoMSIA Ⅱ模型预测值的关系如图2所示,静电场和H键供体场的贡献值分别为51.6%和48.4%,说明酚酸分子结构静电和H键供体特征对其化感抑藻活性影响显著。采用CoMSIA II模型计算预测集化合物72 h-EC50,获得![]() 为0.96。以上参数表明所建立的模型稳健可靠,具有较好的预测能力。
为0.96。以上参数表明所建立的模型稳健可靠,具有较好的预测能力。
表2 CoMSIA模型的偏最小二乘法(PLS)分析结果
Table 2 Partial least squares (PLS) result of CoMSIA
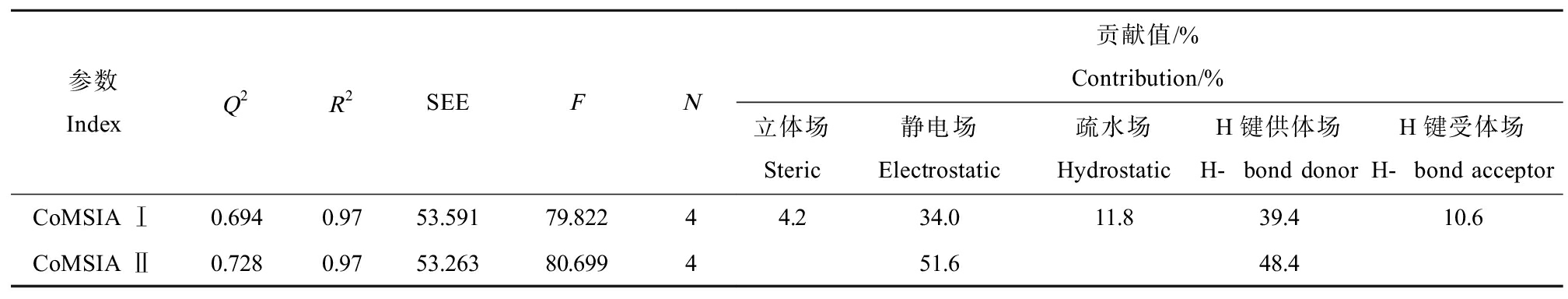
参数 IndexQ2R2SEEFN贡献值/%Contribution/%立体场Steric静电场Electrostatic疏水场HydrostaticH键供体场H-bond donorH键受体场H-bond acceptorCoMSIA Ⅰ0.6940.9753.59179.82244.234.011.839.410.6CoMSIA Ⅱ0.7280.9753.26380.699451.648.4
注:CoMSIA为比较分子相似性指数。
Note:CoMSIA is comparative molecular similarity index.
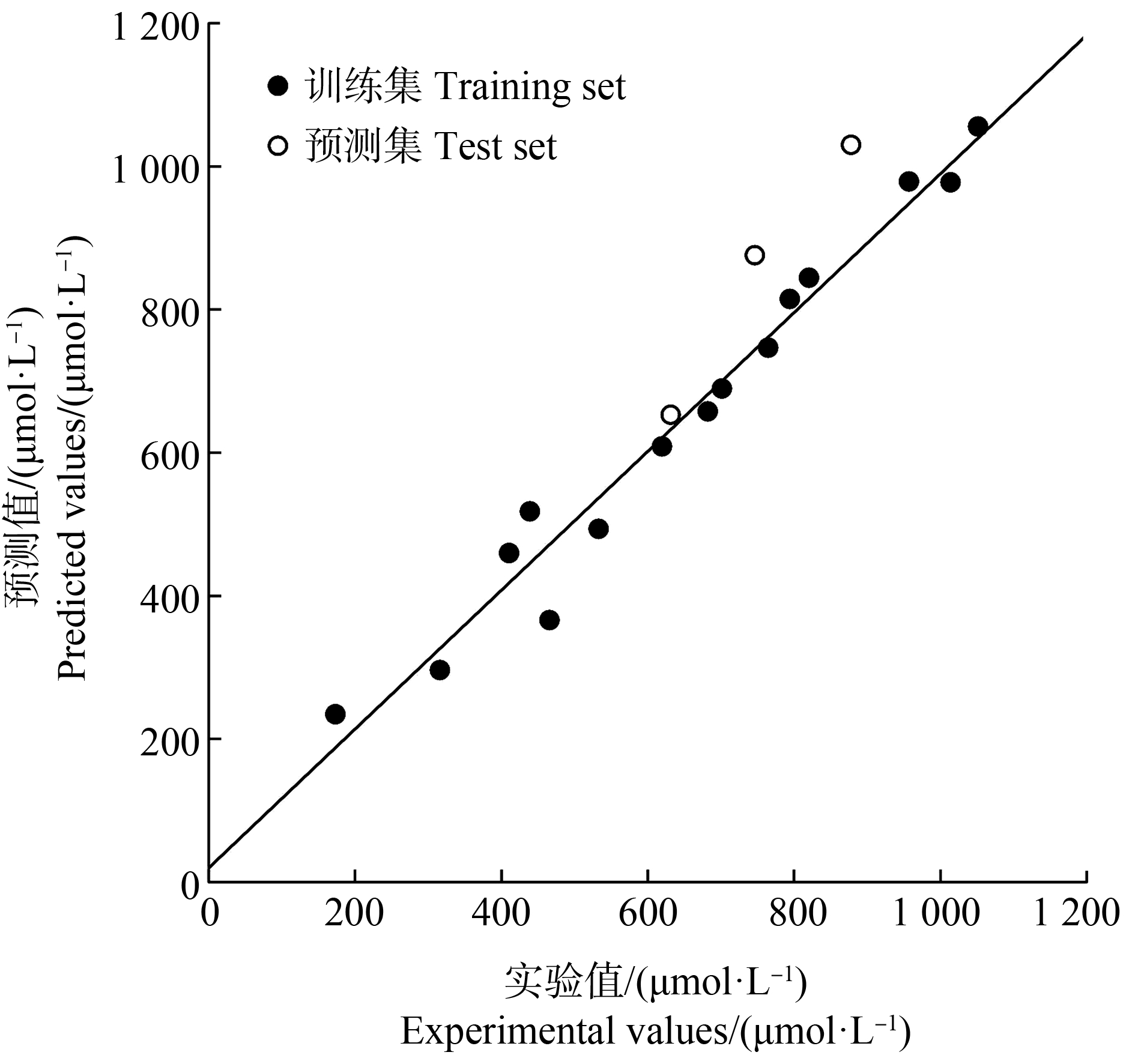
图2 酚酸类化合物抑制铜绿微囊藻EC50实验值与CoMSIA Ⅱ模型预测值的关系图
注:EC50为半数效应浓度。
Fig. 2 The relation schema of EC50 between predicted values and experimental values of phenolic acids to Microcystis aeruginosa
Note: EC50 is concentration for 50% of maximal effect.
2.2.2 CoMSIA Ⅱ三维等高图分析
CoMSIA Ⅱ三维等高图如图3所示。其中,在静电场中,红色和蓝色分别表示该色块覆盖区域增加带负电基团,将相应增强和减弱化合物的化感抑藻活性;在H键供体场中,蓝绿色和紫色分别表示在该色块覆盖区域增加氢键供体,将相应增强和减弱化合物的化感抑藻活性。

图3 CoMSIA Ⅱ模型三维等势图
注:(a)静电场;(b)H键供体场。
Fig. 3 Contour maps of CoMSIA Ⅱ model
Note: (a) Electrostatic field; (b) H-bond donor field.
在CoMSIA Ⅱ模型静电场中,苯环1号位置覆盖了大面积的蓝色色块,表示1号取代基存在电负性较大的基团,将减弱化合物的化感抑藻活性。苯甲酸与肉桂酸、4-羟基苯甲酸与对香豆酸2对化合物分子结构只有1位取代基存在差异,前者1位取代基为羧基,后者为苯烯酸,二者的化感抑藻活性随1位取代基电负性增大而减小。在苯环3号位置覆盖了红色色块,代表3号取代基存在电负性较大的基团,将增强化合物的化感抑藻活性。比较4-羟基苯甲酸与香草酸、肉桂酸与3-甲氧基肉桂酸、对香豆酸与阿魏酸3组化合物,发现在其他分子结构一致的前提下,在苯环3号位上增加甲氧基取代基团,导致3号位点附近电子云密度增大,相应化感抑藻活性都呈增加的趋势。以上实验结果与CoMSIA Ⅱ模型静电场色块图指示的构效关系规律契合良好。
在CoMSIA Ⅱ模型H键供体场中,苯环3和4号位置附近存在蓝绿色色块,代表在该位点存在H键供体取代基将导致酚酸化感抑藻活性的增强。4-羟基苯甲酸、香草酸、阿魏酸和对香豆酸等化合物分子结构中3或4位取代基富含羟基,是良好的H键供体,有利于该化合物抑藻活性的增加。
3 讨论(Discussion)
3.1 酚酸类化合物对铜绿微囊藻的化感抑制活性
化感物质是水生态系统中通过化感作用进行水华藻防控的物质基础。国内外学者在植物浸提液防控水华藻类效能、有效成分提取鉴定方面做了大量研究,包括咖啡酸、水杨酸在内的多种酚酸类物质被逐步分离鉴定并获得关注,采用经典急性毒性测试方法获得酚酸类物质抑制铜绿微囊藻的作用浓度多在mg·L-1的水平[22-29],与本研究结果类似。
化感物质通过多种途径抑制藻细胞生长和繁殖的同时,藻细胞也能产生相应的胁迫适应。藻细胞对外源酚酸胁迫的应答主要表现在2个方面,其一,由于藻细胞体积小、比表面积大,藻细胞能够将酚酸吸附在细胞表面或累积在细胞内[30-31];其二,在某些特定情况下,酚酸可以作为碳源而被藻细胞分解代谢[32-33]。由于藻细胞对酚酸的吸附、累积或代谢作用,可以缩短酚酸在水体中的赋存时间,因此认为酚酸是一类潜在的环境友好型抑藻剂。
3.2 酚酸类化合物抑制铜绿微囊藻的定量构效关系
CoMSIA方法可以同时描述分子周围静电场、H键供体场、H键受体场、立体场和疏水场5个场信息,本研究在建模过程中发现只采用前2种场参数即能良好描述酚酸类物质抑制铜绿微囊藻的构效关系,且获得的模型Q2最高。在建模过程中,本研究也尝试了比较分子场分析方法,以分子的立体场和静电场性质构建模型,未成功。以上结果显示,分子结构的静电和H键供体特征是描述酚酸抑制铜绿微囊藻生长与繁殖的重要参数,由此推测酚酸与藻细胞的相互作用过程中可能存在电子转移和形成H键的反应。
3.3 咖啡酸和芥子酸对铜绿微囊藻的化感抑制作用
与本研究中涉及的其他酚酸化合物相比,咖啡酸和芥子酸对铜绿微囊藻表现出了非常显著的抑制效应,72 h-EC50数值较其他酚酸低一个数量级;采用CoMSIA构建构效关系模型,需剔除2种酸才能成功建模;根据模型预测咖啡酸和芥子酸的72 h-EC50与实验值差异巨大。
就咖啡酸铜绿微囊藻暴露体系,Nakai等[23]认为包括咖啡酸在内的富含2个间位羟基的多酚化合物在碱性条件下容易发生自氧化作用,自氧化产物导致抑藻效能增强;Herrera等[34]在暴露体系中检测到了咖啡酸的氧化产物,并推测微囊藻毒素LR是氧化剂。本研究中发现,以咖啡酸为代表的具有自氧化属性的酚酸,在与藻细胞暴露过程中均发生变色现象,即随着暴露时间的延长,暴露体系中除藻体绿色之外,还出现了咖啡酸被氧化后产生的咖啡色,据此推测在暴露过程中咖啡酸的分子结构存在一个动态变化过程。在芥子酸铜绿微囊藻暴露体系中,随着暴露时间的延长,亦观察到了除藻体绿色之外的其他颜色。综上,我们推测咖啡酸和芥子酸的抑藻作用机制,与其他结构类似酚酸的作用机制可能存在较大差异。
致谢:感谢中国科学院生态环境研究中心杜宇国和魏东斌研究员研究团队给予SYBYL软件平台的支持和建模过程的指导帮助!
[1] Zhu Y Y, Cheng S, Wang P, et al. A possible environmental-friendly removal of Microcystis aeruginosa by using pyroligneous acid [J]. Ecotoxicology and Environmental Safety, 2020, 205: 111159
[2] Wang R, Hua M, Yu Y, et al. Evaluating the effects of allelochemical ferulic acid on Microcystis aeruginosa by pulse-amplitude-modulated (PAM) fluorometry and flow cytometry [J]. Chemosphere, 2016, 147: 264-271
[3] Ni L X, Rong S Y, Gu G X, et al. Inhibitory effect and mechanism of linoleic acid sustained-release microspheres on Microcystis aeruginosa at different growth phases [J]. Chemosphere, 2018, 212: 654-661
[4] Cao Q, Steinman A D, Su X M, et al. Effects of microcystins contamination on soil enzyme activities and microbial community in two typical lakeside soils [J]. Environmental Pollution, 2017, 231(Pt 1): 134-142
[5] Kumar P, Hegde K, Brar S K, et al. Potential of biological approaches for cyanotoxin removal from drinking water: A review [J]. Ecotoxicology and Environmental Safety, 2019, 172: 488-503
[6] Zhang L, Liu J T, Zhang D W, et al. Seasonal and spatial variations of microcystins in Poyang Lake, the largest freshwater lake in China [J]. Environmental Science and Pollution Research International, 2018, 25(7): 6300-6307
[7] Tillett D, Dittmann E, Erhard M, et al. Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC7806: An integrated peptide-polyketide synthetase system [J]. Chemistry & Biology, 2000, 7(10): 753-764
[8] Mulderij G, van Nes E H, van Donk E. Macrophyte-phytoplankton interactions: The relative importance of allelopathy versus other factors [J]. Ecological Modelling, 2007, 204(1-2): 85-92
[9] Kong C H, Xuan T D, Khanh T D, et al. Allelochemicals and signaling chemicals in plants [J]. Molecules, 2019, 24(15): 2737
[10] 孔垂华. 植物种间和种内的化学作用[J]. 应用生态学报, 2020, 31(7): 2141-2150
Kong C H. Inter-specific and intra-specific chemical interactions among plants [J]. Chinese Journal of Applied Ecology, 2020, 31(7): 2141-2150 (in Chinese)
[11] Rice E L. Allelopathy [M]. 2nd ed. Orlando: Academic Press, 1984: 119
[12] Schreidah C M, Ratnayake K, Senarath K, et al. Microcystins: Biogenesis, toxicity, analysis, and control [J]. Chemical Research in Toxicology, 2020, 33(9): 2225-2246
[13] Xian Q M, Chen H D, Liu H L, et al. Isolation and identification of antialgal compounds from the leaves of Vallisneria spiralis L. by activity-guided fractionation [J]. Environmental Science and Pollution Research International, 2006, 13(4): 233-237
[14] Park M H, Chung I M, Ahmad A, et al. Growth inhibition of unicellular and colonial Microcystis strains (Cyanophyceae) by compounds isolated from rice (Oryza sativa) hulls [J]. Aquatic Botany, 2009, 90(4): 309-314
[15] Li B H, Yin Y J, Kang L F, et al. A review: Application of allelochemicals in water ecological restoration: Algal inhibition [J]. Chemosphere, 2021, 267: 128869
[16] Zhu X Q, Dao G H, Tao Y, et al. A review on control of harmful algal blooms by plant-derived allelochemicals [J]. Journal of Hazardous Materials, 2021, 401: 123403
[17] 张庭廷, 韩玉珍, 何宗祥, 等. 酚酸类物质对铜绿微囊藻以及蛋白核小球藻的抑藻作用[J]. 卫生研究, 2016, 45(3): 448-451, 457
Zhang T T, Han Y Z, He Z X, et al. Joint inhibitory effects researches on Microcystis aeruginosa and Chlorella pyrenoidosa of phenolic acids [J]. Journal of Hygiene Research, 2016, 45(3): 448-451, 457 (in Chinese)
[18] 高云霓, 刘碧云, 王静, 等. 苦草(Vallisneria spiralis)释放的酚酸类物质对铜绿微囊藻(Microcystis aeruginosa)的化感作用[J]. 湖泊科学, 2011, 23(5): 761-766
Gao Y N, Liu B Y, Wang J, et al. Allelopathic effects of phenolic compounds released by Vallisneria spiralis on Microcystis aeruginosa [J]. Journal of Lake Sciences, 2011, 23(5): 761-766 (in Chinese)
[19] Li M, Wei D B, Zhao H M, et al. Genotoxicity of quinolones: Substituents contribution and transformation products QSAR evaluation using 2D and 3D models [J]. Chemosphere, 2014, 95: 220-226
[20] 魏东斌, 赵慧敏, 杜宇国. 二苯甲酮类紫外防晒剂发光菌急性毒性及QSAR研究[J]. 生态毒理学报, 2017, 12(3): 234-242
Wei D B, Zhao H M, Du Y G. Acute toxicity and QSAR studies on benzophenone-type UV-filters to Photobacterium [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 234-242 (in Chinese)
[21] 马舒颖. 化合物安全风险评估的QSAR/QSPR研究[D]. 兰州: 兰州大学, 2015: 13-15
Ma S Y. Studies of QSAR/QSPR for the risk assessment of chemicals [D]. Lanzhou: Lanzhou University, 2015: 13-15 (in Chinese)
[22] 钱燕萍, 赵楚, 田如男. 水生植物对藻类的化感作用研究进展[J]. 生物学杂志, 2018, 35(6): 95-97
Qian Y P, Zhao C, Tian R N. Research advances in inhibitory effects on phytoplankton mediated by aquatic plants [J]. Journal of Biology, 2018, 35(6): 95-97 (in Chinese)
[23] Nakai S, Inoue Y, Hosomi M. Algal growth inhibition effects and inducement modes by plant-producing phenols [J]. Water Research, 2001, 35(7): 1855-1859
[24] Gao Y N, Ge F J, Zhang L P, et al. Enhanced toxicity to the cyanobacterium Microcystis aeruginosa by low-dosage repeated exposure to the allelochemical N-phenyl-1-naphthylamine [J]. Chemosphere, 2017, 174: 732-738
[25] Lu Z Y, Liu B Y, He Y, et al. Effects of daily exposure of cyanobacterium and chlorophyte to low-doses of pyrogallol [J]. Allelopathy Journal, 2014, 34(2): 195-205
[26] Laue P, Bährs H, Chakrabarti S, et al. Natural xenobiotics to prevent cyanobacterial and algal growth in freshwater: Contrasting efficacy of tannic acid, gallic acid, and gramine [J]. Chemosphere, 2014, 104: 212-220
[27] 胡利静, 童桂香, 黄光华, 等. 水杨酸对铜绿微囊藻的化感抑制作用[J]. 南方农业学报, 2017, 48(1): 169-173
Hu L J, Tong G X, Huang G H, et al. Allelopathy inhibition of salicylic acid on Microcystis aeruginosa [J]. Journal of Southern Agriculture, 2017, 48(1): 169-173 (in Chinese)
[28] 赵楚, 钱燕萍, 田如男. 梭鱼草化感物质丁二酸、肉桂酸及香草酸对铜绿微囊藻生长的抑制效应[J]. 浙江农林大学学报, 2020, 37(6): 1105-1111
Zhao C, Qian Y P, Tian R N. Inhibitory effect of succinic acid, cinnamic acid and vanillic acid from Pontederia cordata on Microcystis aeruginosa [J]. Journal of Zhejiang A & F University, 2020, 37(6): 1105-1111 (in Chinese)
[29] 朱小琴, 刀国华, 陶益, 等. 典型植物化感物质对铜绿微囊藻生长的抑制效果评价[J]. 中国环境科学, 2020, 40(5): 2230-2237
Zhu X Q, Dao G H, Tao Y, et al. Evaluation of growth inhibition of typical plant-derived allelochemicals on Microcystis aeruginosa [J]. China Environmental Science, 2020, 40(5): 2230-2237 (in Chinese)
[30] Hardy J T, Dauble D D, Felice L J. Aquatic fate of synfuel residuals: Bioaccumulation of aniline and phenol by the freshwater phytoplankter Scenedesmus quadricauda [J]. Environmental Toxicology and Chemistry, 1985, 4(1): 29
[31] Newsted J L. Effect of light, temperature, and pH on the accumulation of phenol by Selenastrum capricornutum, a green alga [J]. Ecotoxicology and Environmental Safety, 2004, 59(2): 237-243
[32] Lika K, Papadakis I A. Modeling the biodegradation of phenolic compounds by microalgae [J]. Journal of Sea Research, 2009, 62(2-3): 135-146
[33] Papazi A, Kotzabasis K. Bioenergetic strategy of microalgae for the biodegradation of phenolic compounds: Exogenously supplied energy and carbon sources adjust the level of biodegradation [J]. Journal of Biotechnology, 2007, 129(4): 706-716
[34] Herrera N, Florez M, Velasquez J, et al. Effect of phenyl-acyl compounds on the growth, morphology, and toxin production of Microcystis aeruginosa Kützing [J]. Water, 2019, 11(2): 236