在化学品生态毒性试验体系中,鱼类作为水生生态毒性试验体系中的顶级脊椎动物,具有不可替代的地位。各类化学品的鱼类急性毒性数据是其危害鉴定和环境风险评估中基本数据要求的一部分。鱼类急性毒性试验[1],简而言之,每组7~10条幼鱼(如斑马鱼(Danio rerio)、黑头软口鲦(Pimephales promelas)、日本青鳉鱼(Oryzias latipes)、蓝鳃鱼(Lepomis macrochirus)、虹鳟(Oncorhynchus mykiss))暴露于至少5个受试物浓度下96 h,计算导致50%鱼死亡的化学物质浓度(LC50)。
欧洲的动物福利法规要求将3Rs原则,即替代(Replacement)、减少(Reduction)和优化(Refinement),纳入监管体系[2],并强调了开发和验证替代方法的重要性和必要性。在监督管理制度内替代、减少或优化鱼类急性毒性试验的可能性已被讨论多年,并已纳入测试策略中。例如,化学品注册、评估、许可和限制法规(Registration, Evaluation, Authorization and Restriction of Chemicals, REACH)高度关注化学品毒性测试中实验动物福利问题,提倡减少测试中脊椎动物的数量,推动非动物测试(如胚胎、细胞和组织等)和替代策略的开发和验证[3]。如有可能,尽量使用已有数据、交叉参照法(read across)、计算机方法(in silico)和(或)体外法(in vitro)获得鱼类急性毒性数据。如若不能,根据经济合作与发展组织(Organisation for Economic Co-operation and Development, OECD)测试指南203中描述的限度试验,即化学品LC50>100 mg·L-1 [1]或根据OECD指导文件126 [4]的阈值方法。但该2种方法所采用的试验生物均为幼鱼或者成鱼。鱼类急性毒性试验的替代方案是基于鱼类胚胎或鱼类细胞系的使用,而鱼类胚胎被认为是最有希望的替代物。目前,国际上首选鱼类急性毒性试验的替代方法为2012年完成验证[5-6],OECD于2013年颁布的鱼类胚胎急性毒性试验(Guidelines for the Testing of Chemicals,2013,No. 236,Fish Embryo Acute Toxicity (FET) Test)[7],该方法中指定的实验生物为斑马鱼受精卵。
OECD TG 236规定将新受精的(16细胞期前)、在体视显微镜下观察无明显不规则分裂或破损的受精卵暴露于不同浓度的测试化学品溶液中,每个浓度组20个胚胎,试验持续96 h,每24 h观察并记录以下终点作为死亡表征:(1)卵黄凝结;(2)体节缺失;(3)尾部未和卵黄囊分离;(4)无心跳。采用胚胎进行毒性试验除了可满足现行动物福利法规的要求,还存在亲鱼体型小(易于饲养和管理方便)、产卵量大、试验体系小(整个试验在24孔细胞板中完成)、测试周期短(96 h)、便于观察(斑马鱼胚胎具有光学透明性)、操作方便等优点。与传统的成鱼或幼鱼的急慢性试验相比,更为灵敏且能够提供更多的观察效应指标。为了验证不同物种对该方法的敏感性,Braunbeck等[8]曾提出鱼类胚胎毒性试验“适用于多物种”,即将针对斑马鱼的协议适用于其他鱼种,如OECD测试指南203中推荐的物种黑头软口鲦和日本青鳉。
稀有鮈鲫(Gobiocypris rarus)是我国特有的一种小型鲤科鱼类[9],也是我国化学品环境管理中首选试验鱼种。其亲鱼性成熟时间短,繁殖季节长,产卵量大,可常年人工繁殖,因此具有成为中国特有模式鱼种的潜能。由于其胚胎也具有光学透明性,可透过卵膜清晰观察胚胎发育,同时其胚胎的形态特征、发育过程及孵化时间也与多数淡水硬骨鱼类似[10],因此,以稀有鮈鲫为实验材料,开展相关的胚胎毒理学研究有一定的基础依据。此外,稀有鮈鲫生物学特征研究已较为系统,研究工作涉及鱼病学、遗传学、环境科学、胚胎学和生理学等领域[11-14]。在此基础上,开展稀有鮈鲫在胚胎领域的毒理学研究将推动我国特有标准试验鱼种用于生态毒性测试的可持续战略,拓展稀有鮈鲫在毒性测试中的使用范围,为其最终成为国际公认的标准试验物种创造条件。
评估任何生态毒理学测试结果时,结果的不确定度水平是很重要的。实验室间比对测试是定义单个测试方法甚至整套测试方法有效性的过程中最重要的步骤之一。因此,国际准则建议确定此类数据的重复性和重现性[15]。已有研究显示稀有鮈鲫胚胎急性毒性试验具有良好的重复性[16],但其重现性无任何报道。
本研究旨在评价稀有鮈鲫胚胎急性毒性试验在各实验室的重现性,验证稀有鮈鲫胚胎是否适用于鱼类胚胎急性毒性试验,为相关化学品测试国家标准的制定提供依据。
1 材料与方法(Materials and methods)
1.1 材料
1.1.1 实验动物
本研究中所使用的稀有鮈鲫亲鱼源自中国科学院水生生物研究所,为野生型封闭群(Ihb:IHB),或引种后自行繁育。单次试验所用胚胎均为同一批次,体视镜镜检下处于16细胞期前(约为受精后90 min),无明显不规则分裂或破损,透明且发育正常的受精卵。
1.1.2 参比物质
3,4-二氯苯胺(梯希爱(上海)化成工业发展有限公司)(表1),其水溶性较低、毒性较大,是常用的有机参比物质,亦是斑马鱼胚胎急性毒性试验推荐的阳性参考物质。
表1 参比物质基本信息
Table 1 The basic information of the test chemicals
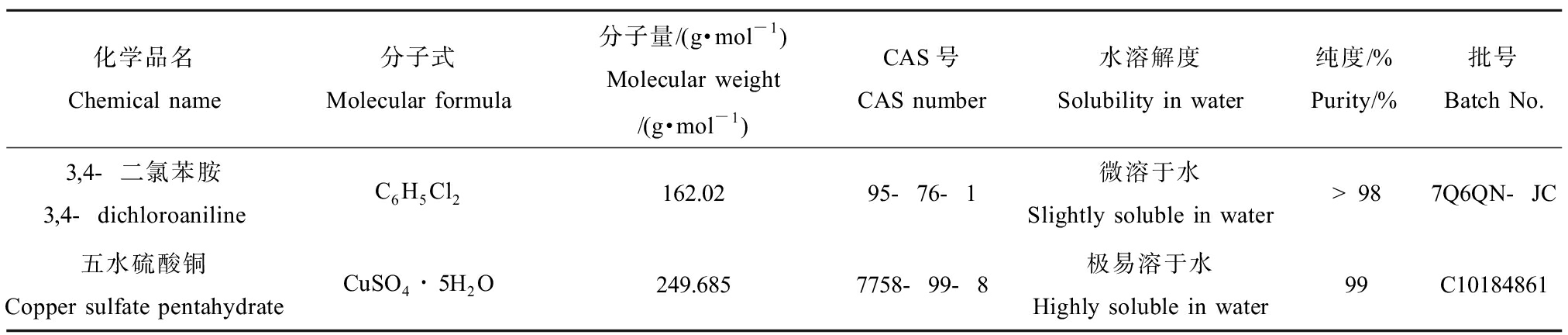
化学品名Chemical name分子式Molecular formula分子量/(g·mol-1)Molecular weight/(g·mol-1) CAS号CAS number水溶解度Solubility in water纯度/%Purity/%批号Batch No.3,4-二氯苯胺3,4-dichloroaniline C6H5Cl2162.0295-76-1微溶于水Slightly soluble in water>987Q6QN-JC五水硫酸铜Copper sulfate pentahydrate CuSO4∙5H2O249.6857758-99-8极易溶于水Highly soluble in water99C10184861
五水硫酸铜(上海麦克林生化科技有限公司)(表1),其性质稳定,试验结果可靠,可比性强,对鱼类各个生命周期的毒性均较大,是水生毒性试验中常用的无机参比物质。
1.2 方法
按照《OECD 化学品测试准则No. 236 鱼类胚胎急性毒性试验》[7]和ISO关于测试方法和结果的准确度评价方法[17]进行试验设计并制定试验方案,选用3,4-二氯苯胺和五水硫酸铜2种参比物质,邀请我国国内良好操作规范实验室(good laboratory practice, GLP)开展针对上述2种参比物质的比对试验,评价试验结果的重现性。
1.2.1 试验原理
将新受精的鱼类胚胎暴露于不同浓度的化学品水溶液中96 h。其后每24 h,观察并记录以下1~4个死亡表征:(1)卵凝结;(2)体节缺失;(3)尾部未分离;(4)无心跳。当暴露结束时,通过上述4个表征的阳性结果确定急性毒性,并计算LC50值。
1.2.2 试验条件
试验用水为经活性炭过滤、紫外线照射处理的自来水,并在恒温储水箱中连续曝气至氧饱和,恒温(26±1) ℃,水硬度为100~300 mg·L-1(以CaCO3计),pH为6.5~8.5,试验期间变化不超过1.5个单位;光照周期为12 h∶12 h(光∶暗);溶解氧不小于空气饱和值的60%。
鱼卵受精后尽快开始试验,胚胎应最晚在16细胞期(约为受精后90 min)前暴露于试验溶液中。暴露96 h后试验结束。每24 h更新化学品母液和各浓度试验溶液。试验前在已预处理24 h的24孔板中,每孔注入2 mL新鲜制备的试验溶液。
1.2.3 试验操作
暴露浓度:根据预试验结果,3,4-二氯苯胺暴露组配制浓度分别为5、7、10、14和20 mg·L-1,五水硫酸铜暴露组配制浓度分别为0.7、1.0、1.5、2.3和3.5 mg·L-1。同时,设置1个空白对照组。
母液配制:试验前一天,将已知量的3,4-二氯苯胺添加到一定体积的试验用水中,连续磁力搅拌24 h至溶解,制备成配制浓度为20 mg·L-1的母液;试验当天将已知量的五水硫酸铜溶于一定体积的去离子水中,制备成配制浓度为10 mg·L-1的母液。试验期间,母液均每天配制更新。
试验溶液配制:将适量的样品母液添加到试验用水中,配制成各浓度的试验溶液。
胚胎分配:在体视显微镜下选择处于16细胞期前(约为受精后90 min),无明显不规则分裂或破损的受精卵进行试验,并计算受精率。所有试验均在标准24孔板中完成,每孔1个受精卵,各组20 个 板-1;以试验用水为介质,在上述各板中另放入4个鱼卵作为板内质控;空白对照组24 个
板-1;以试验用水为介质,在上述各板中另放入4个鱼卵作为板内质控;空白对照组24 个 板-1(图1)。
板-1(图1)。

图1 稀有鮈鲫胚胎急性毒性试验24孔板布局图
注:1~5表示5个试验浓度组;nC表示空白对照组(试验用水);iC表示板内控制(试验用水)。
Fig. 1 Gobiocypris rarus embryo acute toxicity test: 24-well plate layout
Note: 1~5 means five test concentrations; nC means negative control (test water); iC means internal plate control (test water).
观察与记录:每24 h观察记录1次胚胎死亡数和其他可观察效应;从48 h开始,每24 h记录1次空白对照组和各浓度组胚胎孵化数。试验结束时,如板内质控死亡超过1个,则整板无效,该浓度组剔除。
水质参数测定:在暴露开始和暴露结束时,测定空白对照组和最高浓度组的硬度和电导率。试验期间,每次更新试验溶液前后测定空白对照组和最高浓度组试验溶液的pH。在试验结束时,测定空白对照组和最高浓度组(有存活胚胎)的溶解氧浓度。试验期间,每日测定1次温度,测定温度时,随机选取3个试验容器进行测定。
1.2.4 试验有效性判断
试验期间,试验溶液的溶解氧含量应>80% ASV;各试验容器之间的水温波动不超过±1 ℃,维持在(26±1) ℃之间。试验开始时,试验用胚胎总受精率≥70%。试验结束时,空白对照组胚胎的存活率≥90%,空白对照组胚胎的孵化率≥80%。
1.2.5 实验室间比对试验
为评价3,4-二氯苯胺和五水硫酸铜2种参比物质试验结果的重现性,邀请国内5家外部GLP实验室参加稀有鮈鲫胚胎急性毒性比对试验。这些实验室位于我国不同区域,其中华东2家、华中1家、东北1家、西南1家。为了保证数据结果的可靠性和可比性,比对试验由本实验室制定试验方案,统一分发受试物质。
1.3 数据处理
1.3.1 LC50的统计结果分析
将各暴露浓度组96 h的胚胎累计死亡数与空白对照组96 h胚胎的累计死亡数进行对比,绘制浓度-死亡率曲线图。采用点估计计算96 h-LC50及95%置信限。
1.3.2 z分数
评估能力测试结果xi的z分数计算公式[18]如下:
式中:xi表示单个实验室的96 h-LC50值;xpt表示所有参与实验室的96 h-LC50的总体平均值;σpt表示所有参与实验室的96 h-LC50值的标准偏差。
z分数结果的评价标准[19]如下:|z|≤2.0,试验结果可被接受;2.0<|z|<3.0,试验结果可疑,鼓励实验室复查其结果;|z|≥3.0,试验结果不被接受,要求实验室开展纠正措施。
2 结果(Results)
2.1 不同实验室2种参比物质对稀有鮈鲫胚胎急性毒性结果比较
所有参加比对试验的实验室均按照统一的试验方案开展稀有鮈鲫胚胎急性毒性试验,试验用水水质参数(温度、pH、溶解氧、硬度和电导率)的变化和试验用胚胎的选择均符合质量控制要求。试验结束时,所有参与比对实验室的试验空白对照组胚胎的死亡率均为0,孵化率均为100%,均符合试验有效性。
试验结果显示,6家实验室2种参比物质随着浓度的升高和暴露时间的延长,稀有鮈鲫胚胎死亡率呈梯度上升。就3,4-二氯苯胺而言,从7 mg·L-1浓度组均开始胚胎出现较为明显的死亡,死亡率范围为10%~40%。暴露结束时,6家实验室各浓度组稀有鮈鲫胚胎累计死亡率范围为0~100%,死亡表征2家实验室为体节缺失,其余实验室均为无心跳,未观察到任何异常特征。对于五水硫酸铜,试验期间,所有实验室死亡表征除无心跳外,均出现24 h卵黄凝结的现象,96 h胚胎累计死亡率范围为0~100%。
2.2 3,4-二氯苯胺和五水硫酸铜对稀有鮈鲫胚胎急性毒性的96 h-LC50及其95%置信限
通过回归分析,建立各暴露浓度与胚胎死亡效应的关系曲线,获取96 h-LC50值及其95%置信限。各实验室3,4-二氯苯胺对稀有鮈鲫胚胎急性毒性的LC50值在4.10~13.7 mg·L-1之间(图2),五水硫酸铜对稀有鮈鲫胚胎急性毒性的LC50值在1.10~2.55 mg·L-1之间(图3)。

图2 各实验室3,4-二氯苯胺对稀有鮈鲫胚胎急性毒性
的96 h-LC50值及其95%置信限
Fig. 2 The LC50 and its 95% confidence limits of 3,4-dichloroaniline of the acute toxicity on Gobiocypris rarus embryo after 96 h exposure for each participating laboratory
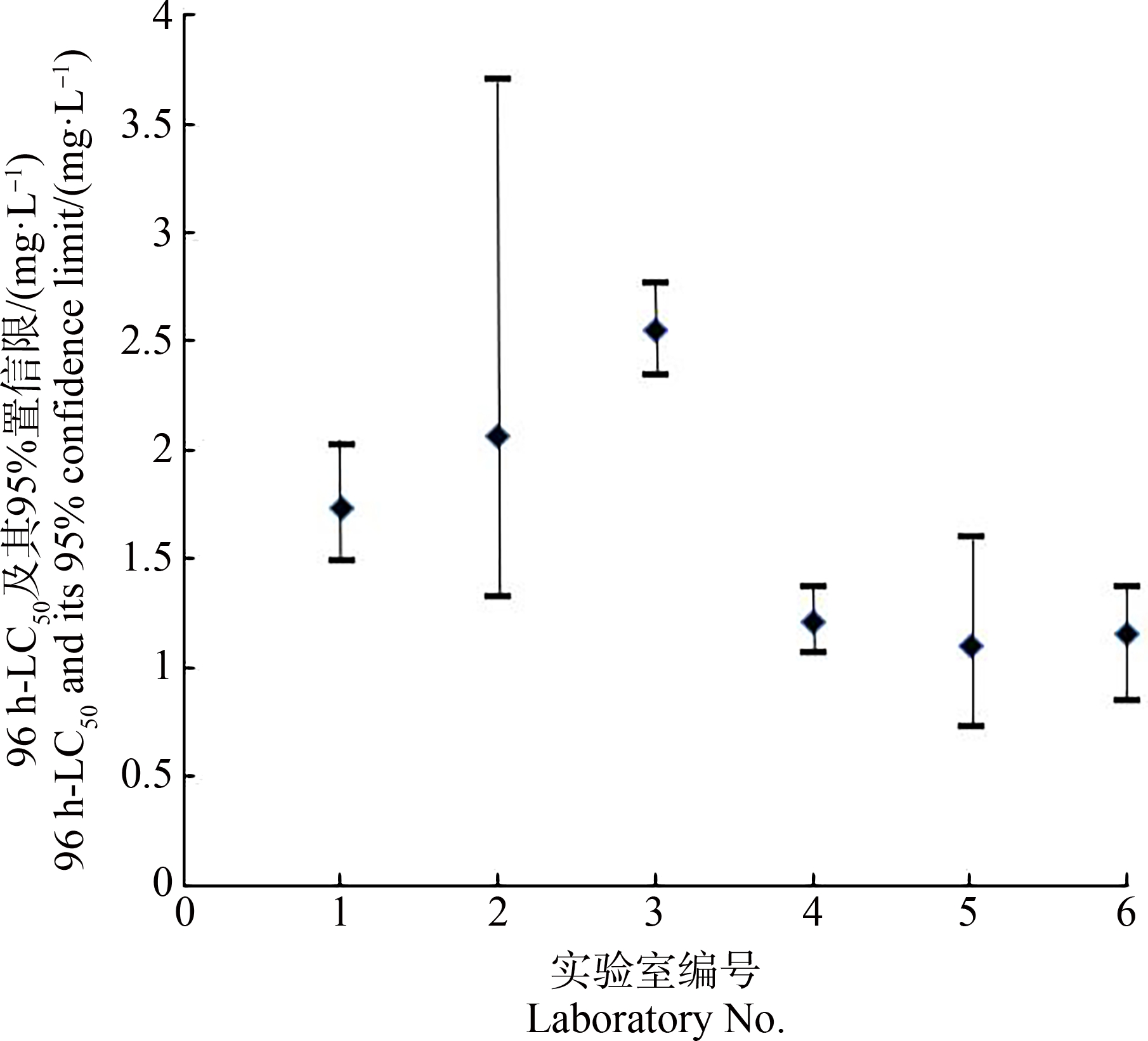
图3 各实验室五水硫酸铜对稀有鮈鲫胚胎急性毒性的96 h-LC50值及其95%置信限
Fig. 3 The LC50 and its 95% confidence limits of copper sulfate pentahydrate of the acute toxicity on Gobiocypris rarus embryo after 96 h exposure for each participating laboratory
将本实验室第一次试验的数据与其他5个外部实验室的数据纳入比对试验评价,得到3,4-二氯苯胺对稀有鮈鲫胚胎急性毒性96 h-LC50的总体平均值(xpt)和标准偏差(σpt)分别为9.25 mg·L-1和3.62 mg·L-1,变异系数为39.1%;五水硫酸铜对稀有鮈鲫胚胎急性毒性96 h-LC50的xpt和σpt分别为1.63 mg·L-1和0.59 mg·L-1,变异系数为36.0%。2种参比物质对稀有鮈鲫胚胎急性毒性的96 h-LC50值均在其xpt±2σpt范围内,如图4和图5所示。
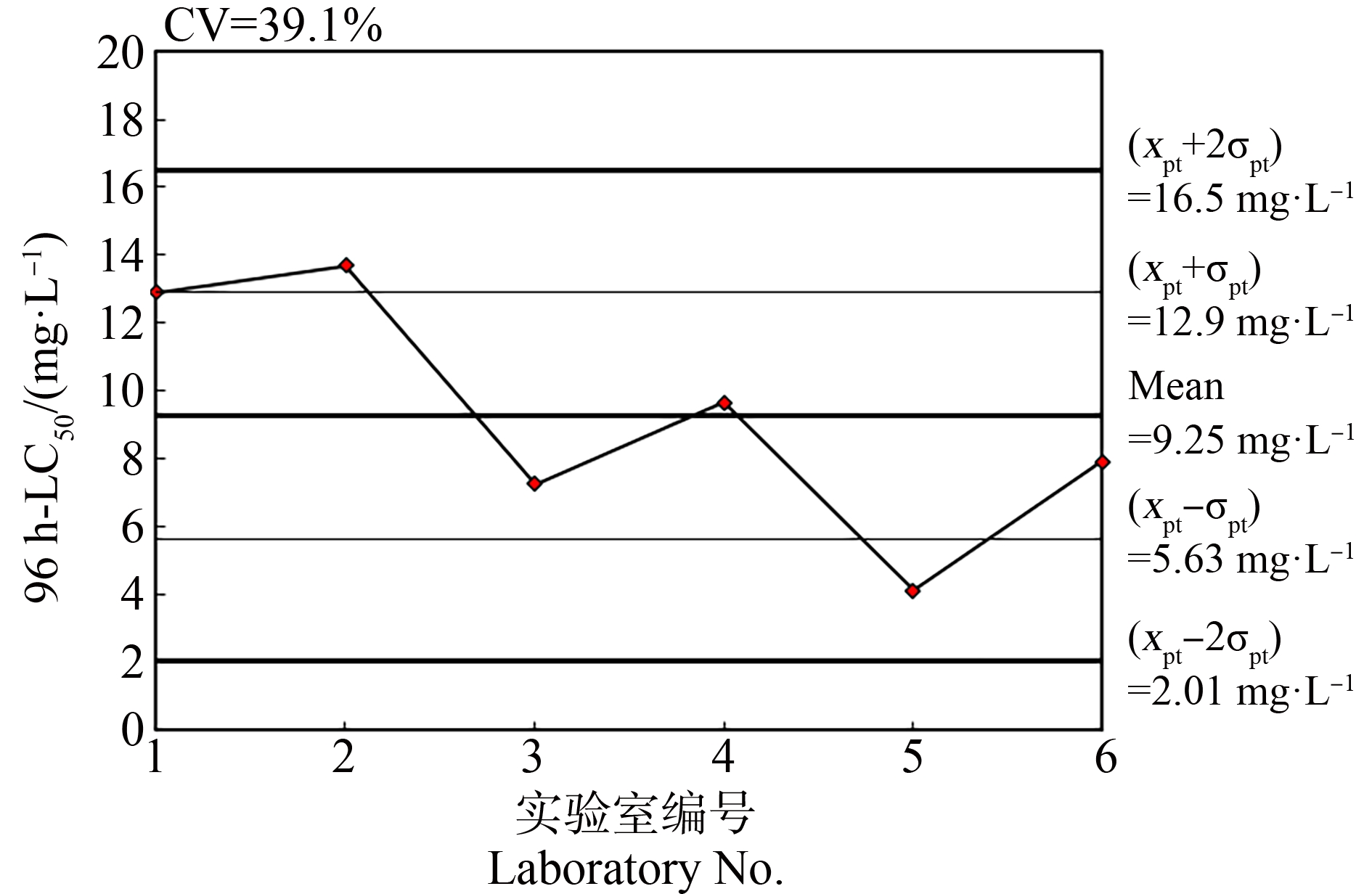
图4 各实验室3,4-二氯苯胺对稀有鮈鲫胚胎急性毒性的质量控制图
Fig. 4 Quality control chart of 3,4- dichloroaniline of the acute toxicity on Gobiocypris rarus embryo for each participating laboratory

图5 各实验室五水硫酸铜对稀有鮈鲫胚胎急性毒性的质量控制图
Fig. 5 Quality control chart of copper sulfate pentahydrate of the acute toxicity on Gobiocypris rarus embryo for each participating laboratory
2.3 各实验室间比对试验结果的z分数
按照z分数计算公式计算各实验室比对试验结果的z分数。各实验室3,4-二氯苯胺对稀有鮈鲫胚胎急性毒性比对试验结果的z分数在-1.42~1.23之间,|z|<2.0(图6);各实验室五水硫酸铜对稀有鮈鲫胚胎急性毒性比对试验结果的z分数在-0.898~1.56之间,|z|<2.0(图7)。当|z|≤2.0,即该LC50值在(xpt±2σpt)范围之内时,可认为该实验室的比对结果与总体情况无明显差异[20]。
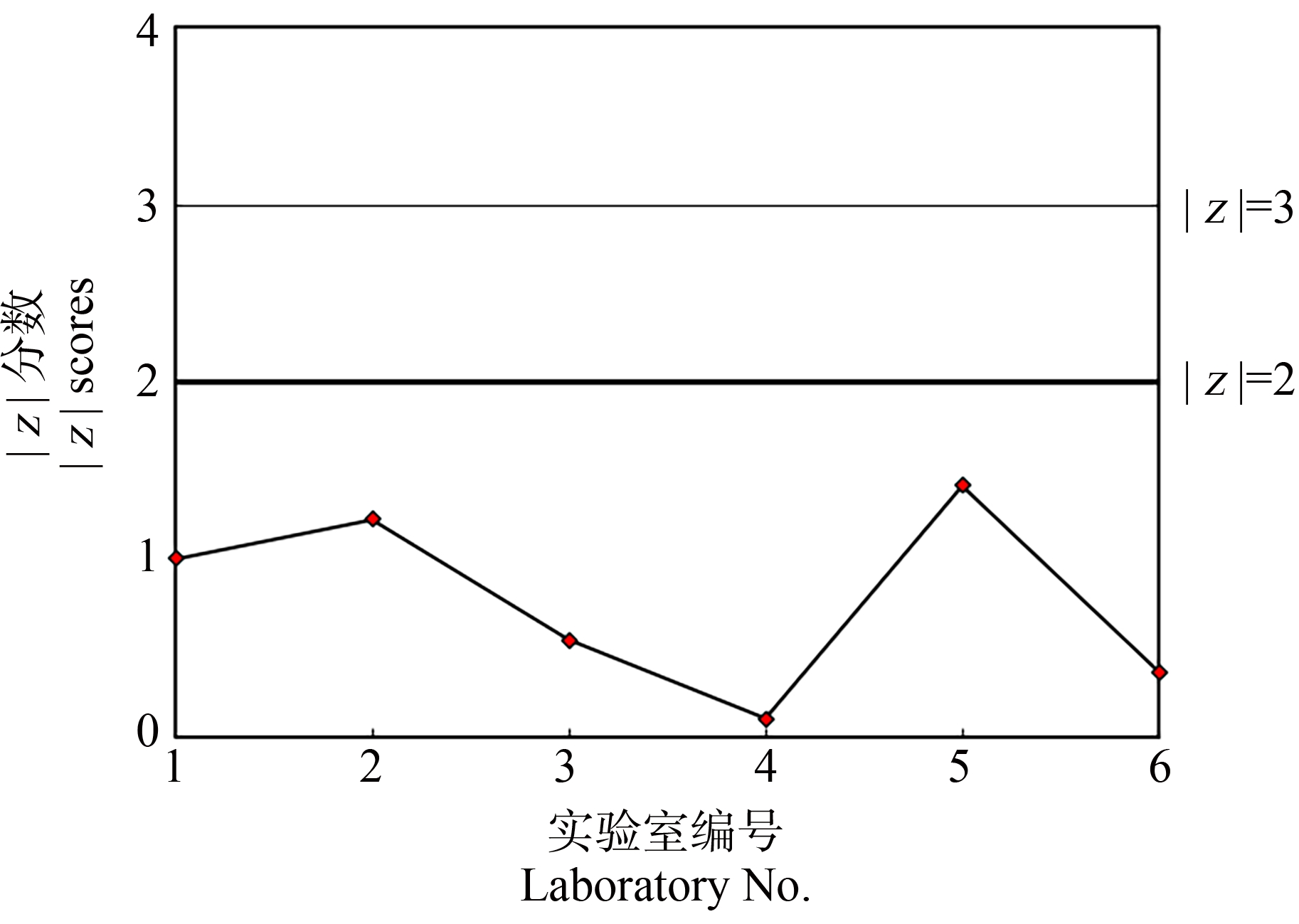
图6 各实验室3,4-二氯苯胺对稀有鮈鲫胚胎急性毒性试验比对结果的z分数
Fig. 6 z scores of 3,4-dichloroaniline of the acute toxicity on Gobiocypris rarus embryo for each participating laboratory
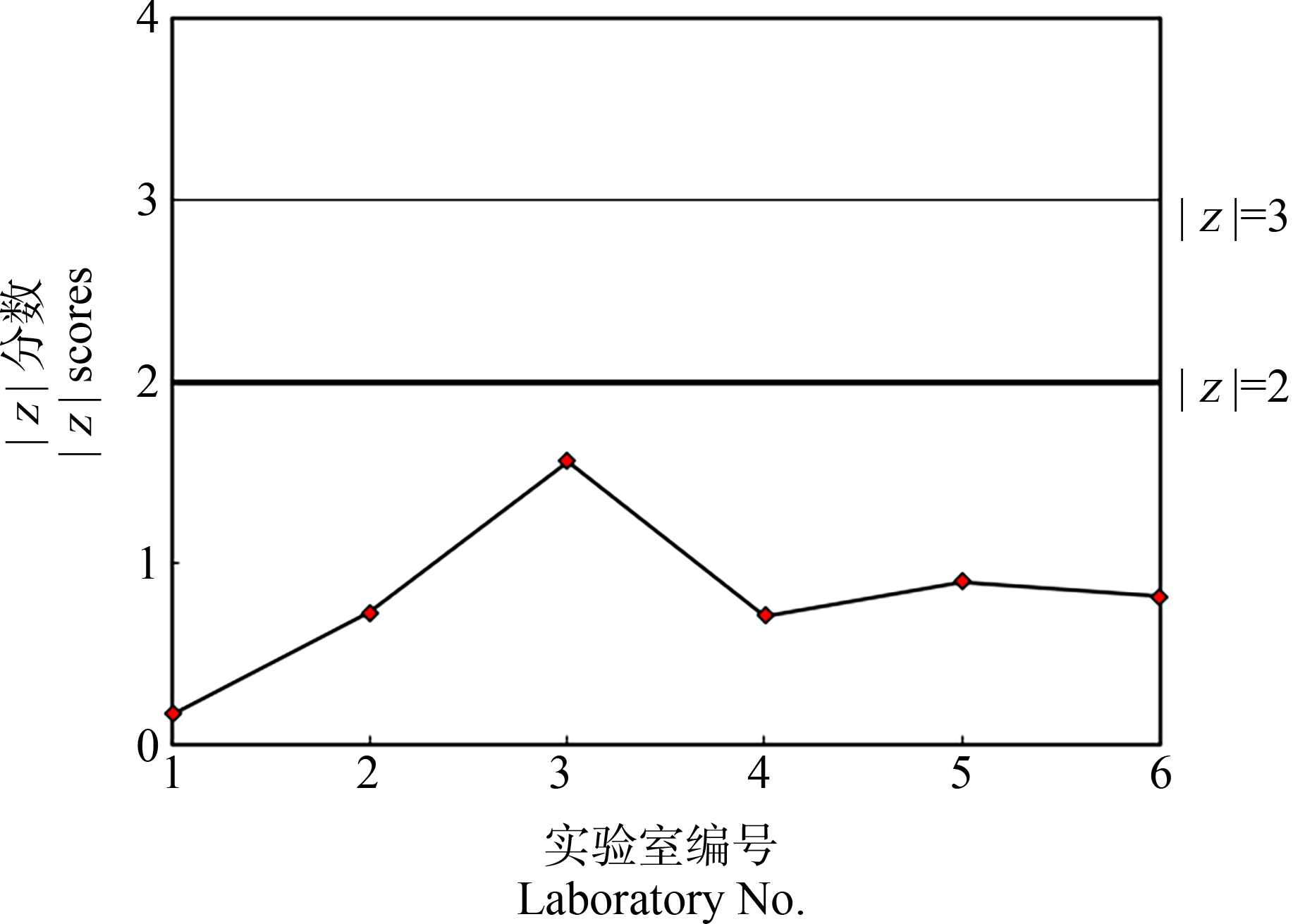
图7 各实验室五水硫酸铜对稀有鮈鲫胚胎急性毒性试验比对结果的z分数
Fig. 7 z scores of copper sulfate pentahydrate of the acute toxicity on Gobiocypris rarus embryo for each participating laboratory
3 讨论(Discussion)
鱼类胚胎急性毒性试验(OECD TG 236)选择处于鱼类整个生命阶段最开始阶段的胚胎进行为期96 h的急性毒性试验,观察受试化学品对鱼类胚胎的急性致死效应。在OECD化学品测试方法中,由于鱼类在水生生态系统中的关键地位,鱼类毒性测试占有重要地位,从生态毒性层面分析,就包括胚胎、仔鱼、幼鱼和成鱼全生命周期的试验标准。胚胎作为鱼类生命的最初期,对化学品的敏感性通常优于其他阶段,且该测试方法技术难度较小,实验室间比对工作相对容易开展。
鱼类胚胎急性毒性试验从方法开发之初,其间开展比对验证,到最终形成OECD导则,斑马鱼(Danio rerio)都是受试鱼种或推荐鱼种。由德国主导的9家实验室间比对项目中3,4-二氯苯胺对斑马鱼胚胎的96 h-LC50值在2.55~3.20 mg·L-1范围之间,五水硫酸铜对斑马鱼胚胎的96 h-LC50值在0.198~0.423 mg·L-1。在本研究中,我国国内各实验室3,4-二氯苯胺对稀有鮈鲫胚胎的96 h-LC50值在4.10~13.7 mg·L-1之间,五水硫酸铜对稀有鮈鲫胚胎的96 h-LC50值在1.10~2.55 mg·L-1之间,相比之下,斑马鱼胚胎对2种参比物质的敏感性高于稀有鮈鲫胚胎,但差异均未超过一个数量级。该差异可能是因为稀有鮈鲫胚胎拥有比斑马鱼更厚的卵壳膜(图8),对于这一点,暂无法对其下定论,但研究推测可能会影响稀有鮈鲫胚胎对某些化学物质的敏感性。但稀有鮈鲫胚胎直径明显大于斑马鱼胚胎直径,稀有鮈鲫的卵直径均超过1 mm[21],这一特点使其在试验中更易于观察;且稀有鮈鲫胚胎黏性较大,易于黏附在试验容器(如24孔板)的底部,在进行溶液更新或镜检观察时,基本不会随水流波动,易于试验操作,而斑马鱼胚胎不具有黏性,胚胎易随水流波动,加大了试验操作的难度。此外,体视显微镜下观察比较2种胚胎发育过程,稀有鮈鲫与斑马鱼相类似,均包含卵裂期、囊胚期、原肠期、分裂期、成形期和孵化期这些发育时期[22],稀有鮈鲫胚胎发育时序及特征符合胚胎试验观察的需求,与斑马鱼基本一致。由此可见,稀有鮈鲫胚胎生物学特征与斑马鱼类似,具有开发和验证鱼类胚胎急性毒性试验的潜力。
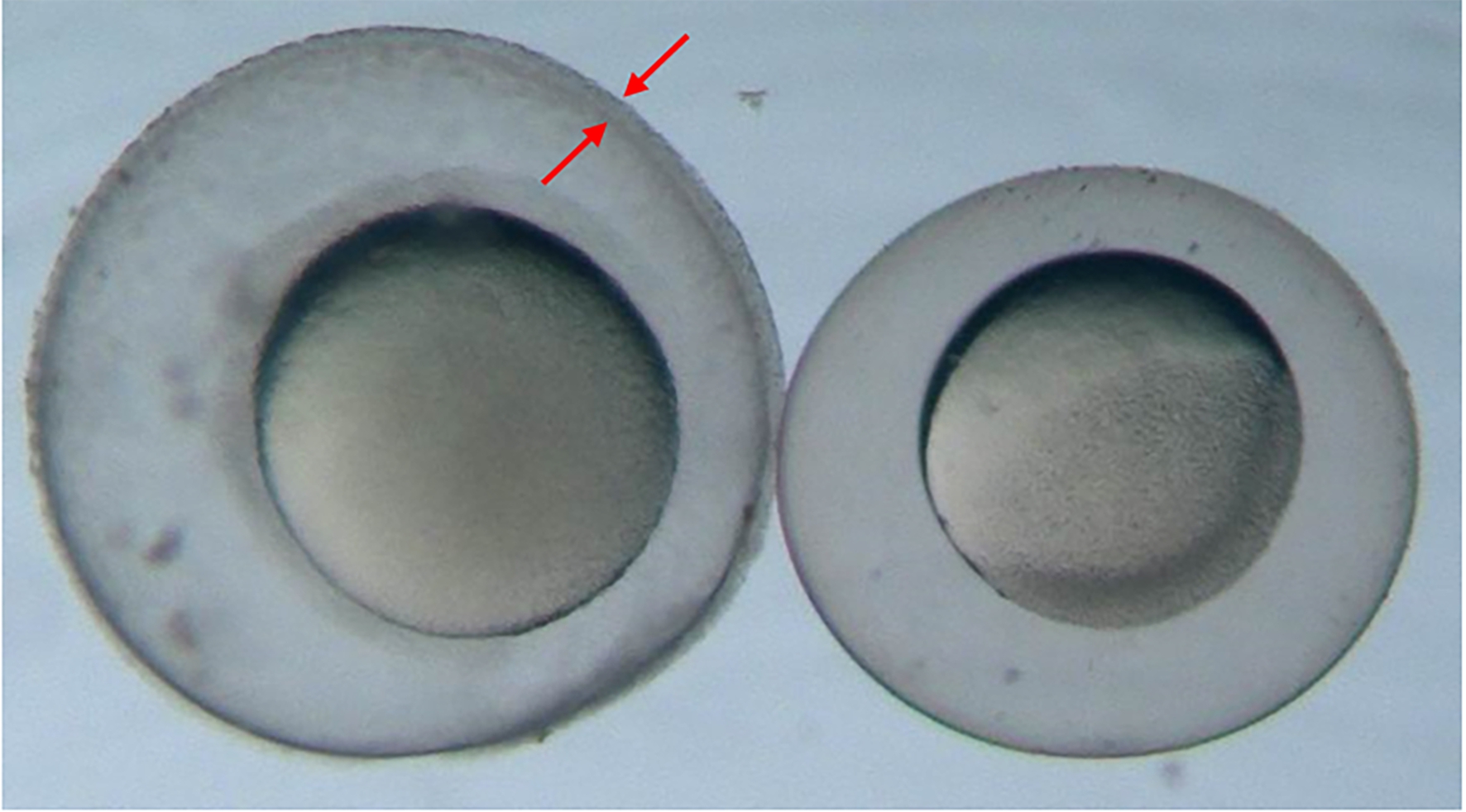
图8 稀有鮈鲫与斑马鱼胚胎卵壳膜比较
注:左为稀有鮈鲫胚胎,右为斑马鱼胚胎,红色箭头为稀有鮈鲫胚胎较厚的卵壳膜。
Fig. 8 Comparison of embryo shell membranes between Gobiocypris rarus embryo and Danio rerio embryo
Note: The left is the embryo of Gobiocypris rarus, the right is embryo of Danio rerio, the red arrow is the thicker embryo shell membrane of Gobiocypris rarus embryo.
本研究选取3,4-二氯苯胺和五水硫酸铜2种参比物作为受试物开展实验室间比对试验,结果显示,稀有鮈鲫胚胎对五水硫酸铜的敏感性高于3,4-二氯苯胺,范博等[23]通过对全部物种的敏感性排序发现,稀有鮈鲫对重金属(Zn2+、Cu2+、Cr6+和Hg2+)较敏感(平均累计概率为36%)。张京佶等[16]开展了6次3,4-二氯苯胺和五水硫酸铜对稀有鮈鲫胚胎的重复性研究,结果表明3,4-二氯苯胺和五水硫酸铜对稀有鮈鲫胚胎的96 h-LC50平均值(x)分别为12.8 mg·L-1和1.76 mg·L-1,标准差(s)分别为1.70 mg·L-1和0.197 mg·L-1,2种化学品6次试验的96 h-LC50均在各自x±2s范围内,重复性较好,敏感性低于斑马鱼胚胎,但差异均未超过一个毒性分级。笔者前期研究了16种化学品对稀有鮈鲫胚胎和斑马鱼胚胎的敏感性[24],结果显示:稀有鮈鲫胚胎和斑马鱼胚胎对其中15种化学品的敏感性相近,其中七水硫酸锌对稀有鮈鲫胚胎的96 h-LC50值为10.4 mg·L-1,斑马鱼为238 mg·L-1,两者差异约22.9倍,可见稀有鮈鲫胚胎对七水硫酸锌异常敏感。此外,3,4-二氯苯胺、五水硫酸铜等11种化学品,斑马鱼胚胎的敏感性略优于稀有鮈鲫胚胎,但毒性值差异在1.02倍~6.05倍之间,有很好的可比性。结合毒性分级,稀有鮈鲫和斑马鱼有11个毒性分级一致,另有5个仅相差1个等级。鉴于化学品理化性质的不同和生物物种间的差异,稀有鮈鲫胚胎的敏感性不亚于斑马鱼胚胎,适宜鱼类胚胎急性毒性试验的应用。
任何一项试验研究在实施的过程中,都会出现各种来源的差异。就鱼类胚胎急性毒性试验而言,除了鱼类胚胎个体内在的受精率和孵化率差异,试验体系中试验水温及其变化范围、溶解氧含量、电导率和硬度等因素都可能导致最终的试验结果存在不同程度的差异,操作人员的不同和实验室环境设施的差异会进一步加剧该差异。因此,同一项试验结果的实验室间差异通常比较大。但是,只要严格控制鱼类胚胎的质量、鱼卵开始暴露时间、试验水温、死亡表征的观察及记录等关键性的试验条件,这些潜在的差异将不会对试验方法的灵敏度产生显著的影响。
本研究验证了鱼类胚胎急性毒性试验的稳定性。各实验室间数据的变异系数较大,可能由以下原因所致:首先,各实验室的试验结果是基于试验溶液中受试物的实测浓度,而试验溶液中受试物的实测浓度因操作人员技术水平、分析仪器设备、样品的采集和保存技术、数据处理与统计方法等的不同而存在较大差异;其次,2种参比物质毒性效应浓度低、试验暴露体系小、试验难度较大等可继续增大结果的差异。统一各实验室该比对试验的操作人员技能、分析仪器设备、样品采集和保存技术以及数据处理与统计方法等可大大降低该差异。6家实验室的数值相比,5号实验室提供的2种参比物质96 h-LC50值均是最小的,最大值与最小值之比未超过一个数量级,且z分数法的评价结果也进一步印证了比对试验结果的重现性。
综上所述,本研究选取3,4-二氯苯胺和五水硫酸铜2种参比物质开展6家实验室间稀有鮈鲫胚胎急性毒性比对试验,结果具有良好的重现性。稀有鮈鲫作为一种中国本土的标准试验鱼种,其胚胎生物学特征与斑马鱼类似,急性毒性试验结果也体现了良好的稳定性、重复性和重现性,胚胎敏感性也不亚于其成鱼和其他国际标准鱼种(如斑马鱼),适用于进行鱼类胚胎急性毒性试验。
[1] Organization for Economic Co-operation and Development (OECD). Guidelines for testing of chemicals, 203: Fish, acute toxicity testing [S]. Paris: OECD, 2019
[2] European Union (EU). Directive 2010/63/EU of the European Parliament and Council of 22 September 2010 on the protection of animals used for scientific purposes [J]. Official Journal of the European Union, 2010, 276: 33-79
[3] European Commission. Regulation (EC) No 1907/2006 of the European Parliament and the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC [J]. Official Journal of the European Union, 2006, 396: 1-849
[4] Organization for Economic Co-operation and Development (OECD). Short guidance on the threshold approach for acute fish toxicity testing. Series on testing and assessment No. 126 [S]. Paris: OECD, 2016
[5] Organization for Economic Co-operation and Development (OECD). OECD validation report (phase 1) for the zebrafish embryo toxicity test. Series on Testing and Assessment. No. 157 [R]. Paris: OECD, 2011
[6] Organization for Economic Co-operation and Development (OECD). OECD validation report (phase 2) for the zebrafish embryo toxicity test. Series on Testing and Assessment, No. 179 [R]. Paris: OECD, 2012
[7] Organization for Economic Co-operation and Development (OECD). Guidelines for the testing of chemicals. Section 2: Effects on biotic systems test No. 236: Acute embryo acute toxicity (FET) test [S]. Paris: OECD, 2013
[8] Braunbeck T, Boettcher M, Hollert H, et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: The fish embryo toxicity test goes multi-species —An update [J]. ALTEX, 2005, 22(2): 87-102
[9] 曹文宣, 王剑伟. 稀有鮈鲫——一种新的鱼类实验动物[J]. 实验动物科学与管理, 2003, 20(S1): 96-99
Cao W X, Wang J W. Rare minnow: A new laboratory animal in China [J]. Laboratory Animal Science and Administration, 2003, 20(S1): 96-99 (in Chinese)
[10] 王蕊, 殷浩文. 斑马鱼胚胎发育中适宜的毒理学指标分析[J]. 环境与职业医学, 2004, 21(2): 88-89, 93
Wang R, Yin H W. Analysis on feasible toxicologic endpoints in embryonic development of Brachydanio rerio [J]. Journal of Labour Medicine, 2004, 21(2): 88-89, 93 (in Chinese)
[11] 朱晓鸣, 解绶启, 崔奕波, 等. 摄食水平和性别对稀有鮈鲫生长和能量收支的影响[J]. 海洋与湖沼, 2001, 32(3): 240-247
Zhu X M, Xie S Q, Cui Y B, et al. Effect of ration level on growth and energy budget of male and female rare minnow Gobiocypris rarus [J]. Oceanologia et Limnologia Sinica, 2001, 32(3): 240-247 (in Chinese)
[12] 王剑伟, 乔晔, 陶玉岭. 稀有鮈鲫仔鱼的摄食和耐饥饿能力[J]. 水生生物学报, 1999, 23(6): 648-654
Wang J W, Qiao Y, Tao Y L. Feeding and starvation tolerance of the yolk-sac larvae of Gobiocypris rarus [J]. Acta Hydrobiologica Sinica, 1999, 23(6): 648-654 (in Chinese)
[13] 王剑伟. 稀有鮈鲫的繁殖生物学[J]. 水生生物学报, 1992, 16(2): 165-174, 195
Wang J W. Reproductive biology of Gobiocypris rarus [J]. Acta Hydrobiologica Sinica, 1992, 16(2): 165-174, 195 (in Chinese)
[14] 常剑波,王剑伟,曹文宣. 稀有鮈鲫胚胎发育研究[J]. 水生生物学报, 1995, 19(2): 97-103
Chang J B, Wang J W, Cao W X. The embryonic development of Gobiocpris rarus [J]. Acta Hydrobiologica Sinica, 1995, 19(2): 97-103 (in Chinese)
[15] ISO/IEC ISO 17043, Conformity assessment - General requirements for proficiency testing; International Organization for Standardization: Geneva, 2010
[16] 张京佶, 王绿平, 张琨. 稀有鮈鲫在鱼类胚胎急性毒性试验中的适用性研究[J]. 环境科学研究, 2019, 32(7): 1162-1169
Zhang J J, Wang L P, Zhang K. Applicability of Gobiocypris rarus in fish embryo acute toxicity test [J]. Research of Environmental Sciences, 2019, 32(7): 1162-1169 (in Chinese)
[17] International Organization for Standardization (ISO). ISO 5725-2 Accuracy (trueness and precision) of measurement methods and results: Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method [S]. Geneva: ISO, 1994
[18] International Organization for Standardization (ISO). ISO 13528: 2015. Statistical methods for use in proficiency testing by interlaboratory comparison [S]. Geneva: ISO, 2015
[19] International Organization for Standardization (ISO). ISO/IEC 17043: 2010 Conformity assessment: General requirements for proficiency testing [S]. Geneva: ISO, 2010
[20] U S Environmental Protection Agency (US EPA). Methods for measuring the acute toxicity of effluents and receiving waters to freshwater and marine organisms-Fifth Edition (EPA-821-R-02-012) [R].Washington DC: Environmental Protection Agency Office of Water (4303T), 2002
[21] 顾党恩, 于学颖, 王剑伟. 稀有鮈鲫封闭群Ihb: IHB生长和繁殖性能的监测[J]. 中国实验动物学报, 2014, 22(1): 71-75
Gu D G, Yu X Y, Wang J W. Monitoring of the growth and reproductive performance of a rare closed colony of Gobiocypris rarus Ihb: IHB [J]. Acta Laboratorium Animalis Scientia Sinica, 2014, 22(1): 71-75 (in Chinese)
[22] 王绿平, 张京佶, 殷浩文. 不同实验条件下稀有鮈鲫胚胎的自然受精率和孵化率[J]. 生态毒理学报, 2020, 15(3): 100-107
Wang L P, Zhang J J, Yin H W. Natural fertility and hatchability of Gobiocypris rarus embryos under different experimental conditions [J]. Asian Journal of Ecotoxicology, 2020, 15(3): 100-107 (in Chinese)
[23] 范博, 樊明, 刘征涛, 等. 稀有鮈鲫物种敏感性及其在生态毒理学与水质基准中的应用[J]. 环境科学研究, 2019, 32(7): 1153-1161
Fan B, Fan M, Liu Z T, et al. Species sensitivity and application in ecotoxicology and water quality criterion for Gobiocypris rarus [J]. Research of Environmental Sciences, 2019, 32(7): 1153-1161 (in Chinese)
[24] 王绿平, 张京佶, 赵华清. 稀有鮈鲫作为鱼类胚胎急性毒性试验受试鱼种的敏感性研究[J]. 生态毒理学报, 2021, 16(5): 102-112
Wang L P, Zhang J J, Zhao H Q. Sensitivity of Chinese rare minnows (Gobiocypris rarus) for fish embryo acute toxicity test [J]. Asian Journal of Ecotoxicology, 2021, 16(5): 102-112 (in Chinese)