我国是抗生素的生产和使用大国,在医学、畜牧业和水产养殖等领域中应用广泛[1]。随着抗生素使用量的日益增加,我国地表水中频繁检出大量抗生素,其中氧氟沙星(OFL)和磺胺甲恶唑(SMX)含量较高[2-3]。环境中长时间存在的抗生素会对生态环境和人类健康造成潜在威胁。研究发现,OFL单独暴露会引起斑马鱼氧化损伤[4];SMX单独暴露影响了斑马鱼胚胎生长,还诱导了氧化应激和炎症[5]。水环境中的抗生素通常以混合形式存在,低浓度混合抗生素对水生生物产生的联合毒性需要重视[6-7]。据报道,SMX单独暴露后普通小球藻的96 h-EC50为1 672.71 μg·L-1,而在恩诺沙星和SMX联合暴露后的96 h-EC50为141.3 μg·L-1,其联合毒性效应比单独暴露更为严重[8]。OFL和SMX在环境水体中广泛存在,并被频繁同时检出,环境浓度均在纳克和微克级别。例如,浑河同时检出OFL (nd~32.1 ng·L-1)和SMX (nd~25.3 ng·L-1)[9];在海口市同时检出OFL (100.9~499.8 ng·L-1)和SMX (711.7~1 385.8 ng·L-1)[10]。鱼类的整个生命周期都处于水环境中,故研究OFL和SMX对鱼类的联合毒性更具现实意义。
抗生素对鱼类为低毒性,虽不直接影响鱼的存活,但机体内的活性氧物质(ROS)的产生与消除会失衡,导致氧自由基在细胞内过量储蓄引起氧化应激[11],继而导致鱼体出现氧化损伤、脂质过氧化、蛋白质损伤、DNA表达变化和酶失活等现象[6]。抗氧化酶是重要的ROS清除物质[12],是保护鱼体的重要屏障。在鱼体抗氧化系统中,酶类抗氧化剂包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽-S转移酶(GST)等,在机体受到氧化应激损害时,会通过酶促系统来清除自由基[12-13]。而丙二醛(MDA)作为生物体内自由基作用于脂质发生过氧化反应的最终产物,可以反应脂质过氧化的水平[14]。
此外,热休克蛋白对细胞应激防御也至关重要,参与机体抗氧化酶活力的调控[15]。热休克蛋白70(HSP70)和热休克蛋白90(HSP90)与促进应激细胞恢复等生理功能有关,能够通过抑制自由基生成关键酶的活性来减少ROS的产生[16]。Nrf2核转录因子在活性氧清除和氧化应激过程中也处于关键地位,调节多种抗氧化酶的表达及相关基因的转录[17],其下游基因CAT、Cu-Zn超氧化物歧化酶(SOD2)、醌氧化还原酶(NQO1)、谷氨酸半胱氨酸合成酶催化亚基(GCLC)和谷胱甘肽-S转移酶(GST)都有助于清除活性氧,保护细胞免受氧化损伤[18]。孕烷受体(PXR)是机体针对有毒物质适应性防御和解毒代谢的重要组成部分,能被抗生素激活[19]。因此,可通过这些抗氧化酶及MDA含量和相关基因mRNA表达的变化,指示联合抗生素的毒性影响。
食蚊鱼(Gambusia affinis)是一种小型的卵胎生淡水鱼类,是生态毒理学的模式实验动物之一。在鱼类的诸多组织中,肝脏作为鱼类解毒的主要器官,肠道作为抗生素的主要吸场所[20],肌肉组织是检出抗生素残留的常见部位[21],对抗生素毒性响应具有代表性,可重点考察联合抗生素对这些组织的影响。本研究通过测定食蚊鱼肝脏、肠道、肌肉组织抗氧化酶活力和相关基因mRNA的表达变化,从蛋白质和mRNA表达水平2个层次,共同探究抗生素OFL和SMX联合暴露对食蚊鱼的氧化损伤;结合主成分分析(PCA)和Spearman相关性分析识别反应灵敏的指标,为混合抗生素的毒性评价提供研究基础。
1 材料与方法(Materials and methods)
1.1 试验动物
本研究所用食蚊鱼购自广西荔浦青山水产养殖场,在实验室水生生物养殖系统内驯养2周,水温为(24±2) ℃,光周期为14 h∶10 h(白昼/黑暗),早晚固定喂食2次丰年虾卵并及时吸出残饵和排泄物。选取健康、活泼和大小均匀的成年雌鱼投入试验,鱼体平均体质量为(0.16±0.05) g,平均体长为(2.23±0.19) cm。
1.2 OFL和SMX联合暴露实验
OFL(纯度>98%)和SMX(纯度>98%),均购自梯希爱(上海)化成工业发展有限公司;二甲基亚砜(DMSO),纯度≥99.5%,购自西陇科学股份有限公司。将OFL和SXM用DMSO配制成贮备液备用,暴露液DMSO终浓度为0.0025%(V/V)[22]。本研究设置3个处理组,每组内OFL和SMX按1∶1混合,分别为低浓度组(OFL 50 ng·L-1+SMX 50 ng·L-1)、中浓度组(OFL 1 μg·L-1+SMX 1 μg·L-1)、高浓度组(OFL 20 μg·L-1+SMX 20 μg·L-1),并设置DMSO对照组(CK),每组设置3个生物平行。在2 L玻璃烧杯中加入2 L实验溶液,各放入8尾食蚊鱼。实验用水均为曝气2 d以上的自来水,pH为7.1~7.4,水温为(24±2) ℃,溶解氧≥5.0 mg·L-1。采用半静态换水方式,每日更换1/2实验溶液,暴露10 d后,采用冰浴解剖,在体式显微镜下快速取出食蚊鱼的肝脏、肠道和肌肉组织。其中,每个烧杯取3尾鱼的组织置于EP管,液氮速冻后于-80 ℃保存,用于酶活的测定;另取3尾鱼的组织置入RNA保存液(TaKaRa)中,4 ℃保存过夜后于-20 ℃保存,用于提取总RNA。
1.3 抗氧化酶活力分析
将保存于-80 ℃的组织取出,按照样品质量∶生理盐水体积=1∶9加入预冷生理盐水,再加入灭菌的氧化锆珠,采用匀浆机(JXFSTPRP-48,上海净信实业发展有限公司)进行低温组织匀浆,4 ℃、2 500 r·min-1离心15 min,吸取上清液配制成1%组织匀浆,用于抗氧化酶活力的测定。测定指标SOD、MDA、CAT、GST和总蛋白含量(TP)均使用南京建成生物工程研究所试剂盒,具体操作参照试剂盒说明进行。
1.4 抗氧化相关基因mRNA表达分析
1.4.1 总RNA的提取及cDNA的合成
使用RNAiso Plus试剂盒(TaKaRa)参照TRIzol法提取肝脏、肠道和肌肉组织的总RNA。用超微量紫外分光光度计(Quawell Q5000,美国)检测RNA的质量和含量。参照PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)试剂盒将RNA合成第一链cDNA,用于荧光定量PCR实验。
1.4.2 荧光定量PCR
根据食蚊鱼基因序列设计qPCR特异性引物(表1),以食蚊鱼GAPDH基因作为内参基因[23],引物由华大基因公司合成。运用荧光定量PCR仪(Applied Biosystems QuantStudio 3)开展实时荧光定量PCR实验。使用SYBR Premix Ex TaqTM(TaKaRa)试剂盒进行qPCR实验,反应总系为10 μL SYBR Premix MixTaq (2×)、上下游引物各1 μL(10 μmol·L-1)、cDNA 2 μL、6 μL ddH2O;反应程序为:预变性50 ℃、2 min,95 ℃、10 min;40个循环95 ℃、15 s,60 ℃、1 min;熔解曲线95 ℃、15 s,60 ℃、1 min,95 ℃、15 s。反应结束后,查看PCR的扩增曲线和熔解曲线判断PCR反应的特异性。检测OFL和SMX联合暴露10 d后食蚊鱼肝脏、肠道、肌肉中GST、HSP70、HSP90、PXR、Nrf2、SOD2、NQO1、GCLC和CAT基因的mRNA表达量。其中,CAT主要在肝脏中特异性表达[24],因此只测定肝脏组织的CAT酶活力和CAT基因mRNA的表达量。
1.5 数据处理
采用2-ΔΔCt法进行基因mRNA相对表达量分析,数c(Mean±SEM)表示。对照组与处理组之间采用t检验,处理组之间采用单因素方差分析(Tukey多重比较)。对测定指标进行主成分分析,同时利用Spearman相关性分析研究抗生素联合胁迫下所测指标之间的相关性。采用Graphpad prism 9和Origin 2019软件进行数据处理和绘图。*表示差异显著P<0.05,**表示差异显著P<0.01,***表示差异显著P<0.001。
2 结果(Results)
2.1 OFL和SMX联合暴露10 d后食蚊鱼不同组织中抗氧化酶活力的变化
不同浓度OFL和SMX联合暴露10 d后,食蚊鱼3个组织中抗氧化酶活力均呈现剂量-效应关系(图1)。低浓度组中,食蚊鱼3个组织的SOD活力均有增强(图1(a))。在肝脏组织中:低、中浓度组SOD活力有所增加,中浓度组SOD活力变化显著(P<0.05),是对照组的2.40倍,高浓度组SOD活力与对照组无显著差异。中浓度组GST活力(图1(b))显著增加(P<0.01),是对照组的1.66倍,高浓度组出现显著下调(P<0.01),比对照组降低24%。CAT活力(图1(c))随着抗生素浓度的升高呈现先上升再下降的趋势,低、中浓度组活力显著增加(P<0.05),分别为对照组的1.44倍和1.99倍,高浓度组CAT活力与对照组无显著差异。MDA含量(图1(d))在低、高浓度组出现显著增加(P<0.001),分别为对照组的2.62倍和2.67倍,机体出现脂质过氧化,而中浓度组出现MDA含量受抑制(P<0.05),比对照组下降35%。
表1 目标基因的qPCR引物序列
Table 1 qPCR primer sequence of target genes

目的基因Genes正向引物(5’~3’)Forward primer sequence (5’~3’)反向引物(5’~3’)Reverse primer sequence (5’~3’)CATCCATCTTCTTCATCAGGGACGCGGGTTTGAGGGTTTCGCTTCTGSTTGCTCGCCATCAATCCCAGGAAGCACCGTAGGACTCGTTCAGHSP70TTACTTCAATGACTCCCAGCGTTACTTCAATGACTCCCAGCGGAPDHTTACTTCAATGACTCCCAGCGTCAGGGATGACCTTGCCAACAGHSP90GAGGACCTGCCCCTAAACAGATTCTGGGAGTCTTCGTGGSOD2TACTGGGCACTGACTAAGGAGCGGCATTGATGTATGGGAGCANQO1TCTACTGGTTCAGCGTCCCGAACGACAGCAGAGCCTTCTTGGCLCGACAGGACCCAAGAGGAACGTCCCCACAGCAAGACAGGTAGNrf2CCTGCTGATGGCTGGCTTTACAGATGTGCTCCTGGTTGAATGPXRGCGATCTGGCGAAGGGTTAGCATTTATTCAGGAACGGACAT
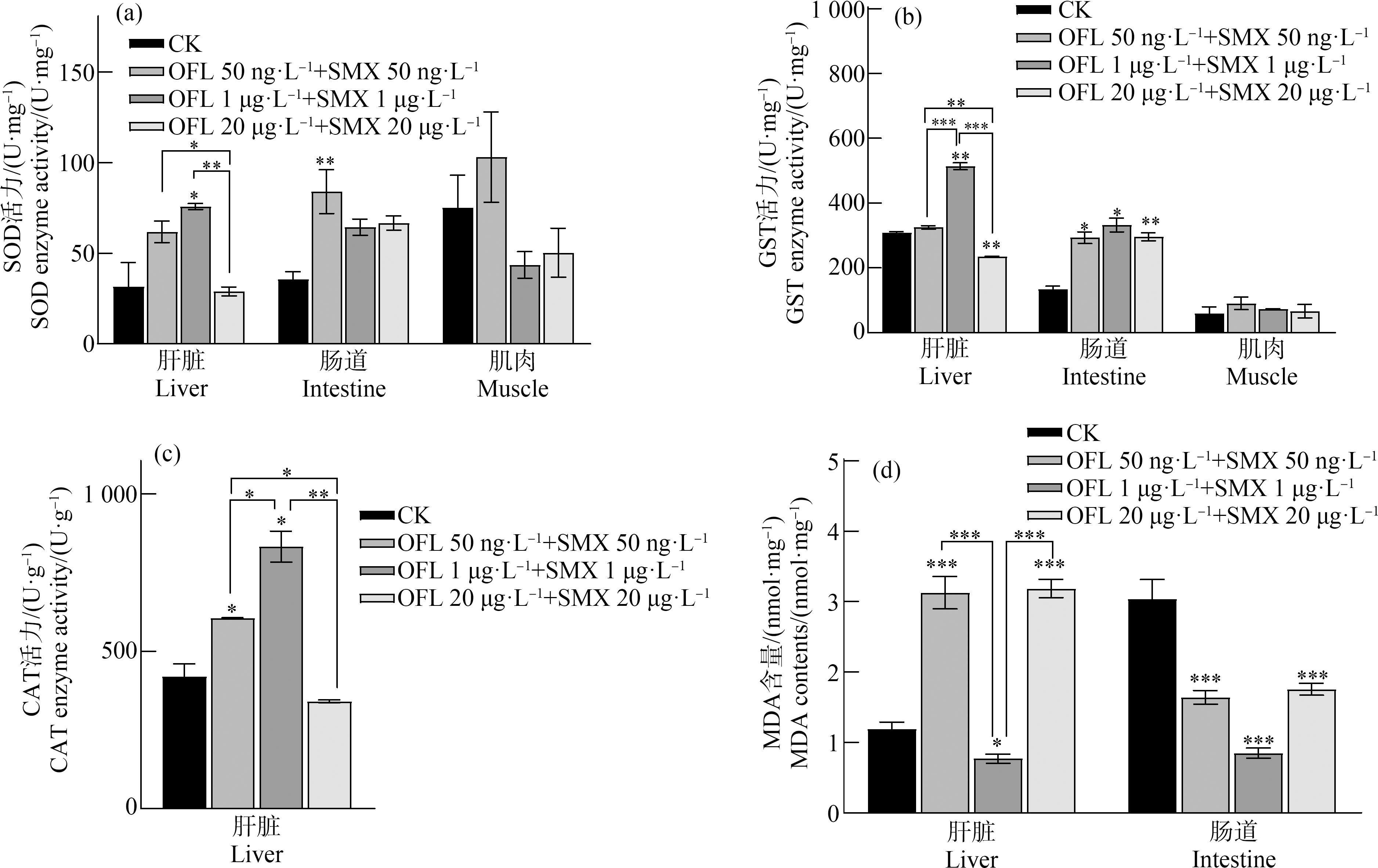
图1 氧氟沙星(OFL)和磺胺甲恶唑(SMX)联合暴露10 d后食蚊鱼不同组织中超氧化物歧化酶(SOD)、
谷胱甘肽S-转移酶(GST)、过氧化氢酶(CAT)活力和丙二醛(MDA)含量的变化
Fig. 1 The changes of the activities of superoxide dismutase (SOD), glutathione S-transferase (GST), catalase (CAT), and malondialdehyde (MDA) contents in the different mosquitofish tissues after combined ofloxacin (OFL) and sulfamethoxazole (SMX) exposure for 10 d
在肠道组织中:低浓度组SOD活力显著增加(P<0.01),是对照组的2.36倍。3个组GST活力均显著增加(P<0.05)。MDA含量在3个组均被显著抑制(P<0.001)。在肌肉组织中:各浓度组总SOD活力和GST活力较对照组均无显著差异,肌肉组织中MDA含量较低,未检出。
总体而言,SOD和GST活力在肝脏和肠道组织中变化明显,肝脏组织中SOD、GST和CAT均呈现“倒U”型,肠道组织中SOD和GST均显著增加。MDA含量在肝脏和肠道中均变化显著,呈现不同的特征,其中,MDA含量在肝脏中呈现“V”型,在肠道中均显著降低。
2.2 OFL和SMX联合暴露10 d后食蚊鱼不同组织抗氧化相关基因mRNA表达的变化
在肝脏组织中(图2),CAT基因mRNA表达量随暴露浓度增加,呈现先升高再下降的趋势。其中,中浓度组CAT基因显著上调(P<0.001),是对照组的2倍;低、中浓度组GST基因表达无显著变化,高浓度组GST基因表达显著上调(P<0.01)。高浓度组HSP70基因表达显著上调(P<0.0001),是对照组的1.95倍,而低、中浓度组HSP90基因显著下调(P<0.05),高浓度组HSP90基因与对照组无显著差异。3个浓度组SOD2基因和NQO1基因mRNA表达量与对照组均无显著差异。低浓度组GCLC基因显著下调(P<0.01),中浓度组Nrf2基因显著下调(P<0.01)且与高浓度组Nrf2基因表达差异显著(P<0.01)。低浓度组PXR基因显著下调(P<0.01),中、高浓度组PXR基因与对照组无明显差异。

图2 OFL和SMX联合暴露10 d后食蚊鱼肝脏组织中抗氧化相关基因mRNA表达变化
Fig. 2 mRNA expression levels of antioxidation-related genes in liver tissue of mosquitofish after combined OFL and SMX exposure for 10 d
在肠道组织中(图3),低浓度组GST基因和HSP70基因显著下调(P<0.01),高浓度组HSP70基因显著下调(P<0.01),而中浓度组HSP70基因与对照组无显著差异。低浓度组HSP90基因显著下调(P<0.05),高浓度组HSP90基因显著上调(P<0.05)。低浓度组SOD2基因显著下调(P<0.001),比对照组下降46%。低、中浓度组NQO1基因均显著下调(P<0.05),分别比对照组下降31%和34%。低浓度组GCLC基因显著下调(P<0.05),中浓度组GCLC基因与对照组无显著差异,高浓度组GCLC基因显著上调(P<0.01)。3个浓度组Nrf2基因和PXR基因mRNA表达量与对照组均无显著差异。
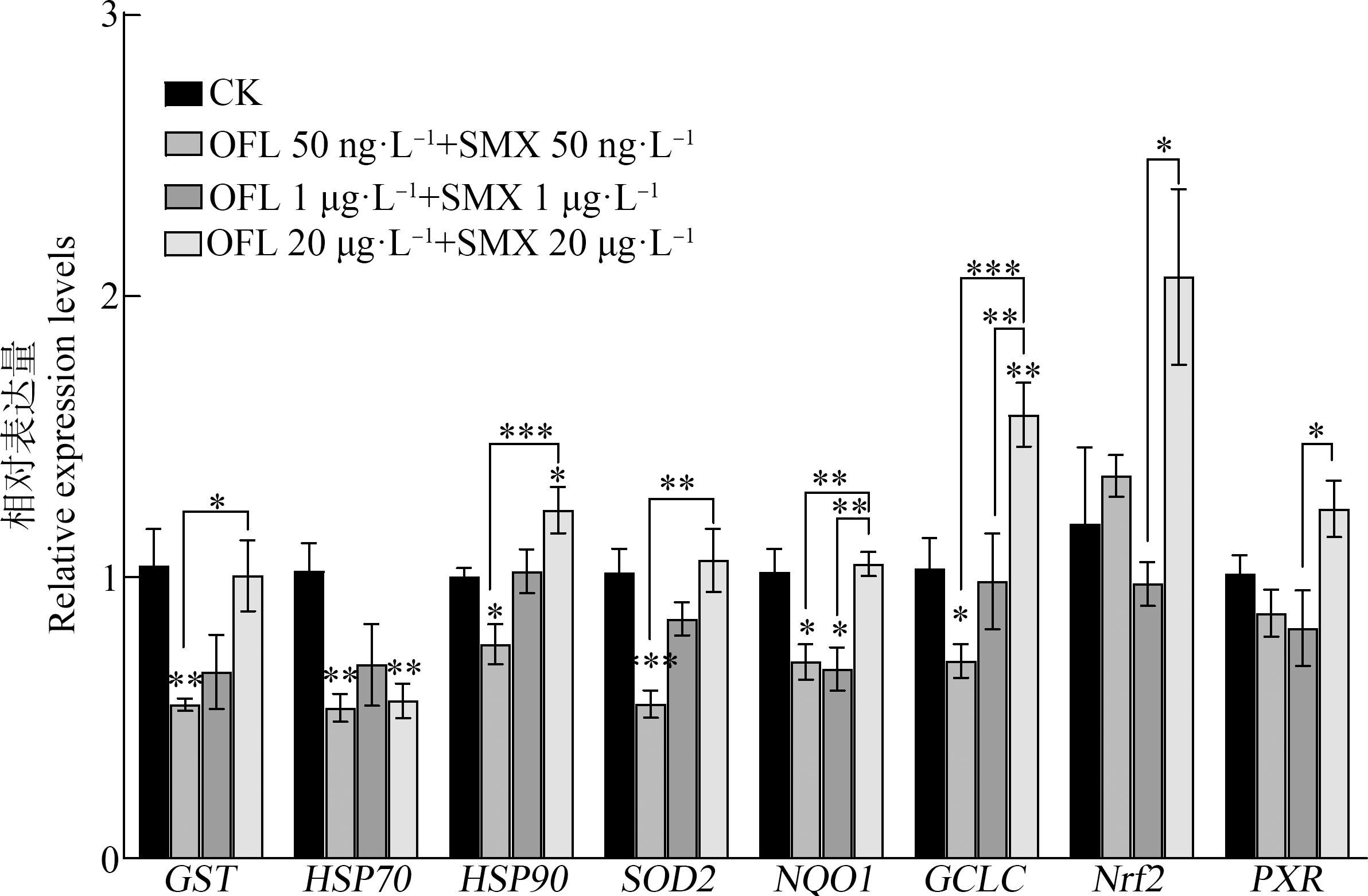
图3 OFL和SMX联合暴露10 d后食蚊鱼肠道组织中抗氧化相关基因mRNA表达变化
Fig. 3 mRNA expression levels of antioxidation-related genes in intestinal tissue of mosquitofish after combined OFL and SMX exposure for 10 d
在肌肉组织中(图4),个体间差异较大。3个浓度组中GST基因、HSP70基因、NQO1基因和GCLC基因mRNA表达量与对照组均无显著差异;中浓度组HSP90基因上调(P<0.05);低、高浓度组SOD2基因mRNA表达量均显著下调(P<0.01),分别比较对照组下降37%和52%。中浓度组Nrf2基因显著上调(P<0.05);低浓度组PXR基因显著下调(P<0.001),较对照组下降60%,而中浓度PXR基因显著上调(P<0.05)。
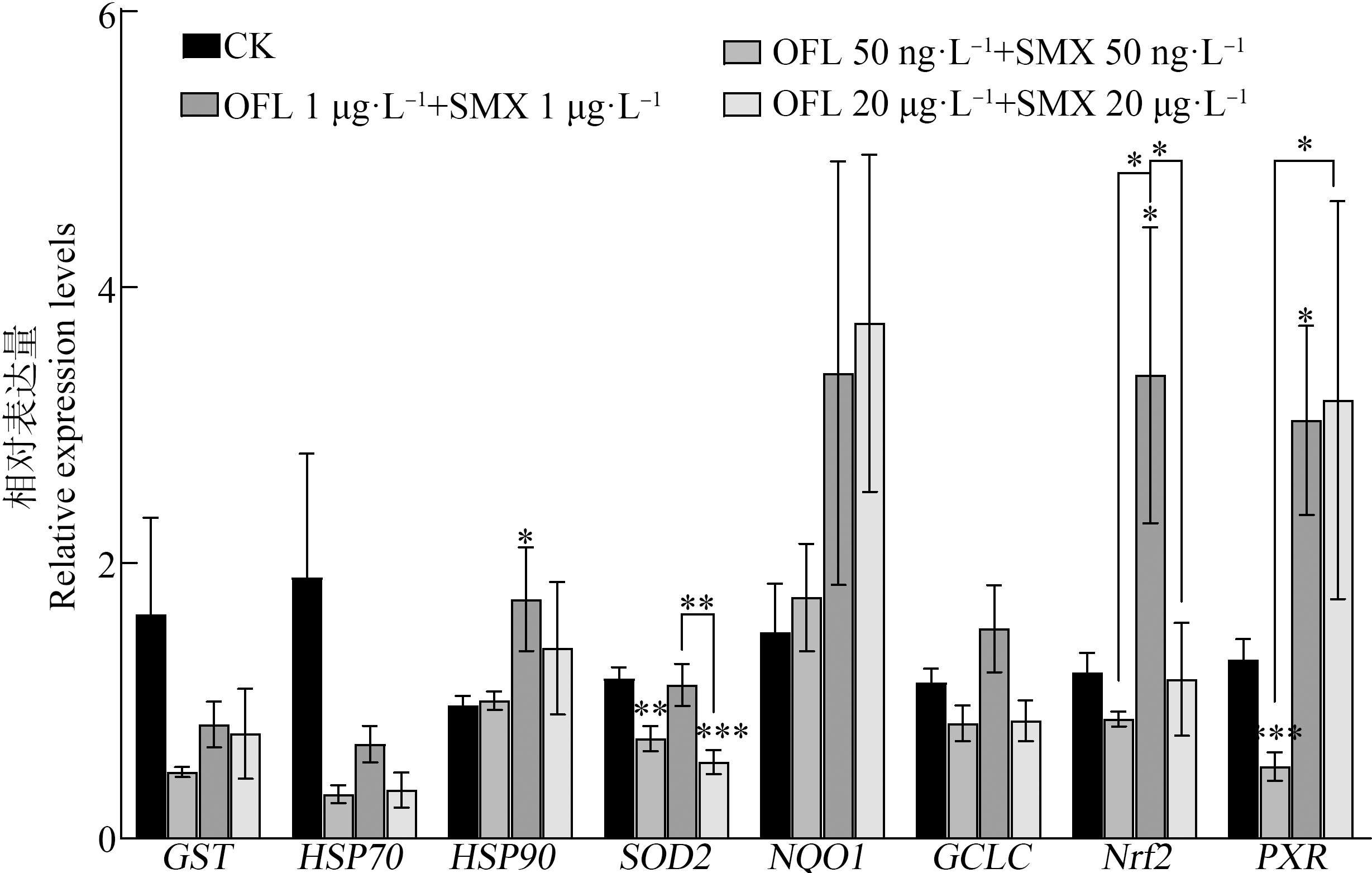
图4 OFL和SMX联合暴露10 d后食蚊鱼肌肉组织中抗氧化相关基因mRNA表达变化
Fig. 4 mRNA expression levels of antioxidation-related genes in muscle tissue of mosquitofish after combined OFL and SMX exposure for 10 d
2.3 主成分分析和相关性分析
根据主成分分析,肝脏组织中,第一主成分(PC1)和第二主成分(PC2)的累积贡献率为84.73%。在PC1特征向量中,NQO1和HSP90贡献最大;PC2特征向量中,HSP70和CAT贡献最大(图5(a))。肠道组织中,PC1和PC2累积贡献率为87.38%,在PC1特征向量中,GST和SOD2贡献最大;PC2特征向量中,SOD酶和GST酶贡献最大(图5(c))。在肌肉组织中,PC1和PC2累积贡献率为74.98%,在PC1特征向量中,HSP90和GST贡献最大;PC2特征向量中,SOD酶和SOD2贡献最大(图5(e))。综上,肝脏组织NQO1、HSP90和HSP70基因受到的影响较大,肠道组织GST酶及基因、SOD酶及SOD2基因受到较大影响,肌肉组织SOD酶、SOD2基因、HSP90基因受到较大影响。
根据Spearman相关性分析,在肝脏组织中(图5(b)),CAT酶分别与GST酶(ρ=0.904,P=0.002)、SOD酶(ρ=0.778,P=0.023)呈显著正相关,与HSP90基因(ρ=-0.952,P<0.001)、NQO1基因(ρ=-0.810,P=0.015)、Nrf2基因(ρ=-0.738,P=0.037)、PXP基因(ρ=-0.833,P=0.01)呈显著负相关。而HSP90基因分别与SOD酶(ρ=-0.843,P<0.001)、GST酶(ρ=-0.952,P<0.001)、CAT酶(ρ=-0.952,P<0.001)呈显著负相关。GST酶与SOD酶呈显著正相关(ρ=0.754,P=0.03),与NQO1基因(ρ=-0.905,P=0.002)呈现显著负相关。
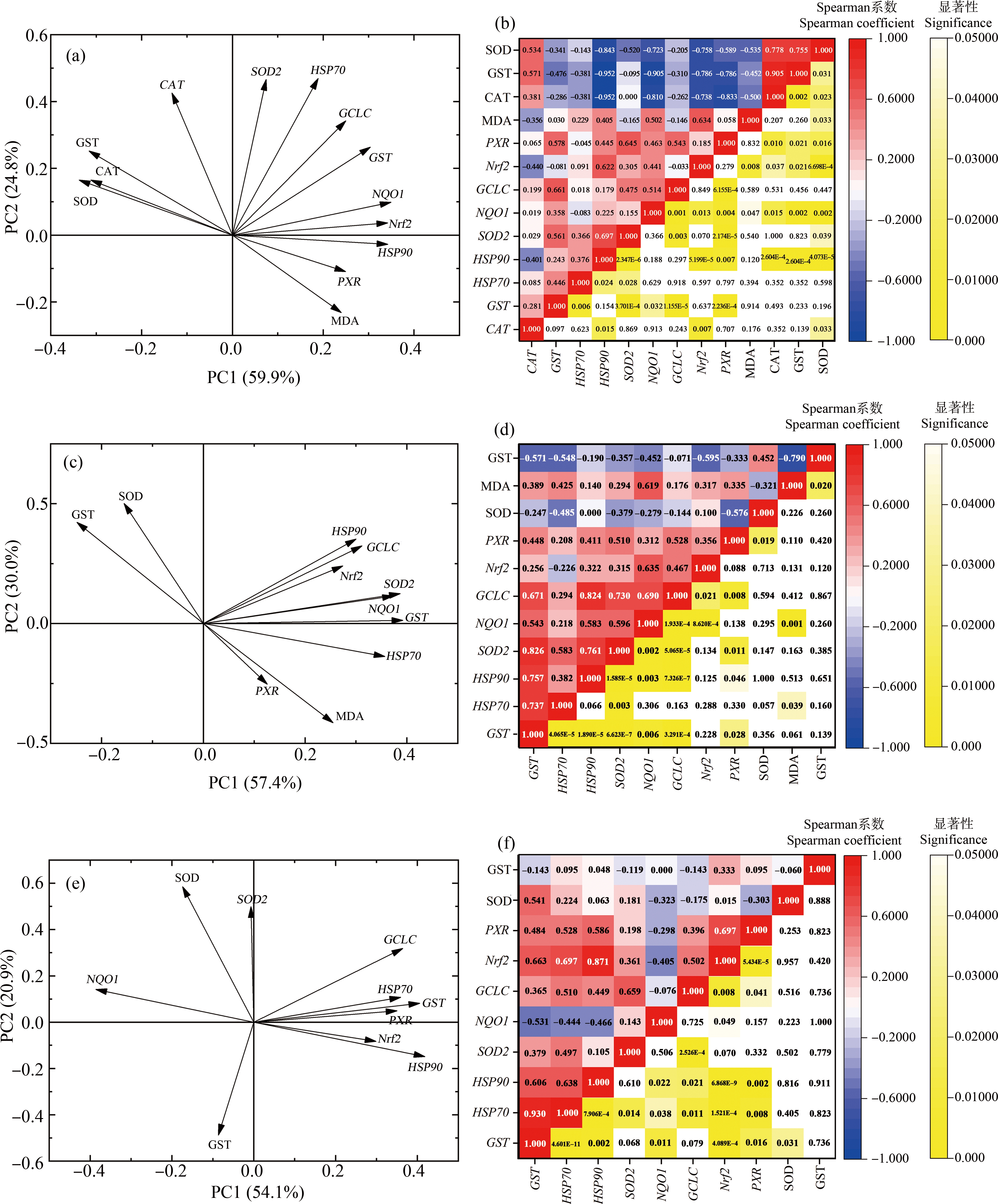
图5 OFL和SMX联合暴露10 d后食蚊鱼不同组织中抗氧化酶和相关基因主成分分析图及Spearman相关性分析热图
注:(a)、(b)为肝脏组织;(c)、(d)为肠道组织;(e)、(f)为肌肉组织。
Fig. 5 Principal component analysis and Spearman correlation analysis heat map of antioxidant enzymes and related genes in different tissues of mosquitofish after combined OFL and SMX exposure for 10 d
Note: (a) and (b) are liver tissue; (c) and (d) are intestinal tissue; (e) and (f) are muscle tissue.
在肠道组织中(图5(d)),GST酶与MDA含量(ρ=-0.790,P=0.02)呈现显著负相关,GST基因分别与HSP70基因(ρ=0.737,P<0.001)、HSP90基因(ρ=0.757,P<0.001)、SOD2基因(ρ=0.826,P<0.001)呈显著正相关。HSP90基因分别与SOD2基因(ρ=0.761,P<0.001)和GCLC基因(ρ=0.824,P<0.001)呈现显著正相关。在肌肉组织(图5(f)),GST基因与HSP70基因(ρ=0.930,P<0.001)呈显著正相关,HSP90基因与Nrf2基因(ρ=0.871,P<0.001)呈显著正相关。
综上,通过主成分分析和Spearman相关性分析,在肝脏组织中,抗氧化酶相互之间相关性较强,抗氧化酶活力与相关基因mRNA表达量均呈现负相关。肠道和肌肉组织中各因素相关性较弱。在食蚊鱼肝脏、肠道和肌肉组织中,HSP70基因、HSP90基因、GST酶和GST基因、SOD酶和SOD2基因,在OFL和SMX联合暴露10 d后受到较大影响,可作为混合抗生素的生态毒理指标。
2.4 OFL和SMX联合暴露10 d后食蚊鱼抗氧化酶活力和相关基因的关系
2.4.1 食蚊鱼不同组织中CAT、SOD、GST酶及基因与OFL和SMX联合暴露10 d的相互关系
肝脏组织中,不同浓度组的CAT活力变化与CAT基因的mRNA表达量变化趋势一致(图6(b),呈现随浓度增加呈现先升高再下降的趋势。SOD酶与SOD2基因在肝脏组织中显著负相关(图6(a)),而在肠道和肌肉组织中无显著相关性(图6(d)、6(f))。GST基因与GST酶均无显著相关性(图6(c)、6(e)、6(g))。
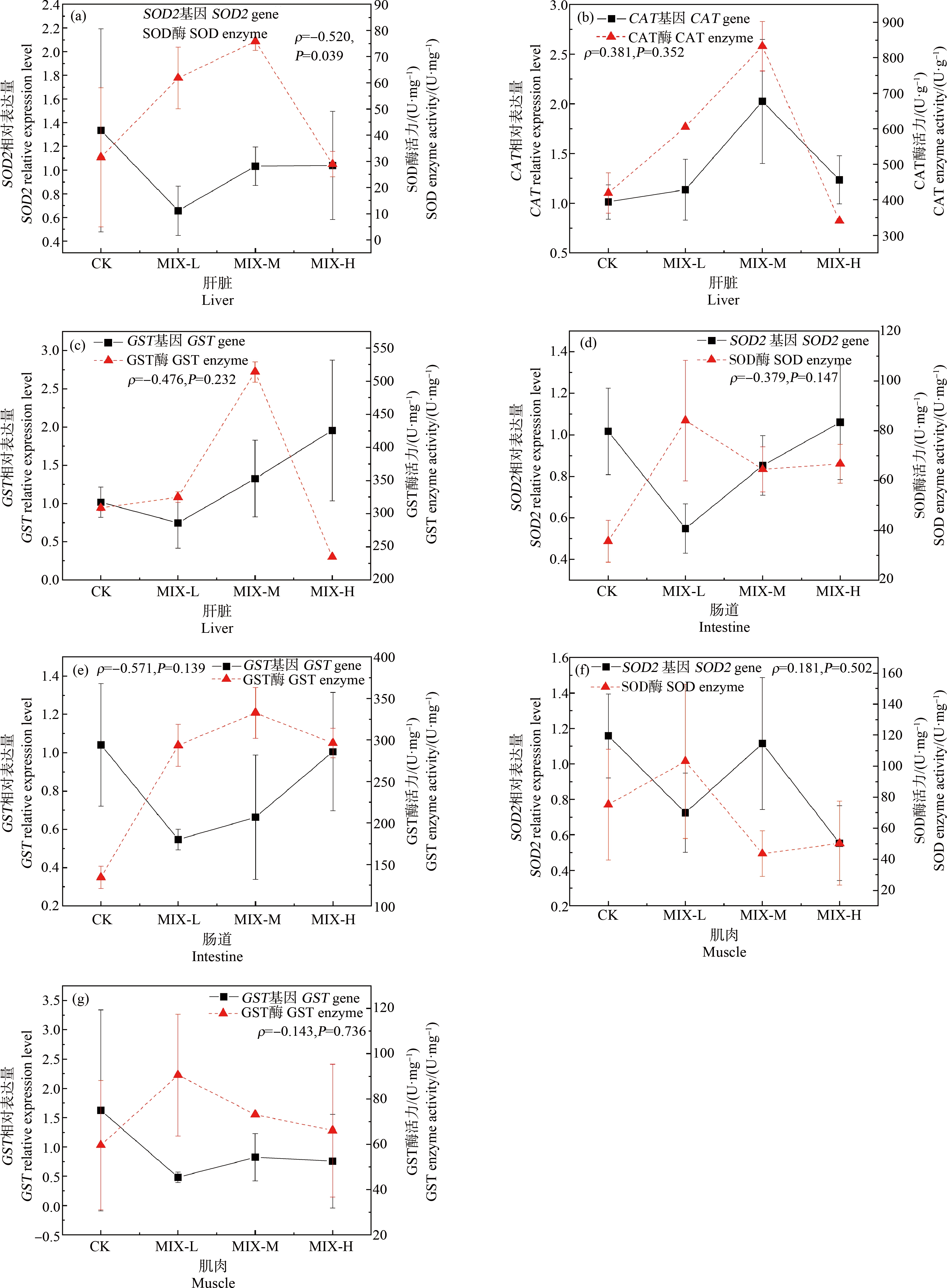
图6 OFL和SMX联合暴露10 d后食蚊鱼不同组织中酶与对应基因的关系
注:(a)、(b)、(c)为肝脏组织,(d)、(e)为肠道组织,(f)、(g)为肌肉组织,ρ表示Spearman相关系数,P值表示显著性;CK表示对照组,MIX-L表示OFL 50 ng·L-1+SMX 50 ng·L-1;MIX-M表示OFL 1 μg·L-1+SMX 1 μg·L-1;MIX-H表示OFL 20 μg·L-1+SMX 20 μg·L-1;下同。
Fig. 6 Relationship between enzymes and corresponding genes in different tissues of mosquitofish after combined OFL and SMX exposure for 10 d
Note: (a), (b), (c) are liver tissue; (d), (e) are intestinal tissue; (f), (g) are muscle tissue; ρ represents Spearman correlation coefficient, and P value represents significance; CK represents the control group, MIX-L represents OFL 50 ng·L-1+SMX 50 ng·L-1; MIX-M represents OFL 1 μg·L-1+SMX 1 μg·L-1; MIX-H represents OFL 20 μg·L-1+SMX 20 μg·L-1; the same below.
2.4.2 食蚊鱼不同组织中Nrf2、PXR及其调控基因对OFL和SMX联合暴露10 d的响应
食蚊鱼肝脏、肠道和肌肉组织中Nrf2及其下游基因CAT、SOD2、NQO1、GCLC和GST在低浓度组时变化趋势相同,均较对照组下调(图7(a)、7(c)、7(e))。GST受到PXR的调控,GST和PXR基因mRNA表达量在3个组织中均呈现出低浓度组表达下调,后随浓度升高又上调的趋势(图7(b)、7(d)、7(f))。在低、中、高3个浓度组联合暴露下Nrf2、PXR及其调控基因在3个组织中呈现相似的随浓度变化趋势。
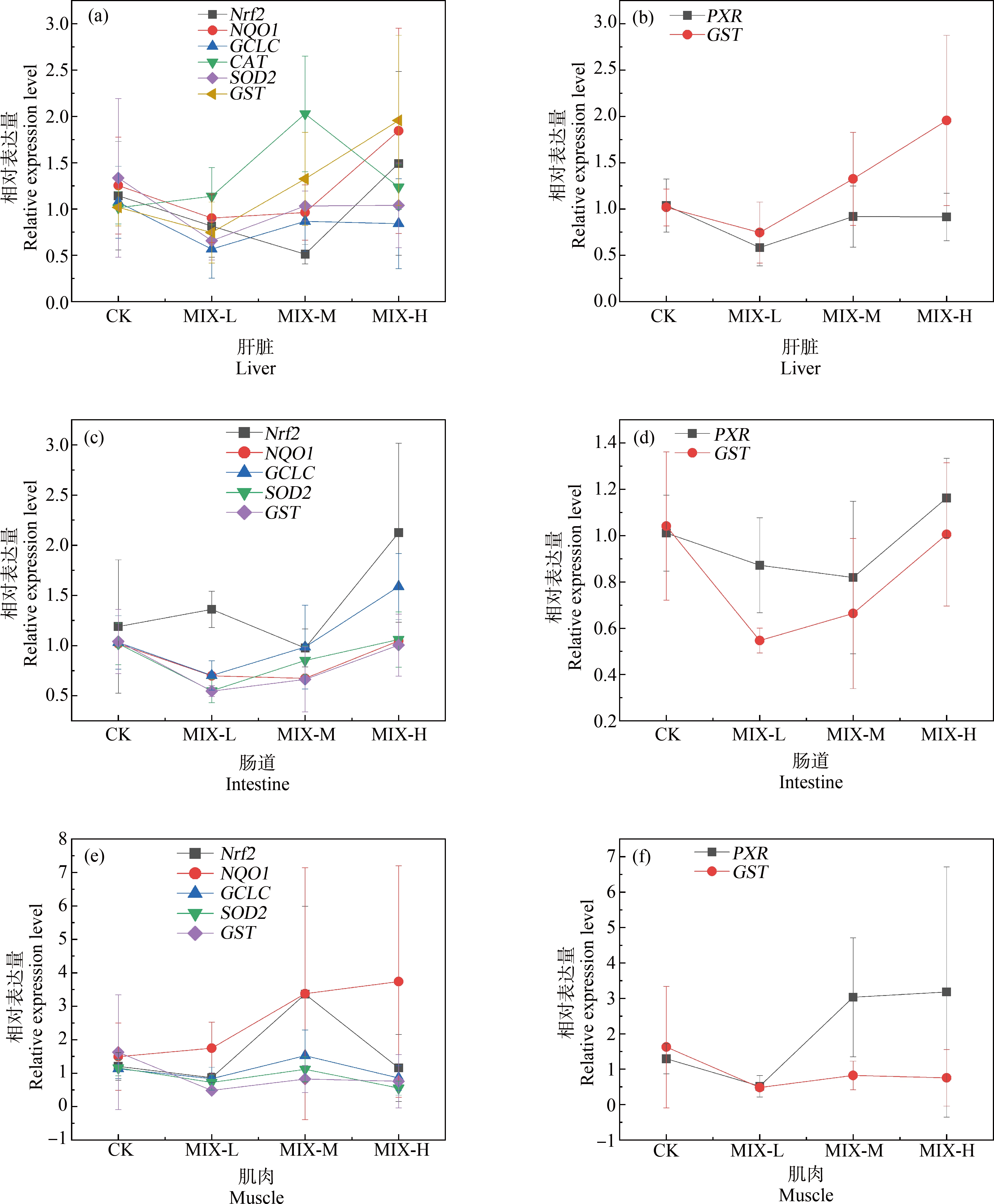
图7 OFL和SMX联合暴露10 d后食蚊鱼不同组织中Nrf2和PXR及其调控基因的mRNA表达变化趋势
Fig. 7 The mRNA expression trends of Nrf2 and PXR and their regulatory genes in different tissues of mosquitofish after combined OFL and SMX exposure for 10 d
3 讨论(Discussion)
3.1 OFL和SMX联合暴露10 d对食蚊鱼抗氧化系统的影响
联合毒性往往不是简单的相加作用,在相同种类的抗生素联合作用下可能会产生协同作用,不同种类的抗生素由于不同的作用机制,其联合毒性可能比单一毒性更大。例如,磺胺二甲基嘧啶和诺氟沙星联合暴露,对青鳉胚胎造成了氧化胁迫,但其氧化胁迫方式和途径与单独暴露存在一定差异[25]。OFL和SMX联合暴露10 d,对食蚊鱼抗氧化酶活力和相关基因表达的变化存在剂量-效应关系,在OFL单独暴露锦鲤和SMX单独暴露斑马鱼胚胎时也有这种特征[4-5]。在单独暴露下,2~10 μg·L-1 OFL和0.8~4 μg·L-1 SMX对淡水鲫鱼SOD均无显著影响。在本研究中,0.05~20 μg·L-1 OFL和SMX联合暴露下,食蚊鱼肝脏和肠道组织SOD均出现了显著变化,这提示OFL与SMX之间可能有着复杂的相互作用,其毒性效应比单独暴露更显著。有研究也发现OFL和SMX单独及联合作用,对风车草的生长、生理及微生物群落均有刺激作用,且联合暴露时毒性效应最大[26]。
在OFL和SMX联合暴露10 d后,食蚊鱼在3个浓度处理组中,肝脏组织HSP70基因mRNA表达上调,而肠道组织HSP70基因mRNA表达下调;HSP90基因mRNA表达量在肝脏组织的低、中浓度组表达下调,在肠道组织低、高浓度组表达上调,呈现出组织特异性。同时,在食蚊鱼肝脏和肠道组织中SOD、GST和CAT在低浓度组呈现增长的特征。有研究也发现260 ng·L-1 SMX暴露能增加斑马鱼肠道炎症因子的表达,在低浓度范围诱导鱼体的生理和基因变化[20]。3个组织中SOD酶活力在不同浓度组无抑制现象发生,且在肝脏中浓度组和肠道低浓度组呈现显著增加趋势,同文献报道的结果一致。例如,鲫鱼在50、250和1 250 μg·L-1 OFL暴露7 d内SOD活力显著增加,在100 μg·L-1和500 μg·L-1 SMX暴露7 d内SOD活力也会显著增加[27];虹鳟鱼暴露于200 μg·L-1卡马西平21 d和42 d后,肝脏SOD活力显著增加[28]。金鱼暴露于0.4 mg·L-1 SMX中7 d,肝脏内SOD活力均显著增加。同时,在肝脏组织中SOD酶活力和CAT酶活力随浓度的变化趋势相同,呈显著正相关(ρ=0.778,P=0.023),许多研究也表明SOD酶和CAT酶具有协同作用[29]。GST酶在食蚊鱼肝脏和肠道表达量较高,且在OFL和SMX联合暴露10 d后活力升高,与PCPs胁迫禾花鲤后肝脏中的GST酶的变化一致[30]。
肝脏组织中,低浓度组和高浓度组MDA含量显著增加。有研究也发现,虹鳟鱼口服100 mg·kg-1土霉素14 d后MDA含量显著增加[31]。在肠道组织中,3个浓度组MDA含量均呈现显著降低,可能是因为相比于肌肉和肝脏等其他器官,肠道是抗生素的主要吸收区域,对抗生素更加敏感,耐受力较低[32],受到了破坏性氧化损伤导致MDA含量表达降低。辛伐他汀(SV) 0.5、5、50和500 μg·L-1暴露食蚊鱼实验中,大部分处理组的鱼体MDA含量也都呈现了抑制趋势[33]。
3.2 OFL和SMX联合暴露10 d后食蚊鱼抗氧化酶及基因的相互关系
OFL和SMX抗生素联合暴露10 d后,在食蚊鱼肝脏组织中,CAT酶及CAT基因随浓度增加的变化趋势相同,SOD酶与SOD2基因呈现显著负相关。GST酶与GST基因之间无显著相关,GST基因高浓度组显著上调,而GST酶活力在高浓度组显著下调。在肠道组织中,GST基因低浓度组显著下调,GST酶活力显著上调,GST基因与GST酶活力对浓度的响应相反。在肠道和肌肉组织中,抗氧化酶及其基因无显著相关性,抗氧化系统在蛋白和mRNA表达水平出现毒性响应差异,食蚊鱼抗氧化系统相关基因mRNA的表达对OFL和SMX联合暴露10 d更为灵敏。鱼体暴露于抗生素后,基因响应比酶活力响应更为灵敏,这可能是因为基因翻译为蛋白的过程中受多种调控因素影响[34],故酶反应滞后于基因的mRNA表达。因此,基因mRNA表达作为生态毒理指标,比酶更具有及时性,能比酶更灵敏和准确地呈现机体的损伤。此外,抗氧化酶及基因在mRNA表达和蛋白水平上有差异,也可能与生物体内酶的多种类型有关,如SOD酶分为有Cu/Zn-SOD、Mn-SOD、Fe-SOD,GST酶包括有α、μ、π和θ等亚型。
3.3 OFL和SMX联合暴露10 d与食蚊鱼不同组织中Nrf2、PXR及其调控基因的响应关系
机体在受到氧化胁迫时,会产生ROS促使Nrf2与keap1解离进入细胞核与抗氧化反应原件(antioxidant response element, ARE)结合,进而激活一系列下游抗氧化酶的表达和Ⅱ相解毒酶,以消除ROS对机体的损伤[18]。在3个组织中,Nrf2基因及其下游基因NQO1、GCLC、SOD2和GST的mRNA表达变化,与GST和PXR基因mRNA表达变化相似,呈现随浓度增加先下降再上升的趋势。下游基因与Nrf2、PXR基因相似的剂量-效应关系,反映了Nrf2基因和PXR基因对其下游基因表达的调控。在肝脏组织中,Nrf2基因与NQO1基因呈弱相关,在肠道和肌肉组织中与NQO1和GCLC基因显著相关。PXR基因与GST基因在3个组织中呈现显著正相关,但相关性较低,说明虽然NQO1、GCLC、SOD2和GST基因是Nrf2基因的下游基因,但可能还受其他通路的影响。食蚊鱼在三氯生(TSC)、双氯芬酸(DCF)和辛伐他汀(SV)暴露后,也出现了类似的变化特征[33,35]。在3个组织中,低浓度和高浓度处理组中Nrf2表达与对照组均无显著差异。在中浓度处理组,食蚊鱼肝脏Nrf2基因mRNA表达量显著降低,可能是Nrf2进入细胞核与ARE结合使其减少,进而刺激下游抗氧化酶转录。在中浓度组肌肉组织中,Nrf2基因mRNA表达上调,可能是暴露下产生氧化应激反应,Nrf2与keap1解离速率大于与ARE的结合速率。有研究报道,SMX和氯氰菊酯在环境浓度下能诱导草鱼产生轻度氧化应激反应,且草鱼的生存机制是通过Nrf2及其下游抗氧化基因发挥作用的[36]。综上,环境水平OFL和SMX联合暴露可诱导食蚊鱼产生氧化应激反应,而其抵御外界抗生素氧化胁迫可能与ROS产生激活Nrf2通路有关。
[1] 张延, 严晓菊, 孙越, 等. 中国抗生素滥用现状及其在环境中的分布情况[J]. 当代化工, 2019, 48(11): 2660-2662, 2666
Zhang Y, Yan X J, Sun Y, et al. Current situation of antibiotic abuse in China and its residues distribution in the environment [J]. Contemporary Chemical Industry, 2019, 48(11): 2660-2662, 2666 (in Chinese)
[2] 章强, 辛琦, 朱静敏, 等. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J]. 环境化学, 2014, 33(7): 1075-1083
Zhang Q, Xin Q, Zhu J M, et al. The antibiotic contaminations in the main water bodies in China and the associated environmental and human health impacts [J]. Environmental Chemistry, 2014, 33(7): 1075-1083 (in Chinese)
[3] Sukul P, Spiteller M. Fluoroquinolone antibiotics in the environment [J]. Reviews of Environmental Contamination and Toxicology, 2007, 191: 131-162
[4] 沈洪艳, 王冰, 赵月, 等. 氧氟沙星对锦鲤抗氧化系统和DNA损伤的影响[J]. 环境科学与技术, 2015, 38(12): 59-66
Shen H Y, Wang B, Zhao Y, et al. Effects of ofloxacin on antioxidant system and DNA damage of Cyprinus carpio [J]. Environmental Science & Technology, 2015, 38(12): 59-66 (in Chinese)
[5] Liu J Y, Wei T Z, Wu X, et al. Early exposure to environmental levels of sulfamethoxazole triggers immune and inflammatory response of healthy zebrafish larvae [J]. The Science of the Total Environment, 2020, 703: 134724
[6] Yang C, Song G, Lim W. A review of the toxicity in fish exposed to antibiotics [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2020, 237: 108840
[7] 方淑霞, 王大力, 朱丽华, 等. 抗生素对微生物的联合与低剂量毒性研究进展[J]. 生态毒理学报, 2015, 10(2): 69-75
Fang S X, Wang D L, Zhu L H, et al. Progress in researches on toxicity of antibiotics in low dose and mixture exposure to microorganisms [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 69-75 (in Chinese)
[8] 王桂祥, 张琼, 匡少平, 等. 环境浓度下的混合抗生素对普通小球藻的联合毒性[J]. 生态毒理学报, 2019, 14(2): 122-128
Wang G X, Zhang Q, Kuang S P, et al. The joint toxicity of mixed antibiotics on Chlorella vulgaris at normal environmental concentration [J]. Asian Journal of Ecotoxicology, 2019, 14(2): 122-128 (in Chinese)
[9] 卢正山. 浑河沈抚段水体典型抗生素分布特征及风险评价[D]. 沈阳: 沈阳师范大学, 2020: 20-28
Lu Z S. Distribution characteristics and risk assessment of typical antibiotics in Shenfu section of Hunhe River [D]. Shenyang: Shenyang Normal University, 2020: 20-28 (in Chinese)
[10] 徐浩, 肖湘波, 唐文浩, 等. 海口城区地表水环境中抗生素含量特征研究[J]. 环境科学与技术, 2013, 36(9): 60-65
Xu H, Xiao X B, Tang W H, et al. Concentration characteristics of antibiotics in urban aquatic environment of Haikou [J]. Environmental Science & Technology, 2013, 36(9): 60-65 (in Chinese)
[11] 袁圣武, 黄超, 季晓亚, 等. 环境污染物导致氧化应激的关键信号通路及其检测方法[J]. 生态毒理学报, 2017, 12(1): 25-37
Yuan S W, Huang C, Ji X Y, et al. Main signaling pathways and detection methods of oxidative stress caused by environmental pollutants [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 25-37 (in Chinese)
[12] Valavanidis A, Vlahogianni T, Dassenakis M, et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants [J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 178-189
[13] Wang X F, Miao J J, Pan L Q, et al. Toxicity effects of p-choroaniline on the growth, photosynthesis, respiration capacity and antioxidant enzyme activities of a diatom, Phaeodactylum tricornutu [J]. Ecotoxicology and Environmental Safety, 2019, 169: 654-661
[14] Lin T, Yu S L, Chen Y Q, et al. Integrated biomarker responses in zebrafish exposed to sulfonamides [J]. Environmental Toxicology and Pharmacology, 2014, 38(2): 444-452
[15] Knowlton A A, Salfity M. Nuclear localization and the heat shock proteins [J].Journal of Biosciences, 1996, 21(2): 123-132
[16] Yu B P. Cellular defenses against damage from reactive oxygen species [J]. Physiological Reviews, 1994, 74(1): 139-162
[17] Ji C L, Li F, Wang Q, et al. An integrated proteomic and metabolomic study on the gender-specific responses of mussels Mytilus galloprovincialis to tetrabromobisphenol A (TBBPA) [J]. Chemosphere, 2016, 144: 527-539
[18] Battino M, Giampieri F, Pistollato F, et al. Nrf2 as regulator of innate immunity: A molecular Swiss army knife! [J]. Biotechnology Advances, 2018, 36(2): 358-370
[19] Kliewer S A, Goodwin B, Willson T M. The nuclear pregnane X receptor: A key regulator of xenobiotic metabolism [J]. Endocrine Reviews, 2002, 23(5): 687-702
[20] Zhou L, Limbu S M, Shen M L, et al. Environmental concentrations of antibiotics impair zebrafish gut health [J]. Environmental Pollution, 2018, 235: 245-254
[21] Varol M, Sünbül M R. Environmental contaminants in fish species from a large dam reservoir and their potential risks to human health [J]. Ecotoxicology and Environmental Safety, 2019, 169: 507-515
[22] Hallare A, Nagel K, Köhler H R, et al. Comparative embryotoxicity and proteotoxicity of three carrier solvents to zebrafish (Danio rerio) embryos [J]. Ecotoxicology and Environmental Safety, 2006, 63(3): 378-388
[23] 欧瑞康, 武小燕, 库培佳, 等. 食蚊鱼(Gambusia afinis) cat、gapdh和gst基因的克隆及其在生态毒理学中的应用[J]. 生态毒理学报, 2015, 10(3): 83-92
Ou R K, Wu X Y, Ku P J, et al. Cloning of cat, gapdh and gst genes of Gambusia affinis and its application in ecotoxicology [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 83-92 (in Chinese)
[24] 王群, 刘淇, 唐雪莲, 等. 诺氟沙星在养殖鲈体内的代谢动力学和残留研究[J]. 水产学报, 2004(B12): 13-18
Wang Q, Liu Q, Tang X L, et al. Study on pharmacokinetics and residues of norfloxacin in cultured Lateolabrax japonicus [J]. Journal of Fisheries of China, 2004(B12): 13-18 (in Chinese)
[25] 王耿丽. 典型抗生素联合暴露对海水青鳉(Oryzias melastigma)胚胎的毒性及生物富集效应研究[D]. 厦门: 厦门大学, 2015: 57-60
Wang G L. Toxicity and bioaccumulation effect of typical antibiotic combined exposure on seawater medaka embryos [D]. Xiamen: Xiamen University, 2015: 57-60 (in Chinese)
[26] Xu J M, Liu X H, Lv Y, et al. Response of Cyperus involucratus to sulfamethoxazole and ofloxacin-contaminated environments: Growth physiology, transportation, and microbial community [J]. Ecotoxicology and Environmental Safety, 2020, 206: 111332
[27] Yang X F, Xu X P, Wei X Y, et al. Biomarker effects in Carassius auratus exposure to ofloxacin, sulfamethoxazole and ibuprofen [J]. International Journal of Environmental Research and Public Health, 2019, 16(9): 1628
[28] Li Z H, Velisek J, Zlabek V, et al. Hepatic antioxidant status and hematological parameters in rainbow trout, Oncorhynchus mykiss, after chronic exposure to carbamazepine [J]. Chemico-Biological Interactions, 2010, 183(1): 98-104
[29] Jiang W D, Wu P, Tang R J, et al. Nutritive values, flavor amino acids, healthcare fatty acids and flesh quality improved by manganese referring to up-regulating the antioxidant capacity and signaling molecules TOR and Nrf2 in the muscle of fish [J]. Food Research International, 2016, 89(Pt 1): 670-678
[30] 宋晓红, 刘顺亮, 陈俊华, 等. PCPs污染物胁迫对禾花鲤不同组织抗氧化系统的影响[J]. 桂林理工大学学报, 2019, 39(1): 177-182
Song X H, Liu S L, Chen J H, et al. Pollutant PCPs on antioxidative system in different tissues of Procypris mera [J]. Journal of Guilin University of Technology, 2019, 39(1): 177-182 (in Chinese)
[31] Enis Yonar M, Mi e Yonar S, Silici S. Protective effect of propolis against oxidative stress and immunosuppression induced by oxytetracycline in rainbow trout (Oncorhynchus mykiss, W.) [J]. Fish & Shellfish Immunology, 2011, 31(2): 318-325
e Yonar S, Silici S. Protective effect of propolis against oxidative stress and immunosuppression induced by oxytetracycline in rainbow trout (Oncorhynchus mykiss, W.) [J]. Fish & Shellfish Immunology, 2011, 31(2): 318-325
[32] Zhou L J, Ying G G, Liu S, et al. Excretion masses and environmental occurrence of antibiotics in typical swine and dairy cattle farms in China [J]. The Science of the Total Environment, 2013, 444: 183-195
[33] Bao S, Lin J W, Xie M N, et al. Simvastatin affects Nrf2/MAPK signaling pathway and hepatic histological structure change in Gambusia affinis [J]. Chemosphere, 2021, 269: 128725
[34] Liang X M, Wang F, Li K B, et al. Effects of norfloxacin nicotinate on the early life stage of zebrafish (Danio rerio): Developmental toxicity, oxidative stress and immunotoxicity [J]. Fish & Shellfish Immunology, 2020, 96: 262-269
[35] Bao S, He C P, Ku P J, et al. Effects of triclosan on the RedoximiRs/sirtuin/Nrf2/ARE signaling pathway in mosquitofish (Gambusia affinis) [J]. Aquatic Toxicology, 2021, 230: 105679
[36] Zhao H J, Wang Y, Guo M H, et al. Environmentally relevant concentration of cypermethrin or/and sulfamethoxazole induce neurotoxicity of grass carp: Involvement of blood-brain barrier, oxidative stress and apoptosis [J]. The Science of the Total Environment, 2021, 762: 143054