两栖动物具有特殊的水陆两栖的生活特性及皮肤呼吸的生理特性,生长与繁殖都十分依赖水源,对水体环境的改变极其敏感[1]。近年来,大量的农业、工业废水的排放严重破坏了生态环境,也直接对两栖类动物的生存造成了不利影响,水体中的重金属进入蛙蟾体内后会沉积到细胞和器官之中,长时间生活在受重金属污染的水源中,两栖动物将在行为表现、生长发育、生理生化和形态组织等各方面发生显著变化,甚至导致死亡[2-3]。长时间受到重金属污染的两栖动物会出现出膜时间明显缩短、体型偏小甚至畸形等现象,黄德军等[4]在使用不同质量浓度的镉(Cd2+)处理花背蟾蜍(Bufo raddei)蝌蚪的研究中发现了经过处理的个体有明显的出膜时间缩短的现象,并且随着镉的质量浓度升高,花背蟾蜍的致畸率也升高,表现为头大身小。汪学英等[5]在多种重金属离子对黑斑蛙(Rana nigromaculata Hallowell)胚胎期及蝌蚪期的毒性作用的研究中发现重金属离子对黑斑蛙胚胎期中的孵化期和开口期的毒性作用最为明显,比较不同重金属离子的毒性作用发现汞离子在胚胎期及蝌蚪期的影响作用最为明显,Cu2+次之。重金属污染的毒性作用还表现出可遗传性,蔡玲玲等[6]通过将中华大蟾蜍(Bufo bufogargarizans)暴露于不同浓度的Cu2+、Pb2+以及铜铅复合溶液中,探究重金属对中华大蟾蜍蝌蚪的DNA损伤情况发现Cu2+与Pb2+对中华大蟾蜍的DNA均有不同程度的损伤,随着溶液浓度的升高损伤程度也升高,并且一定浓度的铅离子在复合溶液中会加强Cu2+的损伤作用,2种重金属离子对两栖动物存在遗传毒性作用。
在污水的重金属离子中,Cu2+等对两栖动物肌肉和循环系统、神经系统造成破坏性影响。Na+-K+-ATPase酶在动物的肌肉收缩和神经冲动传导过程中至关重要,邱吉和贾秀英[7]研究了镉、铜及2种重金属的复合污染对中华大蟾蜍(B. bufogargarizans)蝌蚪的Na+-K+-ATPase酶活性的影响,发现重金属离子影响过后的中华大蟾蜍蝌蚪Na+-K+-ATPase酶活性显著高于对照组,随着浓度的不断升高,蝌蚪Na+-K+-ATPase酶活性又逐渐降低,甚至被抑制,铜、镉复合污染在Na+-K+-ATPase酶水平上表现出一定的协同作用。李红敬等[8]通过制备牛蛙(Rana catesbiana Shaw)的坐骨神经干,将其浸泡于不同浓度的重金属离子溶液之中,发现Hg2+可以增大牛蛙坐骨神经干的动作电位阈值,并且不同处理组的动作电位传导速度也出现了不规律的变化。在冯磊[9]的研究中发现重金属污染严重的花背蟾蜍(B. raddei)的跳跃能力显著低于正常花背蟾蜍,在受污染的花背蟾蜍个体的腓肠肌石蜡切片中发现,被重金属严重污染的花背蟾蜍的腓肠肌肌肉纤维出现了断裂的现象,这可能是其跳跃能力显著下降的关键原因。
作为最为常见的重金属污染物之一,Cu2+在工业废水排放标准为0.5~2.0 mg·L-1[10],远超于地表水中的Cu2+浓度限值(0.01 mg·L-1)[11],如果工业废水中Cu2+浓度超标或随意排放,将对自然环境尤其是水环境造成严重的污染,目前在绿蟾蜍(Bufo viridis)[12]、中华大蟾蜍(B. bufogargarizans)[13]、黑眶蟾蜍(Bufo melanostictus)[14-15]、中国林蛙(Rana chensinensis)[16]、泽蛙(Rana limnocharis)[17]和黑斑蛙(R. nigromaculata Hallowell)[5]等的研究中均已证明高浓度的Cu2+会显著提高两栖动物的半致死率,对两栖动物及水生动物的生存造成毁灭性的影响,因此探究其对两栖动物及水生动物的影响对于保护环境、治理环境有突出的意义。
为了解Cu2+对两栖动物神经、肌肉及心脏的影响,本研究通过不同浓度的CuSO4溶液对离体蛙心进行灌流,观察并记录离体心脏收缩张力和心博频率的变化,同时测定不同浓度CuSO4胁迫下牛蛙的坐骨神经干的兴奋传导速度的变化,以探讨两栖动物受到急性铜胁迫时神经、肌肉和心脏等所受到的影响。本研究可为两栖动物的保护及水体重金属离子污染排放标准的制定提供参考依据。
1 材料与方法(Materials and methods)
1.1 材料
实验使用的美国牛蛙(R. catesbeiana Shaw)共36只购自四川省雅安市农贸市场,体质量300 g左右,活性良好,雌雄各半,空腹处理24 h后用于实验。
1.2 试验仪器
BL-420生物机能实验系统(成都泰盟科技有限公司),张力换能器(JH-B),神经屏蔽盒,引导电极,刺激电极,台式计算机(联想),信号输入线,刺激输出线,离体蛙心灌流装置,培养皿。
1.3 试验试剂
CuSO4·5H2O、NaCl、KCl、CaCl2、NaHCO3、NaH2PO4·H2O、葡萄糖等,均为国产分析纯。
1.4 试验方法
1.4.1 牛蛙离体蛙心灌流
将CuSO4·5H2O配制为浓度为0.01、0.1、1.0、10.0和100.0 mg·L-1的灌流液。使用双毁髓法处死牛蛙,使蛙仰卧固定于蛙板后暴露心脏,以斯式插管法制备离体蛙心,及时用吸管吸取任氏液换洗余血避免血液凝固堵塞套管,套管内灌流液不再有残留血液后,保持套管内液面恒定,约1.5 cm高,用蛙心夹夹住部分心尖部肌肉约1 mm,将蛙心夹上的细线连接固定在双凹夹的张力换能器悬梁臂上,调整蛙心与张力传感器距离,防止细线过紧或过松。通过BL-410生物机能实验系统记录正常心率与收缩张力曲线。待离体心脏在任氏液中稳定一段时间后,再从低浓度向高浓度进行换置灌流液,每种浓度灌流待心脏心肌收缩稳定后记录数据与波形,结束后用任氏液换洗,待心搏恢复正常平稳状态,再进行下一个浓度的实验观察,记录心率和收缩张力的变化。
1.4.2 牛蛙离体坐骨神经干传导速度的测定
用双毁髓法处死牛蛙,让后肢肌肉完全松弛,剪开蛙肚皮,将从上往下数第3节脊柱两侧的所有内脏、头、胸部剪除,保留后肢、骶脊柱和脊柱两侧坐骨神经。用玻璃针和眼科剪小心剥离神经,眼科剪勿触碰神经,剥离时避免拉扯神经,尽量避免神经损伤。神经由脊椎处的主干到下腓总神经与胫神经一直分离到踝关节附近。剥离过程保持标本活性良好,时常用任氏液润湿。剥离的神经用细线结扎两端,放入盛有任氏液的培养皿浸泡10 min,用镊子夹住神经上的细线,用滤纸片吸取神经上多余的任氏液,减小干扰,放入清洁干燥的屏蔽盒中,使坐骨神经干与银电极接触良好,将中枢端连接刺激电极,外周端连接引导电极,并按相应连接刺激输出线和信号输入线。在确定标本活性后,刺激神经中枢端,由外周端导出动作电位波形,计算其传导速度,作为对照。将上述神经干分别浸泡在0.01、0.10、1.00、10.00和100.00 mg·L-1的CuSO4溶液中10 min,然后刺激神经干,导出各浓度下的动作电位波形,记录数据,计算出动作电位传导速度。
1.5 数据处理
实验数据采用SPSS统计软件进行统计学分析并使用t检验法对所获得的数据进行差异显著性分析。通过BL-410生物机能实验系统获得牛蛙离体蛙心搏动振幅加速度(g)和蛙心心跳频率(次·min-1),动作电位传导速度的测定方法为测量神经干接受刺激到冲动产生所需的时间(t)和两引导点之间的距离(S),根据公式:动作电位传导速度=S/t,计算动作电位传导速度(m·s-1)。
2 结果(Results)
2.1 不同浓度CuSO4对牛蛙离体蛙心搏动的影响
由表1和图1可知,使用CuSO4处理过的蛙心搏动振幅加速度为(0.86±0.092) g~(0.32±0.051) g,均小于对照组的(1.16±0.038) g且差异显著(P<0.01)。随着CuSO4溶液浓度的不断升高,对离体蛙心搏动振幅加速度的抑制程度逐渐加强,蛙心搏动幅度逐渐减弱;CuSO4浓度为100 mg·L-1时,蛙心搏动幅度最弱,为(0.32±0.051) g,相比对照组的(1.16±0.038) g降低了72%,差异显著(P<0.01)。
2.2 不同浓度CuSO4对牛蛙离体蛙心心率的影响
由表1、图1和图2可知,当使用低浓度的CuSO4溶液处理离体蛙心时,其心跳频率出现了明显的增加(P<0.01),当CuSO4的浓度增加到1.0 mg·L-1时,牛蛙蛙心的心跳频率达到最大值,为(109.73±13.54) 次·min-1,此时再增大CuSO4的浓度,心跳频率逐渐下降至(79.02±5.28) 次·min-1~(86.30±7.03) 次·min-1,但仍然显著高于对照组的(66.38±2.46) 次·min-1 (P<0.01)。
表1 不同浓度的CuSO4对牛蛙离体蛙心搏动、心率及坐骨神经干传导速度的影响
Table 1 Effect of CuSO4 on the pulsation, heart rate and the conduction velocity of isolated frog heart with different concentrations

CuSO4浓度/(mg·L-1)Concentration of CuSO4/(mg·L-1)00.010.11.010.0100.0心博振幅加速度/gAmplitude of heart pulsation/g1.16±0.0380.86±0.092*0.77±0.076*0.66±0.061*0.62±0.035*0.32±0.051*心率/(次·min-1)Rate of heart attack/(order·min-1)66.38±2.4673.32±6.6578.92±4.99*109.73±13.54*86.30±7.03*79.02±5.28*动作电位传导速度/(m·s-1)Conduction velocity of sciatic nerve trunk/(m·s-1)5.84±0.107.56±1.294.28±0.363.13±0.633.20±0.97
注:*与对照组相比,差异显著性P<0.01。
Note: *compared with the control group, the difference was significant (P<0.01).
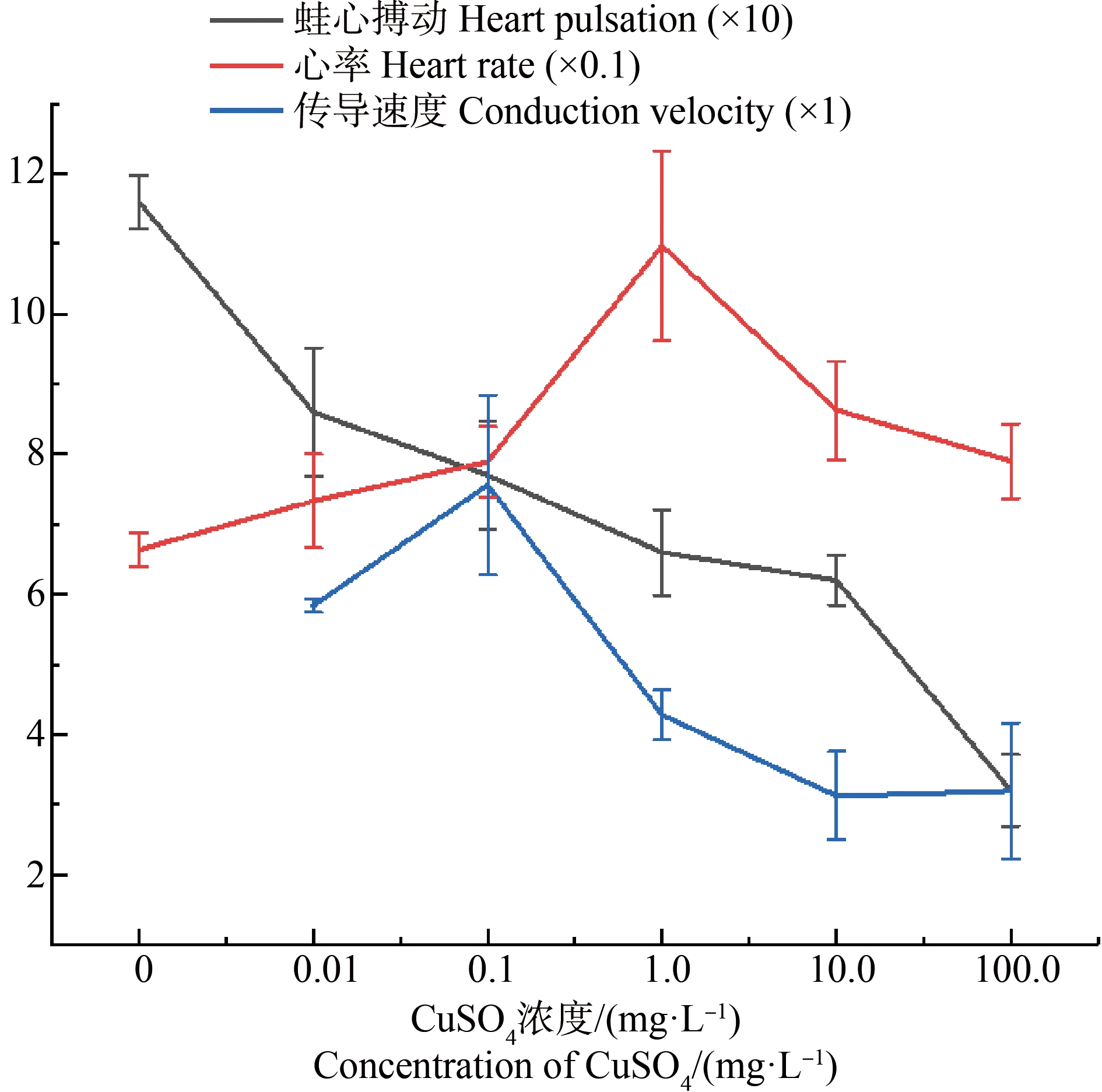
图1 CuSO4对牛蛙离体蛙心搏动、心率及坐骨神经
干传导速度的影响
注:黑色线条为蛙心搏动振幅×10(g);红色线条为心跳频率×0.1(次·min-1);蓝色线条为坐骨神经干传导速度×1(m·s-1)。
Fig. 1 Effect of CuSO4 on the heart pulsation, heart rate and the conduction velocity of isolated frog heart
Note: Black line is the amplitude of heart pulsation ×10(g); red line is the rate of heart attack ×0.1(order·min-1); blue line is the conduction velocity of sciatic nerve trunk ×1(m·s-1).
2.3 不同浓度CuSO4对牛蛙坐骨神经干传导速度的影响
由表1和图1可知,低浓度的CuSO4对于牛蛙坐骨神经干动作电位传导速度有促进作用,当CuSO4浓度为0.1 mg·L-1时动作电位传导速度存在最大值,为(7.56±1.29) m·s-1,当CuSO4的浓度继续增加后发现传导速度呈现出下降的趋势,当浓度为10.0 mg·L-1及以上时逐渐稳定至(3.13±0.63) m·s-1~(3.20±0.97) m·s-1。
3 讨论(Discussion)
当水体环境中的重金属含量超过一定标准时会对水生动物的生存与繁殖产生显著的影响,两栖动物因其特殊的皮肤呼吸的生理特性,对环境中的重金属离子的含量变化十分敏感。在本研究中发现牛蛙离体蛙心对Cu2+十分敏感,随CuSO4浓度的升高,蛙心收缩张力显著下降,而心率明显呈现出先升后降的趋势,但整体均高于对照组。在低浓度条件下,蛙心出现的心率升高现象可能是由于程度较低的重金属胁迫会激发生物的自我调节能力,从而产生了“毒物兴奋效应”,在高浓度的重金属胁迫下则可能会因心率过高而诱发心率衰竭而导致生物死亡[18]。心率主要是由心肌自律细胞膜电位去极化和复极化的速度共同决定,而心脏的收缩是由Ca2+介导的兴奋-收缩耦联完成的,实验中Cu2+通过竞争性地阻断Ca2+由细胞外向膜内的内流,从而抑制了蛙心心搏幅度[19]。由于影响牛蛙心率和心搏幅度的机制具有明显差异,故而不同浓度CuSO4的处理对离体蛙心的心率和收缩幅度的影响并不同步呈现。
动作电位的形成主要依赖Na+-K+-ATPase完成细胞膜两侧的K+和Na+的转运形成可以传播的电位波动,众多研究表明水生动物的Na+-K+-ATPase泵对于重金属的污染十分敏感,重金属离子会影响ATP酶的活性,进而抑制动作电位的形成[20-21]。在本研究中发现,在低浓度的CuSO4环境中,牛蛙坐骨神经干动作电位的传导速度存在小幅的上升,这一结果与邱吉和贾秀英[7]的研究结果一致,Dhavale等[22]对青蟹(Scylla serrata)的研究结果也出现了类似的现象,即生物通过自我调节作用产生的兴奋反应;当溶液中Cu2+浓度增大后,其动作电位传导速度急剧下降直至趋于稳定,Cu2+影响了细胞膜内外电位差的变化导致传导速度下降,当大量Cu2+进入时牛蛙坐骨神经干已经失去生理活性,但仍旧保持较低水平的动作电位传导,这与赵录英等[23]关于Mn2+对蛙心心缩能力的影响的研究结果一致。研究表明,重金属离子对于神经系统的毒性作用是一个缓慢的过程[24],相较于对心脏的损伤作用需要更长的时间,在本研究中,Cu2+对神经传导速度的影响并不仅仅是直接对神经细胞造成的损伤,有可能与神经细胞表面蛋白相互作用或影响自由基的形成而间接对神经细胞造成伤害。由于这种间接损伤需要一定时间和强度的累积作用,本研究亦将在后期对此作用进行慢性毒理作用探讨,以对本研究的结果进行进一步的补充。
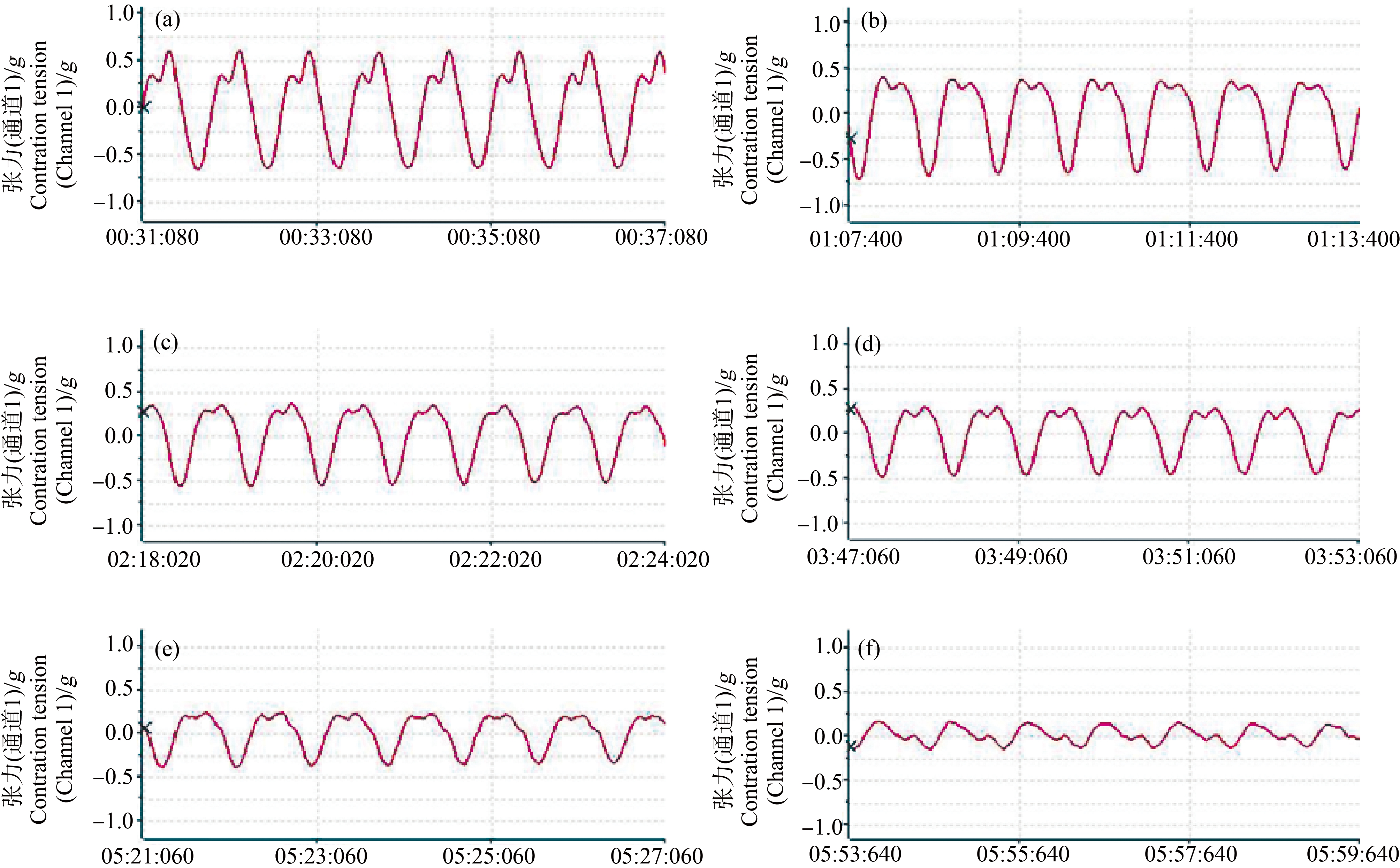
图2 不同浓度的CuSO4灌流后蛙心心缩曲线
注:(a) 0 mg·L-1;(b) 0.01 mg·L-1;(c) 0.10 mg·L-1;(d) 1.00 mg·L-1;(e) 10.0 mg·L-1;(f) 100 mg·L-1。
Fig. 2 The curve of frog heart contraction after CuSO4 perfusion at different concentrations
Note: (a) 0 mg·L-1; (b) 0.01 mg·L-1; (c) 0.10 mg·L-1; (d) 1.00 mg·L-1; (e) 10.0 mg·L-1; (f) 100 mg·L-1.
综上,本实验从离体蛙心搏动幅度、心跳频率以及动作电位传导速度的角度探讨了CuSO4对美国牛蛙的毒性作用,结果显示牛蛙对环境中的Cu2+十分敏感,整体表现为受到抑制,各种生理特性在不同浓度的CuSO4溶液中均有明显的变化。在实际生产活动中,大量未经处理的含铜工业废水的滥排将会严重威胁到蛙蟾类的生存状况,基于本研究的实验结果可以为工厂排放工业废水标准的制定提供理论参考。
[1] 江建平, 谢锋, 臧春鑫, 等. 中国两栖动物受威胁现状评估[J]. 生物多样性, 2016, 24(5): 588-597
Jiang J P, Xie F, Zang C X, et al. Assessing the threat status of amphibians in China [J]. Biodiversity Science, 2016, 24(5): 588-597 (in Chinese)
[2] 赵红霞, 周萌, 詹勇, 等. 重金属对水生动物毒性的研究进展[J]. 中国兽医杂志, 2004, 40(4): 39-41
[3] 周虹, 路爱平, 黄来旺, 等. 重金属污染对蛙蟾类毒性的研究进展[J]. 四川动物, 2009, 28(5): 785-793
Zhou H, Lu A P, Huang L W, et al. A review on the toxicity of heavy metal pollution to Anura [J]. Sichuan Journal of Zoology, 2009, 28(5): 785-793 (in Chinese)
[4] 黄德军, 张迎梅, 赵东芹, 等. 重金属镉对花背蟾蜍蝌蚪生长发育的影响[J]. 兰州大学学报, 2004, 40(2): 81-83
Huang D J, Zhang Y M, Zhao D Q, et al. Effect of cadmium on the development of tadpoles of the Bufo raddei [J]. Journal of Lanzhou University, 2004, 40(2): 81-83 (in Chinese)
[5] 汪学英, 卢祥云, 李春梅, 等. 重金属离子对黑斑蛙胚胎及蝌蚪的毒性影响[J]. 四川动物, 2001, 20(2): 59-61
Wang X Y, Lu X Y, Li C M, et al. Toxicity of heavy metal irons to embryos and larvae of Rana nigromaculata [J]. Sichuan Journal of Zoology, 2001, 20(2): 59-61 (in Chinese)
[6] 蔡玲玲, 汪美贞, 贾秀英. Cu2+ Cd2+及其复合污染对中华大蟾蜍蝌蚪DNA的影响[J]. 农业环境科学学报, 2007, 26(4): 1361-1364
Cai L L, Wang M Z, Jia X Y. Impact of Cu2+, Cd2+ single and combined pollution on DNA of Bufo gargarizans tadpoles [J]. Journal of Agro-Environment Science, 2007, 26(4): 1361-1364 (in Chinese)
[7] 邱吉, 贾秀英. 铜、镉及其复合作用下中华大蟾蜍蝌蚪Na+-K+-ATPase酶的变化[J]. 动物学杂志, 2007, 42(2): 102-106
Qiu J, Jia X Y. Response of the Na+-K+-ATPase activity of Bufo gargarizans tadpole to Cu2+, Cd2+ single and combined pollution exposure [J]. Chinese Journal of Zoology, 2007, 42(2): 102-106 (in Chinese)
[8] 李红敬, 李晓杰, 王雅平, 等. Hg2+、Pb2+对牛蛙坐骨神经干动作电位阈值及传导速度的影响[J]. 湖北农业科学, 2016, 55(20): 5316-5319
Li H J, Li X J, Wang Y P, et al. Effect of Hg2+, Pb2+ on action potential threshold and conduction velocity of bullfrog sciatic nerve-trunk [J]. Hubei Agricultural Sciences, 2016, 55(20): 5316-5319 (in Chinese)
[9] 冯磊. 重金属富集及对花背蟾蜍跳跃能力的影响[D]. 兰州: 兰州大学, 2012: 23-28
Feng L. The bioaccumulation and the effect of heavy metals on the jumping performance of Bufo [D]. Lanzhou: Lanzhou University, 2012: 23-28 (in Chinese)
[10] 国家环境保护总局. 污水综合排放标准: GB 8978—1996[S]. 北京: 中国标准出版社, 1998
[11] 国家环境保护总局, 国家质量监督检验检疫总局. 地表水环境质量标准: GB 3838—2002[S]. 北京: 中国环境科学出版社, 2002
[12] 王爱民. 四种重金属对绿蟾蜍蝌蚪的急性毒性研究[J]. 新疆大学学报(自然科学版), 1990, 7(1): 60-64
Wang A M. Acute toxicity of 4 heavy metals on the tadpoles of Rufo viridis laurenti [J]. Journal of Xinjiang University (Natural Science Edition), 1990, 7(1): 60-64 (in Chinese)
[13] 卢祥云, 张燕萍, 吴海东, 等. 汞离子和铜离子对中华大蟾蜍蝌蚪联合毒性研究[J]. 四川动物, 2006, 25(2): 379-381
Lu X Y, Zhang Y P, Wu H D, et al. Study on joint toxicity of mercury ion and copper ion to Bufo gargarizans tadpole [J]. Sichuan Journal of Zoology, 2006, 25(2): 379-381 (in Chinese)
[14] Khangarot B S, Ray P K. Sensitivity of toad tadpoles, Bufo melanostictus (Schneider), to heavy metals [J].Bulletin of Environmental Contamination and Toxicology, 1987, 38(3): 523-527
[15] 何米雪, 陈沃洪, 刘木养, 等. 几种化学物质对蟾蜍蝌蚪生存及生长发育的影响[J]. 生命科学研究, 2006, 10(2): 156-161
He M X, Chen W H, Liu M Y, et al. Effect of several chemicals on survival and growth of tadpole of toad (Bufo melanostictus Schneider)[J]. Life Science Research, 2006, 10(2): 156-161 (in Chinese)
[16] 马丽, 吴民耀, 王宏元. 7种金属离子对中国林蛙和中华大蟾蜍蝌蚪的急性毒性比较研究[J]. 生态毒理学报, 2015, 10(3): 230-237
Ma L, Wu M Y, Wang H Y. Comparison study on the acute toxicity of 7 metal ions on the Rana chensinensis and Bufo gargarizans tadpoles [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 230-237 (in Chinese)
[17] 贾秀英, 董爱华, 杨亚琴. 铜、锌和三唑磷对泽蛙蝌蚪的毒性研究[J]. 环境科学研究, 2005, 18(5): 26-29, 48
Jia X Y, Dong A H, Yang Y Q. Acute and joint toxicities of copper, zinc and triazophos to Rana limnocharis Boie tadpole [J]. Research of Environmental Sciences, 2005, 18(5): 26-29, 48 (in Chinese)
[18] Stebbing A R D. Hormesis—The stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(3): 213-234
[19] 吕良矩, 赵扬, 王重刚. 4种重金属离子对离体蛙心搏动的影响[J]. 厦门大学学报(自然科学版), 2004, 43(S1): 136-138
Lv L J, Zhao Y, Wang C G. Effects of four heavy metal ions on pulsation of isolated frog heart [J]. Journal of Xiamen University (Natural Science), 2004, 43(S1): 136-138 (in Chinese)
[20] Pinkney A E, Wright D A, Jepson M A, et al. Effects of tributyltin compounds on ionic regulation and gill ATPase activity in estuarine fish [J]. Comparative Biochemistry and Physiology C, Comparative Pharmacology and Toxicology, 1989, 92(1): 125-129
[21] Morgan I J, Henry R P, Wood C M. The mechanism of acute silver nitrate toxicity in freshwater rainbow trout (Oncorhynchus mykiss) is inhibition of gill Na+ and Cl- transport [J]. Aquatic Toxicology, 1997, 38(1-3): 145-163
[22] Dhavale D M, Masurekar V B, Giridhar B A. Cadmium induced inhibition of Na+/K+ ATPase activity in tissues of crab Scylla serrata (Forskal) [J].Bulletin of Environmental Contamination and Toxicology, 1988, 40(5): 759-763
[23] 赵录英, 陈建鸣, 支建明. Mn2+对离体蛙心收缩功能的影响[J]. 山西医科大学学报, 2002, 33(1): 81
[24] 高波, 李河, 鲜思萍, 等. 重金属Pb2+对牛蛙生理活性的影响[J]. 西南农业学报, 2015, 28(4): 1834-1839
Gao B, Li H, Xian S P, et al. Effect of heavy metal Pb2+ on physiological activity of Rana catesbiana [J]. Southwest China Journal of Agricultural Sciences, 2015, 28(4): 1834-1839 (in Chinese)