氟是机体骨骼和牙齿生长发育必需的微量元素,适量的氟有积极作用,但过量的氟在体内蓄积会对机体各系统(消化系统、神经系统、泌尿系统、心血管系统、内分泌系统和生殖系统等)产生消极作用[1-6]。食物是机体氟暴露的主要途径之一。高氟环境会导致农产品中氟含量明显增高[7-8],如在稻米,油菜籽、蔬菜和海鲜[9-11]等食物中都检测出了较高的氟含量。除了自然环境因素,人为因素也是导致某些特殊区域或农产品高氟的原因。有研究表明,一些工业生产(如铝、砖、钢、玻璃和化肥制造)过程中会向周围环境释放氟化物,造成区域性氟污染和农产品氟超富集现象[12-17];本课题组在前期研究中也发现,贵阳市白云区废旧铝厂周围土壤氟含量显著高于其他采样点,在所采集的蔬菜样品中,89.26%的农产品氟化物含量超过了我国《食品中污染物限量》(GB 2762—2005)[18]的最高水平(1 mg·kg-1)。
食物中氟的含量可为评估这种微量元素的健康风险提供基础数据。然而,人们所摄入食物中的氟仅部分被人体所利用,因此将食物中氟含量相当于机体摄入量的评价,显然会高估氟化物的人体健康风险[19-20]。生物可给性的提出为更科学地评价食物中氟暴露的健康风险提供了依据,而体外模拟消化实验(in vitro)为生物可给性的获得提供了有效途径。近年来,体外实验设计方案的迅速发展,也使生物可给性(bioaccessibility, BA)的研究得到广泛关注[21]。生物可给性是指食物进入消化系统后,食物中污染物或营养物质在胃肠道溶解的量占污染物或营养物质总量的比例,反映的是人体对污染物或营养物质可能的最大吸收量[22-23]。
氟的生物可给性受食物种类或食物成分的影响。如Rocha等[24]研究了海鲜产品中氟的生物可给性:胃阶段沙丁鱼(25%)生物可给性远小于凤尾虾(94%);并且来源于其他食物的阳离子(Ca2+、Mg2+、Fe3+和Al3+)与海鲜产品同时进入肠消化时,阳离子的存在会影响海鲜氟的生物可给性。辣椒是世界各地最受欢迎的蔬菜之一,其带来的辛辣刺激感而让人欲罢不能;而辣椒素是辣椒的奥妙所在,是辣椒果实中主要的辛辣成分,辣椒素占辣椒素类物质总含量的69%。在我国,特别四川、贵州、重庆和湖南等地,辣椒是家庭食品烹调中不可或缺的调味品。蔬菜常与辣椒搭配同时被食用,如麻辣火锅中的蔬菜、清汤火锅蔬菜配辣椒蘸水、辣椒炒蔬菜等等。那么辣椒素是否会对氟的生物可给性产生影响,这是一个值得关注的问题。因此结合饮食习惯及膳食成分,探究食物成分辣椒素存在的情况下,蔬菜中氟生物可给性及变化,能够进一步丰富与膳食因素相结合的生物可给性研究,并提供更好的饮食建议;也能为氟的人体健康风险评价提供更为科学的理论依据。
1 材料与方法(Materials and methods)
1.1 蔬菜样品
蔬菜样品采自贵州白云区某废弃铝厂周边的农田,用自来水清洗干净,去离子水清洗3遍,烘干,磨碎后过40目筛,每种蔬菜分3份装于密封袋,-20 ℃保存。另有1个芹菜标准物质(GBWl0048(GSB-6))作为本试验的标准样品,用于保证方法的准确性。3份蔬菜样品分别用于测定蔬菜样品中氟含量、体外胃肠模拟消化蔬菜中氟的生物可给性实验、加入辣椒素体外胃肠模拟消化蔬菜中氟的生物可给性实验。
1.2 氟的测定
蔬菜样品中的氟根据国家标准《食品中氟的测定》(GB/T 5009.18—2003)[25]测定。对每个分析样品进行3次酸提取。标准物质的回收率为89%~118%。
1.3 体外胃肠模拟实验
实验中所用到的化学物质,除特别说明,均来自Sigma-Aldrich公司,为分析纯。本研究采用Ruby等提出的生理原理消化法(PBET),并参考其他研究者的体外(in vitro)消化法[26-28]进行改进,具体操作步骤如下。
胃阶段:称取0.5 g蔬菜样品于50 mL离心管中,加入5 mL模拟胃液(1.25 g·L-1胃蛋白酶、0.5 g·L-1苹果酸钠、0.5 g·L-1柠檬酸钠、420 μL·L-1乳酸、500 μL·L-1醋酸,20%盐酸调pH至2.5),将该混合液置于37 ℃恒温水浴箱(WYC-4030F型,喆图,中国上海)中震荡2 h(100 r·min-1)。每个样本做1个平行,每次试验添加2个空白。
肠阶段:待胃阶段消化结束后,向离心管中加入5 mL模拟肠液(0.5 g·L-1胰酶、1.75 g·L-1胆盐),混合后用饱和NaHCO3调节pH至7.0,将该混合液置于37 ℃恒温水浴箱中震荡4 h(100 r·min-1)。胃、肠消化结束后,用氟离子选择电极(perfectIONTM,Mettler Toledo,瑞士)进行氟测定。胃、肠阶段生物可给性的计算公式如下[24]:
生物可给性![]()
1.4 消化液中蔬菜氟的测定
称样品于50 mL离心管中,如1.3所述,待消化结束后,胃、肠阶段分别加入25 mL总离子缓冲调节剂(上海雷磁),加一级水(ATSgenc1810Apro,重庆安特生纯水机)使总体积为50 mL。采用氟离子电极(perfectIONTM,Mettler Toledo,瑞士)进行3次测定。
1.5 辣椒素处理组消化液蔬菜中氟的测定
称样品于50 mL离心管中,使消化液中辣椒素(纯度98%,北京索莱宝)浓度分别为90、140和210 mg·L-1,如1.3所述,待消化结束后,胃、肠阶段分别加入25 mL总离子缓冲调节剂,加一级水使总体积为50 mL。采用氟离子电极进行3次测定。
1.6 消化液pH的测定
称样品于50 mL离心管中,如1.3所述,胃消化结束后,采用数显pH计(PHS-25型,雷磁,中国上海)进行pH测定。
1.7 消化液中Ca2+、Mg2+的测定
如1.3所述,待消化结束后,将离心管取出,离心后,取上清用于测定Ca2+、Mg2+。采用连续光源火焰-石墨炉原子吸收光谱仪(Contraa700,耶拿,德国)进行测定。
1.8 统计分析
采用Excel 2010、Origin 2018和SPSS 25.0软件对数据进行整理、作图和统计分析。采用随机区组设计方差分析和配对t检验分析显著性,当P<0.05,则认为具有显著性。
2 结果(Results)
2.1 蔬菜样品中氟的含量
由表1所示,分析所用蔬菜样品中氟含量均值均高于《食品中污染物限量》(GB 2762—2005) (1.0 mg·kg-1)[18]。本研究所分析的蔬菜样品氟浓度为1.25~3.50 mg·kg-1。
表1 蔬菜样品中氟的浓度
Table 1 Concentration of fluorine in vegetable samples
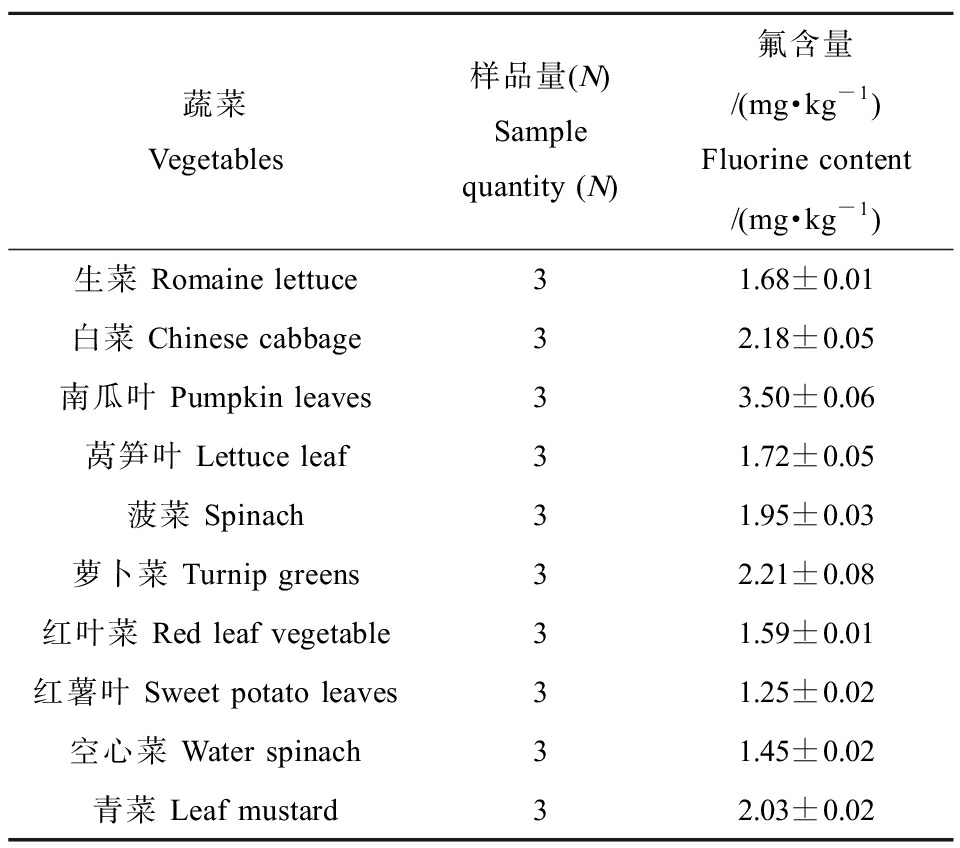
蔬菜Vegetables样品量(N)Sample quantity (N)氟含量/(mg·kg-1)Fluorine content/(mg·kg-1)生菜 Romaine lettuce31.68±0.01白菜 Chinese cabbage32.18±0.05南瓜叶 Pumpkin leaves33.50±0.06莴笋叶 Lettuce leaf31.72±0.05菠菜 Spinach31.95±0.03萝卜菜 Turnip greens32.21±0.08红叶菜 Red leaf vegetable31.59±0.01红薯叶 Sweet potato leaves31.25±0.02空心菜 Water spinach31.45±0.02青菜 Leaf mustard32.03±0.02
2.2 胃、肠消化阶段蔬菜中氟的生物可给性
蔬菜样品中,胃阶段蔬菜中氟的生物可给性从红薯叶26%到菠菜82%不等。相对于胃阶段,肠阶段蔬菜中氟的生物可给性显著降低(平均降低(20±9)%),蔬菜中氟生物可给性降低至空心菜的2%到菠菜的59%(图1)。探究胃阶段、肠阶段蔬菜中氟的生物可给性,可确定蔬菜中氟消化溶解发生的主要阶段。结果表明,不同蔬菜中氟在胃、肠消化阶段的溶解程度不同;胃阶段蔬菜中氟的生物可给性大于肠阶段,差异具有统计学意义(P<0.05)。
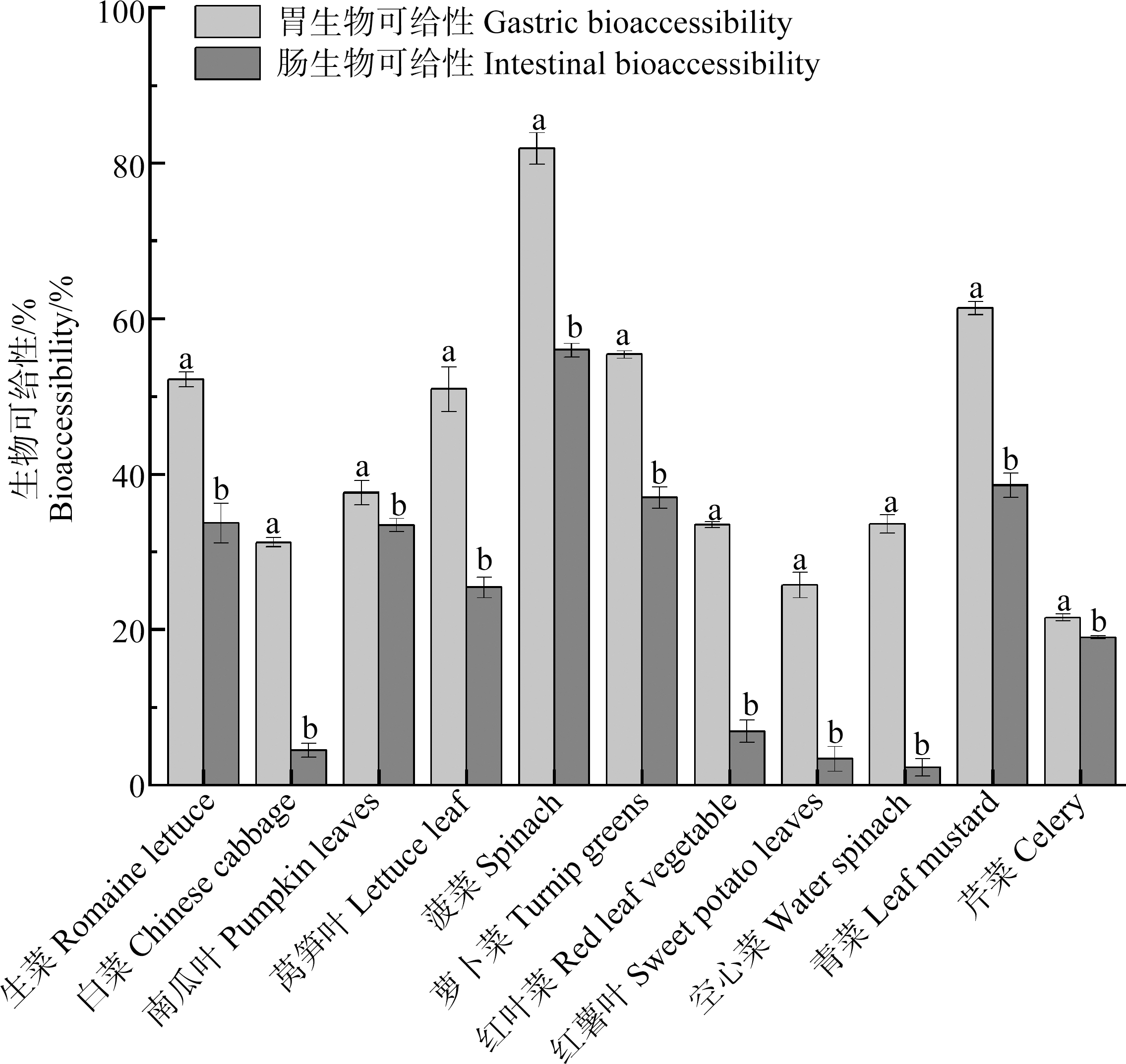
图1 不同蔬菜中氟的生物可给性
Fig. 1 Bioaccessibility of fluorine in different vegetables
2.3 胃、肠阶段辣椒素对蔬菜中氟生物可给性的影响
结果表明(图2),胃阶段各辣椒素处理组(90、140和210 mg·L-1)中,只有210 mg·L-1处理组蔬菜中氟的生物可给性与对照组相比具有统计学差异,并明显大于对照组(P<0.05)。而肠阶段各辣椒素处理组与对照组相比,蔬菜中氟的生物可给性并没有明显差异(P>0.05)。胃阶段,210 mg·L-1辣椒素处理组蔬菜中氟的生物可给性显著升高,平均升高(20±10)%,升高幅度介于38%(空心菜)至93%(生菜)之间。

图2 辣椒素各剂量组蔬菜中氟的生物可给性
注:(a)胃阶段;(b)肠阶段;*表示P<0.05,差异显著。
Fig. 2 Bioaccessibility of fluoride in vegetables at different doses of capsaicin
Note: (a) Gastric stage; (b) Intestinal stage; * means significant difference at P<0.05.
2.4 胃阶段辣椒素(210 mg·L-1)对消化液pH的影响
食物在进入胃肠消化以后,其消化液的pH会有所差异,这主要取决于食物和机体。食物成分会影响消化过程中消化液的pH,从而导致氟生物可给性的差异(图3)。结果表明,在胃消化阶段,辣椒素改变了消化液的pH;变化范围介于白菜(0.13)和红叶菜(1.06)之间,平均变化0.31±0.28;除空白以外,与对照组相比,辣椒素处理组的消化液pH降低(P=0.005<0.05)(图4)。
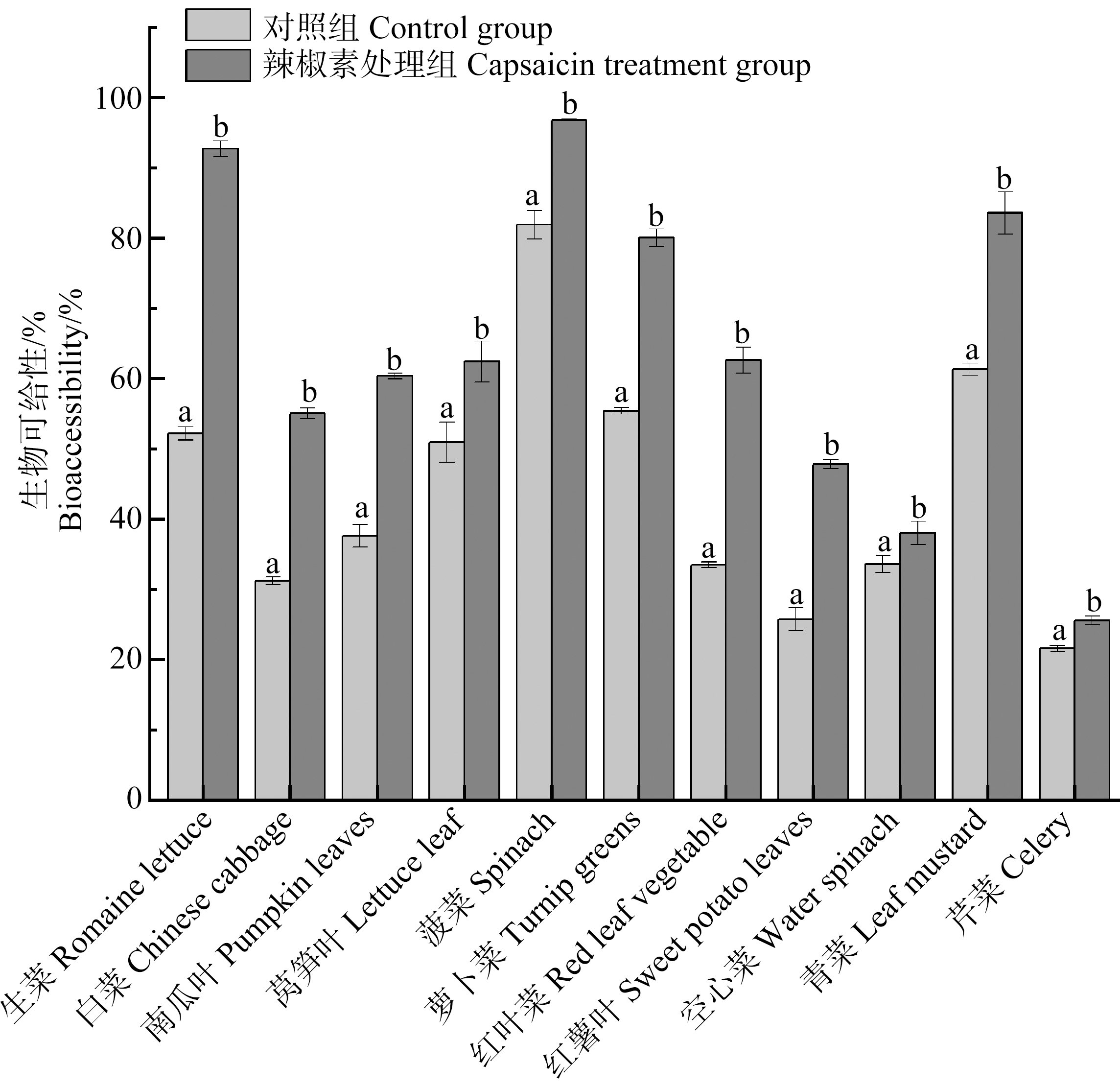
图3 胃阶段对照组和辣椒素处理组不同蔬菜中氟的生物可给性
注:不同字母表示对照组和辣椒素处理组的生物可给性之间存在显著差异(P<0.05)。
Fig. 3 Bioaccessibility of fluoride in different vegetables of control group and capsaicin group at gastric stage
Note: Different letters indicate that there is a significant difference in bioaccessibility between the control group and capsaicin treated group (P<0.05).
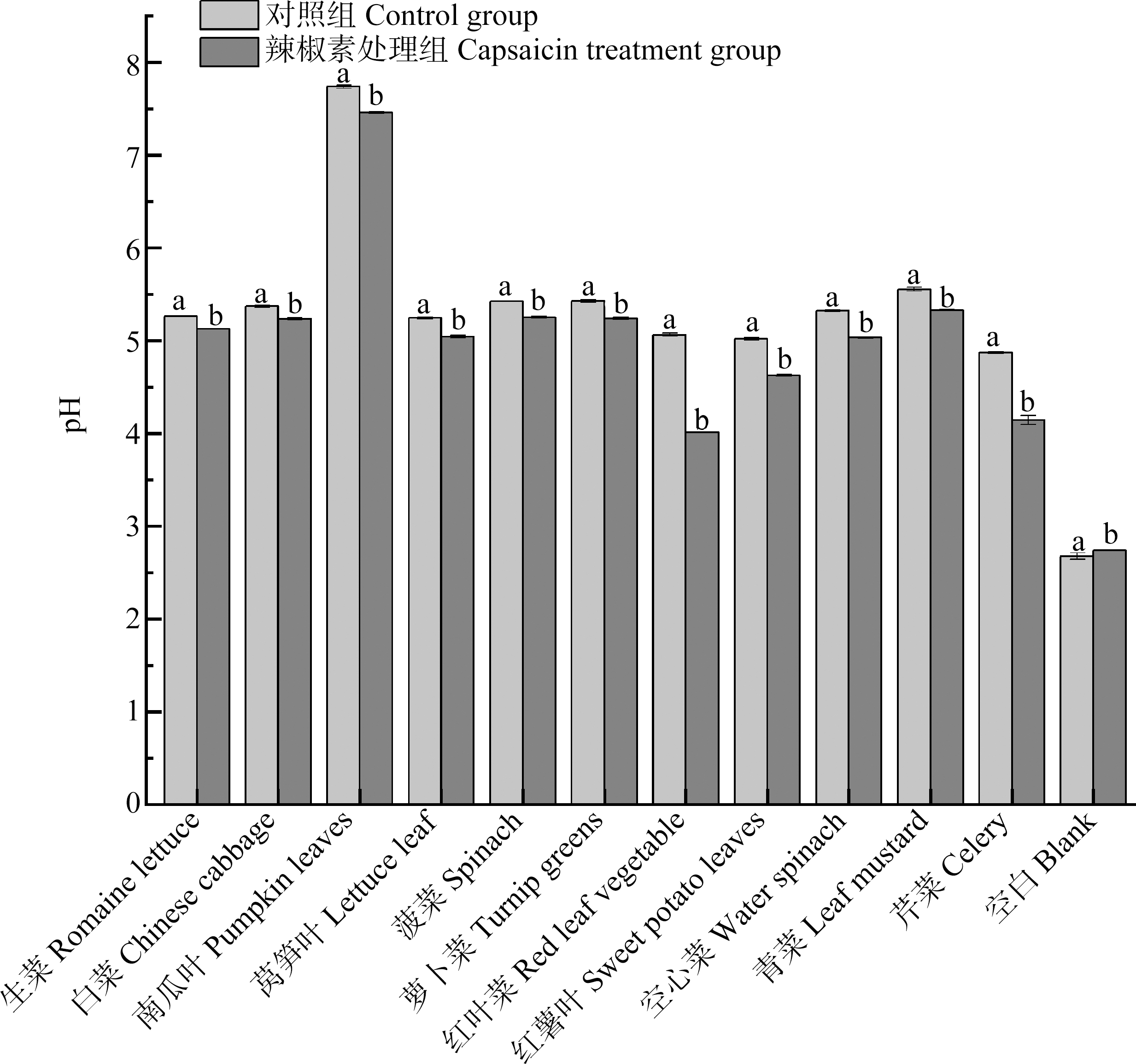
图4 胃阶段对照组与辣椒素处理消化液pH
注:不同字母表示对照组和辣椒素处理组的pH值存在显著差异(P<0.05)。
Fig. 4 pH value of control group and capsaicin treated digestive juice at gastric phase
Note: The different letters indicate that there is a significant difference in pH between the control group and capsaicin treated group (P<0.05).
2.5 胃阶段辣椒素(210 mg·L-1)对消化液中Ca2+、Mg2+含量的影响
氟能与Ca2+、Mg2+等阳离子形成不溶性的盐。因此,蔬菜中Ca2+、Mg2+等阳离子的存在及含量可能会影响蔬菜中氟胃阶段的溶解程度(即生物可给性)。通过测定胃阶段消化液中氟、Ca2+、Mg2+的含量,以探寻Ca2+、Mg2+与氟之间的相关关系,以获知辣椒素是否影响氟与Ca2+、Mg2+的结合,从而影响蔬菜中氟的生物可给性。结果表明,在胃消化阶段,氟的溶解量和Ca2+、Mg2+无相关关系(图5)。但是,辣椒素处理组与对照组相比,Ca2+离子的溶出量降低,而Mg2+的溶出量升高(P<0.05)(图6)。
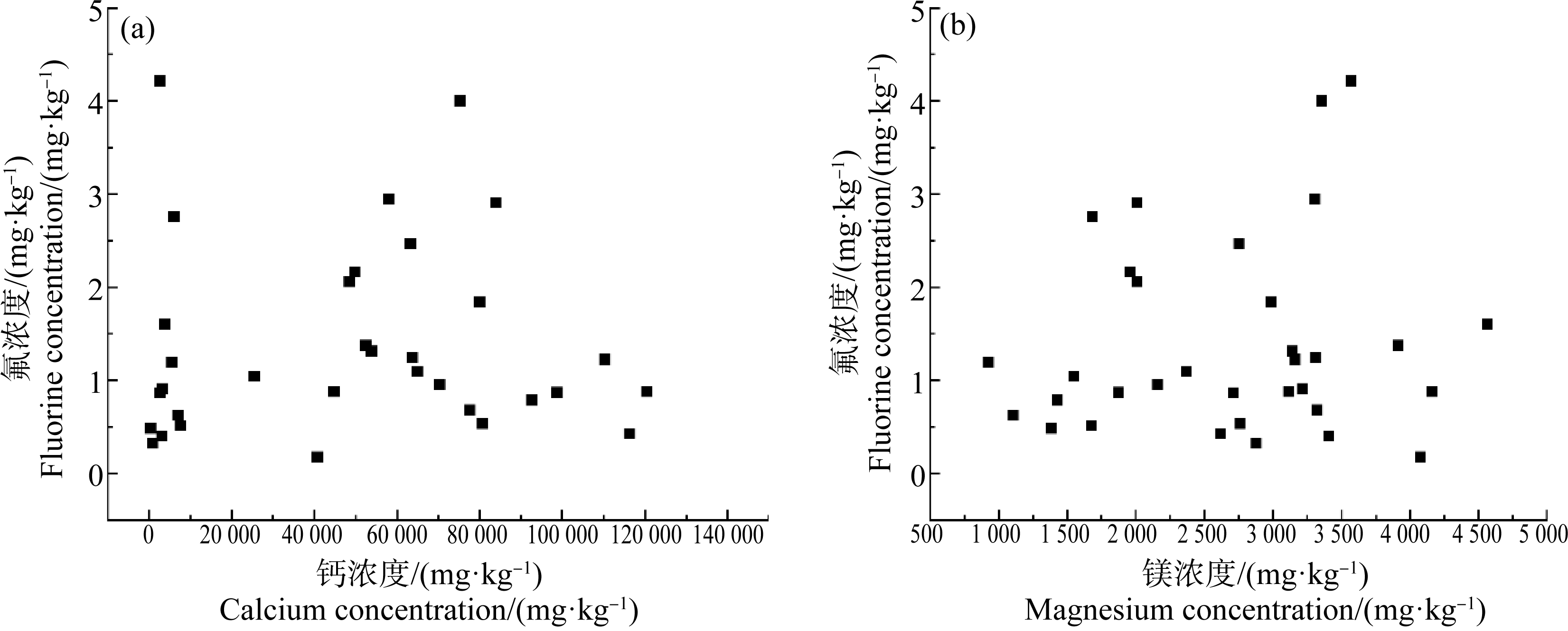
图5 胃阶段蔬菜中氟与钙、镁的散点图
Fig. 5 Scatter diagram of between vegetable fluorine and calcium/magnesium at gastric stage
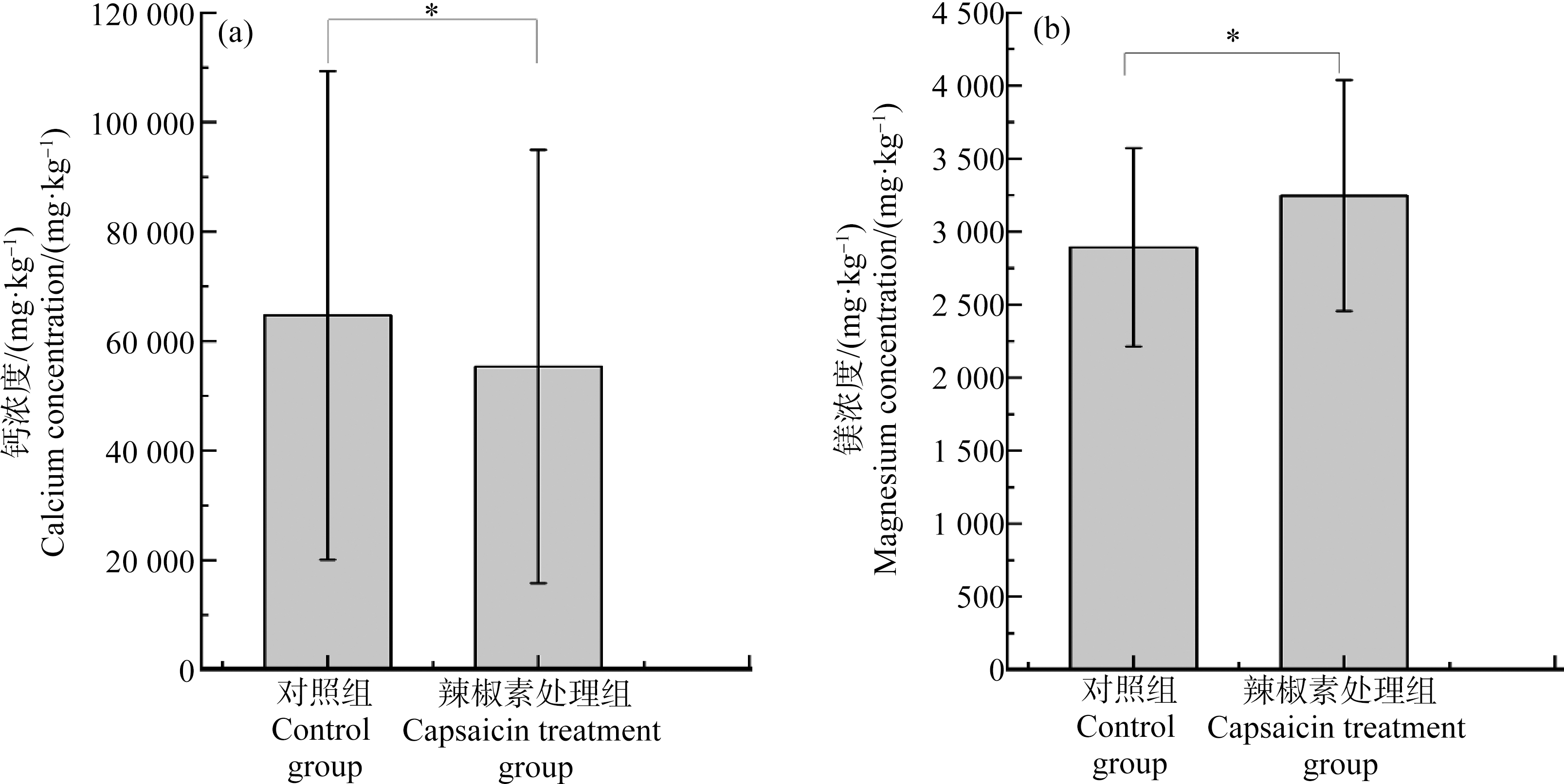
图6 胃阶段对照组与辣椒素处理组蔬菜中钙、镁浓度
注:*表示P<0.05,差异显著。
Fig. 6 Concentration of calcium and magnesium in vegetables of control group and capsaicin treatment group at gastric stage
Note: *means significant difference at P<0.05.
3 讨论(Discussion)
食物中营养物质或污染物进入机体消化系统后,并不能完全被人体所吸收,这主要取决于食物在消化液中的溶解量以及通过小肠壁而达到机体内循环的量,即生物可给性和生物有效性。本文研究了蔬菜中氟的生物可给性,选用蔬菜样品中氟含量的范围为1.25~3.50 mg·kg-1。蔬菜中氟经口摄入后,先进入胃,在胃大量溶出,成为生物可利用的离子状态。此时溶出的氟以pH依赖的方式被吸收,但并未完全被胃所吸收,剩余的(约占总氟的70%~75%)在小肠中被吸收[29]。经胃消化进入肠后,胃阶段溶出而未被胃吸收的游离态氟进入肠阶段,部分可能因pH改变而被转化为非可利用状态,从而导致肠阶段与胃阶段生物可给性存在差异。如本研究结果所示(图1),蔬菜中氟生物可给性肠阶段(23.64%)低于胃阶段(44.08%);其中空心菜、白菜和红叶菜生物可给性的变化水平较高,分别为31.31%、26.77%和26.59%,而南瓜叶、芹菜的变化较小,分别为4.13%、3.13%。这与尚德荣等[30]研究虾肉中氟的生物可给性肠阶段(18.87%)小于胃阶段(87.50%)的结果相符合。膳食组成或成分是影响生物可给性的重要因素,食物基质的不同,同一营养物质或污染物的生物可给性的差异较大;如小扁豆中铁生物可给性为(15.5±12)%,而白豆和鹰嘴豆中铁的生物可给性较高,分别为(51.8±3.8)%和(60.5±4.6)%[31]。一些体内研究也表明,氟的生物可给性受同时摄入的食物成分影响;例如,氟化钠与牛奶同时服用,人体内氟化钠的生物利用度会显著降低[32-34]。
辣椒是受世界人民广泛喜爱的蔬菜及调味品之一,被称为“无国界的蔬菜”。在中国,特别是四川、重庆、湖南和贵州等地更是“无辣不欢”;在燃煤型氟中毒地区,经烘干的辣椒中往往检测出较高含量的氟[35],从而导致辣椒成为燃煤型氟中毒病区主要携氟介质之一;辣椒素是辣椒中主要呈辛辣味的物质,被作为食品添加剂广泛使用;因此食物中氟的摄入可能同时伴有辣椒素的摄入。本研究添加的辣椒素剂量取决于可能与蔬菜一起食用的辣椒的量,根据辣椒每日推荐摄入量计算获得[36-37]。研究结果表明,在辣椒素存在的情况下,胃阶段蔬菜中氟的溶解量增加,平均增加(0.42±0.21) mg·kg-1,继而蔬菜中氟的生物可给性增加。在胃阶段pH较低时,氟以氢氟酸的形式存在;但在pH接近中性的肠阶段时,氟以游离离子形式存在;由于氟的高电负性,氟离子倾向于与大量元素反应形成络合物,其中一些具有低溶解性,如钙、镁和铝等;消化液pH值对氟的生物可给性影响较大。值得注意的是,苏昕峰[38]给大鼠灌喂辣椒素,发现辣椒素可使盲肠内容物pH值显著升高。因此,可以预期,辣椒素可能会使蔬菜在胃、肠消化阶段的pH发生变化,继而改变F-与Ca2+、Mg2+等阳离子的结合,从而影响氟的生物可给性。
蔬菜中氟的消化溶解主要是在胃阶段,辣椒素可使胃阶段氟的生物可给性增加,而肠阶段氟的生物可给性却无明显变化,可能是由于肠阶段消化液的pH值无明显变化。有研究显示,辣椒素会破坏肠道Caco-2细胞肠道屏障的功能,使肠道的通透性增加[39]。由此可以推测,辣椒素虽然对肠阶段蔬菜氟的生物可给性无影响,但有可能会影响肠道屏障的通透性,从而影响蔬菜氟的生物有效性。这将在接下来的实验中进行探索研究。因此本文分析辣椒素对氟化物生物可给性的影响,仅在胃阶段进行评估。胃阶段消化终止后,测定胃液的pH和其中Ca2+、Mg2+阳离子,统计分析胃阶段pH的变化及氟与Ca2+、Mg2+的关系(图4~图6)。研究结果支持了上述理论,辣椒素使胃消化液pH值降低;导致F-与Ca2+、Mg2+的游离或结合状态发生改变。但有趣的是,胃阶段氟溶出量与Ca2+、Mg2+溶出量并无相关关系;辣椒素处理组Ca2+溶解量大于对照组、Mg2+溶解量小于对照组。从表1和图5可知,同一样品的氟含量与Ca2+、Mg2+含量相比,含量很低;可以推测,Ca2+、Mg2+主要以少部分氟化物的形式存在,而其他存在形式占大部分;因此在分析胃阶段F-与Ca2+、Mg2+的溶出量相关关系时,未发现明显相关性。但是,辣椒素处理组消化液pH改变,Ca2+、Mg2+的溶出量也相应发生改变,这也间接说明F-与Ca2+、Mg2+的结合改变。机体胃肠消化是一个动态的过程,通过测定消化终止时的pH值,并不能真实反映摄入食物后体内pH值随消化时间的变化情况。Dressman等[40]观察到,健康成年人摄入食物后,pH值平均为5,最初胃pH值增加到6.7,维持5 min;摄入食物大约2 h后,酸性pH值重新建立。因此,辣椒素影响胃消化液的pH,可能导致氟与Ca2+、Mg2+的结合改变,从而影响蔬菜中氟的生物可给性;但在消化过程中,辣椒素如何影响胃液pH随时间变化的,还有待进一步研究。
[1] Sahu B L, Banjare G R, Ramteke S, et al. Fluoride contamination of groundwater and toxicities in Dongargaon Block, Chhattisgarh, India [J]. Exposure and Health, 2017, 9(2): 143-156
[2] Mullenix P J, Denbesten P K, Schunior A, et al. Neurotoxicity of sodium fluoride in rats [J]. Neurotoxicology and Teratology, 1995, 17(2): 169-177
[3] Dimcevici Poesina N, Bllu C, Nimigean V R, et al. Histopathological changes of renal tissue following sodium fluoride administration in two consecutive generations of mice. Correlation with the urinary elimination of fluoride [J]. Romanian Journal of Morphology and Embryology, 2014, 55(2): 343-349
[4] Adali M K, Varol E, Aksoy F, et al. Impaired heart rate recovery in patients with endemic fluorosis [J]. Biological Trace Element Research, 2013, 152(3): 310-315
[5] Hosur M B, Puranik R S, Vanaki S, et al. Study of thyroid hormones free triiodothyronine (FT3), free thyroxine (FT4) and thyroid stimulating hormone (TSH) in subjects with dental fluorosis [J]. European Journal of Dentistry, 2012, 6(2): 184-190
[6] Messer H H, Armstrong W D, Singer L. Influence of fluoride intake on reproduction in mice [J]. The Journal of Nutrition, 1973, 103(9): 1319-1326
[7] 周青龄, 兰德. 温泉型氟中毒地区环境本底高氟对农作物及人体健康的影响[J]. 南昌大学学报: 工科版, 2008, 30(3): 215-219
Zhou Q L, Lan D. Influence of high fluorine background on the crops and humans in hotspring-induced fluorosis areas [J]. Journal of Nanchang University: Engineering & Technology, 2008, 30(3): 215-219 (in Chinese)
[8] 蓝天水, 张亚平, 蓝永贵, 等. 高氟环境对农作物含氟量的影响[J]. 海峡预防医学杂志, 1996(1): 22-24
[9] 余悦虎, 陶建明, 潘金德, 等. 浙中氟石矿地区耕地土壤-农作物中氟含量分析研究[J]. 农学学报, 2013, 3(5): 22-25
Yu Y H, Tao J M, Pan J D, et al. An evaluation on total fluorine contents in surface soils and crops in fluorite mining area, central Zhejiang Province [J]. Journal of Agriculture, 2013, 3(5): 22-25 (in Chinese)
[10] He L L, Tu C L, He S Y, et al. Fluorine enrichment of vegetables and soil around an abandoned aluminium plant and its risk to human health [J]. Environmental Geochemistry and Health, 2021, 43(3): 1137-1154
[11] Chowdhury C, Khijmatgar S, Kumari D P, et al. Fluoride in fish flesh, fish bone and regular diet in south-coastal area of Karnataka state of India [J]. Indian Journal of Dental Research: Official Publication of Indian Society for Dental Research, 2018, 29(4): 414-417
[12] Cronin S J, Manoharan V, Hedley M J, et al. Fluoride: A review of its fate, bioavailability, and risks of fluorosis in grazed-pasture systems in New Zealand [J]. New Zealand Journal of Agricultural Research, 2000, 43(3): 295-321
[13] Pickering W F. The mobility of soluble fluoride in soils [J]. Environmental Pollution Series B, Chemical and Physical, 1985, 9(4): 281-308
[14] 郑宝山. 地方性氟中毒及工业氟污染研究[M]. 北京: 中国环境科学出版社, 1992: 38-82
[15] Wang M, Yang J Y, He W Y, et al. Vertical distribution of fluorine in farmland soil profiles around phosphorous chemical industry factories [J]. Environmental Science and Pollution Research International, 2019, 26(1): 855-866
[16] Wang M, Li X, He W Y, et al. Distribution, health risk assessment, and anthropogenic sources of fluoride in farmland soils in phosphate industrial area, southwest China [J]. Environmental Pollution, 2019, 249: 423-433
[17] 黄开莲, 李薛燕, 王安伟, 等. 云南省鲁甸县燃煤污染型地方性氟中毒防治现况调查[J]. 中华地方病学杂志, 2019, 38(2): 144-148
Huang K L, Li X Y, Wang A W, et al. An investigation on current situation of coal-burning type endemic fluorosis control and prevention in Ludian County of Yunnan Province [J]. Chinese Journal of Endemiology, 2019, 38(2): 144-148 (in Chinese)
[18] 中华人民共和国国家质量监督检验检疫局. 食品中污染物限量: GB 2762—2005[M]. 北京: 中国标准出版社, 2005: 4
[19] Freeman G B, Johnson J D, Liao S C, et al. Absolute bioavailability of lead acetate and mining waste lead in rats [J]. Toxicology, 1994, 91(2): 151-163
[20] Freeman G B, Dill J A, Johnson J D, et al. Comparative absorption of lead from contaminated soil and lead salts by weanling Fischer 344 rats [J]. Fundamental and Applied Toxicology, 1996, 33(1): 109-119
[21] 尹乃毅, 罗飞, 张震南, 等. 土壤中铜的生物可给性及其对人体的健康风险评价[J]. 生态毒理学报, 2014, 9(4): 670-677
Yin N Y, Luo F, Zhang Z N, et al. Bioaccessibility of soil copper and its health risk assessment [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 670-677 (in Chinese)
[22] Ruby M V, Schoof R, Brattin W, et al. Advances in evaluating the oral bioavailability of inorganics in soil for use in human health risk assessment [J]. Environmental Science & Technology, 1999, 33(21): 3697-3705
[23] 郑小曼. 叶菜类蔬菜中砷的生物有效性研究[D]. 南宁: 广西大学, 2017: 4-6
Zheng X M. Bioavailability of arsenic in leafy vegetables [D]. Nanning: Guangxi University, 2017: 4-6 (in Chinese)
[24] Rocha R A, de la Fuente B, Clemente M J, et al. Factors affecting the bioaccessibility of fluoride from seafood products [J]. Food and Chemical Toxicology, 2013, 59: 104-110
[25] 中华人民共和国卫生部. 食品中氟的测定: GB/T 5009.18—2003[S]. 北京: 中国标准出版社, 2003
[26] Hu X, Zhang Y, Luo J, et al. Bioaccessibility and health risk of arsenic, mercury and other metals in urban street dusts from a mega-city, Nanjing, China [J]. Environmental Pollution, 2011, 159(5): 1215-1221
[27] Intawongse M, Dean J R. Uptake of heavy metals by vegetable plants grown on contaminated soil and their bioavailability in the human gastrointestinal tract [J]. Food Additives and Contaminants, 2006, 23(1): 36-48
[28] Oomen A G, Tolls J, Sips A J A M, et al. In vitro intestinal lead uptake and transport in relation to speciation [J]. Archives of Environmental Contamination and Toxicology, 2003, 44(1): 116-124
[29] Buzalaf M A R, Whitford G M. Fluoride metabolism [J]. Monographs in Oral Science, 2011, 22: 20-36
[30] 尚德荣, 赵宪勇, 宁劲松, 等. 应用体外仿生模型分析南极磷虾中氟的生物可给性及其对人体的健康风险[J]. 中国渔业质量与标准, 2014, 4(4): 21-26
Shang D R, Zhao X Y, Ning J S, et al. Bioaccessibility analysis and health risk assessment of fluorine in Euphausia superba using in vitro whole- bionic model [J]. Chinese Fishery Quality and Standards, 2014, 4(4): 21-26 (in Chinese)
[31] Sahuquillo A, Barberá R, Farré R. Bioaccessibility of calcium, iron and zinc from three legume samples [J]. Die Nahrung, 2003, 47(6): 438-441
[32] 王文辉, 卞金有, 曹采方. 氟化牛奶中氟的生物利用率研究[J]. 中华口腔医学杂志, 2001, 36(2): 116-118
Wang W H, Bian J Y, Cao C F. A study on the bioavailability of fluoride added into milk [J]. Chinese Journal of Stomatology, 2001, 36(2): 116-118 (in Chinese)
[33] Trautner K, Einwag J. Influence of milk and food on fluoride bioavailability from NaF and Na2FPO3 in man [J]. Journal of Dental Research, 1989, 68(1): 72-77
[34] Shulman E R, Vallejo M. Effect of gastric contents on the bioavailability of fluoride in humans [J]. Pediatric Dentistry, 1990, 12(4): 237-240
[35] 张念恒, 安冬, 李达圣, 等. 贵州省燃煤污染型氟中毒重点病区玉米和辣椒氟含量及变化[J]. 中华地方病学杂志, 2017, 36(8): 580-582
Zhang N H, An D, Li D S, et al. Contents of fluoride in corn and peppers in key regions of coal-burning-borne endemic fluorosis areas in Guizhou Province [J]. Chinese Journal of Endemiology, 2017, 36(8): 580-582 (in Chinese)
[36] 常晓轲, 张强, 韩娅楠, 等. 不同类型辣椒中辣椒素含量测定及辣度分析[J]. 中国瓜菜, 2019, 32(9): 30-33
Chang X K, Zhang Q, Han Y N, et al. Analysis and comparison of capsaicinoid contents and pungency degree in different types of pepper [J]. China Cucurbits and Vegetables, 2019, 32(9): 30-33 (in Chinese)
[37] 程琪琪, 葛蔚, 李敬锁, 等. 辣椒中多环芳烃的累积特征及健康风险评估[J]. 环境化学, 2018, 37(2): 229-238
Cheng Q Q, Ge W, Li J S, et al. Accumulation and health risk assessment of polycyclic aromatic hydrocarbons in pepper [J]. Environmental Chemistry, 2018, 37(2): 229-238 (in Chinese)
[38] 苏昕峰. 辣椒素对肠道发酵环境的影响[D]. 重庆: 西南大学, 2012: 4-13
Su X F. Effect of capsaicin on intestinal fermtent environment [D]. Chongqing: Southwest University, 2012: 4-13 (in Chinese)
[39] Isoda H, Han J, Tominaga M, et al. Effects of capsaicin on human intestinal cell line Caco-2 [J]. Cytotechnology, 2001, 36(1-3): 155-161
[40] Dressman J B, Berardi R R, Dermentzoglou L C, et al. Upper gastrointestinal (GI) pH in young, healthy men and women [J]. Pharmaceutical Research, 1990, 7(7): 756-761