随着水体的富营养化以及气候变暖的加剧,全球蓝藻水华现象呈现暴发频率高、发生范围广、持续时间长的趋势[1-2]。有些蓝藻水华种类可以产生蓝藻毒素,严重危害饮用水安全及生态环境健康。除了最常见的微囊藻水华及其产生的肝毒性微囊藻毒素外,常见的一些丝状蓝藻包括鱼腥藻、浮丝藻和束丝藻等可产生具有神经毒性的鱼腥藻毒素(anatoxins, ATXs)[3]。1966年加拿大学者Stavric和Gorham[4]从蓝藻水华中分离出第一株产ATXs(anatoxin-a, ATX-a)蓝藻——水华鱼腥藻(Anabaena flos-aquae),由于其产生的毒素可以使动物在几分钟内产生抽搐、痉挛和呼吸麻痹等神经中毒症状,因此被命为“快速致死因子”。鉴于ATXs的毒性效应,部分国家已在饮用水安全指导中规定ATX-a的安全值,加拿大魁北克省设定ATX-a安全限值为0.0037 mg·L-1,新西兰ATX-a安全限值为0.006 mg·L-1,美国俄亥俄州和俄勒冈州ATX-a安全限值分别为0.002 mg·L-1和0.003 mg·L-1[5]。世界卫生组织(WHO)还没有明确规定ATX-a的安全限值,我国目前也未制定相关标准。随着ATXs引起的动物中毒事件全球频发,ATXs受到越来越多的国际研究者的关注,对其开展的研究方向也日趋广泛。正确认识ATXs对水生生物和人类健康的影响和危害,对于客观评估ATXs的生态毒性具有重要意义。本文根据现有的研究成果,拟从ATXs的致毒机理、毒性效应以及环境归趋等研究前沿方面进行综述分析,并对ATXs未来的研究方向进行了展望。
1 鱼腥藻毒素的概况(An introduction to anatoxins)
1.1 ATXs的分子结构性质
ATXs是一类具有神经毒性的小分子二级胺生物碱。1977年,ATX-a的结构被阐明[6],其分子结构为2-乙酰基-9-氮杂双环[4,2,1]-壬-2-烯,分子式为C10H15NO,相对分子质量(Mr)为165,电离常数pKa值为9.36±0.06,紫外最大吸收波长(λmax)为227 nm。ATXs的其他的异构型包括homoanatoxin-a(HATX-a)、dihyroanatoxin-a(dATX-a)和dihyrohomoanatoxin-a(dHATX-a)。其中HATX-a结构上是由ATX-a侧链上的乙酰基被丙酰基所替代形成,dATX-a和dHATX-a分别是ATX-a和HATX-a分子环上碳双键还原衍生物,dATX-a分子式为C10H16NO,Mr=167,dHATX-a分子式为C11H18NO,Mr=180(图1)[7]。ATXs易溶于水和有机溶剂,在中性和酸性条件下结构稳定,高温、UV和碱性条件下则相对易降解[8]。
Anatoxin-a (S)(现命名为Guanitoxin)(图1)最早是从Anabanea flos-aquae 525-17中分离得到,是一种天然有机磷酸酯,其致毒机理是抑制胆碱脂酶的活性[9]。Anatoxin-a (S)早期被误认为是ATX-a的类似物,其导致的小鼠中毒症状和ATX-a相似,并伴有流诞现象(salivation phenotype),因此在ATX-a后加“S”将其命名为ATX-a (S)。后续系列研究揭示了Anatoxin-a (S)和ATX-a在分子结构、分子遗传基础、毒性大小以及致毒机理上具有明显的差异,为避免混淆,Fiore等[10]根据其分子结构中的磷脂基团(Guani)将其重新命名为Guanitoxin。
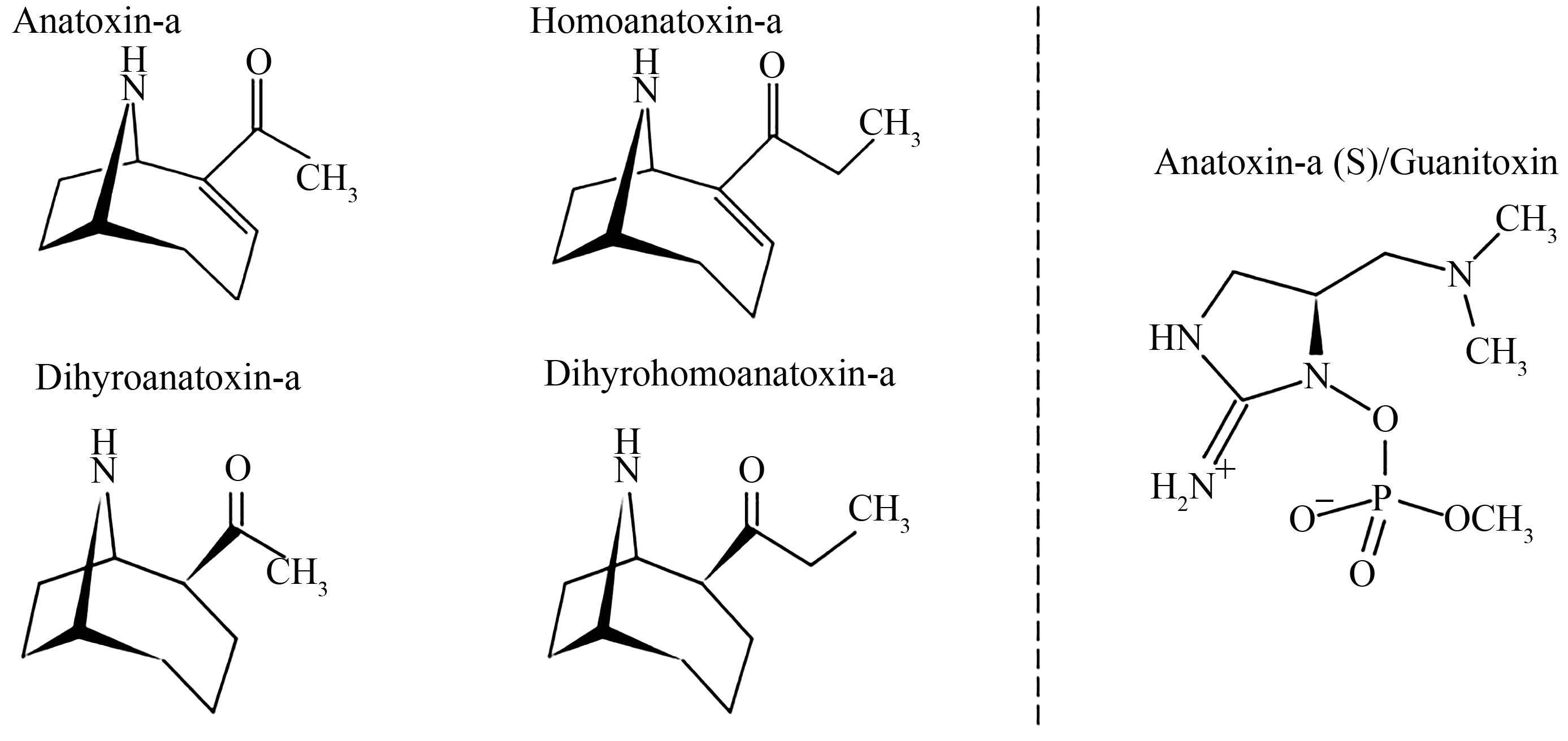
图1 Anatoxins和guanitoxin分子结构
Fig. 1 Molecular structures of anatoxins and guanitoxin
1.2 产ATXs蓝藻
据不完全统计,目前文献报道的产ATXs的淡水丝状蓝藻有11个属40多个种类,包括喜静水水体的浮游丝状蓝藻:长孢藻属(Dolichospermum)、束丝藻属(Aphanizomenon)、矛丝藻属(Cuspidothrix)、浮丝藻属(Planktothrix)[11]、尖头藻属(Raphidiopsis)[12]、柱胞藻属(Cylindrospermum)、节旋藻属(Arthrospira)[13]和念珠藻属(Nostoc)[14]等。喜弱流水的底栖丝状蓝藻颤藻属(Oscillatoria)[15]、席藻属(Phormidium)[16]和微鞘藻属(Microcoleus)[17]等。目前尚未有报道表示海洋蓝藻种类具有产ATXs的能力,对此也需要开展进一步调查后方可确认。
产ATXs蓝藻全球分布的地域跨度包括北温带、热带和南温带区域,绝大部分集中于近亚寒带较高纬度的北温带地区[5]。虽然丝状蓝藻水华如束丝藻和长孢藻水华在我国滇池、洱海、太湖和巢湖等几大淡水湖泊频繁暴发,但关于我国产ATXs丝状蓝藻的检测开展的工作仍相对较少。我们对分离自滇池的22株束丝藻和长孢藻进行检测,发现2株分离自滇池的束丝藻具有产ATXs能力[18],Wang等[19]检测了40株太湖的鱼腥藻,未发现产毒株。陈有信[20]对我国野外环境水体调查分析表明,产ATXs蓝藻在我国高纬度的北温带和亚热带的云贵高原湖泊的分布比长江中下游更为普遍。
2 鱼腥藻毒素的生态毒性效应(The eco-toxicity effects of anatoxins)
2.1 ATXs的致毒机理
ATXs的分子结构十分类似于神经递质乙酰胆碱,可作为胆碱能受体的激动剂[21]。乙酰胆碱是脊椎动物神经系统最重要的神经递质之一,在中枢神经系统中,乙酰胆碱主要参与觉醒、认知和中枢运动控制;在外周神经系统中,乙酰胆碱参与引起骨骼肌收缩运动通路的传递,交感神经和副交感神经兴奋信号的传递以及副交感神经通路的神经节后传输。胆碱能受体是神经递质乙酰胆碱介导的离子型通道受体,可分为烟碱受体和毒蕈碱受体两大类,前者主要分布在中枢神经系统、自主神经节的突触后膜以及神经-肌肉接头的终板膜上,后者主要分布在副交感神经节后纤维所支配的效应器细胞膜以及交感神经节后纤维支配的汗腺和骨骼肌的血管壁上。以神经肌肉细胞为例,在正常的神经信号传递过程中,突触前神经元释放的乙酰胆碱激活突触后神经元上的胆碱能受体后,会引起突触后膜的例子通道快速开放,造成Na+、K+离子的跨膜流动,引起膜去极化,进而引发肌细胞的兴奋与收缩,随后乙酰胆碱迅速被乙酰胆碱脂酶降解失活,从而终止乙酰胆碱对受体的刺激作用,使肌膜恢复极化状态,肌细胞恢复静息状态(图2(a))[22]。而ATXs因具有半刚性的分子结构,其与胆碱能受体结合后不能够被乙酰胆碱酶水解失活,持续地刺激造成受体通道长时间开放,从而使得肌细胞过度兴奋以致痉挛,阻断神经信号的正常传递(图2(b))[22]。
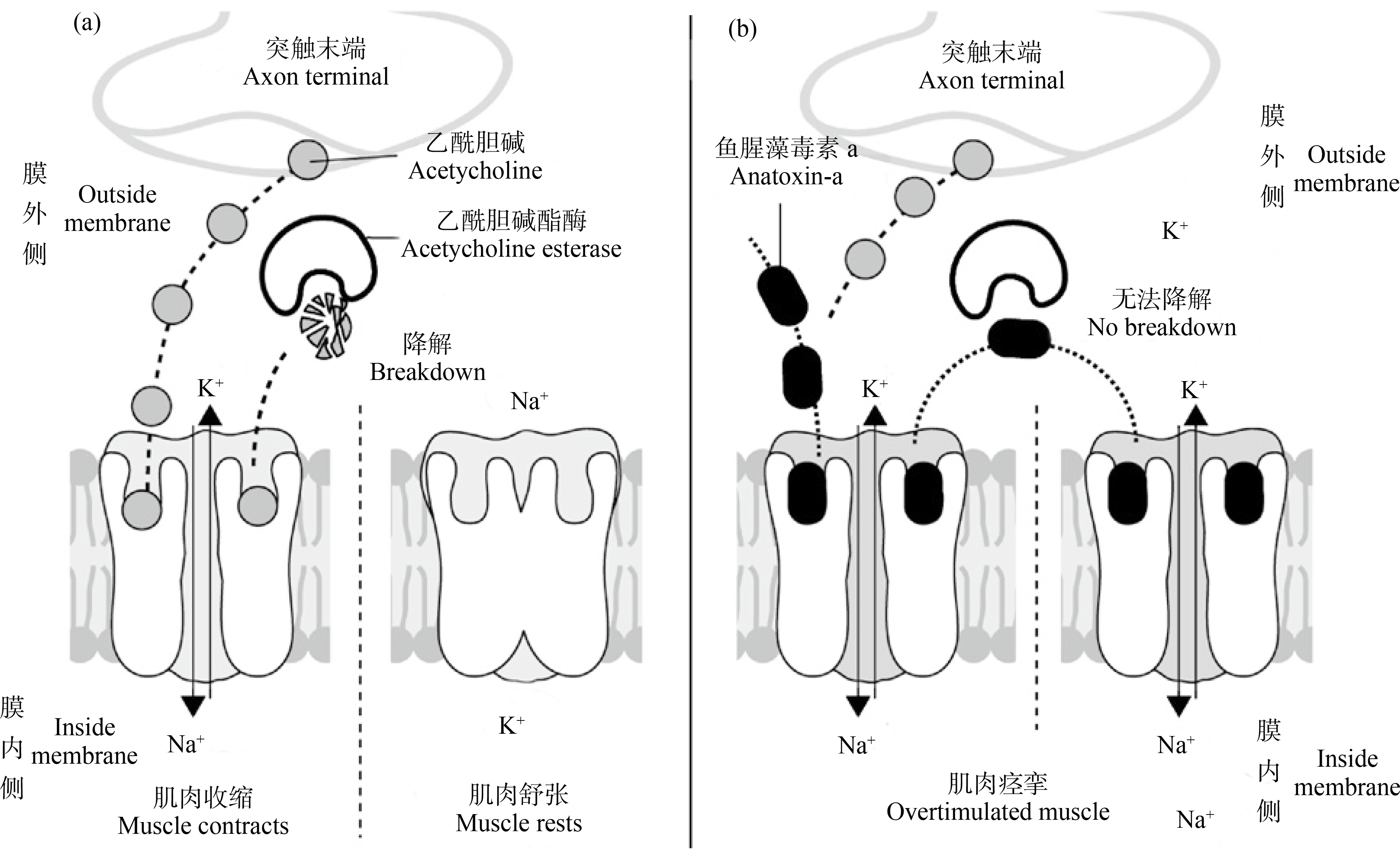
图2 Anatoxin-a在神经肌肉细胞间隙作用于乙酰胆碱受体[22]
注:(a)正常作用模式;(b)中毒模式。
Fig. 2 Scheme showing the anatoxin-a effect on acetylcholine receptors at a neuromuscular junction[22]
Note: (a) Normal event; (b) Intoxication by anatoxin-a.
2.2 ATXs在水体的出现情况
ATXs主要存在于蓝藻细胞内,仅少量在细胞生长过程中被分泌到胞外,然而大量藻细胞一旦死亡裂解后,ATXs将释放入水柱中,对人类健康和生态系统构成极大的威胁。尽管具有潜在产ATXs能力的蓝藻在全球淡水系统中广泛分布,但是关于ATXs在全球水体的暴露情况研究相对较少。WHO最早报告了1985—1996年全球淡水水体细胞外和胞内ATXs的浓度为0.00002~0.00036 mg·L-1[23]。近年来,新西兰、意大利、俄罗斯、德国和美国等国家均在野外水体中监测到ATXs存在,其中新西兰报道8条河流中的ATXs浓度范围为0.0014~0.154 mg·L-1[24],而德国Tegel湖ATXs的浓度范围高达0.943~1.87 mg·L-1[25]。美国对ATXs开展了较为系统的研究,2006—2011年美国报告的湖泊、水库、河流和池塘等地表水中ATXs浓度范围为0.00005~1.929 mg·L-1[26]。其中2009年美国华盛顿州的32个湖泊中,44%的湖泊ATXs浓度范围为0.00005~0.144 mg·L-1,超过16%的湖泊ATXs浓度超过0.001 mg·L-1的安全限值[26]。2008年,在美国佛罗里达州的3份成品饮用水中检测到ATXs,范围从低于检测下限到0.0085 mg·L-1[26]。以上研究数据均表明ATXs在全球淡水系统中已广泛存在,特别是饮用水源中ATXs的污染尤其应该引起重视,若直接饮用ATXs污染的饮用水将给人们带来较大健康风险。
我国国内对相关水体开展ATXs的监测工作较少,在前期工作中我们借助分子监测手段对滇池开展了近2年的ATXs时空动态监测,揭示了柔细束丝藻是滇池主要产ATXs蓝藻,产毒基因的丰度在滇池存在明显的时空差异性[18]。但在水体环境样品中我们并未检出ATXs,可能原因为产毒柔细束丝藻的生物量所占比例较低,其次高原湖泊滇池水体所处的高光、强辐射及碱性条件十分不利于ATXs的稳定,导致释放到滇池水体中ATXs能够被较快降解。陈有信[20]对我国25个水体的199个环境样品开展了大空间尺度下的产毒基因anaF的定量分析,发现anaF广泛分布于中国北温带水体以及云贵高原水体中,但该研究未报道所研究水体中ATXs监测数据。总体来看,现阶段我国对水体中ATXs的基本分布状况及毒素水平尚缺乏系统的研究,对于ATXs在中国水体的分布和污染情况的认知十分有限。而ATXs作为快速致死性的神经类毒素,对于生态系统和人类健康的威胁不容小觑。对我国淡水水体的ATXs分布的基本情况开展调查,将有助于我们获取国内水体ATXs污染的基本情况第一手资料,对水体蓝藻毒素污染风险预警及生态安全评估具有重要意义。
2.3 ATXs的生态毒性效应2.3.1 引起陆生动物及人类中毒事件
ATXs在淡水水体的广泛分布严重影响陆生动物及人类的健康及生存环境,ATXs可能的暴露途径主要概括为:(1)直接饮用被毒素污染的水源;(2)在毒素污染水域进行娱乐活动如游泳、划船和洗浴等;(3)消费被毒素污染的食物,通过食物链富集和生物放大效应最终危害高营养级的生物。
ATXs引发小鼠急性中毒后表现出现抽搐、肌肉痉挛、身体失衡和呼吸麻痹等一系列神经中毒的症状,可在数分钟后导致动物死亡[27]。ATX-a对小鼠腹腔注射的半致死剂量(intraperitoneal injection half lethal dose, i.p. LD50)和口服半致死剂量(oral LD50)如表1所示,其中ATX-a的i.p. LD50值为0.23 μg·g-1,dHATX-a对小鼠的i.p. LD50值约0.73 μg·g-1,而HATX-a的毒性与ATX-a相近[17, 28]。
近年来世界多地由ATXs引起的陆生动物(水鸟、狗、鸭子和牛等)急性中毒事件频发。2001—2005年期间,肯尼亚Bogoria湖和Nakuru湖发生过多起火烈鸟神经中毒死亡的事件,水样、藻席(含有席藻、颤藻和节旋藻等)、鸟肠道内含物以及羽毛中均检测到了ATX-a [13, 29-30]。2015年夏季伊朗的Shoormast湖中鸭子下湖游泳约15~20 min后开始出现抽搐的症状,随后死亡,后在其胃内含物中检测到ATX-a[31]。新西兰、加拿大、英国和德国等均记录了ATXs引起狗的死亡的事件,2019年夏季德国报道了3条狗在Mandichosee水库游泳后突然死亡,其胃内含物中检测到1.77 mg·L-1 ATXs(包括ATX-a和dATX-a),水库中的常丝藻(Tychonema)后被证明是ATXs毒性的主要贡献者[32]。
表1 鱼腥藻毒素对小鼠急性毒性[17, 28]
Table 1 Acute toxicity of anatoxins in mice[17, 28]
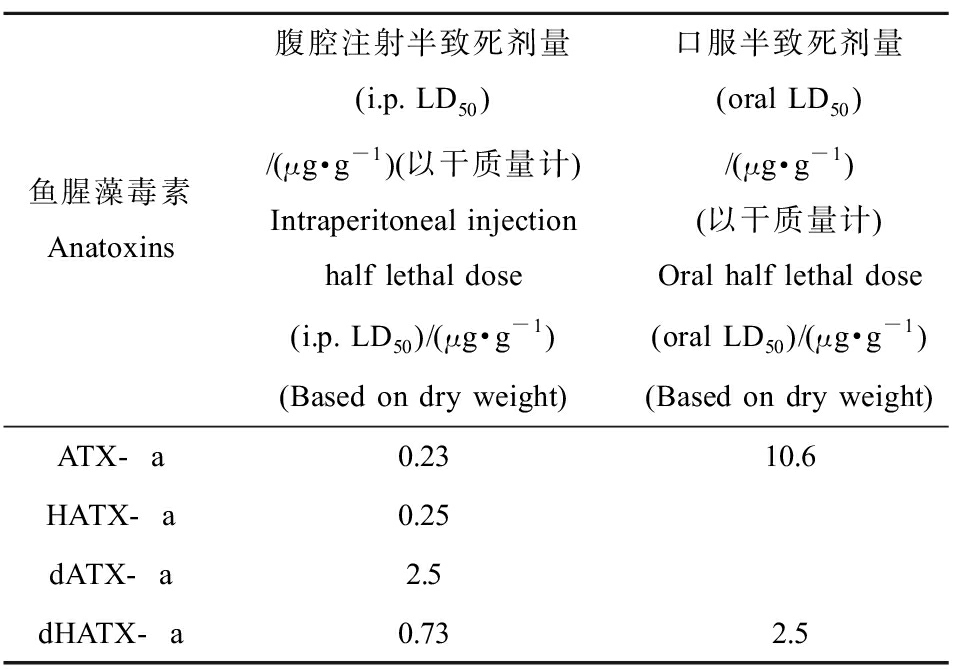
鱼腥藻毒素Anatoxins腹腔注射半致死剂量(i.p. LD50)/(μg·g-1)(以干质量计)Intraperitoneal injection half lethal dose(i.p. LD50)/(μg·g-1)(Based on dry weight)口服半致死剂量(oral LD50)/(μg·g-1)(以干质量计)Oral half lethal dose (oral LD50)/(μg·g-1)(Based on dry weight)ATX-a0.2310.6HATX-a0.25dATX-a2.5dHATX-a0.732.5
注:i.p.为腹腔注射;LD50为半致死效应浓度。
Note: i.p. is for intraperitoneal injection; LD50 is concentration for 50% of lethal dose.
ATX-a可引起人类急性中毒,2002年美国威斯康辛州报道了一例由ATX-a引起青少年中毒死亡的案例,死者曾在暴发藻华的池塘游泳并吞咽了池水,随后出现神经中毒症状,后在其胃内含物检出了ATX-a和水华鱼腥藻[33-34]。鱼类、贝类等水生动物对ATX-a的生物富集和生物放大作用亦可对人类健康产生风险。例如2008年秋季Syczyńskie湖河鲈肝脏组织ATXs含量为12.3~21.0 μg·g-1(以湿质量计),肝脏组织ATXs含量为0~0.53 μg·g-1(以湿质量计)[35]。目前未有因摄食ATXs污染鱼类导致人类中毒的报道,人们摄食ATXs污染鱼类的风险取决于鱼组织的可食用部分ATXs含量,而摄食全鱼的野生动物显然要比人类更具ATXs暴露的风险。2011—2018年法国南部报道多起ATX-a污染贝类引起人类亚急性中毒的案例,中毒者均在食用海鞘后出现视力模糊、头晕、身体乏力、肌肉痉挛和麻木等神经中毒症状,但所有人在30 h之内均恢复了正常状态,他们食用的海鞘样品中检出ATX-a含量为0.194~1.24 μg·g-1 [36]。此外,丝状蓝藻如螺旋藻、水华束丝藻由于具有一系列保健与营养作用已被作为膳食补充剂广泛应用于食品行业,而其作为可潜在产ATXs蓝藻种属同样可对人类造成ATXs暴露的风险。Rellán等[37]报道了市场上33份蓝藻膳食补充剂产品中7.7%的产品存在不同程度的ATX-a污染(2.5~33 μg·g-1)。
2.3.2 对鱼类的毒性效应
ATXs对鱼类的毒性作用体现在神经毒性、免疫毒性和细胞毒性等方面。青鳉鱼在20 μg·g-1(口服绝对致死剂量(absolute lethal dose, LD100))的ATX-a条件下会在1~2 min内因呼吸麻痹而窒息死亡,其口服半致死剂量(LD50)值为11.50 μg·g-1[38]。Wiegand和Pflugmacher[39]研究了ATX-a对鱼类免疫毒性,发现ATX-a可导致鱼类免疫细胞(中性粒细胞、淋巴细胞、巨噬细胞和骨髓细胞)活力下降,引发鱼类免疫系统失调。Zhong等[40]进一步研究了ATX-a对鲫鱼淋巴细胞的毒性机理,揭示了ATX-a能够导致淋巴细胞核染色质浓缩、空泡化和线粒体肿胀等。不同浓度ATX-a(0.01~10 mg·L-1)处理12 h均能诱导鲫鱼淋巴细胞基因组DNA片段化,产生阶梯性电泳这一典型细胞凋亡特征,此外ATX-a还能诱导淋巴细胞产生显著的氧化胁迫反应,不同浓度ATX-a(0.01~10 mg·L-1)处理12 h后,鲫鱼淋巴细胞内活性氧(reactive oxygen species, ROS)和丙二醛(malondialdehyde, MDA)的含量明显升高,而超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽转移酶(glutathione S-transferase, GST)和过氧化氢酶(catalase, CAT)含量显著下降。且ATX-a诱导的细胞凋亡和氧化胁迫反应随着ATX-a浓度的增加呈现明显的剂量效应关系。
2.3.3 对水生植物的毒性效应
水生植物是水生态系统的重要组成部分,水生植物可以通过生物转化作用净化水体中的蓝藻毒素等污染物,然而暴露于蓝藻毒素下也会对水生植物的生理和生态产生不同程度的影响。ATXs对水生植物的影响取决于植物的类型以及毒素的浓度。水生植物对ATXs毒素的敏感性强弱可能与水生植物叶片与污染水体接触的有效面积有关。例如漂浮植物浮萍暴露在较高浓度ATX-a(5~25 mg·L-1)的水环境中可引起植物细胞的氧化胁迫反应,其过氧化物酶、谷胱甘肽转移酶和过氧化氢酶在一定程度上升高,细胞内光合放氧水平降低[41]。而对于沉水植物金鱼藻,在ATX-a的较低浓度水平(0.00005~0.05 mg·L-1)下即表现出对其敏感性,具体表现为生长抑制、氧化胁迫和光合色素含量降低等[42]。此外,其敏感性随着毒素浓度的升高而加强,如金鱼藻在低环境浓度ATX-a(0.0005 mg·L-1)条件下暴露12 d,才开始表现出轻微的抑制效应,而当暴露于较高环境浓度ATX-a(0.005 mg·L-1和0.05 mg·L-1)条件下时,6~8 d内即表现出抑制效应[42]。因此金鱼藻具有作为水体ATX-a污染的指示植物的潜力。
3 鱼腥藻毒素的环境归趋(The environmental fate of anatoxins)
3.1 自然降解
环境因子如光照、pH、高温和UV-B辐射等均能对ATXs的稳定性产生影响。不同于其他蓝藻毒素,ATXs在日光暴露条件下极易被降解,ATX-a可部分或完全被降解成稳定低毒的dATX-a或dHATX-a和无毒的epoxy-ATX-a或epoxy-HATX-a形式[43]。高pH可加速光降解过程,ATX-a在中性pH自然水体的阳光照射条件下半衰期约为5 d[43],但在偏碱性水体(pH=8~9)其半衰期仅为1~2 h[44]。相反低pH和低温条件下ATX-a性质趋于稳定(如ATX-a在20 ℃、pH为3.5时暴露9周后仅3%发生降解);相反在中性和碱性的高温条件下ATX-a可迅速发生降解(如ATX-a在100 ℃、pH为7时暴露1 h后76%发生降解)[8]。此外,UV照射条件下,ATX-a也容易发生降解,如在pH为3.5、20 ℃条件下,经UV-B照射1 h,ATX-a可降解10%[8]。蓝藻水华多发生在温度较高、紫外辐射较强的夏秋季节,且暴发蓝藻水华的水体pH值会随之升高,趋向偏碱性范围,以上环境条件均不利于ATXs的稳定,因此自然降解可能为ATXs的主要降解途径之一。
3.2 微生物降解
微生物对ATX-a也具有明显的降解作用。Kiviranta等[45]证明了从丝状蓝藻的伴生假单胞菌(Pseudomonas)在3 d内对ATX-a的降解效率为6~30 mg·L-1。Rapala等[46]向鱼腥藻ATX-a提取物中添加体积比为1%~2%的Tuusulanjärvi湖湖水接种物和底泥接种物4 d后,所有实验组ATX-a含量由约从2.4 mg·L-1降至0.01 mg·L-1以下,表明湖水和底泥中存在可降解ATXs的微生物。此方面研究可以为ATXs污染水体的生物降解去除提供新思路。
3.3 底泥吸附
含毒素的蓝藻细胞会通过多种途径进入水体沉积物,底泥对ATXs的阳离子交换吸附是ATXs从水柱中消除的一条重要途径。有机富粘土和淤泥对ATXs的吸附较强,而沙质土壤对ATXs的吸附较弱[47]。然而粘土层对ATXs的吸附性可能会减慢微生物对其降解作用,ATXs可能在较长的一段时间内保持生态可用性[48],还会因底栖鱼类对底泥的扰动而被重新释放入水柱中。进一步研究底泥对ATXs吸附和重释放行为及其影响因素对于深入了解ATXs的环境归趋具有重要作用。
3.4 生物富集
ATXs可以通过食物链传递在包括底栖动物、鱼类和贝类等动物体内积累,ATXs被吸收入体内后,一部分积累到机体组织器官中,一部分则会被代谢降解。对欧洲富营养化湖泊Syczyńskie湖的多年研究表明,该湖泊长期暴发产ATXs蓝藻水华,水柱中ATXs的浓度最高可达0.49 mg·L-1 [35],广泛分布的底栖种类揺蚊属幼虫可以摄食产ATXs蓝藻,其体内最高检测到185.4 μg·g-1(以湿质量计)ATXs[49]。而生物量巨大的揺蚊幼虫作为多种鱼类的优良饵料,极易将自身ATXs通过食物链转移到鱼类体内。对2006—2009年期间对Syczyńskie湖中多种土著鱼类进行ATXs检测,鱼体内均发现了一定量ATXs在的生物积累,且肝脏组织内积累含量要高于肌肉组织[35]。Osswald等[50]研究结果表明紫贻贝不仅可以在体内生物积累ATXs(最高达0.0066 μg·g-1(以干质量计)),还可以通过自身代谢作用将ATXs净化。除了水生动物之外,水生植物如金鱼藻也被证明对ATX-a具有较强吸收与净化作用[51]。此方面的研究可为ATX-a污染水体的生物净化开辟新途径。
4 研究展望(Research prospect)
尽管目前对鱼腥藻毒素生态毒性的研究日益增多,但总体上我们的认识还不够全面和系统,仍有许多方面值得探索,本文对未来的研究方向提出以下几点展望。
(1)产ATXs底栖丝状蓝藻。前期研究者主要关注湖泊浮游性丝状蓝藻产ATXs能力,如鱼腥藻、束丝藻和浮丝藻等,且很多研究仅检测ATX-a一种毒素类型(可能由于缺乏其他ATXs标准品),ATXs的实际总浓度水平存在严重低估的可能性;近年来,随着有关河流、水库的底栖藻类(如席藻、微鞘藻和常丝藻)引起动物中毒事件的频发,且HATX-a、dATX-a或dHATX-a为其主要的毒素类型,因而受到研究者普遍关注。底栖丝状蓝藻一般附着在河流、湖泊和温泉等的固体基质上,相较于浮游性丝状水华蓝藻种类更不易被人们察觉,因而对水质安全更具潜在危害性。因此在后期工作中有必要加强对底栖丝状蓝藻产ATXs产毒能力的检测,从而加强对产ATXs蓝藻的种类及生态分布的认识,为水质安全提供保障。
(2)ATXs和其他污染物的联合毒性效应。环境污染物的毒性风险评价不能仅限于单一污染物毒性评价的结果,而需要关注多种污染物在环境浓度下的联合作用结果。富营养化水体暴发蓝藻水华过程中,往往会出现多种蓝藻毒素(微囊藻毒素、拟柱胞藻毒素和麻痹性贝类毒素等)共存的情况[52-54]。早期研究发现ATX可与MC-LR对小鼠产生协同毒性效应,经过亚致死剂量的MC-LR处理后的小鼠,其对ATX的半致死剂量减少75%[55]。Smutná等[56]研究证实相比纯化的微囊藻毒素,产微囊藻毒素蓝藻对浮游动物水蚤的毒性效应更强,表明蓝藻毒素与其他蓝藻代谢产物如脂多糖、多肽和生物碱也存在相互作用。此外,研究还证明微囊藻毒素与![]() 和Cu2+均能对斑马鱼产生协同毒性作用[57-59]。开展多种污染物联合毒性研究对于水体的复合污染风险评估和防控具有重要意义,因此ATXs与其他污染物(如其他蓝藻次级代谢产物、重金属等)之间形成的多种复合污染及其联合毒性效应方面的研究也有待进一步探索。
和Cu2+均能对斑马鱼产生协同毒性作用[57-59]。开展多种污染物联合毒性研究对于水体的复合污染风险评估和防控具有重要意义,因此ATXs与其他污染物(如其他蓝藻次级代谢产物、重金属等)之间形成的多种复合污染及其联合毒性效应方面的研究也有待进一步探索。
(3)ATXs在食物链中的传递和富集。已有研究结果表明ATXs能够在多种生物体内富集积累,但相关研究仍欠全面和系统,开展ATXs对不同营养级生物的毒性作用和影响研究,对于系统揭示ATXs在食物链中的传递和生物富集的规律以及阐明ATXs的生态的毒性具有重要意义。
[1] Visser P M, Verspagen J M H, Sandrini G, et al. How rising CO2 and global warming may stimulate harmful cyanobacterial blooms [J]. Harmful Algae, 2016, 54: 145-159
[2] Ho J C, Michalak A M, Pahlevan N. Widespread global increase in intense lake phytoplankton blooms since the 1980s [J]. Nature, 2019, 574(7780): 667-670
[3] Osswald J, Rellán S, Gago A, et al. Toxicology and detection methods of the alkaloid neurotoxin produced by cyanobacteria, anatoxin-A [J]. Environment International, 2007, 33(8): 1070-1089
[4] Stavric B, Gorham P R. Toxic factors from Anabaena flos-aquae (Lyngb.) de Breb clone NRC-44 h [J]. Proceedings of the Canada Society. Plant Physiologists, 1966, 7: 21
[5] Colas S, Marie B, Lance E, et al. Anatoxin-a: Overview on a harmful cyanobacterial neurotoxin from the environmental scale to the molecular target [J]. Environmental Research, 2021, 193: 110590
[6] Devlin J P, Edwards O E, Gorham P R, et al. Anatoxin-a, a toxic alkaloid from Anabaena flos-aquae NRC-44h [J]. Canadian Journal of Chemistry, 1977, 55(8): 1367-1371
[7] Méjean A, Paci G, Gautier V, et al. Biosynthesis of anatoxin-a and analogues (anatoxins) in cyanobacteria [J]. Toxicon, 2014, 91: 15-22
[8] Kaminski A, Bober B, Lechowski Z, et al. Determination of anatoxin-a stability under certain abiotic factors [J]. Harmful Algae, 2013, 28: 83-87
[9] Valério E, Chaves S, Tenreiro R. Diversity and impact of prokaryotic toxins on aquatic environments: A review [J]. Toxins, 2010, 2(10): 2359-2410
[10] Fiore M F, de Lima S T, Carmichael W W, et al. Guanitoxin, re-naming a cyanobacterial organophosphate toxin [J]. Harmful Algae, 2020, 92: 101737
[11] Viaggiu E, Melchiorre S, Volpi F, et al. Anatoxin-a toxin in the cyanobacterium Planktothrix rubescens from a fishing pond in northern Italy [J]. Environmental Toxicology, 2004, 19(3): 191-197
[12] Namikoshi M, Murakami T, Watanabe M F, et al. Simultaneous production of homoanatoxin-a, anatoxin-a, and a new non-toxic 4-hydroxyhomoanatoxin-a by the cyanobacterium Raphidiopsis mediterranea Skuja [J]. Toxicon: Official Journal of the International Society on Toxinology, 2003, 42(5): 533-538
[13] Ballot A, Krienitz L, Kotut K, et al. Cyanobacteria and cyanobacterial toxins in three alkaline Rift Valley Lakes of Kenya—Lakes Bogoria, Nakuru and Elmenteita [J]. Journal of Plankton Research, 2004, 26(8): 925-935
[14] Ghassempour A, Najafi N M, Mehdinia A, et al. Analysis of anatoxin-a using polyaniline as a sorbent in solid-phase microextraction coupled to gas chromatography-mass spectrometry [J]. Journal of Chromatography A, 2005, 1078(1-2): 120-127
[15] Mann S, Cohen M, Chapuis-Hugon F, et al. Synthesis, configuration assignment, and simultaneous quantification by liquid chromatography coupled to tandem mass spectrometry, of dihydroanatoxin-a and dihydrohomoanatoxin-a together with the parent toxins, in axenic cyanobacterial strains and in environmental samples [J]. Toxicon: Official Journal of the International Society on Toxinology, 2012, 60(8): 1404-1414
[16] Wood S A, Smith F M, Heath M W, et al. Within-mat variability in anatoxin-a and homoanatoxin-a production among benthic Phormidium (cyanobacteria) strains [J]. Toxins, 2012, 4(10): 900-912
[17] Puddick J, van Ginkel R, Page C D, et al. Acute toxicity of dihydroanatoxin-a from Microcoleus autumnalis in comparison to anatoxin-a [J]. Chemosphere, 2021, 263: 127937
[18] Wang S Q, Zhu L, Li Q, et al. Distribution and population dynamics of potential anatoxin-a-producing cyanobacteria in Lake Dianchi, China [J]. Harmful Algae, 2015, 48: 63-68
[19] Wang Z J, Liu Y, Xu Y, et al. The divergence of cpcBA-IGS sequences between Dolichospermum and Aphanizomenon (Cyanobacteria) and the molecular detection of Dolichospermum flos-aquae in Taihu Lake, China [J]. Phycologia, 2013, 52(5): 447-454
[20] 陈有信. 中国水体中产神经毒素蓝藻的分布、分子特征及监测[D]. 北京: 中国科学院大学, 2018: 62-80
Chen Y X. Distribution, molecular characteristics and monitoring of neutroxin-producing cyanobacteria in China [D]. Beijing: University of Chinese Academy of Sciences, 2018: 62-80 (in Chinese)
[21] Thomas P, Stephens M, Wilkie G, et al. (+)-Anatoxin-a is a potent agonist at neuronal nicotinic acetylcholine receptors [J]. Journal of Neurochemistry, 1993, 60(6): 2308-2311
[22] Carmichael W W. The toxins of cyanobacteria [J]. Scientific American, 1994, 270(1): 78-86
[23] Christoffersen K, Kaas H. Toxic cyanobacteria in water. A guide to their public health consequences, monitoring, and management [J]. Limnology and Oceanography, 2000, 45(5): 1212
[24] McAllister T G, Wood S A, Atalah J, et al. Spatiotemporal dynamics of Phormidium cover and anatoxin concentrations in eight New Zealand rivers with contrasting nutrient and flow regimes [J]. The Science of the Total Environment, 2018, 612: 71-80
[25] Fastner J, Beulker C, Geiser B, et al. Fatal neurotoxicosis in dogs associated with tychoplanktic, anatoxin-a producing Tychonema sp. in mesotrophic Lake Tegel, Berlin [J]. Toxins, 2018, 10(2): E60
[26] United States Environmental Protection Agency (US EPA). Health effects support document for the cyanobacterial toxin cylindrospermopsin [R]. Washington DC: US EPA, 2015
[27] Carmichael W W, Boyer G L. Health impacts from cyanobacteria harmful algae blooms: Implications for the North American Great Lakes [J]. Harmful Algae, 2016, 54: 194-212
[28] Skulberg O M, Skulberg R, Carmichael W W, et al. Investigations of a neurotoxic oscillatorialean strain (Cyanophyceae) and its toxin. Isolation and characterization of homoanatoxin-a [J]. Environmental Toxicology and Chemistry, 1992, 11(3): 321-329
[29] Krienitz L, Ballot A, Kotut K, et al. Contribution of hot spring cyanobacteria to the mysterious deaths of Lesser Flamingos at Lake Bogoria, Kenya [J]. FEMS Microbiology Ecology, 2003, 43(2): 141-148
[30] Metcalf J S, Morrison L F, Krienitz L, et al. Analysis of the cyanotoxins anatoxin-a and microcystins in lesser flamingo feathers [J]. Toxicological & Environmental Chemistry, 2006, 88(1): 159-167
[31] Nowruzi B, Blanco S, Nejadsattari T. Chemical and molecular evidences for the poisoning of a duck by anatoxin-a, nodularin and cryptophycin at the coast of Lake Shoormast (Mazandaran Province, Iran) [J]. International Journal on Algae, 2018, 20(4): 359-376
[32] Bauer F, Fastner J, Bartha-Dima B, et al. Mass occurrence of anatoxin-a- and dihydroanatoxin-a-producing Tychonema sp. in mesotrophic reservoir Mandichosee (River Lech, Germany) as a cause of neurotoxicosis in dogs [J]. Toxins, 2020, 12(11): E726
[33] Behm D. Coroner cites algae in teen’s death-experts are uncertain about toxin’s role [J]. Milwaukee Journal Sentinel, 2003, 1: 1
[34] Weirich C A, Miller T R. Freshwater harmful algal blooms: Toxins and children’s health [J]. Current Problems in Pediatric and Adolescent Health Care, 2014, 44(1): 2-24
[35] Pawlik-Skowrońska B, Toporowska M, Rechulicz J. Simultaneous accumulation of anatoxin-a and microcystins in three fish species indigenous to lakes affected by cyanobacterial blooms [J]. Oceanological and Hydrobiological Studies, 2012, 41(4): 53-65
[36] Biré R, Bertin T, Dom I, et al. First evidence of the presence of anatoxin-a in sea figs associated with human food poisonings in France [J]. Marine Drugs, 2020, 18(6): E285
[37] Rellán S, Osswald J, Saker M, et al. First detection of anatoxin-a in human and animal dietary supplements containing cyanobacteria [J]. Food and Chemical Toxicology, 2009, 47(9): 2189-2195
[38] Colas S, Duval C, Marie B. Toxicity, transfer and depuration of anatoxin-a (cyanobacterial neurotoxin) in medaka fish exposed by single-dose gavage [J]. Aquatic Toxicology, 2020, 222: 105422
[39] Wiegand C, Pflugmacher S. Ecotoxicological effects of selected cyanobacterial secondary metabolites a short review [J]. Toxicology and Applied Pharmacology, 2005, 203(3): 201-218
[40] Zhong Y C, Shen L L, Ye X P, et al. Neurotoxic anatoxin-a can also exert immunotoxicity by the induction of apoptosis on Carassius auratus lymphocytes in vitro when exposed to environmentally relevant concentrations [J]. Frontiers in Physiology, 2020, 11: 316
[41] Mitrovic S M, Pflugmacher S, James K J, et al. Anatoxin-a elicits an increase in peroxidase and glutathione S-transferase activity in aquatic plants [J]. Aquatic Toxicology, 2004, 68(2): 185-192
[42] Ha M H, Pflugmacher S. Phytotoxic effects of the cyanobacterial neurotoxin anatoxin-a: Morphological, physiological and biochemical responses in aquatic macrophyte, Ceratophyllum demersum [J]. Toxicon, 2013, 70: 1-8
[43] Harada K I, Nagai H, Kimura Y, et al. Liquid chromatography/mass spectrometric detection of anatoxin-a, a neurotoxin from cyanobacteria [J]. Tetrahedron, 1993, 49(41): 9251-9260
[44] Stevens D K, Krieger R I. Stability studies on the cyanobacterial nicotinic alkaloid anatoxin-a [J]. Toxicon, 1991, 29(2): 167-179
[45] Kiviranta J, Sivonen K, Lahti K, et al. Production and biodegradation of cyanobacterial toxins—A laboratory study [J]. Archiv Für Hydrobiologie, 1991, 121(3): 281-294
[46] Rapala J, Lahti K, Sivonen K, et al. Biodegradability and adsorption on lake sediments of cyanobacterial hepatotoxins and anatoxin-a [J]. Letters in Applied Microbiology, 1994, 19(6): 423-428
[47] Klitzke S, Beusch C, Fastner J. Sorption of the cyanobacterial toxins cylindrospermopsin and anatoxin-a to sediments [J]. Water Research, 2011, 45(3): 1338-1346
[48] Bouaïcha N, Corbel S. Cyanobacterial toxins emerging contaminants in soils: A review of sources, fate and impacts on ecosystems, plants and animal and human health [M]//Soil Contamination—Current Consequences and Further Solutions. InTech, 2016: 105-126
[49] Toporowska M, Pawlik-Skowrońska B, Kalinowska R. Accumulation and effects of cyanobacterial microcystins and anatoxin-a on benthic larvae of Chironomus spp. (Diptera: Chironomidae) [J]. European Journal of Entomology, 2014, 111(1): 83-90
[50] Osswald J, Rellán S, Gago A, et al. Uptake and depuration of anatoxin-a by the mussel Mytilus galloprovincialis (Lamarck, 1819) under laboratory conditions [J]. Chemosphere, 2008, 72(9): 1235-1241
[51] Kaminski A, Bober B, Chrapusta E, et al. Phytoremediation of anatoxin-a by aquatic macrophyte Lemna trisulca L. [J]. Chemosphere, 2014, 112: 305-310
[52] 万翔, 薛庆举, 顾毓蓉, 等. 微囊藻毒素及其与其他环境污染物的联合毒性研究进展[J]. 生态毒理学报, 2021, 16(2): 50-62
Wan X, Xue Q J, Gu Y R, et al. Advance on combined toxicity of microcystins and other environmental pollutants [J]. Asian Journal of Ecotoxicology, 2021, 16(2): 50-62 (in Chinese)
[53] Chrapusta E, Węgrzyn M, Zabaglo K, et al. Microcystins and anatoxin-a in Arctic biocrust cyanobacterial communities [J]. Toxicon, 2015, 101: 35-40
![]() J, Savadova-Ratkus K, Toruńska-Sitarz A, et al. First report of saxitoxins and anatoxin-a production by cyanobacteria from Lithuanian Lakes [J]. European Journal of Phycology, 2020, 55(3): 327-338
J, Savadova-Ratkus K, Toruńska-Sitarz A, et al. First report of saxitoxins and anatoxin-a production by cyanobacteria from Lithuanian Lakes [J]. European Journal of Phycology, 2020, 55(3): 327-338
[55] Taylor J. A review of: “Detection Methods for Cyanobacterial Toxins” [J]. Chemistry and Ecology, 1995, 11: 4, 275-276
[56] Smutná M, Babica P, Jarque S, et al. Acute, chronic and reproductive toxicity of complex cyanobacterial blooms in Daphnia magna and the role of microcystins [J]. Toxicon: Official Journal of the International Society on Toxinology, 2014, 79: 11-18
[57] Pavagadhi S, Gong Z Y, Balasubramanian R. Toxicological implications of microcystins for zebrafish embryos in the presence of other environmental pollutants [J]. Environmental Toxicology and Chemistry, 2013, 32(7): 1574-1581
[58] Lin W, Hou J, Guo H H, et al. The synergistic effects of waterborne microcystin-LR and nitrite on hepatic pathological damage, lipid peroxidation and antioxidant responses of male zebrafish [J]. Environmental Pollution, 2018, 235: 197-206
[59] Wei H M, Wang S, Xu E G, et al. Synergistic toxicity of microcystin-LR and Cu to zebrafish (Danio rerio) [J]. The Science of the Total Environment, 2020, 713: 136393