六溴环十二烷(hexabromocyclododecanes, HBCDs; C12H18Br6)是全球产量和用量位居第二的溴代阻燃剂[1-2],主要用于聚丙烯塑料、纤维和聚苯乙烯泡沫塑料的阻燃,中国已经是全球HBCDs生产和使用第一大国[3]。商用HBCDs产品主要包括α、β和γ这3个非对映异构体,含量分别是10%~15%、1%~12%和75%~89%,且均为手性对映异构体[4]。作为一种添加型阻燃剂,HBCDs极易在产品使用和拆解过程中释放到环境 [5]。随着HBCDs的大量使用,研究者们发现,全球环境中无处不在的HBCDs具有持久性有机污染物(persistent organic pollutants, POPs)的典型特征,即难降解、生物蓄积性和可长距离迁移性。一些HBCDs的毒理学研究也相继证明,HBCDs伴有多种生物毒性[6],例如早期发现的细胞毒性[7]、可降低哺乳动物发育和记忆能力的毒性[8],以及可扰乱甲状腺激素受体介导的基因表达毒性[9]。最新关于HBCDs早期发育毒性研究结果还证实,HBCDs暴露对母体和后代具有氧化应激和细胞凋零毒害作用[10],也会促进脂肪细胞的形成[11]。因此,2013年斯德哥尔摩公约已经将其列为A类POPs化合物清单(POPRC8.3, 2013)。鉴于此,欧洲作为斯德哥尔摩公约的缔约国,于2016年全面禁止HBCDs的生产和使用,而中国环境保护部等11部委也承诺,2016年12月26日至2021年12月25日豁免期内,HBCDs的生产、使用和进出口仅限于聚丙乙烯保温材料[12]。
基于以上原因,早期相当数量的研究工作,主要集中在不同环境介质中HBCDs来源和浓度的调查与监测[13-14]。这些研究为环境中HBCDs的监控、潜在暴露途径的早期预防与控制提供有效手段,更为斯德哥尔摩公约POPs的全球控制方案制定与修订提供重要依据。而近年来HBCDs在环境中的高检出率、生物毒性的多样性,特别是人体中HBCDs检出率和检出浓度的持续升高[14-16],使控制HBCDs暴露源、降低环境生物的HBCDs暴露风险成为全球HBCDs的防控共识。在开展环境中生物体HBCDs暴露风险评价研究中,研究者主要围绕HBCDs的来源、暴露途径,以及环境中HBCDs的迁移转化规律和分布特征,进而开展生物体HBCDs暴露量与风险评价研究。
环境中HBCDs的研究表明,HBCDs主要通过大气和大气灰尘从排放源(地区)迁移,并通过降尘进入水、土壤和沉积物等环境或环境介质中。最后进入环境中的HBCDs通过各种迁移转化过程,进入生物体内。但毒理学研究证实,HBCDs的3个异构体和6个手性对映异构体的细胞毒性和生物毒性不同,而揭示环境-生物系统中HBCDs各种异构体分布特征和迁移转化规律,是开展HBCDs生物暴露量和风险评价的理论基础与科学依据。
因此,众多研究者以两相系统为典型模型,开展了不同环境HBCD非对映异构体和对映异构体向生物中的迁移转化规律研究[17-23]。而在这些众多研究中,室内模拟和开放条件下环境-生物系统中HBCDs的迁移转化研究是重要的研究手段。
本文主要介绍近20年来室内模拟和开放环境条件下,土壤-生物、水-生物、沉积物-生物和水-生物-沉积物不同环境系统中,HBCDs及3种非对映异构体在环境和生物中的分布特征和迁移转化规律研究,以及研究者关于环境-生物系统中HBCDs迁移规律与分布特征达成的共识和存在的疑问,进而针对这些疑问我们所面临的新科学问题,提出笔者对环境-生物系统中HBCDs迁移转化和分布特征研究的展望。
1 模拟条件下研究结果及进展(Findings and progress under simulation conditions)
早期环境-生物系统中HBCDs的室内模拟研究以HBCDs对生物的暴露毒性研究为主[24-25]。本文侧重环境-生物系统中HBCDs的迁移转化与毒性相关研究。
1.1 土壤-生物系统中HBCDs的迁移转化和生物毒性
土壤-生物系统中HBCDs的迁移转化与生物毒性的研究,主要包括土壤-植物和土壤-动物2种类型。
2011年Li等[15]通过室内模拟实验,研究了土壤-蔬菜系统中HBCDs的迁移转化和分布特征。研究者用HBCDs(含9%的α-HBCD,6%的β-HBCD和85%的γ-HBCD)浸染无污染土壤后放置在培养器皿中,然后将萝卜和甘蓝种子种植在土壤中,并观察8周后土壤、萝卜和甘蓝的根、茎中HBCDs总量及各种异构体的分布特征。模拟实验结果表明,不同蔬菜对HBCDs富集和吸收能力具有差异性,根茎是HBCDs的主要富集部位,根中富集浓度高于茎中浓度。根、茎中3种非对映异构体均可检测到,但2个部位的富集优势体不同,根系和茎中HBCDs的优势体分别为γ-HBCD和α-HBCD。
Li等[15]的研究证实了土壤中的HBCDs是通过根吸收后,向茎等组织中迁移。但γ-HBCD和α-HBCD优势异构体仅是一种观察结果和实验现象,研究者解释高浓度γ-HBCD是植物体中其富集或具有优势浓度(用含85%的γ-HBCD的HBCDs混合标准品开展实验)的成因,但同样不能排除茎中α-HBCD富集不是异构体转化的结果。
因此,随后研究者选择3种非对映异构体单体,即3对手性对映异构体开展土壤-生物系统HBCDs相关研究。例如,2017年Zhu等[21]通过制备色谱,分离和纯化了HBCDs混合体,得到3种非对映异构体HBCD的单体,分别研究了其在土壤-黑麦草(盆栽)系统中的迁移和转化特征。研究结果表明:α-HBCD、β-HBCD和γ-HBCD均可通过黑麦草的根向茎和叶中迁移,并在根、茎、叶中都有检出,但主要富集在根部,进一步证实了Li等[15]的研究结果;3种异构体在黑麦草各部位中富集浓度顺序为α-HBCD>β-HBCD>γ-HBCD;β-HBCD和γ-HBCD在黑麦草中迁移时会向α-HBCD转化,但未观察到α-HBCD向β-HBCD或γ-HBCD转化的现象;黑麦草对(+)α-、(-)β-和(+)γ-HBCD具有选择富集性;HBCDs对黑麦的生物毒性表现为抑制了黑麦草植株、根和茎的生物质量,降低叶片色素含量,且γ-HBCD对根和茎的生长抑制最显著。
除了土壤-植物系统,也有关于土壤-动物系统研究。例如,在2015年Li等[26]开展了土壤-蚯蚓系统中,3种非对映异构体从土壤中向2种不同蚯蚓体内迁移、富集、分布特征和代谢速度的研究。研究者证实,α-HBCD在蚯蚓体内的迁移和生物富集能力最强,半衰期最短;3种非对映异构体在2种蚯蚓体内生物富集参数存在差异,蚯蚓体内蛋白和脂质含量是主要影响因素;β-HBCD和γ-HBCD在2种蚯蚓体内会转化成α-HBCD,但转化程度受生物种类影响(2种蚯蚓的转化程度有差异);3种非对映异构体在蚯蚓体内发生手性对映体选择富集和代谢,其中α-HBCD最显著((-)α-HBCD)。
由此可见,HBCDs 3种非对映异构体单体的土壤-植物和土壤-动物模拟实验均表明,HBCDs可在生物体内富集,α-HBCD体是生物体中优先富集的异构体,但不同生物体对α-HBCD的手性对映体选择性有些表现为(+)α-HBCD[22],有些表现为(-)α-HBCD[26]。
然而土壤-生物系统中HBCDs的最新研究却对HBCDs在生物体内的富集性有了新的认识。这项研究来自Brandon等[27]。研究者采用的是一种特殊的固体-生物系统,即聚乙烯泡沫塑料-粉虱。这项室内研究,观察了粉虱对含有不同浓度HBCDs聚乙烯泡沫塑料的降解过程,并将粉虱作为饲料喂养虾。研究结果表明,被粉虱摄入的HBCDs仅有(0.27±0.10)%保留在体内,而大部分在24 h后随粪便排出体外,用这些粉虱喂养虾后,虾体内未观察到HBCDs存在明显的生物富集现象。研究者认为如果将时间维度拉长,可以观察到随微小颗粒进入粉虱体内的HBCDs,不是一种生物富集或累积现象,而是趋于一种代谢平衡。
1.2 水-生物系统中HBCDs非对映异构体的迁移转化和生物毒性
水-生物系统的模拟实验有一个限制条件,必须考虑3种HBCDs异构体在水中的溶解度。α-HBCD、β-HBCD和γ-HBCD常温下水中溶解度分别为48.8、14.7和2.1 μg·L-1[28],研究者也充分考虑了HBCDs的溶解度,其中具有代表性的是来自Wu等[22,29]和Huang等[18]团队关于水-玉米系统一系列研究结果。
例如,在2012年,Wu等[22]通过室内模拟实验,观察了简单的水-玉米植株系统中,HBCDs从水质培养液向玉米植株迁移转化及生物毒害作用。研究中,研究者配制的培养液中含有HBCDs混合体,其中α-HBCD、β-HBCD和γ-HBCD浓度以溶解度最小的γ-HBCD为标准,均为2.0 μg·L-1。通过在培养箱中培养,植株中HBCDs检测结果表明,培养液中HBCDs向玉米植株中发生了迁移和富集。3种非对映异构体中β-HBCD在根系和茎中富集,是植物中优势异构体,且随着暴露浓度增大和暴露时间延长,HBCDs会抑制玉米植株的生长,产生玉米氧化应激压力和DNA损害毒性。
到了2016年,该团队以水-玉米植株模拟系统,开展了更详细的研究[18,29]。首先,通过水-玉米植株室内模拟实验,进一步采用分子机理和分子对接方法证实了HBCDs通过根茎从培养液向玉米中迁移和富集,并有手性对映异构体选择性[18]。其次,他们的研究给出了一些新的研究结果和认识:CYP71C3v2和GST31这2种酶在玉米根部与HBCDs结合都具有手性对映体选择性,但前者优势结合异构体为(+)α-、(-)β-和(-)γ-HBCD;植物(玉米)体中HBCDs的总浓度与培养液中HBCDs总浓度和暴露时间正相关,且总量趋于平衡;HBCDs暴露使玉米植株中产生羟基自由基和组蛋白磷酸化,从而造成氧化应激和DNA双链损害;玉米根部的HBCDs通过羟基化和脱溴代谢成为单羟基、二羟基、五溴和四溴化合物。随后2019年Huang等[30]体外分子水平实验进一步证实,细胞色素P450 (CYP)酶对HBCDs不同异构体具有立体选择性,即这种代谢的立体选择性造成了生物体内HBCDs代谢速度差异,进而使生物体表现出对HBCDs具有非对映异构体和手性异构体的选择性富集。
对于以上这些研究我们发现,玉米根和茎中HCBD的优势异构体与培养液中优势异构体相关,但β-HBCD体在生物体中的占比高于培养液。例如当分别暴露在α-HBCD、β-HBCD和γ-HBCD浓度为25.0、17.5和2.0 μg·L-1的培养液时,α-HBCD是根系中优势异构体[18],而暴露在α-HBCD、β-HBCD和γ-HBCD占比分别为(12.87±0.15)%、(13.12±0.23)%和(74.01±0.35)%混合培养液时,γ-HBCD是根和茎中的优势异构体[29],具体如图1所示。

水-植物系统与土壤-生物系统的研究结果相似,初步以观察实验现象证实了生物体对环境中的HBCDs具有选择性富集,富集主要途径是由根部向茎部富集,根和茎是主要的富集部位。但研究者多采用非对映异构体间浓度有差异的混合溶液,但研究结果无法解释造成这种非对映异构体和手性选择性吸收或富集的机理。
针对以上疑问,研究者开始以单个异构体开展水-动物系统中HBCDs的相关研究[16,25]。2006年Law等[25]的研究针对的是水-虹鳟鱼模拟体系,证实了γ-HBCD随着暴露时间体内富集浓度线性增加,而α和β的富集浓度随着暴露时间延长呈指数级增长,并且α-HBCD的生物放大因子(BMF)最大。到了2018年,程鑫[16]将水-动物系统中动物的种类增加,在延长了食物链的同时,深入开展3种非对映异构体在鱼体不同器官和组织中分布特征、选择性富集,以及选择性代谢和半衰期。研究者采用浸染饵料喂养和污染水体饲养的方法,研究了鱼体(青鳉鱼和黄姑鱼)单独暴露在3种非对映异构体污染的水环境后,不同组织和器官内HBCDs选择性富集和代谢规律。该研究结果表明:鱼体内β-HBCD和γ-HBCD可以转化为α-HBCD,α-HBCD未向其他异构体转化,β-HBCD和γ-HBCD之间也无相互转化;从各组织分布来看,暴露时间越长各组织和器官中HBCD浓度越高,肠道和鳃中HBCDs的富集浓度最高;各非对映异构体在鱼体内的半衰期不同,α-HBCD最慢,γ-HBCD和β-HBCD较快;肝脏中HBCDs的代谢能力最强,肌肉中最慢。由此可见α-HBCD代谢速度最慢,可能是其表现出强富集性的一个主要原因。
2 开放环境中研究结果及进展(Findings and progress in open environment)
以上的室内模拟研究表明:培养基或培养液中的HBCDs会在生物体中发生选择性迁移和蓄积,而异构体及其浓度差异会对迁移、富集和分布特征会产生影响。但真实环境中HBCDs各异构体的残留浓度和分布特征不尽相同,必须进一步识别环境-生物系统中HBCDs异构体、量化不同异构体的暴露量,开展开放环境中HBCDs迁移规律和分布特征研究,为环境中生物暴露风险和潜在毒性评价提供重要技术手段。代表性的研究有土壤-生物和水-生物系统。
2.1 土壤-植物系统中HBCDs的迁移规律
截至目前为止,系统地开展环境土壤-植物中HBCDs非对映异构体的迁移规律和特征的研究相对较少[23,31-32],代表性研究来自于Huang等[33]和Lv等[23]关于土壤-作物系统的研究。
2017年Huang等[33]在塑料回收站区域,开展了土壤-植物系统中HBCDs的迁移特征。该研究调查了塑料回收站附近农田-作物(蔬菜和粮食)中HBCDs非对映异构体和对映异构体分布特征。研究结果显示,农田土壤和作物中均检出α-HBCD(检出率仅为25%),β-HBCD(检出率100%)和γ-HBCD(100%),农田土壤中HBCDs总浓度大于作物中总浓度;γ-HBCD是土壤优势异构体,α-HBCD是作物中优势异构体且具有生物富集性,但异构体组成在不同土壤和作物种类间存在差异。研究结果同时表明HBCDs在农田土壤和作物中有明显的手性对映体选择现象。
与Huang等[33]的研究不同,2019年Lv等[23]选择普通农田-蔬菜系统,开展了土壤-蔬菜系统中HBCDs非对映异构体和对映异构体的迁移转化研究。研究者以中国重要的农业种植区珠江三角洲为研究区域,调查了中国广州、江门、惠州和佛山共4个采样地区配套的60组土壤和蔬菜样品中HBCDs残留水平及特征。结果表明土壤和蔬菜中均检出α-HBCD,β-HBCD和γ-HBCD,蔬菜中HBCDs的浓度高于土壤中HBCDs浓度,蔬菜对HBCDs具生物富集效应,生物富集因子(bioconcentration factor, BCFs)>1,但不同蔬菜对HBCDs富集能力存在差异性。土壤和蔬菜中HBCD的优势体一致,均是γ-HBCD。
根据开放环境中土壤-植物系统的研究,不难看出研究者们主要是揭示和发现了对土壤-植物系统中HBCDs迁移转化的影响因素。主要的研究结果包括:在污染场地,土壤和蔬菜等作物中的优势异构体有差异,分别是γ-HBCD和α-HBCD;在非污染区,农田土壤和蔬菜中优势异构体一致,均为γ-HBCD。土壤-植物系统中HBCDs迁移转化的影响因素有HBCDs各异构体的浓度、HBCDs的来源或暴露途径和植物体的差异[31]。此外,也有研究表明土壤中的有机质、土壤中酶和菌群[23]也对HBCDs的迁移转化能力或活性有影响。
2.2 水-生物系统中HBCDs的迁移规律
关于自然界水-生物系统中HBCDs的迁移特征的研究很多,大部分研究聚焦在水体、沉积物或水体单一或同一食物链等级生物中HBCDs残留特征研究[31-32,34-37]。
例如,较早是Zhang等[31]、Steven等[34]和Jeong等[37]分别对海水-生物和淡水-生物环境中沉积物和生物、食物链中HBCDs及3种非对映异构体的残留特征的研究。研究结果表明,生物体对α-HBCD有富集作用,沉积物中HBCDs总浓度高于生物体内HBCDs总浓度,但差异较小;沉积物和生物体内HBCD优势异构体分别为γ-HBCD和α-HBCD,其在总量中的占比相近,约80%,且大部分生物对(+)α-、(-)β-和(-)γ-HBCD有选择性富集。
早期这些研究以海水或淡水中生物体内HBCD残留特征为主,但由于水体流动性大,水体(特别是淡水)中HBCDs浓度较低,影响因素复杂,缺少水体中HBCDs分析,难以考察水体中HBCDs对生物体内HBCDs迁移、富集和分布特征的影响。为此,2017年Gu等[17]同时考察了养殖区海水、沉积物和贻贝中HBCDs非对映异构体,研究海洋-生物-沉积物系统中HBCDs的迁移特征。研究结果证实贻贝中HBCDs总浓度明显高于海水中浓度,但低于沉积物中HBCDs浓度。海水和贻贝中HBCD的优势异构体均为α-HBCD,且贻贝中α-HBCD的BCF达到1.05×106 L·kg-1,而沉积物中优势异构体为γ-HBCD。该结果与Jeong等[37]河水系统中研究结果相一致。
在2018年,Zhang等[38]选择近海岸HBCDs生产企业附近海域为研究区域,开展了海水-生物系统中HBCDs在腐生食物链和草生食物链内迁移特征的研究,扩展了食物链种类和等级。研究结果表明,近海岸的乌鱼、牡蛎、螃蟹、平头鱼、鲈鱼、海螺、大鳞鞋底鱼和虾等12种海产品中均有HBCDs的3种非对映异构体检出,α-HBCD是所有水生动物体内优势异构体,HBCDs总浓度和α-HBCD浓度与生物在食物链中等级相关,α-HBCD具有生物富集作用,即生物等级越高体内HBCDs浓度越高。
3 研究发展趋势(Developments trends)
当前,水-生物和土壤-植物系统中HBCDs研究主要取得以下共识:环境与生物体中HBCDs的非对映异构体类别一致;生物对环境中HBCDs有富集作用,这种富集能力与生物种类和HBCDs非对映异构体类型有关,动物体内(水产养殖鱼、虾等)富集浓度远高于植物(农作物)。室内模拟实验的研究结论基本被开放环境中的调查和研究结果证实,但开放环境-生物系统中一些调查和研究结果,很难用已有的模拟实验和结果进行解释。例如对于环境与生物体中HBCDs非对映异构体的组成特征、优势异构体的差异,生物体内异构体转化现象等,研究者仅能给出了一些解释、推断或实验结果,但具体的机理和成因需要进一步研究。笔者认为,未来以下几个方向的研究会引起更多的关注,成为新的研究热点。
3.1 生物体中的优势异构体与优势富集异构体研究
如前2.2中所述环境-生物系统中,研究者们通过土壤-生物体中HBCDs的浓度调查,查明了生物体中HBCDs的优势异构体。那么这些优势异构体的存在是否代表选择性富集?我们认为当前大多数研究结果是生物中HBCDs异构体浓度分布情况,高浓度的异构体仅仅代表优势异构体,不足以表明生物对该异构体具有选择性迁移和富集。
例如,Huang等[33]和Lv等[23]的研究结果可以很好说明这点。我们赞同Huang等[33]关于塑料处理区土壤和蔬菜中HBCDs的研究结论,即γ-HBCD为阻燃剂的主要成分,同时不断有新的污染源输入土壤中,故γ-HBCD是土壤中优势异构体(浓度范围4.58~13.5 ng·g-1),而α-HBCD的强水溶性使土壤中检出率仅为25%的α-HBCD在植物体发生选择性富集,其检出率为100%,浓度为2.59~16.9 ng·g-1。相比较,在Lv等[23]的研究中,非污染场地土壤和蔬菜中优势异构体均为γ-HBCD,浓度范围分别为3.16~6.66 ng·g-1和7.33~15.6 ng·g-1,即蔬菜中浓度高。尽管Lv等[23]的研究数据表明蔬菜中γ-HBCD浓度高于土壤中浓度,但不足以说明γ-HBCD在植物体内发生了选择性富集。我们认为该研究结果表明γ-HBCD是蔬菜中优势异构体的同时,也同样证实α-HBCD是优先富集异构体。如表1所示,Lv等[23]原文中数据显示土壤中α-HBCD检出率明显低于植物,植物中α-HBCD的检出率为100%。另一方面,根据文中土壤和蔬菜中HBCDs异构体的检测结果,不难看出,尽管蔬菜中γ-HBCD浓度占优势,但蔬菜中α-HBCD与γ-HBCD浓度比值总体超过土壤中浓度比值(表2)。这些都表明随着作物不断生长,α-HBCD将会取代γ-HBCD成为优势异构体。
为此也引出另一个问题,即生物体在生命周期内,准确地说其体内HBCDs优势异构体存在一个变化过程。目前,研究者已经发现影响优势异构体的因素包括HBCDs浓度、溶解性和生物体之间差异,还有环境中的有机质和菌群等,但不同环境中哪些因素是主控因素和决定因素,生物体内优势异构体的演变及其对生物体毒性的影响有待开展进一步的研究。
3.2 三相系统中HBCDs迁移与转化特征研究
通过近20年文献调研,除了关于HBCDs在土壤-麦苗-空气封闭系统中迁移和分布特征一项研究[20],据我们所知室内模拟研究主要以两相系统为主。与室内模拟体系研究相比,当前开放环境三相系统中HBCDs迁移和分布特征调查研究越来越多。
由于室内模拟研究的滞后,使得开放环境三相系统的一些研究结果缺少理论基础和实验数据。例如对于水-生物-沉积物(底泥)系统[17],研究结果表明系统中的生物体内的优势异构体或优先富集异构体是有差异的,总体与生物体生存相关。但需要模拟实验来证实,哪些生物体中HBCDs的分布特征与水体一致,哪些生物与沉积物一致,影响生物体中优势或优先富集异构体的是初始暴露浓度,还是异构体化学特性?这些研究对进一步揭示生物体中HBCDs的环境来源、各异构体在不同生物体的浓度和影响因素,以及生物体毒性风险具有重要意义。因此,加快三相系统中HBCDs迁移、转化和分布特征研究迫在眉睫。
3.3 非对映异构体转化发生场所的研究
尽管一些模拟体系和开放系统的研究结果显示,将生物体暴露在仅含有β-HBCD或γ-HBCD的环境后,生物体内同时有α-HBCD、β-HBCD和γ-HBCD检出,但当生物体仅暴露在含有α-HBCD的环境中时,生物体内无β-HBCD或γ-HBCD。因此,研究者普遍认为β-HBCD和γ-HBCD在向生物体内迁移时发生了β-HBCD和γ-HBCD向α-HBCD转化。
但当前的研究仅证明了模拟的环境-生物系统内HBCDs有异构体转化现象[18,25,39],尚无法证明这种转化是发生在生物体内,或是环境介质中。因为,现有的研究观察HBCDs某个非对映异构体在环境-生物体的迁移转化时,往往关注的是生物体内的HBCDs分布特征和变化,没有对水或土壤中HBCDs做同步或动态监测,无法准确揭示这种转化发生的时间或具体场所。未来,针对这一问题,人们将在环境-生物系统中HBCDs异构体转化方面开展更加深入的研究。只有揭示异构体转化发生在生物体内还是生物体外,特别是搞清环境介质物理特性差异对这种迁移转化的“微观作用”,才能准确掌握环境-生物系统中HBCDs的迁移转化的具体过程、重要环节和分布特征,并科学预测和评估HBCDs的生物毒性。
表1 非污染场地土壤和蔬菜中α-HBCD和γ-HBCD浓度及比值a
Table 1 The ratio of concentration between α-HBCD and γ-HBCD in farmland soil and vegetablesa
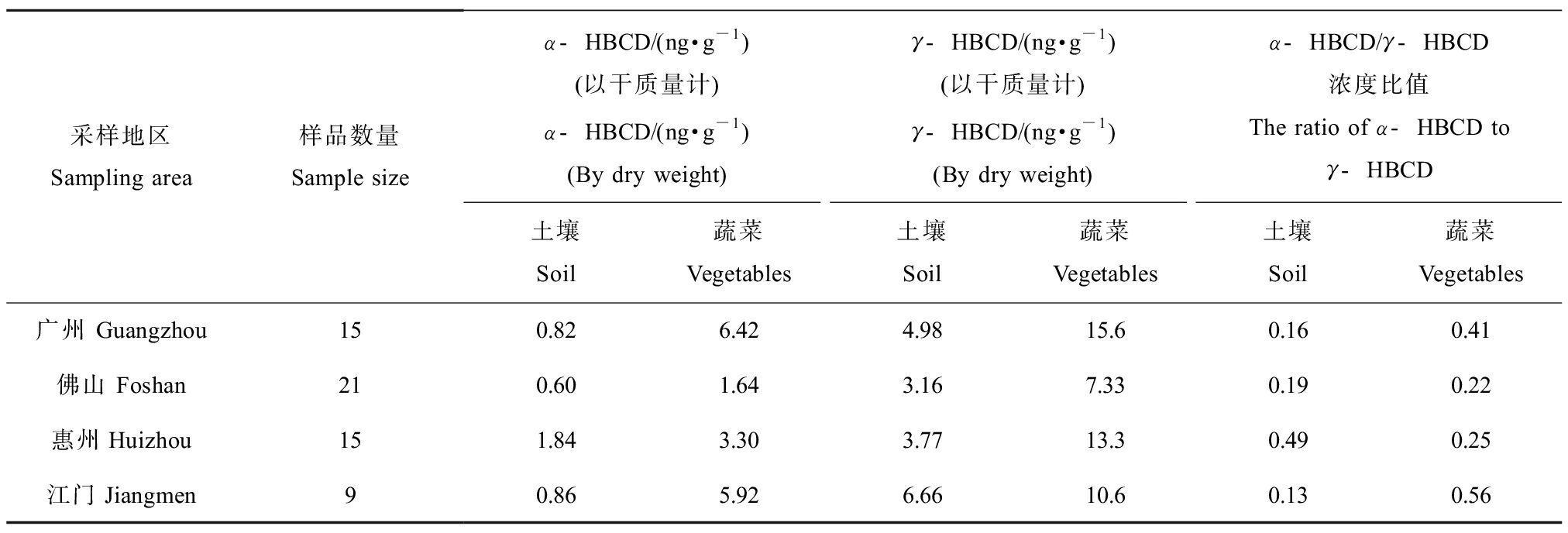
采样地区Sampling area样品数量Sample sizeα-HBCD/(ng·g-1)(以干质量计)α-HBCD/(ng·g-1)(By dry weight)γ-HBCD/(ng·g-1)(以干质量计)γ-HBCD/(ng·g-1)(By dry weight)α-HBCD/γ-HBCD浓度比值The ratio of α-HBCD toγ-HBCD土壤Soil蔬菜Vegetables土壤Soil蔬菜Vegetables土壤Soil蔬菜Vegetables广州 Guangzhou150.826.424.9815.60.160.41佛山 Foshan210.601.643.167.330.190.22惠州Huizhou151.843.303.7713.30.490.25江门Jiangmen90.865.926.6610.60.130.56
注:a以文献[23]的研究数据为例,蔬菜中浓度采用文献中报道值的均值。
Note: a means that all data come from reference 23, and the concentration is the average value.
3.4 非对映异构体转化及手性对映体选择性机理的研究
众所周知,在一定温度条件和光照条件下,β-HBCD和γ-HBCD会异构化为α-HBCD,现有研究结果也显示HBCDs在环境和生物体内有手性对映体选择性。但环境-生物系统非对映异构体转化和手性对映体选择性富集的仍然需要更多的机理性研究。例如HBCDs在环境介质的迁移转化过程(不涉及到生物过程)是否会发生β和γ向α的转化,以及转化机理需要进一步研究;多数研究表明,生物中相对富集α-HBCD。这种选择性富集有异构体之间的转化、生物可利用性差异,还有生物体内代谢速率差异等多种原因,但不同情况下主要因素需要进一步研究;玉米中的某些特殊酶与HBCDs不同手性异构体的结合强度差异[18],是HBCDs在玉米体内发生手性对映体选择性的成因。但关于生物体内,特别是动物体内HBCD手性对映体选择性机理,都尚不清楚;手性选择性富集生物有些表现出一致性,如对于γ-HBCD,都是选择性富集(+)γ-HBCD,但α-HBCD有些选择性富集(+)α-HBCD,有些选择性富集(-)α-HBCD,具体的生物调控机制需要更深入探讨。总之,只有摸清不同环境-生物系统中,HBCDs异构化和手性对映体选择性的机理,才能采取有效措施控制高毒性HBCDs异构体的转移和富集,降低HBCDs对生物体的危害。
[1] Zhang Y Q, Lu Y L, Wang P, et al. Transport of hexabromocyclododecane (HBCD) into the soil, water and sediment from a large producer in China [J]. Science of the Total Environment, 2018, 610-611: 94-100
[2] Huang L, Wang W W, Shah S B, et al. The HBCDs biodegradation using a Pseudomonas strain and its application in soil phytoremediation [J]. Journal of Hazardous Materials, 2019, 380: 120833
[3] Cao X H, Lu Y L, Zhang Y Q, et al. An overview of hexabromocyclododecane (HBCDs) in environmental media with focus on their potential risk and management in China [J]. Environmental Pollution, 2018, 236: 283-295
[4] Shi Z X, Zhang L, Li J G, et al. Legacy and emerging brominated flame retardants in China: A review on food and human milk contamination, human dietary exposure and risk assessment [J]. Chemosphere, 2018, 198: 522-536
[5] Ruan Y F, Zhang K, Wu C X, et al. A preliminary screening of HBCD enantiomers transported by microplastics in wastewater treatment plants [J]. Science of the Total Environment, 2019, 674: 171-178
[6] Yu Z Q, Chen L G, Mai B X, et al. Diastereoisomer- and enantiomer-specific profiles of hexabromocyclododecane in the atmosphere of an urban city in South China [J]. Environmental Science & Technology, 2008, 42(11): 3996-4001
[7] Zhang X L, Yang F X, Xu C, et al. Cytotoxicity evaluation of three pairs of hexabromocyclododecane (HBCD) enantiomers on Hep G2 cell [J]. Toxicology in Vitro: An International Journal Published in Association with BIBRA, 2008, 22(6): 1520-1527
[8] Eriksson P, Fischer C, Wallin M, et al. Impaired behaviour, learning and memory, in adult mice neonatally exposed to hexabromocyclododecane (HBCDD) [J]. Environmental Toxicology and Pharmacology, 2006, 21(3): 317-322
[9] Yamada-Okabe T, Sakai H, Kashima Y, et al. Modulation at a cellular level of the thyroid hormone receptor-mediated gene expression by 1,2,5,6,9,10-hexabromocyclododecane (HBCD), 4, 4’-diiodobiphenyl (DIB), and nitrofen (NIP) [J]. Toxicology Letters, 2005, 155(1): 127-133
[10] Chen H B, Guo S, Li H, et al. Multi-generational effects and variations of stress response by hexabromocyclododecane (HBCD) exposure in the nematode Caenorhabditis elegans [J]. Journal of Environmental Management, 2019, 245: 216-222
[11] Xie X N, Yu C X, Ren Q D, et al. Exposure to HBCD promotes adipogenesis both in vitro and in vivo by interfering with Wnt6 expression [J]. The Science of the Total Environment, 2020, 705: 135917
[12] Shi Z X, Zhang L, Zhao Y F, et al. A national survey of tetrabromobisphenol-A, hexabromocyclododecane and decabrominated diphenyl ether in human milk from China: Occurrence and exposure assessment [J]. The Science of the Total Environment, 2017, 599-600: 237-245
[13] Li F, Jin J, Tan D Q, et al. Hexabromocyclododecane and tetrabromobisphenol A in sediments and paddy soils from Liaohe River Basin, China: Levels, distribution and mass inventory [J]. Journal of Environmental Sciences, 2016, 48: 209-217
[14] Remberger M, Sternbeck J, Palm A, et al. The environmental occurrence of hexabromocyclododecane in Sweden [J]. Chemosphere, 2004, 54(1): 9-21
[15] Li Y N, Zhou Q X, Wang Y Y, et al. Fate of tetrabromobisphenol A and hexabromocyclododecane brominated flame retardants in soil and uptake by plants [J]. Chemosphere, 2011, 82(2): 204-209
[16] 程鑫. 六溴环十二烷异构体在鱼体内的污染分布特征及其选择性代谢规律研究[D]. 舟山: 浙江海洋大学, 2018: 28-41
Cheng X. Distribution characteristics and selective metabolism of hexabromocyclododecane isomers in fish [D]. Zhoushan: Zhejiang Ocean University, 2018: 28-41 (in Chinese)
[17] Gu S Y, Ekpeghere K I, Kim H Y, et al. Brominated flame retardants in marine environment focused on aquaculture area: Occurrence, source and bioaccumulation [J]. The Science of the Total Environment, 2017, 601-602: 1182-1191
[18] Huang H L, Zhang S Z, Lv J T, et al. Experimental and theoretical evidence for diastereomer- and enantiomer-specific accumulation and biotransformation of HBCD in maize roots [J]. Environmental Science & Technology, 2016, 50(22): 12205-12213
[19] Zhu H K, Sun H W, Zhang Y W, et al. Uptake pathway, translocation, and isomerization of hexabromocyclododecane diastereoisomers by wheat in closed chambers [J]. Environmental Science & Technology, 2016, 50(5): 2652-2659
[20] Zhu H K, Zhang K, Sun H W, et al. Spatial and temporal distributions of hexabromocyclododecanes in the vicinity of an expanded polystyrene material manufacturing plant in Tianjin, China [J]. Environmental Pollution, 2017, 222: 338-347
[21] Zhu H K, Sun H W, Yao Y M, et al. Fate and adverse effects of hexabromocyclododecane diastereoisomers (HBCDDs) in a soil-ryegrass pot system [J]. Chemosphere, 2017, 184: 452-459
[22] Wu T, Wang S, Huang H L, et al. Diastereomer-specific uptake, translocation, and toxicity of hexabromocyclododecane diastereoisomers to maize [J]. Journal of Agricultural and Food Chemistry, 2012, 60(34): 8528-8534
[23] Lv H X, Ma X J, Huang X J, et al. Distribution, diastereomer-specific accumulation and associated health risks of hexabromocyclododecanes (HBCDs) in soil-vegetable system of the Pearl River Delta region, South China [J]. Journal of Environmental Management, 2019, 248: 109321
[24] Du M M, Lin L F, Yan C Z, et al. Diastereoisomer- and enantiomer-specific accumulation, depuration, and bioisomerization of hexabromocyclododecanes in zebrafish (Danio rerio) [J]. Environmental Science & Technology, 2012, 46(20): 11040-11046
[25] Law K, Palace V P, Halldorson T, et al. Dietary accumulation of hexabromocyclododecane diastereoisomers in juvenile rainbow trout (Oncorhynchus mykiss) Ⅰ: Bioaccumulation parameters and evidence of bioisomerization [J]. Environmental Toxicology and Chemistry, 2006, 25(7): 1757
[26] Li B, Yao T Q, Sun H W, et al. Diastereomer- and enantiomer-specific accumulation, depuration, bioisomerization, and metabolism of hexabromocyclododecanes (HBCDs) in two ecologically different species of earthworms [J]. Science of the Total Environment, 2016, 542: 427-434
[27] Brandon A M, El Abbadi S H, Ibekwe U A, et al. Fate of hexabromocyclododecane (HBCD), A common flame retardant, In polystyrene-degrading mealworms: Elevated HBCD levels in egested polymer but no bioaccumulation [J]. Environmental Science & Technology, 2020, 54(1): 364-371
[28] Yu G, Bu Q W, Cao Z G, et al. Brominated flame retardants (BFRs): A review on environmental contamination in China [J]. Chemosphere, 2016, 150: 479-490
[29] Wu T, Huang H L, Zhang S Z. Accumulation and phytotoxicity of technical hexabromocyclododecane in maize [J]. Journal of Environmental Sciences, 2016, 42: 97-104
[30] Huang H L, Wang D, Wen B, et al. Roles of maize cytochrome P450 (CYP) enzymes in stereo-selective metabolism of hexabromocyclododecanes (HBCDs) as evidenced by in vitro degradation, biological response and in silico studies [J]. Science of the Total Environment, 2019, 656: 364-372
[31] Zhang Y W, Sun H W, Liu F, et al. Hexabromocyclododecanes in limnic and marine organisms and terrestrial plants from Tianjin, China: Diastereomer- and enantiomer-specific profiles, biomagnification, and human exposure [J]. Chemosphere, 2013, 93(8): 1561-1568
[32] Jo H, Son M H, Seo S H, et al. Matrix-specific distribution and diastereomeric profiles of hexabromocyclododecane (HBCD) in a multimedia environment: Air, soil, sludge, sediment, and fish [J]. Environmental Pollution, 2017, 226: 515-522
[33] Huang H L, Wang D, Wan W N, et al. Hexabromocyclododecanes in soils and plants from a plastic waste treatment area in North China: Occurrence, diastereomer- and enantiomer-specific profiles, and metabolization [J]. Environmental Science and Pollution Research International, 2017, 24(27): 21625-21635
[34] Steven M, Colin R A, Bart N Z, et al. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea Estuaries and aquatic food webs [J]. Environmental Science & Technology, 2004, 38(21): 5497-5504
[35] Xian Q M, Ramu K, Isobe T, et al. Levels and body distribution of polybrominated diphenyl ethers (PBDEs) and hexabromocyclododecanes (HBCDs) in freshwater fishes from the Yangtze River, China [J]. Chemosphere, 2008, 71(2): 268-276
[36] Eljarrat E, de la Cal A, Raldua D, et al. Occurrence and bioavailability of polybrominated diphenyl ethers and hexabromocyclododecane in sediment and fish from the Cinca River, a tributary of the Ebro River (Spain) [J]. Environmental Science & Technology, 2004, 38(9): 2603-2608
[37] Jeong G H, Hwang N R, Hwang E H, et al. Hexabromocyclododecanes in crucian carp and sediment from the major rivers in Korea [J]. The Science of the Total Environment, 2014, 470-471: 1471-1478
[38] Zhang Y Q, Lu Y L, Wang P, et al. Biomagnification of hexabromocyclododecane (HBCD) in a coastal ecosystem near a large producer in China: Human exposure implication through food web transfer [J]. Science of the Total Environment, 2018, 624: 1213-1220
[39] Szabo D T, Diliberto J J, Hakk H, et al. Toxicokinetics of the flame retardant hexabromocyclododecane gamma: Effect of dose, timing, route, repeated exposure, and metabolism [J]. Toxicological Sciences, 2010, 117(2): 282-293