亚硝酸盐在天然水体中普遍存在,通常作为氨氮转化成硝酸盐过程中的中间产物,是环境中的一种常见污染物[1]。人类亚硝酸盐的来源主要是饮用水和食物,一旦机体摄入过量的亚硝酸盐,它将与血红蛋白结合,形成高铁血红蛋白,随后削弱血液携带氧气的能力,导致组织缺氧,引发急性中毒甚至癌变[1-3]。同时,有研究显示亚硝酸盐暴露会造成机体多种器官组织的毒性作用。其中,对脑神经系统影响的研究发现亚硝酸盐暴露会导致精神萎靡、反应迟钝、神志不清、嗜睡以及学习记忆能力降低等,并可能与人体先天畸形密切相关[4-5]。在哺乳动物的研究中表明,大鼠经过连续15 d的亚硝酸钠给药出现了严重的焦虑和抑郁行为[6];小鼠经亚硝酸盐插管3个月后表现出突触丧失和学习记忆能力下降的情况[7]。另外,亚硝酸盐暴露还能抑制小鼠的成体神经发生[8]。近年的研究还显示,亲代孕期小鼠经过亚硝酸盐暴露后还能够引起子代小鼠的学习能力下降[9]。
在水产养殖业中,亚硝酸盐的累积同样会对养殖品种造成类似的神经功能障碍。据报道,红鳍东方鲀经亚硝酸盐暴露后表现出游动缓慢,反应迟钝,甚至鱼体昏迷的神经中毒症状[10]。在印度主要鲤科鱼类(Catla catla, Labeo rohita和Cirrhinus mrigala)中的研究发现,随着亚硝酸盐暴露浓度的增加,鱼脑中乙酰胆碱酯酶(acetylcholinesterase, AChE)的活性显著降低[11]。Jannat等[12]研究发现,亚硝酸盐可以通过下调多巴胺能神经元中酪氨酸羟化酶(tyrosine hydroxylase, TH)的表达而降低斑马鱼胚胎和幼鱼的运动活动。García-Jaramillo等[13]研究也发现,成年斑马鱼在暴露于19.5 mg·L-1的亚硝酸钠4周后,表现出了轻微的焦虑行为,并且执行功能和学习能力下降。越来越多的证据表明,亚硝酸盐具有神经毒性作用,然而其相关致神经毒性机制的研究仍很匮乏。根据水质调查结果,在夏季的一些养殖池塘中亚硝酸盐的含量可高达15 mg·L-1,甚至在冬季也可以达到0.5 mg·L-1[14]。鱼类终生生活在水体中,因此慢性亚硝酸盐暴露对鱼神经系统的不良影响不容忽视。
本研究为了探究亚硝酸盐慢性暴露对斑马鱼神经系统的影响以及其可能的作用机制,以雄性斑马鱼为实验动物,选取0、0.2、2和20 mg·L-1亚硝酸盐作为暴露浓度,开展一个为期30 d的慢性暴露实验。实验目的包括:(1)观察不同浓度亚硝酸盐暴露30 d后斑马鱼神经行为变化;(2)测定不同浓度亚硝酸盐慢性暴露后脑组织结构、神经递质系统相关指标以及氧化-抗氧化系统相关参数变化,并试图阐明亚硝酸盐诱导斑马鱼神经毒性的分子机制。
1 材料与方法(Materials and methods)
1.1 试剂
研究中使用的NaNO2为分析纯,购自上海国药集团化学试剂有限公司。实验前,将NaNO2用超纯水溶解制成10 g·L-1的亚硝酸盐母液并密封保存在4 ℃冰箱中。正式实验时,按照目标暴露浓度0.2、2和20 mg·L-1对母液进行稀释。实验中所用的MS-222购自美国Sigma-Aldrich公司;RNAiso Plus试剂盒,Prime ScriptTMRT Master Mix试剂盒购自TaKaRa公司;iQTM SYBR® Green Supermix购自美国Bio-Rad公司。多巴胺(dopamine, DA)、乙酰胆碱(acetylcholine, ACh)、AChE、丙二醛(malondialdehyde, MDA)、总抗氧化能力(total antioxidant capacity, T-AOC)、超氧化物歧化酶(superoxide dismutase, SOD)、总蛋白浓度以及高铁血红蛋白含量检测试剂盒均购自南京建成生物工程研究所,其他常规试剂药品为国产分析纯。
1.2 斑马鱼的养殖暴露
实验用斑马鱼购自中国科学院水生生物研究所,为同一批繁殖的3月龄健康雄性成年斑马鱼(AB品系)。正式试验前,将斑马鱼在全自动循环水养殖系统中进行适应性饲养14 d,循环水养殖系统的水质参数保持在水温(28±0.5) ℃,溶氧7.0 mg·L-1左右,光周期为14 h∶10 h(光照∶黑暗)。在适应性养殖期间,每天分别用新鲜孵化的丰年虫饱食投喂2次,取样前24 h停止投喂。
根据半致死剂量和先前的研究报道[15-16],本实验亚硝酸盐的暴露浓度设置为0、0.2、2和20 mg·L-1。实验中,每个浓度有3个平行缸,每个平行缸有鱼20尾,整个暴露实验持续30 d。为了保持亚硝酸盐浓度稳定且相对接近于设定浓度,每3 d用含有相应浓度的亚硝酸盐溶液替换鱼缸中1/3的旧暴露溶液,并用分光光度法测定各处理组缸内亚硝酸盐的实际浓度。整个实验期间,各亚硝酸盐处理组的实测浓度与设定浓度相差不到20%,这符合《化学品 鱼类延长毒性14天试验》(GB/T 21808—2008) [17]的标准。暴露结束后,分别进行组织样品的采集和行为学检测。
1.3 行为学检测1.3.1 运动能力检测
参照Salahinejad等[18]提供的方法,在斑马鱼为期30 d的亚硝酸盐暴露结束后,从每个处理的3个平行缸中随机挑选10条斑马鱼依次进行运动能力的检测。每次单独放一条鱼在如图1所示的鱼缸中,鱼缸被平均分为垂直方向的5段和水平方向的2段。然后用摄像机对斑马鱼的运动行为进行视频记录,并通过计算斑马鱼在4 min内穿越各段的总次数来评估斑马鱼的运动能力。
1.3.2 群体偏好行为检测
根据Salahinejad等[18]的方法再结合自身实际情况,本研究中群体偏好实验所用斑马鱼是在暴露期结束后,从每个处理的3个平行缸中随机挑选10条鱼与其他鱼群先进行48 h的隔离,隔离期间各处理组斑马鱼还是养殖在含有相应浓度亚硝酸盐的水体中,间隔期结束后正式开始实验。实验鱼和刺激鱼群分别被放置在2个独立的长方形实验缸中(图2)。其中一个标记为实验缸,在其外侧玻璃正面用线条标记均分为5个水平区域(每个区域7 cm宽)。另一个标记为刺激缸,实验缸被放置在刺激缸的左侧,刺激缸中事先放有3条雄性斑马鱼和3条雌性斑马鱼(同一批购买,未经任何处理的3月龄成年健康斑马鱼)。在本实验中,每条实验鱼(每个处理组有10个重复)先单独放入实验缸中适应4 min,在此期间,刺激缸中的鱼群与实验缸中的实验鱼被不透明的隔板所遮挡。适应期结束后,轻轻移开隔板,开始计时,并用摄像机视频记录4 min内每条实验鱼在实验缸中每个区域停留的时间,以实验鱼在离刺激鱼群最近的区域即1号区域停留的累积时间作为最后结果。
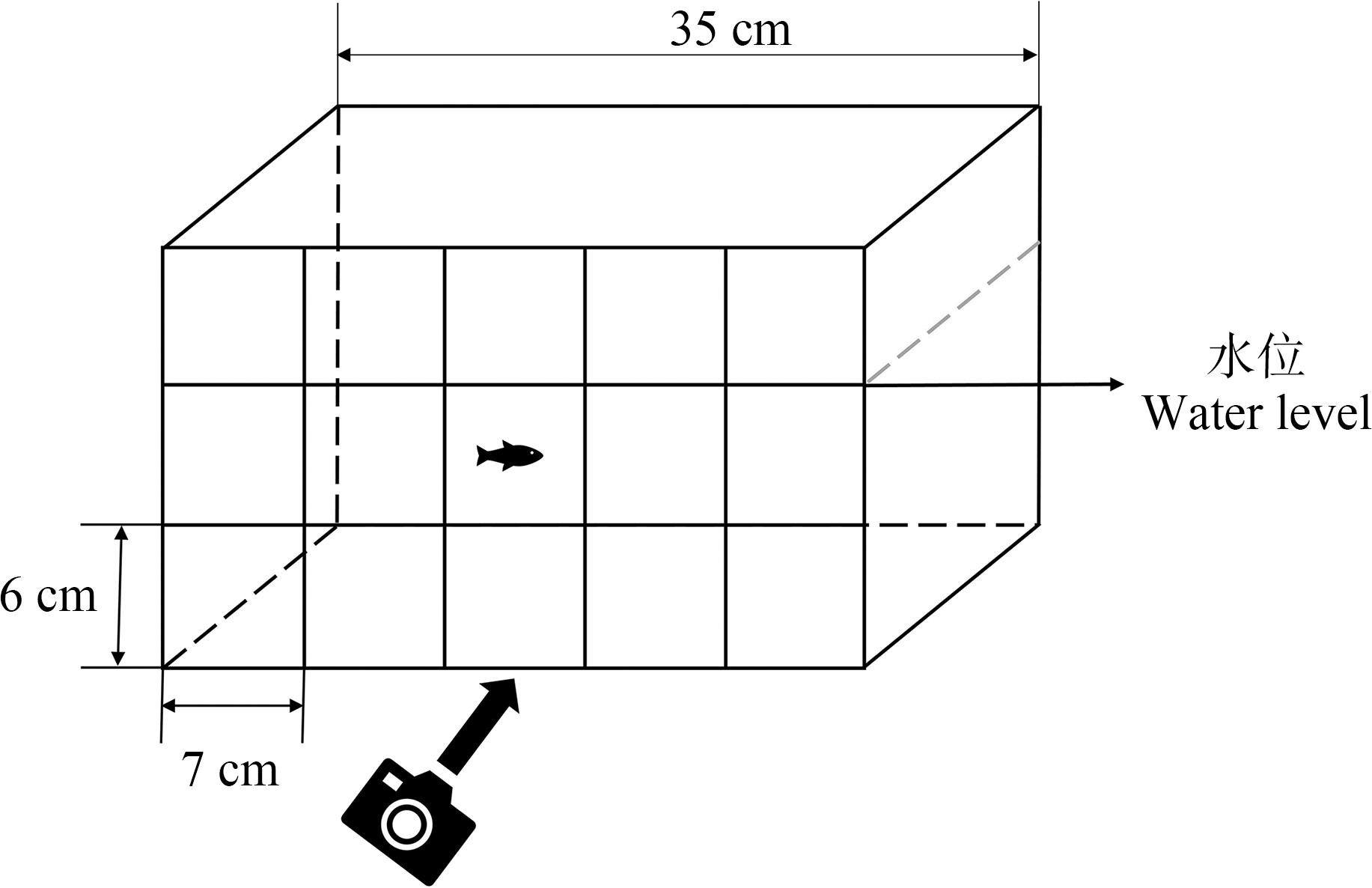
图1 测量斑马鱼运动能力的实验缸示意图
Fig. 1 Schematic diagram of the experimental tank used to measure the locomotor activity of zebrafish
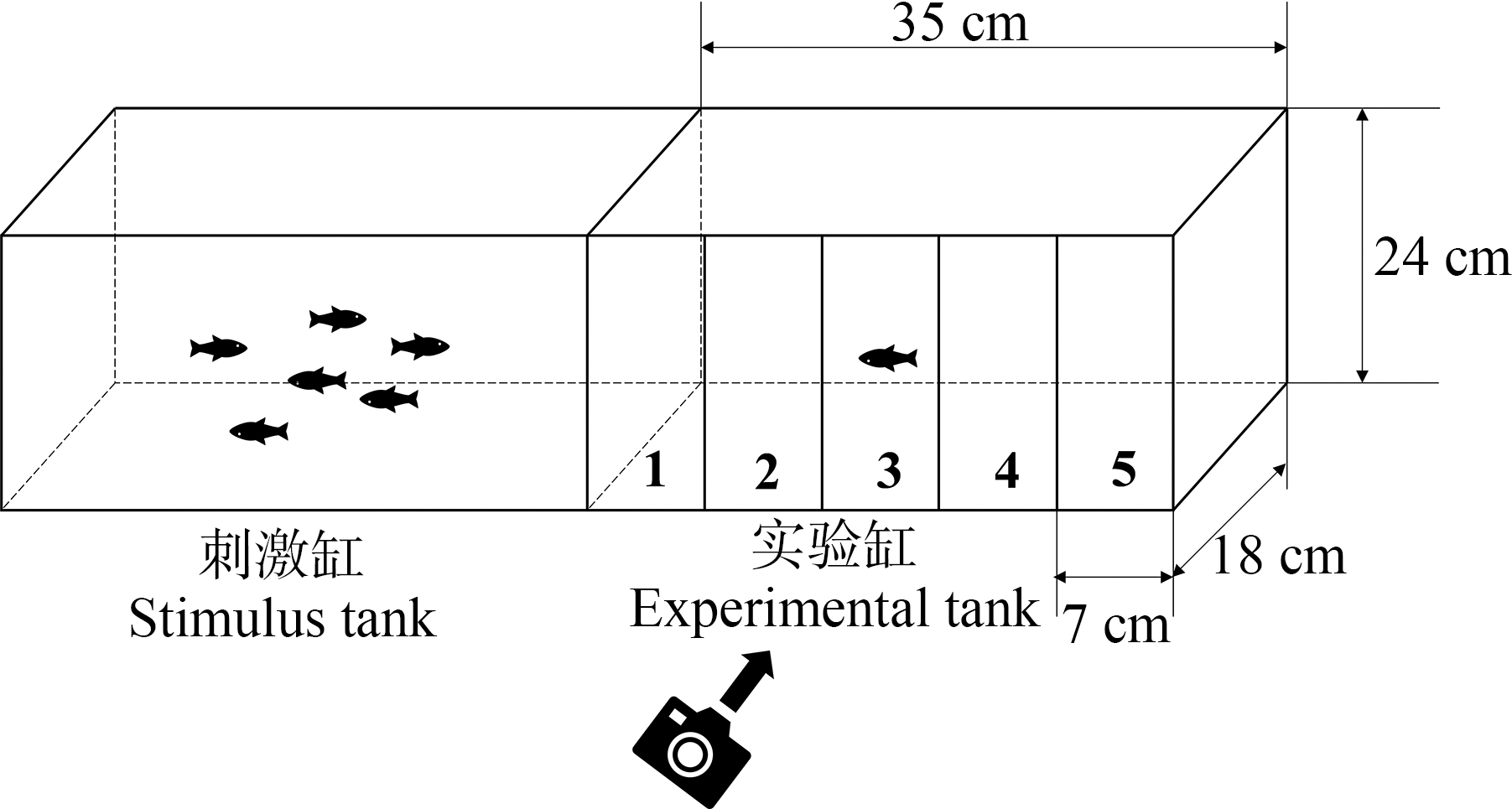
图2 测量斑马鱼群体偏好的实验缸示意图
Fig. 2 Schematic diagram of the experimental tank for measuring zebrafish group preference
1.3.3 学习记忆能力检测
T型水迷宫实验(T迷宫)主要是用来评价斑马鱼的学习记忆能力,本研究的T迷宫实验是参考文献[19-20]所用方法来进行的。T迷宫分为长臂和短臂两部分,由透明亚克力玻璃板制成,具体尺寸如图3所示。在整个实验过程中,T迷宫中的水深为10 cm,水温保持在28 ℃左右。短臂两端区域中的一个被用作为食物奖励(enriched chamber,EC)区,实验期间,在EC区滴入少量丰年虾幼虫,为斑马鱼提供食物奖励。试验前,从每个处理的3个重复缸中随机挑选10条鱼进行T迷宫环境适应;训练期间,每条斑马鱼都被单独放置在T迷宫中进行训练;训练结束后,检测斑马鱼的学习记忆能力,用摄像机记录斑马鱼的行为用于后续分析。实验过程中,斑马鱼只是在T迷宫进行适应和训练的时候是正常养殖水,其余时间还是养殖在含有相应浓度亚硝酸盐的水中。
具体方法如下:
(1)为期4 d的适应阶段。暴露期结束后,让斑马鱼在T迷宫中进行自由探索以适应新环境。适应期第1天,从对照组中随机挑选10条斑马鱼,一次性放入T迷宫中,让其自由探索T迷宫1 h;适应期第2天,将前1天同样的10条鱼分2次,每次放5条鱼进入T迷宫中探索30 min;适应期第3天,将第1天的10条鱼分5次,每次放2条鱼进入T迷宫中探索10 min;适应期最后1天,将第1天中的10条鱼每次单独放1条鱼进入T迷宫中并让其自由游动4 min。剩下的各亚硝酸盐处理组也是同样的操作。
(2)为期4 d的训练试验。训练试验旨在通过食物刺激,训练斑马鱼出现在食物奖励区,并给予食物奖励,培养斑马鱼的联想学习记忆能力。在训练试验过程中,每个处理组中经过适应期的斑马鱼将被单独放在T迷宫的起始区域,30 s后拿开隔板释放,让斑马鱼在T迷宫中探索4 min,期间在EC区滴入少量丰年虾幼虫进行食物奖励以诱导斑马鱼进入EC区。整个训练期间,如果斑马鱼在4 min的测试时间内没有出现在EC区,它将被引导到EC区,并让它在其中停留1 min,连续4 d,每天1次。
(3)训练试验结束的第2天进行记忆能力测试试验,以评估斑马鱼的学习记忆能力。所有处理组中经过前2个阶段的斑马鱼每次被单独放入T型迷宫的起始区域,30 s后拿开隔板,摄像机记录斑马鱼在T迷宫中的行为,在此阶段,不在EC区以食物作为奖励,让其在T迷宫中自由游动,计时4 min。计算斑马鱼在T迷宫中的潜伏期时长以及在EC区的累计停留时间,潜伏期定义为斑马鱼从起始区域第1次游到EC区所需的时间。
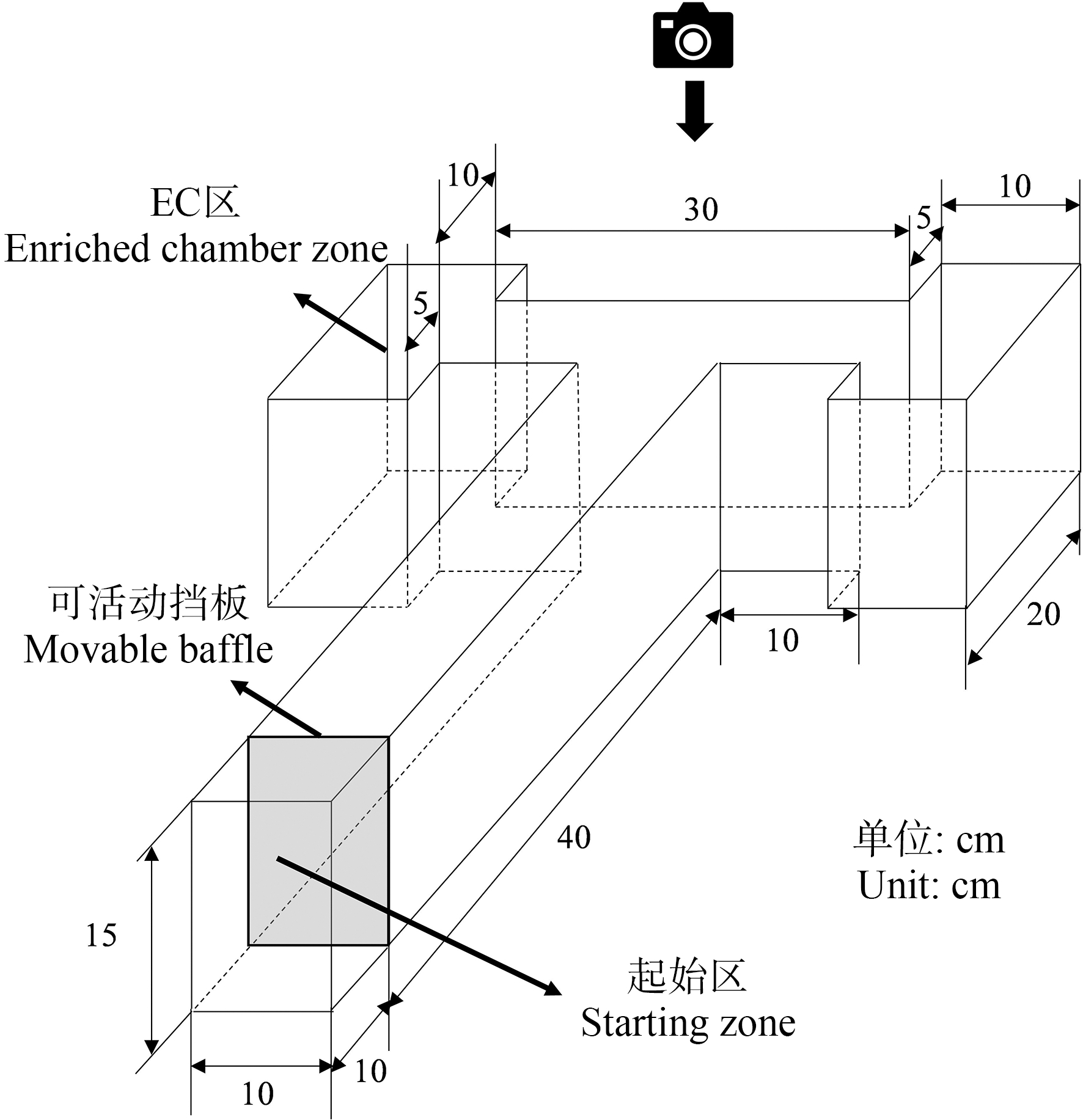
图3 T迷宫实验缸
Fig. 3 T-maze apparatus experiment tank
1.4 组织样品采集
暴露期结束后,从每个处理的3个平行缸随机选取斑马鱼进行组织采样,使用0.02%的MS-222对采样鱼进行麻醉。在每个处理组中,每10条鱼的血液样本混样制备成抗凝全血并作为1个重复,共3个生物学重复,放于-20 ℃以下冰箱中储存,用于高铁血红蛋白含量的测定;每3条鱼的脑组织混样作为1个重复,共5个生物学重复,液氮速冻后储存在-80 ℃冰箱中以进行基因表达分析;每5条鱼的脑组织混样作为1个重复,共3个生物学重复,液氮速冻后储存在-80 ℃冰箱中用作生物化学分析;另各取3条鱼的脑组织放入10%中性福尔马林缓冲液中固定用于组织病理学的观察。
1.5 神经递质系统指标的检测
将采集的脑组织一部分按照ACh检测试剂盒说明书的组织样本处理要求分离出上清液用于ACh的检测;另一部分脑组织按照1∶9(m∶V)加入预冷的0.9%氯化钠溶液,冰浴匀浆,然后在4 ℃下以2 500~3 000 r·min-1离心10 min,分离出上清液用于AChE和DA的测定。采用酶联免疫吸附法进行DA的测定,比色法进行ACh和AChE的测定,严格按照试剂盒(南京建成生物工程研究所)说明书进行,在酶标仪上测定吸光度值,记录并处理数据。匀浆中的总蛋白含量采用二辛可宁酸(bicinchoninic acid, BCA)试剂盒进行测定。
1.6 高铁血红蛋白的检测
将放于-20 ℃以下冰箱中储存备用的抗凝全血取出,按照购自南京建成生物工程研究所高铁血红蛋白测试盒说明书的操作步骤进行,在酶标仪上测定相应波长下的吸光度值,记录并处理数据。
1.7 氧化-抗氧化系统指标检测
将脑组织样品按照1∶9(m∶V)加入预冷的0.9%氯化钠溶液,冰浴匀浆,然后在4 ℃下以3 000 r·min-1离心10 min,分离出上清液待测。脑组织中MDA的含量,T-AOC和SOD的活性检测均按照试剂盒(南京建成生物工程研究所)说明书进行,在酶标仪上测定吸光度值,记录并处理数据。匀浆中的蛋白质含量通过BCA试剂盒进行测定。
1.8 光镜样品制备及观察
分离斑马鱼的脑组织,立即放入10%中性福尔马林溶液中固定24~48 h,待固定液彻底渗透后换成70%的酒精保存。随后按常规梯度酒精进行脱水,二甲苯透明,石蜡包埋,Leica RM2235半自动切片机(Leica公司,德国)连续切片,切片厚度保持5 μm,摊片结束后烤干,进行苏木精-伊红(H&E)染色,最后用中性树胶封片,自然干燥,并在Nikon H600L显微镜(Nikon公司,日本)下观察并拍照记录。应用图像分析系统测量病变区域面积[21],病变区域占比(%)以神经细胞崩解区域面积或血栓的面积占总小球周灰质带的百分比来确定。
1.9 基因表达的测定
用RNAiso Plus试剂盒(TakaRa,大连,中国)提取脑组织总RNA,使用NanoDrop 2000c(ThermoScientific,Wilmington,DE,美国)测定总RNA浓度。取1 μg总RNA,用PrimeScript® RT Reagents反转录试剂盒合成cDNA,并将得到的cDNA保存在-20 ℃冰箱备用。qPCR引物用Primer Premier 5.0软件设计,由武汉擎科生物技术有限公司合成。采用Bio-Rad iQ5 Multicolor实时定量PCR仪,参照TaKaRa公司的PrimeScriptTMRT Master Mix试剂盒介绍的方法进行qRT-PCR,荧光染料为SYBR Green Ⅰ。PCR反应体系总量20 μL,包括18 μL混合试剂和2 μL cDNA样品。PCR反应条件为:95 ℃预变性5 min,随后95 ℃变性10 s,58 ℃退火15 s,72 ℃延伸10 s,共40个循环。本研究以gapdh作内参,采用2-ΔΔCt法分析数据[22],计算不同处理组中目的基因的相对表达量。qPCR检测的基因名称、GenBank登录号、引物序列、扩增产物长度及扩增效率如表1所示。
表1 实时荧光定量PCR 引物序列
Table 1 Sequences of primers used for qPCR

目的基因Target gene登录号Accession No.引物序列(5’~3’)Primer sequences (5’~3’)产物长度/bpProduct length/bp扩增效率/%Amplification efficiency/%gapdhNM_001115114F: CTGGTGACCCGTGCTGCTT15098R: TTTGCCGCCTTCTGCCTTACu/ZnsodNM_131294.1F: GTCCGCACTTCAACCCTCA19992R: CCCAAGTCATCCTCCTTCTCATMnsod NM_199976.1F: GCTTGGGATAGATGTCTGGG11994R: CTTGGAAACGCTCGCTGAacheNM_131846F: CCCTCCAGTGGGTACAAGAA19895R: GGGCCTCATCAAAGGTAACAchrna4bNM_001048063.1F: TCATCCCACTGATTGGCGAG16894R: TGAACAGGTAACGAGGCACCchrna7NM_201219.2F: CCTGCCAATACTTACCGCCA112101R: CCATACGTCCAGGAGCCAAAthNM_131149.1F: TTGATCGAGGATGCGCGTAA8395R: TCAAACACGATCTGCTCGCTdatNM_131755.1F: ACTTTCTGCTGTCCGTCATC88105R: GCTCCTCCGCCATTCTTGdrd1bNM_001135976.2F: ACGCTGTCCATCCTTATCTC13599R: TGTCCGATTAAGGCTGGAGdrd4aNM_001012616.3F: GCCTCTTTCCCATCTCACAG281107R: CTCAGACACACCAGCACGTTdrd4bNM_001012618.1F: AGACCCCAGTGAATGCAAAC150104R: AGTTTGGCTTTGCGTGTTTCdrd3NM_183067.1F: ATCAGTATCGACAGGTATACAGC13799R: CCAAACAGTAGAGGGCAGGgad1bNM_194419F: AACTCAGGCGATTGTTGCAT109103R: TGAGGACATTTCCAGCCTTCglsaNM_001045044.1F: AGGCCATGCTGAGGTTG194101R: CTGCCGTCTCTTTTTCGCTgat1NM_001007362.1F: ATGCTGTTTATCCTGTTCATCCG19396R: TGTTGAAGGGGTTGTAGCTCCgabra1NM_001077326.1F: TCAGGCAGAGCTGGAAGGAT11798R: TGCCGTTGTGGAAGAACGThtr1aaNM_001123321.1F: TTCTACATCCCGCTCATCCTCA18097R: CCTCCAAGTTTTACCCACCTCTChtr1abNM_001145766.1F: AAACACCGAGGCGAAGAGGAA9987R: GGCAGCCAACACAGAATGAAAGThtr1bNM_001128709F: GCTACGTCAACTCACTCATCAA10691R: TCCTATCGTCTGCAACATCTAAAhtr2aXM_684208F: TACGGTGGCTGGGAACATTTTAG18795R: GGGACACAGTGATGCAGGGAAA
1.10 统计学分析
统计分析使用Windows的SPSS 20.0进行,所有值均以“平均值±标准误(mean±SEM)”表示。应用单因素方差分析(one-way ANOVA)和邓肯检验(Duncan’s test)来比较处理组之间的统计学差异。检验前先验证数据的正态分布和方差齐性,显著性水平表示为P<0.05和P<0.01。作图使用Graphpad Prism.v 7.0软件。
2 结果(Results)
2.1 暴露期间斑马鱼死亡情况
暴露30 d后,不同处理组的斑马鱼累积死亡数量如表2所示。所有处理组的累积死亡率均低于5%。
表2 暴露于亚硝酸盐30 d的雄性斑马鱼的累积死亡数量
Table 2 Cumulative mortality of male zebrafish exposed to nitrite for 30 d

亚硝酸盐设定浓度/(mg·L-1)Nitrite nominal concentrations/(mg·L-1)死亡数量/条Mortality/(number of death)020.2123202
2.2 行为学实验结果
斑马鱼运动能力的检测结果显示,在2 mg·L-1和20 mg·L-1的亚硝酸盐暴露组中,斑马鱼在4 min内穿过各段的次数与对照组相比显著性下降(P<0.05)(图4(a))。群体偏好的行为检测结果显示,斑马鱼在1号区域停留的时间随着亚硝酸盐暴露浓度的升高而显著降低(P<0.05)(图4(b))。同时,斑马鱼在T迷宫中的潜伏期时长随着亚硝酸盐暴露浓度的升高而显著上升,20 mg·L-1的亚硝酸盐暴露组与对照组相比更是上升了17倍(图4(c))(P<0.05)。在各亚硝酸盐暴露组中,斑马鱼在EC区的累积停留时间与对照组相比下降趋势不明显,统计学结果无显著性(P>0.05)(图4(d))。
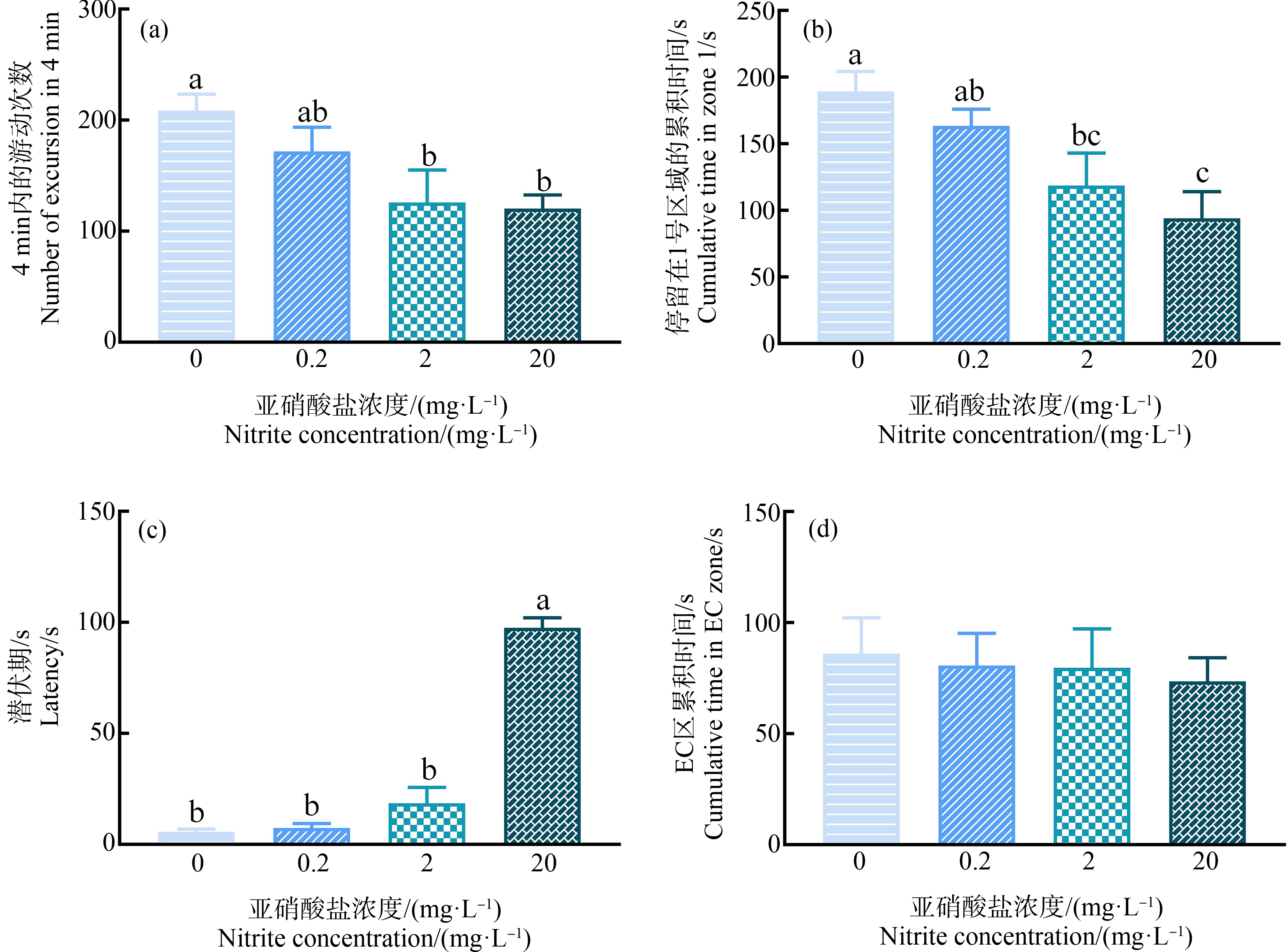
图4 暴露于0、0.2、2和20 mg·L-1亚硝酸盐30 d后斑马鱼行为学实验的结果
注:(a)运动能力(n=10);(b)群体偏好(n=10);(c)T迷宫中的潜伏期(n=10);(d)T迷宫EC区累积停留时间(n=10)。
Fig. 4 The results of zebrafish behavior experiments after exposure to 0, 0.2, 2 and 20 mg·L-1 nitrite for 30 d
Note: (a) Locomotor activity (n=10); (b) Social preference (n=10); (c) Latency in T-maze (n=10); (d) Cumulative time in EC zone of T-maze (n=10).
2.3 神经递质系统指标
2.3.1 胆碱能系统
图5显示了斑马鱼脑中胆碱能系统相关指标的结果变化。与对照组相比,胆碱能系统中ACh的含量和AChE的酶活变化情况不明显(图5(a)和5(b)),但是乙酰胆碱酯酶基因(ache)和乙酰胆碱受体基因(chrna4b和chrna7)mRNA转录水平在高浓度亚硝酸盐暴露组(2 mg·L-1和20 mg·L-1)中被显著抑制(P<0.05)(图5(c))。

图5 暴露于0、0.2、2和20 mg·L-1亚硝酸盐30 d后斑马鱼脑中胆碱能系统相关指标结果
注:(a)乙酰胆碱含量(n=3);(b)乙酰胆碱酯酶活性(n=3);(c)ache, chrna4b和chrna7的转录水平(n=5)。
Fig. 5 Results of the cholinergic system-related indicators in zebrafish brain after exposure to 0, 0.2, 2 and 20 mg·L-1 nitrite for 30 d
Note: (a) Acetylcholine content (n=3); (b) Acetylcholinesterase activity (n=3); (c) Transcription level of ache, chrna4b and chrna7 (n=5).
2.3.2 多巴胺能系统
如图6所示,0.2 mg·L-1和2 mg·L-1亚硝酸盐暴露均显著降低了脑中多巴胺的含量(P<0.05)(图6(a))。与对照组相比,多巴胺转运体基因dat的表达水平在20 mg·L-1亚硝酸盐暴露组中显著下调(P<0.05),多巴胺受体基因drd1b、drd4a的表达水平在2 mg·L-1和20 mg·L-1亚硝酸盐暴露组中也都出现了显著性下调(P<0.05),而基因th、drd3和drd4b的表达水平在亚硝酸盐的暴露下变化不显著(P>0.05)(图6(b))。

图6 暴露于0、0.2、2和20 mg·L-1亚硝酸盐30 d后斑马鱼脑中多巴胺能系统相关指标的结果
注:(a)多巴胺含量(n=3);(b)th、dat、drd1b、drd3、drd4a和drd4b的转录水平(n=5)。
Fig. 6 Results of the dopaminergic system-related indicators in zebrafish brain after exposure to 0, 0.2, 2 and 20 mg·L-1 nitrite for 30 d
Note: (a) Dopamine content (n=3); (b) Transcription level of th, dat, drd1b, drd3, drd4a and drd4b (n=5).
2.3.3 GABA系统和5-羟色胺系统
与对照组相比,γ-氨基丁酸A受体基因(gabra1)和转运蛋白基因(gat1)的mRNA表达水平在2 mg·L-1和20 mg·L-1亚硝酸盐处理组显著下调(P<0.05),但gad1b和glsa的表达水平显示无统计学显著差异(P>0.05)(图7(a))。相应的,5-羟色胺家族的受体基因htr1aa、htr1ab和htr2a的转录水平随着亚硝酸盐浓度的升高而出现显著性下调(P<0.05),htr1b的转录水平则无显著性变化(P>0.05)(图7(b))。

图7 暴露于0、0.2、2和20 mg·L-1亚硝酸盐30 d后斑马鱼脑中γ-氨基丁酸(GABA)系统和5-羟色胺(5-HT)系统相关基因的mRNA表达水平
注:(a)GABA系统(n=5);(b)5-羟色胺系统(n=5)。
Fig. 7 The mRNA expression levels of γ-aminobutyric acid (GABA) system and 5-hydroxytryptamine (5-HT) system related genes in zebrafish brain after exposure to 0, 0.2, 2, and 20 mg·L-1 nitrite for 30 d
Note: (a) GABA system (n=5); (b) 5-HT system (n=5).
2.4 高铁血红蛋白的含量
与对照组相比,高铁血红蛋白的含量在2 mg·L-1亚硝酸盐暴露组中出现显著性升高(P<0.05),在20 mg·L-1亚硝酸盐暴露组中显著性上升(P<0.01),而在0.2 mg·L-1的亚硝酸盐暴露组中没有明显变化(P>0.05)(图8)。

图8 暴露于0、0.2、2和20 mg·L-1亚硝酸盐30 d后斑马鱼血浆中高铁血红蛋白的含量
注:n=3。
Fig. 8 The contents of methemoglobin in zebrafish after 30 d of exposure to 0, 0.2, 2 and 20 mg·L-1 nitrite
Note: n=3.
2.5 氧化-抗氧化系统参数
如图9(a)所示,与对照组相比,亚硝酸盐处理MDA的含量呈剂量-依赖性变化,在2 mg·L-1和20 mg·L-1亚硝酸盐暴露组中分别增加了149%和224%(P<0.05)。与此同时,总抗氧化能力T-AOC和SOD的活性在亚硝酸盐暴露组中则出现了显著性下降(P<0.05)(图9(b))和9(c))。SOD相关基因CuZnsod和Mnsod的mRNA表达水平在2 mg·L-1和20 mg·L-1的亚硝酸盐暴露组中均显著下调(P<0.05)(图9(d))。

图9 暴露于0、0.2、2和20 mg·L-1亚硝酸盐30 d后斑马鱼脑中丙二醛(MDA)的含量和抗氧化系统参数及其相关基因的mRNA表达水平
注:(a)丙二醛含量(n=3);(b)总抗氧化能力(n=3);(c)超氧化物歧化酶活性(n=3);(d)Cu/Znsod和Mnsod的mRNA表达水平(n=5)。
Fig. 9 Malondialdehyde (MDA) content and parameters of the antioxidant system and mRNA expression levels of its related genes in zebrafish brain after 30 d of exposure to 0, 0.2, 2 and 20 mg·L-1 nitrite
Note: (a) MDA content (n=3); (b) Total antioxidant capacity (n=3); (c) Superoxide dismutase activity (n=3); (d) mRNA expression levels of Cu/Znsod and Mnsod (n=5).
2.6 组织病理学结果
如图10所示,通过显微镜观察发现,对照组斑马鱼中脑组织切片各神经层细胞结构正常完整,其小球周灰质带细胞分布丰富紧密(图10(a))。经过30 d的亚硝酸盐暴露之后,0.2 mg·L-1亚硝酸盐暴露组中脑组织未见明显的病理损伤(图10(b))。相比之下,2 mg·L-1和20 mg·L-1亚硝酸盐暴露组中观察到鱼脑小球周灰质带大量神经细胞核的丢失以及血栓的出现(图10(c)和10(d))。病变区域面积定量化结果也显示,与对照组相比,2 mg·L-1和20 mg·L-1亚硝酸盐暴露组对斑马鱼中脑造成明显的结构损伤(图10(e))和10(f))。

图10 亚硝酸盐慢性暴露30 d后斑马鱼中脑组织H&E染色病理切片
注:(a)对照组;(b)0.2 mg·L-1亚硝酸盐暴露组;(c)2 mg·L-1亚硝酸盐暴露组;(d)20 mg·L-1亚硝酸盐暴露组;(e)神经细胞崩解区域占小球周灰质带面积的比例(n=3);(f)血栓面积占小球周灰质带面积的比例(n=3);SM表示边缘层;SC表示中央层;PGZ表示小球周灰质带;红色箭头,细胞崩解形成空网状;蓝色箭头,血栓。
Fig. 10 H&E-stained pathological section of zebrafish brain tissue after 30 d of exposure to nitrite
Note: (a) Control group; (b) 0.2 mg·L-1 nitrite group; (c) 2 mg·L-1 nitrite group; (d) 20 mg·L-1 nitrite group; (e) The relative areas for dissolved cells in periglomerular gray zone (n=3); (f) The relative areas for thrombi in periglomerular gray zone (n=3); SM means stratum marginale; SC means stratum centrale; PGZ means periglomerular gray zone; red arrow, dissolved cells; blue arrow, thrombus.
2.7 最低可观察效应浓度(LOEC)
综合单因素方差分析结果可得出:亚硝酸盐对斑马鱼脑神经递质、行为紊乱及氧化应激的30 d最低可观察效应浓度(LOEC)为0.2 mg·L-1。
3 讨论(Discussion)
众所周知,亚硝酸盐可以在血液中累积并将血红蛋白会氧化成高铁血红蛋白,降低红细胞携氧能力,致使组织器官缺氧[23]。本研究中血液高铁血红蛋白含量随着亚硝酸盐暴露浓度的升高而显著增加也证实了这一点。与此同时,有研究表明,缺氧会触发鱼体内氧化应激的发生并产生大量活性氧(reactive oxygen species, ROS)导致脂质过氧化[24],而MDA作为脂质过氧化的标志性产物在本研究中随着亚硝酸盐暴露浓度升高呈现浓度依赖性增加,进一步证实亚硝酸盐诱导产生了氧化应激。类似地,大鼠皮下注射亚硝酸钠3周后检测发现大脑皮层和中脑中MDA水平显著高于对照组[25]。此外,T-AOC代表了所有抗氧化剂的一个累积效应,与几种抗氧化剂的简单相加相比,它提供了一个综合指数来进行评估[26]。在此基础上,检测T-AOC和SOD的水平可以从整体到细节指示机体的抗氧化状态。在我们的研究中,斑马鱼脑内T-AOC降低、SOD活性的下降以及Cu/Znsod、Mnsod基因表达水平的下调也表明亚硝酸盐暴露导致的氧化应激破坏了抗氧化系统与ROS的内源性平衡,减弱了斑马鱼大脑抗氧化能力,而氧化应激长期以来一直被认为是动物神经系统疾病和认知能力下降的关键驱动因素之一[27-28]。
对于成年斑马鱼来说,中脑是运动必不可少的部分,视顶盖在中脑中占比较高且视觉信息都聚集在此,并且视觉信息输入对于斑马鱼的捕食、社交等神经活动具有重要作用[29-30]。本次研究我们采用H&E染色的方法来探索亚硝酸盐对斑马鱼中脑组织结构的影响。研究结果显示,随着亚硝酸盐暴露浓度的升高,中脑小球周灰质带神经细胞数量逐渐崩解降低,并且在20 mg·L-1的亚硝酸盐暴露组中观察到血栓的出现。血栓的形成使脑血管发生阻塞,导致相应供血区的脑组织缺血、坏死,同时会影响运动和语言,而血栓的形成和缺氧密切相关[31]。有研究发现,经苯肼(phenylhydrazine, PHZ)诱导形成血栓的斑马鱼胚胎体内氧化应激和脂质过氧化水平增加[32]。
由于神经细胞非常敏感,且代偿能力比其他细胞弱,一旦受损会导致一系列的神经毒性症状。例如激光烧蚀斑马鱼的脑组织会影响其逃逸行为[33]。辐射也会损伤斑马鱼的大脑,导致神经元的损伤,并最终引起行为改变[34]。本实验中,随着亚硝酸盐浓度的升高斑马鱼运动能力显著下降,可能就是由于中脑受损而导致的运动行为异常。此外,在群体偏好行为测试中,本研究还发现暴露于2 mg·L-1和20 mg·L-1亚硝酸盐组斑马鱼在1号区域停留的时间显著降低,表明亚硝酸盐暴露导致了斑马鱼的对同类鱼群聚集的倾向性降低。群聚行为是许多小型鱼类的一种社会行为,对它们寻找食物和配对生殖有很大益处,而且还能避免单独被捕食的危险[35]。研究显示,斑马鱼具有明显且常见的群聚行为,另外,在年龄大的群体中发现群聚行为也更强[36-37]。在本研究中,斑马鱼对同类鱼群聚集的倾向降低可能与斑马鱼的视觉信息输入受损再加上斑马鱼的运动能力下降有关。为了进一步测定斑马鱼的认知功能,本实验让斑马鱼在T迷宫中探索,当到达EC区时给予食物奖励以形成学习和记忆[38-39]。通过T迷宫检测发现,斑马鱼在2 mg·L-1和20 mg·L-1亚硝酸盐处理组中第一次到达EC区的时间即潜伏期要显著长于对照组,而斑马鱼在EC区的停留时间总体呈下降趋势,表明斑马鱼在记忆食物出现位置的过程中受到了视觉损伤的干扰,证明斑马鱼的学习记忆能力也受到了亚硝酸盐的毒性影响。与此类似的,García-Jaramillo等[13]发现斑马鱼经过亚硝酸钠暴露后,其学习能力有下降的现象。
神经递质水平与机体的各项生理活动息息相关,负责各神经元间的信息传递,常见的有DA、Ach、GABA、5-HT和谷氨酸等。目前已经有大量证据表明,DA与运动、摄食、学习记忆等认知功能有重要联系[40]。近来也有研究指出,DA与帕金森病有关联[41]。此外,胆碱能系统中ACh对运动和认知功能也有着关键性作用[42-43]。本次研究测定了斑马鱼脑中DA和ACh的神经递质水平以及能够调节ACh信息传递活动的AChE活性来作为斑马鱼神经行为变化的进一步证据。结果表明,经过30 d的亚硝酸盐暴露后,神经递质DA的水平显著下降,与DA代谢相关基因(dat、drd1b和drd4a)的mRNA表达水平也显著下调,表明慢性亚硝酸盐通过破坏DA的合成、运输和释放,妨碍了多巴胺能神经递质系统的正常运作。同时,虽然ACh水平和AChE活性变化不明显,但斑马鱼大脑中显著下调的胆碱能系统相关基因(ache、chrna4b和chrna7)表明亚硝酸盐也在一定程度上破坏了胆碱能系统的功能。我们还测定了GABA系统和5-羟色胺系统相关基因的mRNA表达水平来进一步研究亚硝酸盐诱导的神经毒性分子机制。其中,抑制性神经递质GABA系统中的gabra1和gat1以及5-羟色胺受体家族基因(htr1aa、htr1ab和htr2a)的转录水平在亚硝酸盐暴露后显著下调。GABA转运蛋白(GAT)位于神经元和星形胶质细胞的质膜上,可以使GABA失活或重新再被利用[44]。因此,本研究中gat1的下调可能会影响斑马鱼的GABA再摄取。GABAA受体α1(gabra1)是配体门控离子通道,在中枢神经系统多数抑制性突触传递中起着至关重要的作用[45]。在脊椎动物研究中发现,GABAAR介导了与进食行为相关的神经元活动[46],本研究中gabra1的下调可能提示了斑马鱼的摄食行为受到阻碍,进而影响到斑马鱼T迷宫中的学习行为。众所周知,5-HT在调节脊椎动物的运动输出中起重要作用[47]。也有研究表明,5-HT系统还可以通过与其他神经递质系统相互作用在涉及到学习和记忆能力、高水平的认知需求以及认知功能受损后的恢复中发挥重要作用[48-49]。本研究中5-HTlAR、5-HT2AR基因(htr1aa、htr1ab和htr2a)的转录水平下调提示,慢性亚硝酸盐的暴露通过干扰5-羟色胺受体的表达导致斑马鱼的运动以及学习和记忆能力受损。结合本研究中斑马鱼行为学实验的结果来看,或许可以提示我们,亚硝酸盐处理组中由于缺氧引起的大脑结构改变可能是导致斑马鱼神经行为异常和神经递质功能紊乱的病理原因。
综上所述,本研究的结果表明,环境浓度的亚硝酸盐慢性暴露导致缺氧引起大脑产生氧化应激,抗氧化能力下降,损伤脑部生理结构,最终造成神经递质系统功能紊乱以及斑马鱼的行为异常,且亚硝酸盐对斑马鱼脑神经递质、行为紊乱及氧化应激的30 d-LOEC为0.2 mg·L-1。
[1] Jensen F B. Nitrite disrupts multiple physiological functions in aquatic animals [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2003, 135(1): 9-24
[2] 邓熙, 林秋奇, 顾继光. 广州市饮用水源中硝酸盐亚硝酸盐含量与癌症死亡率联系[J]. 生态科学, 2004, 23(1): 38-41
Deng X, Lin Q Q, Gu J G. Correlation between concentration of nitrate, nitrite in drinking water source and cancer mortality for Guangzhou City [J]. Ecologic Science, 2004, 23(1): 38-41 (in Chinese)
[3] 易智勇, 左笑丛, 彭广泽, 等. 亚硝酸盐食物中毒的文献分析[J]. 中国公共卫生管理, 2006, 22(6): 524-527
[4] 李智文, 任爱国, 张乐, 等. 中国2003年出生缺陷高发区和低发区重大体表畸形患病率监测[J]. 中华流行病学杂志, 2005, 26(4): 252-257
Li Z W, Ren A G, Zhang L, et al. Prevalence of major external birth defects in high and low risk areas in China, 2003 [J]. Chinese Journal of Epidemiology, 2005, 26(4): 252-257 (in Chinese)
[5] 王东辉, 韩桂珍, 李鑫, 等. 亚硝酸钠中毒所致神经系统损害的治疗[J]. 吉林大学学报(医学版), 2004, 30(2): 168
[6] Ribeiro M C, Bezerra T D S, Soares A C, et al. Hippocampal and cerebellar histological changes and their behavioural repercussions caused by brain ischaemic hypoxia experimentally induced by sodium nitrite [J]. Behavioural Brain Research, 2017, 332: 223-232
[7] Chen Y F, Cui Z J, Wang L, et al. The impairment of learning and memory and synaptic loss in mouse after chronic nitrite exposure [J]. Environmental Toxicology, 2016, 31(12): 1720-1730
[8] 王久涛, 张伟, 安磊, 等. 亚硝酸盐中毒抑制小鼠成体神经发生[J]. 中国兽医学报, 2014, 34(4): 641-646
Wang J T, Zhang W, An L, et al. Nitrite poisoning inhibits the adult neurogenesis in mice [J]. Chinese Journal of Veterinary Science, 2014, 34(4): 641-646 (in Chinese)
[9] 李瑞玲, 陈永芳, 王颖, 等. 孕期亚硝酸盐暴露对子鼠视皮质突触改变的影响[J]. 解剖学报, 2015, 46(6): 729-736
Li R L, Chen Y F, Wang Y, et al. Synapse loss in visual cortex of mouse after prenatal nitrite exposure [J]. Acta Anatomica Sinica, 2015, 46(6): 729-736 (in Chinese)
[10] 汪家鑫, 张钊, 胡盼, 等. 亚硝酸氮对红鳍东方鲀的毒性效应[J]. 广东海洋大学学报, 2013, 33(6): 52-56
Wang J X, Zhang Z, Hu P, et al. Effect of nitrite on hepatic antioxidant enzymes and acute toxicity in juvenile Takifugu rubripe [J]. Journal of Guangdong Ocean University, 2013, 33(6): 52-56 (in Chinese)
[11] Das P C, Ayyappan S, Das B K, et al. Nitrite toxicity in Indian major carps: Sublethal effect on selected enzymes in fingerlings of Catla catla, Labeo rohita and Cirrhinus mrigala [J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology: CBP, 2004, 138(1): 3-10
[12] Jannat M, Fatimah R, Kishida M. Nitrate ![]() are endocrine disruptors to downregulate expression of tyrosine hydroxylase and motor behavior through conversion to nitric oxide in early development of zebrafish [J]. Biochemical and Biophysical Research Communications, 2014, 452(3): 608-613
are endocrine disruptors to downregulate expression of tyrosine hydroxylase and motor behavior through conversion to nitric oxide in early development of zebrafish [J]. Biochemical and Biophysical Research Communications, 2014, 452(3): 608-613
[13] García-Jaramillo M, Beaver L M, Truong L, et al. Nitrate and nitrite exposure leads to mild anxiogenic-like behavior and alters brain metabolomic profile in zebrafish [J]. PLoS One, 2020, 15(12): e0240070
[14] 高明辉, 马立保, 葛立安, 等. 亚硝酸盐在水生动物体内的吸收机制及蓄积的影响因素[J]. 南方水产, 2008, 4(4): 73-79
Gao M H, Ma L B, Ge L, et al. Nitrite uptake mechanism and the influencing factors of accumulation in aquatic animals [J]. South China Fisheries Science, 2008, 4(4): 73-79 (in Chinese)
[15] Kroupova H, Machova J, Svobodova Z. Nitrite influence on fish: A review [J]. Veterinární Medicína, 2012, 50(11): 461-471
[16] Voslá![]() á E, Pištěková V, Svobodová Z. Nitrite toxicity to Danio rerio: Effects of fish age and chloride concentrations [J]. Acta Veterinaria Brno, 2006, 75(1): 107-113
á E, Pištěková V, Svobodová Z. Nitrite toxicity to Danio rerio: Effects of fish age and chloride concentrations [J]. Acta Veterinaria Brno, 2006, 75(1): 107-113
[17] 国家标准化管理委员会, 国家质量监督检验检疫总局. 化学品 鱼类延长毒性14天试验: GB/T 21808—2008[S]. 北京: 国家标准化管理委员会, 国家质量监督检验检疫总局, 2008
[18] Salahinejad A, Naderi M, Attaran A, et al. Effects of chronic exposure to bisphenol-S on social behaviors in adult zebrafish: Disruption of the neuropeptide signaling pathways in the brain [J]. Environmental Pollution, 2020, 262: 113992
[19] 朱小乔, 唐天乐, 彭翔, 等. 双酚AF暴露降低斑马鱼学习记忆能力并影响神经系统相关基因表达[J]. 生态毒理学报, 2017, 12(1): 119-126
Zhu X Q, Tang T L, Peng X, et al. Bisphenol AF exposure reduces learning and memory ability and influences expression of nervous system genes in zebrafish [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 119-126 (in Chinese)
[20] 陈金. 纳米氧化铝胚胎暴露致成年斑马鱼的学习和记忆能力进行性损伤[D]. 太原: 山西医科大学, 2020: 10-11
Chen J. Progressive impairment of learning and memory in adult zebrafish treated by Al2O3 nanoparticles when in embryos [D]. Taiyuan: Shanxi Medical University, 2020: 10-11 (in Chinese)
[21] Lin W, Guo H H, Wang L K, et al. Parental transfer of microcystin-LR-induced innate immune dysfunction of zebrafish: A cross-generational study [J]. Environmental Science & Technology, 2020, 54(2): 1014-1023
[22] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J]. Methods, 2001, 25(4): 402-408
[23] Jensen F B. Nitrite disrupts multiple physiological functions in aquatic animals [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2003, 135(1): 9-24
[24] 赵丹. 急、慢性缺氧对斑马鱼幼鱼神经系统损伤机制的初步研究[D]. 广州: 南方医科大学, 2014: 36-37
Zhao D. Pilot study of mechanism of nervous system damage of zebrafish larvae caused by acute/chronic hypoxia [D]. Guangzhou: Southern Medical University, 2014: 36-37 (in Chinese)
[25] Ali E H A, Ahmed-Farid O A, Osman A A E. Bone marrow-derived mesenchymal stem cells ameliorate sodium nitrite-induced hypoxic brain injury in a rat model [J]. Neural Regeneration Research, 2017, 12(12): 1990-1999
[26] Ghiselli A, Serafini M, Natella F, et al. Total antioxidant capacity as a tool to assess redox status: Critical view and experimental data [J]. Free Radical Biology & Medicine, 2000, 29(11): 1106-1114
[27] Praticò D, Clark C M, Liun F, et al. Increase of brain oxidative stress in mild cognitive impairment: A possible predictor of Alzheimer disease [J]. Archives of Neurology, 2002, 59(6): 972-976
[28] Dias V, Junn E, Mouradian M M. The role of oxidative stress in Parkinson’s disease [J]. Journal of Parkinson’s Disease, 2013, 3(4): 461-491
[29] 邹苏琪, 殷梧, 杨昱鹏, 等. 斑马鱼行为学实验在神经科学中的应用[J]. 生物化学与生物物理进展, 2009, 36(1): 5-12
Zou S Q, Yin W, Yang Y P, et al. The ethology application of zebrafish in neuroscience [J]. Progress in Biochemistry and Biophysics, 2009, 36(1): 5-12 (in Chinese)
[30] 李小泉, 杜久林. 幼年斑马鱼的视觉系统与捕食行为[J]. 遗传, 2013, 35(4): 368-376
Li X Q, Du J L. Visual system and prey capture behavior of larval zebrafish [J]. Hereditas, 2013, 35(4): 368-376 (in Chinese)
[31] Gupta N, Zhao Y Y, Evans C E. The stimulation of thrombosis by hypoxia [J]. Thrombosis Research, 2019, 181: 77-83
[32] Sheng J, Meng Q F, Yang Z Z, et al. Identification of cryptotanshinone from Tongmai to inhibit thrombosis in zebrafish via regulating oxidative stress and coagulation cascade [J]. Phytomedicine, 2020, 76: 153263
[33] Liu K S, Fetcho J R. Laser ablations reveal functional relationships of segmental hindbrain neurons in zebrafish [J]. Neuron, 1999, 23(2): 325-335
[34] Liao G X, Li R, Chen X H, et al. Sodium valproate prevents radiation-induced injury in hippocampal neurons via activation of the Nrf2/HO-1 pathway [J]. Neuroscience, 2016, 331: 40-51
[35] 陈思杰, 彭刚. 斑马鱼模式动物在神经功能环路研究中的应用[J]. 心理科学进展, 2013, 21(6): 1014-1019
Chen S J, Peng G. Zebrafish model and physiological psychology research [J]. Advances in Psychological Science, 2013, 21(6): 1014-1019 (in Chinese)
[36] Engeszer R E, Ryan M J, Parichy D M. Learned social preference in zebrafish [J]. Current Biology, 2004, 14(10): 881-884
[37] Miller N, Gerlai R. Quantification of shoaling behaviour in zebrafish (Danio rerio) [J]. Behavioural Brain Research, 2007, 184(2): 157-166
[38] Wenk G L. Assessment of spatialmemor using the T maze [J]. Current Protocols in Neuroscience, 2001(8): 8.5B
[39] Roy T, Bhat A. Social learning in a maze? Contrasting individual performance among wild zebrafish when associated with trained and naive conspecifics [J]. Behavioural Processes, 2017, 144: 51-57
[40] Schultz W. Multiple functions of dopamine neurons [J]. F1000 Biology Reports, 2010, 2: 2
[41] Kim J H, Auerbach J M, Rodríguez-Gómez J A, et al. Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson’s disease [J]. Nature, 2002, 418(6893): 50-56
[42] Behra M, Cousin X, Bertrand C, et al. Acetylcholinesterase is required for neuronal and muscular development in the zebrafish embryo [J]. Nature Neuroscience, 2002, 5(2): 111-118
[43] Hasselmo M E. The role of acetylcholine in learning and memory [J]. Current Opinion in Neurobiology, 2006, 16(6): 710-715
[44] Kang T C, Kim H S, Seo M O, et al. The changes in the expressions of gamma-aminobutyric acid transporters in the gerbil hippocampal complex following spontaneous seizure [J]. Neuroscience Letters, 2001, 310(1): 29-32
[45] Sajovic P, Levinthal C. Inhibitory mechanism in zebrafish optic tectum: Visual response properties of tectal cells altered by picrotoxin and bicuculline [J]. Brain Research, 1983, 271(2): 227-240
[46] Morteza Z, Vahhab B, Hossein J. Effects of central histamine receptors blockade on GABA(A) agonist-induced food intake in broiler cockerels [J]. Pakistan Journal of Biological Sciences: PJBS, 2008, 11(3): 416-421
[47] Jacobs B L, Fornal C A. Serotonin and motor activity [J]. Current Opinion in Neurobiology, 1997, 7(6): 820-825
[48] Buhot M C. Serotonin receptors in cognitive behaviors [J]. Current Opinion in Neurobiology, 1997, 7(2): 243-254
[49] Buhot M C, Martin S, Segu L. Role of serotonin in memory impairment [J]. Annals of Medicine, 2000, 32(3): 210-221