随着我国电子工业快速发展,电子垃圾被大量排放,预计在2040年将产生2 000万t的电子垃圾[1]。多氯联苯(polychlorinated biphenyls, PCBs)和重金属被广泛应用于生产电子产品,是电子垃圾拆解处置过程中产生的主要污染物。目前已经在电子垃圾拆解区检测到高浓度的PCBs和重金属,这些污染物会通过饮食摄入、皮肤接触和呼吸等途径进入生物体,对生态环境和人体健康产生潜在威胁[2-3]。研究表明,PCBs和重金属具有神经毒性、内分泌干扰性和致癌性[4-6]。
微生物是土壤生态系统的重要组成部分,但其对环境变化尤其敏感[7]。因此,土壤微生物可以作为响应环境变化的潜在指示物。多项研究表明电子垃圾造成的污染可改变土壤中微生物群落结构,影响微生物代谢能力[8-12]。Barra Caracciolo等[13]在研究中识别出与PCBs转化相关的数种基因和响应重金属的氧化应激酶,并发现变形菌门(Proteobacteria)具有降解PCBs和抵抗重金属毒性的能力。Jiang等[8]研究表明电子垃圾拆解区产生的多环芳烃(polycyclic aromatic hydrocarbons, PAHs)、多溴联苯醚(polybrominated diphenyl ethers, PBDEs)和重金属显著影响微生物群落组成和多样性。同时,研究者也可以根据微生物群落组成和多样性,解释影响微生物变化的环境因子[14]。
近年来,中国禁止电子垃圾进口并出台相关政策对规范电子拆解企业经营提出要求[15-17],但当前关于电子垃圾拆解区的污染情况,特征污染物对土壤微生物群落的影响研究有限,开展相关研究可以为电子垃圾拆解区的土壤风险管理和生物修复提供重要支撑。基于此,本研究对华南地区某电子垃圾拆解区土壤中的污染物和微生物进行了全面调查,尝试阐明电子垃圾拆解区微生物多样性以及微生物之间的相互关系,并确定影响微生物群落结构的主要环境因子。
1 材料与方法(Materials and methods)
1.1 样品点分布与样品采集
土壤样品于2020年12月采集于华南地区某电子垃圾拆解区,采样点如图1所示:设置华南地区电子垃圾拆解区的2个集中拆解区域作为采样区域(A和B),两地从20世纪90年代开始从事电子垃圾拆解活动,产生了大量的污染物直接排放于土壤,随着相关政策的出台,近年来分别建立了循环经济产业园规范电子拆解企业经营,以减少环境污染。本研究共14个采样点(A:S1~S8;B:S9~S14),采集表层5~20 cm的土壤样品,同一采样点相隔一定距离采样,共采集3个土壤样品,由于部分样品未提取DNA,所以S9和S11采样点为2份土壤样品,土壤样品共40份。将采集好的土壤样本去除杂物,低温保存运回实验室,样品保存于-20 ℃和-80 ℃,分别用于测定污染物浓度和提取DNA。
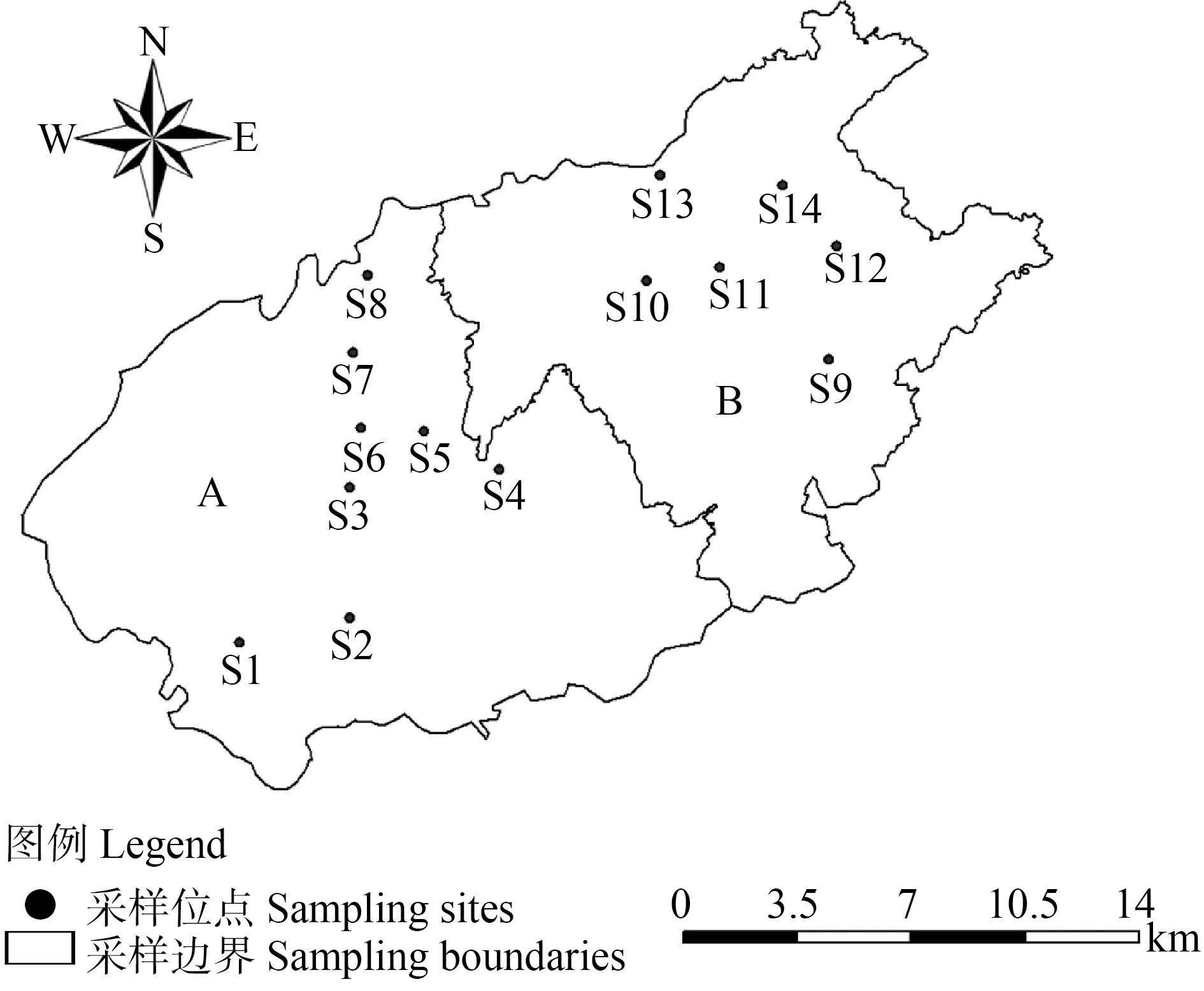
图1 华南地区某电子垃圾拆解区采样点布设图
Fig. 1 Sampling sites layout of an electronic waste dismantling area in South China
1.2 PCBs与重金属分析
土壤PCBs浓度测定:将土壤样品冷冻干燥、研磨、过100目尼龙筛。精确称取1 g土样和硅藻土混合后置于快速溶剂萃取(ASE)池中,按V二氯甲烷∶V正己烷为1∶1混合,静态萃取10 min,萃取压力为10 342.5 kPa,萃取温度为100 ℃,循环3次。将萃取液浓缩后,加入至氧化铝硅胶柱,用70 mL上述有机溶剂混合液淋洗氧化铝硅胶柱,氮吹至近干,正己烷定容至200 μL,使用电子轰击电离(EI)和选择离子监测(SIM)模式,通过气相色谱-质谱联用仪(GC-MS,7890A-5975C,安捷伦公司,美国)检测多氯联苯同系物。气相色谱仪配备DB-5MS柱(60 m×0.25 mm×0.25 μm,J&W Scientific,美国)。升温程序如下:初始温度为120 ℃,以6 ℃·min-1的速率增加至180 ℃,然后以1 ℃的速率将温度降至240 ℃,最后以6 ℃·min-1的速率达到290 ℃(保持10 min)。离子源、色质传输线和四极杆温度分别设置为230 ℃、280 ℃和150 ℃[4]。
土壤重金属含量测定:将土壤样品冷冻干燥、研磨、过100目尼龙筛。精确称取0.1 g样品,于聚四氟乙烯消解罐中微波消解。消解后样品过0.45 μm亲水性滤膜,稀释定容,采用电感耦合等离子体质谱仪(ICP-MS, PerkinElmer NexION 2000,美国)进行重金属浓度测定[18]。
1.3 土壤微生物多样性检测
土壤样本中的微生物组总DNA使用E.Z.N.A.® Soil DNA Kit (Omega Bio-tek,美国)试剂盒进行提取。细菌群落结构研究采用16S rRNA V4-V5区引物 515F(5’-barcode-GTGCCAGCMGCCGCGG-3’)和907R(5’-CCGTCAATTCMTTTRAGTTT-3’)进行PCR扩增,每个样本的扩增引物含有8个碱基标签序列用以区分样本。利用Qubit®3.0 (Life Invitrogen)对纯化后的PCR产物进行精准定量,然后将带有不同标签序列的24个扩增子样本进行等量混合,构成混合DNA样品池,DNA产物参照Illumina基因组测序文库构建流程构建Illumina双端测序的PE文库。该扩增子文库参照标准流程采用Illumina平台进行PE250模式测序,建库测序工作由上海凌恩生物科技有限公司承担。
1.4 数据分析
根据测序原始数据序列首尾两端的barcode和引物区分样品,并调整序列方向。数据拆分后进行数据除杂,过滤read尾部质量值20以下的碱基,设置10 bp的窗口,过滤质控后50 bp以下的read;拼接序列的overlap区允许的最大错配比率为0.2;最小overlap长度为10 bp。对有效序列进行归类,获得可操作分类单元(OTU)。使用UCHIME软件鉴定并移除嵌合序列,采用UPARSE(version 7.1 http://drive5.com/uparse/)软件将相似性达97%的序列聚类为OTU。采用RDP classifier (http://rdp.cme.msu.edu/)贝叶斯算法对OTU代表序列进行分类学分析,比对Silva数据库,置信度阈值为0.7,最终获得每个OTU在各个分类学水平上的物种信息,并由此统计各个分类水平上各样本的微生物群落构成。
本研究用到的方差分析、方差分解分析、冗余分析和微生物共现性网络参数等主要使用R软件的vegan包、igraph包和ggplot2包等计算;微生物共现性网络图通过Gephi绘制,用来探究微生物之间的相互关系,选取总相对丰度>0.5%的属进行Spearman相关性分析,筛选出相关系数>0.8且显著性P值<0.05的相关关系构建相关性网络。网络图中每个节点表示1个属,每条边表示节点之间显著的强相关关系。计算每个网络图的拓扑参数,包括平均路径长度、网络直径、平均度、图密度等。
2 结果(Results)
2.1 土壤中污染物浓度分析
PCBs和重金属浓度如表1所示。PCBs各单体在各个样品点中有不同程度的检出,检出率为5%~97.5%,PCB 52、PCB 66、PCB 77、PCB 81和PCB 101检出率最高,均为97.5%,PCB 126检出率仅为5%。PCB 126、PCB 156、PCB 157、PCB 167和PCB 189仅在A地区检出。A地区与B地区PCBs总浓度均值分别为174.39 ng·g-1和14.49 ng·g-1。重金属元素在各个样品点均有检出,检出率为100%。镍(Ni)、铜(Cu)、砷(As)、镉(Cd)、锑(Sb)和铅(Pb)在A地区平均浓度较高;钙(Ca)、铬(Cr)、锰(Mn)、钴(Co)、锌(Zn)和硒(Se)在B地区平均浓度较高。
表1 A和B地区污染物浓度
Table 1 Pollutant concentrations in areas A and B

名称 NameAB名称 NameABPCB 83.56(ND~15.35)0.69(ND~8.42)PCB 1703.72(ND~18.53)0.36(ND~1.51)PCB 1810.34(ND~66.56)1.08(ND~4.13)PCB 1808.76(ND~50.98)0.79(ND~3.13)PCB 2826.27(ND~177.57)0.94(ND~2.48)PCB 1874.01(ND~24.44)0.15(ND~0.92)PCB 4410.32(ND~63.89)0.58(ND~1.34)PCB 1890.09(ND~0.63)ND(ND~ND)PCB 5212.84(ND~73.37)0.62(ND~1.53)PCB 1951.22(ND~8.00)0.06(ND~0.38)PCB 6611.54(ND~66.88)1.90(ND~9.63)PCB 2069.13(ND~65.24)0.14(ND~0.77)PCB 775.36(ND~18.26)2.00(ND~4.18)PCB 2093.16(ND~27.18)0.07(ND~0.41)PCB 813.54(ND~9.47)1.24(0.54~3.06)∑27PCB174.39(0.08~804.86)14.49(5.40~31.30)PCB 10110.18(ND~52.8)0.39(0.14~0.70)Ca395.42(65.16~1 159.93)669.3(157.96~1 215.67)PCB 1055.33(ND~30.94)0.31(ND~0.81)Cr22.89(10.13~48.34)36.92(12.97~97.90)PCB 1140.25(ND~2.03)0.01(ND~0.19)Mn266.99(63.05~406.38)633.94(204.43~2 091.52)PCB 11811.22(ND~63.76)0.56(0.05~1.66)Co5.02(2.06~9.66)6.00(0.90~17.65)PCB 1231.18(ND~6.91)0.12(ND~0.61)Ni13.68(4.29~27.89)11.78(2.32~32.58)PCB 1260.02(ND~0.24)NDCu145.06(6.03~618.95)70.10(6.14~314.99)PCB 1282.30(ND~10.88)0.19(ND~0.59)Zn96.61(16.96~208.14)114.12(16.9~252.05)PCB 13815.01(ND~63.81)1.25(ND~2.62)As26.18(7.35~57.5)13.23(6.02~29.14)PCB 15312.85(ND~49.17)1.05(ND~2.55)Se5.79(0.87~12.45)5.83(2.44~9.94)PCB 1561.40(ND~7.39)NDCd0.50(0.04~1.74)0.38(0.11~0.94)PCB 1570.20(ND~1.53)NDSb10.12(2.08~42.64)7.04(0.79~32.48)PCB 1670.60(ND~2.6)NDPb87.61(22.27~250.98)59.42(25.37~95.5)
注:PCBs浓度单位为ng·g-1,重金属浓度单位为mg·kg-1,ND表示为未检出。
Note: The unit of PCBs concentration is ng·g-1, the unit of heavy metal concentration is mg·kg-1, and ND means not detected.
2.2 微生物组成及多样性分析
通过对研究区域样品的测序分析,数据抽平后共有14 344个OTU,53个门,1 359个属。如图2所示,青枯菌属(Ralstonia,28.38%)、鞘氨醇单胞菌属(Sphingomonas,5.11%)、甲基杆菌属-甲基红杆菌属(Methylobacterium-Methylorubrum,3.47%)、嗜盐单胞菌属(Halomonas,3.39%)、栖热菌属(Thermus,2.84%)是A地区的优势属。Ralstonia(20.43%)、Sphingomonas(6.38%)、un_f_Gemmatimonadaceae(3.80%)、norank_f_Vicinamibacteraceae(3.35%)、MND1(3.20%)为B地区的优势属。
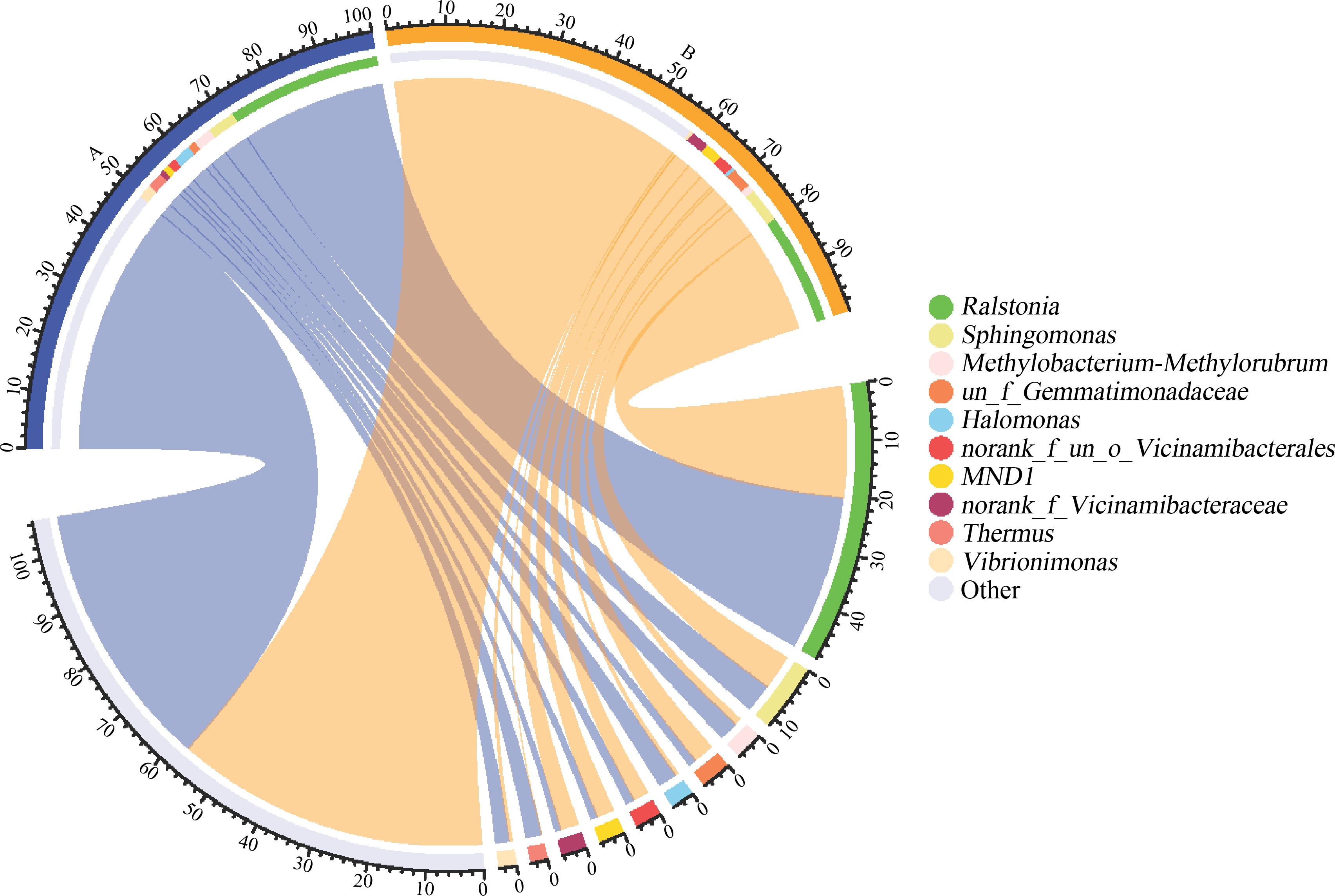
图2 微生物群落属水平相对丰度
Fig. 2 Relative abundance of microbial communities at the genus level
ACE和Chao1指数用以反映微生物丰富度,Shannon和Simpson指数反映微生物群落多样性。如图3所示,对A地区和B地区微生物alpha多样性进行方差分析(ANOVA),结果显示,两地微生物群落的ACE和Chao1指数有显著区别,A地区微生物丰富度低于B地区;Shannon和Simpson指数在A、B 2个地区差异不显著。
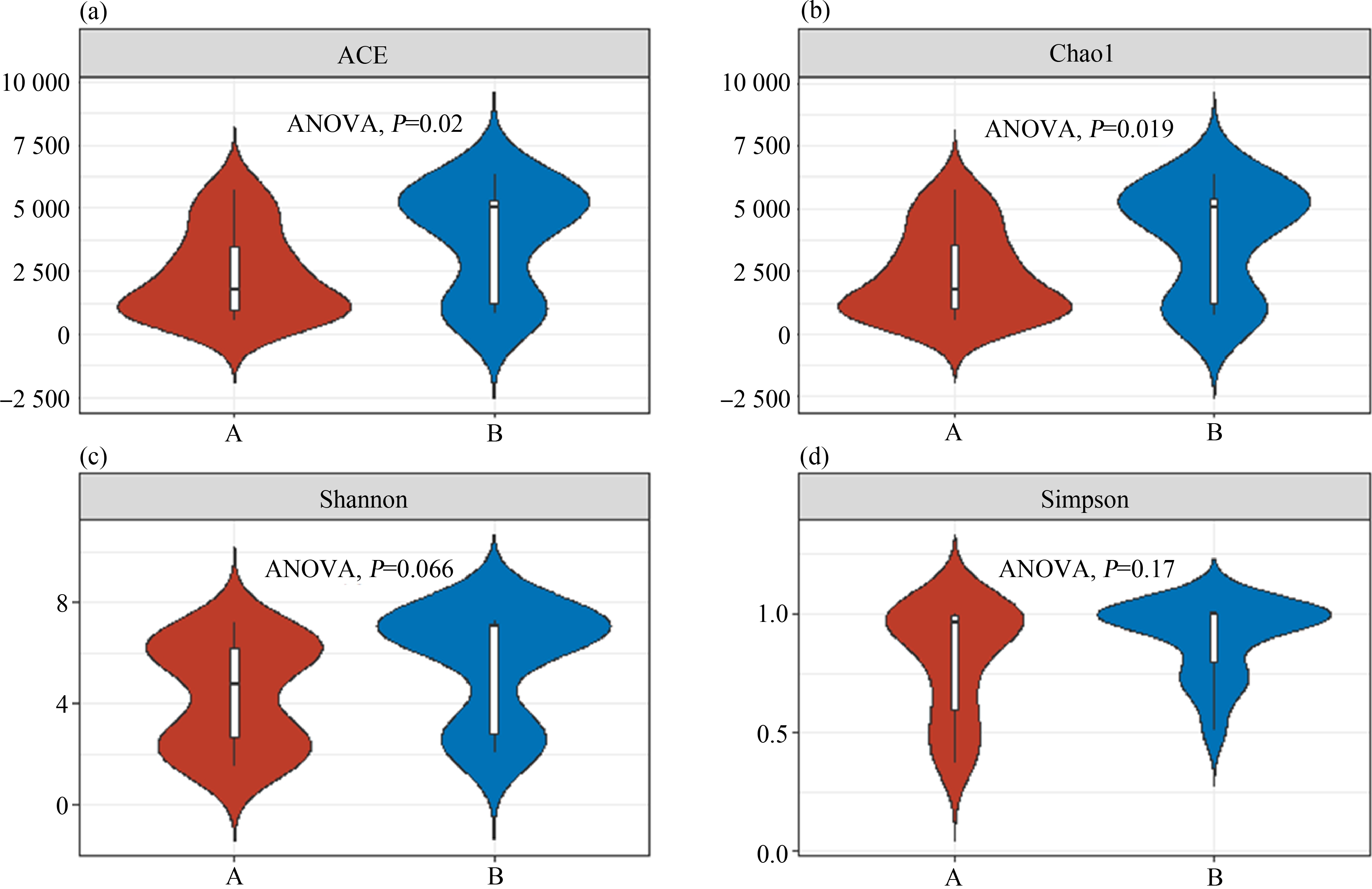
图3 不同地区微生物alpha多样性指数
注:(a) ACE指数;(b) Chao1指数;(c) Shannon指数;(d) Simpson指数。
Fig. 3 Microbial alpha diversity indices in different regions
Note: (a) ACE; (b) Chao1; (c) Shannon; (d) Simpson.
2.3 微生物共现性网络分析
A地区共现性网络(图4(a))共包含291个节点(属)和4 374条边,正相关边数为4 282,负相关边数为92,每个节点的平均边数是15.03,平均路径长度2.831,聚类系数0.568,模块化指数0.356,网络直径11,平均加权度24.42,图密度0.104。网络图中节点分属24个门,其中Proteobacteria(36.77%)、放线菌门(Actinobacteriota,17.53%)、绿弯菌门(Chloroflexi,8.59%)、酸杆菌门(Acidobacteriota,7.90%)、拟杆菌门(Bacteroidota,5.84%)占所有节点的76.63%,是重要的门水平物种。网络模块化指数是评估土壤微生物群落成员之间相互作用网络变化的有效指标,其值>0.4表明网络具有拓扑建构[19-20]。网络模块化分析显示共形成8个模块,其中模块1中主要节点属于Proteobacteria、Actinobacteriota、Acidobacteriota,模块2中主要节点属于Proteobacteria、Actinobacteriota、Chloroflexi,模块3中主要节点属于Proteobacteria、Actinobacteriota、Acidobacteriota。中介中心性描述一个节点维系其他节点的能力,根据中介中心性能够确定网络中的关键类群[21]。根据中介中心性得分,可知在该网络所有节点中异根瘤菌属-新根瘤菌属-副根瘤菌属-根瘤菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium)、norank_f_JG30-KF-CM45、发硫菌属(Thiothrix)、norank_o_Chthonomonadales、类诺卡氏菌属(Nocardioides)是关键属。
B地区共现性网络(图4(b))共包含253个节点(属)和3 984条边,正相关边数为3 625,负相关边数为359,每个节点的平均边数是15.75,平均路径长度2.315,聚类系数0.495,模块化指数0.477,网络直径6,平均加权度22.052,图密度0.125。网络图中节点分属27个门,Proteobacteria(32.41%)、Actinobacteriota(15.81%)、Acidobacteriota(8.30%)、Bacteroidota(7.11%)、浮霉菌门(Planctomycetota,7.11%)占所有节点的70.74%,是重要的门水平物种。网络形成5个模块,其中模块1中主要节点属于Proteobacteria、Acidobacteriota、Planctomycetota,模块2中主要节点属于Actinobacteriota、Proteobacteria、Chloroflexi,模块3中主要节点属于Proteobacteria、Planctomycetota、Actinobacteriota。根据中介中心性得分,可知在该网络节点中根瘤菌属(Chelativorans)、肾杆菌属(Renibacterium)、Iamia、norank_o_Kapabacteriales、norank_o_Rokubacteriales是关键属。
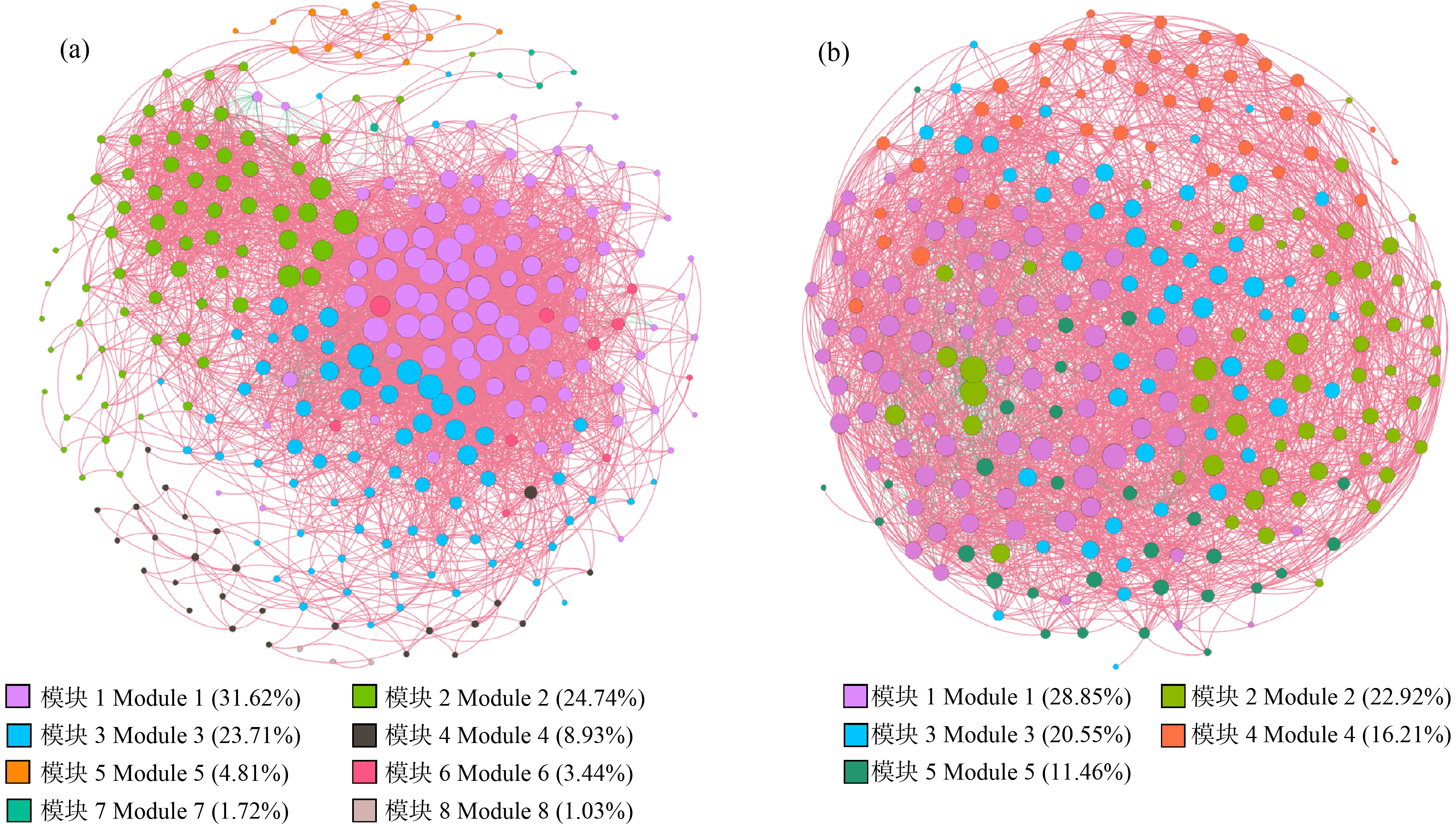
图4 微生物共发生网络
注:(a) A地区;(b) B地区。
Fig. 4 Microbial co-occurrence network
Note: (a) Area A; (b) Area B.
2.4 微生物群落和环境因子关系
为了评价环境因子对微生物多样性的影响,对PCBs和重金属与微生物多样性进行了线性回归分析(图5),结果显示,Zn和Cd与微生物ACE和Chao1指数呈显著线性回归关系,且回归系数>0,表明Zn和Cd可能是电子垃圾拆解区微生物alpha多样性的主要驱动因素。冗余分析(redundancy analysis, RDA)(图6(a))表明PCBs和重金属对微生物群落的影响,RDA1和RDA2分别解释了29.93%和27.95%的群落变量。选取与微生物群落蒙特卡罗检验(P<0.01)中显著相关的环境变量,对显著相关的环境变量进行共线性分析,剔除VIF>10的变量,确定PCB 153、PCB 209、Mn、Zn、Cd和Pb是显著影响微生物群落组成的环境因子。进一步进行方差分解分析(variance partiton analysis, VPA)(图6(b)),表明所选环境因子共解释微生物群落变化的21.33%,其中PCBs单独解释了5.23%,其单体PCB 153和PCB 209分别解释4.27%和2.47%;重金属单独解释了14.65%,其中Mn、Zn、Cd和Pb分别解释1.70%、4.60%、2.22%和1.87%。此外,PCBs和重金属共同作用解释了1.46%。

图5 Zn和Cd与微生物Chao1和ACE指数的线性回归关系
注:(a)Zn与Chao1的线性回归关系;(b)Cd与Chao1的线性回归关系;(c)Zn与ACE的线性回归关系;(d)Cd与ACE的线性回归关系;Zn、Cd浓度进行了对数转换。
Fig. 5 Linear regression of Zn and Cd with microbial Chao1 and ACE indices
Note: (a) Linear regression of Zn with Chao1; (b) Linear regression of Cd with Chao1; (c) Linear regression of Zn with ACE; (d) Linear regression of Cd with ACE; the Zn and Cd concentration were log transformed.

图6 环境因子对属水平微生物群落的影响
注:(a)冗余分析(RDA);(b)方差分解分析(VPA)。
Fig. 6 Effect of environmental factors on microbial communities at the genus level
Note: (a) Redundancy analysis (RDA); (b) Variance partition analysis (VPA).
3 讨论(Discussion)
2个研究区域PCBs总浓度高于中国表层土壤背景值0.138~1.84 ng·g-1 [22],A地区PCBs总浓度均值是B地区的12倍,A地区各单体浓度也高于B地区,重金属含量在A、B 2个地区未显示出明显的分布差异。以上结果表明,研究区域仍存在一定程度污染,且A地区PCBs污染程度更高。
微生物属在不同研究区域相对丰度及alpha多样性分析表明,B地区Ralstonia相对丰度较A地区下降7.95%,Sphingomonas相对丰度上升1.28%,但是相对于其他菌种二者仍然是研究区域相对丰度最高的优势属,原因可能是Ralstonia和Sphingomonas具有较强的降解有机污染物能力,分别被证实能够降解PCBs和五氯苯酚(pentachlorophenol, PCP),并可以耐受高浓度重金属[23-24],说明这2个优势属具有较强的环境抗性。Shannon、Simpson指数在A、B 2个地区区别不显著,微生物的多样性变化不明显,也表明微生物群落一定范围内能够适应环境污染物[25]。
微生物共现性网络分析表明,Proteobacteria(36.77%),Actinobacteriota(17.53%)是该研究区域微生物共现性网络中重要的门,这些门可能与研究地区的电子垃圾污染密切相关。关键属在生态过程中发挥着重要作用,2个研究区域的微生物共现性网络关键属发生改变,可能是由于这些属微生物具有较强的适应环境变化和抗污染物能力。例如,A地区的关键属Thiothrix能够将硝酸盐厌氧还原为亚硝酸盐[26];Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium属具有较强的抗微塑料侵害性[27];诺卡氏菌(Nocardioides)被发现能够以二苯并呋喃作为唯一的碳源和能源进行生长。B地区的关键属根瘤菌属(Chelativorans)能够降解Cd-EDTA和Ni-EDTA复合物[28]。肾杆菌属(Renibacterium)能够水解壳聚糖[29]。Iamia是Cr的敏感属,能够作为Cr的潜在指示微生物[30]。显然,A地区关键属参与了有机污染物降解,B地区关键属则与重金属相关。网络模块化分析表明,A地区模块化指数低于B地区,且模块化指数低于0.4,不具有拓扑建构,这可能是由于A地区PCBs浓度较高导致A地区微生物群落发生变化,微生物共现性网络不稳定。这与其他研究者结果一致[20, 31]。网络正相关和负相关的连接分别表示了微生物之间协同和竞争的关系[32-33]。本研究2个区域网络正相关连接均远多于负相关连接,且A地区网络具有更高比例的正相关连接,表明大多数微生物通过协同作用以应对PCBs和重金属造成的污染。
冗余分析表明,PCBs和重金属是影响微生物群落的关键因素,可能对土壤中的微生物活动产生影响,改变群落结构[9-11]。属水平微生物与环境因子Pearson相关性分析表明,Thermus与大部分PCBs显著相关,说明Thermus可以作为潜在的PCBs污染指示微生物。线性回归分析表明,Zn、Cd与微生物丰富度显著正相关。许多研究表明,Cd污染土壤降低了土壤微生物群落多样性,抑制微生物种群繁殖[34-35],但土壤微生物在Cd低浓度水平(0.5~1 mg·L-1)时出现显著增加,即使10 mg·L-1 Cd对微生物仍没有显著的负面影响[36-37]。同样,高浓度Zn水平会抑制微生物的生长,但低浓度水平可促进微生物的生长,土壤微生物群落能够在一定程度上适应Zn污染[38]。可见研究区域土壤微生物可以利用低浓度水平Cd和Zn。由方差分解分析可知,相较于PCBs,重金属对微生物群落做出了更多解释,进一步说明该研究区域内重金属可以显著影响微生物群落结构。78.67%的微生物变化未被解释,这可能是由未被监测的土壤理化性质和其他特征污染物引起[10]。
综合分析,本研究表明PCBs和重金属是影响微生物群落的关键因素,二者可以改变微生物关键属,并导致微生物共现性网络不稳定,大多数微生物通过协同作用以应对PCBs和重金属造成的污染。Proteobacteria、Actinobacteriota是研究区域重要的门,Ralstonia、Sphingomonas为优势属,具有较强的环境抗性。由于A地区PCBs和重金属污染程度较高,导致A地区微生物丰富度低于B地区,而低浓度的Zn和Cd与微生物丰富度显著正相关,Thermus可以作为潜在的PCBs污染指示微生物,大多数微生物通过协同作用以应对PCBs和重金属造成的污染。
[1] Li J H, Yang J, Liu L L. Development potential of e-waste recycling industry in China [J]. Waste Management & Research: the Journal of the International Solid Wastes and Public Cleansing Association, 2015, 33(6): 533-542
[2] Hopf N B, Ruder A M, Waters M A. Historical reconstruction of polychlorinated biphenyl (PCB) exposures for workers in a capacitor manufacturing plant [J]. Environmental Science and Pollution Research International, 2014, 21(10): 6419-6433
[3] 周钰涵, 王彭彭, 李佳琳, 等. 典型新型有机污染物对儿童肥胖和神经发育影响的研究进展[J]. 环境与职业医学, 2021, 38(9): 1001-1009
Zhou Y H, Wang P P, Li J L, et al. Effects of emerging organic contaminants on childhood obesity and neurodevelopment: A review [J]. Journal of Environmental and Occupational Medicine, 2021, 38(9): 1001-1009 (in Chinese)
[4] Yu Y J, Lin B G, Qiao J, et al. Levels and congener profiles of halogenated persistent organic pollutants in human serum and semen at an e-waste area in South China [J]. Environment International, 2020, 138: 105666
[5] Yu Y J, Liu L T, Chen X C, et al. Brominated flame retardants and heavy metals in common aquatic products from the Pearl River Delta, South China: Bioaccessibility assessment and human health implications [J]. Journal of Hazardous Materials, 2021, 403: 124036
[6] 宋力, 黄民生. 底泥中持久性有毒物质研究现状与展望[J]. 华东师范大学学报(自然科学版), 2011(1): 73-86
Song L, Huang M S. Development and prospect for the study of persistent toxic substances of sediment [J]. Journal of East China Normal University (Natural Science), 2011(1): 73-86 (in Chinese)
[7] Cantarel A A M, Bloor J M G, Pommier T, et al. Four years of experimental climate change modifies the microbial drivers of N2O fluxes in an upland grassland ecosystem [J]. Global Change Biology, 2012, 18(8): 2520-2531
[8] Jiang L F, Cheng Z N, Zhang D Y, et al. The influence of e-waste recycling on the molecular ecological network of soil microbial communities in Pakistan and China [J]. Environmental Pollution, 2017, 231(Pt 1): 173-181
[9] El-Alam I, Verdin A, Fontaine J, et al. Ecotoxicity evaluation and human risk assessment of an agricultural polluted soil [J]. Environmental Monitoring and Assessment, 2018, 190(12): 738
[10] Wu Z N, Gao G H, Wang Y Y. Effects of soil properties, heavy metals, and PBDEs on microbial community of e-waste contaminated soil [J]. Ecotoxicology and Environmental Safety, 2019, 180: 705-714
[11] Girardot F, Allégra S, Pfendler S, et al. Bacterial diversity on an abandoned, industrial wasteland contaminated by polychlorinated biphenyls, dioxins, furans and trace metals [J]. The Science of the Total Environment, 2020, 748: 141242
[12] Gran-Scheuch A, Ramos-Zu iga J, Fuentes E, et al. Effect of co-contamination by PAHs and heavy metals on bacterial communities of diesel contaminated soils of south Shetland Islands, Antarctica [J]. Microorganisms, 2020, 8(11): E1749
iga J, Fuentes E, et al. Effect of co-contamination by PAHs and heavy metals on bacterial communities of diesel contaminated soils of south Shetland Islands, Antarctica [J]. Microorganisms, 2020, 8(11): E1749
[13] Barra Caracciolo A, Grenni P, Garbini G L, et al. Characterization of the belowground microbial community in a poplar-phytoremediation strategy of a multi-contaminated soil [J]. Frontiers in Microbiology, 2020, 11: 2073
[14] Wu W C, Dong C X, Wu J H, et al. Ecological effects of soil properties and metal concentrations on the composition and diversity of microbial communities associated with land use patterns in an electronic waste recycling region [J]. The Science of the Total Environment, 2017, 601-602: 57-65
[15] Lin S Y, Man Y B, Chow K L, et al. Impacts of the influx of e-waste into Hong Kong after China has tightened up entry regulations [J]. Critical Reviews in Environmental Science and Technology, 2020, 50(2): 105-134
[16] 中国政府网. 废弃电器电子产品回收处理管理条例[EB/OL]. (2011-01-01) [2022-02-17]. http://www.gov.cn/flfg/2009-03/04/content_1250844.htm
[17] 中华人民共和国环境保护部. 废弃电器电子产品处理污染控制技术规范: HJ 527—2010[S]. 北京: 中国环境科学出版社, 2010
[18] 李昇昇, 李敏, 朱晓辉, 等. 大亚湾海产中重金属的健康风险与海产消费建议[J]. 环境化学, 2020, 39(2): 352-361
Li S S, Li M, Zhu X H, et al. Heavy metals in selected marine organisms from Daya Bay: Human health risk assessment and advice for seafood consumption [J]. Environmental Chemistry, 2020, 39(2): 352-361 (in Chinese)
[19] Barberán A, Bates S T, Casamayor E O, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities [J]. The ISME Journal, 2012, 6(2): 343-351
[20] Stamou G P, Monokrousos N, Gwynn-Jones D, et al. A polyphasic approach for assessing eco-system connectivity demonstrates that perturbation remodels network architecture in soil microcosms [J]. Microbial Ecology, 2019, 78(4): 949-960
[21] Berry D, Widder S. Deciphering microbial interactions and detecting keystone species with co-occurrence networks [J]. Frontiers in Microbiology, 2014, 5: 219
[22] Ren N Q, Que M X, Li Y F, et al. Polychlorinated biphenyls in Chinese surface soils [J]. Environmental Science & Technology, 2007, 41(11): 3871-3876
[23] Jiang L F, Luo C L, Zhang D Y, et al. Biphenyl-metabolizing microbial community and a functional operon revealed in e-waste-contaminated soil [J]. Environmental Science & Technology, 2018, 52(15): 8558-8567
[24] Colores G M, Radehaus P M, Schmidt S K. Use of a pentachlorophenol degrading bacterium to bioremediate highly contaminated soil [J]. Applied Biochemistry and Biotechnology, 1995, 54(1-3): 271-275
[25] Zhang W, Wang H, Zhang R, et al. Bacterial communities in PAH contaminated soils at an electronic-waste processing center in China [J]. Ecotoxicology, 2010, 19(1): 96-104
[26] Trubitsyn I V, Andreevskikh Z G, Yurevich L I, et al. Capacity for nitrate respiration as a new aspect of metabolism of the filamentous sulfur bacteria of the genus Thiothrix [J]. Microbiology, 2013, 82(1): 15-21
[27] Wen B, Liu J H, Zhang Y, et al. Community structure and functional diversity of the plastisphere in aquaculture waters: Does plastic color matter? [J]. The Science of the Total Environment, 2020, 740: 140082
[28] Kuvichkina T N, Kaparullina E N, Doronina N V, et al. Degradation of the EDTA and EDTA complexes with metals by immobilized cells of Chelativorans oligotrophicus LPM-4 bacteria [J]. Prikladnaia Biokhimiia i Mikrobiologiia, 2012, 48(6): 626-630
[29] Xing P C, Liu D, Yu W G, et al. Molecular characterization of an endo-type chitosanase from the fish pathogen Renibacterium sp. QD1 [J]. Journal of the Marine Biological Association of the United Kingdom, 2014, 94(4): 681-686
[30] Pei Y X, Yu Z S, Ji J, et al. Microbial community structure and function indicate the severity of chromium contamination of the Yellow River [J]. Frontiers in Microbiology, 2018, 9: 38
[31] Xu J B, Zhang J W, Zhu C W, et al. Influence of rice cultivars on soil bacterial microbiome under elevated carbon dioxide[J]. Journal of Soils and Sediments, 2019, 19(5): 2485-2495
[32] Deng Y, Zhang P, Qin Y J, et al. Network succession reveals the importance of competition in response to emulsified vegetable oil amendment for uranium bioremediation [J]. Environmental Microbiology, 2016, 18(1): 205-218
[33] 曹静, 程晓钰, 曾智霖, 等. 广西桂林新村屯洞穴细菌群落的生境特异性及网络分析[J]. 科学通报, 2021, 66(31): 4003-4016
Cao J, Cheng X Y, Zeng Z L, et al. Habitat specificity and co-occurrence network of bacterial communities in the Xincuntun Cave, Guilin, Guangxi [J]. Chinese Science Bulletin, 2021, 66(31): 4003-4016 (in Chinese)
[34] Wang G, Wang L, Ma F. Effects of earthworms and arbuscular mycorrhizal fungi on improvement of fertility and microbial communities of soils heavily polluted by cadmium [J]. Chemosphere, 2022, 286: 131567
[35] 徐佳慧, 王萌, 张润, 等. 土壤镉污染的生物毒性研究进展[J]. 生态毒理学报, 2020, 15(5): 82-91
Xu J H, Wang M, Zhang R, et al. Toxicity of cadmium pollution in soil to organisms: A review [J]. Asian Journal of Ecotoxicology, 2020, 15(5): 82-91 (in Chinese)
[36] Shentu J L, He Z L, Yang X E, et al. Microbial activity and community diversity in a variable charge soil as affected by cadmium exposure levels and time [J]. Journal of Zhejiang University Science B, 2008, 9(3): 250-260
[37] Lv Z, Li X G, Wang Y J, et al. Responses of soil microbial community to combination pollution of galaxolide and cadmium [J]. Environmental Science and Pollution Research International, 2021, 28(40): 56247-56256
[38] Zhou Y, Yao J, Choi M M, et al. A combination method to study microbial communities and activities in zinc contaminated soil [J]. Journal of Hazardous Materials, 2009, 169(1-3): 875-881