浮游植物作为内陆水域生态系统中初级生产力的重要组成,是构成食物网的基础,在生物地球化学循环中扮演重要角色。环境因子如何影响、调节浮游植物的光合生理、初级生产、种群结构及丰度是生态学研究的重要内容。因空间位置(经、纬度)、水体类型(湖泊、河流)、局域环境条件的不同,影响浮游植物光合生理、群落结构的主要环境因子在不同流域存在一定差异。
黄山市是世界文明的生态旅游城市,同时也是我国受酸雨影响较大的城市之一(可参见历年的《中国生态环境状况公报》)。酸雨引起的水体酸化是影响新安江流域浮游植物的重要胁迫因子。水体酸化可影响浮游植物色素含量[1-2]、增加耐酸性基因表达[3]、影响光合生理过程、抑制生长,进而影响群落结构组成[4-5]。前期的研究表明,新安江流域浮游植物多样性及丰度在短期酸胁迫下整体呈降低趋势,且不同门类浮游植物的敏感性不同[6],这可能与种间/株系间差异性有关[7]。
淡水水体因溶解有机质含量、水体pH值等因素的影响,水体透光率存在较大差异,从而使到达水体的光质及光强发生改变。对浮游植物光合作用及初级生产过程来说,阳光光谱中可见光(P,400~700 nm)与紫外光(UVR,包括320~400 nm紫外线A(UVA)和280~320 nm紫外线B(UVB))是最为重要的部分。作为水质全年总体较优(Ⅰ类或Ⅱ类以上占比较高)的水系(浊度较低)[8-9],长期酸雨背景下将进一步提高水体透明度,从而增加可见光(P)及紫外辐射(UVR)在水中的强度与透射深度。UVR可单独或与高光强耦合降低浮游植物的光合速率[10],抑制营养盐吸收[11-12],诱导细胞DNA、RNA突变以及活性氧自由基的产生[13-14],导致生产力的降低[12]。针对新安江流域(屯溪段)浮游植物群落结构与环境因子的研究也表明,阳光辐射尤其是UVR(UVA和UVB)为调控浮游植物丰度的重要因子[9]。
黄山市境内新安江流域为我国首个跨省生态补偿试点区,具有重要生态意义与示范作用。在我国重要河流、湖泊水质逐步好转这一背景下,酸雨胁迫与UVR耦合对浮游植物生理、生态过程的影响,在未来将是我国淡水生态系统面临的重要环境问题之一。虽然在一定时期内酸雨不会导致水体pH值降低至酸雨临界点(pH值5.65)或更低的水平,然而,长期、持续酸胁迫下,伴随水体酸碱缓冲能力(acid-neutralizing capacity, ANC)的降低,流域水体在未来将面临低pH的胁迫。因此,研究酸雨胁迫如何与UVR耦合影响新安江流域水体初级生产者,是亟需探讨的重要科学问题。前期的调查表明绿藻门为新安江流域主要优势门类(硅藻门、蓝藻门次之)[6, 9],小球藻作为新安江流域重要优势种类,出现频率高、丰度占比高[9]。本研究选取流域分离获得的一株小球藻(Chlorella vulgaris)为对象,通过模拟实验,研究了该种生长及光合活性对短期模拟酸雨胁迫引起的水体pH值降低的响应,并探讨了水体酸化与短期UVR的耦合效应。
1 材料与方法(Materials and methods)
1.1 藻种及培养条件
本实验所用小球藻(Chlorella vulgaris)于2013年7月分离自安徽省黄山市休宁县汊口乡一小型人工水池。藻种使用BG-11(+N)培养基进行培养,并长期保种于光照培养箱内,温度为20 ℃,光照强度为60 μmol·m-2·s-1,光暗比(L∶D)为12 h∶12 h。
1.2 实验方法
1.2.1 模拟酸雨母液制备及培养基pH值测定
人工调配质量分数为98%的浓硫酸(国药集团化学试剂有限公司)与质量分数为65%的浓硝酸(国药集团化学试剂有限公司),按物质的量比为8∶1制备模拟酸雨母液(黄山地区以硫酸型酸雨为主)。通过向培养基中加入不同体积的模拟酸雨母液,分别获得pH值为5.65和4.50的模拟酸雨培养基,正常培养基使用1 mol L-1的HCl和NaOH调节pH值为7.10作为对照组。模拟酸雨制备过程中使用Mettler Toledo DL15 Titrator(瑞典)对pH值进行测定,测定前使用National Bureau of Standards(NBS)缓冲液对pH计进行校正。
L-1的HCl和NaOH调节pH值为7.10作为对照组。模拟酸雨制备过程中使用Mettler Toledo DL15 Titrator(瑞典)对pH值进行测定,测定前使用National Bureau of Standards(NBS)缓冲液对pH计进行校正。
1.2.2 模拟酸雨处理及细胞粒径、比生长速率(μ)的测定
通过向已调节好pH值(7.10、5.65和4.50)的培养基中加入指数生长期的藻细胞,调节细胞浓度至约1.0×105 个 mL-1,于体积为1 L的聚碳酸酯瓶(PC)中培养,每个处理下3个重复培养。将上述不同pH处理的小球藻藻体置于高(150 μmol·m-2·s-1)、低(60 μmol·m-2·s-1,即培养光强)光强下进行短期培养(24 h),光暗比(L∶D)为12 h∶12 h,培养温度为20 ℃。使用颗粒计数仪(Z2, Beckman,美国)测定上述条件下培养24 h后的细胞浓度及细胞粒径,并对各处理下的pH值进行测定获得其变化情况。
mL-1,于体积为1 L的聚碳酸酯瓶(PC)中培养,每个处理下3个重复培养。将上述不同pH处理的小球藻藻体置于高(150 μmol·m-2·s-1)、低(60 μmol·m-2·s-1,即培养光强)光强下进行短期培养(24 h),光暗比(L∶D)为12 h∶12 h,培养温度为20 ℃。使用颗粒计数仪(Z2, Beckman,美国)测定上述条件下培养24 h后的细胞浓度及细胞粒径,并对各处理下的pH值进行测定获得其变化情况。
比生长速率(μ)的计算使用公式:
μ(h-1)=(lnNA-lnNB)/t
式中:NA为各处理下培养24 h(t)后的细胞浓度(个·mL-1),NB为初始接种的细胞浓度(个·mL-1)。
1.2.3 色素的提取和测定
各pH值处理24 h后,将一定体积的藻液经GF/F滤膜(0.7 μm, Whatman)过滤,置于离心管内并加入5 mL甲醇,4 ℃条件下过夜提取,于离心机内5 000 g下离心10 min,分光光度计(Beckman DU-800,美国)下测定200~750 nm吸光值(Anm)。叶绿素a(Chl a)、叶绿素b(Chl b)及类胡萝卜素(carotenoid)的测定方法参照Wellburn[15],紫外吸收物质(MAAs)的测定依据提取液上清吸收光谱在334 nm处的吸收峰高度(HOD)[16],以HOD与Chl a的比值获得,各种色素的具体计算方法如下:
Chl a (μg·mL-1)=15.65×(A666-A750)-7.34×(A653-A750)
Chl b (μg·mL-1)=27.05×(A653-A750)-11.21×(A666-A750)
Carotenoid (μg·mL-1)=(1000×(A470-A750)-2.86×Chl a-129.2×Chl b)/221
MAAs (HOD·ng-1)=H/Chl a
1.2.4 紫外辐射处理
将上述不同pH值、高低光强下培养24 h后的小球藻置于35 mL石英管内,通过在石英管外包裹不同的滤光膜获得2种辐射处理,即只有可见光辐射(P)(Ultraphan 395滤膜,UV Opak,Digefra,德国),或者全波段辐射(PAB,可见光+紫外线A+紫外系B)(Ultraphan 295滤膜,UVOpak,Digefra,德国)。本研究辐射处理使用太阳模拟器(Sol 1200 W,A. G. Hönle,Martinsried,德国)进行,该光源可获得稳定的辐射处理,其中P的强度为87.5 W·m-2,UVA的强度为33.5 W·m-2,UVB的强度为1.91 W·m-2(参考我国南方地区夏季UVB辐射强度设置)。
1.2.5 叶绿素荧光参数测定
叶绿素荧光参数使用Xe-PAM(Walz,德国)进行测定。小球藻经不同pH处理0、0.5、1、3、8、20和24 h后,对其有效光化学效率(Yield)进行时间序列测定。转移至阳光模拟器下进行短期辐射处理,测定经P和PAB辐射处理1 h后的Yield和光响应曲线。光响应曲线共设置8个光强梯度,即0、156、226、337、533、781、1 077、1 593和2 130 μmol·m-2·s-1,其中饱和脉冲强度为5 000 μmol·m-2·s-1,持续时间为0.8 s。
Yield的计算公式为:
Yield=(F’m-F)/F’m
式中:Yield为光系统Ⅱ的有效光化学效率,F为光适应下的实际荧光值,F’m为光适应下的最大叶绿素荧光。
光响应曲线相对电子传递速率(rETR)通过以下的公式计算:
rETR=Yield×0.5×PFD
式中:0.5代表光系统Ⅱ吸收的光量子占总量的50%,PFD为光化光的强度(μmol·m-2·s-1)。
快速光响应曲线的拟合参照Jassby和Platt[17]的方法,使用如下公式进行:
Y=rETRmax×tanh (α×x/rETRmax)
式中:x表示为光强,Y为rETR。
通过拟合可获得相对最大电子传递速率(rETRmax)、光能利用效率(α),以rETRmax与α的比值计算得到饱和光强(Ik)。
经阳光模拟器下处理后,相对于初始状态的Yield,由P以及PAB导致的抑制率,计算方式如下:
式中:InhP、InhPAB表示在阳光模拟器下经P和PAB辐射处理1 h后相对于PInitial(初始Yield值)的抑制率,PP和PPAB表示P和PAB下1 h后的Yield值。
1.2.6 数据统计分析
不同pH值处理之间的显著性使用one-way ANOVA(Turkey)分析;培养光强、pH值以及辐射处理两两之间以及三者之间的交互效应使用Two/Three-way ANOVA分析(P<0.05)。数据处理及分析使用Prism 9.0和SPSS 26.0软件进行。
2 结果(Results)
2.1 培养体系pH值变动情况
相对于初始pH值,经24 h培养后,各处理下pH值均有一定升高,高光(HL)下pH值7.10、5.65和4.50处理,pH值分别升高了4.74%、9.20%和4.30%,低光(LL)下分别升高了3.19%、7.49%和2.59%(表1)。
表1 不同处理下初始和培养24 h后的pH值
Table 1 pH values at the beginning and after 24 h
culture under different treatments

初始Initial24 h后After 24 hpH 7.107.107.44±0.02高光(HL) High light (HL)pH 5.655.656.17±0.02(150 μmol·m-2·s-1)pH 4.504.504.69±0.03pH 7.107.107.33±0.02低光(LL) Low light (LL)pH 5.655.656.07±0.02(60 μmol·m-2·s-1)pH 4.504.504.62±0.01
2.2 细胞粒径及比生长速率(μ)
多因素方差分析表明,pH值处理对小球藻的μ产生显著影响(P<0.05)。pH 5.65下,低光处理与对照组μ无显著差异,高光处理μ显著升高了79.6%(P<0.05)(图1(a));较低的pH值(4.50)细胞出现负增长,相对于pH值7.10处理,高、低光强下分别降低了223%(P<0.05)和225%(P<0.05)(图1(a))。
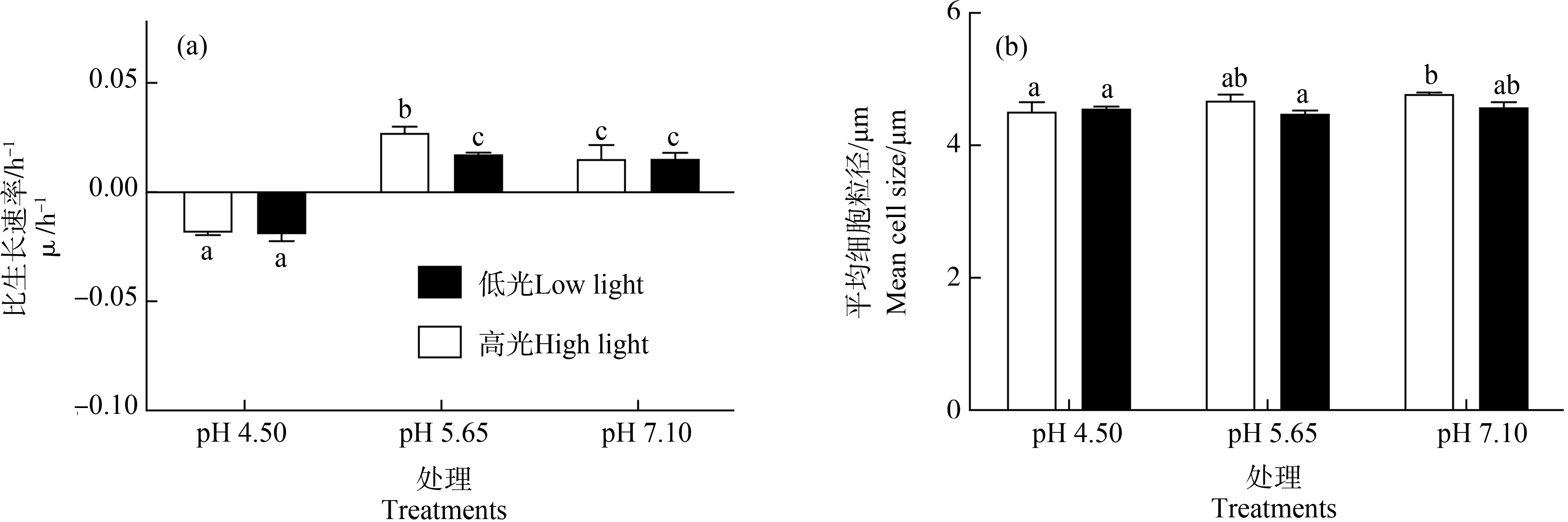
图1 小球藻经正常pH值(7.10)以及模拟酸雨胁迫(pH值5.65和4.50)处理,转移至高光(150 μmol·m-2·s-1)
和低光(60 μmol·m-2·s-1)下培养24 h后的比生长速率(μ)(a)和平均细胞粒径(b)(n=3)
Fig. 1 Specific growth rate (μ) (a) and mean cell size (b) of Chlorella vulgaris cultured under high (150 μmol·m-2·s-1) and
low (60 μmol·m-2·s-1) light conditions for 24 h in control pH (7.10) and acid stress treatments (pH 5.65 and 4.50) (n=3)
多因素方差分析表明,光强与pH值处理均单独或交互对细胞粒径产生显著影响(P<0.05)。各pH值处理下高、低光强间细胞粒径无显著差异(P>0.05);相较于对照组(7.10),低pH值下(4.50)细胞粒径在高光培养下显著降低了5.5%(P<0.05),低光下各pH值处理间无显著差异(P>0.05)(图1(b))。
2.3 色素含量变化
多因素方差分析表明,光强而非pH值对光合色素(叶绿素a、b)及光保护色素(类胡萝卜素)含量产生了显著影响(均P<0.05);光强与pH值协同对叶绿素a、叶绿素b和类胡萝卜素含量无显著交互效应(均P>0.05)(图2)。不同pH值处理24 h后,高光强培养的藻体,单位细胞的叶绿素a(图2(a))、叶绿素b(图2(b))都显著低于低光培养的藻体(P<0.05);类胡萝卜素含量在高、低光强处理间无显著差异(P>0.05)(图2(c));高光强下,类胡萝卜素与叶绿素a的比值显著高于低光处理组(P<0.05)(图2(d));MAAs在高、低光强下无显著差异(P>0.05)(图2(e))。高、低光强处理下,叶绿素a、叶绿素b、类胡萝卜素、类胡萝卜素与叶绿素a的比值以及MAAs在各pH值处理间无显著差异(P>0.05)。

图2 小球藻经正常pH值(7.10)以及模拟酸雨胁迫(pH值5.65和4.50)处理,转移至高光(150 μmol·m-2·s-1)
和低光(60 μmol·m-2·s-1)下培养24 h后的叶绿素a(a)、叶绿素b(b)、
类胡萝卜素(c)、类胡萝卜素与叶绿素a的比值(d)以及三苯甲咪唑类氨基酸(MAAs)(e)(n=3)
注:MAAs的浓度以单位叶绿素a的质量计。
Fig. 2 Chlorophyll a (a), chlorophyll b (b), carotenoid (c), the ratio of carotenoid to chlorophyll a (d) and mycosporinie-like
amino acids (MAAs) (e) of Chlorella vulgaris cultured under high (150 μmol·m-2·s-1) and low (60 μmol·m-2·s-1) light
conditions for 24 h in control pH (7.10) and acid stress treatments (pH 5.65 and 4.50) (n=3)
Note: The concentration of MAAs is expressed as mass per unit Chl a.
2.4 有效光化学效率(Yield)及快速光响应曲线
经模拟酸雨处理后,对各处理下藻体Yield进行时间序列测定。相对于初始Yield,高、低光强下藻体Yield随处理时间的增加都呈增加趋势(图3)。高光培养下,相对于pH值7.10处理,低pH值处理(4.50)的藻体,Yield随时间呈先升高后降低趋势,经模拟酸雨处理8、20和24 h后,Yield相对于pH值7.10处理显著降低了6.77%、4.69%和2.61%(P<0.05)(图3(a));低光处理下,各pH处理间在一系列时间序列下都无显著性差异(P>0.05)(图3(b))。多因素方差分析显示,不同培养光强对各pH值处理下藻体Yield具有显著影响(P<0.05)。对比高、低光强处理各pH值下的Yield,整体上低光培养的藻体具有高的Yield(图3(a)和图3(b))。
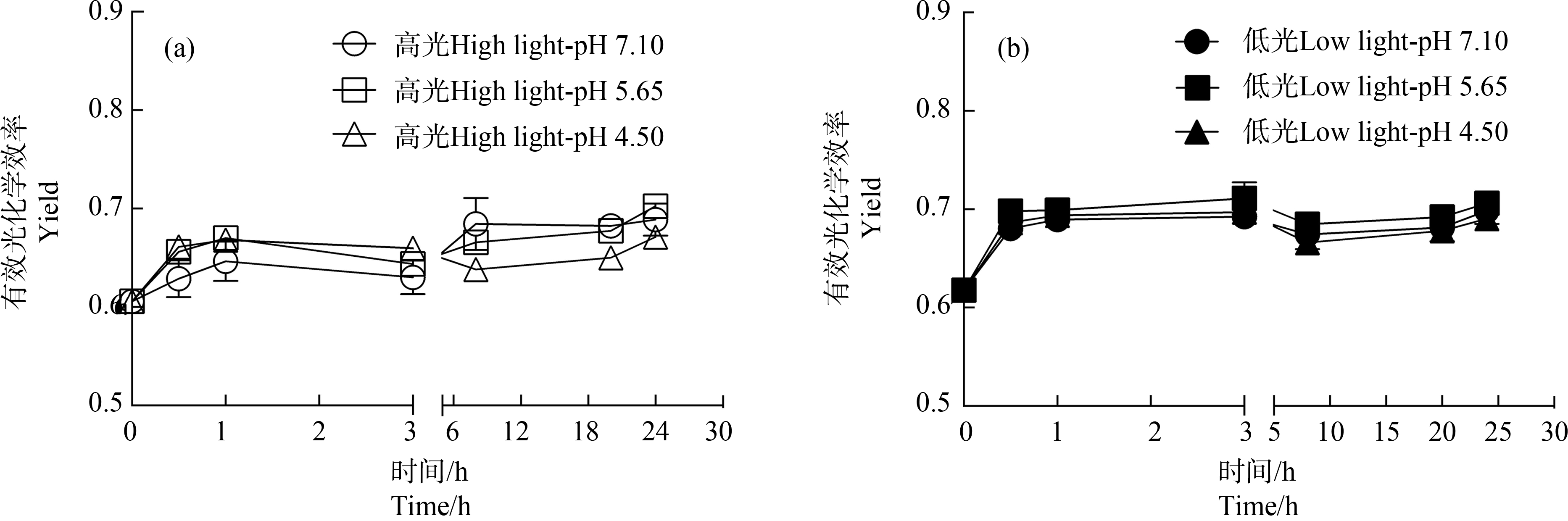
图3 小球藻经正常pH值(7.10)以及模拟酸雨胁迫(pH值5.65和4.50)处理,转移至高光(150 μmol·m-2·s-1)(a)和
低光(60 μmol·m-2·s-1)(b)下培养24 h过程中的有效光化学效率(Yield)(n=3)
Fig. 3 The effective quantum yield (Yield) of control pH (7.10) and acid stress (pH 5.65 and 4.50) treated Chlorella vulgaris during
the 24 h culture under high (150 μmol·m-2·s-1) and low (60 μmol·m-2·s-1) light intensity (n=3)
置于阳光模拟器下辐射处理1 h后,与培养光强相比,Yield在各pH值下都显著受到抑制,且抑制程度在PAB处理下更高(P<0.05)(图4)。多因素方差分析表明,培养光强、辐射处理(P、PAB)以及pH处理都显著影响了藻体的Yield(P<0.05),且培养光强、辐射处理及pH处理两两之间以及三者之间对Yield均产生了交互影响(P<0.05)。高光培养下的藻,相对于pH值7.10处理,在pH值4.50下经P、PAB辐射处理后,Yield显著降低了14.3%(P<0.05)和21.4%(P<0.05)(图4(a));而低光下培养的藻,经阳光模拟器下辐射处理后(PAB),Yield在低pH值(5.65、4.50)下整体低于高光处理组,相较于pH值7.10处理,pH值4.50下Yield显著降低了20.8%(P<0.05)(图4(b))。高光强培养的藻体,UVR诱导的Yield抑制率在各pH处理间无显著差异(P>0.05);而低光下培养的藻,pH值4.50下UVR诱导的抑制率在所有处理间最高,相较于pH值7.10处理升高了53.2%(P<0.05)(图4(c))。

图4 小球藻经正常pH值(7.10)以及模拟酸雨胁迫(pH值5.65和4.50)处理,转移至高光(150 μmol·m-2·s-1)(a)
和低光(60 μmol·m-2·s-1)(b)下培养24 h后,置于阳光模拟器下给予可见光(P)和可见光+紫外线A+紫外线B(PAB)
辐射处理1 h的Yield和UVR诱导的抑制率(c) (n=3)
Fig. 4 The Yield (a), (b) and its inhibition rate induced by UVR (c) of control pH (7.10) and acid stress (pH 5.65 and 4.50)
treated Chlorella vulgaris that have been cultured under high (150 μmol·m-2·s-1) and low (60 μmol·m-2·s-1) light
intensity for 24 h when exposure with P and PAB for 1 h (n=3)
对比高、低培养光强处理下UVR导致的抑制率,pH值4.50处理下,相对于高光培养的藻,UVR诱导的抑制率在低光强处理下增加了62.1%(P<0.05);其余pH值处理下,高、低光强间无显著差异(P>0.05)(图4(c))。多因素方差分析表明,培养光强以及pH值处理都可显著影响藻体对UVR的响应(抑制率),且二者具有交互影响(P<0.05)。
总体上,pH值处理未对藻体rETRmax、α和IK产生影响(均P>0.05,three-Way ANOVA);而紫外辐射显著影响了藻体的rETRmax、α和IK(均P<0.05,three-Way ANOVA)(图5和表2)。相较于P处理,PAB处理下rETRmax、α显著降低,IK呈升高趋势;培养光强与紫外辐射耦合显著影响了α(P<0.05)和IK(P<0.05)(表2)。高光培养下的藻体经PAB辐射处理后,rETRmax、α随pH值降低呈降低趋势;低光培养下的藻体,经PAB辐射处理后,rETRmax、α和IK在各pH值间无显著差异(P>0.05),然而UVR诱导的rETRmax和α的抑制率在低光处理下整体高于高光培养的藻体(表2)。

图5 小球藻在正常pH值(7.10)以及模拟酸雨胁迫(pH值5.65和4.50)处理后转移至高光(150 μmol·m-2·s-1)(a)
和低光(60 μmol·m-2·s-1)(b)下培养24 h后,置于阳光模拟器下给予可见光(P)和
可见光+紫外线A+紫外线B(PAB)辐射处理1 h的快速光响应曲线(n=3)
Fig. 5 The rapid light curve of control pH (7.10) and acid stress (pH 5.65 and 4.50) treated Chlorella vulgaris that have
been cultured under high (150 μmol·m-2·s-1) (a) and low (60 μmol·m-2·s-1) (b) light intensity for 24 h, exposure
with P and PAB for 1 h (n=3)
表2 根据图5快速光响应曲线计算得到的不同光强水平、pH值下培养的小球藻经可见光(P)和可见光+紫外线A
+紫外线B(PAB)辐射处理1 h的最大相对电子传递速率(rETRmax)、光能利用效率(α)和饱和光强(IK)(n=3)
Table 2 The calculated maximum relative electron transport rate (rETRmax), light using efficiency (α) and
saturation light intensity (IK) of Chlorella vulgaris that acclimated under high and low light intensity with
different pH treatments, when exposure with P and PAB for 1 h, the calculation was according to figure 5 (n=3)
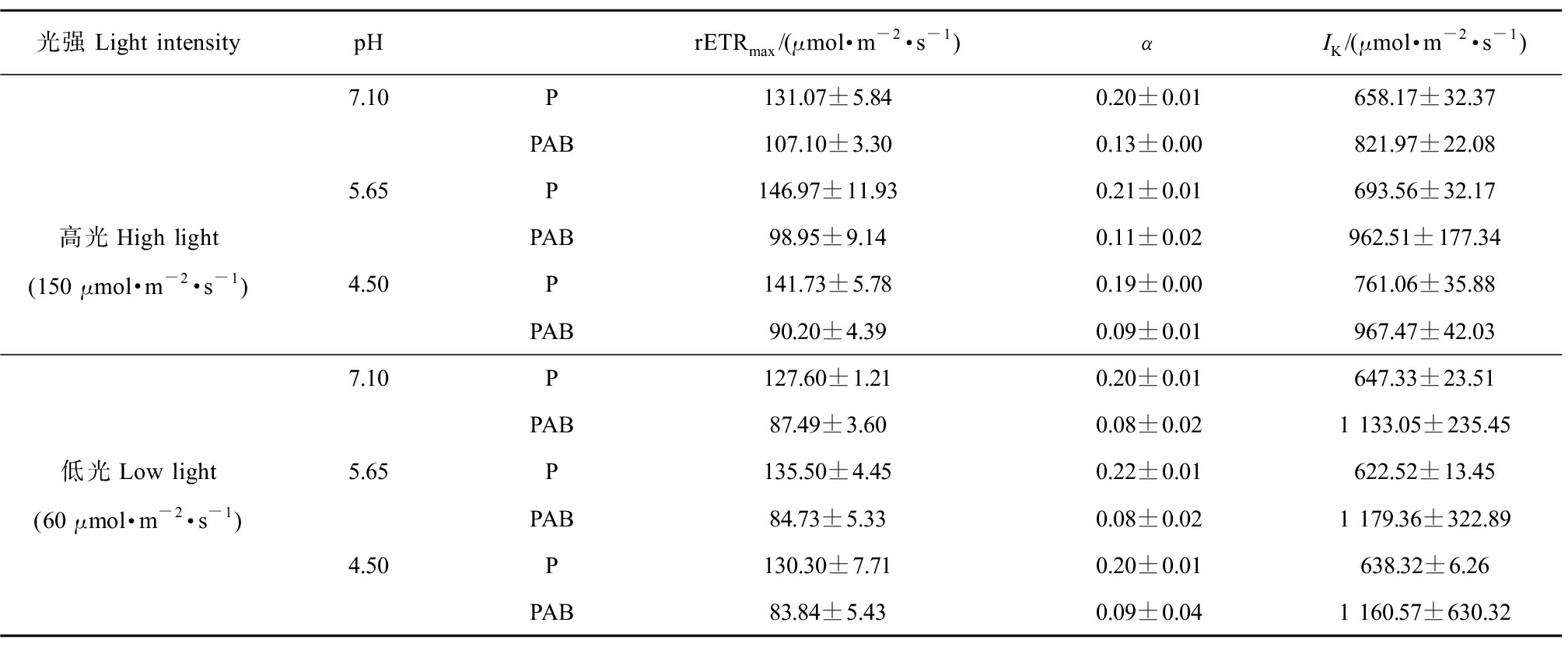
光强Light intensitypHrETRmax/(μmol·m-2·s-1)αIK/(μmol·m-2·s-1)7.10P131.07±5.840.20±0.01658.17±32.37PAB107.10±3.300.13±0.00821.97±22.085.65P146.97±11.930.21±0.01693.56±32.17高光High lightPAB98.95±9.140.11±0.02962.51±177.34(150 μmol·m-2·s-1)4.50P141.73±5.780.19±0.00761.06±35.88PAB90.20±4.390.09±0.01967.47±42.037.10P127.60±1.210.20±0.01647.33±23.51PAB87.49±3.600.08±0.021 133.05±235.45低光Low light5.65P135.50±4.450.22±0.01622.52±13.45(60 μmol·m-2·s-1)PAB84.73±5.330.08±0.021 179.36±322.894.50P130.30±7.710.20±0.01638.32±6.26PAB83.84±5.430.09±0.041 160.57±630.32
3 讨论(Discussion)
对浮游植物光合生理过程以及群落结构组成产生调节效应的诸多生态因子中,水体pH值和光照(光质、光强)是最为主要的调节因子。小球藻是绿藻门中分布较为广泛(淡、咸水水体)的世界性普生种类[18],适应与耐受环境胁迫能力较强,也是新安江流域的重要优势种类[9],探讨流域重要环境胁迫(酸雨与UVR)对其光合生理的影响,具有重要生态学意义。本研究结果表明小球藻对模拟酸雨引起的短期pH值降低有一定耐受能力,生长及色素对pH值降低的响应相较于培养光强影响的响应要低,低光、较低pH值(4.50)下培养的藻体光合过程对高光强、紫外辐射的敏感性增加。
酸雨的生态学效应在陆生植物中已开展了较多的研究[19-20],酸雨引起的水体酸化对水生藻类的影响也有了一定的认识[21-23]。以往的研究表明,酸雨胁迫引起的水体短期或长期酸化可改变浮游[6, 24]或底栖生物群落结构组成[21]。酸雨引起的水体酸化其效应主要包括水体酸碱缓冲能力降低(pH值下降)和无机碳浓度、形式改变[25],因不同门类、属种的浮游植物的敏感程度(无机碳亲和力、酸碱耐受能力)不同[26],响应水体酸化的光合生理过程也存在显著的种间或株系间差异[6-7]。本研究短期模拟酸雨临界点pH值(5.65)对小球藻生长、细胞粒径大小及色素含量均未产生显著影响,相较于蓝藻门铜绿微囊藻产毒株系905以及不产毒株系469[7],小球藻对模拟酸雨引起的水体酸化耐受性较高、敏感性较低。这种响应模拟酸雨胁迫引起水体pH降低的种间差异性表现,在酸雨控制区内可能成为水体浮游植物群落结构组成的主要调节因素。浮游植物光合色素含量可受光强变动的调节[27-28],本研究也表明光合色素(Chl a、Chl b)受培养光强的影响较大、响应较快,而光合及光保护色素(类胡萝卜素、MAAs)对短期pH值变化的响应不敏感,整体上未受光强或pH值影响。光保护色素未受培养光强升高的影响,表明本研究设置的高光培养(150 μmol·m-2·s-1)尚未达到其饱和光强,无需通过光保护色素的合成应对光胁迫。
水体酸化引起的H+浓度升高,酸碱耐受能力不同的藻类(胞内酸碱平衡调控),其能量代谢过程(光合放氧、固碳、光呼吸及暗呼吸等过程)也将受到不同程度的影响,进而引起差异性的光合特性与生长表现[29]。水体H+增加(CO2浓度升高引起)与高光强耦合可显著抑制浮游植物的光合效率、诱导高的非光化学淬灭(NPQ)从而抑制藻类生长[30-31]。本研究中也发现低pH/高H+与高的培养光强耦合,对藻体光化学效率产生协同抑制效应,表明较低的pH下藻体对光强的敏感性增加、光能利用效率降低。
以往研究表明UVR可通过损伤光系统光合元件(例如,光系统II关键蛋白D1、PsbA和PsbD等)[32-34]、诱导活性氧自由基等[35]降低藻体光合活性。此外,UVR与酸雨胁迫耦合可进一步降低浮游植物的光合能力,且这一影响存在种间/株系间差异[7]。本研究中UVR对Yield、最大相对电子传递速率(rETRmax)和光能利用效率(α)的抑制率在低pH值(4.50)、低光培养下的藻体中更为显著,藻体对高光及紫外辐射的敏感性增加,这可能与低光培养下藻体相对较低的carotenoid/Chl a以及光系统Ⅱ高的损伤、低的修复速率有关[34]。这一结果表明藻细胞经历的光环境(高、低光强)可显著影响水体酸化与UVR的耦合效应。
根据《中国生态环境状况公报》公布的近30年的观测数据,我国受酸雨影响的城市依然处于较高的比例(例如,2020年度发生酸雨的城市占所有监测城市的34.0%),酸雨胁迫及其生态学效应在未来很长一段时间仍将是我国面临的重要环境问题之一。淡水水体,尤其是河流生态系统,水体光环境(光强、光质)受水深、流速、浊度以及降雨量等因素影响,并存在季节变化特征。酸雨控制区不同门类、属种的浮游植物如何响应与适应pH值与光环境的变化将对河流浮游植物的群落结构组成与变动起到重要调节作用。小球藻作为新安江流域主要优势种类,对短期水体酸化有一定耐受能力,然而,气候变化背景下其光合生理过程如何响应与适应未来长期、多重环境胁迫的影响,将决定其在水生态系统中的竞争优势与结果。本研究是基于短期模拟酸雨胁迫与UVR耦合效应的研究,未来的研究将通过开展长期胁迫下的响应与适应机制探讨,以及通过对流域其他门类(蓝藻门、硅藻门等)、类群(例如非优势种类)进行比较生理学分析,以系统了解酸雨控制区光强、光质如何影响水体浮游植物群落多样性及演替规律。
[1] Kwiatkowski R E, Roff J C. Effects of acidity on the phytoplankton and primary productivity of selected northern Ontario Lakes [J]. Canadian Journal of Botany, 1976, 54(22): 2546-2561
[2] Leavitt P R, Findlay D L, Hall R I, et al. Algal responses to dissolved organic carbon loss and pH decline during whole-lake acidification: Evidence from paleolimnology [J]. Limnology and Oceanography, 1999, 44(3part2): 757-773
[3] Ohta H, Kobayashi Y, Moriyama A, et al. Acid Stress Responsive Genes, slr0967 and sll0939, are Directly Involved in Low-pH Tolerance of Cyanobacterium synechocystis sp. PCC6803 [M]//Advanced Topics in Science and Technology in China. Berlin, Heidelberg: Springer Berlin Heidelberg, 2013: 659-662
[4] Lessmann D, Fyson A, Nixdorf B. Phytoplankton of the extremely acidic mining lakes of Lusatia (Germany) with pH ≤3 [J]. Hydrobiologia, 2000, 433: 123-128
[5] Raut R, Sharma S, Bajracharya R M. Biotic response to acidification of lakes—A review [J]. Kathmandu University Journal of Science, Engineering and Technology, 2012, 8(1): 171-184
[6] 李伟, 杨雨玲, 董丽丽, 等. 短期酸化对新安江流域屯溪段水体浮游植物群落结构及多样性的影响[J]. 生态毒理学报, 2016, 11(6): 313-322
Li W, Yang Y L, Dong L L, et al. Short-term impact of acidification on the community structure and diversity of aquatic phytoplankton in Xin’anjiang River Basin (Tunxi section) [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 313-322 (in Chinese)
[7] 李伟, 杨雨玲, 黄松, 等. 产毒与不产毒铜绿微囊藻对模拟酸雨及紫外辐射的生理响应[J]. 生态学报, 2015, 35(23): 7615-7624
Li W, Yang Y L, Huang S, et al. Physiological responses of toxigenic and non-toxigenic strains of Microcystis aeruginosa to simulated acid rain and UV radiation [J]. Acta Ecologica Sinica, 2015, 35(23): 7615-7624 (in Chinese)
[8] 胡长玉, 方建新, 李伟, 等. 新安江(安徽段)及其支流丰水期浮游植物功能群[J]. 生态学杂志, 2019, 38(4): 1013-1021
Hu C Y, Fang J X, Li W, et al. Phytoplankton functional groups of Xin’anjiang River Basin (Anhui section) and its tributaries in flood season [J]. Chinese Journal of Ecology, 2019, 38(4): 1013-1021 (in Chinese)
[9] 张国庆, 杨雨玲, 唐爱国, 等. 新安江流域(屯溪段)浮游植物群落结构及其与环境因子的关系[J]. 生态学杂志, 2020, 39(2): 527-540
Zhang G Q, Yang Y L, Tang A G, et al. Phytoplankton community structure and its relationship with environmental factors in Xin’anjiang River Basin (Tunxi section) [J]. Chinese Journal of Ecology, 2020, 39(2): 527-540 (in Chinese)
[10] Li W, Yang Y L, Li Z Z, et al. Effects of seawater acidification on the growth rates of the diatom Thalassiosira (Conticribra) weissflogii under different nutrient, light, and UV radiation regimes [J]. Journal of Applied Phycology, 2017, 29(1): 133-142
[11] Harrison J W, Smith R E H. Effects of ultraviolet radiation on the productivity and composition of freshwater phytoplankton communities [J]. Photochemical & Photobiological Sciences, 2009, 8(9): 1218-1232
[12] Litchman E, Neale P J. UV effects on photosynthesis, growth and acclimation of an estuarine diatom and cryptomonad [J]. Marine Ecology Progress Series, 2005, 300: 53-62
[13] van de Poll W H, Janknegt P J, Van Leeuwe M A, et al. Excessive irradiance and antioxidant responses of an Antarctic marine diatom exposed to iron limitation and to dynamic irradiance [J]. Journal of Photochemistry and Photobiology B: Biology, 2009, 94(1): 32-37
[14] Buma A G J, Boelen P, Jeffrey W H. UVR-induced DNA Damage in Aquatic Organisms [M]//UV Effects in Aquatic Organisms and Ecosystems. Cambridge: Royal Society of Chemistry, 2007: 291-328
[15] Wellburn A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution [J]. Journal of Plant Physiology, 1994, 144(3): 307-313
[16] Dunlap W C, Rae G A, Helbling E W, et al. Ultraviolet-absorbing compounds in natural assemblages of Antarctic phytoplankton [J]. Antarctic Journal of the United States, 1995, 30: 323-326
[17] Jassby A D, Platt T. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton [J]. Limnology and Oceanography, 1976, 21(4): 540-547
[18] 中国科学院中国孢子植物志委员会. 中国淡水藻志(第八卷): 绿藻门: 绿球藻目(上) [M]. 北京: 科学出版社, 2004: 30-31
[19] Du E Z, Dong D, Zeng X, et al. Direct effect of acid rain on leaf chlorophyll content of terrestrial plants in China [J]. Science of the Total Environment, 2017, 605-606: 764-769
[20] Liu Z Q, Yang J Y, Zhang J E, et al. A bibliometric analysis of research on acid rain [J]. Sustainability, 2019, 11(11): 3077
[21] Ledger M E, Hildrew A G. The ecology of acidification and recovery: Changes in herbivore-algal food web linkages across a stream pH gradient [J]. Environmental Pollution, 2005, 137(1): 103-118
[22] Gao S. A decline in macro-algae species resulting in the overwhelming prevalence of Corallina species is caused by low-pH seawater induced by short-term acid rain [J]. Journal of Experimental Marine Biology and Ecology, 2016, 475: 144-153
[23] Ledger M E, Hildrew A G. Growth of an acid-tolerant stonefly on epilithic biofilms from streams of contrasting pH [J]. Freshwater Biology, 2001, 46(11): 1457-1470
[24] Vinebrooke R D, Dixit S S, Graham M D, et al. Whole-lake algal responses to a century of acidic industrial deposition on the Canadian Shield [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2002, 59(3): 483-493
[25] Stumm W, Morgan J J. Aquatic Chemistry: Chemical Equilibria and Rates in Natural Waters [M]. John Wiley & Sons, 2012: 138-140
[26] Reinfelder J R. Carbon concentrating mechanisms in eukaryotic marine phytoplankton [J]. Annual Review of Marine Science, 2011, 3: 291-315
[27] Li W, Wang T F, Campbell D A, et al. Ocean acidification interacts with variable light to decrease growth but increase particulate organic nitrogen production in a diatom [J]. Marine Environmental Research, 2020, 160: 104965
[28] Larkum A W D. Light-harvesting Systems in Algae [M]// Larkum A W D, Douglas S E, Raven J A. Photosynthesis in Algae. Dordrecht: Springer Netherlands, 2003: 277-304
[29] Gao K S, Campbell D A. Photophysiological responses of marine diatoms to elevated CO2 and decreased pH: A review [J]. Functional Plant Biology, 2014, 41(5): 449-459
[30] Gao K S, Xu J T, Gao G, et al. Rising CO2 and increased light exposure synergistically reduce marine primary productivity [J]. Nature Climate Change, 2012, 2(7): 519-523
[31] Liu N N, Yuan Y J, Yi J D, et al. The effects of modified acid rain on Anabaena flos-aquae under different light levels [J]. Fundamental and Applied Limnology, 2022, 195(4): 297-304
[32] Wu H Y, Abasova L, Cheregi O, et al. D1 protein turnover is involved in protection of photosystem Ⅱ against UV-B induced damage in the cyanobacterium Arthrospira (Spirulina) platensis [J]. Journal of Photochemistry and Photobiology B, Biology, 2011, 104(1-2): 320-325
[33] Nina Bouchard J, Campbell D A, Roy S. Effects of UV-b radiation on the d1 protein repair cycle of natural phytoplankton communities from three latitudes (Canada, Brazil, and Argentina) [J]. Journal of Phycology, 2005, 41(2): 273-286
[34] Wu H Y, Roy S, Alami M, et al. Photosystem Ⅱ photoinactivation, repair, and protection in marine centric diatoms [J]. Plant Physiology, 2012, 160(1): 464-476
[35] Häder D P, Williamson C E, Wängberg S, et al. Effects of UV radiation on aquatic ecosystems and interactions with other environmental factors [J]. Photochemical & Photobiological Sciences, 2015, 14(1): 108-126