抗生素(antibiotics)能干扰或抑制致病微生物的存在,广泛使用于人类及动物的疾病防治、畜牧及水产养殖等领域[1]。据统计,全世界抗生素的使用量可达10~20万t[2],其中我国是抗生素最大的生产国和消费国,2013年我国抗生素的使用量已高达16.2万t[3]。大多数的抗生素很难被人体或动物全部吸收,25%~75%的抗生素会以原药或代谢产物的形式通过粪便或尿液排入水环境中,已在各种水体中检测到了其广泛存在[4],主要包括四环素类、大环内酯类、磺胺类、喹诺酮类和氯霉素类[5-8]。
四环素类抗生素(tetracyclines, TCs)作为我国生产量和实际使用量最大的抗生素,在各种水体中被频繁地检测到[9-12]。其中,氧四环素(oxytetracycline, OTC)的检出浓度最高。在黄浦江中OTC和TC的最高浓度分别可达479 ng·L-1和440 ng·L-1[13]。在中国的海陵湾地区水体中检测到了21种抗生素,其中OTC的浓度最高,平均浓度为417.76 ng·L-1,最高浓度高达15.16 μg·L-1[12]。有关OTC在环境浓度慢性暴露下对水生生物的影响研究较少,近几年的研究发现环境浓度OTC影响鱼类的肠道结构和微生物群落。环境浓度OTC(420 ng·L-1)暴露或者投喂罗非鱼导致其生长受抑制、肠道屏障被破坏和肠道菌群失调[14-15]。420 ng·L-1OTC暴露导致斑马鱼抗氧化性显著降低,肠道屏障功能障碍,炎症因子表达量增加,肠道菌群受到干扰[16]。在水生态系统中,抗生素对水生生物的毒性效应也会受到一些非生物因素的影响,例如pH、温度、紫外线以及其他环境污染物(重金属、有机污染物等)。在众多的水环境污染物中,微塑料不仅能够直接对水生生物产生危害还可以作为载体吸附抗生素[17],因此其对抗生素毒性效应的影响亟待得到关注。
微塑料(microplastics, MPs)被定义为尺寸<5 mm的塑料颗粒,具有粒径小、不易被降解等特点。环境调查发现我国水体、土壤和沉积物等环境中均有微塑料,且水体是其主要归趋地之一[18]。调查表明黄浦江与长江河口交界处微塑料浓度为(4 137.3±2461.5)个·m-3[19]。武汉市湖泊水体大多流动性较小或是静水,其微塑料的累积量高达(8 925±1 591)个·m-3[20]。对水环境中微塑料种类的检测发现,聚苯乙烯微塑料(polystyrene microplastics, PS-MPs)是其主要成分之一[21]。MPs极易通过摄食等途径在水生生物体内累积,其在各种鱼类、中华白鳍豚和东亚江豚等肠道内均被检测到[22-25]。此外,微塑料能够抑制鱼类摄食和生长,引起肠道损伤和炎症,氧化应激毒性和生殖毒性等多种毒性效应[26-29]。其中,微塑料对鱼类肠道损伤和微生物群落的影响近年来受到了广泛的关注。研究发现PS-MPs暴露导致斑马鱼肠道菌群失调、炎症反应和肠道屏障功能障碍[30-32]。
为了探索PS-MPs和OTC对鱼类的联合毒性效应,本文以黄颡鱼幼鱼为实验生物,探究了环境浓度OTC(500 ng·L-1)和PS-MPs(100 μg·L-1和1 000 μg·L-1)单独及联合暴露28 d后对黄颡鱼幼鱼的生长、肠道氧化应激、肠道消化酶活性、肠道组织病理及肠道菌群的影响。本研究从个体水平、器官水平和微生物水平评价OTC和PS-MPs对黄颡鱼幼鱼的肠道影响,进而为评价PS-MPs和OTC的环境健康风险评价提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验试剂
氧四环素,CAS号为6153-64-6,纯度≥97%,购自上海麦克林生化科技有限公司,使用去离子水将OTC溶解配制成浓度为50 μg·mL-1的储备液,储存在4 ℃冰箱里。聚苯乙烯微塑料(PS-MPs,球形,5 μm,纯度≥99%)购自天津倍思乐色谱技术开发中心,用去离子水将微塑料原液稀释为1 mg·mL-1的储备液,储存在4 ℃冰箱;PS-MPs储备液使用前需超声20 min并用曝气24 h的自来水稀释为100 μg·L-1和1 000 μg·L-1的暴露液。
1.2 黄颡鱼驯养及暴露实验
黄颡鱼鱼苗购自武汉市黄优源渔业发展有限公司,将刚出苗3 d的黄颡鱼鱼苗转移至室内养殖系统中进行为期2周的暂养。在实验开始时,选取规格一致的健康仔鱼(平均体长(13.38±0.62)mm,平均体质量(0.028±0.003)g)分别暴露在CON组、OTC(500 ng·L-1)组、MPs-L(100 μg·L-1 PS-MPs)组、MPs-H(1 000 μg·L-1PS-MPs)组、MPs-L+OTC(100 μg·L-1PS-MPs+500 ng·L-1OTC)组和MPs-H+OTC(1000μg·L-1PS-MPs+500 ng·L-1OTC)组共6个浓度组中,每组有3个平行缸,每缸60尾鱼于18 L暴露液中。暴露养殖水为曝气24 h的自来水,暴露过程中持续稳定曝气(防止微塑料颗粒凝聚)。保持稳定的水质参数:pH=7~8,水温(26.1±0.8)℃,溶氧(16.4±0.2)mg·L-1,光周期为14 h/10 h(昼/夜),每天更换一半暴露液、暴露时间为28 d。每天投喂商业饲料3次(10:00、16:00和21:00),投喂率为鱼体质量的4%。
1.3 PS-MPs的表征分析
表征前,将PS-MPs进行20 min超声,采用超纯水制备5 mL浓度为1 000 μg·L-1的测试溶液。采用透射电子显微镜(TEM,HT-7700,日本日立有限公司)来观察PS-MPs的尺寸;用纳米粒度及Zeta电位分析仪(Zetasizer Nano ZS,英国马尔文公司)测得PS-MPs的Zeta电位。
1.4 生长指标的测定
暴露结束后,黄颡鱼禁食24 h后浸泡在<4 ℃的冰水浴中安乐死。每个浓度每个平行取25尾黄颡鱼幼鱼,测量并分析黄颡鱼幼鱼的体质量(body weight, BW)、体长(body length, BL)(黄颡鱼幼鱼吻到尾鳍基部)、存活率(survival rate, SR)、体质量增长率(weight gain rate, WGR)、特定生长率(specific growth rate, SGR)(d-1)、脑体比(brain somatic index, BSI)和肝体比(hepato somatic index, HSI)。计算公式如下:
存活率(SR)=(Nt/N0)×100%
体质量增长率(WGR)=(Wt-W0)/W0×100%
特定生长率(SGR)=[ln(Wt/Nt)-ln(W0/N0)]/t×100%
肝体比(HSI)=(肝脏质量/Wt)×100%
脑体比(BSI)=(脑质量/Wt)×100%
式中:W0为试验鱼的初始质量(g),Wt为试验鱼的终末质量(g),N0和Nt为试验开始和试验结束时每组鱼尾数,t为试验时间(d)
1.5 肠道组织病理分析
暴露28 d后,随机从每个浓度每个平行缸取4尾黄颡鱼幼鱼用于肠道组织病理学分析。取样前禁食24 h,解剖取中肠组织(1~2 cm)于4%多聚甲醛缓冲液固定24~48 h。肠组织经乙醇、二甲苯透明液脱水,石蜡包埋、切片(4 μm),苏木精和伊红(H &E)染色切片,使用立体显微镜(Leica, M205FA,德国)的400倍镜头进行组织病理学评估。
1.6 肠道抗氧化酶的活性测定
暴露28 d后,禁食24 h,随机从每个浓度每个平行中取3尾黄颡鱼幼鱼肠道测定酶的活性。装入EP冻存管迅速置于液氮冷冻,置于-80 ℃冰箱中保存待测。使用组织细胞破碎仪(Buller Blender, Tissulyser-24,美国Next Advance公司)将肠组织样品和0.86%冷生理盐水均质,4 ℃离心15 min(2 500 r·min-1)。取上清液按照试剂盒说明书测定肠道超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)酶活性。蛋白质浓度采用蛋白定量(TP)测定盒(BCA微板法)测定。实验所使用酶标仪为Synergy H4(Biotek, VT, USA),使用的商业化试剂盒均购自南京建成研究所。
1.7 肠道消化酶的活性测定
暴露结束后,每个浓度每个平行中取3尾黄颡鱼幼鱼用于消化酶活性的测定,肠道的取样方法和前处理方法同1.6。测定肠道胰蛋白酶(trypsin, TRS)、淀粉酶(amylase, AMS)和脂肪酶(lipase, LPS)活性的方法参照各试剂盒说明书。酶液蛋白质浓度采用蛋白定量(TP)测定盒(BCA微板法)测定。所使用的商业化试剂盒购自南京建成研究所。
1.8 肠道菌群16S rRNA扩增子测序分析
暴露结束后,随机从各实验组的每个平行缸中在无菌操作台上取6尾黄颡鱼幼鱼肠道用于肠道菌群测序检测。具体操作如下:冰盘上无菌解剖黄颡鱼肠道并收集,液氮速冻后转移至-80 ℃冰箱中待测。将取得的36个肠道样本送至广东美立康生物科技有限公司进行测序分析。具体分析流程如下:采用两步PCR法,使用通用正向引物515F(5’-GTGYCAGCMGCCGCGGTA-3’)和反向引物909R(5’-CCCCGYCAATTCMTTTRAGT-3’)扩增微生物16s rRNA基因的V4-V5高变区,扩增条件为94 ℃预变性3 min,然后进行30个循环的常规扩增(94 ℃变性40 s,56 ℃退火60 s,72 ℃延伸60 s),最后72 ℃延伸10 min。使用1.2%的琼脂糖凝胶电泳后采用sanPrep DNA凝胶回收试剂盒(生工,中国)纯化,所有纯化的DNA等量混合后,对高变区进行PCR扩增后用Illumina Miseq测序平台对PCR扩增产物进行测序,鉴定群落中的微生物组成和其相对丰度。采用QIIME 1.9.0软件按照序列97%的相似性将序列聚类为OTUs(Operational Taxonomic Units),计算α多样性指数和UniFrac距离矩阵并进行PCoA排序分析。
1.9 数据分析与统计
所有数据均以“平均值±标准误差”(Mean±SEM)表示,双因素方差分析(Two-way ANOVA)方法分析试验数据的差异性(IBM SPSS Statistics 22)。如果差异达到显著水平(P<0.05),选择Duncan法进行多重比较分析。运用R(4.1.2)采用相关分析方法分析黄颡鱼幼鱼生长、肠道氧化应激水平和肠道消化酶活性与肠道微生物之间的相关性。
2 结果(Results)
2.1 聚苯乙烯微塑料(PS-MPs)的表征
如图1所示,用透射电子显微镜观察到PS-MPs的尺寸为5 μm(图1(a)),用纳米粒度及Zeta电位分析仪(Zetasizer Nano ZS)测得PS-MPs的Zeta电位为-44.3 mV(图1(b)),表明PS-MPs在超纯水中,直径为5 μm,粒径几乎没有差异。
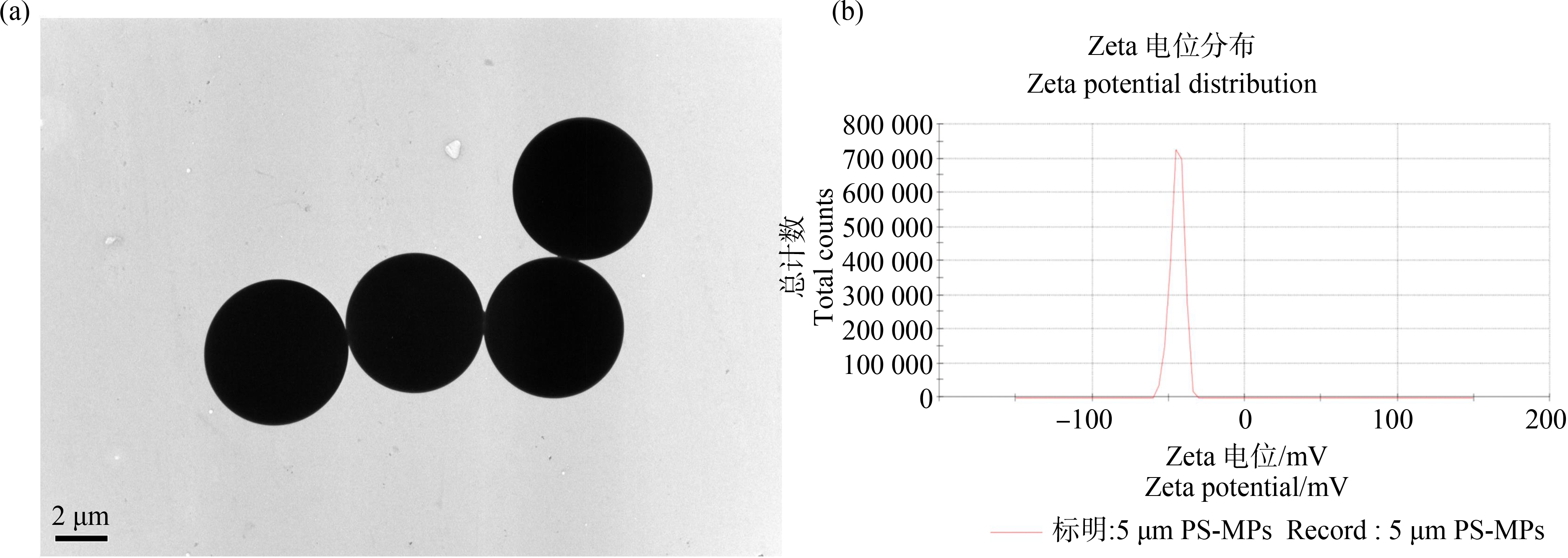
图1 聚苯乙烯微塑料(PS-MPs)的尺寸和Zeta电位
注:(a)PS-MPs透射电子显微镜图;(b)PS-MPs在水溶液中的Zeta电位。
Fig.1 Dimensions and compositions of polystyrene microplastics(PS-MPs)
Note:(a)TEM of PS-MPs;(b)Zeta potential of PS-MPs.
2.2 OTC和PS-MPs暴露28 d后对幼年黄颡鱼生长性能的影响
如表1所示,暴露28 d后,与对照组相比,OTC组、MPs-L组和MPs-L+OTC组的所有生长指标均无显著性差异;MPs-H组的体质量显著下降15.06%(P<0.05),体质量增长率显著下降8.41%(P<0.05);MPs-H+OTC组的体质量显著下降15.45%(P<0.05),体质量增长率显著下降17.17%(P<0.05),SGR显著下降7.49%(P<0.05),BSI显著降低25.57%(P<0.05);此外,与MPs-H组相比,MPs-H+OTC组的BSI显著降低了19.79%(P<0.05)。
表1 氧四环素(OTC)和PS-MPs单独及复合暴露对幼年黄颡鱼生长性能的影响
Table 1 Effects of oxytetracycline(OTC)and PS-MPs alone or in combination exposure on growth performance of juvenile yellow catfish
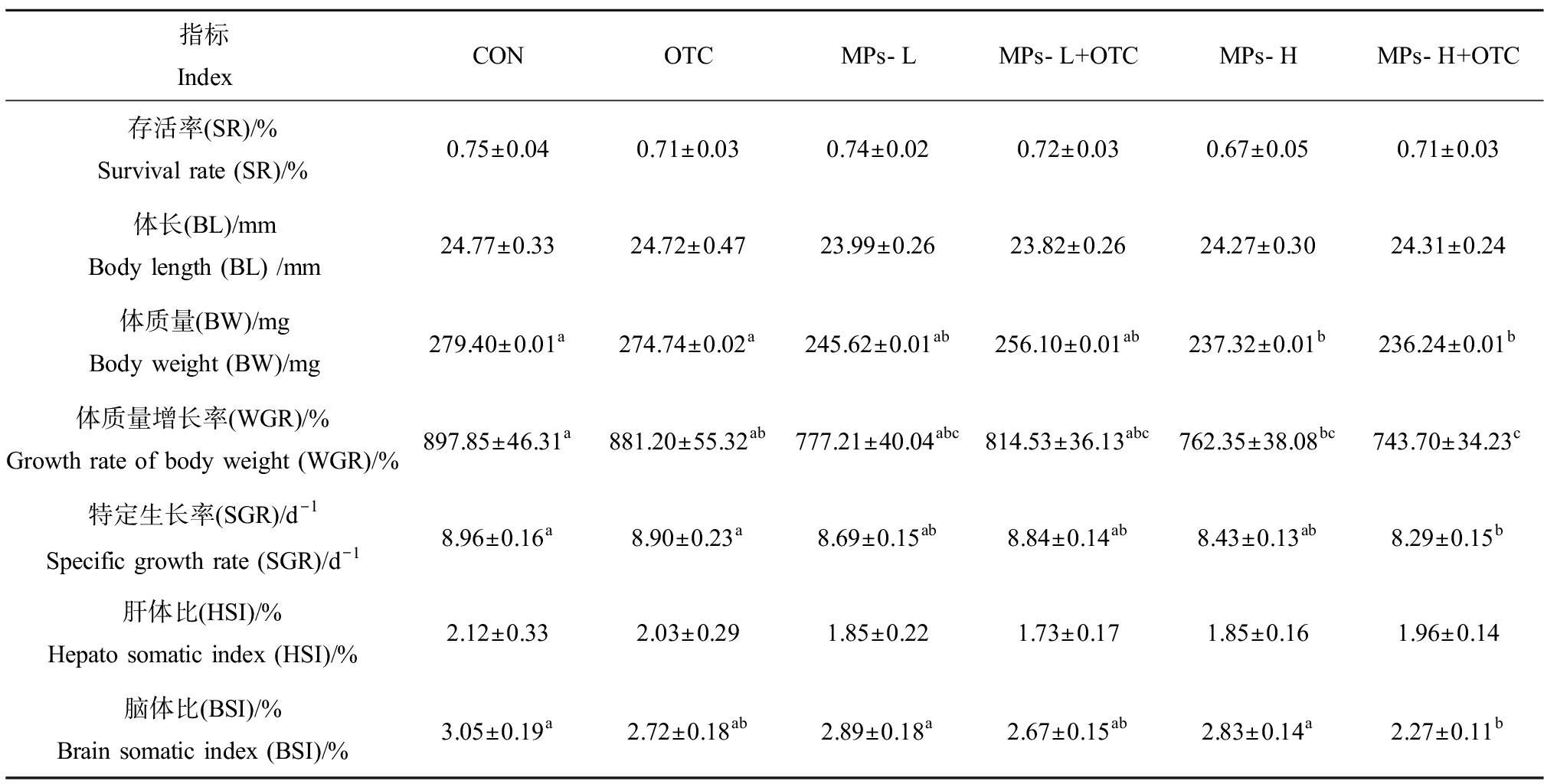
指标IndexCON OTCMPs-LMPs-L+OTCMPs-HMPs-H+OTC存活率(SR)/%Survival rate (SR)/%0.75±0.040.71±0.030.74±0.020.72±0.030.67±0.050.71±0.03体长(BL)/mm Body length (BL) /mm 24.77±0.33 24.72±0.47 23.99±0.26 23.82±0.26 24.27±0.30 24.31±0.24体质量(BW)/mgBody weight (BW)/mg 279.40±0.01a274.74±0.02a245.62±0.01ab256.10±0.01ab237.32±0.01b236.24±0.01b体质量增长率(WGR)/%Growth rate of body weight (WGR)/%897.85±46.31a881.20±55.32ab777.21±40.04abc814.53±36.13abc762.35±38.08bc743.70±34.23c特定生长率(SGR)/d-1Specific growth rate (SGR)/d-18.96±0.16a8.90±0.23a8.69±0.15ab8.84±0.14ab8.43±0.13ab8.29±0.15b肝体比(HSI)/% Hepato somatic index (HSI)/%2.12±0.332.03±0.291.85±0.221.73±0.171.85±0.161.96±0.14脑体比(BSI)/%Brain somatic index (BSI)/%3.05±0.19a2.72±0.18ab2.89±0.18a2.67±0.15ab2.83±0.14a2.27±0.11b
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05)。
Note: Different lowercase letters in the same column indicated significant difference among groups(P<0.05).
2.3 中肠组织病理分析
如图2所示,黄颡鱼肠组织结构可由黏膜层、肌层和浆膜层组成,淋巴细胞常在上皮细胞之间分布,多位于基底部。与对照组相比,OTC组和MPs-L组的肠道组织形态学完整,肠黏膜皱襞排列整齐,纹状缘清晰,边缘光滑,没有明显的病理损伤(图2(a)、2(b)和2(d))。在MPs-H组中,肠道出现轻微的组织损伤:少量空泡化现象(图2(c))。在MPs-L+OTC组和MPs-H+OTC组中,组织损伤加剧:部分淋巴细胞轻微向游离面游走,空泡化变性,肠上皮细胞轻微缺失,固有膜结缔组织疏松(图2(e)和2(f))。

图2 OTC和PS-MPs单独及复合暴露对黄颡鱼幼鱼鱼肠道组织的影响(400×,比例尺为50 μm)
注:柱状上皮细胞(1);杯状细胞(2);固有层(3);淋巴细胞(4);空泡化(→);肠上皮细胞缺失(▲);淋巴细胞向游离面游走(☆)。
Fig.2 Effect of OTC and PS-MPs alone or in combination exposure on gut histology of juvenile yellow catfish(400×, scale bars 50 μm)
Note: Columnar epithelial cells(1); goblet cells(2); lamina propria(3); lymphocytes(4);vacuolation(→); intestinal epithelial cells are absent(▲); lymphocytes migrate to the free surface(☆).
2.4 黄颡鱼幼鱼肠道抗氧化酶的活性
如图3所示,与对照相比,OTC组和MPs-L组未受到显著性影响;MPs-H组的SOD活性和CAT活性分别显著提高了35.3%(P<0.05)和100.8%(P<0.05);MPs-L+OTC组的SOD活性和CAT活性分别显著提高了42.7%(P<0.05)和85.5%(P<0.05);MPs-H+OTC组中SOD活性和CAT活性分别显著提高了120.5%(P<0.05)和169.6%(P<0.05)。此外,与MPs-H组相比,MPs-H+OTC组CAT活性和SOD活性分别显著提高了34.3%(P<0.05)和63.7%(P<0.05)。

图3 OTC和PS-MPs单独及复合暴露对黄颡鱼幼鱼氧化应激酶活性的影响(n=3)
注:标注不同小写字母表示组间有显著性差异(P<0.05)。
Fig.3 Effects of OTC and PS-MPs alone or in combination exposure on oxidative stress activity of juvenile yellow catfish gut(n=3)
Note: Different lowercase letters indicated significant difference among groups(P<0.05).
2.5 黄颡鱼幼鱼肠道消化酶的活性
如图4所示,与对照组相比,OTC组、MPs-L组和MPs-L+OTC组的消化酶未受到显著性影响;MPs-H暴露组的脂肪酶(LPS)和胰蛋白酶(TRS)活性分别显著下降了35.61%(P<0.05)和48.01%(P<0.05);MPs-H+OTC暴露组的LPS和TRS活性分别显著下降了47.73%(P<0.05)和60.25%(P<0.05)。

图4 OTC和PS-MPs单独及复合暴露对黄颡鱼幼鱼肠道消化酶活性的影响(n=3)
注:标注不同小写字母表示组间有显著性差异(P<0.05)。
Fig.4 Effects of OTC and PS-MPs alone or in combination exposure on gut digestive enzyme activities of juvenile yellow catfish(n=3)
Note: Different lowercase letters indicated significant difference among groups(P<0.05).
2.6 微塑料和氧四环素对黄颡鱼幼鱼肠道菌群的影响
2.6.1 微塑料和氧四环素对黄颡鱼幼鱼肠道菌群α多样性的影响和主成分分析
α多样性中,Chao1指数为描述群落丰富度的指数,指数越大,代表对应的群落其丰富度就越高。Shannon指数和Simpson指数为描述群落多样性的指数,综合考虑了群落的丰富度和均匀度,其值越高,群落的多样性越高。如图5(a)所示,MPs-H+OTC组OTUs数目与对照组相比,显著下降(P<0.05),其余组别无显著性影响。如图5(b)、5(c)和5(d)所示,与对照组相比,所有处理组的Simpson指数无显著性差异,MPs-H组的Shannon指数(菌群的物种多样性)显著性降低(P<0.05),MPs-H+OTC组的Chao1指数(菌群丰富度)(P<0.05)和Shannon指数(菌群的物种多样性)显著性降低(P<0.05)。如图5(e)所示,从Weighted Unifrac距离来进行PCoA分析,一个点代表一个样本,同种颜色的点表示相同的处理组。投影分析表明样本之间距离越近,在相应维度中的群落组成越相似。与对照组相比,MPs-H+OTC暴露组发生了分离,其余组均有重合。
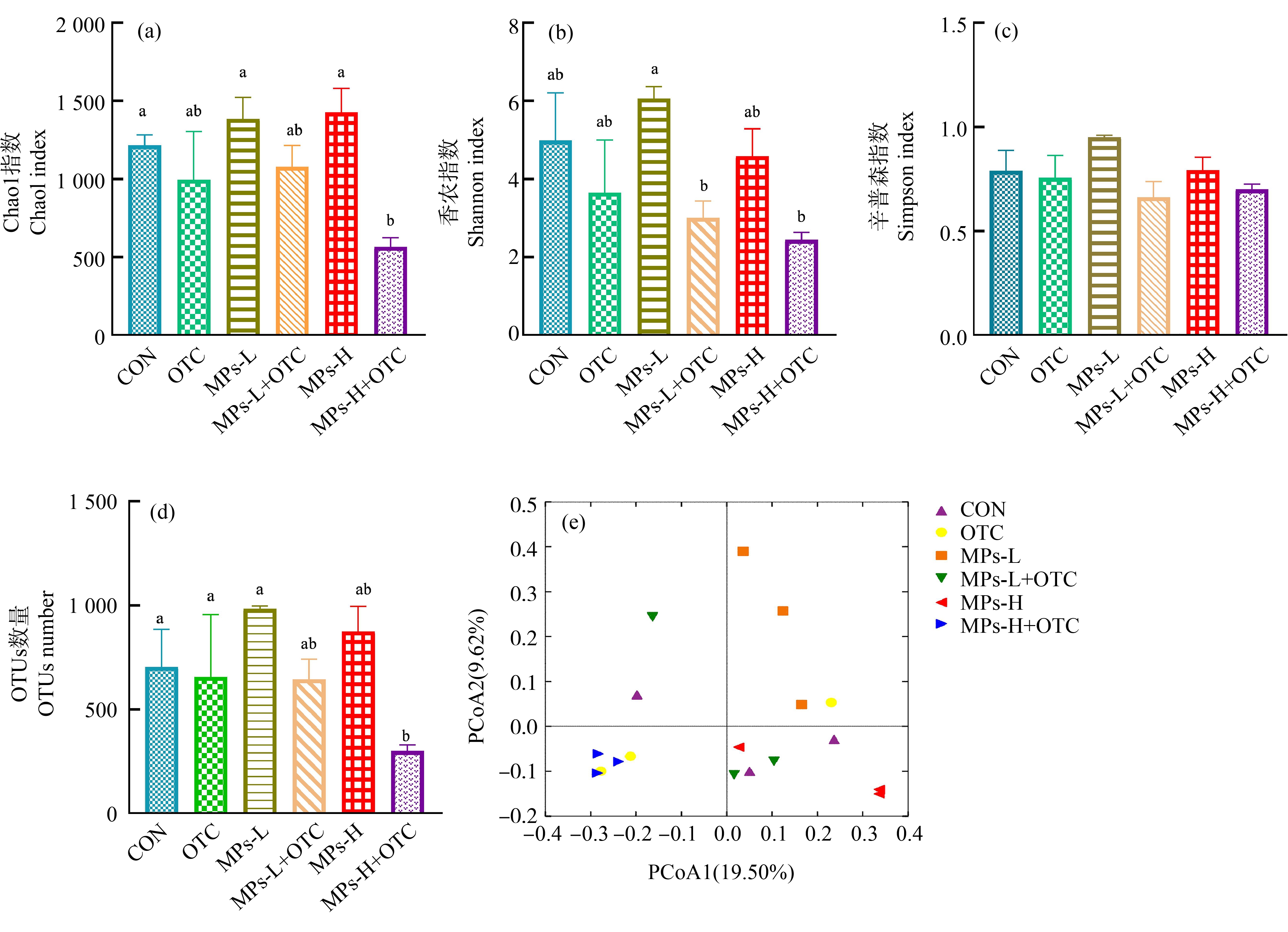
图5 OTC和PS-MPs单独及复合暴露对黄颡鱼幼鱼肠道菌群α多样性指数和β多样性指数的影响
注:标注不同小写字母表示组间有显著性差异(P<0.05)。
Fig.5 Effects of OTC and PS-MPs alone or in combination exposure on alpha diversity and beta diversity of intestinal microbiota in juvenile yellow catfish
Note: Different lowercase letters indicated significant difference among groups(P<0.05).
2.6.2 微塑料和氧四环素对黄颡鱼幼鱼肠道菌群门、属水平的影响
在门水平上,共检出53个门(2个古细菌门和51个真细菌门)。如图6(b)所示,其中优势门(至少在一个样品的相对丰度超过1%)有变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)、蓝藻门(Cyanobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)和软壁菌门(Tenericutes)。如图6(a)所示,肠道菌群主要富集在3个门上:变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)和厚壁菌门(Firmicutes)。对照组中变形菌门、梭杆菌门和厚壁菌门的相对丰度分别为38.44%、24.22%和15.53%;OTC组中为33.73%、49.65%和13.74%;MPs-L组中为27.63%、5.42%和13.01%;MPs-H组中为43.56%、5.20%和2.52%;MPs-L+OTC组中为78.57%、5.57%和2.65%;MPs-H+OTC中为15.30%、79.32%和0.85%。与对照组相比,OTC组、MPs-L组肠道菌群无显著性变化;MPs-H组中厚壁菌门的相对丰度显著下降83.77%(P<0.05);MPs-L+OTC低浓度联合暴露组中变形菌门的相对丰度显著上升104.40%(P<0.05);MPs-H+OTC高浓度联合暴露组中,变形菌门和厚壁菌门的相对丰度分别显著下降60.20%(P<0.05)和94.53%(P<0.05),梭杆菌门的相对丰度显著上升227.50%(P<0.05);此外,与MPs-H组相比,MPs-H+OTC中变形菌门的相对丰度显著下降64.87%(P<0.05),梭杆菌门的相对丰度显著上升了1425.38%(P<0.05)。
在属水平上,如图6(c)所示,优势属主要有鲸杆菌属(Cetobacterium)、埃希氏菌属(Escherichia)和邻单胞菌属(Plesiomonas),对照组中鲸杆菌属、埃希氏菌属和邻单胞菌属相对丰度分别为27.12%、25.91%和0.69%,OTC组中为49.65%、0.1%和24.09%,MPs-L组中为5.23%、1.10%和6.63%,MPs-H组中为5.04%、6.83%和20.99%,MPs-L+OTC组中为5.53%、46.57%和1.99%,MPs-H+OTC组中为79.31%、0.05%和14.75%。与对照组相比,在MPs-H+OTC高浓度联合暴露组中,鲸杆菌属的相对丰度显著上升了192.44%(P<0.05);与MPs-H组相比,MPs-H+OTC组中鲸杆菌属的相对丰度显著上升了1 373.61%(P<0.05)。
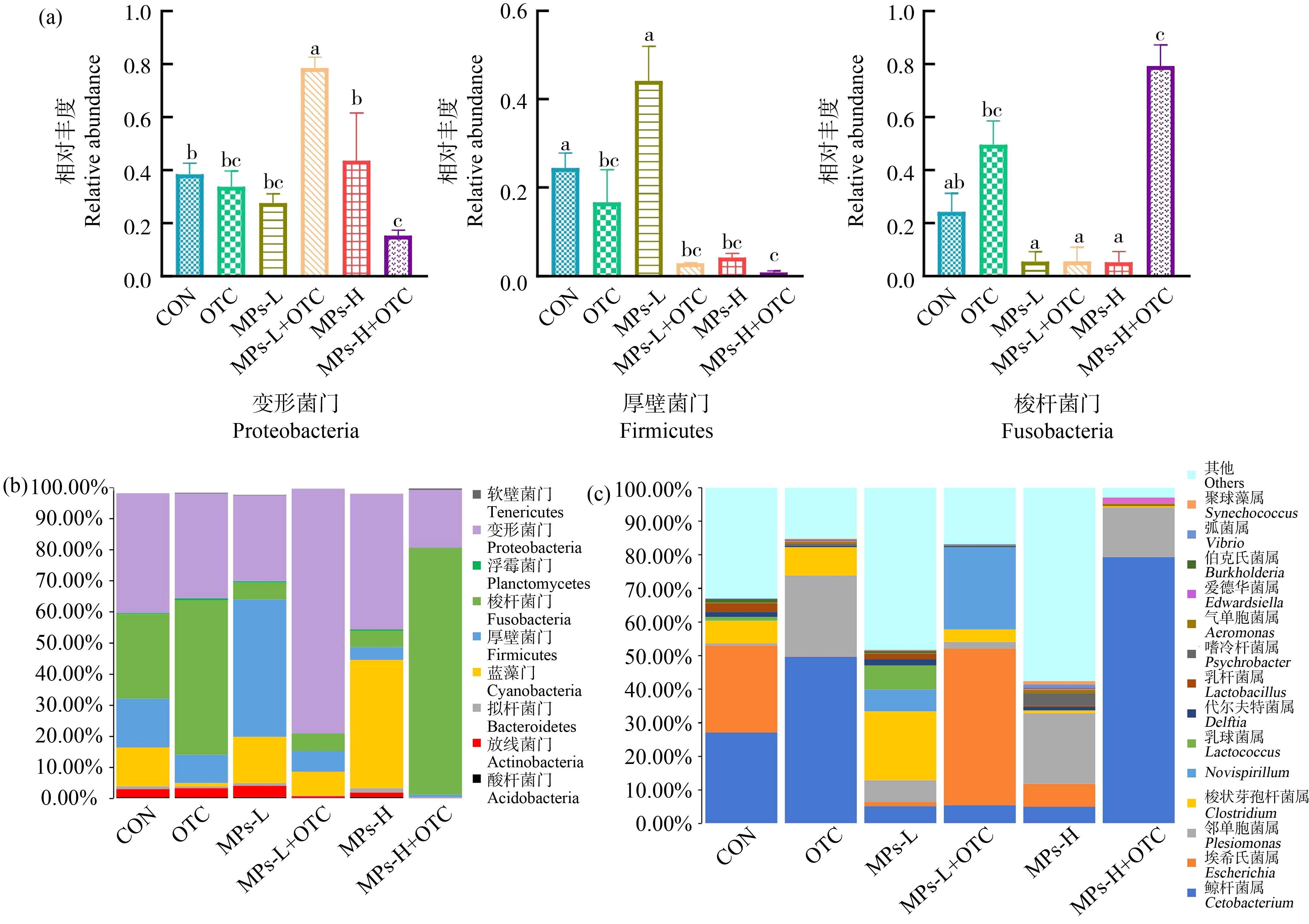
图6 OTC和PS-MPs单独及复合暴露对黄颡鱼幼鱼肠道菌群组成的影响
注:(a)各类群在门水平上的相对丰度;(b)门水平上肠道微生物组成;(c)属水平上的肠道微生物组成;标注不同小写字母表示组间有显著性差异(P<0.05)。
Fig.6 Effect of OTC and PS-MPs alone or in combination exposure on the intestinal microbial composition in juvenile yellow catfish
Note:(a)Relative abundance of various groups at phylum level;(b)Gut microbiota composition at the phylum level;(c)Gut microbiota composition at the genus level; different lowercase letters indicated significant difference among groups(P<0.05).
2.6.3 微塑料和氧四环素对黄颡鱼幼鱼的生理指标与肠道微生物之间的相关性分析
如图7所示,葡萄球菌属(Staphylococcus)与体长成显著负相关(P<0.05)。鲸杆菌属(Cetobacterium)与SOD成显著正相关(P<0.05),与BSI成显著负相关(P<0.01)。气单胞菌属(Aeromonas)与LPS成显著负相关(P<0.05),与AMS成显著正相关(P<0.05)。

图7 黄颡鱼幼鱼样本的细菌属丰度(>1%)与鱼类健康指数的Pearson相关性分析
注:筛选了与鱼类健康指数显著相关的肠道微生物属,蓝色表示正相关,红色表示负相关;*P<0.05和**P<0.01表示该相关性分析具有显著差异;SOD表示超氧化物歧化酶,CAT表示过氧化氢酶,TRS表示胰蛋白酶,LPS表示脂肪酶,AMS表示淀粉酶,HSI表示肝体比,BSI表示脑体比,Length表示体长,Weight表示体质量。
Fig.7 Pearson correlation analysis of bacterial abundance(>1%)and fish health index in juvenile yellow catfish samples
Note: The intestinal microbe genera significantly correlated with fish health index were screened, with positive correlation in blue and negative correlation in red; *P<0.05 and **P<0.01 indicate significant differences in the correlation analysis; SOD stands for superoxide dismutase; CAT stands for catalase; TRS stands for trypsin; LPS stands for lipase; AMS stands for amylase; HSI stands for hepato somatic index; BSI stands for brain somatic index; Length stands for body length; Weight stands for body weight.
3 讨论(Discussion)
OTC的滥用导致其在水环境中被频繁检测出,相关研究表明,环境中广泛存在的OTC能够在水生生物体内累积[33],环境浓度OTC能够通过PS-MPs吸附加剧其在生物体内蓄积[34]。目前,OTC和PS-MPs联合暴露是否影响黄颡鱼幼鱼肠道健康损伤还是未知的。本研究通过OTC和PS-MPs联合暴露黄颡鱼仔鱼28 d,探究其生长指标、肠道病理损伤、肠道抗氧化酶活性、消化酶活性及肠道菌群变化。
毒理学实验中,生长是评价环境压力对生物影响的重要参数之一[35]。本研究中,环境浓度的OTC单独暴露对黄颡鱼幼鱼的生长无显著影响。这一结果与之前的研究类似,420 ng·L-1OTC暴露成年斑马鱼42 d,对其生长无显著影响,但引起成年代谢率显著性增加,表明鱼类需要额外的能量来耐受毒理学应激,而不是将其用于生长[35]。本实验中,100 μg·L-1PS-MPs对黄颡鱼幼鱼的生长无显著性影响,但1 000 μg·L-1PS-MPs显著抑制黄颡鱼幼鱼的体质量增长。类似的研究也发现100 mg·L-1PS-MPs暴露50 d后显著抑制了鲫鱼体质量增长[36],这可能是由于PS-MPs会导致饱腹感,通过影响其进食来抑制其生长。本实验中MPs-H+OTC组黄颡鱼幼鱼会显著降低其体质量,但与对应的MPs-H和OTC单独暴露组相比均无显著性。在肠道微生物与体长的相关性分析中发现,葡萄球菌属与体长成显著负相关。葡萄球菌属是一群革兰氏阳性球菌,其中金黄色葡萄球菌作为一种常见的致病菌,感染严重时能导致坏死性肺炎至肺组织坏死[37],表明金黄色葡萄球菌可能与黄颡鱼生长抑制相关。
鱼类的肠道是一个重要的器官,不仅参与消化、吸收和免疫,而且还能充当有害物质入侵的屏障[32]。肠道的形态完整性在一定程度上可以反映肠道的健康状况[33,37]。我们的实验结果表明OTC单独暴露(500 ng·L-1)对肠道无显著性病理损伤,但是有研究报道420 ng·L-1OTC暴露斑马鱼48 d减少了斑马鱼肠道中杯状细胞的数量[35]。2个研究中结果的不一致可能与抗生素暴露浓度、暴露时间不同有关。近年来,一些研究探索微塑料暴露对生物肠道上皮细胞的影响[37],值得关注的是5 μm的PS-MPs可以进入肠道,并穿过黏液屏障,与肠上皮细胞部分直接接触[38]。本实验中,MPs-H组造成肠道少量空泡化变性,类似的研究也发现纤维状PS-MPs(10 μg·L-1)暴露成年斑马鱼21 d后,使其肠道产生轻微空泡化变性[27]。本研究联合暴露中,MPs-L+OTC组和MPs-H+OTC组肠道中部分淋巴细胞轻微向游离面游走,空泡化变性,肠上皮细胞轻微缺失,固有膜结缔组织疏松,表明OTC与PS-MPs复合暴露加剧了黄颡鱼幼鱼的肠道损伤。
氧化应激酶可以反映鱼体对外部刺激的反应及其自由基新陈代谢的状态[39]。抗氧化酶(包括SOD和CAT)是对抗生物体中自由基的酶防御机制的第一道防线[40]。本实验中,OTC单独组(500 ng·L-1)对黄颡鱼幼鱼肠道氧化应激酶活性无显著性影响。类似研究表明50 μg·L-1的OTC暴露斑马鱼仔鱼48 h后,对SOD和CAT的活性无显著性影响[41]。本研究中,MPs-H组中黄颡鱼幼鱼肠道SOD和CAT活性显著升高。这一结果与先前的研究类似,PS-MPs作为激活剂能促进体内抗氧化酶(SOD和CAT)的分泌,在这个过程中提高了鱼类清除自由基和减少过氧化氢的能力[39],PS-MPs(5 μm, 1 000 μg·L-1)暴露斑马鱼21 d显著增加SOD和CAT活性[42]。本研究MPs-H+OTC组与MPs-H组相比,显著加剧了黄颡鱼幼鱼肠道SOD和CAT活性的升高。表明1 000 μg·L-1PS-MPs显著增加了黄颡鱼幼鱼肠道抗氧化能力,而1 000 μg·L-1PS-MPs和500 ng·L-1OTC复合暴露会给黄颡鱼幼鱼肠道氧化应激抵抗力带来额外的压力,增强对其SOD和CAT活性的促进作用。而在肠道微生物与SOD的相关性分析中,鲸杆菌属和SOD呈显著正相关,在MPs-H+OTC组中,PS-MPs与OTC可能通过黄颡鱼幼鱼肠道内鲸杆菌属的显著上升影响其SOD活性的升高。
鱼类消化酶活性能够直接反应鱼类本身摄食以及消化情况,消化酶活性越高,鱼的生长情况越好[43]。本实验中,OTC对黄颡鱼幼鱼肠道淀粉酶(AMS)、脂肪酶(LPS)和胰蛋白酶(TRS)活性无显著影响。这与肖亮[44]的发现类似,250 mg·kg-1OTC饲料喂养异育银鲫28 d对其肠道消化酶(AMS、LPS和TRS)活性和生长均无显著影响。这表明OTC组肠道消化酶与生长指标结果是相符的。本研究中1000μg·L-1PS-MPs显著降低了黄颡鱼幼鱼肠道LPS和TRS的活性。据报道,PS-MPs进入鱼类肠道,会导致饱腹感,使获取的食物和能量减少,影响其消化性能,MPs浓度越高,对消化性能的抑制作用越大[45],类似研究中PS-MPs(32~40 μm, 1 000 μg·L-1)暴露孔雀鱼幼鱼28 d,显著降低其肠道AMS、LPS和TRS活性[46]。消化酶在蛋白质、脂质和碳水化合物的水解中起着非常重要的作用,从而有助于营养物质的同化和生物体的发育[47],鱼类肠道消化酶活性与其生长相关[44]。本研究中MPs-H+OTC组与MPs-H组的肠道消化酶变化类似,这2组通过显著降低黄颡鱼幼鱼的肠道消化酶活性来抑制其生长。而每组中肠道消化酶与生长指标结果是相符的,表明肠道消化酶活性降低与其生长受抑制相关。鱼类中消化酶活性可能还与肠道菌群中的主要菌群有一定的相关性[46]。此外,本研究中气单胞菌属与LPS成显著负相关,与肠道AMS成显著正相关,气单胞菌属不仅广泛分布在淡水和底部沉积物中的细菌,并且作为鱼类肠道中的细菌,能够引起出血性败血症,这是养殖淡水鱼中发生的最常见的疾病之一[48],表明气单胞菌属变化与可能影响鱼类消化酶活性变化。
肠道菌群的组成结构关系着鱼类的营养吸收和能量平衡,不仅由内在因素(生物物种、遗传等)决定,还受到外部因素(免疫状态、饮食和环境等)的干扰,肠道环境为其中一个重要的外部因素,毒理暴露引起的肠道环境变化可能会导致水生生物的肠道菌群紊乱[30-32, 49]。本研究中,通过对黄颡鱼幼鱼的肠道进行α多样性分析,发现OTC组与MPs-L组的α多样性均无显著性变化,MPs-L+OTC组的肠道菌群多样性显著降低,MPs-H+OTC组的肠道菌群多样性和丰富度均显著降低。PCoA分析结果显示对照组和MPs-H+OTC组的肠道菌群具有较高的离散度,表明500 ng·L-1OTC和1 000 μg·L-1PS-MPs复合暴露显著降低黄颡鱼幼鱼肠道菌群β多样性。
本研究中,500 ng·L-1OTC单独暴露对黄颡鱼幼鱼肠道门和属水平上的菌群无显著性影响。与之前的研究类似,420 ng·L-1OTC暴露斑马鱼42 d,对其肠道菌群数量无显著性影响[16]。本实验中1000μg·L-1PS-MPs单独暴露使其厚壁菌门相对丰度显著下降[31]。类似的研究发现1 000 μg·L-1PS-MPs导致斑马鱼仔鱼厚壁菌门的相对丰度显著增加,表明1 000 μg·L-1PS-MPs导致厚壁菌门的失调。本研究中,与对应的MPs和OTC单独暴露组相比,MPs-L+OTC组中变形菌门的相对丰度显著增加,厚壁菌门的相对丰度显著降低;MPs-H+OTC组中变形菌门的相对丰度显著降低,梭杆菌门和鲸杆菌属的相对丰度显著上升。研究发现梭杆菌门细菌可能在能量生产和消化中发挥重要作用,能够产生重要的消化酶,如酯酶、脂肪酶和α-葡萄糖醛酸酶等,并通过发酵氨基酸和葡萄糖并产生丁酸盐,在消化中产生了重要作用,梭杆菌门失调会影响消化酶的活性[50],鲸杆菌属作为有益菌,是鱼类微生物屏障的重要组成部分[50]。本研究500 ng·L-1OTC和1000μg·L-1PS-MPs复合暴露可能影响黄颡鱼幼鱼肠道的微生物屏障,并通过梭杆菌门失调影响消化酶活性,表明OTC和PS-MPs复合暴露加剧了黄颡鱼幼鱼肠道菌群的紊乱。
综上所述,OTC和PS-MPs(100 μg·L-1)单独暴露对黄颡鱼幼鱼的生长、肠道消化酶、肠道氧化应激反应及肠道菌群方面均未产生影响;但OTC和PS-MPs(100 μg·L-1)复合暴露导致黄颡鱼肠道氧化应激活性显著升高、肠道损伤以及肠道菌群失调,且与OTC单独暴露对比,复合暴露显著升高肠道氧化应激酶活性。PS-MPs(1 000 μg·L-1)单独暴露抑制了黄颡鱼幼鱼生长,显著升高氧化应激酶活性,显著降低了消化酶活性以及引起了肠道菌群紊乱;且与PS-MPs(1 000 μg·L-1)单独组和OTC单独组相比,MPs-H+OTC组进一步加剧肠道氧化酶活性升高、消化酶活性降低、肠道损伤和肠道菌群紊乱。相关性分析表明,肠道葡萄球菌属和体长显著负相关;鲸杆菌属和SOD显著正相关;气单胞菌属与LPS显著负相关,与AMS显著正相关。研究表明,PS-MPs(1 000 μg·L-1)单独以及与OTC复合暴露可能通过肠道损伤以及肠道菌群的改变,进而影响肠道消化酶活性,从而抑制黄颡鱼幼鱼生长。本实验PS-MPs和OTC的复合肠道毒性表现出显著的协同效应。这可能与OTC积累增加、暴露途径改变和毒性机制共享有关,但需要进一步研究。该研究为评估OTC和PS-MPs的联合毒性效应提供新的视角。
[1] 李红亮.土霉素光催化降解的特性研究[D].武汉: 华中科技大学, 2012: 1-2
Li H L.Study on characteristics of photocatalytic degradation of oxytetracycline[D].Wuhan: Huazhong University of Science and Technology, 2012: 1-2(in Chinese)
[2] Kümmerer K.Antibiotics in the aquatic environment—A review—Part Ⅰ[J].Chemosphere, 2009, 75(4): 417-434
[3] Zhang Q Q, Ying G G, Pan C G, et al.Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J].Environmental Science &Technology, 2015, 49(11): 6772-6782
[4] Karthikeyan K G, Meyer M T.Occurrence of antibiotics in wastewater treatment facilities in Wisconsin, USA[J].The Science of the Total Environment, 2006, 361(1-3): 196-207
[5] Chang X S, Meyer M T, Liu X Y, et al.Determination of antibiotics in sewage from hospitals, nursery and slaughter house, wastewater treatment plant and source water in Chongqing region of Three Gorge Reservoir in China[J].Environmental Pollution, 2010, 158(5): 1444-1450
[6] Chen H, Liu S, Xu X R, et al.Antibiotics in the coastal environment of the Hailing Bay region, South China Sea: Spatial distribution, source analysis and ecological risks[J].Marine Pollution Bulletin, 2015, 95(1): 365-373
[7] Ma Y P, Li M, Wu M M, et al.Occurrences and regional distributions of 20 antibiotics in water bodies during groundwater recharge[J].The Science of the Total Environment, 2015, 518-519: 498-506
[8] Wei R C, Ge F, Huang S Y, et al.Occurrence of veterinary antibiotics in animal wastewater and surface water around farms in Jiangsu Province, China[J].Chemosphere, 2011, 82(10): 1408-1414
[9] Karthikeyan K G, Meyer M T.Occurrence of antibiotics in wastewater treatment facilities in Wisconsin, USA[J].The Science of the Total Environment, 2006, 361(1-3): 196-207
[10] Sarmah A K, Meyer M T, Boxall A B.A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere, 2006, 65(5): 725-759
[11] 李兆君, 姚志鹏, 张杰, 等.兽用抗生素在土壤环境中的行为及其生态毒理效应研究进展[J].生态毒理学报, 2008, 3(1): 15-20
Li Z J, Yao Z P, Zhang J, et al.A review on fate and ecological toxicity of veterinary antibiotics in soil environments[J].Asian Journal of Ecotoxicology, 2008, 3(1): 15-20(in Chinese)
[12] Chen H, Liu S, Xu X R, et al.Antibiotics in the coastal environment of the Hailing Bay Region, South China Sea: Spatial distribution, source analysis and ecological risks[J].Marine Pollution Bulletin, 2015, 95(1): 365-373
[13] 沈群辉, 冀秀玲, 傅淑珺, 等.黄浦江水域抗生素及抗性基因污染初步研究[J].生态环境学报, 2012, 21(10): 1717-1723
Shen Q H, Ji X L, Fu S J, et al.Preliminary studies on the pollution levels of antibiotic and antibiotic resistance genes in Huangpu River, China[J].Ecology and Environmental Sciences, 2012, 21(10): 1717-1723(in Chinese)
[14] Rodrigues S, Antunes S C, Correia A T, et al.Rainbow trout(Oncorhynchus mykiss)pro-oxidant and genotoxic responses following acute and chronic exposure to the antibiotic oxytetracycline[J].Ecotoxicology, 2017, 26(1): 104-117
[15] Limbu S M, Zhou L, Sun S X, et al.Chronic exposure to low environmental concentrations and legal aquaculture doses of antibiotics cause systemic adverse effects in Nile tilapia and provoke differential human health risk[J].Environment International, 2018, 115: 205-219
[16] Zhou L, Limbu S M, Shen M L, et al.Environmental concentrations of antibiotics impair zebrafish gut health[J].Environmental Pollution, 2018, 235: 245-254
[17] Zhang H B, Wang J Q, Zhou B Y, et al.Enhanced adsorption of oxytetracycline to weathered microplastic polystyrene: Kinetics, isotherms and influencing factors[J].Environmental Pollution, 2018, 243(Pt B): 1550-1557
[18] Li L, Geng S X, Wu C X, et al.Microplastics contamination in different trophic state lakes along the middle and lower reaches of Yangtze River Basin[J].Environmental Pollution, 2019, 254(Pt A): 112951
[19] Zhao S Y, Zhu L X, Wang T, et al.Suspended microplastics in the surface water of the Yangtze Estuary System, China: First observations on occurrence, distribution[J].Marine Pollution Bulletin, 2014, 86(1-2): 562-568
[20] Wang W F, Ndungu A W, Li Z, et al.Microplastics pollution in inland freshwaters of China: A case study in urban surface waters of Wuhan, China[J].The Science of the Total Environment, 2017, 575: 1369-1374
[21] Hirt N, Body-Malapel M.Immunotoxicity and intestinal effects of nano-and microplastics: A review of the literature[J].Particle and Fibre Toxicology, 2020, 17(1): 57
[22] Xiong X, Chen X C, Zhang K, et al.Microplastics in the intestinal tracts of East Asian finless porpoises(Neophocaena asiaeorientalis sunameri)from Yellow Sea and Bohai Sea of China[J].Marine Pollution Bulletin, 2018, 136: 55-60
[23] Su L, Deng H, Li B W, et al.The occurrence of microplastic in specific organs in commercially caught fishes from coast and estuary area of East China[J].Journal of Hazardous Materials, 2019, 365: 716-724
[24] Yuan W K, Liu X N, Wang W F, et al.Microplastic abundance, distribution and composition in water, sediments, and wild fish from Poyang Lake, China[J].Ecotoxicology and Environmental Safety, 2019, 170: 180-187
[25] Zhu J M, Yu X Y, Zhang Q, et al.Cetaceans and microplastics: First report of microplastic ingestion by a coastal Delphinid, Sousa chinensis[J].The Science of the Total Environment, 2019, 659: 649-654
[26] Jin Y X, Xia J Z, Pan Z H, et al.Polystyrene microplastics induce microbiota dysbiosis and inflammation in the gut of adult zebrafish[J].Environmental Pollution, 2018, 235: 322-329
[27] Qiao R X, Deng Y F, Zhang S H, et al.Accumulation of different shapes of microplastics initiates intestinal injury and gut microbiota dysbiosis in the gut of zebrafish[J].Chemosphere, 2019, 236: 124334
[28] Qiao R X, Sheng C, Lu Y F, et al.Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish[J].The Science of the Total Environment, 2019, 662: 246-253
[29] Wang W F, Gao H, Jin S C, et al.The ecotoxicological effects of microplastics on aquatic food web, from primary producer to human: A review[J].Ecotoxicology and Environmental Safety, 2019, 173: 110-117
[30] Jin Y X, Xia J Z, Pan Z H, et al.Polystyrene microplastics induce microbiota dysbiosis and inflammation in the gut of adult zebrafish[J].Environmental Pollution, 2018, 235: 322-329
[31] Wan Z Q, Wang C Y, Zhou J J, et al.Effects of polystyrene microplastics on the composition of the microbiome and metabolism in larval zebrafish[J].Chemosphere, 2019, 217: 646-658
[32] Qiao R X, Sheng C, Lu Y F, et al.Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish[J].Science of the Total Environment, 2019, 662: 246-253
[33] Yuan L, Wang L, Li Z H, et al.Antibiotic resistance and microbiota in the gut of Chinese four major freshwater carp from retail markets[J].Environmental Pollution, 2019, 255: 113327
[34] Han Y, Zhou W S, Tang Y, et al.Microplastics aggravate the bioaccumulation of three veterinary antibiotics in the thick shell mussel Mytilus coruscusand induce synergistic immunotoxic effects[J].The Science of the Total Environment, 2021, 770: 145273
[35] Zhou L, Limbu S M, Shen M L, et al.Environmental concentrations of antibiotics impair zebrafish gut health[J].Environmental Pollution, 2018, 235: 245-254
[36] 刘湧滨, 李香琴.微塑料对淡水鱼生长性能的影响[J].渔业致富指南, 2021(21): 70-72
[37] Hirt N, Body-Malapel M.Immunotoxicity and intestinal effects of nano-and microplastics: A review of the literature[J].Particle and Fibre Toxicology, 2020, 17(1): 57
[38] Hoogenboom L.Presence of microplastics and nanoplastics in food, with particular focus on seafood[J].EFSA Journal, 2016, 14(6): e04501
[39] Revel M, Lagarde F, Ettajani H P, et al.Tissue-specific biomarker responses in the blue mussel Mytilusspp.exposed to a mixture of microplastics at environmentally relevant concentrations[J].Frontiers in Environmental Science, 2019, 7: 33
[40] Deng J M, Mai K S, Chen L Q, et al.Effects of replacing soybean meal with rubber seed meal on growth, antioxidant capacity, non-specific immune response, and resistance to Aeromonas hydrophilain tilapia(Oreochromis niloticus× O. aureus)[J].Fish &Shellfish Immunology, 2015, 44(2): 436-444
[41] 余晓玲.猪场废水中四环素类抗生素对斑马鱼抗氧化效应毒理研究[D].南昌: 南昌大学, 2019: 43-45
Yu X L.Toxicological study on antioxidant effects of tetracycline antibiotics on zebrafish in swine wastewater[D].Nanchang: Nanchang University, 2019: 43-45(in Chinese)
[42] Qiao R X, Sheng C, Lu Y F, et al.Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish[J].The Science of the Total Environment, 2019, 662: 246-253
[43] Zmora N, Suez J, Elinav E.You are what you eat: Diet, health and the gut microbiota[J].Nature Reviews Gastroenterology &Hepatology, 2019, 16(1): 35-56
[44] 肖亮.土霉素对异育银鲫毒性和残留研究[D].武汉: 华中农业大学, 2008: 33-37
Xiao L.Study on toxicity and tissue elimination of oxytetracycline in allogynogenetic crucian[D].Wuhan: Huazhong Agricultural University, 2008: 33-37(in Chinese)
[45] Wen B, Zhang N, Jin S R, et al.Microplastics have a more profound impact than elevated temperatures on the predatory performance, digestion and energy metabolism of an Amazonian cichlid[J].Aquatic Toxicology, 2018, 195: 67-76
[46] Huang J N, Wen B, Zhu J G, et al.Exposure to microplastics impairs digestive performance, stimulates immune response and induces microbiota dysbiosis in the gut of juvenile guppy(Poecilia reticulata)[J].The Science of the Total Environment, 2020, 733: 138929
[47] Ahmadifar E, Sadegh T H, Dawood M A, et al.The effects of dietary Pediococcus pentosaceuson growth performance, hemato-immunological parameters and digestive enzyme activities of common carp(Cyprinus carpio)[J].Aquaculture, 2020, 516(C): 734656
[48] Lu T H, Chen C Y, Liao C M.Aeromonas hydrophilaas an environmental indicator to detect TiLV-infected tilapia under coinfection threat[J].Environmental and Sustainability Indicators, 2021, 11: 100135
[49] Zhang M L, Sun Y H, Liu Y K, et al.Response of gut microbiota to salinity change in two euryhaline aquatic animals with reverse salinity preference[J].Aquaculture, 2016, 454: 72-80
[50] Parker-Graham C A, Eetemadi A, Yazdi Z, et al.Effect of oxytetracycline treatment on the gastrointestinal microbiome of critically endangered white abalone(Haliotis sorenseni)treated for withering syndrome[J].Aquaculture, 2020, 526: 735411