磺胺甲恶唑(sulfamethoxazole, SMX)是一种广谱型的磺胺类抗生素,是治疗和预防人类由于敏感菌引起感染的常用药[1],也广泛应用于畜牧业以及水产养殖业等[2]。SMX一般通过污水、农业生产和畜禽粪便排放到水环境中[3]。调查数据显示,全球范围内的多种水体中都能频繁检测到SMX。例如,波罗的海德国沿岸区域检测到SMX的浓度范围为0.6~47.5 ng·L-1[4],日本多摩川流域中为110 ng·L-1[5],美国地表水中为7.9~1 900 ng·L-1[6-7],湄公河三角洲地区为19.2 μg·L-1[8],而非洲地表水中检测到的SMX的浓度高达39 μg·L-1[9]。SMX通过食物链等生态循环会对人体造成溶血性贫血、肝脏损害和肾脏损害等较严重的病症,因此2017年世界卫生组织国际癌症研究机构(International Agency for Research on Cancer, IARC)将SMX划为致癌物质之一[10]。
SMX较难降解,在环境中可长时间存在,会在生物体内富集从而对生物体造成影响[11]。近年来,SMX已经被证明对水生生物(藻类、甲壳类和鱼类)具有胚胎毒性、发育毒性和神经毒性等多种负面效应。例如,刘仁彬等[12]研究发现,0.01 mg·L-1磺胺甲恶唑暴露96 h对斑马鱼胚胎的抗氧化系统造成明显的损伤,超氧化物歧化酶(SOD)和谷胱甘肽S-转移酶(GST)被显著诱导,过氧化氢酶(CAT)受到显著抑制,丙二醛(MDA)含量显著增加,并导致斑马鱼仔鱼的心率减慢以及体长缩短。有研究表明,磺胺类药物会使肠道微生物的菌群数量下降,对鱼类的生长发育造成显著的负面影响,斑马鱼肠道在无菌的状态下,其刷状缘碱性磷酸酶活力丧失,导致肠道发育受阻,进而影响斑马鱼的生长发育[13]。张石云[14]发现,含有SMX的饲料会降低罗非鱼肠道菌群的生物丰度、物种丰度和生物多样性,从而对罗非鱼的生长发育造成显著影响。此外,张健等[15]发现SMX能对斑马鱼的自由运动和心跳速率产生诱导和抑制作用,对斑马鱼的身体循环功能和身体协调功能产生负面影响。在鱼类中,GH/IGF-Ⅰ轴是生长发育的重要调控轴[16],垂体前叶产生生长激素(growth hormone, GH),通过与生长激素受体(growth hormone receptor, GHR)结合发挥作用,最终在肝脏中促进胰岛素样生长因子(insulin like growth factor, IGF)的合成[17],从而促进细胞增殖、活化进而促使鱼类生长发育[18]。多项研究发现,许多外源性化学物质包括某些抗生素(3,4-二氯苯胺、二噁英、螺吲哚啉磺酰胺MK-677和环肽生长抑素等)能够通过干扰GH/IGF-Ⅰ轴从而影响生物机体的生长[19-22]。但是,目前环境相关浓度的SMX暴露对鱼类的发育毒性及生长抑制机制尚不清楚。
斑马鱼是一种被广泛使用的模式动物,具有养殖成本低,发育周期短,幼鱼透明易观察,产卵量大等独特优势[23]。本实验以斑马鱼为实验动物,检测SMX暴露下斑马鱼胚胎的孵化率,仔鱼的死亡率、心率、体长和畸形率等发育参数,测定斑马鱼GH/IGF-Ⅰ轴激素含量和相关基因的转录水平,评估SMX对斑马鱼早期生命阶段的发育毒性,揭示SMX对仔鱼的生长抑制作用机制,为SMX的水生生态安全性评价提供参考数据。
1 材料与方法(Materials and methods)
1.1 实验材料
磺胺甲恶唑,即4-氨基-N-(5-甲基-3-异恶唑基)苯磺酰胺(纯度为98%,美国生命科学与高科技集团公司);二甲亚砜(DMSO)(分析纯,阿拉丁科技(中国)有限公司)。FastPure®Cell/Tissue Total RNA Isolation Kit V2(南京诺唯赞生物科技股份有限公司),HiScript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(南京诺唯赞生物科技股份有限公司),ChamQTM Universal SYBR®qPCR Master Mix(南京诺唯赞生物科技股份有限公司)。
本实验采用野生型成年斑马鱼,购自国家斑马鱼资源中心。实验开始前对斑马鱼进行1个月的饲养驯化,保持14 h/10 h光暗比,水温(28.0±1)℃,pH值为7.0~8.0,溶解氧>7 mg·L-1。
1.2 实验方法
1.2.1 胚胎/幼体发育毒性实验
使用DMSO为助溶剂,将磺胺甲恶唑溶解,配制成1 g·L-1储备液,避光保存于4 ℃。进行暴露实验前,将储备液逐级稀释至E3孵化液中(5 mmol·L-1NaCl,0.17 mmol·L-1KCl,0.33 mmol·L-1CaCl2,0.33 mmol·L-1MgSO4),溶液中DMSO终浓度为0.01%,实验共设置1个助溶剂对照组(0.01% DMSO)和3个处理组(4、40和400 μg·L-1SMX),每一处理组设置3个平行。暴露实验在玻璃培养皿中进行,每个培养皿中放置100 mL E3孵化液和100粒受精卵,持续暴露120 h,光照周期12 h/12 h。
暴露过程中,统计记录48、72、96和120 h死亡胚胎数,计算48、72和96 h这3个时间段不同浓度下的孵化率。统计并记录48、72和96 h斑马鱼仔鱼30 s的心率,记录72 h、96 h斑马鱼仔鱼的体长,观察记录48、72和96 h斑马鱼仔鱼致畸效果。
1.2.2 生长激素(GH)和胰岛素样生长因子(IGF-Ⅰ)检测
GH和IGF-Ⅰ含量的测定采用斑马鱼生长激素(GH)ELISA检测试剂盒和斑马鱼胰岛素样生长因子(IGF-Ⅰ)ELISA检测试剂盒(南京建成生物工程研究所),每个平行随机选取15条仔鱼,实验步骤和计算公式参照试剂盒说明书。
1.2.3 荧光定量PCR
120 hpf时,每个平行随机选取10条斑马鱼仔鱼,制备全鱼组织匀浆,使用FastPure®Cell/Tissue Total RNA Isolation Kit V2(南京诺唯赞生物科技股份有限公司)提取RNA,使用HiScript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(南京诺唯赞生物科技股份有限公司)进行逆转录合成cDNA。使用ChamQTM Universal SYBR®qPCR Master Mix(南京诺唯赞生物科技股份有限公司)在仪器LightCycle®480Ⅱ(瑞士罗氏)上进行qRT-PCR反应。以rpl8为内参基因,用2-ΔΔCt方法计算目的基因的相对表达量。引物通过NCBI网站的Primer-Blast在线工具设计,目标基因和内参基因的引物序列如表1所示。
表1 实验所用引物序列
Table 1 Nucleotide sequences of primers used in present study
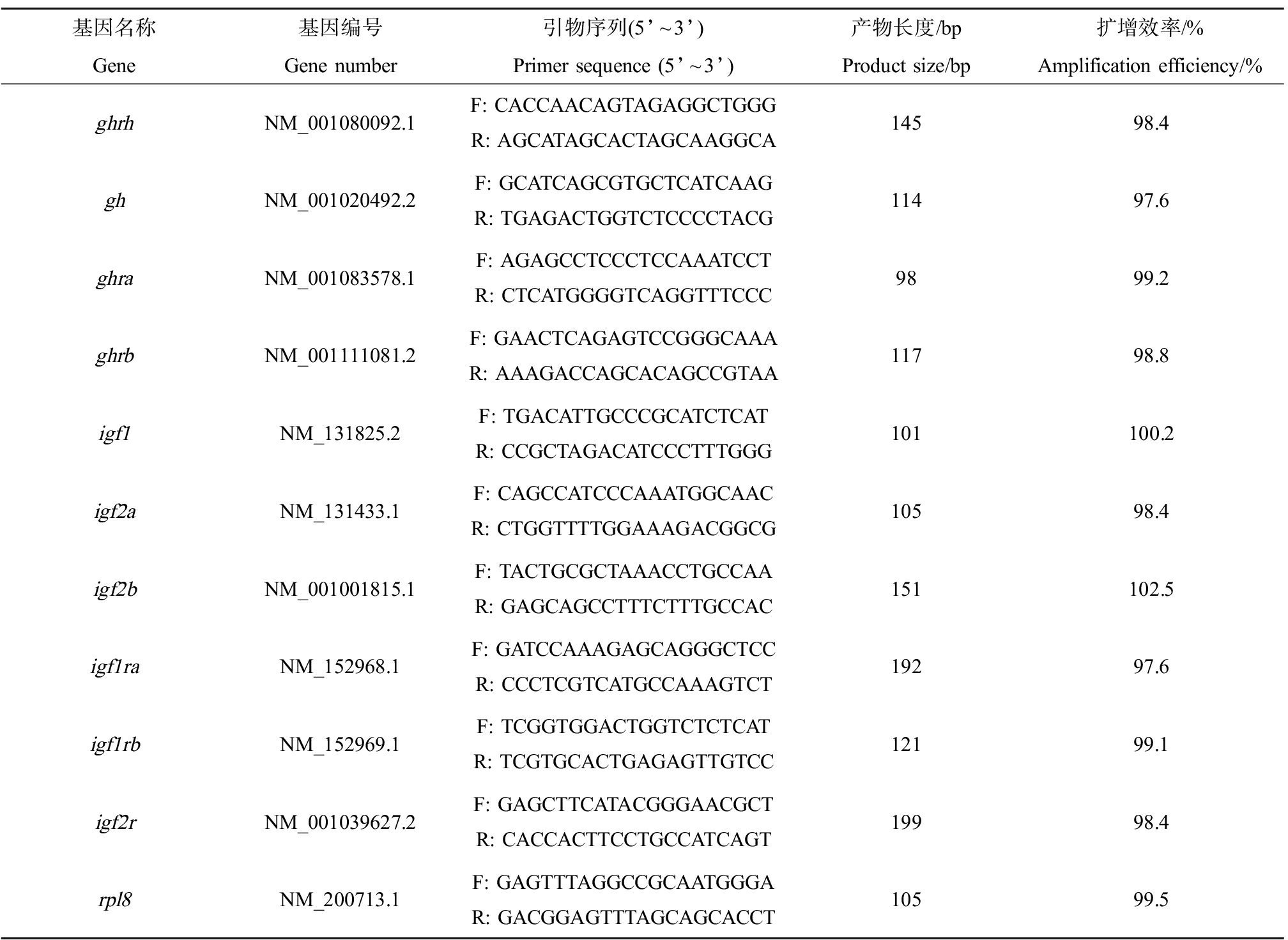
基因名称基因编号引物序列(5’~3’)产物长度/bp扩增效率/%GeneGene numberPrimer sequence (5’~3’)Product size/bpAmplification efficiency/%ghrhNM_001080092.1 F: CACCAACAGTAGAGGCTGGG R: AGCATAGCACTAGCAAGGCA 14598.4ghNM_001020492.2F: GCATCAGCGTGCTCATCAAGR: TGAGACTGGTCTCCCCTACG11497.6ghraNM_001083578.1F: AGAGCCTCCCTCCAAATCCTR: CTCATGGGGTCAGGTTTCCC9899.2ghrbNM_001111081.2F: GAACTCAGAGTCCGGGCAAAR: AAAGACCAGCACAGCCGTAA11798.8igf1NM_131825.2F: TGACATTGCCCGCATCTCATR: CCGCTAGACATCCCTTTGGG101100.2igf2aNM_131433.1F: CAGCCATCCCAAATGGCAACR: CTGGTTTTGGAAAGACGGCG10598.4igf2bNM_001001815.1F: TACTGCGCTAAACCTGCCAAR: GAGCAGCCTTTCTTTGCCAC151102.5igf1raNM_152968.1F: GATCCAAAGAGCAGGGCTCCR: CCCTCGTCATGCCAAAGTCT19297.6igf1rbNM_152969.1F: TCGGTGGACTGGTCTCTCATR: TCGTGCACTGAGAGTTGTCC12199.1igf2rNM_001039627.2F: GAGCTTCATACGGGAACGCTR: CACCACTTCCTGCCATCAGT19998.4rpl8NM_200713.1F: GAGTTTAGGCCGCAATGGGAR: GACGGAGTTTAGCAGCACCT10599.5
1.3 数据处理
本实验所有数据均使用SPSS 25.0软件进行统计分析。实验结果在检验方差齐性后采用单因素方差分析(One-way ANOVA),通过Tukey’s HSD检验差异的显著性(P<0.05)。实验结果均以平均值±标准差(mean±S.D.)的形式表示。
2 结果(Results)
2.1 磺胺甲恶唑对斑马鱼胚胎/幼体的发育参数的影响
如图1(a)所示,与对照组相比,SMX暴露至24 hpf时,S40和S400处理组死亡率显著增加至39.25%和38.23%(P<0.05),暴露至48 hpf时,S40和S400处理组死亡率显著上升至39.75%和39.33%(P<0.05),暴露至72 hpf时,S40和S400处理组死亡率显著升高至54.75%和41.33%(P<0.05),当暴露至96 hpf时,S4和S40处理组的仔鱼死亡率显著上升至61.67%和67.25%(P<0.05),暴露至120 hpf时,S4、S40和S400处理组死亡率都显著升高到75.00%、72.50%和63.33%(P<0.05)。由图1(b)可知,斑马鱼在SMX暴露至48 hpf和96 hpf后,所有实验组孵化率与对照组相比未出现明显变化,但在暴露至72 hpf时,S400处理组的孵化率显著上升至98.67%(P<0.05)。由图1(c)可知,暴露至48 hpf时,S4、S40和S400处理组的心率显著降低至102.94、106.60和115.73 次·min-1(P<0.05),暴露至72 hpf和96 hpf时,所有处理组的心率均发生显著降低(P<0.05)。在SMX胁迫下仔鱼体长变化如图1(d)所示,在SMX暴露至72 hpf时,S400处理组的斑马鱼体长与对照组相比显著降低至2.51 mm(P<0.05)。在暴露至96 hpf时,S40和S400处理组的斑马鱼体长与对照组相比显著下降至3.08 mm和2.33 mm(P<0.05)。
如图1(e)所示,SMX暴露至48 hpf时,所有实验组仔鱼畸形率与对照组相比无显著差异(P<0.05);暴露至72 hpf时,S40处理组的仔鱼畸形率显著上升至5.33%(P<0.05);暴露至96 hpf时,S4、S40和S400处理组的畸形率显著增加至12.00%、16.00%和14.00%(P<0.05)。如图2所示,SMX暴露72 h后,典型的畸形有脊柱弯曲(图2(b))、尾部变形(图2(c))和尾部缺失(图2(d));SMX暴露至96 h时,仔鱼出现了卵黄囊水肿(图2(f))、脊柱弯曲(图2(g))和心包囊水肿(图2(h))等畸形。
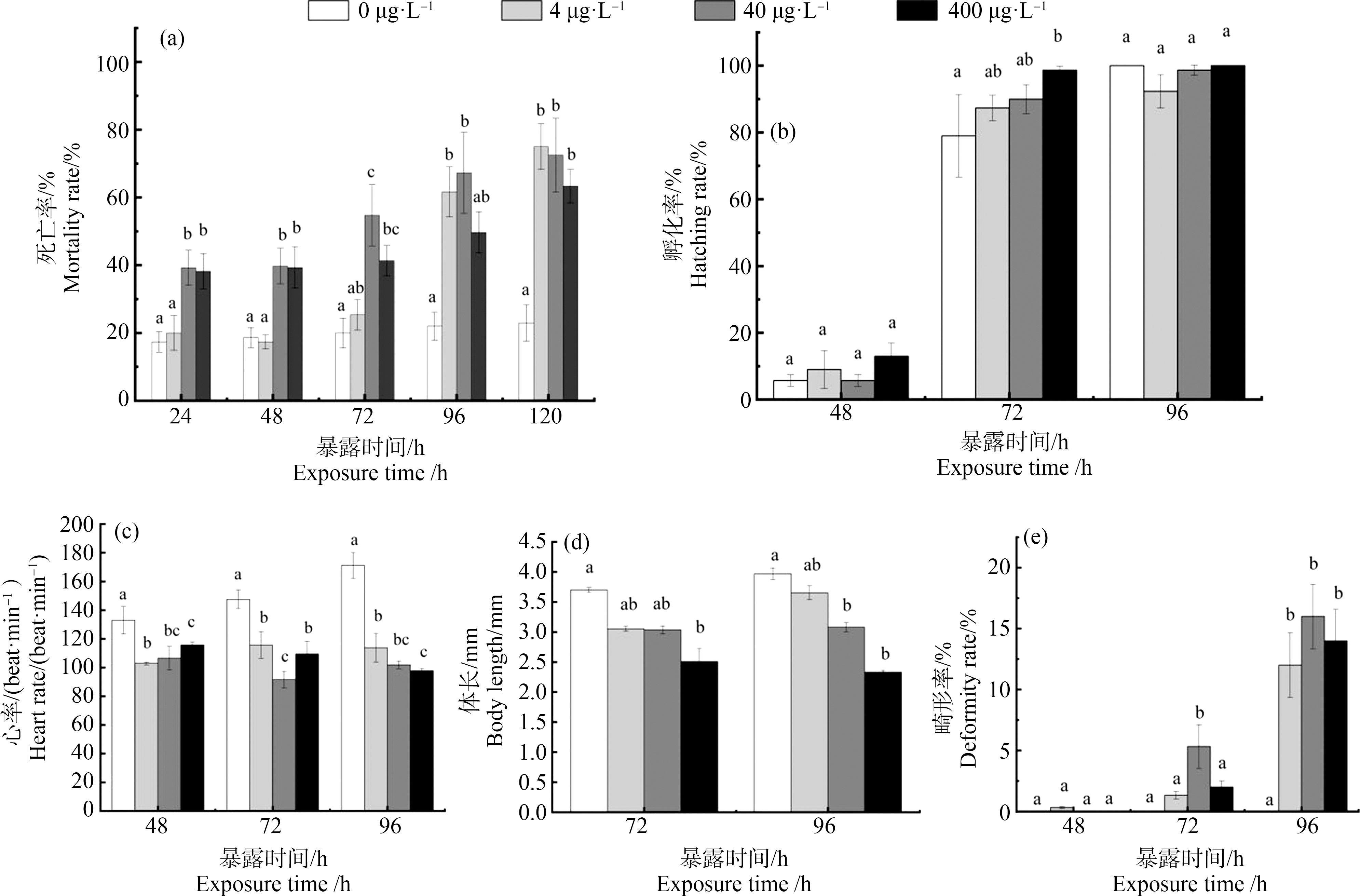
图1 磺胺甲恶唑(SMX)暴露对斑马鱼孵化率、死亡率、心率、体长和畸形率的影响
Fig. 1 Effects of sulfamethoxazole(SMX)exposure on hatchability, mortality, heart rate, body length and malformation rate of zebrafish

图2 72 hpf和96 hpf时斑马鱼幼鱼典型的畸形情况
注:TD表示尾部变形;YSE表示卵黄囊水肿;PE表示心包囊水肿;BS表示脊柱弯曲;TM表示尾部缺失。
Fig.2 Typical malformations of zebrafish larvae at 72 hpf and 96 hpf
Note: TD.tail deformation; YSE.yolk sac edema; PE.pericardial edema; BS.bend spinal; TM.tail missing.
2.2 磺胺甲恶唑对斑马鱼体内GH、IGF-Ⅰ含量的影响
不同浓度SMX暴露下斑马鱼仔鱼全鱼GH和IGF-Ⅰ的含量如图3所示,暴露至120 hpf时,实验组体内的GH含量和IGF-Ⅰ含量与对照组相比均显著升高(P<0.05)。
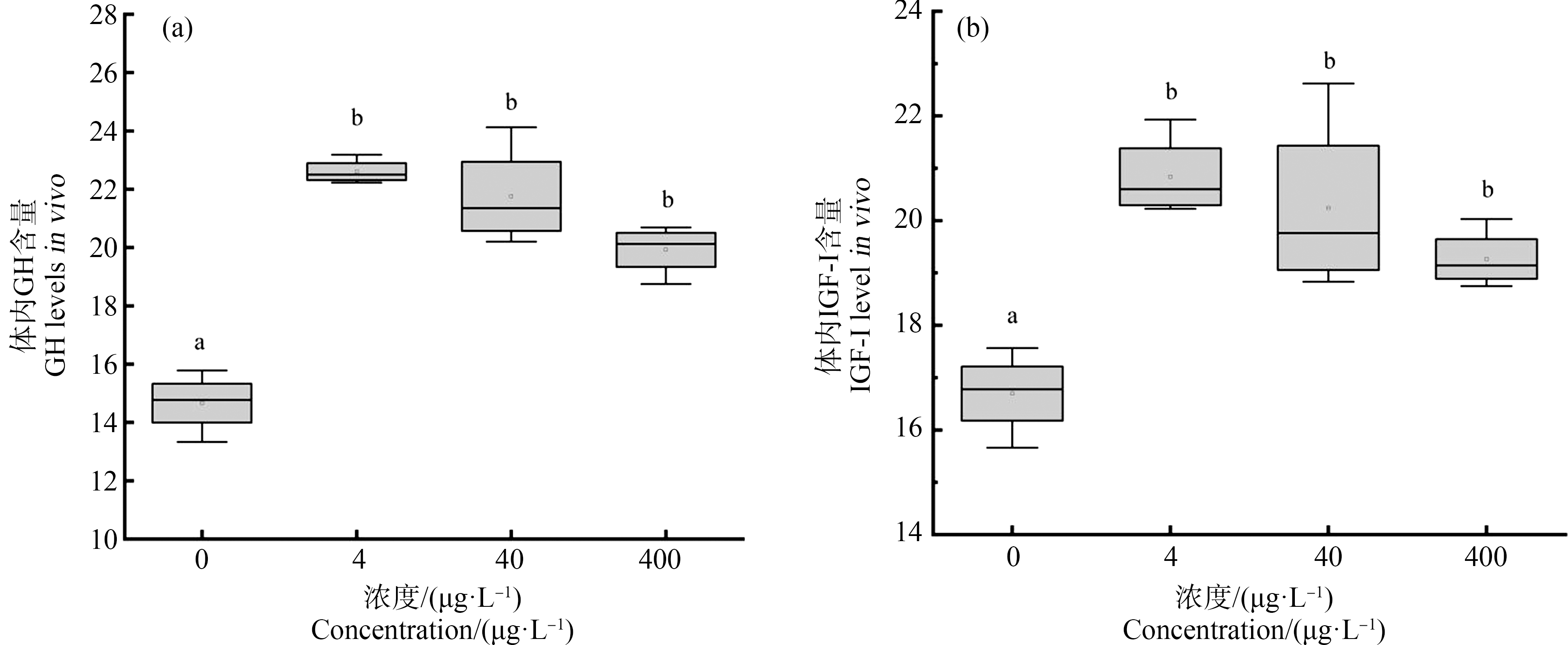
图3 120 hpf时斑马鱼幼鱼体内生长激素(GH)和胰岛素样生长因子(IGF-Ⅰ)的含量
Fig. 3 The contents of growth hormone(GH)and insulin-like growth factor(IGF-Ⅰ)in zebrafish larvae at 120 hpf
2.3 SMX暴露后斑马鱼的基因表达
如图4所示,斑马鱼在SMX暴露至120 hpf时,S4处理组的gh1(0.30倍)、ghrb(0.74倍)、igf1(0.75倍)、igf1ra(0.49倍)的mRNA表达量与对照组相比显著下调(P<0.05)。S40处理组gh1(0.17倍)、ghra(0.48倍)、ghrb(0.36倍)、igf1(0.23倍)、igf2b(0.57倍)、igf1ra(0.22倍)、igf1rb(0.74倍)的mRNA表达量与对照组相比显著下调(P<0.05)。S400处理组gh1(0.10倍)、ghra(0.36倍)、ghrb(0.39倍)、igf1(0.33倍)、igf2a(0.48倍)、gf2b(0.32倍)、igf1ra(0.72倍)、gf1rb(0.45倍)、igf2r(0.35倍)的mRNA表达量与对照组相比显著下调(P<0.05)。
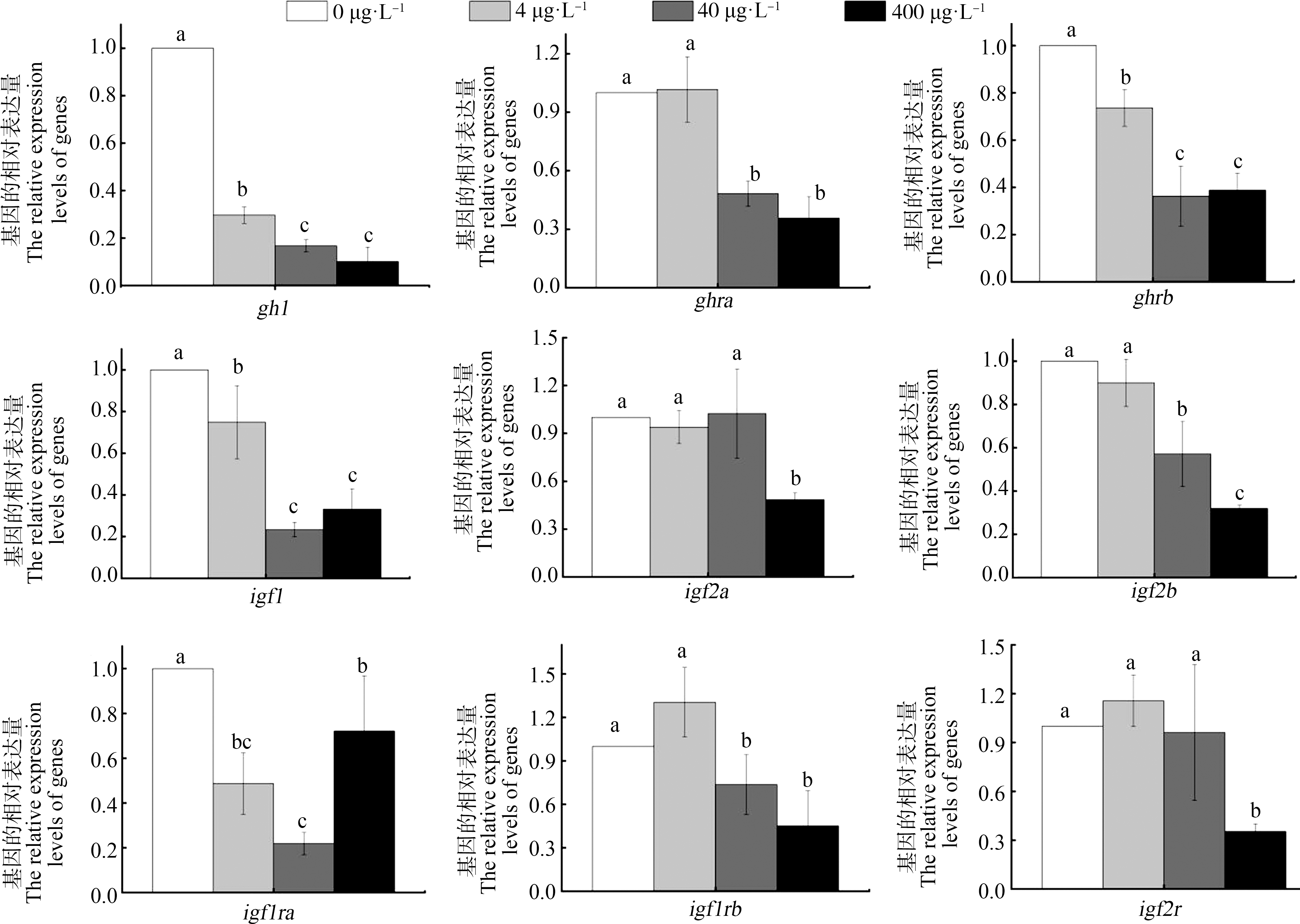
图4 斑马鱼幼鱼体内GH/IGF-Ⅰ轴相关基因的mRNA表达水平
Fig. 4 The mRNA expression levels of genes involved in GH/IGF-Ⅰ axis in zebrafish larvae
2.4 相关分析
在不同浓度的SMX暴露下,体长与心率、激素水平和相关基因的转录水平的皮尔逊相关分析如表2所示。暴露96 h后,体长和心率与GH、IGF-Ⅰ水平呈显著负相关,而与gh1、ghra、ghrb、igf1、igf2a、gf2b、igf1ra、gf1rb和igf2r的转录水平呈显著正相关。
表2 皮尔逊相关分析
Table 2 Pearson correlation analysis

激素水平Hormone levelmRNA水平mRNA level心率Heart rateGHIGF-Ⅰgh1ghraghrbigf1igf2aigf2bigf1raigf1rbigf2r体长Body lengthr0.591*-0.887**-0.874**0.734**0.735**0.740**0.739**0.736**0.734**0.754**0.733**0.730**
注:*表示显著相关P<0.05;**表示显著相关P<0.01。
Note: *indicates a significant correlation P<0.05; **indicates a significant correlation P<0.01.
3 讨论(Discussion)
SMX是一种广谱型的抗生素,由于大量使用而在水环境中广泛存在,通过生物富集从而对水生生物产生负面影响。本研究以斑马鱼胚胎/仔鱼为模型,考察了SMX暴露下斑马鱼胚胎的死亡率、孵化率、心率、体长和畸形率等发育参数的变化以及仔鱼体内生长相关激素水平及GH/IGF轴基因的转录变化,旨在探究SMX对斑马鱼早期生命阶段的发育毒性及生长抑制机制。
以往的研究表明,抗生素的暴露可能会对水生生物的存活产生影响。例如,刘丽丽等[24]发现用高浓度的磺胺二甲嘧啶(500~1 000 mg·L-1)暴露,会导致斑马鱼胚胎的死亡率显著上升。本研究发现较低浓度的SMX暴露仍然显著提高了斑马鱼胚胎的死亡率,并表现出明显的剂量效应关系,这表明SMX对鱼类的早期生命阶段具有很强的毒性。孵化期是斑马鱼胚胎发育的一个关键时期,孵化率是评估化学物质对鱼类影响的一个重要毒理学终点[25]。据文献报道,不同的化学物质对斑马鱼孵化率的影响各不相同。例如,4,4’-二氟二苯醚和2,4’-二羟基二苯醚等物质会降低斑马鱼的孵化率,而乙酸三苯锡、联苯菊酯能够促进斑马鱼胚胎的孵化[26]。本研究中除了SMX暴露至72 hpf时S400处理组的孵化率显著上升,其余处理组的孵化率都未受到显著影响。刘丽丽等[24]研究发现,与SMX具有相似化学结构的磺胺二甲嘧啶(1~700 mg·L-1)暴露斑马鱼胚胎,48 hpf时孵化率显著升高,表现出毒物兴奋效应。因此,我们推测400 μg·L-1SMX暴露对斑马鱼胚胎发育可能表现出同样的毒物兴奋效应,在72 hpf时使胚胎自主运动频率升高,提前出膜而导致孵化率异常升高。胚胎发育过程中心脏是最早发生并发挥生理功能的器官,完善的循环功能对于胚胎的正常发育起着关键作用[27]。因此,心率是评估环境污染物对斑马鱼胚胎心脏毒性的重要指标。本研究中,SMX暴露显著降低了斑马鱼胚胎/仔鱼的心率,这与Lin等[28]将斑马鱼暴露于磺胺甲恶唑、磺胺二甲嘧啶和磺胺嘧啶溶液中观察到的心率显著下降的结果相似。这些结果表明,SMX暴露可以降低斑马鱼胚胎/仔鱼的心率,影响心脏发育和干扰心脏的正常生理功能。此外,本研究发现高浓度的SMX(400 μg·L-1)会导致幼鱼畸形率显著升高。从暴露时间来看,SMX暴露至48 hpf时,斑马鱼的胚胎暂未出现畸形,继续暴露至72 hpf和96 hpf时出现了不同程度的畸形,包括脊柱弯曲、尾部缺失和心包囊水肿等。SMX对斑马鱼畸形率的影响表现出明显的时间依赖性,且实验中出现的脊柱及尾部弯曲表明SMX对斑马鱼早期生命阶段的骨骼发育有着明显的致畸作用,这与Yan等[29]用磺胺类药物暴露斑马鱼胚胎引起水肿和脊柱畸形的结果相似。
本研究还发现,高浓度的SMX(400 μg·L-1)对斑马鱼的体长有明显的抑制作用,并且表现出明显的剂量效应关系。近期研究也发现,在72 hpf时,SMX(0、2、20和2 000 μg·L-1)暴露显著降低了斑马鱼幼鱼的体长[30]。相似的,Liu等[31]将斑马鱼幼鱼暴露于100 μg·L-1SMX后,也发现了幼鱼体长显著缩短。这种体长的抑制效应可能与斑马鱼的心率有关,因为心率的下降会造成营养物质缺失,导致生长缓慢[32]。为了更深入地阐释SMX对斑马鱼生长的抑制作用机制,本研究对斑马鱼体内的GH、IGF-Ⅰ水平及GH/IGF-Ⅰ轴相关基因的转录水平进行了进一步的探索。GH是调控鱼类生长的关键因子,它通过IGF-Ⅰ的介导发挥作用[33-34]。IGF-Ⅰ是具有促有丝分裂和胰岛素样代谢功能的蛋白质[35],通过血液循环促进GH的合成与分泌。本实验中,SMX暴露使斑马鱼体内GH和IGF-Ⅰ的含量都显著升高,这与生长抑制效应的结果不一致。在鱼体内,IGF-Ⅰ水平受GH的调控,GH含量的上升对IGF-Ⅰ的表达具有正调节作用,会使鱼体内的IGF-Ⅰ浓度上升[36]。但是,GH对IGF-Ⅰ的调节是通过与生长激素受体(GHR)结合发挥作用,而IGF的活性主要受IGF受体(IGFR)的调控,IGFR水平的降低会抑制IGF结合蛋白(IGFBPs)的合成从而影响IGF转运,导致生长发育受损[37]。因此,我们推测SMX胁迫可能影响了GH与GHR及IGF-Ⅰ与IGFR的结合,从而抑制它们发挥正常的生理功能,从而对斑马鱼造成生长抑制效应。在本研究中,基因转录分析显示,高浓度的SMX暴露引起gh1和igf1的mRNA表达量显著下调,与幼鱼体内GH和IGF-Ⅰ变化趋势相反。这可能是由于斑马鱼在SMX暴露后激素水平的变化相较于基因转录水平的变化存在滞后性,GH/IGF轴相关基因的表达、转录、翻译调控与翻译后的修饰到相应物质合成需要一定的时间过程,因此随着暴露时间延长,GH和IGF-Ⅰ水平也可能会相应地出现下调。类似的,孙文静等[38]用一定剂量的BaP注射于褐菖鲉体内,发现EROD蛋白含量的变化明显滞后于基因表达量的变化。Borski等[39]发现,17β-雌二醇处理会诱导雌性成年大鼠体内GH和IGF-Ⅰ含量的显著上升,而gh和igf1mRNA表达水平显著下调,并导致大鼠体质量显著下降。在本研究中,高浓度SMX暴露组中gh1、ghra、ghrb、igf1、igf2a、igf2b、igf1ra、gf1rb和igf2r的转录水平均显著下降,与体长缩短的结果表现出显著正相关。ghr、igf1ra和igf1rb转录水平的下调也从基因层面上印证了我们的推测,SMX胁迫可能是通过抑制GH和IGF与受体的结合,从而影响了它们发挥正常的生理功能[40]。同时,IGF-Ⅰ水平的升高会通过负循环反馈机制抑制垂体GH的分泌[41],也可能导致后期鱼体内GH含量下降。此外,甲状腺激素水平对于鱼类早期的生长发育非常重要[42]。近期研究表明,SMX暴露能干扰甲状腺激素的合成,引起T4含量显著下降[43]。因此,甲状腺干扰也可能是SMX造成生长抑制效应的机制之一,有待进一步研究。
综上表明,SMX暴露对斑马鱼早期生命阶段表现出发育毒性,引起死亡率显著增加,心率明显下降和体长缩短。此外,高浓度(400 μg·L-1)的SMX对斑马鱼仔鱼有明显的致畸作用,典型畸形包括心包囊肿、脊柱弯曲和尾部畸形等。SMX暴露会导致斑马鱼仔鱼体内GH和IGF-Ⅰ水平的增加,但会下调多个GH/IGF轴基因的转录水平。SMX可能通过减缓心脏搏动和干扰GH/IGF轴从而产生生长抑制效应。
[1] Rodayan A, Roy R, Yargeau V.Oxidation products of sulfamethoxazole in ozonated secondary effluent[J].Journal of Hazardous Materials, 2010, 177(1-3): 237-243
[2] Wang J L, Wang S Z.Microbial degradation of sulfamethoxazole in the environment[J].Applied Microbiology and Biotechnology, 2018, 102(8): 3573-3582
[3] Luo Y, Xu L, Rysz M, et al.Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J].Environmental Science &Technology, 2011, 45(5): 1827-1833
[4] Fisch K, Waniek J J, Schulz-Bull D E.Occurrence of pharmaceuticals and UV-filters in riverine run-offs and waters of the German Baltic Sea[J].Marine Pollution Bulletin, 2017, 124(1): 388-399
[5] Mano H, Okamoto S.Preliminary ecological risk assessment of 10 PPCPs and their contributions to the toxicity of concentrated surface water on an algal species in the middle basin of Tama River[J].Journal of Water and Environment Technology, 2016, 14(6): 423-436
[6] Lv M, Sun Q, Hu A Y, et al.Pharmaceuticals and personal care products in a mesoscale subtropical watershed and their application as sewage markers[J].Journal of Hazardous Materials, 2014, 280: 696-705
[7] Wang L, Wu Y C, Zheng Y, et al.Efficient degradation of sulfamethoxazole and the response of microbial communities in microbial fuel cells[J].RSC Advances, 2015, 5(69): 56430-56437
[8] Managaki S, Murata A, Takada H, et al.Distribution of macrolides, sulfonamides, and trimethoprim in tropical waters: Ubiquitous occurrence of veterinary antibiotics in the Mekong Delta[J].Environmental Science &Technology, 2007, 41(23): 8004-8010
[9] Faleye A, Adegoke A, Ramluckan K, et al.Antibiotic residue in the aquatic environment: Status in Africa[J].Open Chemistry, 2018, 16(1): 890-903
[10] 陈雪妍.希瓦氏菌MR-1作用下磺胺甲恶唑的去除效果及强化研究[D].北京: 北京林业大学, 2020: 9
Chen X Y.Study on strengthening degradation and effect of sulfamethoxazole by Shewanella oneidensisMR-1[D].Beijing: Beijing Forestry University, 2020: 9(in Chinese)
[11] 金凡.电化学阴极增强Co(Ⅱ)-过硫酸盐体系降解水中磺胺甲恶唑的研究[D].重庆: 重庆大学, 2019: 11
Jin F.Research on electrochemical cathode enhanced degradation of sulfamethoxazole from aqueous solution in coupling cobalt(Ⅱ)with persulfate[D].Chongqing: Chongqing University, 2019: 11(in Chinese)
[12] 刘仁彬, 姜锦林, 张宇峰, 等.磺胺甲恶唑对斑马鱼胚胎/仔鱼的毒性效应[J].环境污染与防治, 2020, 42(3): 310-316
Liu R B, Jiang J L, Zhang Y F, et al.Toxic effects of sulfamethoxazole on zebrafish(Danio rerio)embryo/larva[J].Environmental Pollution &Control, 2020, 42(3): 310-316(in Chinese)
[13] Bates J M, Mittge E, Kuhlman J, et al.Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation[J].Developmental Biology, 2006, 297(2): 374-386
[14] 张石云.抗生素磺胺甲噁唑和微塑料复合暴露对罗非鱼生理效应影响的机制研究[D].南京: 南京农业大学, 2019: 50
Zhang S Y.Mechanism of antibiotics sulfamethoxazole and micro-plastics on physiological effects of tilapia[D].Nanjing: Nanjing Agricultural University, 2019: 50(in Chinese)
[15] 张健, 刘玉兰, 张冬, 等.水体中二氯乙酰胺以及磺胺甲恶唑对斑马鱼的毒性研究[J].环境科技, 2015, 28(6): 34-39
Zhang J, Liu Y L, Zhang D, et al.Toxic research on zebrafish exposed to dichloroacetamide and sulfamethoxazole in aquatic ecosystem[J].Environmental Science and Technology, 2015, 28(6): 34-39(in Chinese)
[16] 郑艳, 汝少国.外源化学物质对鱼类生长和GH/IGF-Ⅰ轴的影响[J].中国海洋大学学报(自然科学版), 2012, 42(S1): 102-106
Zheng Y, Ru S G.Effects of exogenous chemicals on fish growth and GH/IGF-Ⅰ axis[J].Periodical of Ocean University of China, 2012, 42(S1): 102-106(in Chinese)
[17] 仲勇.盐度影响金钱鱼生长及渗透相关基因的表达[D].上海: 上海海洋大学, 2019: 4
Zhong Y.Effects of salinity on growth and osmotic gene expression in spotted scat(Scatophagus argus)[D].Shanghai: Shanghai Ocean University, 2019: 4(in Chinese)
[18] Jones J I, Clemmons D R.Insulin-like growth factors and their binding proteins: Biological actions[J].Endocrine Reviews, 1995, 16(1): 3-34
[19] Svensson J, Ohlsson C, Jansson J O, et al.Treatment with the oral growth hormone secretagogue MK-677 increases markers of bone formation and bone resorption in obese young males[J].Journal of Bone and Mineral Research, 1998, 13(7): 1158-1166
[20] Murray R D, Kim K, Ren S G, et al.Central and peripheral actions of somatostatin on the growth hormone-IGF-Ⅰ axis[J].The Journal of Clinical Investigation, 2004, 114(3): 349-356
[21] Elonen G E, Spehar R L, Holcombe G W, et al.Comparative toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin to seven freshwater fish species during early life-stage development[J].Environmental Toxicology and Chemistry, 1998, 17(3): 472-483
[22] Ensenbach U, Nagel R.Toxicity of binary chemical mixtures: Effects on reproduction of zebrafish(Brachydanio rerio)[J].Archives of Environmental Contamination and Toxicology, 1997, 32(2): 204-210
[23] 许冰洁, 张立将, 李春启, 等.斑马鱼胚胎评价5种药物的发育毒性与模型验证[J].中国药理学通报, 2016, 32(1): 74-79
Xu B J, Zhang L J, Li C Q, et al.Model validation and evaluation of developmental toxicity of five drugs using zebrafish embryos[J].Chinese Pharmacological Bulletin, 2016, 32(1): 74-79(in Chinese)
[24] 刘丽丽, 吕鹏, 闫艳春.磺胺二甲嘧啶对斑马鱼胚胎的急性毒性作用[J].中国渔业质量与标准, 2018, 8(1): 34-39
Liu L L, Lv P, Yan Y C.Acute toxicities of sulfamethazine to zebrafish embryos[J].Chinese Fishery Quality and Standards, 2018, 8(1): 34-39(in Chinese)
[25] Organization for Economic Co-operation and Development(OECD).Test No.236: Fish embryo acute toxicity(FET)test[S].Paris: OECD, 2013
[26] Qin L, Liu F, Liu H, et al.Evaluation of HODE-15, FDE-15, CDE-15, and BDE-15 toxicity on adult and embryonic zebrafish(Danio rerio)[J].Environmental Science and Pollution Research International, 2014, 21(24): 14047-14057
[27] 吴玉琼, 陈莹, 胡永乐, 等.四种新型农药对斑马鱼胚胎发育的毒性效应[J].生物技术通报, 2017, 33(6): 155-161
Wu Y Q, Chen Y, Hu Y L, et al.Toxic effects of four currently-used pesticides on zebrafish embryonic development[J].Biotechnology Bulletin, 2017, 33(6): 155-161(in Chinese)
[28] Lin T, Yu S L, Chen Y Q, et al.Integrated biomarker responses in zebrafish exposed to sulfonamides[J].Environmental Toxicology and Pharmacology, 2014, 38(2): 444-452
[29] Yan Z Y, Yang Q L, Jiang W L, et al.Integrated toxic evaluation of sulfamethazine on zebrafish: Including two lifespan stages(embryo-larval and adult)and three exposure periods(exposure, post-exposure and re-exposure)[J].Chemosphere, 2018, 195: 784-792
[30] Yan Z H, Lu G H, Ye Q X, et al.Long-term effects of antibiotics, norfloxacin, and sulfamethoxazole, in a partial life-cycle study with zebrafish(Danio rerio): Effects on growth, development, and reproduction[J].Environmental Science and Pollution Research, 2016, 23(18): 18222-18228
[31] Liu J Y, Wei T Z, Wu X, et al.Early exposure to environmental levels of sulfamethoxazole triggers immune and inflammatory response of healthy zebrafish larvae[J].The Science of the Total Environment, 2020, 703: 134724
[32] 宋唯一, 刘景, 白琼琼, 等.有机磷阻燃剂TDMPP对斑马鱼早期器官发育毒性的研究[J].中国实用医药, 2020, 15(36): 202-206
Song W Y, Liu J, Bai Q Q, et al.Study on toxicity of organophosphorus flame retardant TDMPP to early organ development of zebrafish[J].China Practical Medicine, 2020, 15(36): 202-206(in Chinese)
[33] 林浩然.鱼类生长和生长激素分泌活动的调节[J].动物学报, 1996, 42(1): 69-79
Lin H R.The regulation of growth and growth hormone secretion in fish[J].Acta Zoologica Sinica, 1996, 42(1): 69-79(in Chinese)
[34] 姜雪.久效磷对早期生长发育阶段斑马鱼GH、GHR1和IGF-Ⅰ基因表达的影响[D].青岛: 中国海洋大学, 2009: 49
Jiang X.The effects of monocrotophos on the expression of GH, GHR1 and IGF-Ⅰ of early developmental stages of zebrafish[D].Qingdao: Ocean University of China, 2009: 49(in Chinese)
[35] 马文阁.黄颡鱼GH/IGF生长轴基因的序列特征和两性表达差异分析[D].武汉: 华中农业大学, 2016: 14
Ma W G.Characterization and sex-dependent expression of GH/IGF axis genes in yellow catfish[D].Wuhan: Huazhong Agricultural University, 2016: 14(in Chinese)
[36] Wood A W, Duan C M, Bern H A.Insulin-like growth factor signaling in fish[J].International Review of Cytology, 2005, 243: 215-285
[37] Baxter R C, Martin J L.Binding proteins for the insulin-like growth factors: Structure, regulation and function[J].Progress in Growth Factor Research, 1989, 1(1): 49-68
[38] 孙文静, 王晓艳, 祁鹏志, 等.苯并[a]芘(BaP)对褐菖鲉(Sebasticus marmoratus)肝CYP1A1酶活性、基因表达及蛋白表达的影响[J].海洋与湖沼, 2018, 49(4): 897-903
Sun W J, Wang X Y, Qi P Z, et al.Effects of benzo[a]pyrene on EROD activity, mRNA expression, and protein expression of CYP1A1 in the liver of Sebasticus marmoratus[J].Oceanologia et Limnologia Sinica, 2018, 49(4): 897-903(in Chinese)
[39] Borski R J, Tsai W, DeMott-Friberg R, et al.Regulation of somatic growth and the somatotropic axis by gonadal steroids: Primary effect on insulin-like growth factor Ⅰ gene expression and secretion[J].Endocrinology, 1996, 137(8): 3253-3259
[40] Wang L N, Yan R, Yang Q L, et al.Role of GH/IGF axis in arsenite-induced developmental toxicity in zebrafish embryos[J].Ecotoxicology and Environmental Safety, 2020, 201: 110820
[41] Wong A O, Zhou H, Jiang Y H, et al.Feedback regulation of growth hormone synthesis and secretion in fish and the emerging concept of intrapituitary feedback loop[J].Comparative Biochemistry and Physiology Part A, Molecular &Integrative Physiology, 2006, 144(3): 284-305
[42] 于道德, 宁璇璇, 任贵如, 等.甲状腺激素在鱼类繁殖中的作用[J].海洋科学, 2010, 34(7): 106-110
Yu D D, Ning X X, Ren G R, et al.Functions of thyroid hormone in fish reproduction[J].Marine Sciences, 2010, 34(7): 106-110(in Chinese)
[43] Thienpont B, Tingaud-Sequeira A, Prats E, et al.Zebrafish eleutheroembryos provide a suitable vertebrate model for screening chemicals that impair thyroid hormone synthesis[J].Environmental Science &Technology, 2011, 45(17): 7525-7532