基于抗生素的化学结构,抗生素可大致分为磺胺类、四环素类、喹诺酮类和β内酰胺类等,诺氟沙星是喹诺酮类抗生素中的一种,能有效抑制革兰氏阳性菌和革兰氏阴性菌[1],被广泛应用于医疗和牲畜养殖。2013年,我国诺氟沙星的使用量5 440 t[2],人和动物对诺氟沙星的吸收率较低,大部分通过粪便或者尿液被排出,最终会以原始物质或副产物的形式排入水中,对水环境构成潜在的威胁。研究发现,在不同的废水、地表水和地下水中都能检测到一定浓度的诺氟沙星(ng·L-1~μg·L-1)[3-4],它的持续输入和生物积累可能会引发一些严重的问题,会干扰细菌DNA复制,对植物和水生生物造成伤害,还可能转移到人体,引起胃肠道不适、头晕、头痛和失眠等[5-7]。目前关于诺氟沙星的研究多集中在降解去除、毒性效应等方面,张艳荣等[8]发现在pH为中性、BiOBr分子印迹材料投加量为2.5 g·L-1时,对低浓度(1 mg·L-1)诺氟沙星溶液的去除率可达到99%;Lakshmi Prabavathi和Muthuraj[9]发现与单一组分的g-C3N4纳米片、NiWO4纳米棒相比,合成的NiWO4@g-C3N4光催化剂对诺氟沙星具有更加优异的光催化降解性能;付泊明等[10]发现在pH为7.0、温度为30 ℃、哌嗪与诺氟沙星浓度比为5∶1时,山羊葡萄球菌对初始浓度为5 mg·L-1的诺氟沙星的降解率为92.6%;沈洪艳和王亚萌[11]发现诺氟沙星对黑麦草种子发芽有抑制作用,浓度越大发芽率越低;施文杰等[12]通过对比诺氟沙星对盐生杜氏藻、新月菱形藻和小球藻的毒性效应,发现其对小球藻的毒性效应最高。随着“十四五”时期生态文明建设的不断深化,抗生素等新污染物已成为生态环境保护工作的重点对象,诺氟沙星作为一种应用广泛的抗生素,自2015年起就被原国家农业部禁止用于食品动物,但在环境中仍有不同程度的残留,为探究其残留浓度对水生生物的影响,有必要开展诺氟沙星相关研究。此外,目前我国尚未制定抗生素的水质标准及水质基准,研究制定符合我国生态环境特征的诺氟沙星水生生物基准,将为制订相关生态环境质量标准、评估生态环境风险以及进行生态环境管理提供理论基础和科学依据。综上所述,亟待开展诺氟沙星水生生物水质基准相关研究。
结合诺氟沙星对水生生物的急性、慢性毒性效应数据,采用毒性百分数排序法和物种敏感度分布法推导诺氟沙星水生生物水质基准,并采用商值法和安全阈值法对我国典型水体的诺氟沙星暴露生态风险进行评估,旨在为我国地表水环境质量标准的制定提供建议,为水环境风险管控和水生态系统保护提供参考。
1 材料与方法(Materials and methods)
1.1 诺氟沙星毒性数据搜集、筛选
水质基准值的推导需要依据科学的毒理数据,此次诺氟沙星基准值推导所需要的数据主要来自US EPA的ECOTOX数据库,并在中国知网以及Web of Science数据库查找并搜集迄今已发表文献中诺氟沙星对水生生物的急、慢性毒理数据进行补充。从ECOTOX上共搜集到123条数据,从知网及Web of Science上公开发表的文献中搜集到5条数据,统计时间截至2021年10月。将ECOTOX、CNKI和Web of Science数据库搜集到的数据整理在一起,对其进行筛选,筛选原则依据生态环境部发布的《淡水生物水质基准推导技术指南》[13],数据筛选的步骤如下:①以分布在我国境内、能反映我国淡水生物区系特征的水生生物为优选对象,避免采用外来入侵物种;②水生生物毒性数据均来自于水相中诺氟沙星的实验结果,均为流水式、半静态暴露毒性数据,急性毒性终点包括半抑制浓度(EC50),慢性毒性终点包括无可见效应浓度(NOEC)和最低可见效应浓度(LOEC);③舍弃有问题的数据,如物种的同一毒性终点实验数据相差10倍以上的离群值;④当同物种、同终点有多个毒性值可用时,取几何平均值为物种平均毒性值[14]。
1.2 水质基准值的推导方法
物种敏感度分布法考虑了生物间因地理和环境因素的差异,即不同生物对同一种污染物的敏感性不同,并且认为这些敏感度差异符合一定的概率分布模型,该方法利用获得的毒性数据来拟合多个物种敏感度分布曲线,选择最优拟合曲线,并以最优曲线的数学模型外推得出基准值[15]。在这种方法中[13],首先计算同效应急性值(AVE)和同效应慢性值(CVE),并对其进行对数转换,其次进行累积频率(FR)计算,并分别以AVE和CVE的lg值为横轴,以对应的FR为纵轴,利用正态分布模型、对数正态分布模型、逻辑斯谛模型和对数逻辑斯谛模型进行拟合,最后通过拟合曲线得出能保护95%生物的污染物浓度,经评估因子外推后得到水生生物短期水质基准(SWQC)和水生生物长期水质基准(LWQC)。
毒性百分数排序法分开考虑急性和慢性毒性效应,并且使用数统方法来制定基准值。在这种方法中[16],首先计算属平均急性值(GMAV)及属平均慢性值(GMCV),将GMAV及GMCV按照数值大小从高到低排序,计算每个属对应的的FR,其次用得到的GMAV和FR计算最终急性值(FAV),基准最大浓度(CMC)是FAV的1/2,最终慢性值(FCV)可用GMCV和FR计算得到,也可以由FAV与最终急慢性比(FACR)的比值得到,基准连续浓度(CCC)是FCV、最终植物值(FPV)、最终残留值(FRV)中的最小值。
1.3 生态风险评估方法
生态风险评估是定量表征有毒污染物生态危害的评估体系,商值法是一种简单易行、使用范围广泛的半定量风险评估方法,风险商值(RQ)由药物残留的预测环境浓度(PEC)和预测无影响浓度(PNEC)确定,然而对于PEC的计算十分复杂,为方便计算,PEC可以用环境暴露浓度(MEC)代替,因此,本研究使用MEC代替PEC,PNEC使用推导出的LWQC/CCC值表示[17]。RQ的计算公式如下:
RQ=MEC/PNEC
根据Hernando等[18]提出的RQ分类方法来评估生态风险等级,即当RQ<0.01时认为污染物对水生生物无生态风险;当0.01≤RQ<0.1时认为污染物对水体生物存在低等风险,暂无需实施管理措施;当0.1≤RQ<1时表示污染物对水体生物存在中等风险,需监测其环境动态,避免高风险发生;当RQ≥1时认为污染物对水体生物存在高风险,应重点关注。
安全阈值法是一种可从图上分析污染物对水生生物影响程度的定量风险评估方法,通过比较物种敏感度分布曲线和暴露浓度累积分布曲线的重合程度,分析评估污染物给环境带来的风险程度[19]。毒性数据和暴露浓度的分布重合度(MOS10)由保护90%水生生物的浓度(SSD10)与P为90%的暴露浓度(ECD90)的比值确定,计算公式如下:
MOS10=SSD10/ECD90
MOS10<1时表明污染物对水生生物有较高生态风险,MOS10>1时表明其对水生生物没有生态风险。
2 结果与讨论(Results and discussion)
2.1 诺氟沙星对水生生物的毒性数据
按照1.1中步骤将毒性数据进行筛选整理,共获得33条数据。搜集到诺氟沙星的淡水生物急性毒性数据16条,涵盖5门、8科、10属、15个物种;搜集到慢性毒理数据17条,涵盖5门、7科、8属、11个物种。诺氟沙星的淡水生物急性、慢性毒理数据均来自蓝藻门、绿藻门、被子植物门、节肢动物门和脊索动物门。诺氟沙星的AVE/SMAV和GMAV值见表1,CVE/SMCV和GMCV值见表2。表1中诺氟沙星的AVE均为生长类AVE,结合表2中同一暴露实验的慢性毒性数据,计算得到大型溞的最大容许毒物浓度(MATC)为120.0 μg·L-1,基于MATC/NOEC/LOEC得到生长类CVE。
表1 诺氟沙星的水生生物急性毒性数据
Table 1 Acute toxicity data for aquatic organisms of norfloxacin
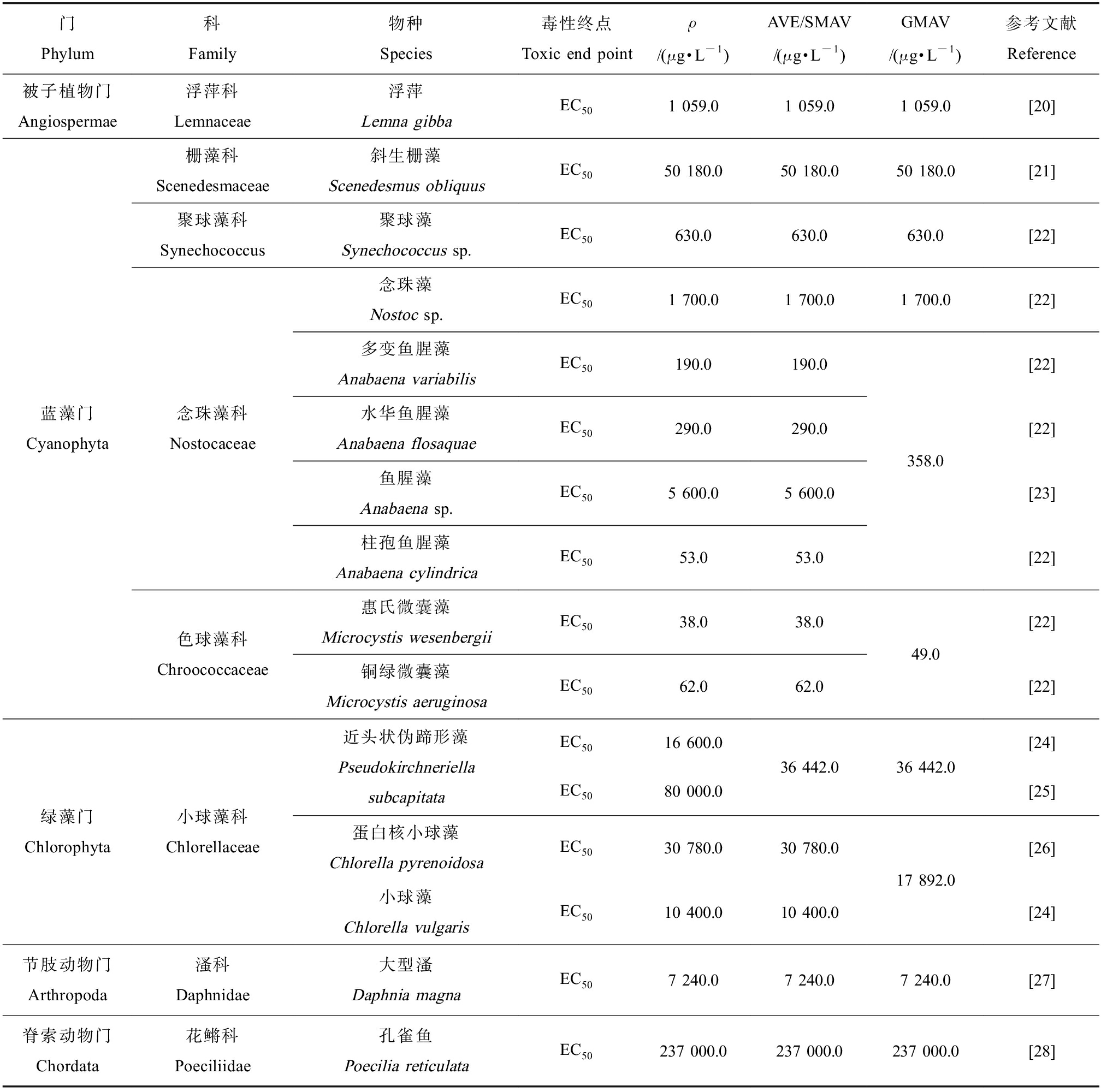
门Phylum科Family物种Species毒性终点Toxic end pointρ/(μg·L-1)AVE/SMAV/(μg·L-1)GMAV/(μg·L-1)参考文献Reference被子植物门Angiospermae浮萍科Lemnaceae浮萍Lemna gibbaEC501 059.01 059.01 059.0[20]蓝藻门Cyanophyta栅藻科Scenedesmaceae聚球藻科Synechococcus念珠藻科Nostocaceae色球藻科Chroococcaceae斜生栅藻Scenedesmus obliquusEC5050 180.050 180.0聚球藻Synechococcus sp.EC50630.0630.0念珠藻Nostoc sp.EC501 700.01 700.0多变鱼腥藻Anabaena variabilisEC50190.0190.0水华鱼腥藻Anabaena flosaquaeEC50290.0290.0鱼腥藻Anabaena sp.EC505 600.05 600.0柱孢鱼腥藻Anabaena cylindricaEC5053.053.0惠氏微囊藻Microcystis wesenbergiiEC5038.038.0铜绿微囊藻Microcystis aeruginosaEC5062.062.050 180.0630.01 700.0358.049.0[21][22][22][22][22][23][22][22][22]绿藻门Chlorophyta小球藻科Chlorellaceae近头状伪蹄形藻Pseudokirchneriella subcapitata蛋白核小球藻Chlorella pyrenoidosa小球藻Chlorella vulgarisEC5016 600.0EC5080 000.0EC5030 780.0EC5010 400.036 442.030 780.010 400.036 442.017 892.0[24][25][26][24]节肢动物门Arthropoda溞科Daphnidae大型溞Daphnia magnaEC507 240.07 240.07 240.0[27]脊索动物门Chordata花鳉科Poeciliidae孔雀鱼Poecilia reticulataEC50237 000.0237 000.0237 000.0[28]
注:EC50表示半抑制浓度,AVE表示同效应急性值,SMAV表示物种平均急性值,GMAV表示属平均急性值。
Note: EC50 is the half inhibitory concentration, AVE is acute value for the same effect, SMAV is the mean acute value of species, and GMAV is the mean acute value of genus.
表2 诺氟沙星的水生生物慢性毒性数据
Table 2 Chronic toxicity data of aquatic organisms of norfloxacin
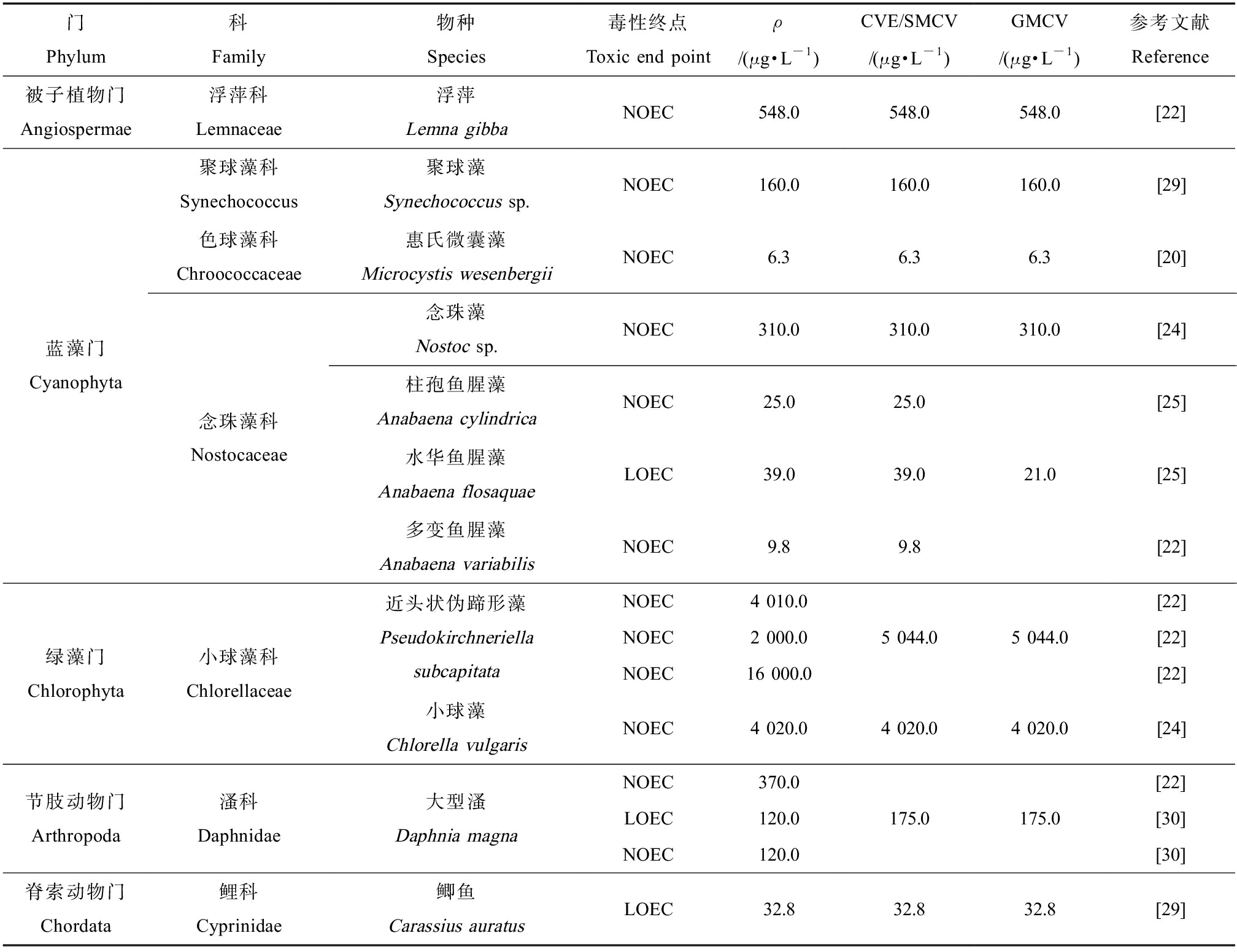
门Phylum科Family物种Species毒性终点Toxic end pointρ/(μg·L-1)CVE/SMCV/(μg·L-1)GMCV/(μg·L-1)参考文献Reference被子植物门Angiospermae浮萍科Lemnaceae浮萍Lemna gibbaNOEC548.0548.0548.0[22]蓝藻门Cyanophyta聚球藻科Synechococcus色球藻科Chroococcaceae念珠藻科Nostocaceae聚球藻Synechococcus sp.NOEC160.0160.0惠氏微囊藻Microcystis wesenbergiiNOEC6.36.3念珠藻Nostoc sp.NOEC310.0310.0柱孢鱼腥藻Anabaena cylindricaNOEC25.025.0水华鱼腥藻Anabaena flosaquaeLOEC39.039.0多变鱼腥藻Anabaena variabilisNOEC9.89.8160.06.3310.021.0[29][20][24][25][25][22]绿藻门Chlorophyta小球藻科Chlorellaceae近头状伪蹄形藻Pseudokirchneriella subcapitata小球藻Chlorella vulgarisNOEC4 010.0NOEC2 000.0NOEC16 000.0NOEC4 020.05 044.05 044.04 020.04 020.0[22][22][22][24]节肢动物门Arthropoda溞科Daphnidae大型溞Daphnia magnaNOEC370.0LOEC120.0NOEC120.0175.0175.0[22][30][30]脊索动物门Chordata鲤科Cyprinidae鲫鱼Carassius auratusLOEC32.832.832.8[29]
注:LOEC表示最低可见效应浓度,NOEC表示无可见效应浓度,CVE表示同效应慢性值,SMCV表示物种平均慢性值,GMCV表示属平均慢性值。
Note: LOEC is the lowest observed effect concentration, NOEC is the no observed effect concentration, CVE is chronic value for the same effect, SMCV is the mean chronic value of species, and GMCV is the mean chronic value of genus.
2.2 诺氟沙星的水生生物水质基准值
2.2.1 基于物种敏感度分布法的水质基准推导
使用我国生态环境基准专家委员会研发的EEC-SSD软件进行SWQC推导,在推导时以诺氟沙星AVE的lg值为横轴,以对应的FR为纵轴,分别使用正态分布模型、对数正态分布模型、逻辑斯谛模型和对数逻辑斯谛模型进行拟合,拟合曲线见图1,各模型拟合参数与计算结果见表3。模型的拟合优度用均方根误差(RMSE)和概率(P)值评价,根据拟合优度评价结果,在P>0.05的拟合模型中,选择RMSE最小的正态分布模型作为最优拟合模型,基于该模型得到的HC5为21.84 μg·L-1,由于有效急性毒性数据包括的物种数量为15,故评估因子取3,即基于物种敏感度分布法的诺氟沙星SWQC为7.28 μg·L-1。

图1 不同模型拟合的诺氟沙星急性物种敏感度分布曲线
注:AVE表示同效应急性值,FR表示累积频率。
Fig. 1 Distribution curves of acute species sensitivity of norfloxacin fitted by different models
Note: AVE is acute value for the same effect, and FR is the cumulative frequency.
表3 不同模型拟合诺氟沙星的急性物种敏感度分布曲线结果
Table 3 The results of fitting acute species sensitivity distribution curves of norfloxacin by different models
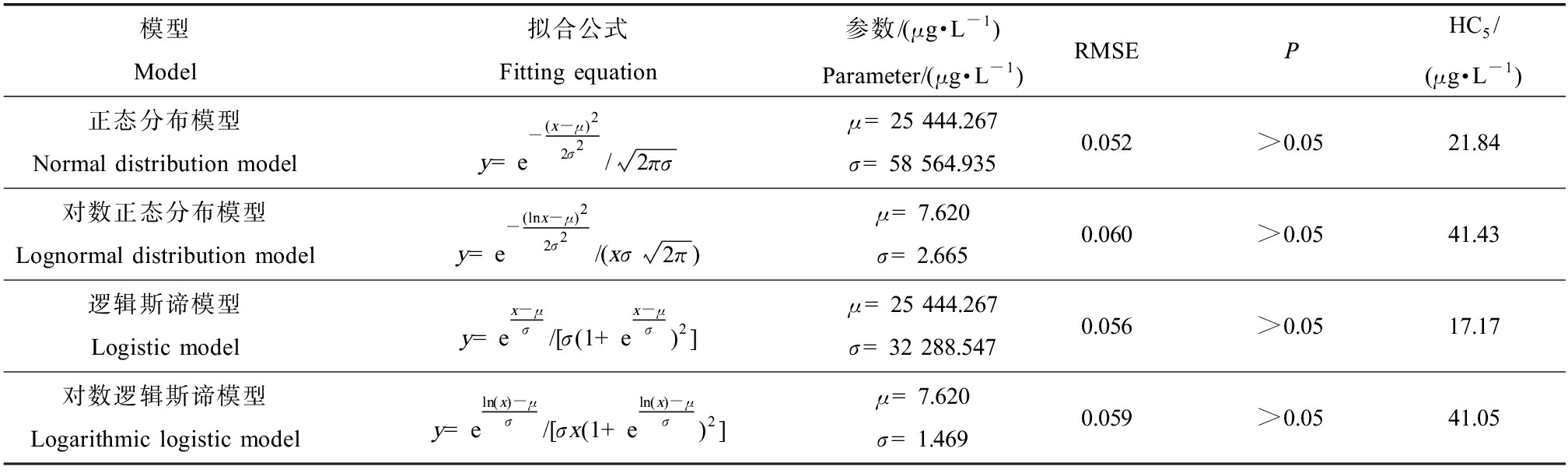
模型Model拟合公式Fitting equation参数/(μg·L-1)Parameter/(μg·L-1)RMSEPHC5/(μg·L-1)正态分布模型Normal distribution modely=e-(x-μ)22σ2/2πσμ=25 444.267σ=58 564.9350.052>0.0521.84对数正态分布模型Lognormal distribution modely=e-(lnx-μ)22σ2/(xσ2π)μ=7.620σ=2.6650.060>0.0541.43逻辑斯谛模型Logistic modely=ex-μσ/[σ(1+ex-μσ)2]μ=25 444.267σ=32 288.5470.056>0.0517.17对数逻辑斯谛模型Logarithmic logistic modely=eln(x)-μσ/[σx(1+eln(x)-μσ)2]μ=7.620σ=1.4690.059>0.0541.05
使用我国生态环境基准专家委员会研发的EEC-SSD软件进行LWQC推导,在推导时以诺氟沙星CVE的lg值为横轴,以对应的FR为纵轴,分别使用正态分布模型、对数正态分布模型、逻辑斯谛模型和对数逻辑斯谛模型进行拟合,拟合曲线见图2,各模型拟合参数与计算结果见表4。模型的拟合优度用RMSE和P值评价,根据拟合优度评价结果,在P>0.05的拟合模型中,选择RMSE最小的对数正态分布模型作为最优拟合模型,基于该模型得到的HC5为6.96 μg·L-1,由于有效慢性毒性数据包括的物种数量为11,故评估因子取3,即基于物种敏感度分布法的诺氟沙星LWQC为2.32 μg·L-1。

图2 不同模型拟合的诺氟沙星慢性物种敏感度分布曲线
注:CVE表示同效应慢性值,FR表示累积频率。
Fig. 2 Distribution curves of chronic species sensitivity of norfloxacin fitted by different models
Note: CVE is chronic value for the same effect, and FR is the cumulative frequency.
表4 不同模型拟合诺氟沙星的慢性物种敏感度分布曲线结果
Table 4 The results of fitting chronic species sensitivity distribution curves of norfloxacin by different models

模型Model拟合公式Fitting equation参数/(μg·L-1)Parameter/(μg·L-1)RMSEPHC5/(μg·L-1)正态分布模型Normal distribution modely=e-(x-μ)22σ2/2πσμ=942.718σ=1 713.1160.057>0.053.30对数正态分布模型Lognormal distribution modely=e-(lnx-μ)22σ2/(xσ2π)μ=4.873σ=2.1330.055>0.056.96逻辑斯谛模型Logistic modely=ex-μσ/[σ(1+ex-μσ)2]μ=942.718σ=942.3130.059>0.052.79对数逻辑斯谛模型Logarithmic logistic modely=eln(x)-μσ/[σx(1+eln(x)-μσ)2]μ=4.873σ=1.1760.059>0.057.07
2.2.2 基于毒性百分数排序法的水质基准推导
按照物种敏感度对诺氟沙星的急性毒性数据排序,急性数据排序结果如表5所示。对GMAV进行排序后,得到对诺氟沙星急性毒性最敏感的4个属分别为:微囊藻属(FR=0.0909)、鱼腥藻属(FR=0.1818)、聚球藻属(FR=0.2727)和浮萍属(FR=0.3636),四者的GMAV分别为49.0、358.0、630.0和1 059.0 μg·L-1。根据表中数据计算得到FAV为27.17 μg·L-1,基于毒性百分数排序法的诺氟沙星CMC值为13.59 μg·L-1。
表5 属平均急性值及其他相关计算
Table 5 The mean acute value and other related calculations
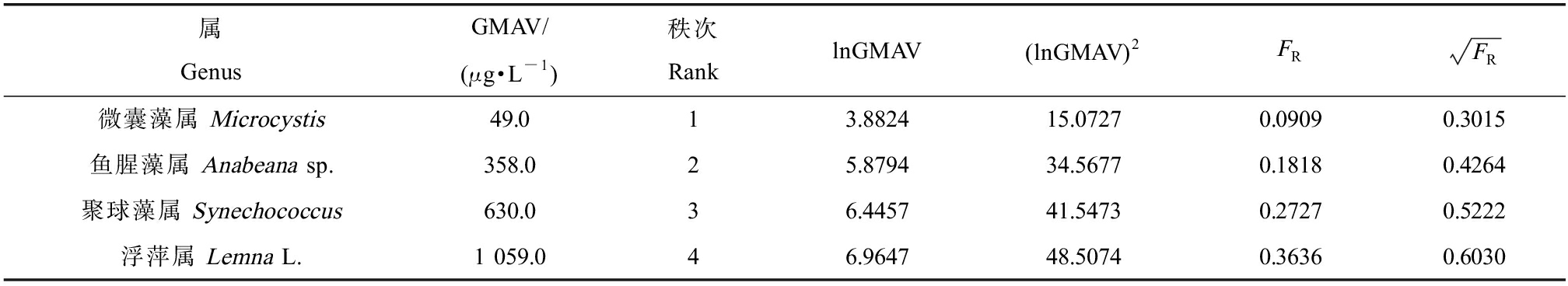
属GenusGMAV/(μg·L-1)秩次RanklnGMAV(lnGMAV)2FRFR微囊藻属 Microcystis49.013.882415.07270.09090.3015鱼腥藻属 Anabeana sp.358.025.879434.56770.18180.4264聚球藻属 Synechococcus630.036.445741.54730.27270.5222浮萍属 Lemna L.1 059.046.964748.50740.36360.6030
按照物种敏感度对诺氟沙星的慢性毒性数据排序,慢性数据排序结果如表6所示。对GMCV进行排序后,得到对诺氟沙星慢性毒性最敏感的4个属分别为:微囊藻属(FR=0.1000)、鱼腥藻属(FR=0.2000)、鲫属(FR=0.3000)和聚球藻属(FR=0.4000),四者的GMAV分别为6.3、21.0、32.8和160.0 μg·L-1。根据表中数据计算得到FCV为3.85 μg·L-1。CCC是FCV、FPV、FRV中的最小值,FPV是最终植物值,是藻类或水生维管束植物所做的慢性实验得出的结果中的最小值,取惠氏微囊藻的6.3 μg·L-1,FRV是最终残留值,是最大允许组织浓度与生物富集因子的比值,由范红照等[31]的研究发现,诺氟沙星在鳗鲡的肌肉、肝、肾等部位消除较快,表明诺氟沙星在鱼体内的富集作用不明显,因此不再计算FRV。基于毒性百分数排序法的诺氟沙星CCC值为3.85 μg·L-1。
表6 属平均慢性值及其他相关计算
Table 6 The mean chronic value and other related calculations
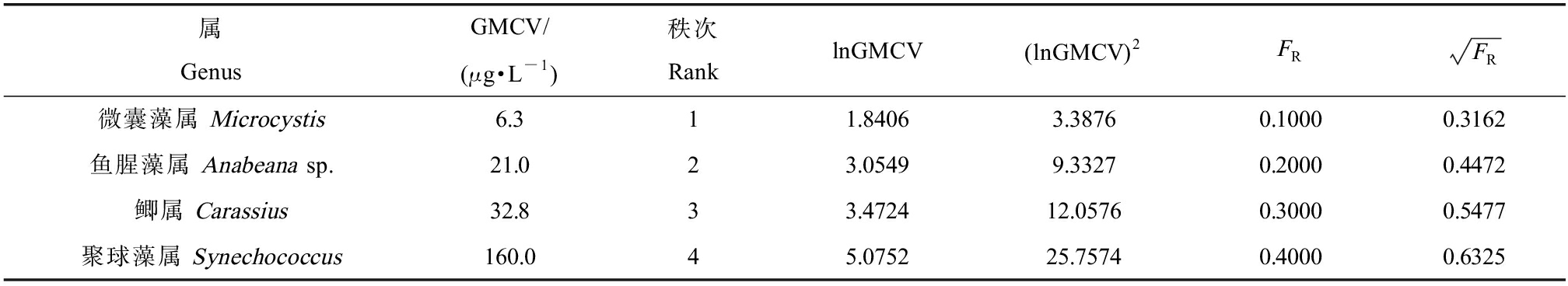
属GenusGMCV/(μg·L-1)秩次RanklnGMCV(lnGMCV)2FRFR微囊藻属 Microcystis6.311.84063.38760.10000.3162鱼腥藻属 Anabeana sp.21.023.05499.33270.20000.4472鲫属 Carassius32.833.472412.05760.30000.5477聚球藻属 Synechococcus160.045.075225.75740.40000.6325
2.2.3 2种方法水质基准推导结果对比分析
本研究采用2种方法来推导我国淡水环境诺氟沙星水生生物水质基准,物种敏感度分布法推导出的诺氟沙星SWQC和LWQC值分别为7.28 μg·L-1和2.32 μg·L-1,毒性百分数排序法推导出的诺氟沙星CMC和CCC值分别为13.59 μg·L-1和3.85 μg·L-1,通过比较可以看出2种方法推导出的基准值存在一定差异。相对而言,毒性百分数排序法得出的水质基准值较高,同样的情况在推导六价铬的基准值时也有发现[32]。毒性百分数排序法在计算过程中求取了属平均急性值,考虑了物种之间的联系,但在计算FAV和FCV时,只考虑了最敏感的4个属,基准值不能从整体水平上反映污染物对生物的影响,其推导结果不能很好地适用于更多的水生生物。物种敏感度分布法能够充分利用所搜集到的毒性数据,因此基准值更加科学合理,能够全面地表征诺氟沙星对水生态系统的影响,此外,虽然物种敏感度分布法没有考虑污染物在生物体内的富集效应,但是相对毒性百分数排序法推导的基准值,物种敏感度分布法推导的基准值相对比较保守,对水生生物保护相对也更有利。因此以物种敏感度分布法的结果作为最终基准值。
2.3 我国典型水体中诺氟沙星的生态风险
2.3.1 基于商值法生态风险评估
搜集中国多个水域的诺氟沙星浓度,主要包括长江、黄河、珠江、海河、辽河和松花江等流域,这些水系几乎涵盖了我国七大流域。取其表层水中已监测到的最大环境暴露浓度作为MEC值,物种敏感度分布法推导得到的LWQC值(2.32 μg·L-1)作为PNEC值,进行RQ值计算。我国典型水体中诺氟沙星的生态风险见表7。由表7可知,诺氟沙星在我国长江、松花江哈尔滨段、太湖、阿什河等水域RQ值<0.01,基本无风险,在黄河、珠江、海河和鸭绿江等水域RQ值处于0.01与0.1之间,风险较低,在辽河等水域RQ值>0.1,风险中等。
表7 我国典型水体中诺氟沙星的生态风险
Table 7 Ecological risk of norfloxacin in typical waters of China
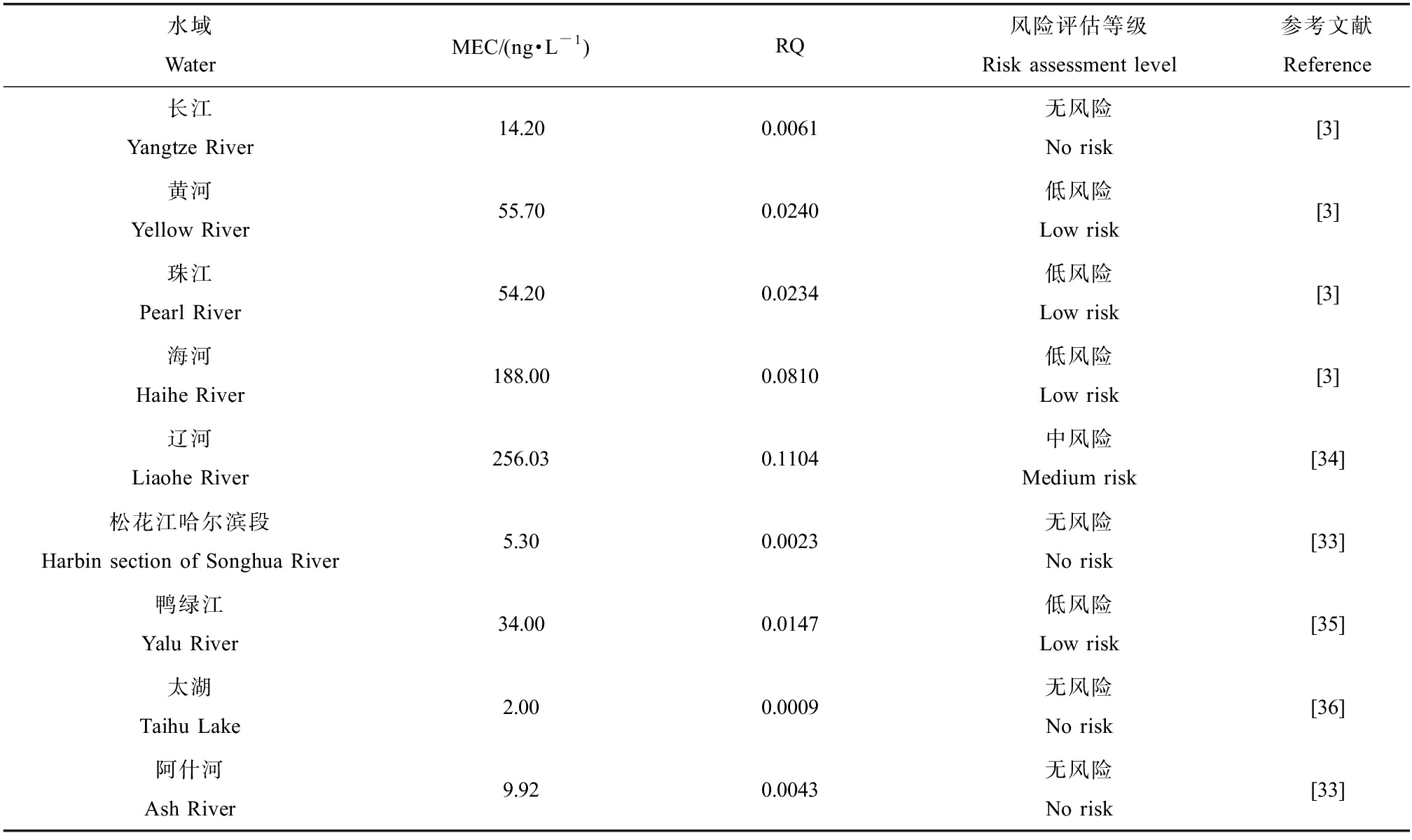
水域WaterMEC/(ng·L-1)RQ风险评估等级Risk assessment level参考文献Reference长江Yangtze River14.200.0061无风险No risk[3]黄河Yellow River55.700.0240低风险Low risk[3]珠江Pearl River54.200.0234低风险Low risk[3]海河Haihe River188.000.0810低风险Low risk[3]辽河Liaohe River256.030.1104中风险Medium risk[34]松花江哈尔滨段Harbin section of Songhua River5.300.0023无风险No risk[33]鸭绿江Yalu River34.000.0147低风险Low risk[35]太湖Taihu Lake2.000.0009无风险No risk[36]阿什河Ash River9.920.0043无风险No risk[33]
注:MEC表示环境暴露浓度,RQ表示风险商值。
Note: MEC is the environmental exposure concentration and RQ is the risk quotient.
在风险评估中,辽河和海河的RQ值较其他水域高,可能是因为辽河周边区域人口数量多,养殖业、畜牧业发达,有抗生素企业位于辽河流域内,导致其生态风险水平较高[33];海河是中国北方地区最大的水系,流域周边地区人口超过1.2亿[34],附近的畜牧业和水产养殖业比较集中,水产养殖和牲畜的排泄物排到海河,导致海河流域中抗生素污染较严重[35]。在生态风险评估中,松花江哈尔滨段和太湖的RQ较其他水域低,这可能与松花江哈尔滨段流域内部分企业进行转型和清洁生产有关[36];太湖流域位于长江三角洲的南缘,国家提出长三角生态绿色一体化发展,使其更加重视生态环境治理[37],可能与此有关。
2.3.2 基于安全阈值法的生态风险评估
以诺氟沙星的环境暴露浓度、急性毒性数据为横坐标,以其在我国典型水体中的FR为纵坐标,使用正态分布模型作为推导模型,使用我国生态环境基准专家委员会研发的EEC-SSD软件拟合曲线,评估我国典型水体中诺氟沙星的生态风险,评估结果见图3。暴露浓度累积分布曲线和物种敏感度分布曲线的P值均>0.05,RMSE值均为0.052,曲线拟合效果均较好。当FR为90%时,根据暴露浓度累积分布曲线计算得到ECD90为0.212 μg·L-1,当FR为10%时,根据物种敏感度分布曲线计算得到SSD10为54.497 μg·L-1,MOS10是SSD10与ECD90的比值,为257.06,远大于1,暴露浓度累积分布曲线和物种敏感度分布曲线的重叠程度极低,这说明诺氟沙星对水生生物无生态风险。
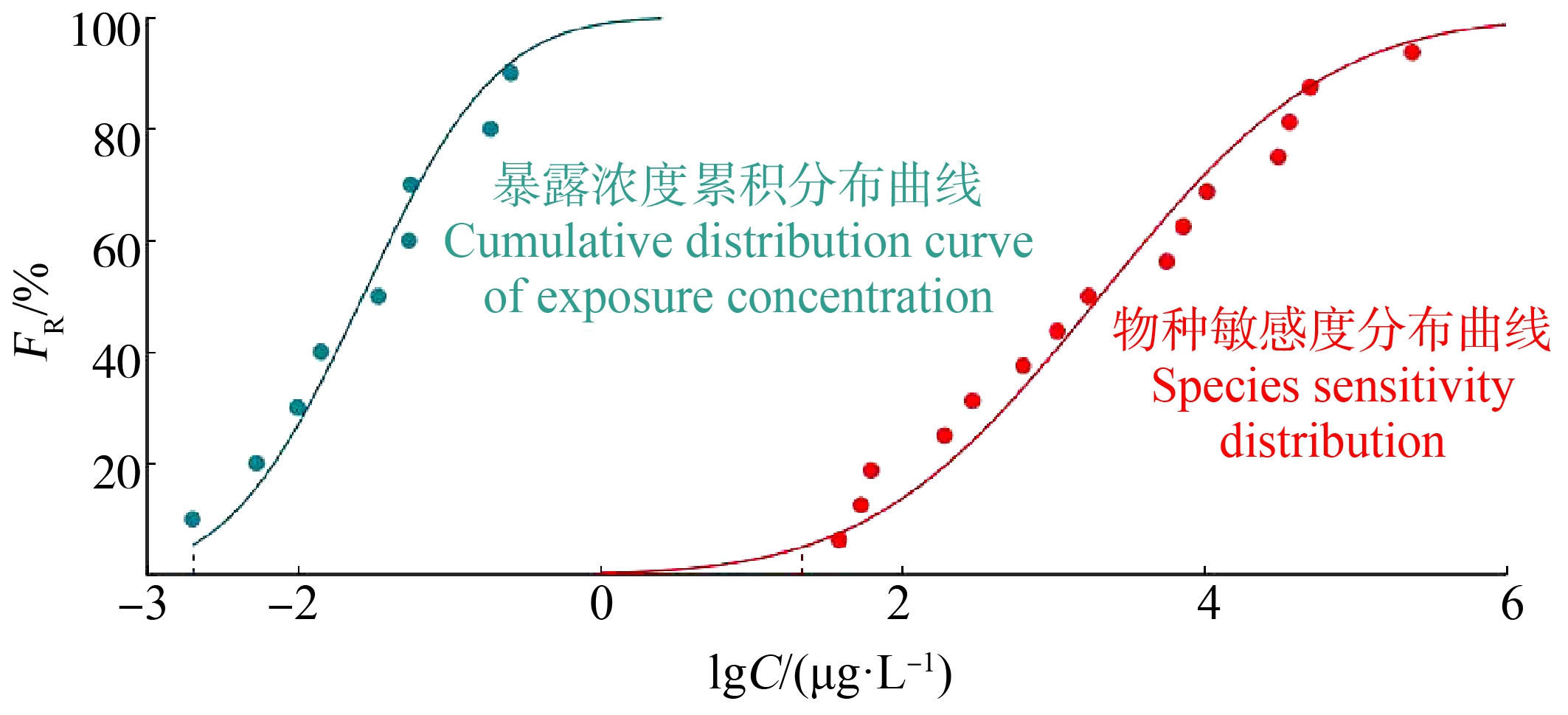
图3 我国水体诺氟沙星的暴露浓度和毒性数据的累积概率分布
Fig. 3 Cumulative probability distribution of norfloxacin exposure concentrations and toxicity data in China
2.3.3 2种方法生态风险评估结果总结
本研究采用2种方法进行我国典型水体中诺氟沙星的生态风险评估。基于商值法得到的生态风险结果显示,诺氟沙星在我国长江、松花江哈尔滨段、太湖和阿什河等水域基本无风险,在黄河、珠江、海河和鸭绿江等水域风险较低,在辽河等水域风险中等;基于安全阈值法得到的生态风险结果显示,在我国水体中诺氟沙星对水生生物无生态风险。2种结论存在一定差异,主要原因是商值法更注重于水体的受污染程度,污染物暴露浓度超过一定阈值就会造成生态风险,适用于初步评估,而且研究中使用最大污染浓度作为MEC值进行评估,可能导致基于商值法得到的生态风险水平偏高;相对而言,安全阈值法通过比较暴露浓度分布曲线和物种敏感度分布曲线的重合度得到生态风险水平,在统计学上更具有代表意义且评估结果很直观。因此以安全阈值法的生态风险评估结果作为最终结果。经生态风险评估发现,诺氟沙星对我国淡水水生生物没有生态风险,推测可能是因为诺氟沙星在水体中的浓度相对较低,在我国医院废水和制药废水中,诺氟沙星的含量可达到mg·L-1的级别,但是在河流、湖泊等水体中多在ng·L-1、μg·L-1的级别[38]。
综上所述,本研究结果表明:
(1) 基于物种敏感度分布法推导出的诺氟沙星SWQC和LWQC值分别为7.28 μg·L-1和2.32 μg·L-1,基于毒性百分数排序法推导出的诺氟沙星CMC和CCC值分别为13.59 μg·L-1和3.85 μg·L-1,推导出的基准值在同一数量级,以物种敏感度分布法的结果作为最终基准值。
(2) 基于商值法得到的生态风险结果显示,诺氟沙星在我国典型水体中风险水平整体较低,基于安全阈值法得到的生态风险结果显示,诺氟沙星在我国典型水体中无风险,以安全阈值法的生态风险评估结果作为最终结果。
[1] Wang B, Jiang Y S, Li F Y, et al. Preparation of biochar by simultaneous carbonization, magnetization and activation for norfloxacin removal in water [J]. Bioresource Technology, 2017, 233: 159-165
[2] Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science &Technology, 2015, 49(11): 6772-6782
[3] Hanna N D, Sun P, Sun Q, et al. Presence of antibiotic residues in various environmental compartments of Shandong Province in Eastern China: Its potential for resistance development and ecological and human risk [J]. Environment International, 2018, 114: 131-142
[4] Balakrishna K, Rath A, Praveenkumarreddy Y, et al. A review of the occurrence of pharmaceuticals and personal care products in Indian water bodies [J]. Ecotoxicology and Environmental Safety, 2017, 137: 113-120
[5] Chen M J, Chu W. H2O2 assisted degradation of antibiotic norfloxacin over simulated solar light mediated Bi2WO6: Kinetics and reaction pathway [J]. Chemical Engineering Journal, 2016, 296: 310-318
[6] Joakim Larsson D G, de Pedro C, Paxeus N. Effluent from drug manufactures contains extremely high levels of pharmaceuticals [J]. Journal of Hazardous Materials, 2007, 148(3): 751-755
[7] Chaiyasing K, Liawruangrath B, Natakankitkul S, et al. Sequential injection analysis for the determination of fluoroquinolone antibacterial drug residues by using eosin Y as complexing agent [J]. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy, 2018, 202: 107-114
[8] 张艳荣, 张卫珂, 杨凯, 等. BiOBr分子印迹材料的制备及其降解诺氟沙星性能[J]. 环境科学学报, 2020, 40(3): 940-949
Zhang Y R, Zhang W K, Yang K, et al. BiOBr molecularly imprinted material preparation and its degradation performance for norfloxacin [J]. Acta Scientiae Circumstantiae, 2020, 40(3): 940-949 (in Chinese)
[9] Lakshmi Prabavathi S, Muthuraj V. Superior visible light driven photocatalytic degradation of fluoroquinolone drug norfloxacin over novel NiWO4 nanorods anchored on g-C3N4 nanosheets [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 567: 43-54
[10] 付泊明, 陈立伟, 蔡天明, 等. 诺氟沙星降解菌NOR-36的分离筛选及降解特性研究[J]. 环境科学学报, 2017, 37(2): 576-584
Fu B M, Chen L W, Cai T M, et al. Isolation and characterization of norfloxacin-degrading bacterium strain NOR-36 [J]. Acta Scientiae Circumstantiae, 2017, 37(2): 576-584 (in Chinese)
[11] 沈洪艳, 王亚萌. 诺氟沙星对黑麦草的生物毒性效应研究[J]. 安全与环境学报, 2020, 20(3): 1169-1175
Shen H Y, Wang Y M. Effect of norfloxacin on biological toxicity of ryegrass [J]. Journal of Safety and Environment, 2020, 20(3): 1169-1175 (in Chinese)
[12] 施文杰, 王长友, 杨锐. 诺氟沙星对盐生杜氏藻、新月菱形藻和小球藻的生态毒性效应[J]. 海洋环境科学, 2019, 38(1): 1-6
Shi W J, Wang C Y, Yang R. Effects of norfloxacin on Dunaliella salina, Nitzschia closterium f. minutissima and Chlorella vulgaris [J]. Marine Environmental Science, 2019, 38(1): 1-6 (in Chinese)
[13] 生态环境部. 淡水生物水质基准推导技术指南: HJ 831—2022 [R/OL]. (2022-03-10) [2022-05-15] https://www.mee.gov.cn/ywgz/fgbz/bz/bzwb/shjbh/xgbzh/202203/W020220402565005165833.pdf
[14] 吴丰昌, 冯承莲, 张瑞卿, 等. 我国典型污染物水质基准研究[J]. 中国科学: 地球科学, 2012, 42(5): 665-672
Wu F C, Feng C L, Zhang R Q, et al. Derivation of water quality criteria for representative water-body pollutants in China [J]. Scientia Sinica (Terrae), 2012, 42(5): 665-672 (in Chinese)
[15] 闫振广, 刘征涛, 孟伟, 等. 水生生物水质基准理论与应用[M]. 北京: 化学工业出版社, 2014: 5-65
[16] 冯承莲, 吴丰昌, 赵晓丽, 等. 水质基准研究与进展[J]. 中国科学: 地球科学, 2012, 42(5): 646-656
Feng C L, Wu F C, Zhao X L, et al. Water quality criteria research and progress [J]. Scientia Sinica (Terrae), 2012, 42(5): 646-656 (in Chinese)
[17] 陈丽红, 张瑜, 丁婷婷, 等. 红霉素水生生物基准推导和对中国部分水体生态风险初步评估[J]. 生态环境学报, 2020, 29(8): 1610-1616
Chen L H, Zhang Y, Ding T T, et al. Development of aquatic life criteria for erythromycin and preliminary assessment for the ecological risk of some water bodies in China [J]. Ecology and Environmental Sciences, 2020, 29(8): 1610-1616 (in Chinese)
[18] Hernando M D, Mezcua M, Fernández-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments [J]. Talanta, 2006, 69(2): 334-342
[19] 丁婷婷. 沙颍河流域典型污染物的水生生物基准推导及生态风险评估[D]. 合肥: 安徽建筑大学, 2019: 76-77
[20] Brain R A, Johnson D J, Richards S M, et al. Effects of 25 pharmaceutical compounds to Lemna gibba using a seven-day static-renewal test [J]. Environmental Toxicology and Chemistry, 2004, 23(2): 371-382
[21] 鹿金雁. 叔丁基对羟基茴香醚和诺氟沙星对水生生物的毒性效应[D]. 广州: 暨南大学, 2007: 26-28
[22] Ando T, Nagase H, Eguchi K, et al. A novel method using cyanobacteria for ecotoxicity test of veterinary antimicrobial agents [J]. Environmental Toxicology and Chemistry, 2007, 26(4): 601-606
[23] González-Pleiter M, Gonzalo S, Rodea-Palomares I, et al. Toxicity of five antibiotics and their mixtures towards photosynthetic aquatic organisms: Implications for environmental risk assessment [J]. Water Research, 2013, 47(6): 2050-2064
[24] Eguchi K, Nagase H, Ozawa M, et al. Evaluation of antimicrobial agents for veterinary use in the ecotoxicity test using microalgae [J]. Chemosphere, 2004, 57(11): 1733-1738
[25] Yang L H, Ying G G, Su H C, et al. Growth-inhibiting effects of 12 antibacterial agents and their mixtures on the freshwater microalga Pseudokirchneriella subcapitata [J]. Environmental Toxicology and Chemistry, 2008, 27(5): 1201-1208
[26] 聂湘平, 鹿金雁, 李潇, 等. 诺氟沙星(Norfloxacin)对蛋白核小球藻(Chlorella pyrenoidosa)生长及抗氧化酶活性的影响[J]. 生态毒理学报, 2007, 2(3): 327-332
Nie X P, Lu J Y, Li X, et al. Toxic effects of norfloxacin on the growth and the activity of antioxidase ofChlorella pyrenoidosa [J]. Asian Journal of Ecotoxicology, 2007, 2(3): 327-332 (in Chinese)
[27] 严拾伟. 诺氟沙星对大型溞(Daphnia magna)行为及种群动态的影响研究[D]. 昆明: 云南大学, 2016: 25-43
[28] 房英春, 齐跃, 李莹, 等. 盐酸环丙沙星、恩诺沙星和诺氟沙星对孔雀鱼急性毒性试验研究[J]. 沈阳大学学报(自然科学版), 2012, 24(3): 15-17
Fang Y C, Qi Y, Li Y, et al. Acute toxicity experience to guppy with ciprofloxacin HCI, enrofloxacin and norfloxacin [J]. Journal of Shenyang University (Natural Science), 2012, 24(3): 15-17 (in Chinese)
[29] Liu J C, Lu G H, Wu D H, et al. A multi-biomarker assessment of single and combined effects of norfloxacin and sulfamethoxazole on male goldfish (Carassius auratus) [J]. Ecotoxicology and Environmental Safety, 2014, 102: 12-17
[30] Lu G, Li Z, Liu J. Effects of selected pharmaceuticals on growth, reproduction and feeding of Daphnia magna [J]. Fresenius Environmental Bulletin, 2013, 9(22): 2583-2594
[31] 范红照, 林茂, 鄢庆枇, 等. 诺氟沙星在日本鳗鲡体内的代谢动力学及残留消除规律[J]. 中国渔业质量与标准, 2016, 6(1): 22-28
Fan H Z, Lin M, Yan Q P, et al. Norfloxacin pharmacokinetics and the residue elimination in Anguilla japonica [J]. Chinese Fishery Quality and Standards, 2016, 6(1): 22-28 (in Chinese)
[32] 廖静, 梁峰, 杨绍贵, 等. 我国六价铬淡水水生生物安全基准推导研究[J]. 生态毒理学报, 2014, 9(2): 306-318
Liao J, Liang F, Yang S G, et al. Derivation of freshwater quality criteria for hexavalent chromium for protection of aquatic organisms in China [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 306-318 (in Chinese)
[33] 张晓娇, 柏杨巍, 张远, 等. 辽河流域地表水中典型抗生素污染特征及生态风险评估[J]. 环境科学, 2017, 38(11): 4553-4561
Zhang X J, Bai Y W, Zhang Y, et al. Occurrence, distribution, and ecological risk of antibiotics in surface water in the Liaohe River Basin, China [J]. Environmental Science, 2017, 38(11): 4553-4561 (in Chinese)
[34] Li S, Shi W Z, Liu W, et al. A duodecennial national synthesis of antibiotics in China’s major rivers and seas (2005-2016) [J]. The Science of the Total Environment, 2018, 615: 906-917
[35] 周志洪, 赵建亮, 魏晓东, 等. 珠江广州段水体抗生素的复合污染特征及其生态风险[J]. 生态环境学报, 2017, 26(6): 1034-1041
Zhou Z H, Zhao J L, Wei X D, et al. Co-occurrence and ecological risk of antibiotics in surface water of Guangzhou section of Pearl River [J]. Ecology and Environmental Sciences, 2017, 26(6): 1034-1041 (in Chinese)
[36] Meng F S, Wang Y Y, Zhang L S, et al. Organic pollutant types and concentration changes of the water from Songhua River, China, in 1975-2013 [J]. Water, Air, &Soil Pollution, 2016, 227(6): 214
[37] 房振南, 金科, 王雪姣, 等. 长三角一体化生态绿色发展示范区主要河湖水质变化趋势分析[J]. 水利水电快报, 2021, 42(4): 68-74
Fang Z N, Jin K, Wang X J, et al. Analysis on water quality variation trend of main rivers and lakes in integrated demonstration area on ecologically friendly development in Yangtze River Delta [J]. Express Water Resources &Hydropower, 2021, 42(4): 68-74 (in Chinese)
[38] 刘营. TiO2改性生物炭的制备及其去除诺氟沙星性能研究[D]. 徐州: 中国矿业大学, 2021: 1-3