砷是环境中最普遍的有毒物质,在美国有毒物质和疾病登记署和美国环境保护局公布的危险物质优先清单中排名第一。值得注意的是,砷的毒性和致癌性在很大程度上取决于砷的化学形态[1]。一般来说,无机砷(iAs)包括亚砷酸盐(As(Ⅲ))和砷酸盐(As(Ⅴ)),比起甲基化的五价砷如一甲基砷酸盐(MMA(Ⅴ))和二甲基砷酸盐(DMA(Ⅴ))的毒性更大,同时MMA(Ⅴ)和DMA(Ⅴ)比砷甜菜碱(AsB)的毒性更大。据报道,AsB和砷胆碱(AsC)被认为是毒性最小的砷形态[2-3]。
人类可通过空气、饮用水和食物接触到砷,导致生理功能障碍和各种疾病的发生,如心血管疾病、糖尿病和多器官癌症等[4]。由于iAs的高毒性和致癌性,其生物转化也受到了广泛关注[5]。摄入的iAs,包括As(Ⅴ)和As(Ⅲ),可以通过甲基化代谢,形成MMA(Ⅴ)和DMA(Ⅴ)作为最终代谢产物,然后通过哺乳动物的尿液排出。然而,在哺乳动物尿液中观察到这些甲基化代谢产物的反应中间体,即一甲基砷酸(MMA(Ⅲ))和二甲基砷酸(MMA(Ⅲ)),其毒性比iAs毒性更大[6-7]。此外,砷甲基化的机制包括随着甲基的参与,As(Ⅴ)被还原为As(Ⅲ),其中S-腺苷蛋氨酸是主要的甲基供体,谷胱甘肽等硫醇是还原剂。以往研究发现,As3MT和Cyt19在内的甲基转移酶可以参与砷甲基化的过程[7]。
一甲基化砷和二甲基化砷的生物转化也受到了相当多的关注。据报道,在小鼠盲肠匀浆存在时,MMA(Ⅲ)可以甲基化为DMA(Ⅴ),并去甲基化为As(Ⅴ) [8]。除此之外,还观察到摄入的MMA(Ⅲ)在小鼠中比MMA(Ⅴ)更广泛地代谢为二甲基化砷[9]。人们还提出了二甲基化砷生物转化的几种机制,一些研究表明,DMA(Ⅴ)没有去甲基化,并作为主要代谢物在人类和动物的尿液中排出,包括小鼠、大鼠、仓鼠和兔子[10-11]。相反,另一些研究表明,DMA(Ⅴ)可以被还原为二甲基砷酸(DMA(Ⅲ)),可被大鼠的红细胞有效吸收[12],或去甲基化为MMA(Ⅴ)和iAs,随后在DMA(Ⅴ)处理后的大鼠的尿液中排出[13]。此外,先前的一项研究表明,口服DMA(Ⅴ)后的小鼠,4%~15%会以三甲基砷氧化物(TMAO)的形式在其尿液中排出[11]。另一项研究显示,大鼠暴露于含有DMA(Ⅴ)的饮用水14 d后排出了含有TMAO的粪便[14]。此外,暴露于DMA(Ⅴ)或DMA(Ⅲ)的大鼠和小鼠的尿液、粪便或肝脏中检测到未知的砷代谢物[15-16]。
海产品,特别是海洋鱼类和贝类含有高浓度的AsB[17-18],使其成为人类摄入AsB的有效途径[17]。一项研究表明,在兔、大鼠和小鼠中注射AsB后,98.5%的AsB在2 d内被排泄,此后未检测到其他形态的砷[19],表明由于AsB具有高极性和亲水特性,因此,AsB在啮齿类动物中的排出速率远大于其转化效率[20]。然而,最近的证据表明,AsB可以在人类胃肠道(GI)中被微生物转化,DMA和TMAO是主要的降解产物[21]。同时,在喂食含AsB饲料的大鼠的尿液中检测到其他形式的砷,包括TMAO、MMA、DMA、四甲基砷和iAs[22]。目前,据估计,许多国家海产品中总砷(AsB>90%)的浓度可能比食品中iAs(50 ng·g-1)限值高出200倍[23]。此外,关于AsB向iAs降解的研究有助于增进对与AsB相关的潜在食品毒性和健康风险的了解。因此,有必要进一步研究AsB在哺乳动物体内的生物转化。
因此,本研究旨在以安全剂量(ADI)反复灌胃C57BL/6J小鼠14 d后,研究包括AsB、As(Ⅲ)和As(Ⅴ)在内的几种砷形态的生物转化。可以得到,与不同的iAs形态相比,AsB的吸收、生物转化和生物积累模式存在显著差异。此外,通过对不同形态砷的单次暴露实验,可以准确分析每种砷形态的生物转化;这对评价不同形态砷的健康危害具有重要意义。
1 材料与方法(Materials and methods)
1.1 化学药品和试剂(Chemicals and reagents)
标准品、萃取液和流动相溶液使用Milli-Q水(18.2 MΩ cm, IQ 7000, Millipore SAS,法国)制备。此外,总砷的标准溶液由10 mg·L-1原液(多元素校准标准2A,安捷伦,美国)连续稀释制备,AsB、As(Ⅲ)和As(Ⅴ)的溶液分别由砷甜菜碱(C5H11AsO2, Sigma-Aldrich, St Louis, MO, USA)、亚砷酸钠(NaAsO2,Sigma-Aldrich)和砷酸二氢七水钠(Na2HAsO4·7H2O,Sigma-Aldrich)制备。实验小鼠用戊巴比妥钠(生物试剂C11H17O3N2Na,中国上海源业生物科技有限公司)麻醉,实验动物采集的样品用65%硝酸消化(德国默克公司)。此外,用于高效液相色谱(HPLC)的流动相化学品(柠檬酸(C6H8O7,分析试剂(AR)级),1-己烷磺酸钠(C6H13O3SNa, 98%)和氢氧化钠((NaOH, (AR级))购自中国上海化学工业园区。不同砷溶液和提取物存放在高密度聚丙烯离心管中,4 ℃冷藏待用。
1.2 动物与砷暴露(Animals and arsenic exposures)
雄性C57BL/6J小鼠(23.2~27.6 g, 7周)购自中国医学科学院实验动物研究所(CAMS)和中国北京协和医学院(PUMC)。该研究的设计和报告遵循了ARRIVE指南(https://arriveguidelines.org)。所有动物实验均按照国家卫生研究院《实验动物护理与使用指南》(第8版)的指导原则进行,并经广州大学动物伦理委员会批准。小鼠最初被安置在标准聚丙烯笼中(每笼5只),以SPF级窝料为垫料,温度为(22±1) ℃,光照/黑暗周期为12 h/12 h,相对湿度为50%~60%,不断提供食物和水。在暴露实验开始之前,小鼠需用7 d适应这些测试条件。垫料和饲料购自广州赛博诺生物科技有限公司。
驯化7 d后,将40只小鼠随机分为对照、AsB、As(Ⅲ)和As(Ⅴ) 4个处理组,2个重复笼,每笼5只。配制AsB、As(Ⅲ)、As(Ⅴ) (Sigma-Aldrich)原液100 mg·L-1,研究砷在小鼠体内的生物转化。此外,AsB、As(Ⅲ)和As(Ⅴ)处理组小鼠在暴露期(14 d)内每天灌胃10 mL·kg-1相应的砷形态(计算剂量为1 000 μg·kg-1),对照组小鼠不进行任何砷形态的处理。在整个实验期间,提供SPF级维持小鼠的饲料和消毒纯净水(总砷浓度低于7×10-6 mg·L-1的检测限度)。为避免灌注过程中小鼠应激,暴露时间限制在14 d。小鼠饲料中总砷浓度为(0.29±0.02) μg·g-1,其中As(Ⅲ) (0.05±0.01) μg·g-1、As(Ⅴ) (0.18±0.02) μg·g-1、MMA (0.02±0.003) μg·g-1、DMA (0.02±0.01) μg·g-1和AsB (0.02±0.008) μg·g-1。每天测定小鼠体质量。每天灌胃给药前采集粪便样本,解剖前禁食24 h,确保胃空。但是,依然提供饮用水。在结束暴露后第2天,用0.5%戊巴比妥钠50 mg·kg-1麻醉小鼠,并进行全身灌注,以清除循环系统和小鼠器官的血液[24]。在灌注过程开始时采集血液样本(约1 mL)进行砷形态分析。分别采集膀胱和小肠的尿液和食糜样本进行砷形态分析(砷形态分析见1.4节),同时采集内脏器官/组织,包括心脏、肝脏、脾脏、肺、肾脏、肠(冲洗去除食物残渣)、胃(冲洗去除食物残渣)、肌肉和粪便样本,均质化进行总砷和砷形态分析。
1.3 总砷含量测定(Total arsenic content determination)
小鼠的总砷含量按以下程序测定[25]。简单地说,将组织、食糜和粪便粉末样品各取约0.1 g,用1 mL HNO3 (65%,AR级,默克公司)在室温(22 °C)下混合消化2 h,然后在80 °C下消化24 h,直到混合物变得清晰。然后,通过电感耦合等离子体质谱(ICP-MS,Agilent 7900,东京,日本)分析样品的总砷含量。通过分析金枪鱼标准参考物质(SRM) (BCR-627,比利时吉尔标准物质与测量研究所)来评估消解方法的准确性。SRM的总砷回收率为97.8% ((4.7±0.3) μg·g-1,参考值为(4.8±0.2) μg·g-1,n=6))。此外,组织、食糜和粪便样品中的砷浓度均以μg·g-1(干质量)表示。
1.4 砷形态分析(Arsenic speciation analysis)
砷的形态分析如前所述,仅略作修改[26]。简单地说,将大约0.2~0.3 g的组织、食糜和粪便粉末样品加入8 mL 1% HNO3的Xpress反应罐(55 mL)中,然后在微波炉(CEM Mars 6, USA)中100 °C消化1.5 h[26]。接下来,将混合物转移到15 mL离心管中,在90 °C下加热浓缩。随后加入15 mL MilliQ水2次,浓缩至4 mL。待冷却后,浓缩液通过0.22 μm酸化硝化纤维素过滤器(广州初林生物科技有限公司,中国)过滤至2 mL棕色样品瓶(安捷伦)。采用高效液相色谱法(Agilent 1260 Infinity Ⅱ, Böblingen,德国),结合Agilent Zobarx SB-Aq柱(含20 mmol·L-1柠檬酸(C6H8O7)和5 mmol·L-1 1-己磺酸钠(C6H13O3S·Na)的混合物为流动相(pH为4.3))和ICP-MS检测系统,测定提取溶液中砷形态的含量。
比较了2种从龙胆石斑鱼饲料中提取砷的方法(添加AsB)。第1种方法是用50%的甲醇溶液均质提取砷[25],第2种方法是上述提取方法。2种提取方法得到的结果均未显示AsB降解。此外,小鼠暴露于不同处理后,获得了心脏、肝脏、脾脏、肺、肾、肠、胃和肌肉组织中As(Ⅲ)、As(Ⅴ)、MMA、DMA和AsB的图谱。AsB暴露处理如图1所示。BCR-627检测AsB含量为(3.71±0.17) μg·g-1 (回收率为95.1%,参考值为(3.90±0.22) μg·g-1,n=6),DMA含量为(1.28±0.19) μg·g-1 (回收率为85.3%,参考值为(1.50±0.02) μg·g-1,n=6)。另外3种As(Ⅲ)、As(Ⅴ)和MMA(Ⅴ)的回收率分别为82%~90%、89%~94%和87%~93%。此外,柱回收率计算为不同砷形态的含量之和与使用提取溶液测定的总砷含量的比值[27]。回收率在67.7%~300.0%范围内变化。

图1 AsB暴露组小鼠心脏、肝脏、脾脏、肺、肾、肠、胃和肌肉中As(Ⅲ)、As(Ⅴ)、MMA、DMA和AsB对应的色谱图
注:AsB表示砷甜菜碱,MMA表示一甲基砷,DMA表示二甲基砷。
Fig. 1 Chromatograms corresponding to As(Ⅲ), As(Ⅴ), MMA, DMA, and AsB in the heart, liver, spleen, lungs, kidneys, intestine, stomach, and muscle of mice in the AsB treatment group
Note: AsB means arsenobetaine, MMA means monomethylarsonate, and DMA means dimethylarsinate.
1.5 统计分析(Statistical analysis)
GraphPad Prism version 5 (GraphPad Software, San Diego, CA, USA)用于图形展示。数值数据以平均值±标准差表示(n=10,除非另有说明)。所有实验至少重复2次,得到相似的结果。
2 结果与讨论(Results and discussion)
2.1 砷的吸收(Arsenic absorption)
通过测定粪便中排泄的砷含量来估计砷形态的口服吸收率,这主要是因为哺乳动物吸收的砷主要通过尿液排出[28]。一般而言,不同砷形态处理组的粪便中总砷含量在2 d后呈上升趋势,随后趋于平稳(图2(a))。在暴露14 d期间,As(Ⅲ)处理组小鼠粪便中砷含量最高(~11.5 μg·g-1),其次是As(Ⅴ)处理组(~7.8 μg·g-1)和AsB处理组(~2.2 μg·g-1)(图2(a))。AsB、As(Ⅴ)和As(Ⅲ)处理的小鼠通过粪便排出的砷含量分别为3.8%、14.2%和18.9%(图2(b)),表明AsB在小鼠体内的口服吸收效率最高,超过96.2%的总砷被胃肠道吸收。这与之前的研究结果一致,即口服73As标记的AsB几乎完全被小鼠的胃肠道吸收[19]。
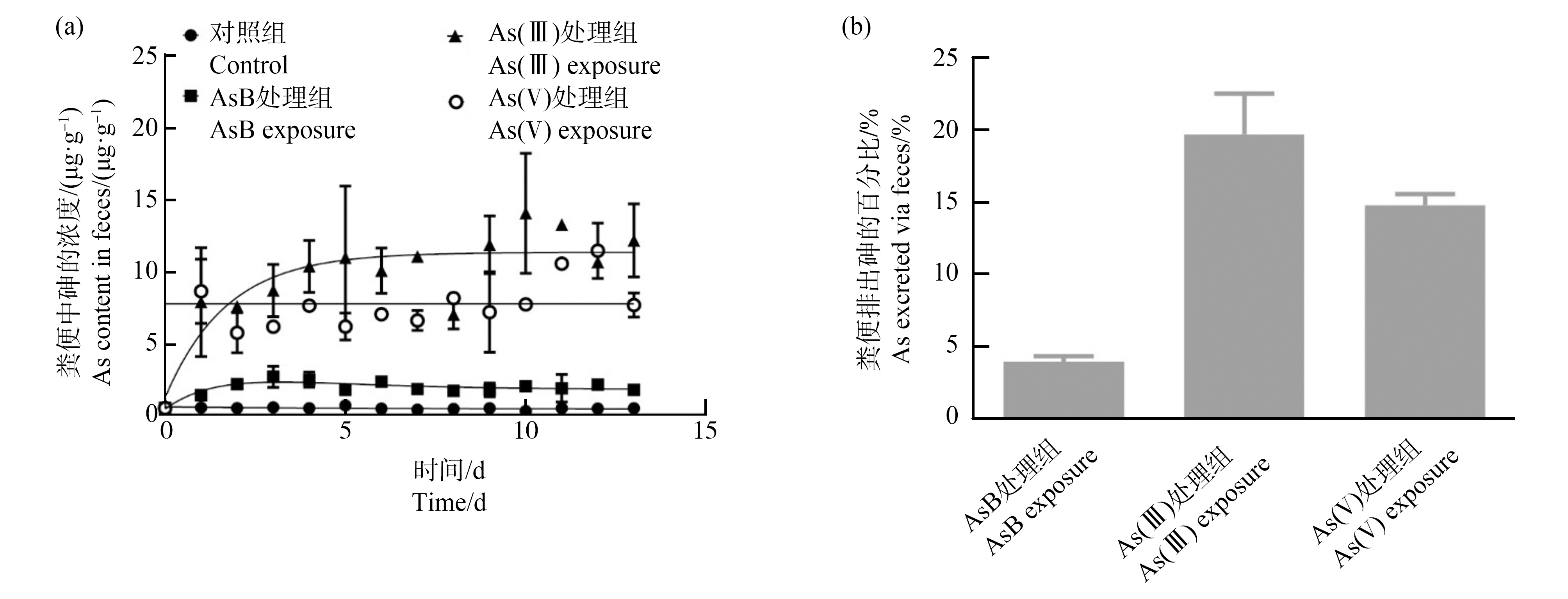
图2 各种砷形态在小鼠体内的粪便排泄
注:(a)暴露14 d期间小鼠粪便样品中砷含量变化情况,(b)通过粪便排出砷的百分比,按公式计算(粪便中砷总量/暴露总量(灌胃+饲料暴露))×100%;数据以平均值±标准差(SD)表示(n=10)。
Fig. 2 Fecal excretion of various As species in mice
Note: (a) Variation of the As contents of mice fecal samples during the 14 d exposure period, (b) Percentage of As excreted via feces as calculated according to the expression (total amount of As in feces/total As exposed (oral gavage+feed exposure))×100%; data are presented as the mean±standard deviation (SD) (n=10).
2.2 有机砷和iAs的生物转化(Biotransformation of organic and inorganic arsenic)
尽管iAs在哺乳动物中的生物分布、生物转化和毒性已经被广泛研究,但AsB在这方面的生物转化研究仍然少之又少[6,29]。因此,本研究对AsB和iAs暴露小鼠的血液、食糜、排泄物和内脏中砷的生物转化进行了探讨。汇总了不同砷形态的绝对含量、相对含量及百分比。此外,实验动物主要内脏器官中砷形态的净累积浓度和百分比(暴露处理水平减去对照处理水平)如图3所示。

图3 不同处理(暴露处理水平减去对照处理水平)后食糜、血液、主要脏器和粪便中砷形态的分布(%)
Fig. 3 Distribution of As species (%) in chyme, blood, major internal organs, and feces after the different treatments (exposure treatment level minus control treatment level)
经AsB暴露后,食糜中AsB的累积量相对较高(49.3%),其次是As(Ⅲ)(24.6%)、As(Ⅴ)(12.4%)、MMA(Ⅴ)(7.29%)和DMA(Ⅴ)(6.46%)。这些结果有力地证明,部分AsB在吸收前被降解为iAs和甲基砷,这与之前的研究一致,这表明小肠好氧微生物有助于AsB降解为DMA和iAs[21-22]。值得注意的是,AsB处理小鼠的器官、粪便和尿液中砷积累水平较高(70.8%~98.2%),而AsB处理后小鼠的脾脏、心脏、胃、肌肉、肺和肾脏中的As(Ⅴ)含量分别为14.9%、13.1%、12.9%、6.85%、4.38%和2.66%。此外,心脏、胃和肺组织的DMA(Ⅴ)含量分别为8.33%、7.56%和2.23%(图3(b))。这些结果进一步证实,AsB可能在肠内被降解为DMA(Ⅴ)和As(Ⅴ),随后在不同器官/组织中吸收和积累。同时,AsB在小鼠的尿液(96.2%)和粪便(78.4%)中积累水平较高,说明摄入的AsB有很大一部分通过尿液和粪便排出。
经灌胃和饲料饲喂的AsB总剂量为1 μg·g-1 (体质量、湿质量)×24.5 g(体质量)×14 d+24.5 g(体质量)×4.8 g(饲料)/30 g(体质量)×14 d×0.02 μg·g-1(饲料)=344.1 μg。因此,假设14 d暴露结束后的同化效率为100%,AsB累积浓度为344.1 μg。相反,在所有组织、粪便和食糜样品中检测到的AsB浓度(均以干质量表示)为4.5 μg·g-1×1.28 g+1.44 μg·g-1×6.63 g+0.35 μg·g-1×0.19 g=15.4 μg。AsB处理组小鼠所有干组织中DMA(Ⅴ)和As(Ⅴ)的净浓度分别为(0.091 μg·g-1×1.28 g)-(0.026 μg·g-1×1.26 g)=0.0837 μg和(0.242 μg·g-1×1.28 g)-(0.076 μg·g-1×1.26 g)=0.214 μg,而DMA(Ⅴ)和As(Ⅴ)的比例分别为0.0837 μg/344.1 μg×100%=0.024%和0.214 μg/344.1×100%=0.062%。这些结果表明,至少有0.086%的AsB在肠道中降解为DMA(Ⅴ)和As(Ⅴ),然后在小鼠组织中积累。此外,当AsB在肠内降解形成As(Ⅴ)和DMA时,小鼠组织中仅积累了约0.2%的As(Ⅴ)(图2(a),根据As(Ⅴ)处理组相应数据计算)和约0.05%的DMA (未发表数据),而超过85%的As(Ⅴ)(图2(b))和约70%的DMA (未发表数据)通过尿液排出。因此,AsB在小鼠体内的降解率>0.086%。
小鼠口服As(Ⅲ)和As(Ⅴ)在不同的内脏器官中表现出相似的形态分布,As(Ⅲ)是大多数样品中积累最多的砷形态,而DMA(Ⅴ)是大多数样品中器官中积累最多的形态(图3(c)和(d))。此外,As(Ⅲ)、MMA(Ⅴ)和DMA(Ⅴ)在As(Ⅲ)和As(Ⅴ)处理的小鼠食糜中表现出相对较高的积累水平,在As(Ⅴ)处理的小鼠食糜中仅观察到1.43%的AsB。这些结果表明,MMA(Ⅴ)和DMA(Ⅴ)的生物合成可能在胃肠道吸收之前就开始了。因此,其代谢途径为As(Ⅴ)还原为As(Ⅲ),As(Ⅲ)氧化为As(Ⅴ),然后加入甲基形成MMA(Ⅴ)和DMA(Ⅴ) [30]。据报道,砷在哺乳动物中的经典代谢途径是通过重复还原和氧化甲基化进行的[31]。不仅如此还观察到,肠道微生物组可能有助于小鼠iAs的生物转化[28,32]。因此,我们可以推测,在AsB和iAs联合暴露下,肠道微生物组可能有助于吸附前AsB降解和iAs甲基化。
在先前的研究中,通过检测AsB暴露个体尿液中砷形态的分布来评估AsB在人类和啮齿类动物中的生物转化。然而,在这些研究中,并没有研究砷在内脏器官中的形态形成[22,33]。目前,AsB在哺乳动物中的转化仍存在争议。例如,以往研究表明,AsB在含有微生物的有氧环境中培养7 d后降解为DMA、二甲基乙酸(DMAA)和TMAO[21],这表明在哺乳动物中,AsB可由四甲基胂或TMAO形成[22]。此外,口服AsB在小鼠、大鼠、兔子和仓鼠中几乎完全从胃肠道吸收,并通过尿液排出[20,34]。不仅如此,AsB或TMAO可能在微生物的参与下被降解为iAs。例如,在大鼠中观察到尿中消除了AsB、TMAO、DMA、MMA、四甲基砷(TeMA)、As(Ⅴ)和As(Ⅲ),而MMA、DMA和iAs在尿中消除较晚,且程度有限[22]。MMA、DMA和iAs消除的这种可变性可能归因于微生物在大鼠体内对氧化三甲胺的去甲基化[8]。本研究结果表明,As(Ⅴ)在小鼠体内积累的原因可能是AsB在吸附前倾向于被微生物降解为DMA和As(Ⅴ);但AsB代谢的机制尚不清楚。此外,小鼠胃肠道的微生物组成与人类胃肠道的微生物组成有很大差异,这可能对人体AsB的药代动力学有影响。因此,微生物在生物转化中的作用有待进一步研究。
2.3 不同内脏器官的差异生物积累(Differential bioaccumulation in various internal organs)
吸收砷主要通过生物转化途径在体内多个器官/组织内积累或代谢,并通过尿液和粪便排出体外。本研究的结果显示,摄入的砷在几个内脏器官中以特定形式存在(图4(a)~(h))。具体而言,iAs的服用,尤其是As(Ⅲ),导致几乎所有主要内脏器官,包括胃、肠、肾、肝、肺、脾、心脏和肌肉,都有较高的总砷积累水平(图4(a)~(h))。这可能是由于急性As(Ⅲ)中毒时,As(Ⅲ)与体内SH-基团之间的结合[35]。组织中iAs的积累增加表明无机形式不容易排泄[36]。有趣的是,暴露于AsB的小鼠比暴露于iAs的小鼠表现出更高的总砷积累水平。此外,AsB和iAs这2个处理组表现出不同的器官分布、积累(图4(f))和组织分布;因此,有必要进一步研究AsB在小鼠体内的特异靶器官。

图4 砷暴露后在主要内脏/组织中的差异生物积累((a)~(h))
注:胃(a)、肠(b)、肾(c)、肝(d)、肺(e)、脾(f)、心脏(g)和肌肉(h)的总砷含量;数据以平均值±SD表示(n=10)。
Fig. 4 Differential bioaccumulation of As in major internal organs/tissues after exposure
Note: Total As content of the stomach (a), intestine (b), kidneys (c), liver (d), lungs (e), spleen (f), heart (g), and muscles (h); data are presented as mean±SD (n=10).
2.4 不同形态砷的潜在毒理风险(Potential toxicological risks of different arsenic forms)
摄入砷的毒性很大程度上取决于不同器官中累积的砷量。因此,我们进一步分析了各种内部器官/组织的iAs含量(图5)。一般来说,As(Ⅲ)处理的小鼠在胃、肠、心、肝、脾和肺的iAs积累水平最高,其次是As(Ⅴ)处理的小鼠。值得注意的是,AsB处理小鼠的脾脏、肺和肌肉中的总砷水平比对照组小鼠高得多(图5)。然而,我们观察到,毒性最强的As(Ⅲ)在14 d暴露期间会导致小鼠的体质量变化(图6(a))。此外,不同处理后的小鼠主要内脏器官(包括肝、肾、肺、脾和心脏)的系数(用小鼠特定器官/体质量的质量百分比计算)之间没有显著差异(图6(b)~(f)),表明短期暴露砷对小鼠的药代动力学活性影响有限,这可以从整个暴露期间体质量的不显著变化中得到证明。

图5 不同处理后小鼠主要内脏/组织的砷含量
注:砷含量以单位质量冻干小鼠组织(g)中iAs的含量(μg)表示;数据以平均值±标准差表示(n=10)。
Fig. 5 iAs contents of major internal organs/tissues of mice following the different treatments
Note: The iAs contents are presented as μg of iAs per gram of freeze-dried mouse tissue; data are shown as means±SD (n=10).

图6 砷暴露在实验小鼠体内显示出有限的药代动力学活性
注:(a)不同砷形态暴露14 d后小鼠体质量变化;(b)~(f)小鼠经各种处理后的主要内脏器官肝(b)、肾(c)、肺(d)、脾(e)、心脏(f)的系数,计算公式为(器官质量/体质量)×100%;数据以平均值±标准差表示(n=10)。
Fig. 6 Arsenic exposure showing limited pharmacokinetic activity in the experimental mice
Note: (a) Body mass changes of mice during the 14 d administration of different As species; (b)~(f) Coefficient of major internal organs, including the liver (b), kidneys (c), lungs (d), spleen (e), and heart (f), of mice after various treatments calculated as (organ mass/body mass)×100%; data are presented as means±SD (n=10).
国际癌症研究机构(IARC)根据几种砷对人类的毒性和致癌性将其分为不同的类别。特别是,iAs包括As(Ⅲ)和As(Ⅴ),被归类为对人类有剧毒和致癌性(组1),而AsB被归类为低毒性(组3),不考虑其对人类的致癌性[1]。根据砷形态的急性毒性也可以得出类似的毒性分类。例如,无机As(Ⅲ)的LD50约为AsB的200倍[37];此外,急性口服暴露时,AsB的LD50值高于iAs。在本研究中,AsB在吸附前主要被生物降解为iAs,推测可能是通过肠道微生物。此外,摄入砷的急性毒性并不是其潜在健康风险的适当指标,因为在现实世界中,个人更有可能以很低的水平接触砷,但持续时间相对较长。AsB是海产品中最常见的砷形式,长期以来一直被认为是低毒性,其在哺乳动物中的排出速率远大于转化速率,其慢性毒性很少被评估[38]。然而,本研究的结果表明,AsB(以1 000 μg·kg-1口服14 d)在被某些组织吸收之前,很容易被降解为其他形式的砷,特别是As(Ⅴ)。此外,我们观察到AsB处理的小鼠与iAs处理的小鼠相比,其肝脏、肺和脾脏中累积的总砷水平更高。不仅如此,与短期接触AsB的对照组小鼠相比,AsB处理小鼠的内脏/组织中iAs水平更高,这表明长期从海鲜中摄入AsB对健康有一定的风险。
综上所述:砷的潜在健康风险不仅取决于砷的形态,还取决于其在体内的生物转化。除了职业性接触或通过受污染的饮用水接触外,食用海产品是摄入砷,特别是AsB的另一个主要来源。对摄入AsB的生物转化的研究可以大大提高对砷潜在健康风险的认识。因此,本研究比较了AsB和iAs在小鼠体内的吸收、生物转化和生物积累,发现AsB在小鼠体内吸收前就容易降解为毒性强的As(Ⅴ),为AsB在哺乳动物体内的生物降解提供了证据。值得注意的是,AsB处理的小鼠在短期暴露后比对照组小鼠表现出更高的组织/器官iAs积累水平。这一研究结果引出了长期接触AsB是否有相关的潜在健康风险。鉴于此,我们呼吁未来更多关注AsB的长期风险评估。
通信作者简介:张伟(1982—),女,博士,副教授,主要研究方向为环境污染物的生态毒理学、环境过程-暴露机制-生态健康、去除技术原理与应用。
[1] International Agency for Research on Cancer (IARC). List of Classifications-Agents classified by the IARC Monographs [M]. Lyon: IARC, 2020: 1-127
[2] Moe B, Peng H Y, Lu X F, et al. Comparative cytotoxicity of fourteen trivalent and pentavalent arsenic species determined using real-time cell sensing [J]. Journal of Environmental Sciences, 2016, 49: 113-124
[3] Donahue J M, Abernathy C O. Exposure to inorganic arsenic from fish and shellfish [C]//Chappell W R, Abemathy C O, Calderon R L (Eds.). Arsenic exposure and health effects Ⅲ. Proceedings of the third International Conference on Arsenic Exposure and Health Effects. Elsevier Science Ltd, 1999: 89-98
[4] Zhang L, Gao Y, Wu S, et al. Global impact of atmospheric arsenic on health risk: 2005 to 2015 [J]. Proceedings of the National Academy of Science, 2020, 117(25): 13975-13982
[5] Li C J, Wang J H, Yan B, et al. Progresses and emerging trends of arsenic research in the past 120 years [J]. Critical Reviews in Environmental Science and Technology, 2020, 51: 1306-1353
[6] Kenyon E M, Hughes M F, Adair B M, et al. Tissue distribution and urinary excretion of inorganic arsenic and its methylated metabolites in C57BL6 mice following subchronic exposure to arsenate in drinking water [J]. Toxicology and Applied Pharmacology, 2008, 232(3): 448-455
[7] Vahter M. Mechanisms of arsenic biotransformation [J]. Toxicology, 2002, 181-182: 211-217
[8] Cullen W, McBride B, Manji H, et al. The metabolism of methylarsine oxide and sulfide [J]. Applied Organometallic Chemistry, 1989, 3: 71-78
[9] Hughes M F, Devesa V, Adair B M, et al. Tissue dosimetry, metabolism and excretion of pentavalent and trivalent monomethylated arsenic in mice after oral administration [J]. Toxicology and Applied Pharmacology, 2005, 208(2): 186-197
[10] Marafante E, Vahter M. The effect of methyltransferase inhibition on the metabolism of [74As]arsenite in mice and rabbits [J]. Chemico-Biological Interactions, 1984, 50(1): 49-57
[11] Marafante E, Vahter M, Norin H, et al. Biotransformation of dimethylarsinic acid in mouse, hamster and man [J]. Journal of Applied Toxicology, 1987, 7(2): 111-117
[12] Shiobara Y, Ogra Y, Suzuki K T. Animal species difference in the uptake of dimethylarsinous acid (DMA(Ⅲ)) by red blood cells [J]. Chemical Research in Toxicology, 2001, 14(10): 1446-1452
[13] Chen H, Yoshida K, Wanibuchi H, et al. Methylation and demethylation of dimethylarsinic acid in rats following chronic oral exposure [J]. Applied Organometallic Chemistry, 1996, 10: 741-745
[14] Adair B M, Moore T, Conklin S D, et al. Tissue distribution and urinary excretion of dimethylated arsenic and its metabolites in dimethylarsinic acid- or arsenate-treated rats [J]. Toxicology and Applied Pharmacology, 2007, 222(2): 235-242
[15] Suzuki K T, Katagiri A, Sakuma Y, et al. Distributions and chemical forms of arsenic after intravenous administration of dimethylarsinic and monomethylarsonic acids to rats [J]. Toxicology and Applied Pharmacology, 2004, 198(3): 336-344
[16] Suzuki K T, Mandal B K, Katagiri A, et al. Dimethylthioarsenicals as arsenic metabolites and their chemical preparations [J]. Chemical Research in Toxicology, 2004, 17(7): 914-921
[17] Molin M, Ulven S M, Meltzer H M, et al. Arsenic in the human food chain, biotransformation and toxicology—Review focusing on seafood arsenic [J]. Journal of Trace Elements in Medicine and Biology: Organ of the Society for Minerals and Trace Elements (GMS), 2015, 31: 249-259
[18] Zhang W, Guo Z Q, Song D D, et al. Arsenic speciation in wild marine organisms and a health risk assessment in a subtropical bay of China [J]. The Science of the Total Environment, 2018, 626: 621-629
[19] Vahter M, Marafante E, Dencker L. Metabolism of arsenobetaine in mice, rats and rabbits [J]. The Science of the Total Environment, 1983, 30: 197-211
[20] Yamauchi H, Kaise T, Yamamura Y. Metabolism and excretion of orally administered arsenobetaine in the hamster [J]. Bulletin of Environmental Contamination and Toxicology, 1986, 36(3): 350-355
[21] Harrington C F, Brima E I, Jenkins R O. Biotransformation of arsenobetaine by microorganisms from the human gastrointestinal tract [J]. Chemical Speciation &Bioavailability, 2008, 20(3): 173-180
[22] Yoshida K, Kuroda K, Inoue Y, et al. Metabolites of arsenobetaine in rats: Does decomposition of arsenobetaine occur in mammals? [J]. Applied Organometallic Chemistry, 2001, 15(4): 271-276
[23] Sakurai T, Kojima C, Ochiai M, et al. Evaluation of in vivo acute immunotoxicity of a major organic arsenic compound arsenobetaine in seafood [J]. International Immunopharmacology, 2004, 4(2): 179-184
[24] Wiklander O P, Nordin J Z, O’Loughlin A, et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting [J]. Journal of Extracellular Vesicles, 2015, 4: 26316
[25] Zhang W, Guo Z Q, Zhou Y Y, et al. Biotransformation and detoxification of inorganic arsenic in Bombay oyster Saccostrea cucullata [J]. Aquatic Toxicology, 2015, 158: 33-40
[26] Jia Y Y, Wang L, Ma L, et al. Speciation analysis of six arsenic species in marketed shellfish: Extraction optimization and health risk assessment [J]. Food Chemistry, 2018, 244: 311-316
[27] Brockman John D, Brown Ⅳ John W N. Measurement of arsenic species in infant rice cereals by liquid chromatography inductively coupled plasma mass spectrometry [J]. American Journal of Analytical Chemistry, 2012, 3(10): 693-697
[28] Chi L, Xue J C, Tu P C, et al. Gut microbiome disruption altered the biotransformation and liver toxicity of arsenic in mice [J]. Archives of Toxicology, 2019, 93(1): 25-35
[29] Xi S H, Jin Y P, Lv X Q, et al. Distribution and speciation of arsenic by transplacental and early life exposure to inorganic arsenic in offspring rats [J]. Biological Trace Element Research, 2010, 134(1): 84-97
[30] García-Montalvo E A, Valenzuela O L, Sánchez-Pe a L C, et al. Dose-dependent urinary phenotype of inorganic arsenic methylation in mice with a focus on trivalent methylated metabolites [J]. Toxicology Mechanisms and Methods, 2011, 21(9): 649-655
a L C, et al. Dose-dependent urinary phenotype of inorganic arsenic methylation in mice with a focus on trivalent methylated metabolites [J]. Toxicology Mechanisms and Methods, 2011, 21(9): 649-655
[31] Kobayashi Y, Agusa T. Arsenic Metabolism and Toxicity in Humans and Animals: Racial and Species Differences [M]// Yamauchi H, Sun G. (Eds.). Arsenic Contamination in Asia: Biological Effects and Preventive Measures. Singapore: Springer, 2019: 13-28
[32] Coryell M, McAlpine M, Pinkham N V, et al. The gut microbiome is required for full protection against acute arsenic toxicity in mouse models [J]. Nature Communications, 2018, 9(1): 5424
[33] Newcombe C, Raab A, Williams P N, et al. Accumulation or production of arsenobetaine in humans? [J]. Journal of Environmental Monitoring, 2010, 12(4): 832-837
[34] Kaise T, Watanabe S, Itoh K. The acute toxicity of arsenobetaine [J]. Chemosphere, 1985, 14(9): 1327-1332
[35] Nurchi V M, Djordjevic A B, Crisponi G, et al. Arsenic toxicity: Molecular targets and therapeutic agents [J]. Biomolecules, 2020, 10(2): 235
[36] Vahter M, Concha G. Role of metabolism in arsenic toxicity [J]. Pharmacology &Toxicology, 2001, 89(1): 1-5
[37] Kaise T, Yamauchi H, Horiguchi Y, et al. A comparative study on acute toxicity of methylarsonic acid, dimethylarsinic acid and trimethylarsine oxide in mice [J]. Applied Organometallic Chemistry, 1989, 3(3): 273-277
[38] Popowich A, Zhang Q, Le X C. Arsenobetaine: The ongoing mystery [J]. National Science Review, 2016, 3(4): 451-458