2007美国国家研究委员会(National Research Council, NRC)《21世纪的毒性测试:愿景和策略》报告确定21世纪毒理学力推高通量、高灵敏度、低成本、预测能力强且准确的毒性测试策略主基调后,在欧美引领下迎来转化毒理学与体外替代技术十数年的迅猛发展。技术发展促进化学品管理法规与动物福利“3R原则”进一步融合,国际化学品风险评估标准技术体系中体外替代测试方法的数量直线上升,标准化体外替代技术的关注对象亦从高等脊椎动物(如哺乳动物)逐渐扩展至所有脊椎动物,推动了生态毒理学领域的标准体外替代技术方法的研发。
OECD于2013年颁布了鱼类胚胎急性毒性的标准技术方法[1],并在欧盟化学品登记申报中成功替代部分鱼类急性毒性体内测试[2]。2021年,进一步推出虹鳟鱼鳃上皮细胞系RTgill-W1急性毒性标准试验方法(OECD 249,2021)[3]作为鱼类急性毒性试验或其预试验的体外替代标准方法,该方法为ISO标准(ISO 21115,2019)[4]的转化,相较胚胎急性毒性测试,体外细胞毒性试验方法进一步缩短试验周期、缩小试验体系、节约试验成本,提升测试通量,有利于应对不断涌现的新化学物质、新型污染物等给管理、测试及研究机构带来的巨大挑战。
然而,OECD 249标准方法在化学品登记注册、风险评估与管理领域的应用与推广仍存在以下问题或局限:(1)方法相对较新,尚无采用该标准方法的实际应用报道,已有数据多源自方法开发机构的前期研究,接种细胞数及操作过程均与标准方法存在一定差异,故标准方法在实际应用中的适用性有待评估;(2)方法开发[5]时缺少金属化合物的毒性测试数据,可能局限其在该类物质毒性评估中的应用;(3)方法验证报告[5]中大量引用非标准测试的文献结果,并通过个别化学品的细胞毒性结果与鱼体内急性毒性结果的偏离,得出方法对通过特定作用方式(如离子通道或脑组织受体)产生神经毒性作用的化学品不敏感[3]的结论,而验证报告中诸如乙醇[6]、六氯酚[7]、鱼藤酮[8]等通过特定离子通道及受体产生神经毒性物质的细胞毒性试验结果并不支撑上述结论;(4)验证报告[5]中使用文献中的细胞急性毒性数据(即非标准方法获取的数据)与来自不同研究机构单一鱼种的一个或多个鱼类急性毒性试验数据进行线性拟合,拟合数据选取具较大不确定性,通过其拟合回归方程亦难于判断细胞急性毒性试验结果与鱼急性毒性数据的相关程度,局限了细胞急性毒性试验对鱼类急性毒性试验结果直接转化及准确预测。
针对上述问题,采用OECD 249标准方法基础上,使用方法推荐参比物质3,4-二氯苯胺验证标准方法体系的稳定性及重现性,进一步研究3,4-二氯苯胺、五水硫酸铜、重铬酸钾、2,3,6-三甲基苯酚、二苯甲酮、多菌灵、重铬酸钾、1,2-苯并异噻唑啉-3-酮、三氯生、三唑酮和三氯卡班等涵盖重金属、工业化学品、农药在内的化学品对RTgill-W1细胞的多终点急性毒性效应,其中,二苯甲酮[9]、多菌灵[10]、1,2-苯并异噻唑啉-3-酮[11]、三氯生[12-13]、三氯卡班[14]等为通过特殊作用方式致神经毒性化学品。关注上述10种化学品体外细胞测试结果与鱼体内急性毒性数据的相关性,初步建立细胞急性毒性数据与标准鱼种急性毒性数据的转换关系,评价方法的适用性并探讨可能应用方向,以期为基于鱼细胞体外替代方法在化学品毒性评估中的应用提供参考。
1 材料与方法(Materials and methods)
1.1 细胞系
虹鳟鱼鳃上皮细胞系RTgill-W1(ATCC® CRL-2523TM)购自吉泰生物科技有限公司。
1.2 受试化学品和主要试剂
受试化学品3,4-二氯苯胺(98%)、重铬酸钾(99.5%)购自西格玛奥德里奇(上海)贸易有限公司,五水硫酸铜(99%)、多菌灵(98%)购自国药集团化学试剂有限公司,2,3,6-三硝基苯酚(98%)、二苯甲酮(99.5%)、1,2-苯并异噻唑啉-3-酮(98%)、三氯生(97%)、三唑酮(98%)和三氯卡班(98%)购自上海麦克林生化科技有限公司,以上化学品均为分析纯。受试化学品详细信息见表1。
表1 受试化学品信息
Table 1 Information for test chemicals

化学品名称Chemical nameCAS号CAS No.分子式Molecular formula水溶解度Water solubility辛醇水分配系数(lgKow)3,4-二氯苯胺(3,4-DCA)3,4-dichloroaniline (3,4-DCA)95-76-1C6H5Cl2N580 mg·L-1(20 ℃)2.7五水硫酸铜(CSP)Copper sulfate pentahydrate (CSP)7758-99-8CuSO4∙5H2O220 g·L-1(25 ℃)—2,3,6-三甲基苯酚(2,3,6-TMP)2,3,6-trimethylphenol (2,3,6-TMP)2416-94-6C9H12O1.42 g·L-1(25 ℃)2.72(25 ℃)二苯甲酮(BP)Benzophenone (BP)119-61-9C13H10O23.9 mg·L-1(20 ℃)3.18(25 ℃)多菌灵(CBD)Carbendazim (CBD)10605-21-7C9H9N3O28 mg·L-1(pH=7, 24 ℃)1.51(pH=7, 25 ℃)重铬酸钾(PD)Potassium dichromate (PD)7778-50-9K2Cr2O729.4 g·L-1(20 ℃)—1,2-苯并异噻唑啉-3-酮(BIT)1,2-benzothiazol-3-one (BIT)2634-33-5C7H5NOS1.695 g·L-1(pH=7, 20.1 ℃)0.7(pH=7, 20 ℃)三氯生(TCS)Triclosan (TCS)3380-34-5C12H7Cl3O26.5 mg·L-1(pH=5, 20 ℃)4.9(pH=5, 20 ℃)三唑酮(TAM)Triadimefon (TAM)43121-43-3C14H16ClN3O271.7 mg·L-1*2.77*三氯卡班(TCC)Triclocarban (TCC)101-20-2C13H9Cl3N2O0.624 mg·L-1(25 ℃)3.63(25 ℃)
注:除“*”标注数据源自美国环境保护局CompTox Chemical Dashboard数据库,其余信息均源自欧洲化学品管理局登记注册卷宗;“—”表示无数据。
Note: All the information were collected from register dossier of European Chemicals Agency (ECHA), except data marked with “*” were collected from CompTox Chemical Dashboard of U.S. Environmental Protection Agency (US EPA); no date available marked with “—”.
主要化学试剂二甲基亚砜(dimethyl sulfoxide, DMSO;HPLC级)及生化试剂阿尔玛蓝细胞活性试剂(alamarBlueTM)、5-羧基荧光素二乙酸酯乙酰氧基甲酯(5-carboxyfluorescein diacetate, acetoxymethyl ester, 5-CFDA, AM)和中性红(Neutral Red)均购自赛默飞世尔科技(中国)有限公司。
1.3 主要仪器
恒温培养箱(美墨尔特IPPplus 260,德国),全功能酶标仪(美谷分子Spectra Max M5,美国)。
1.4 细胞毒性试验
试验依照OECD 249[3]及ISO 21115[4]方法进行,同时测定比较alamarBlue、5-CFDA,AM及Neutral Red等3种分别指示线粒体代谢活性、细胞质膜完整性及溶酶体活性的荧光染料荧光信号在不同受试化学品暴露组与无受试化学品的对照组荧光差异,确定受试化学品暴露对RTgill W1细胞活性的影响,从而判断受试化学品的细胞急性毒性效应。
受试化学品的母液浓度为最高受试浓度的200倍,其中3,4-二氯苯胺及五水硫酸铜的母液以灭菌去离子水配制,其余受试化学品的母液以DMSO作为溶剂。根据前期试验结果设置不同受试化学品的细胞毒性试验浓度组(表2),每个浓度组设置3个生物学重复。以受试化学品3,4-二氯苯胺作为阳性参比物,分别对3年内5个不同批次培养的细胞进行毒性试验,其余受试化学品仅用单一批次细胞进行毒性试验。
表2 受试化学品试验浓度组设置
Table 2 Test concentrations for test chemicals

受试化学品Test chemicals配制浓度/(mg·L-1)Nominal concentration/(mg·L-1)实测浓度/(mg·L-1)Measured concentration/(mg·L-1)3,4-DCA10,3.13,6.25,12.5,25.0,50.0,100—CSP0,0.781,1.56,3.13,6.25,12.5,25.0—2,3,6-TMP20,1.56,3.13,6.25,12.5,25.0,50.0—BP20,1.56,3.13,6.25,12.5,25.0,50.00,1.20,2.38,4.90,9.90,19.6,35.0CBD30,0.205,0.410,0.820,1.64,3.28,6.55—PD10,50.0,128,205,328,525,840—BIT20,1.53,2.44,3.91,6.25,10.0,16.00,1.53,2.56,3.93,6.32,10.0,16.0TCS20,0.150,0.243,0.394,0.638,1.03,1.680,0.180,0.246,0.345,0.564,0.800,1.72TAM10,2.37,3.55,5.33,8.00,12.0,18.0—TCC20,0.0338,0.0507,0.0760,0.114,0.171,0.2560,0.0261,0.0420,0.0588,0.0893,0.138,0.212
注:1表示前期试验或已有文献证实化学品试验期间浓度可稳定维持可用配制浓度表述试验结果,“—”表示不进行浓度实测;2表示受试化学品不稳定,试验结果以试验0 h及24 h实测浓度的几何平均值表示;3表示受试化学品24 h内稳定但溶解度有限,最高浓度溶液经0.22 μm滤膜过滤后稀释成各试验浓度,以最高浓度组的初始实测浓度外推稀释试验系列浓度。
Note: 1 represents the test concentrations can be maintained and the nominal concentrations can be used to express the test results based on preliminary tests or existed studies, “—” means measured concentrations are not necessary; 2 represents test chemicals are unstable, and test results were expressed as the geometric mean values of the measured concentrations at 0 h and 24 h; 3 represents test chemical is stable within 24 h but its solubility is limited, the highest test solution was filtered by 0.22 μm filter membrane and then diluted to each test concentration, and the initial measured concentration of the highest test group was used to extrapolate the concentrations of the dilution test series.
1.5 统计分析
依照OECD 249[3]方法进行数据计算,并采用ToxRat Professional(Version 3.3)软件各终点半数效应浓度(median effect concentration, EC50)。采用Origin 2018软件进行剂量-效应曲线绘制、鱼类急性毒性LC50及RTgill-W1细胞EC50值的线性拟合。
2 结果(Results)
2.1 试验体系的稳定性及结果可重复性研究
开展参比样品3,4-二氯苯胺对3年内5个不同批次培养的RTgill-W1细胞急性毒性试验,alamarBlue、5-CFDA,AM及Neutral Red等3个终点的平均EC50值分别为(35.4±2.7)、(36.9±5.3)及(41.9±3.7) mg·L-1(表3),与OECD 249(3个终点平均EC50值分别为(43.6±6.1)、(62.5±18.9)及(58.6±18.6) mg·L-1)及ISO 21115(3个终点平均EC50值分别为(42.9±5.7)、(62.6±24.9)及(48.8±10.0) mg·L-1)结果具可比性,平均值在水生急性毒性危害分级[15]层面无差异。然而,RTgill-W1急性毒性方法验证报告[5]中6家比对机构对于3,4-二氯苯胺暴露下alamarBlue、5-CFDA,AM及Neutral Red等3个终点毒性进行了3次测试,剔除异常EC50值后上述3个终点的实验室内变异范围分别为4.3%~29%、3.7%~25%及1.2%~41.5%、实验室间变异分别为22.4%、44.0%及25.8%,表明RTgill-W1细胞急性毒性试验在不同实验室间的结果存在较大变异性,因此方法[3-4]规定的可接受质控范围在3个终点平均EC50值2.5倍SD范围内,绝对值可跨1个数量级,可能导致危害分级上的差异。本研究中5个不同批次培养细胞3个终点的变异在较小范围内,分别为7.6%、14.4%及8.8%(表3),表明同一实验室在标准方法及规范操作下长期开展RTgill-W1急性毒性试验,有利于保证试验的可重复性及结果再现性。
表3 3,4-二氯苯胺对RTgill-W1细胞的急性毒性
Table 3 Acute toxicity of 3,4-dichloroaniline to RTgill-W1 cell
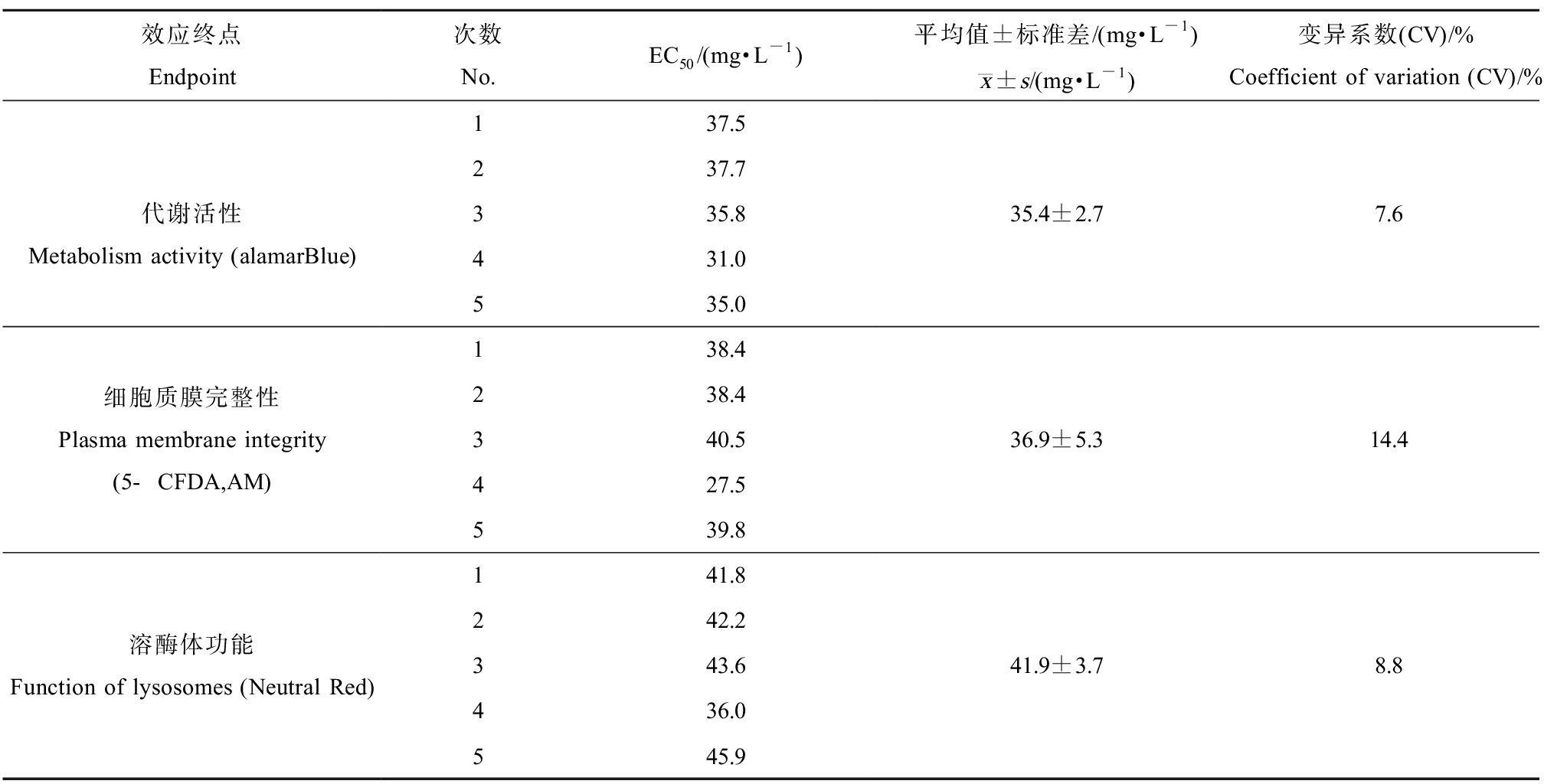
效应终点Endpoint次数No.EC50/(mg·L-1)平均值±标准差/(mg·L-1)x—±s/(mg·L-1)变异系数(CV)/%Coefficient of variation (CV)/%代谢活性Metabolism activity (alamarBlue)137.5237.7335.8431.0535.035.4±2.77.6细胞质膜完整性Plasma membrane integrity(5-CFDA,AM)138.4238.4340.5427.5539.836.9±5.314.4溶酶体功能Function of lysosomes (Neutral Red)141.8242.2343.6436.0545.941.9±3.78.8
2.2 10种化学品对RTgill-W1细胞3个终点急性毒性效应研究
OECD 249[3]方法综合考虑成本、操作便利度等因素选择了alamarBlue、5-CFDA,AM及Neutral Red等3种荧光染料作为细胞活性指示剂(见1.4),以期从代谢活性、质膜完整性及溶酶体功能不同角度揭示化学品对RTgill-W1细胞的毒性作用。参与方法验证的5家实验室对6种化学品开展上述3个终点RTgill-W1细胞急性毒性测试,其中2,2,2-三氯乙醇及马拉硫磷暴露下不同终点EC50值差异较大,上述2种化学品最敏感终点均为alamarBlue[5,16]。上述结果提示,因暴露化学品毒性作用的差异,可能导致终点效应的差异。本研究10种化学品暴露下,亦观察到了不同终点的效应差异,尽管细胞3个毒性终点的剂量-效应曲线趋势相似(图1),但部分化学品3个终点的敏感性差异较大。如在五水硫酸铜及多菌灵暴露下,Neutral Red这一终点较其他2个终点更为敏感。通常认为Neutral Red仅在活细胞中功能正常的溶酶体内积累,该荧光染料在活细胞存留还可反映质膜完整性及细胞代谢能量的充足性,涵盖了alamarBlue及5-CFDA,AM这2种染料关注的终点效应[17]。一项关于铜对鲤鱼损害的研究表明,铜多分布于鲤鱼细胞的溶酶体中[18]。虽无多菌灵暴露对鱼体溶酶体功能影响的相关报道,但有研究表明多菌灵暴露后雄性大鼠主要表现出富含溶酶体的肝、肾组织功能异常[19],已有研究证实作用于肝肾的药物会聚集在试验动物肝肾溶酶体内引发其功能异常[20],溶酶体功能正常则可防止药物产生肾脏毒性[21],由此可推测多菌灵造成肝肾异常可能与其对溶酶体功能的破坏有关。上述研究为五水硫酸铜及多菌灵暴露下Neutral Red这一染料指示终点更为敏感提供了依据,提示体外细胞急性毒性试验终点效应差异较大时,其敏感终点可能揭示化学品体内毒性机理。此外,3个终点效应产生的实质均为化学品透过生物膜产生的毒性效应,可反映生物膜的完整性,我国《新化学物质环境管理登记指南》规定可豁免不可透过生物膜的难溶化学品的水生毒性试验,但未提供相应的生物膜透性评估方法,因此可采用OECD 249方法通过RTgill-W1细胞3个终点的响应,判断大分子量、难溶化学品透过生物膜产生毒性的可能,为该类化学品是否可豁免水生毒性试验提供判断依据。

图1 3,4-DCA(a)、CSP(以CuSO4计)(b)、2,3,6-TMP(c)、BP(d)、CBD(e)、PD(f)、BIT(g)、TCS(h)、TAM(i)及TCC(j)对RTgill-W1细胞的急性毒性效应
Fig. 1 Acute toxicity on RTgill-W1 cell lines induced by 3,4-DCA (a), CSP (concentration calculated by CuSO4) (b), 2,3,6-TMP (c), BP (d), CBD (e), PD (f), BIT (g), TCS (h), TAM (i) and TCC (j)
10种化学品RTgill-W1细胞急性毒性试验结果(表4)表明,3个终点的EC50值差异总体不具水生急性毒性危害分级[15]差异。
表4 受试化学品RTgill-W1细胞急性毒性测试结果
Table 4 Results of RTgill-W1 acute toxicity tests for test chemicals

受试化学品Test chemicals3个测试终点EC50值(95%置信区间)/(mg·L-1)EC50 values (95% confidence interval) of three test endpoints/(mg·L-1)alamarBlue5-CFDA,AMNeutral Red3,4-DCA31.0 (28.8~33.3)27.5 (23.6~32.0)36.0 (27.8~46.5)CSP23.9 (—)13.0 (8.58~19.3)8.13 (—)2,3,6-TMP19.6 (19.5~19.8)20.5 (20.4~20.6)19.7 (17.3~22.3)BP21.0 (16.7~26.1)23.0 (20.5~25.8)22.4 (17.2~29.2)CBD43.5 (—)75.4 (—)10.5 (4.13~25.6)PD76.1 (75.8~76.5)96.2 (95.8~96.6)55.1 (48.1~63.3)BIT2.97 (2.95~3.00)3.24 (2.99~3.52)2.81 (2.76~2.86)TCS1.92 (—)>1.72 (—)4.86 (—)TAM18.7 (16.1~21.9)17.8 (13.8~23.0)20.5 (16.8~25.0)TCC0.268 (0.204~0.349)0.448 (—)0.221 (0.186~0.261)
注:“—”表示软件计算结果无95%置信区间。
Note: “—” means 95% confidence interval cannot be calculated by software.
2.3 RTgill-W1细胞急性毒性数据与鱼类急性毒性数据的关联与转换
OECD 249[3]标准方法推荐采用3种测试终点(见2.1)EC50值的最低值用于保守估计。而事实上,方法验证报告[5]论述细胞与鱼体内数据相关性时,引用文献研究的67种化学品[22-23],多数化学品代谢活性(即alamarBlue)终点的EC50值始终为最低值(即低于其他2个终点EC50值),少数化学品代谢活性EC50值与最低EC50值终点差异较小(即差异在20%内),提示方法验证所选化学品的细胞毒性表现可能相对单一,主要细胞毒性表现为代谢活性的抑制。因此,方法验证报告中仅采用代谢活性这一终点的数据探讨RTgill-W1细胞急性毒性数据与鱼体数据的相关性。此外,验证报告[5]中67种化学品的RTgill-W1细胞急性毒性试验[22-23]并未采用OECD 249标准方法,故获取的细胞EC50值存在不确定性,研究细胞EC50值与鱼体内急性毒性数据相关性时,鱼急性毒性LC50数据的选取并无统一规则:部分化学品采用了黑头软口鲦(Pimephales promelas)单一鱼种单个或多个数据[22],其余则采用了涵盖斑马鱼(Danio rerio)、虹鳟(Oncorhynchus mykiss)或鲤鱼(Cyprinus carpio)等在内的不同鱼种的单一试验数据[23]。因此,选取的鱼急性毒性LC50数值亦存在不确定性。因存在上述不确定性,验证报告进行细胞EC50及鱼急性毒性LC50线性回归拟合时,仅能采用适用数据有较大不确定性的戴明回归(Deming regression)获得拟合方程:鱼急性毒性LC50对数值=(0.86±0.08)×细胞EC50对数值-(0.09±0.12),该回归不适合给出线性回归决定系数(coefficient of determination; R2),难于判断细胞急性毒性EC50值预测鱼急性毒性LC50的真实适用性。早在鱼类胚胎急性毒性标准方法[1]研究中,已建立X、Y轴为定值且相关性较好的体内与体外数据线性回归关系(即胚胎LC50对数值=(0.989×鱼急性毒性LC50对数值)-0.195,R2=0.92),如能通过研究建立与胚胎急性毒性相类似的RTgill-W1细胞与鱼类急性毒性的可靠转换关系,有利于推进RTgill-W1细胞急性毒性结果更好预测或替代鱼急性毒性试验结果[24]。因此,尝试通过重复性好的标准操作体系、规范鱼急性毒性LC50值数据的选取方式降低回归拟合时细胞EC50值及鱼毒LC50值的不确定性,研究RTgill-W1细胞急性毒性EC50值数据与鱼类急性LC50的实际相关性以数据转换。
根据标准方法[3]建议,采用RTgill-W1最敏感终点EC50值的对数作为线性拟合X轴数据点(即细胞EC50的对数值)。Y轴数据点(即化学品鱼急性毒性LC50值)随鱼种不同存在一定差异,标准方法验证报告[5]亦未统一鱼毒LC50数据选取方式。根据ECHA化学品安全评估系列指南文件[25],当存在多个效应数据时,如数据均为同一物种的数据结果或各数据结果差异在1个数量级以内时可以采用多个效应数据的几何平均值,而通过检索美国环境保护局ECOTOX数据库及欧洲化学品管理局化学品登记注册卷宗发现本研究中10种化学品均有多个标准鱼种鱼类急性毒性LC50值,不同研究LC50值差异超过1个数量级,故需寻求几何平均值以外的多数据处理方式。OECD 249验证报告[5]引用的文献研究[22-23]均表明,与各化学品RTgill-W1细胞急性毒性EC50值相关性好的鱼体内急性毒性LC50值总体处于所有标准鱼种数据的中间水平(即介于化学品不同鱼种鱼急性毒性LC50值的最低值与最高值之间)。进一步分析OECD 249方法验证及多家实验室比对时引用的6种化学品[5,17]鱼急性毒性LC50值(表5),均为黑头软口鲦的试验数据,而事实上6种化学有较多标准鱼种试验数据,数据差异可跨1~2个数量级,因此尝试分析各化学品对应所有标准鱼种LC50的中位值。结果表明,除马拉硫磷外,其余5种化学品黑头软口鲦的LC50值几乎与所有标准鱼种的LC50的中位值相当,在危害分级[15]上无本质差异。马拉硫磷所有标准试验鱼种的LC50中位值2.23 mg·L-1与多数标准鱼种96 h鱼急性毒性LC50水平[26]相近,而马拉硫磷对黑头软口鲦的LC50值(14.1 mg·L-1)与多家实验室中马拉硫磷对RTgill-W1细胞的最低EC50值(11.9±7.6) mg·L-1相近,推测细胞EC50值与鱼毒LC50值相近是OECD 249验证研究中选取线性拟合用鱼急性毒性LC50的考虑因素之一。然而,RTgill-W1细胞急性毒性试验开发的目的与意义为实现鱼类急性毒性LC50值的预测或鱼体内试验的替代,因此在研究细胞EC50与鱼急性毒性LC50相关性时,不应根据细胞EC50结果去选取适配的鱼急性毒性LC50值,而应采用更为客观、相对统一方式选取拟合用的鱼类急性毒性LC50数据,相对而言,多鱼种的LC50中位值比不同研究中单一鱼种单个或多个LC50数据更有代表性及可操作性。综上,本研究采用美国环境保护局ECOTOX数据库及欧洲化学品管理局化学品登记注册卷宗收录的标准鱼种的急性毒性LC50值中位值,对该值取对数后作为曲线拟合的Y轴数据点(即鱼毒LC50的对数值)。
表5 OECD 249试验实验室比对中6种化学品对应的鱼类急性毒性LC50值
Table 5 LC50 values of acute fish toxicity tests for six chemicals used in inter-laboratory comparison of OECD 249 testing method
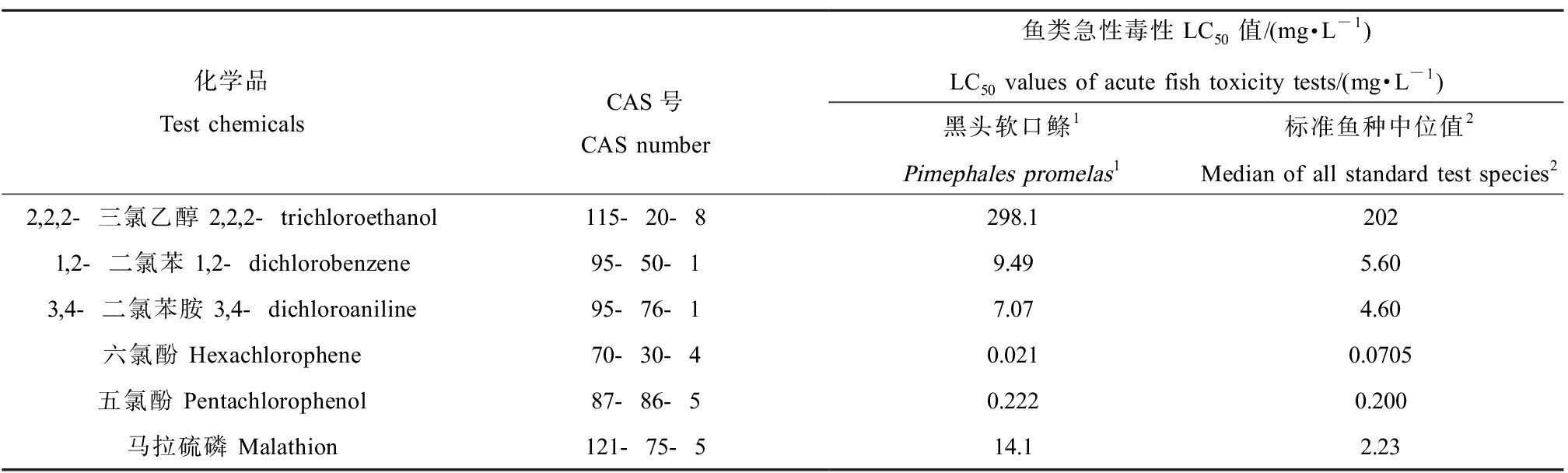
化学品Test chemicalsCAS号CAS number鱼类急性毒性LC50值/(mg·L-1)LC50 values of acute fish toxicity tests/(mg·L-1)黑头软口鲦1Pimephales promelas1标准鱼种中位值2Median of all standard test species22,2,2-三氯乙醇 2,2,2-trichloroethanol115-20-8298.12021,2-二氯苯 1,2-dichlorobenzene95-50-19.495.603,4-二氯苯胺 3,4-dichloroaniline95-76-17.074.60六氯酚 Hexachlorophene70-30-40.0210.0705五氯酚 Pentachlorophenol87-86-50.2220.200马拉硫磷 Malathion121-75-514.12.23
注:1表示OECD 249实验室比对研究[5,17]引用数据,数据源自美国环境保护局黑头软口鲦数据库(U.S. EPA fathead minnow database)(http://www.epa.gov/med/Prods Pubs/fathead minnow.htm),如有1中化学品有多个LC50值时,采用多个值的几何平均值;2表示本研究调研的每种化学品不同鱼种LC50数据的中位值,调研数据为美国环境保护局ECOTOX数据库及欧洲化学品管理局(European Chemicals Agency, ECHA)化学品登记注册卷宗中鱼类急性毒性标准方法推荐的所有标准鱼种数据。
Note: 1 represents data cited by validation and inter-lab comparison study[5,17] of OECD 249, which collected from U.S. EPA fathead minnow database (http://www. epa.gov/med/Prods Pubs/fathead minnow.htm); if more than one LC50 value was available per chemical, the database lists the geometric mean; 2 represents median LC50 values of different test species for each chemical investigated in this study, all data were collected from U.S. EPA ECOTOX database and ECHA chemical registration dossier.
尽管涵盖BP、CBD、BIT、TCS、TCC等具神经毒性、RTgill-W1细胞毒性试验可能存在预测偏差的化学品[3-4],本研究中10种化学品的细胞EC50值与国际标准鱼种的LC50值仍具较好相关性,R2为0.7009(图2(a)),除多菌灵预测偏差较大外(细胞EC50与鱼急性毒性LC50的数值差异倍数达31倍),其余化学品细胞与鱼毒结果的差异均在10倍以内(0.939倍~5.98倍),细胞与鱼毒数据相关性优于OECD验证报告[5]列举的源自文献[22]的主要验证数据(图2(b)及(c))。上述结果表明,在标准方法下获取RTgill-W1细胞急性毒性数据,与国际标准试验鱼种的急性毒性LC50具有较好相关性。
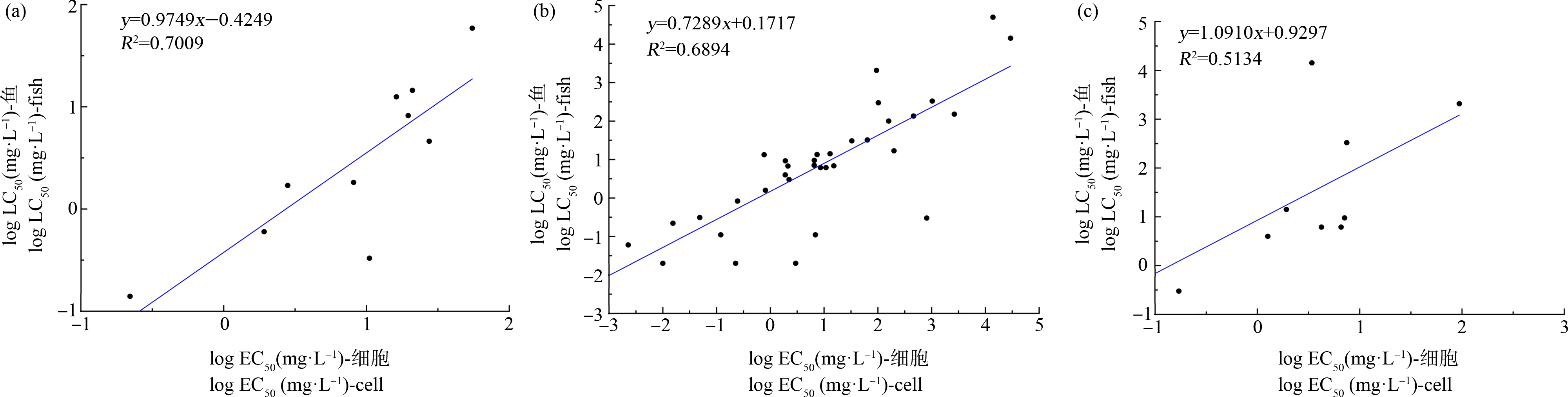
图2 本研究10种化学品(a)、OECD验证报告[5]引用文献[22]中的化学品(b)、OECD验证报告[5]引用文献[22]中随机(excel生成随机数)选取10个化学品(c)RTgill-W1细胞急性毒性试验最低EC50值与标准鱼种鱼类急性毒性试验LC50值的线性拟合
Fig. 2 Linear regression for the lowest EC50 values of acute toxicity tests by using RTgill-W1 cell lines vesus LC50 values of acute fish toxicity tests by using standard test species with ten chemicals of this study (a), chemicals in research paper[22] which cited by OECD validation report[5](b), ten chemicals randomly selected (random number generated by excel) from research paper[22] which cited by OECD validation report[5](c)
进一步比较10种化学品RTgill-W1细胞急性毒性EC50与本实验室使用我国本土标准试验鱼种稀有鮈鲫及其胚胎获取的急性毒性LC50[27](图3),细胞与稀有鮈鲫及其胚胎数据相关性较好,R2分别为0.7110及0.7975,细胞EC50与鱼及胚胎LC50的倍数差异均在10倍以内(分别为0.478倍~9.84倍以及0.103倍~7.38倍)。已有文献证实[27-29],多菌灵对不同标准试验鱼种的LC50数值差异较大,结果可跨极毒(96 h-LC50≤1 mg·L-1)、高毒(96 h-LC50为1~10 mg·L-1)及中毒(96 h-LC50为10~100 mg·L-1)3个危害分级[15]。本实验室研究(未发表)表明,多菌灵对稀有鮈鲫及斑马鱼具有延迟死亡效应,即死亡效应出现在96 h之后,一项多菌灵引起斑马鱼幼鱼细胞凋亡的研究为2种鱼的死亡延迟提供了解释[30]。同时,亦提示以代谢活性、质膜完整性及溶酶体功能为终点的RTgill-W1细胞急性毒性试验,在预测不对细胞活性产生急性毒性效应化学品的鱼类急性毒性LC50上可能出现较大偏差,而具特定神经毒性作用的化学品可能不是导致结果偏差的主要原因。
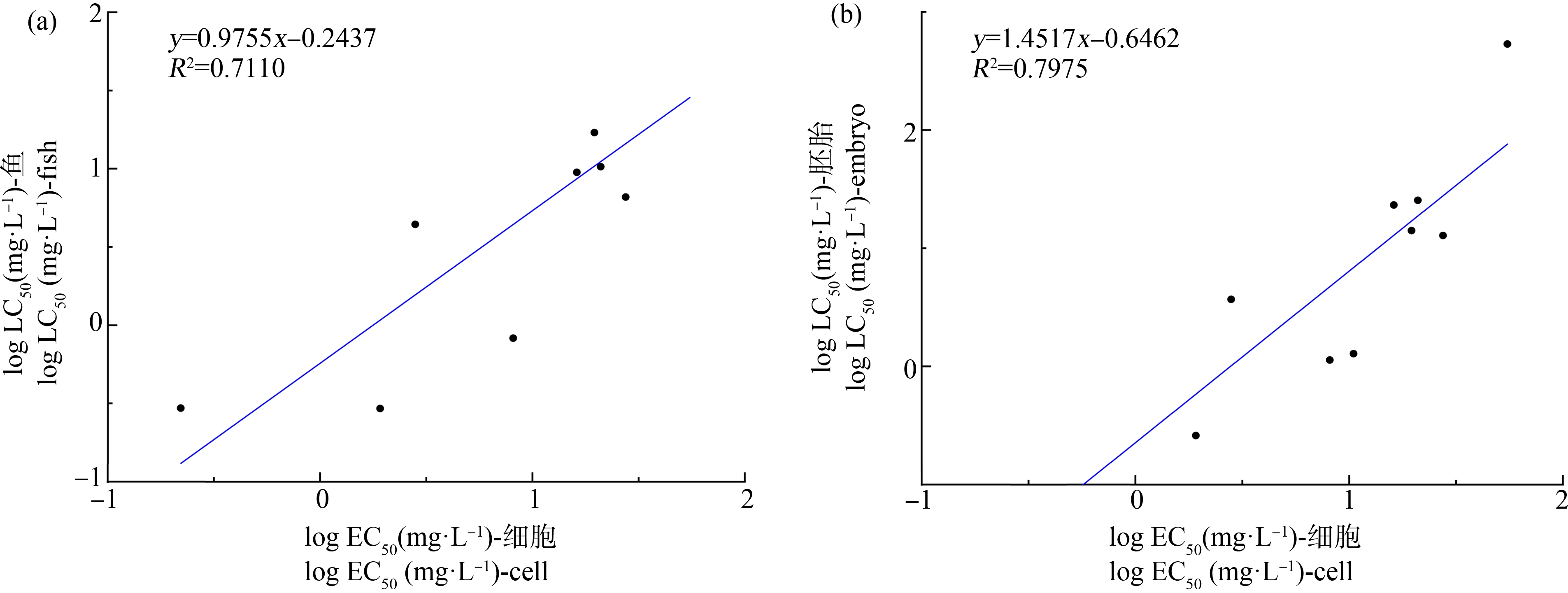
图3 本研究10种化学品对RTgill-W1细胞急性毒性试验最低EC50值与对稀有鮈鲫[27](a)、稀有鮈鲫胚胎[27](b)急性毒性试验LC50值的线性拟合
注:多菌灵暴露下,96 h内未观察到稀有鮈鲫死亡效应[27],故该数据不用于曲线拟合。
Fig. 3 Linear regression for the lowest EC50 values of acute toxicity tests by using RTgill-W1 cell lines vesus LC50 values of acute fish toxicity tests by using Chinese rare minnows (Gobiocypris rarus)[27](a) and its embryo[27](b) with ten chemicals of this study
Note: No mortality effect of Chinese rare minnows (Gobiocypris rarus) can be observed with exposure of carbendazim within 96 h[27], and therefore, this data was excluded.
3 讨论(Discussion)
生态毒理学领域标准体外替代方法数量较少,以鱼类胚胎急性毒性试验(OECD 236)[1]应用最多,从2013年方法开发至今已应用于数千种化学品的研究,方法与鱼类急性毒性试验的数据相关性亦被不断证实。在动物福利“3R原则”考虑的推动下,欧盟在化学品与化妆品管理中致力于避免不必要动物试验并将其作为化学品最后的评估手段,尽管胚胎急性毒性试验方法应用局限尚不明确(毒性被胚胎急性毒性低估的化学品中基线毒性物质与反应性毒性物质无规律性差异)[31],胚胎急性毒性试验已从化学品整合测试与评估方法中(integrated approach to testing and assessment, IATA)的部分测试转变为特定化学品水生危害评估中替代鱼类急性毒性试验的关键试验。预计虹鳟鱼鳃RTgill-W1细胞急性毒性标准试验方法(OECD 249)[3]在积累一定应用实例后,亦可能在化妆品原料评估中作为鱼类急性毒性试验的关键替代试验。目前,与OECD 236标准方法仅能从化学品理化性质(如化学品辛醇-水分配系数、空气-水分配系数等)角度提出方法的适用范围[31]类似,OECD 249方法亦从化学品理化性质角度规定了方法适用范围[5],较胚胎急性毒性试验有更广的适用范围,可适用于疏水性、挥发性强的化学品。OECD 249方法亦未从化学品毒作用机制角度阐明方法应用局限,其验证报告[5]中毒性被低估的物质不仅有神经毒性物质,还包括基线毒性物质,仅2个具神经毒性的物质与鱼类急性毒性数据差异>10倍,故被认为对此类物质可能存在预测偏差。而验证报告[5]中其他神经毒性物质与本研究中5种具特殊神经毒性物质的RTgill-W1细胞急性毒性试验结果均表明,特殊神经毒性化学品并非导致毒性被细胞急性毒性试验体系低估的本质原因。因此,需采用标准方法及规范操作已减少操作及试验条件的差异导致的结果偏差,在确保结果重现性基础上积累不同化学品的应用数据,从毒作用机制角度对毒性被低估的化学品进行分析,逐步明确毒性可能被低估的化学品类别。为实现上述目的,欧洲化学工业委员会(European Chemical Industry Council, CEFIC)发起一项为期2~3年的研究项目,致力于明确胚胎及细胞急性毒性试验的应用域并推进其在法规层面的应用。目前,OECD验证报告[5]及本研究中采用OECD 249标准方法研究的化学品数量有限,尚不足以从毒作用机制角度得出具有规律性的结果,但仍可为标准方法在法规层面的应用评估提供有效数据支撑。同时,本研究亦为OECD 249方法的进一步完善、应用与发展提供了一定思路。
标准方法中3,4-DCA暴露下细胞毒性EC50值制定的依据为多家比对实验室的EC50值,因此限值的允许范围较宽,存在数量级的差异。而本研究表明,同一实验室根据OECD 249标准方法操作,可建立稳定性、重复性好的试验体系:不同批次培养细胞在3,4-DCA暴露下的RTgill-W1细胞毒性EC50值变异较小,可有效避免因EC50结果波动而致危害分级出现差异。RTgill-W1细胞急性毒性相关研究表明,OECD 249方法测定的alamarBlue、5-CFDA,AM及Neutral Red等3个终点EC50值与标准鱼种鱼类急性毒性LC50值中位值相近[22-23]。OECD验证报告[5]例举的多数化学品中,alamarBlue均为3个细胞测定终点中的敏感终点,有研究表明[32],该终点敏感性低于噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)法。本研究中依据OECD 249标准方法采用细胞急性毒性最低EC50值已与国外标准鱼种LC50中位值具良好线性关系,方法3个终点对通过细胞凋亡途径至鱼体毒性的多菌灵的敏感性较低。上述结果提示,OECD 249的3个细胞测定终点可能敏感性偏低,导致部分化学品的毒性被低估,后续研究可考虑开发更敏感终点。未来采用更敏感终点研究细胞EC50值与鱼急性毒性LC50的相关性时,可尝试用分位数方法对多个鱼急性毒性LC50值进行分类处理。本研究10种化学品RTgill-W1细胞急性毒性试验结果表明,RTgill-W1细胞急性毒性在对涵盖金属化合物及特殊神经毒性作用化学品的预测上与标准鱼种的鱼类急性毒性试验结果总体差异较小。在标准方法下建立稳定的细胞毒性试验体系后,细胞急性毒性最低EC50值与国外标准鱼种LC50中位值以及同一实验室常用标准试验鱼种(如稀有鮈鲫)的LC50值具较好相关性,可在同一实验室数据基础上建立RTgill-W1细胞急性毒性EC50值与标准鱼种急性毒性LC50值之间良好的线性回归关系后,实现细胞急性毒性EC50值至鱼类急性毒性试验的LC50值相对准确的转化。
此外,尚未在实验室建立细胞急性毒性EC50值与标准鱼种急性毒性LC50值的转换关系时,依据OECD 249方法获取的单一细胞急性毒性试验结果仍具有一定应用价值:(1)可替代鱼类急性毒性试验的预试验,节约常规鱼类急性毒性试验的周期并减少试验用鱼数量;(2)可用于预测鱼类急性毒性试验的LC50,尤其对预测软件应用域范围外的化学品,RTgill-W1细胞急性毒性的预测结果具有一定可靠性;(3)可通过3个细胞毒性终点对化学品的响应,评估分子量大的难溶化学品透过生物膜产生水生毒性的可能性,据此决定该化学品是否可在化学登记申报中豁免水生毒性试验,为我国《新化学物质环境管理登记指南》中的生物膜透性评估提供具体可行的技术手段。
综上,认为OECD 249方法具有良好应用前景及应用潜能,经应用数据积累,可实现鱼类急性毒性试验结果相对可靠的预测,但完全替代鱼类急性毒性试验应用于化学品登记注册法规层面尚需时日。
未来工作中,可对方法进行以下完善与发展:(1)开发更敏感且操作便捷的细胞急性毒性测定终点,提高细胞毒性检测的敏感性,以减少在细胞毒性评估中毒性被低估的化学品数量;(2)考虑不同鱼种细胞的敏感性差异[33-34],建立源自我国本土鱼种稀有鮈鲫可稳定传代的细胞系,开展相应的标准化急性毒性研究;(3)在标准方法应用数据积累的基础上,进一步完善细胞急性毒性试验与标准鱼种急性毒性试验结果间的转换。通过上述工作为体外替代标准技术在我国化学品管理中的应用提供有力支撑,提升我国在国际化学品管理中的影响力及话语权。
[1] Organization for Economic Cooperation and Development (OECD). OECD guidelines for the testing of chemicals. Section 2: Effects on biotic systems test No. 236: Fish embryo acute toxicity (FET) test [S]. Paris: OECD, 2013
[2] Organization for Economic Cooperation and Development (OECD). OECD guidelines for the testing of chemicals. Section 2: Effects on biotic systems test No. 203: Fish, acute toxicity test [S]. Paris: OECD, 2019
[3] Organization for Economic Cooperation and Development (OECD). OECD guidelines for the testing of chemicals. Section 2: Effects on biotic systems test No. 249: Fish cell line acute toxicity: The RTgill-W1 cell line assay [S]. Paris: OECD, 2021
[4] International Standardization Organization (ISO). ISO 21115, Water quality-Determination of the acute toxicity of water samples and chemicals to fish gill cell line (RTgill-W1) [S]. Geneva: ISO, 2019
[5] Organization for Economic Cooperation and Development (OECD). Series on testing and assessment, No. 334: Validation report for the test guideline 249 on fish cell line acute toxicity-the RTgill W1 cell line assay [S]. Paris: OECD, 2021
[6] Lovinger D M, White G, Weight F F. Ethanol inhibition of neuronal glutamate receptor function [J]. Annals of Medicine, 1990, 22(4): 247-252
[7] Zheng Y M, Zhu X J, Zhou P Z, et al. Hexachlorophene is a potent KCNQ1/KCNE1 potassium channel activator which rescues LQTs mutants [J]. PLoS One, 2012, 7(12): e51820
[8] Pal R, Monroe T O, Palmieri M, et al. Rotenone induces neurotoxicity through Rac1-dependent activation of NADPH oxidase in SHSY-5Y cells [J]. FEBS Letters, 2014, 588(3): 472-481
[9] Wnuk A, Rzemieniec J, Lasoń W, et al. Benzophenone-3 impairs autophagy, alters epigenetic status, and disrupts retinoid X receptor signaling in apoptotic neuronal cells [J]. Molecular Neurobiology, 2018, 55(6): 5059-5074
[10] Zhang W J, Fan R Q, Luo S L, et al. Antagonistic effects and mechanisms of carbendazim and chlorpyrifos on the neurobehavior of larval zebrafish [J]. Chemosphere, 2022, 293: 133522
[11] Kim D, Kim E H, Bae O N. Comparative study of two isothiazolinone biocides, 1,2-benzisothiazolin-3-one (BIT) and 4,5-dichloro-2-n-octyl-isothiazolin-3-one (DCOIT), on barrier function and mitochondrial bioenergetics using murine brain endothelial cell line (bEND.3) [J]. Journal of Toxicology and Environmental Health Part A, 2021, 84(22): 932-943
[12] Wang D T, Wang X D, Huang H S, et al. Triclosan regulates alternative splicing events of nerve-related genes through RNA-binding protein CELF2 to induce zebrafish neurotoxicity [J]. Journal of Hazardous Materials, 2021, 413: 125414
[13] Szychowski K A, Wnuk A, Rzemieniec J, et al. Triclosan-evoked neurotoxicity involves NMDAR subunits with the specific role of GluN2A in caspase-3-dependent apoptosis [J]. Molecular Neurobiology, 2019, 56(1): 1-12
[14] Kajta M, Rzemieniec J, Wnuk A, et al. Triclocarban impairs autophagy in neuronal cells and disrupts estrogen receptor signaling via hypermethylation of specific genes [J]. The Science of the Total Environment, 2020, 701: 134818
[15] 中华人民共和国环境保护部. 新化学物质危害评估准则: HJ/T 154—2004 [S]. 北京: 中国环境科学出版社, 2004
[16] Fischer M, Belanger S E, Berckmans P, et al. Repeatability and reproducibility of the RTgill-W1 cell line assay for predicting fish acute toxicity [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2019, 169(2): 353-364
[17] Dayeh V R, Schirmer K, Lee L E J, et al. Rainbow Trout Gill Cell Line Microplate Cytotoxicity Test [M]// Blaise C, Férard J F. Small-scale Freshwater Toxicity Investigations. Berlin/Heidelberg: Springer-Verlag, 2005: 473-503
[18] 王利, 汪开毓. 铜对鲤损害的电镜X射线显微分析[J]. 水生态学杂志, 2009, 30(5): 67-70
Wang L, Wang K Y. Studies on electron probe X-ray microanalysis of copper in poisoned Cyprinus carpio [J]. Journal of Hydroecology, 2009, 30(5): 67-70 (in Chinese)
[19] Selmanoglu G, Barlas N, Songür S, et al. Carbendazim-induced haematological, biochemical and histopathological changes to the liver and kidney of male rats [J]. Human Experimental Toxicology, 2001, 20(12): 625-630
[20] Schneider P. Drug-induced lysosomal disorders in laboratory animals: New substances acting on lysosomes [J]. Archives of Toxicology, 1992, 66(1): 23-33
[21] 郭晓燕, 杨陈, 刘华锋. 溶酶体与肾脏疾病[J]. 中华肾脏病杂志, 2019, 35(8): 635-640
Guo X Y, Yang C, Liu H F. Lysosomes and kidney diseases [J]. Chinese Journal of Nephrology, 2019, 35(8): 635-640 (in Chinese)
[22] Tanneberger K, Knöbel M, Busser F J, et al. Predicting fish acute toxicity using a fish gill cell line-based toxicity assay [J]. Environmental Science &Technology, 2013, 47(2): 1110-1119
[23] Natsch A, Laue H, Haupt T, et al. Accurate prediction of acute fish toxicity of fragrance chemicals with the RTgill-W1 cell assay [J]. Environmental Toxicology and Chemistry, 2018, 37(3): 931-941
[24] Belanger S E, Rawlings J M, Carr G J. Use of fish embryo toxicity tests for the prediction of acute fish toxicity to chemicals [J]. Environmental Toxicology and Chemistry, 2013, 32(8): 1768-1783
[25] European Chemicals Agency (ECHA). Guidance on information requirements and chemical safety assessment: Chapter R.10: Characterisation of dose [concentration]- response for environment [S]. Helsinki, Finland: ECHA, 2008
[26] Deka S, Mahanta R. Malathion toxicity on fish-A review [J]. International Journal of Current Research, 2016, 8(12): 44120-44128
[27] 王绿平, 张京佶, 赵华清. 稀有鮈鲫作为鱼类胚胎急性毒性试验受试鱼种的敏感性研究[J]. 生态毒理学报, 2021, 16(5): 102-112
Wang L P, Zhang J J, Zhao H Q. Sensitivity of Chinese rare minnows (Gobiocypris rarus) for fish embryo acute toxicity test [J]. Asian Journal of Ecotoxicology, 2021, 16(5): 102-112 (in Chinese)
[28] Palawski D U, Knowles C O. Toxicological studies of benomyl and carbendazim in rainbow trout, channel catfish and bluegills [J]. Environmental Toxicology and Chemistry, 1986, 5(12): 1039-1046
[29] University of Hertfordshire. Pesticide Properties DataBase (PPDB): Carbendazim (Ref: BAS 346F) [EB/OL]. (2021-06-01) [2021-02-02]. http://sitem.herts.ac.uk/aeru/ppdb/en/Reports/116.htm
[30] Jiang J H, Wu S G, Wang Y H, et al. Carbendazim has the potential to induce oxidative stress, apoptosis, immunotoxicity and endocrine disruption during zebrafish larvae development [J]. Toxicology in Vitro, 2015, 29(7): 1473-1481
[31] Scholz S, Klüver N, Kühne R. Analysis of the relevance and adequateness of using fish embryo acute toxicity (FET) test guidance (OECD 236) to fulfil the information requirements and addressing concerns under REACH [R]. Helsinki, Finland: European Chemicals Agency, 2016
[32] di Nunzio M, Valli V, Tomás-Cobos L, et al. Is cytotoxicity a determinant of the different in vitro and in vivo effects of bioactives? [J]. BMC Complementary and Alternative Medicine, 2017, 17(1): 453
[33] Wang Y C, Chaung R H, Tung L C. Comparison of the cytotoxicity induced by different exposure to sodium arsenite in two fish cell lines [J]. Aquatic Toxicology, 2004, 69(1): 67-79
[34] Bermejo-Nogales A, Fernández-Cruz M L, Navas J M. Fish cell lines as a tool for the ecotoxicity assessment and ranking of engineered nanomaterials [J]. Regulatory Toxicology and Pharmacology, 2017, 90: 297-307