对于野生生物而言,其在整个生命周期中将不可避免地遭遇各种各样的不健康状态。以组织损伤为例,受伤、疾病和衰老等均可能导致生物体组织或器官在形态和功能上的缺失,从而降低个体的生命质量。因此,具有一定的组织修复和再生能力,对于所有生物个体乃至种群而言均是极为重要的[1]。相对于哺乳动物,鱼类等低等脊椎动物具有更为强大的再生能力,其心脏、肝脏、鱼鳍等多个组织器官在受损后均可以完全再生[2-3]。其中,斑马鱼尾鳍再生模型由于其组织结构相对简单、易于手术操作以及再生过程迅速等诸多优点而成为研究脊椎动物再生机理的首选[3-4]。
近年来,基于斑马鱼尾鳍再生模型,研究者发现部分环境污染物可以损害鱼类的组织修复和再生能力,从而影响其在环境中的生态适应性,最终可能导致种群数量下降。比如,Tanguay研究组首先发现,芳烃类化合物(比如TCDD)可在不引起其他毒性效应的暴露浓度下,特异性地抑制幼鱼和成鱼的尾鳍再生[5-6]。之后的研究陆续发现了糖皮质激素类化合物、细胞色素P450抑制剂等均有干扰尾鳍再生的效应[7-8]。类似的,基于斑马鱼心脏再生模型,Hirose等[9]在Science发文,揭示了外源性甲状腺激素可以损伤心脏的再生能力。由此可见,忽略了环境污染物对鱼类等水生生物组织修复与再生能力的可能影响,将很有可能低估其生态风险,从而难以对相关污染物进行科学合理的管控。
在过去的二三十年间,有关环境内分泌干扰物的毒性效应和作用机理一直是生态毒理学领域的研究热点。环境内分泌干扰物通过干扰生物体内分泌系统主要调控轴,可对生长、发育、繁殖等生理过程造成不可逆的损害。在我们之前的研究中发现,环境雌激素能够干扰斑马鱼幼鱼的尾鳍再生过程[10]。然而,环境内分泌干扰物中的另一大类——雄激素是否能够影响生物的组织修复与再生过程则还未见报道。
科学界对雄激素的关注开始于有关造纸厂下游水体中雌鱼雄性化的相关报道[11]。环境已检测到的天然雄激素主要为睾酮(testosterone)以及衍生物,而群勃龙醋酸酯(trenbolone acetate)则为最受关注的人工合成雄激素之一[12]。群勃龙醋酸酯是一种合成代谢类固醇,广泛应用于养殖业,比如作为肉牛促生长剂[12]。群勃龙(17β-trenbolone, TREN)是群勃龙醋酸酯主要的代谢产物,在养殖场附近的地表水中浓度一般在几到几十ng·L-1,最高可达270 ng·L-1 [12-13]。群勃龙作为雄激素受体激动剂,作用靶点明确,且不会像某些固醇类雄激素会经芳香化生成雌激素类代谢物,由此成为生态毒理学研究者公认的模式化合物[12,14]。研究表明,环境浓度的群勃龙暴露即可影响鱼类内分泌系统功能的改变,并导致一系列毒性效应[12]。本研究将以群勃龙作为雄激素的代表,确定其对斑马鱼幼鱼尾鳍再生的影响。在此基础上,通过与雄激素受体拮抗剂氟他胺(flutamide, FLUT)的联合暴露,揭示雄激素干扰组织修复与再生的可能机理。
1 材料与方法(Materials and methods)
1.1 化学试剂
群勃龙(CAS:10161-33-8,纯度>98%)购于Cayman Chemical,氟他胺(CAS:13311-84-7,纯度99.90%)购于MedChemExpress,均用二甲基亚砜(DMSO)配制成贮备液,-20 ℃保存。麻醉剂三卡因(tricaine,CAS:886-86-2,纯度98%)购于Sigma-Aldrich。
1.2 实验动物
野生AB系和转基因Tg(mpx:EGFP)斑马鱼均购于国家斑马鱼资源中心。成鱼(6月龄)养殖用水为活性碳过滤并曝气的自来水,水温(28.0±1.0) ℃,溶氧不低于6 mg·L-1。光周期为14 h∶10 h (昼∶夜)。每天投喂商品饲料和刚孵化的丰年虫幼虫。参照标准方法配鱼,收集正常发育的胚胎[10]。28 ℃下72 h孵化基本完成,幼鱼用于后续实验。
1.3 幼鱼尾鳍切除以及暴露实验
幼鱼用三卡因(浓度为0.016%)麻醉后,在琼脂板上借助体视显微镜,沿脊柱末端切除尾鳍[5,10]。断尾的幼鱼在曝气水中复苏后立即进行半静水暴露实验。暴露实验在6孔板中进行,每孔15条幼鱼。根据之前的文献报道[12,15]以及预实验结果,群勃龙单独暴露的浓度设置为10、100、300和1 000 ng·L-1;联合暴露的浓度设置为群勃龙1 000 ng·L-1,氟他胺则分别为30、100和300 μg·L-1。每个浓度4个平行,并设置溶剂对照(0.01% DMSO)。鉴于幼鱼断尾后3 d即可完成再生过程,暴露持续时间72 h。暴露期间每天更换暴露液。
1.4 幼鱼尾鳍再生面积检测
暴露后24、48和72 h分别在显微镜下拍照,记录再生尾鳍状态,利用ImageJ (NIH)软件测量暴露组以及对照组幼鱼的再生尾鳍面积,并以对照组进行归一[5,10]。
1.5 相关基因的转录水平检测
将暴露后的幼鱼匀浆(每个平行15条幼鱼合并为一个样品),用Trizol (Takara,日本)提取总RNA。测定RNA的浓度和纯度后,通过反转录试剂盒(ReverTra Ace qPCR RT kit, Toyobo,日本)将RNA反转录为cDNA。基于相关报道[10,16],选取了免疫系统和再生通路的相关基因,以及雄激素受体基因,对其转录水平进行荧光定量PCR分析。引物序列参考之前的报道[10,16]。PCR反应条件为95 ℃ 3 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。相对转录水平以管家基因β-actin进行校正。
1.6 中性粒细胞的招募和迁移
转基因斑马鱼Tg(mpx:EGFP)以绿色荧光蛋白特异性标记中性粒细胞,能在荧光显微镜下清楚观察到体内中性粒细胞的行为[17]。幼鱼断尾以及暴露如上所述。在断尾后不同时间,拍摄、记录并统计再生尾鳍处的中性细胞数量[10]。
1.7 统计分析
试验数据确认符合正态分布及方差齐性后,通过单因素方差分析(ANOVA)并以Dunnett’s检验进行多重比较。设P<0.05时有统计学差异。
2 结果(Results)
2.1 群勃龙暴露对斑马鱼幼鱼尾鳍再生面积的影响
不同浓度的群勃龙单独暴露后,不同时间点断尾幼鱼再生尾鳍的形态如图1(a),相应再生尾鳍面积量化结果如图1(b)所示。从图1可知,群勃龙影响尾鳍再生面积,并在不同时间点有着类似的剂量效应关系,即随着浓度升高,尾鳍面积下降,且1 000 ng·L-1暴露组和对照组相比具有显著差异。在24、48和72 hpa (hour post amputation,即断尾后小时数),1 000 ng·L-1暴露组再生尾鳍面积分别为同一时间点对照组的84.9%、87.9%和80.6%。低浓度组似乎能促进尾鳍再生,但仅在48 hpa有显著差异。
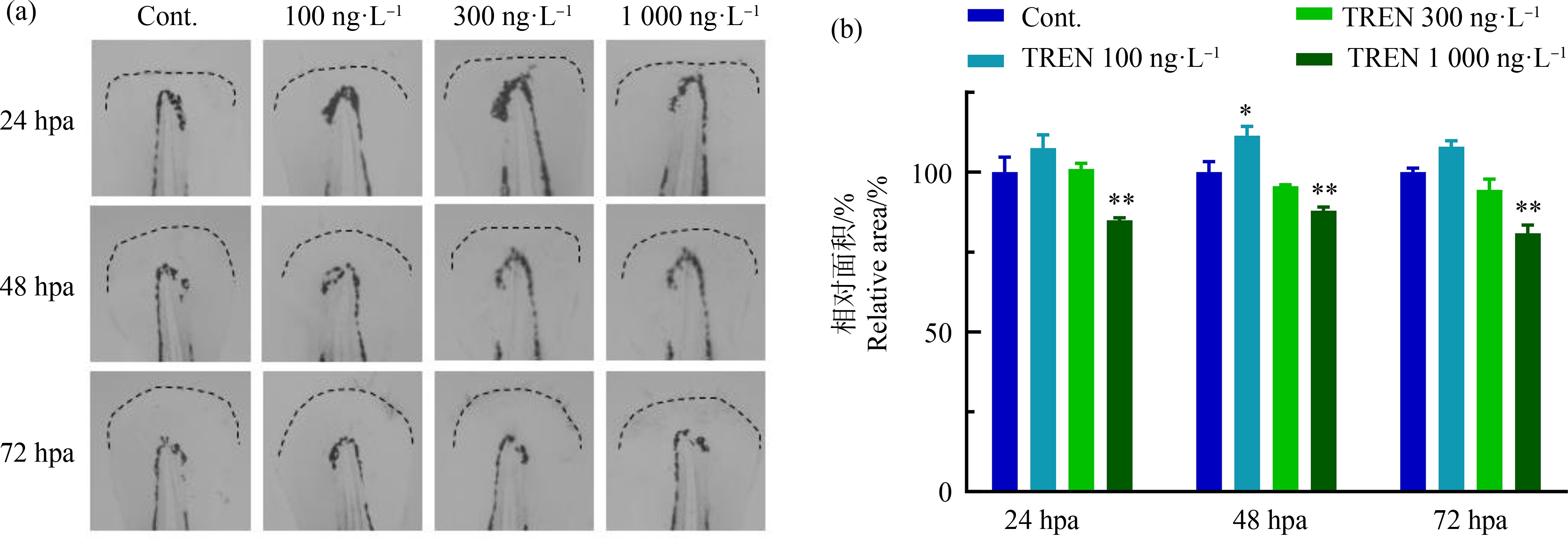
图1 群勃龙单独暴露对斑马鱼幼鱼尾鳍再生面积的影响
注:(a)群勃龙暴露后再生尾鳍形态;(b)群勃龙暴露后再生尾鳍的相对面积;结果以平均值±标准误表示;星号表示与对照组相比有显著差异(*P<0.05;**P<0.01);TREN表示群勃龙;Cont.表示对照组;hpa表示断尾后小时数。
Fig. 1 Effects of 17β-trenbolone on the area of regenerating caudal fin in zebrafish larvae
Note: (a) Representative pictures of regenerating fins after exposure to 17β-trenbolone; (b) Quantification of the relative fin area; the results are presented as the mean±SEM; asterisks denote significant difference compared to the control (*P<0.05 and **P<0.01); TREN means 17β-trenbolone; Cont. means control; hpa means hour post amputation.
2.2 群勃龙和氟他胺联合暴露对斑马鱼幼鱼尾鳍再生面积的影响
鉴于1 000 ng·L-1的群勃龙能显著抑制斑马鱼幼鱼尾鳍再生,后续选择该浓度群勃龙与氟他胺进行联合暴露。由图2可知,与之前相一致,1 000 ng·L-1的群勃龙单独暴露显著抑制尾鳍再生,而其在与氟他胺联合暴露后,随着氟他胺浓度升高,再生尾鳍面积随之增加,并与对照组无差异,且在72 hpa时氟他胺高浓度联合暴露组(300 μg·L-1)与群勃龙单独暴露组有显著差异。由此可见,氟他胺可以缓解群勃龙对斑马鱼幼鱼尾鳍再生的抑制作用。
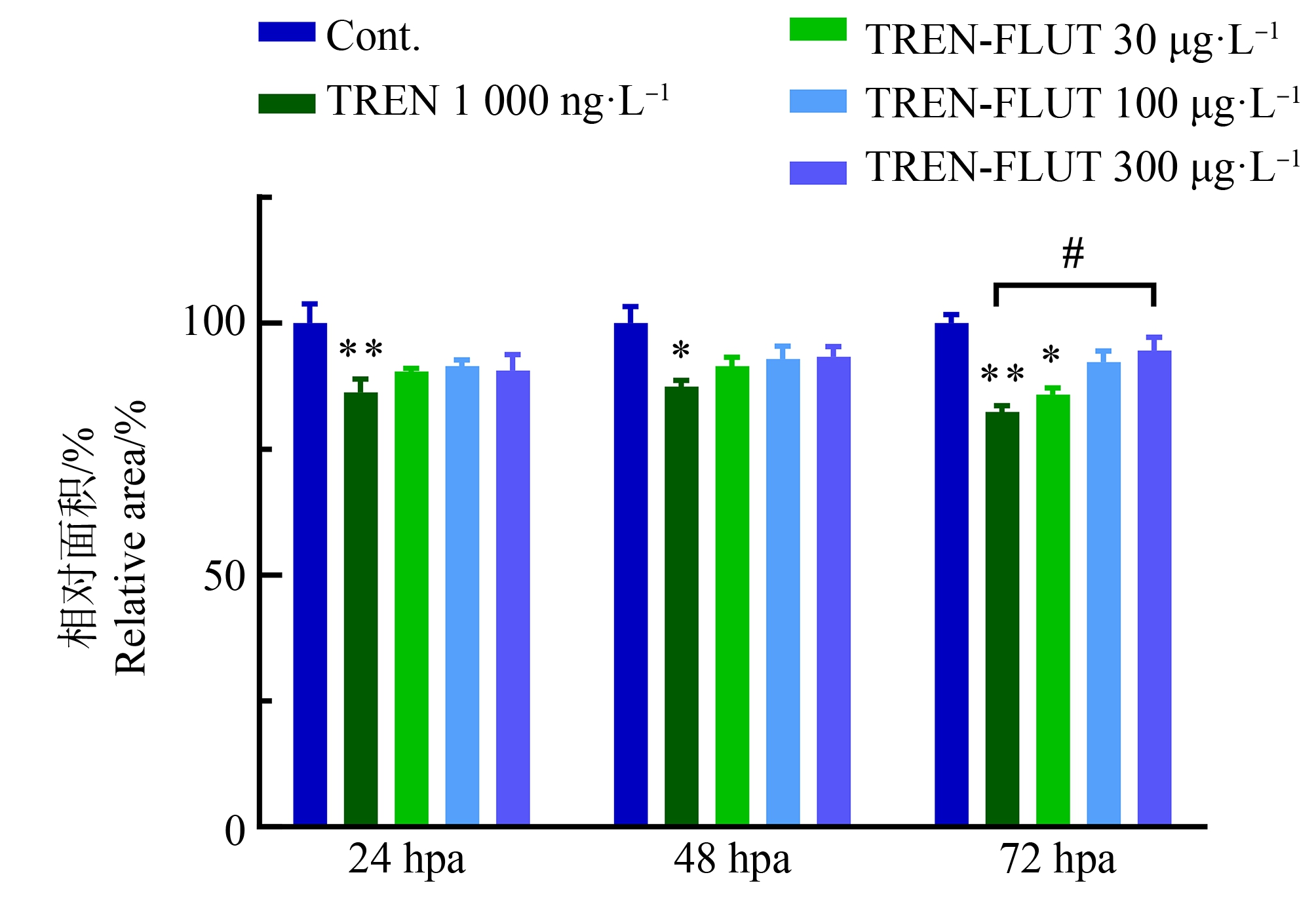
图2 群勃龙和氟他胺联合暴露对斑马鱼幼鱼尾鳍再生面积的影响
注:结果以平均值±标准误表示;星号表示与对照组相比有显著差异,#号表示与群勃龙单独暴露组有显著差异(*, # P<0.05;**P<0.01);TREN表示群勃龙;FLUT表示氟他胺;Cont.表示对照组;hpa表示断尾后小时数。
Fig. 2 Effects of exposure to 17β-trenbolone and flutamide in combination on the area of regenerating caudal fin in zebrafish larvae
Note: The results are presented as the mean±SEM; asterisks denote significant difference compared to the control, and hash signs denote significant difference compared to the group exposed to TREN alone (*, # P<0.05, and **P<0.01); TREN means 17β-trenbolone; FLUT means flutamide; Cont. means control; hpa means hour post amputation.
2.3 群勃龙和氟他胺联合暴露对相关基因转录水平的影响
为了揭示群勃龙影响斑马鱼幼鱼尾鳍再生的可能机理,在与雄激素受体拮抗剂氟他胺联合暴露后,分别对雄激素受体基因、免疫系统和再生通路相关基因的转录水平变化进行检测,结果如图3所示。

图3 群勃龙和氟他胺联合暴露后雄激素受体、免疫系统以及再生通路相关基因的转录水平变化
注:星号表示与对照组相比有显著差异,#号表示与群勃龙单独暴露组有显著差异(*, # P<0.05和**P<0.01);TREN表示群勃龙;FLUT表示氟他胺;Cont.表示对照组;hpa表示断尾后小时数。
Fig. 3 Transcriptional changes of genes related to androgen receptor, immune system, and fin regeneration after exposure to 17β-trenbolone and flutamide in combination
Note: Asterisks denote significant difference compared to the control, and hash signs denote significant difference compared to the group exposed to TREN alone (*, # P<0.05, and **P<0.01); TREN means 17β-trenbolone; FLUT means flutamide; Cont. means control; hpa means hour post amputation.
鉴于群勃龙和氟他胺分别为雄激素受体的激动剂和拮抗剂,首先检测了雄激素受体基因的转录水平变化。从结果可见,1 000 ng·L-1群勃龙单独暴露在12 hpa和72 hpa这2个时间点均诱导雄激素受体转录水平升高,且在72 hpa和对照组相比有统计学差异;而在和氟他胺联合暴露后,其转录水平呈浓度依赖性降低,并与对照组无差异。由此可见,和预期相一致,在所设定的暴露浓度下,氟他胺能够有效拮抗群勃龙的雄激素效应。
同时,也检测了群勃龙和氟他胺联合暴露后对再生相关通路部分基因的转录水平影响。包括了Wnt/β-catenin通路中的axin2、lef1、msx1b、wnt5b和wnt10a,成骨蛋白BMP通路中的bmp2b和bmp4,成纤维细胞生长因子FGF通路中的fgf20a和fgfr1a,胰岛素样生长因子IGF中的igf2b,Notch中的notch1b,视黄酸RA中的raldh2,音猬因子Hh中shha,以及尾鳍中细胞增殖的标志基因mps1和pcna。
如图3所示,Wnt/β-catenin通路中大部分基因在群勃龙单独暴露后均有转录下调的趋势,且lef1、wnt5b和wnt10基因在72 hpa与对照组有显著差异;相反地,在与氟他胺联合暴露后,该信号通路基因的转录水平均随着氟他胺的浓度升高而上调,呈现浓度依赖性,并与对照组相比无统计学差异。FGF和BMP通路相关基因的转录水平变化也有类似趋势。对于Notch的notch1b,以及细胞繁殖的标志基因mps1和pcna而言,群勃龙单独暴露后亦可见其转录水平有下调趋势,并在12 hpa时与对照组相比有显著差异;而与氟他胺联合暴露后,上述基因的转录水平回复,并与对照组无差异。其中,notch1b基因在氟他胺高浓度联合暴露组与群勃龙单独暴露组相比有显著差异。然而,对于IGF中的igf2b,RA中raldh2以及Hh中shha而言,群勃龙单独暴露似乎能够上调基因的转录水平,而与氟他胺联合暴露后,转录水平有下降趋势,但均未见统计学差异。
鉴于免疫系统在再生过程中的重要作用,以及免疫和内分泌系统间的交互关系,我们也检测了若干免疫系统相关基因的转录水平变化,包括促炎性细胞因子(il-1β、il-6和il-8),抗炎性细胞因子il-10,调控因子nf-κb2,以及中性粒细胞的特异性标志基因mpx[18]。由图3可知,群勃龙单独暴露后,在12 hpa和72 hpa这2个时间点均显著上调了促炎性细胞因子il-1β的转录水平,而与氟他胺联合暴露后,其转录水平则呈现浓度依赖性下降,并在高浓度时与对照组相比无统计学差异;而对于其他2个促炎性细胞因子(il-6和il-8),群勃龙的单独暴露或与氟他胺联合暴露均未见影响。群勃龙单独暴露似乎并不影响抗炎性细胞因子il-10的转录,但在联合暴露组中,氟他胺的加入能够下调其转录水平,并与对照组相比有显著差异。对于调控因子nf-κb2,群勃龙单独暴露在72 hpa降低了其转录水平,而与氟他胺联合暴露后,在氟他胺中低浓度组,mRNA水平似乎有回复到对照组水平的趋势,但在高浓度联合暴露组则依然低于对照组。对于中性粒细胞的特异性标志基因mpx,在12 hpa时,群勃龙能够上调其转录,但与氟他胺联合暴露后,其mRNA水平下调,并回复到对照组水平;而在72 hpa,暴露后mpx基因的转录水平未见变化。
2.4 群勃龙和氟他胺联合暴露对再生尾鳍处中性粒细胞数量的影响
借助于转基因斑马鱼,检测了暴露后迁移至再生尾鳍处中性粒细胞的数量,结果见图4。对于正常未断尾的斑马鱼幼鱼而言,尾鳍处的中性粒细胞是极少的。但在断尾后,幼鱼再生尾鳍处中性粒细胞数量大幅增加(即图4中对照组),在2 hpa时,其数量平均高达10个左右。之后随着再生进程,中性粒细胞数量缓慢下降,在48 hpa后,其平均值仅不到3个。群勃龙单独暴露似乎能够导致更多的中性粒细胞迁移至再生尾鳍处,这在再生前期(12 hpa之前)尤为明显。然而,氟他胺的联合暴露使得再生尾鳍处中性粒细胞显著减少,并与对照组相比无统计学差异(12 hpa)。
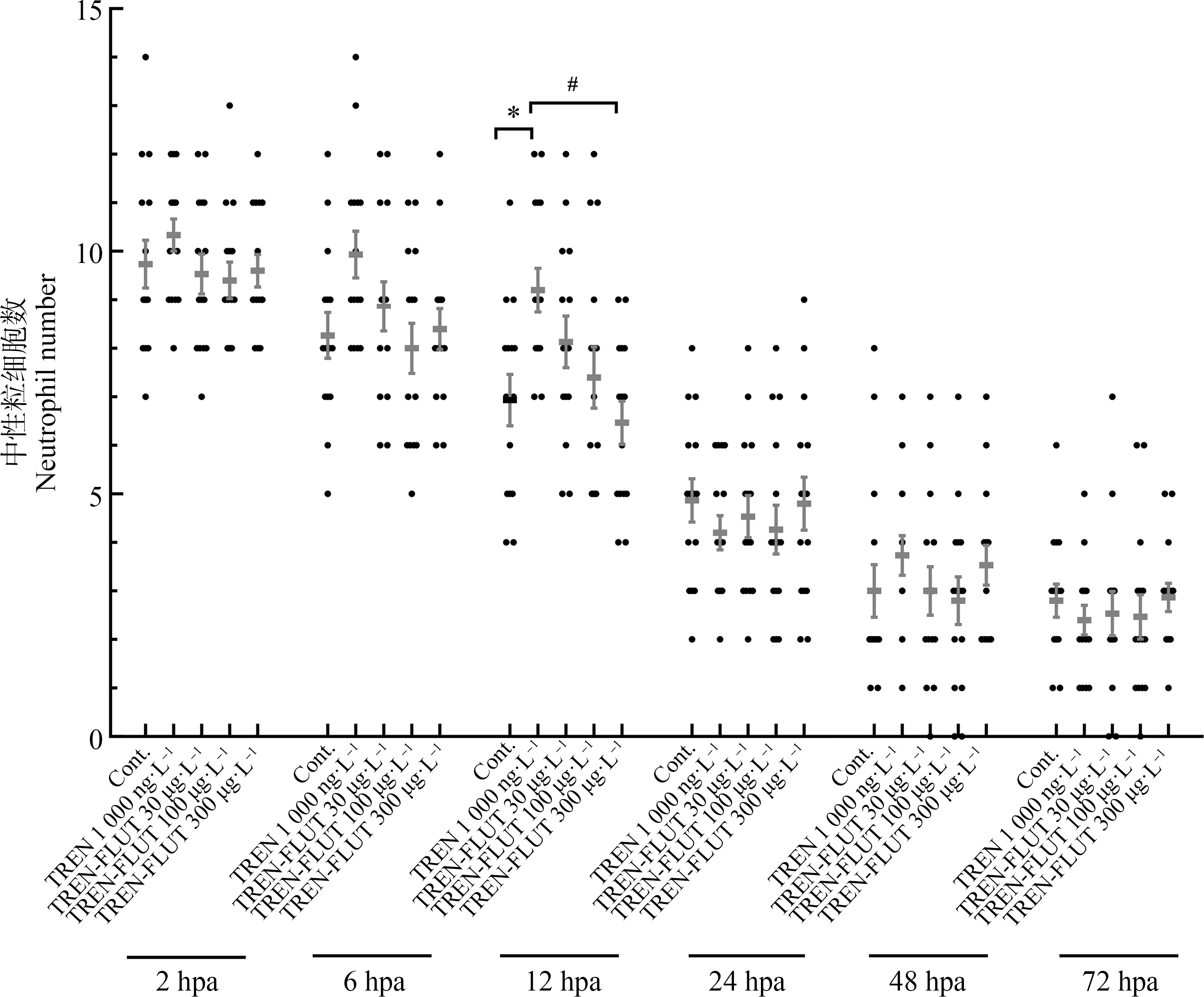
图4 群勃龙和氟他胺联合暴露后幼鱼再生尾鳍处中性粒细胞数量的变化
注:结果以平均值±标准误表示;星号表示与对照组相比有显著差异,#号表示与群勃龙单独暴露组有显著差异(*, # P<0.05);TREN表示群勃龙;FLUT表示氟他胺;Cont.表示对照组;hpa表示断尾后小时数。
Fig. 4 Changes of the number of neutrophils in the regenerating fin of zebrafish larvae after exposure to 17β-trenbolone and flutamide in combination
Note: The results are presented as the mean±SEM; asterisks denote a significant difference compared to the control, and hash signs denote a significant difference compared to the group exposed to TREN alone (*, # P<0.05); TREN means 17β-trenbolone; FLUT means flutamide; Cont. means control; hpa means hour post amputation.
3 讨论(Discussion)
对于生物体而言,内分泌和免疫系统一度被认为是2个独立的系统。然而,近年来已有广泛的证据表明内分泌和免疫系统间存在复杂的交互作用,内分泌干扰物也可以影响生物体的免疫系统,比如鱼类免疫器官上有雌激素受体的表达,而雌激素暴露可以改变免疫基因的转录等等[19-20]。另一方面,生物在损伤发生之后,免疫系统被强烈激活,不仅可以清除伤口处的病原微生物,而且在组织修复和再生中有重要的调控作用[21]。在多种模式生物上均已证实,免疫系统可以影响损伤器官结构和功能的再生,比如创伤愈合的程度[22]。因此,我们有理由推断环境内分泌干扰物也可以通过干扰鱼类组织修复和再生过程,进而影响其在环境中的生存。事实上,研究也已表明了环境雌激素和天然雌激素均可干扰斑马鱼尾鳍再生能力[10]。
在本研究中,为了确定雄激素是否能干扰鱼类组织修复与再生能力,借助斑马鱼幼鱼尾鳍再生模型,检测了雄激素受体激动剂群勃龙(10~1 000 ng·L-1)对尾鳍再生面积的影响,发现高浓度群勃龙能够抑制尾鳍的再生作用(图1)。为了进一步确定上述影响是否是群勃龙通过雄激素受体途径而产生的,将群勃龙与雄激素受体拮抗剂氟他胺联合暴露,发现随着氟他胺浓度升高,斑马鱼尾鳍再生面积有恢复的趋势(图2)。由此可见,氟他胺可以缓解群勃龙对斑马鱼幼鱼尾鳍再生的抑制作用。
为了揭示群勃龙干扰斑马鱼幼鱼尾鳍再生的内在机制,进一步在基因转录水平研究了群勃龙单独以及与氟他胺联合暴露对断尾幼鱼的影响(图3)。
首先,就雄激素受体而言,其转录水平能够被群勃龙诱导上升,而与氟他胺联合暴露后,其转录水平下降,确证了2个化合物对雄激素受体的激动或拮抗效应。
其次,我们检测了若干重要的再生相关信号通路基因的转录水平变化。斑马鱼尾鳍被切除之后,将会启动再生进程,并先后历经伤口愈合(wound healing)、芽基形成(blastema formation)以及外生长(regenerative outgrowth)阶段,在一系列信号通路调控下,最终使得尾鳍的结构和功能得到完全复原[4,23]。目前,已知的重要信号通路包括经典的Wnt/β-catenin信号途径,其被认为对于尾鳍再生过程是必要和充分的,并在伤口愈合、芽基形成以及外生长阶段均有重要作用,扮演着作为调控中心的关键角色[23-24]。而其下游的FGF信号通路,也和再生过程的各阶段均关系密切[23]。此外,BMP、RA、Activin、Hedgehog等,均是调控相关生物学过程的重要信号通路[2,23-24]。群勃龙单独暴露使得其中大多数基因的转录水平有下降趋势,且部分基因与对照组相比有统计学差异,比如Wnt/β-catenin中的wnt10a、lef1,FGF中的fgf20a,BMP中的bmp2b等等。有报道指出,抑制Wnt/β-catenin信号通路将导致尾鳍再生受阻,其他多个再生相关通路也将随之受到干扰[25];而FGF通路的抑制则可以干扰芽基的形成以及后续的外生长阶段,从而抑制尾鳍再生[26]。由此可见,群勃龙暴露后导致上述基因的转录水平下降可能是尾鳍再生被抑制的原因。在和氟他胺联合暴露后,上述基因的转录水平随之上升,且恢复至与对照组相比无统计学差异。这进一步证明了相关基因在尾鳍再生中的重要作用;同时,也暗示了上述基因的转录水平变化与雄激素受体信号通路间的可能联系。
此外,我们也检测了群勃龙单独以及联合暴露对免疫系统的影响。结果表明,群勃龙单独暴露后,免疫系统相关基因的转录水平也有部分改变。比如诱导了mpx的升高,相应地,迁移至再生尾鳍处的中性粒细胞数量也随之增加。与此相符的,已有报道表明群勃龙能够影响免疫功能[12,27]。而在与氟他胺联合暴露后,包括mpx在内多数基因的转录水平有恢复到对照组的趋势,而再生尾鳍处的中性粒细胞数量随之变化。但是,对于抗炎性细胞因子il-10,群勃龙单独暴露并不影响其mRNA水平,但和氟他胺联合暴露后转录水平显著下降。有研究表明,免疫反应对于组织修复和再生的作用较为复杂,既有正面的作用,也有负面的作用[28]。比如,损伤发生之后,免疫系统被强烈激活。但是,炎症反应的适时消退有助于伤口愈合以及再生过程的进行,而过强的免疫反应则会通过抑制芽基形成等作用而影响再生进程[29]。在群勃龙单独以及与氟他胺联合暴露后,与再生通路相关基因的变化不同,免疫系统并未呈现一致降低或升高的变化趋势,这可能也归因于免疫系统和再生过程间的复杂关系。但是,上述结果也表明了免疫反应和雄激素受体信号通路间存在一定的互作关系。
许多研究已表明,虽然尾鳍与心脏等其他器官相比结构迥异,但涉及组织再生过程关键的分子和细胞调控机制却是类似的[2,4],而组织再生相关机制在不同的脊椎动物间也存在一定程度的保守性[28-29]。因此,群勃龙对于斑马鱼尾鳍再生的干扰作用可外推至其他组织或器官,甚至为评价环境雄激素对其他高等动物的毒性效应提供参考。然而,有组学研究发现群勃龙暴露后,部分mRNA、蛋白以及代谢物的变化似乎和雄激素受体信号通路并不直接相关[12]。同时,考虑到再生过程调控网络及其与免疫系统间复杂的互作关系,雄激素如何影响生物体再生能力还需要更进一步的研究,以阐明相关的分子和细胞作用机制。
总而言之,本研究通过群勃龙单独以及与氟他胺联合暴露,表明雄激素可以干扰鱼类组织修复与再生能力,而这很可能是通过雄激素受体相关途径,并随之影响免疫系统以及再生信号相关通路而导致的。本研究也提示我们,对于环境中作用机制与雄激素类似的污染物,是否具有干扰生物体组织修复和再生能力,可能是全面准确评价其生态风险时所必须考虑的。
[1] Yoshinari N, Kawakami A. Mature and juvenile tissue models of regeneration in small fish species [J]. The Biological Bulletin, 2011, 221(1): 62-78
[2] Sehring I M, Jahn C, Weidinger G. Zebrafish fin and heart: What’s special about regeneration? [J]. Current Opinion in Genetics &Development, 2016, 40: 48-56
[3] 李礼, 罗凌飞. 以斑马鱼为模式动物研究器官的发育与再生[J]. 遗传, 2013, 35(4): 321-332
Li L, Luo L F. Zebrafish as the model system to study organogenesis and regeneration [J]. Hereditas, 2013, 35(4): 321-332 (in Chinese)
[4] Sehring I M, Weidinger G. Recent advancements in understanding fin regeneration in zebrafish [J]. Wiley Interdisciplinary Reviews Developmental Biology, 2020, 9(1): e367
[5] Mathew L K, Andreasen E A, Tanguay R L. Aryl hydrocarbon receptor activation inhibits regenerative growth [J]. Molecular Pharmacology, 2006, 69(1): 257-265
[6] Zodrow J M, Tanguay R L. 2,3,7,8-tetrachlorodibenzo-p-dioxin inhibits zebrafish caudal fin regeneration [J]. Toxicological Sciences, 2003, 76(1): 151-161
[7] Mathew L K, Sengupta S, Kawakami A, et al. Unraveling tissue regeneration pathways using chemical genetics [J]. The Journal of Biological Chemistry, 2007, 282(48): 35202-35210
[8] Sengupta S, Bisson W H, Mathew L K, et al. Alternate glucocorticoid receptor ligand binding structures influence outcomes in an in vivo tissue regeneration model [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2012, 156(2): 121-129
[9] Hirose K, Payumo A Y, Cutie S, et al. Evidence for hormonal control of heart regenerative capacity during endothermy acquisition [J]. Science, 2019, 364(6436): 184-188
[10] Sun L W, Gu L Q, Tan H N, et al. Effects of 17α-ethinylestradiol on caudal fin regeneration in zebrafish larvae [J]. The Science of the Total Environment, 2019, 653: 10-22
[11] Parks L G, Lambright C S, Orlando E F, et al. Masculinization of female mosquitofish in Kraft mill effluent-contaminated Fenholloway River water is associated with androgen receptor agonist activity [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2001, 62(2): 257-267
[12] Ankley G T, Coady K K, Gross M, et al. A critical review of the environmental occurrence and potential effects in aquatic vertebrates of the potent androgen receptor agonist 17β-trenbolone [J]. Environmental Toxicology and Chemistry, 2018, 37(8): 2064-2078
[13] Bartelt-Hunt S L, Snow D D, Kranz W L, et al. Effect of growth promotants on the occurrence of endogenous and synthetic steroid hormones on feedlot soils and in runoff from beef cattle feeding operations [J]. Environmental Science &Technology, 2012, 46(3): 1352-1360
[14] Ankley G T, Bencic D C, Breen M S, et al. Endocrine disrupting chemicals in fish: Developing exposure indicators and predictive models of effects based on mechanism of action [J]. Aquatic Toxicology, 2009, 92(3): 168-178
[15] Sun L W, Peng T, Liu F, et al. Transcriptional responses in male Japanese medaka exposed to antiandrogens and antiandrogen/androgen mixtures [J]. Environmental Toxicology, 2016, 31(11): 1591-1599
[16] Gu L Q, Tian L, Gao G, et al. Inhibitory effects of polystyrene microplastics on caudal fin regeneration in zebrafish larvae [J]. Environmental Pollution, 2020, 266(Pt 3): 114664
[17] Renshaw S A, Loynes C A, Trushell D M I, et al. A transgenic zebrafish model of neutrophilic inflammation [J]. Blood, 2006, 108(13): 3976-3978
[18] Rehberger K, Werner I, Hitzfeld B, et al. 20 Years of fish immunotoxicology - What we know and where we are [J]. Critical Reviews in Toxicology, 2017, 47(6): 509-535
[19] Casanova-Nakayama A, Wenger M, Burki R, et al. Endocrine disrupting compounds: Can they target the immune system of fish? [J]. Marine Pollution Bulletin, 2011, 63(5-12): 412-416
[20] Milla S, Depiereux S, Kestemont P. The effects of estrogenic and androgenic endocrine disruptors on the immune system of fish: A review [J]. Ecotoxicology, 2011, 20(2): 305-319
[21] Ingerslev H C, Lunder T, Nielsen M E. Inflammatory and regenerative responses in salmonids following mechanical tissue damage and natural infection [J]. Fish &Shellfish Immunology, 2010, 29(3): 440-450
[22] Peiris T H, Hoyer K K, Oviedo N J. Innate immune system and tissue regeneration in planarians: An area ripe for exploration [J]. Seminars in Immunology, 2014, 26(4): 295-302
[23] Tal T L, Franzosa J A, Tanguay R L. Molecular signaling networks that choreograph epimorphic fin regeneration in zebrafish - A mini-review [J]. Gerontology, 2010, 56(2): 231-240
[24] Wehner D, Weidinger G. Signaling networks organizing regenerative growth of the zebrafish fin [J]. Trends in Genetics, 2015, 31(6): 336-343
[25] Wehner D, Cizelsky W, Vasudevaro M D, et al. Wnt/β-catenin signaling defines organizing centers that orchestrate growth and differentiation of the regenerating zebrafish caudal fin [J]. Cell Reports, 2014, 6(3): 467-481
[26] Shibata E, Yokota Y, Horita N, et al. FGF signalling controls diverse aspects of fin regeneration [J]. Development, 2016, 143(16): 2920-2929
[27] Massart S, Redivo B, Flamion E, et al. The trenbolone acetate affects the immune system in rainbow trout, Oncorhynchus mykiss [J]. Aquatic Toxicology, 2015, 163: 109-120
[28] Mescher A L, Neff A W, King M W. Inflammation and immunity in organ regeneration [J]. Developmental &Comparative Immunology, 2017, 66: 98-110
[29] Poss K D. Advances in understanding tissue regenerative capacity and mechanisms in animals [J]. Nature Reviews Genetics, 2010, 11(10): 710-722